рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Образование
- /
- При їх сумісній присутності
Реферат Курсовая Конспект
При їх сумісній присутності
При їх сумісній присутності - раздел Образование, Титриметричний аналіз Визначення Вмісту Іонів Кальцію Та Магнію При Їх Сумісній При...
Визначення вмісту іонів кальцію та магнію при їх сумісній присутності грунтується на попередньому визначенні їх сумарного вмісту титруванням певного об'єму аналізованого розчину стандартним розчином ЕДТА в присутності індикатора еріохрому чорного Т і амонійного буферного розчину. Після цього в такому ж об'ємі аналізованого розчину визначають вміст іонів кальцію титруванням ЕДТА в присутності індикатора мурексиду і розчину NaOH (рН > 11). При додаванні розчину NaOH іони магнію зв’язуються у вигляді Mg(OH)2 і не титруються. Вміст магнію у розчині обчислюють за різницею об'ємів ЕДТА, витрачених на титрування суми іонів кальцію і магнію та лише кальцію.
Методика визначення.У дві конічні колби, в яких містяться однакові об'єми аналізованого розчину, вливають по 50 см3 дистильованої води. В одну з колб добавляють 10 см3 амонійного буферного розчину і на кінчику шпателя ~20 мг індикатора еріохрому чорного Т (суміш його з NаCl). Перемішують до повного розчинення індикатора і повільно титрують розчином ЕДТА до переходу винно-червоного забарвлення спочатку в синьо-фіолетове і далі у чисто синє. Записують об'єм (V1 ) ЕДТА, витрачений на титрування суми іонів Са2+ і Mg2+.
У другу колбу додають 5 см3 20 %-ого розчину NаОН і на кінці шпателя ~20 мг індикатора мурексиду (його суміш з NаCl). Після повного розчинення індикатора вміст колби титрують розчином ЕДТА до зміни червоного забарвлення на фіолетове. Якщо через 2-3 хв. червоне забарвлення поновлюється, розчин потрібно дотитрувати. Записують об'єм розчину ЕДТА, витрачений на титрування іонів кальцію (V2).
Вміст іонів кальцію і магнію в аналізованому розчині обчислюють за формулами:
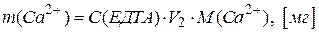 .
.
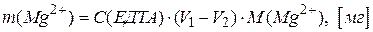 .
.
 г/моль;
г/моль;  г/моль.
г/моль.
– Конец работы –
Эта тема принадлежит разделу:
Титриметричний аналіз
національний університет Львівська політехніка... Титриметричний аналіз Методичні вказівки для студентів хімічних...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: При їх сумісній присутності
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов