рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Геометрия молекул: отталкивание электронных пар
Реферат Курсовая Конспект
Геометрия молекул: отталкивание электронных пар
Геометрия молекул: отталкивание электронных пар - раздел Химия, Вопросы для самопроверки В Подразд. 3.4 Уже Начато Рассмотрение Геометрии Многоатомных Частиц – На Осн...
В подразд. 3.4 уже начато рассмотрение геометрии многоатомных частиц – на основе концепции гибридизации атомных орбиталей. Однако не случайно там рассмотрены только довольно простые примеры – частицы без кратных связей. Метод ГАО часто (особенно для частиц с кратными связями) позволяет лишь объяснить геометрию, если она заранее известна, но не предсказать ее. Поэтому более подробно рассмотрим другой подход, предложенный Гиллеспи (1953).
В основе лежит простая, естественная идея – одноименно заряженные электронные облака в многоатомных частицах должны отталкиваться. Энергия отталкивания должна стремиться к минимуму. Такой минимум достигается при максимальном удалении электронных облаков в пространстве друг от друга. Осталось вспомнить, что в рамках метода ВС электроны в молекулах попарно относятся либо к неподеленным, принадлежащим конкретному атому (НП), либо к связывающим (СП), осуществляющим ковалентные связи между двумя атомами (естественно, речь идет о валентных электронах; внутренние располагаются настолько близко к своим ядрам и настолько прочно связаны с ними, что при рассмотрении геометрии можно их не учитывать). И это всё!
Далее элементарная геометрия и чуть-чуть терминологии. Все атомы в многоатомной частице разделим на центральные (свя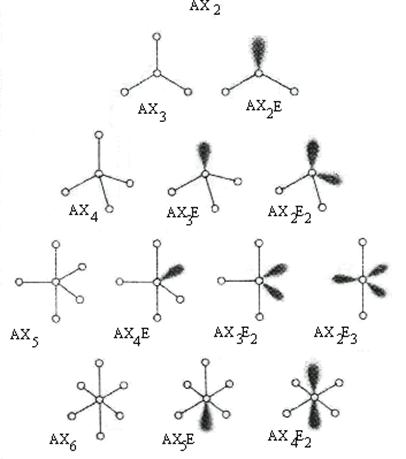 зан
зан ные более чем с одним атомом) и концевые, или заместители (связанные только с одним атомом). Например, в рассмотренной выше молекуле ВеСl2 центральный атом (ЦА) – Ве, [He]2s2, два валентных электрона; заместители – два Сl. В молекуле две s‑связи, общее количество электронных пар (ЭП) у ЦА равно двум, обе пары связывающие (СП): Сl––Вe––Cl. Естественно, что для минимизации отталкивания они должны располагаться на максимальном удалении друг от друга, т. е. под углом 180º! Все три атома (точнее, их центры) располагаются на одной линии – это пример линейной трехатомной молекулы.
ные более чем с одним атомом) и концевые, или заместители (связанные только с одним атомом). Например, в рассмотренной выше молекуле ВеСl2 центральный атом (ЦА) – Ве, [He]2s2, два валентных электрона; заместители – два Сl. В молекуле две s‑связи, общее количество электронных пар (ЭП) у ЦА равно двум, обе пары связывающие (СП): Сl––Вe––Cl. Естественно, что для минимизации отталкивания они должны располагаться на максимальном удалении друг от друга, т. е. под углом 180º! Все три атома (точнее, их центры) располагаются на одной линии – это пример линейной трехатомной молекулы.
Для молекулы SnCl2 электронная конфигурация ЦА [Kr]4d105s25p2, четыре валентных электрона, и только два из них
..
участвуют в образовании s‑связей: Сl––Sn––Cl. Остающиеся два
валентных электрона олова остаются неподеленными, т. е. у ЦА, кроме двух СП, имеется еще и одна НП, а общее количество ЭП равно трем. Естественно, для минимизации отталкивания три электронные пары располагаются в пространстве не так, как две, а под углом 120º, в вершине которого находится ЦА. Такие молекулы называют угловыми.
Для удобства далее будем обозначать ЦА как А, заместители – Х, неподеленные ЭП – Е (ограничимся пока молекулами с одним ЦА). Полезно ввести понятие стерического числа (СЧ), равного сумме количества заместителей и неподелённых пар.
Количество ближайших к выделенному атому соседних атомов (ближайших соседей) называют координационным числом (КЧ). Для частиц с ковалентными связями КЧ равно числу s‑связей.
Иначе для многоатомной частицы типа АХnEm СЧ = n + m или равно сумме координационного числа и числа неподеленных пар центрального атома. Для рассмотренных примеров СЧ = 2 + 0 = 2 для ВеСl2 и 3 = 2 + 1 для SnСl2. Достаточно очевидно, что если в центр многогранника поместить центральный атом А, то для значений СЧ, равного 4, ЭП должны располагаться по вершинам тетраэдра; для СЧ = 5 – по вершинам тригональной бипирамиды; для СЧ = 6 – по вершинам октаэдра.
Геометрия расположения ЭП и частиц по Гиллеспи приведена на рис. 24 и в табл. 9.
При СЧ ≥ 5 возникает возможность различного взаиморасположения заместителей и НП, т. е. возникает возможность появления пространственных изомеров – соединений одинакового состава, отличающихся геометрией (пространственным строением). Метод Гиллеспи позволяет предсказывать, какие из этих изомеров окажутся наиболее устойчивыми, если ввести одно уточнение: отталкивание между ЭП увеличивается в ряду СП‑СП – СП‑НП – НП‑НП (связывающие электронные пары притягиваются сразу к двум ядрам, поэтому их облака расположены в пространстве более компактно, чем НП, и отталкивание между ними меньше).
Таблица 9
– Конец работы –
Эта тема принадлежит разделу:
Вопросы для самопроверки
На сайте allrefs.net читайте: "Вопросы для самопроверки"
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Геометрия молекул: отталкивание электронных пар
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов