рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Вопросы для самопроверки
Реферат Курсовая Конспект
Вопросы для самопроверки
Вопросы для самопроверки - раздел Химия, Многоатомные Частицы. Химическая ...
МНОГОАТОМНЫЕ ЧАСТИЦЫ. ХИМИЧЕСКАЯ СВЯЗЬ
Словно нити паутины, всё, что видишь ты вокруг. Их работа из алмазов жизнь земную создала, Ими сотканы из газов наши гибкие тела…Обменный механизм образования ковалентной связи.
Структурные и электронные формулы
На рис. 14 схематически изображено изменение распределения..
электронной плотности при образовании молекулы Н–F (Н··F:) из
..
 атомов Н· и F·. Неспаренные 1s-электрон атома Н и 2рх-электрон F образуют обобществленную, принадлежащую в молекуле обоим атомам пару электронов. Электронное облако этой пары, связывающей атомы в молекуле, представляет собой линейную комбинацию исходных электронных облаков. Спаренные 2ру- и 2рz‑электроны F (и тем более внутренние электроны) остаются в молекуле в неизменном состоянии и по-прежнему принадлежат только фтору.
атомов Н· и F·. Неспаренные 1s-электрон атома Н и 2рх-электрон F образуют обобществленную, принадлежащую в молекуле обоим атомам пару электронов. Электронное облако этой пары, связывающей атомы в молекуле, представляет собой линейную комбинацию исходных электронных облаков. Спаренные 2ру- и 2рz‑электроны F (и тем более внутренние электроны) остаются в молекуле в неизменном состоянии и по-прежнему принадлежат только фтору.
Рис. 14. Электронные облака НF:
атом Н, 1s-АО. Светлое облако означает, что на АО находится один электрон; атом F, 2р-орбитали. Светлое облако соответствует одному электрону на АО, более тёмные – двум. Принимающая участие в образовании связи 2рх-АО под действием положительно заряженного ядра Н перестаёт быть симметричной гантелью, расширяется в его сторону и сужается с противоположной стороны. Тёмные облака в молекуле НF соответствуют двум электронам на каждой АО; 2s-АО F не показана
В возникшей молекуле AB состояние обоих электронов меняется: они утрачивают свою принадлежность к А или В и принадлежат в равной степени обоим атомам – обобществляются (используется еще термин «перекрывание электронных облаков») и с большей вероятностью локализуются в пространстве между А и В, взаимно притягивая таким образом друг к другу положительно заряженные ядра атомов.
Участвующие в образовании связи обобществлённые пары электроновназывают связывающими (СП), не участвующие, принадлежащие и в образовавшейся молекуле по-прежнему собственным атомам – неподелёнными (НП).
Таким образом, объединение атомов в молекулу происходит за счет электрического притяжения разноименных зарядов; но вот тот факт, что для такого притяжения нужна именно пара электронов (да ещё с разными спинами) и выполнение некоторых других важных условий (в частности, волновые функции перекрывающихся АО должны иметь одинаковый знак), связан исключительно с двойственной, волновой природой электрона и может быть объяснён только в рамках квантовой механики. Ограничимся здесь замечанием о том, что обобществленные электроны, образующие ковалентную связь, описываются уже не атомными, а так называемыми молекулярными орбиталями, МО (впрочем, принципы Паули, наименьшей энергии и правило Гунда применимы и к заселению электронами МО; так же существуют основное и возбужденные электронные состояния и соответствующие энергетические уровни, возможны переходы электронов между этими уровнями).
Аналогично происходит и образование многоатомных (состоящих более чем из двух атомов) частиц, например молекулы воды:
.. ..
2Н· + ·О· = Н··О··Н или Н–О–Н.
·· ··
Важно отметить, что спаривание электронов в двух- или многоатомной частице всегда приводит к понижению энергии. Поэтому молекулы с четным числом электронов в основном состоянии почти всегда имеют все электроны в спаренном состоянии, в виде СП или НП, и не имеют неспаренных электронов. Частицы с неспаренными электронами называются радикалами; как правило, они весьма реакционноспособны, т. е. стремятся вступить в химические реакции между собой или с другими частицами, чтобы спарить неспаренные электроны и уменьшить этим энергию системы. Примеры радикалов: Н·, Сl·, ·ОН, ·СН3 и т. п. Стабильные радикалы редки, из неорганических отметим ·NO и ·NО2.
Выше использована электронная формула А··В (обобществлённые электронные пары, т. е. ковалентные связи, обозначаются парой точек «··», расположенной между связанными атомами, а неподелённые электронные пары – парой точек около соответствующего атома). В структурных формулах (А–В, Н–О–Н) каждая ковалентная связь (т. е. СП) обозначается черточкой, направление которой не несёт смысловой нагрузки и выбирается из удобства изображения (рис. 15). Таким образом, структурные формулы отражают и химический состав молекулы (количество атомов каждого элемента), и ее строение (взаимное расположение атомов и то, как они связаны друг с другом).
| H··F H¾F | Cl··B··Cl : Cl | Cl¾B¾Cl ½ Cl | .. F··P··F : F | .. F¾P¾F ½ F | |
| F F ½ F S F ½ F F |
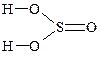
| H H H H ½ ½ ½ ½ H H¾C¾C¾C¾C¾N ½ ½ ½ ½ H Cl H H H | |||
Рис. 15. Электронные и структурные формулы HF, BCl3, PF3,
и структурные SF6, H2SO3, C4H10NCl
Неподелённые пары в структурных формулах указываются не всегда (здесь – указаны только для атома фосфора в РF3), а только в тех случаях, когда их наличие по каким-то причинам существенно.
Важнейшие характеристики ковалентной связи – ее длина и энергия. Длина связи – расстояние между центрами (т. е. ядрами) связанных атомов. Энергия связи(для двухатомной частицы) – разность энергии между бесконечно удаленными невзаимодействующими атомами А и В, с одной стороны, и частицей АВ – с другой. В процессе А + В = АВ энергия выделяется, следовательно, энергия связи – величина по смыслу отрицательная, но обычно величины энергий связи приводятся без указания знака. Соответственно процесс разрыва связи (диссоциации) требует затраты энергии; Есвязи = –Едисс.. Из закона сохранения энергии следует, что при диссоциации многоатомной молекулы на атомы энергия этого процесса не зависит от порядка отрыва атомов.
В стехиометрических формулах, называемых также валовыми или брутто-формулами (HCl, BCl3, H2O, H2S2, SO32– и т. п.), указан только состав частицы (молекулы или иона – здесь имеющий заряд минус 2 ед. СГСЕ сульфит-ион SO32–) или химического соединения.
Количество атомов данного элемента в частице (относительное количество в соединении) указывается в правом нижнем индексе символа элемента; электрический заряд (в ед. СГСЕ) – в правом верхнем индексе. Если заряд указывается в конце формулы, по умолчанию подразумевается, что он относится ко всей частице.
Химическое соединение – вещество, состоящее из разных элементов в определенных соотношениях, т. е. имеющее определенный химический состав,сохраняющийся без изменений при постоянстве внешних условий некоторое время в некотором объеме. Вещества, состоящие из атомов одного элемента, называют простыми веществами (например, двухатомный кислород О2, озон О3; алмаз, графит, карбин, фуллерены – различные модификации углерода, С).
Часто атомы в молекулах имеют восемь валентных электронов, включая как связывающие, так и неподелённые электронные пары (правило октета); водород – два электрона. Например, одна СП и три НП у хлора в HCl и F в PF3, три СП и одна НП у фосфора в PF3, четыре СП у углерода в органических молекулах дают электронный октет (см. рис. 15). Однако существуют и другие устойчивые электронные конфигурации атомов в молекулах, например: шесть (3 СП у бора в BCl3), десять (4 СП и 1 НП у серы в H2SO3), двенадцать (6 СП у серы в SF6), четырнадцать (7 СП у иода в IF7), шестнадцать электронов (8 СП у ксенона в XeO4).
Вопросы для самопроверки
1. Какие силы удерживают атомы в молекуле?
2. Сравните порядки энергий связи между нуклонами в ядре и между атомами в молекуле.
3. Что необходимо для образования ковалентной связи по обменному механизму: наличие неспаренного электрона у одного атома; у обоих атомов; разный спин обобществляемых электронов; что-то другое?
4. Попробуйте схематично изобразить электронные облака для атома Н и молекулы Н2.
5. Изобразите электронные и структурные формулы Н2, F2, HF, H2O, ОН–, SF4, включая все неподеленные электронные пары. Какие из них подчиняются правилу октета?
6. Какие из перечисленных в предыдущем вопросе частиц относятся к простым веществам?
7. Какие из перечисленных частиц являются радикалами: F, HF, F-, F+, OH, ОН–, CF3, С5Н11?
Ковалентность
О теории Бутлерова повествуя. Атомы в молекулах – не буквы в словах – С определённой валентностью существуют…Стехиометрия соединений с Н, F и О
Можно сказать, что молекулы собираются из атомов, но не так, как слова из букв, а наподобие детского конструктора, и число шипов или пазов у каждого… Приведенные в табл. 6 брутто-формулы – это разрешенные, возможные значения… Оставим пока без комментариев вопрос о том, почему для элементов подгрупп VA, VIА и VIIА не существует соединений с…Донорно-акцепторный механизм образования связи
По этому механизму образуются ионы гидроксония H3O+, аммония NH4+ и множество координационных (комплексных) соединений, таких, как [BF4]-. Например,… F B- F F F F – B F F F Важно, что все три связи О–Н в H3O+ ковалентные и совершенно одинаковые, все три водорода полностью эквивалентны,…Геометрия молекул: гибридизация атомных орбиталей
Геометрическое строение молекул важно не только само по себе, оно влияет на протекание многих реакций. Почему молекула СО2 линейна, тогда как SO2 и… Трёхатомные молекулы могут быть либо линейны (ядра всех трёх атомов… Однако в молекуле воды валентный угол составляет не 90º, а 105º, примерно такие же валентные углы в…Свойства гибридных атомных орбиталей
Гибридизоваться могут не все орбитали, а только близкие по энергии (в пределах одного электронного слоя или с участием предвнеших d‑АО), и… Чтобы уяснить подход к описанию геометрии молекул через ГАО, следует обратить… Вопросы для самопроверкиОриентация связывающих пар: s- и p‑связи. Сопряжение
На рис. 20 показаны случаи s- (s-s, s-p, p-p и d-s) и p‑перекрывания (p‑p, d-p и d-d). Ось симметрии для s‑связей проходит по… Из расположения трех взаимно перпендикулярных «лепестков» р-АО вытекает, что… Чем больше кратность связи, тем больше её энергия и тем меньше длина (разумеется, для связей между одинаковыми парами…Сопряжение в частицах СО2, N2О, ВО33-на основе резонанса
Графически при изображении структурных формул с сопряженными связями такие связи показывают пунктиром (как на схеме выше) или дугами, а для… Изложение теории МО можно найти почти в любом курсе общей химии, в том числе в… Вопросы для самопроверкиГеометрия молекул: отталкивание электронных пар
В основе лежит простая, естественная идея – одноименно заряженные электронные облака в многоатомных частицах должны отталкиваться. Энергия… Далее элементарная геометрия и чуть-чуть терминологии. Все атомы в… Для молекулы SnCl2 электронная конфигурация ЦА [Kr]4d105s25p2, четыре валентных электрона, и только два из нихГеометрия частиц по Гиллеспи
По тем же причинам молекулы типа АХ3Е2 – «Т-образные», а не плоские треугольные; АХ2Е3 – линейные; АХ4Е2 – квадратные. Не следует смешивать разные понятия: геометрию расположения ЭП (т. е. А, Х и… На рис. 25приведены модели некоторых молекул, отражающие их строение в реальном масштабе. При этом следует помнить…Электроотрицательность. Полярность связи
Свойство атомов оттягивать на себя электронную плотность при образовании ковалентной связи называют электроотрицательностью. Электроотрицательность… Существует несколько количественных шкал ЭО. Электроотрицательность связана с… Именно соотношение ЭО атомов определяет такое полезное понятие, как степень окисления – условный заряд атома в…Электроотрицательность атомов элементов по Полингу
В подразд. 3.2, с. 64, говорилось о стехиометрии соединений различных элементов с водородом: НЭ для подгруппы VIIА, Н2Э для VIА, Н3Э для VА, хотя… Водород, наоборот, чаще имеет ЭО меньше, чем Э, его степень окисления H+1.… Электроотрицательность – относительная величина, но именно разность ЭО участвующих в связи атомов определяет ее…Молекулы: заключение
Итак, молекулы – это объединённые ковалентными связями атомы. Внутренние электроны локализованы вблизи ядер своих атомов и для химии не важны. Некоторые (иногда все) валентные электроны участвуют в образовании ковалентных связей между атомами, некоторые не участвуют и остаются локализованными у своих атомов (неподелённые электронные пары). Очень часто каждый атом в молекуле имеет восемь валентных электронов, включая обобществлённые и неподелённые (правило октета).
Основных механизмов обобществления электронов при образовании ковалентной связи два – обменный, когда каждый из атомов предоставляет для связи по одному электрону, и донорно-акцепторный, когда оба электрона первоначально принадлежат донору. Свойства связи не зависят от механизма её образования.
При образовании молекулы из атомов выделяется энергия, равная сумме энергий связей, для разрыва молекулы на атомы (атомизации) требуется затратить такую же энергию. Величина энергии одной ковалентной связи ~ 1 эВ или несколько сотен кДж/моль.
Поскольку образование ковалентной связи приводит к значительному выигрышу энергии, почти все радикалы (частицы с неспаренными электронами) нестабильны.
Боковое перекрывание p- и d-АО позволяет образовать дополнительные p‑связи. Чередование s- и p-связей (или p-связей и неподелённых или вакантных р-АО) приводит к сопряжению – выравниванию электронной плотности и кратности соседних связей. Расстояния между атомами в молекулах сопоставимы с размерами атома – около 1 Å и уменьшаются с увеличением кратности связей.
Определённая ковалентность атомов различных элементов приводит к строго стехиометрическим соотношениям между элементами в молекулах. Направленность ковалентной связи обусловлена определённой формой электронных облаков для разных АО и задаёт геометрию молекул. При неполярной связи электронная плотность поровну распределена между атомами, при полярной - смещена в сторону более электроотрицательного. Количественной мерой полярности связей служит дипольный момент.
Вопросы для самопроверки
1. Приведите примеры молекул, ионов, радикалов.
2. Приведите примеры частиц с донорно-акцепторными связями, запишите их структурные формулы.
3. Приведите примеры частиц: с сопряжёнными связями и с кратными связями, но без сопряжения.
4. Приведите примеры полярных молекул, имеющих и не имеющих дипольный момент.
5. Какие частицы (одноатомные и двухатомные) можно в принципе построить из следующего набора элементарных частиц: два протона, два нейтрона и два электрона? Какие прогнозы можно дать относительно их устойчивости?
6. Какие молекулярные частицы можно построить из водорода и кислорода? Какие из них будут устойчивы?
7. Приведите примеры частиц, в которых сера имеет разную ковалентность (включая 3). Возможна ли ковалентность серы, равная 3, без неспаренных электронов для нейтральных частиц; для ионов? Предложите такой ион.
[*] Строго говоря, почти все соединения подгрупп IА и IIА – ионные, а не ковалентные, но об этом в подразд. 4.2.
[†] Пока ЭF8 не получены, известен только ХеF6.
[‡] В скобках указано количество таких углов в частице.
[§] D (или Д) – дебай, единица измерения ре; 1 D = 3,34·10-30 Кл·м.
– Конец работы –
Используемые теги: вопросы, самопроверки0.052
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Вопросы для самопроверки
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов