рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Геометрия молекул: гибридизация атомных орбиталей
Реферат Курсовая Конспект
Геометрия молекул: гибридизация атомных орбиталей
Геометрия молекул: гибридизация атомных орбиталей - раздел Химия, Вопросы для самопроверки Геометрическое (Пространственное) Строение – Это Взаимное Расположение Атомов...
Геометрическое (пространственное) строение – это взаимное расположение атомов в многоатомной частице, характеризуемое длинами связей (понятие определено в подразд. 3.1) и валентными углами – углами между отрезками, соединяющими центры трех ближайших атомов, один из которых – общий (иначе – угол между двумя связями).
Геометрическое строение молекул важно не только само по себе, оно влияет на протекание многих реакций. Почему молекула СО2 линейна, тогда как SO2 и Н2О – угловые, почему молекула SO3 плоская, а NH3 – пирамидальная? Ответы на эти вопросы вы скоро узнаете, но начнем с более простых примеров.

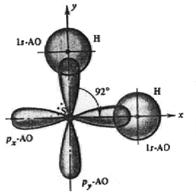 Трёхатомные молекулы могут быть либо линейны (ядра всех трёх атомов располагаются на одной линии), либо образовывать угол. Легко объяснить угловую форму H2S, H2Se, H2Te. Халькоген имеет два неспаренных р-электрона, каждый водород – по одному s‑электрону. При образовании связей происходит перекрывание р‑облаков центрального атома молекулы (S, Se, Te) с s-облаком Н (рис. 16). Как известно, угол между р-АО равен 90º, примерно таков же и валентный угол Н–Э–Н в рассмотренных молекулах.
Трёхатомные молекулы могут быть либо линейны (ядра всех трёх атомов располагаются на одной линии), либо образовывать угол. Легко объяснить угловую форму H2S, H2Se, H2Te. Халькоген имеет два неспаренных р-электрона, каждый водород – по одному s‑электрону. При образовании связей происходит перекрывание р‑облаков центрального атома молекулы (S, Se, Te) с s-облаком Н (рис. 16). Как известно, угол между р-АО равен 90º, примерно таков же и валентный угол Н–Э–Н в рассмотренных молекулах.
Однако в молекуле воды валентный угол составляет не 90º, а 105º, примерно такие же валентные углы в пирамидальной молекуле NH3. Близки к этой величине и углы в тетраэдрической молекуле СН4 – 109º.
Причина состоит в том, что для образования максимально возможного числа ковалентных связей и минимизации отталкивания между отрицательно заряженными электронными парами (как образующими связи – связывающими, так и неподеленными) происходит «перемешивание» близких по энергии АО и соответствующих электронных облаков, называемое гибридизацией атомных орбиталей (ГАО).
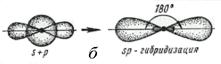
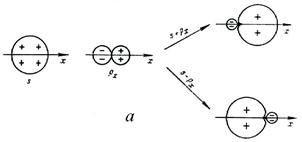 Рассмотрим образование молекулы ВеCl2. Бериллий в основном состоянии не может образовать связи по обменному механизму – для конфигурации [He]2s2 нет неспаренных электронов. В возбужденном состоянии, [He]2s12р1, есть необходимые два неспаренных электрона для образования двух связей с неспаренными р‑электронами хлора. Но 2s‑облако находится в основном внутри 2р‑облака и связь не может образоваться. Для образования двух ковалентных связей используется линейная комбинация (смешивание) АО: из двух исходных АО (2s и 2р в равных долях) образуются две гибридных (гибридизованных) АО: s + pх и s - рх. Оказывается, что состояние 2s12px1 может быть совершенно эквивалентно представлено как состояние (s + pх)1(s - pх)1, в котором неспаренные электроны располагаются на орбиталях, направленных под углом 180º. Таким образом, молекула ВеCl2 линейна (рис. 17). Затраты энергии на возбуждение s-электрона на р‑орбиталь окупаются за счёт образования двух ковалентных связей.
Рассмотрим образование молекулы ВеCl2. Бериллий в основном состоянии не может образовать связи по обменному механизму – для конфигурации [He]2s2 нет неспаренных электронов. В возбужденном состоянии, [He]2s12р1, есть необходимые два неспаренных электрона для образования двух связей с неспаренными р‑электронами хлора. Но 2s‑облако находится в основном внутри 2р‑облака и связь не может образоваться. Для образования двух ковалентных связей используется линейная комбинация (смешивание) АО: из двух исходных АО (2s и 2р в равных долях) образуются две гибридных (гибридизованных) АО: s + pх и s - рх. Оказывается, что состояние 2s12px1 может быть совершенно эквивалентно представлено как состояние (s + pх)1(s - pх)1, в котором неспаренные электроны располагаются на орбиталях, направленных под углом 180º. Таким образом, молекула ВеCl2 линейна (рис. 17). Затраты энергии на возбуждение s-электрона на р‑орбиталь окупаются за счёт образования двух ковалентных связей.
 Аналогично бор образует плоскую молекулу BCl3 с валентными углами 120°: В [He]2s22р1 ® В [He]2s12р2 = В [He](sp2‑ГАО)3, где, как (sp2‑ГАО), условно обозначены три гибридные орбитали, образующиеся из одной s- и двух р‑АО и направленные под углами 120° от
Аналогично бор образует плоскую молекулу BCl3 с валентными углами 120°: В [He]2s22р1 ® В [He]2s12р2 = В [He](sp2‑ГАО)3, где, как (sp2‑ГАО), условно обозначены три гибридные орбитали, образующиеся из одной s- и двух р‑АО и направленные под углами 120° от 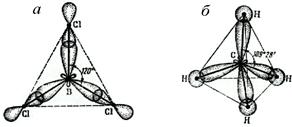 центрального атома бора к вершинам правильного треугольника, в которых располагаются концевые атомы хлора (рис. 18, а). Вклад каждой из АО бора в ГАО – 1/3, так что ГАО имеют смешанный характер – на 1/3 s и на 2/3 – р.
центрального атома бора к вершинам правильного треугольника, в которых располагаются концевые атомы хлора (рис. 18, а). Вклад каждой из АО бора в ГАО – 1/3, так что ГАО имеют смешанный характер – на 1/3 s и на 2/3 – р.
 Также углерод в sp3-гибридном состоянии образует четыре ГАО, направленных к вершинам правильного тетраэдра (число ГАО обязательно равно числу исходных, смешиваемых АО) (см. рис. 18, б). Поэтому метан, CCl4 и подобные соединения углерода имеют тетраэдрическую форму (центральный атом С в центре, концевые атомы – по вершинам тетраэдра). При этом вовсе не обязательно заместители должны быть одинаковыми. Например, CCl2F2 – тоже тетраэдрический, хотя валентные углы FCF, FCCl, ClCCl незначительно (всего на несколько градусов) отличаются от идеальных тетраэдрических значений, так как величины отталкивания связывающих электронных пар C–Cl и C–F несколько различны.
Также углерод в sp3-гибридном состоянии образует четыре ГАО, направленных к вершинам правильного тетраэдра (число ГАО обязательно равно числу исходных, смешиваемых АО) (см. рис. 18, б). Поэтому метан, CCl4 и подобные соединения углерода имеют тетраэдрическую форму (центральный атом С в центре, концевые атомы – по вершинам тетраэдра). При этом вовсе не обязательно заместители должны быть одинаковыми. Например, CCl2F2 – тоже тетраэдрический, хотя валентные углы FCF, FCCl, ClCCl незначительно (всего на несколько градусов) отличаются от идеальных тетраэдрических значений, так как величины отталкивания связывающих электронных пар C–Cl и C–F несколько различны.
Таблица 7
– Конец работы –
Эта тема принадлежит разделу:
Вопросы для самопроверки
На сайте allrefs.net читайте: "Вопросы для самопроверки"
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Геометрия молекул: гибридизация атомных орбиталей
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов