рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Ориентация связывающих пар: s- и p‑связи. Сопряжение
Реферат Курсовая Конспект
Ориентация связывающих пар: s- и p‑связи. Сопряжение
Ориентация связывающих пар: s- и p‑связи. Сопряжение - раздел Химия, Вопросы для самопроверки ...

 |
До сих пор мы рассматривали только частицы с одинарными связями, с перекрыванием s-s, s-p, s-(sp), s-(sp2), s-(sp3), (sp)-p, (sp2)‑p, (sp3)-p, для которых максимум перекрывания находится на линии, соединяющей ядра связываемых атомов. Такие связи называют s‑связями (сигма-), в отличие от бокового р‑р перекрывания – p‑связей (пи-).
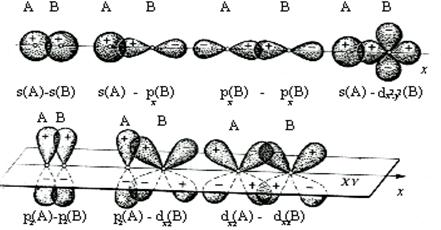
 На рис. 20 показаны случаи s- (s-s, s-p, p-p и d-s) и p‑перекрывания (p‑p, d-p и d-d). Ось симметрии для s‑связей проходит по линии связи, в отличие от p‑связей. Названия типа связей и АО не случайно начинаются на одну букву (сигма-связи и эс-АО; пи-связи и пэ‑АО) и помогают запомнить, что p-связи образуются р‑орбиталями. s-АО в принципе не могут участвовать в образовании p-связей (но р- и d‑АО могут участвовать в образовании как s-, так и p‑связей).
На рис. 20 показаны случаи s- (s-s, s-p, p-p и d-s) и p‑перекрывания (p‑p, d-p и d-d). Ось симметрии для s‑связей проходит по линии связи, в отличие от p‑связей. Названия типа связей и АО не случайно начинаются на одну букву (сигма-связи и эс-АО; пи-связи и пэ‑АО) и помогают запомнить, что p-связи образуются р‑орбиталями. s-АО в принципе не могут участвовать в образовании p-связей (но р- и d‑АО могут участвовать в образовании как s-, так и p‑связей).
 Из расположения трех взаимно перпендикулярных «лепестков» р-АО вытекает, что пара атомов может образовать без участия d-АО не более трех ковалентных связей: одну s-связь (например, перекрыванием пары принадлежащих этим атомов px-АО) и две p-связи (боковым перекрыванием пар pz‑АО и pу‑АО). Перекрывание электронных облаков для молекулы N2 показано на рис. 21. Число ковалентных связей, приходящееся на пару образующих связь атомов, называется кратностью (порядком связи). В молекуле азота кратность связи равна 3.
Из расположения трех взаимно перпендикулярных «лепестков» р-АО вытекает, что пара атомов может образовать без участия d-АО не более трех ковалентных связей: одну s-связь (например, перекрыванием пары принадлежащих этим атомов px-АО) и две p-связи (боковым перекрыванием пар pz‑АО и pу‑АО). Перекрывание электронных облаков для молекулы N2 показано на рис. 21. Число ковалентных связей, приходящееся на пару образующих связь атомов, называется кратностью (порядком связи). В молекуле азота кратность связи равна 3.
Чем больше кратность связи, тем больше её энергия и тем меньше длина (разумеется, для связей между одинаковыми парами атомов). Энергия С–С-связи 360 (длина 1,54), С=С 600 (1,34), С≡С 810 кДж/моль (1,20 Å) – двойная связь уступает по прочности двум одинарным, так как при боковом перекрывании р-АО связывающие электроны в основном локализованы не на прямой, соединяющей атомы, в отличие от s-перекрывания. Энергия наиболее прочной тройной связи в N2 и CO составляет примерно 1000 кДж/моль.
Отметим, что s‑АО не могут образовывать p‑связей. Например, при перекрывании 1s‑АО и направленной перпендикулярно линии связи 2р‑АО связь не может образоваться, так как имеющая положительный знак 1s‑АО (y100) должна перекрываться одновременно с двумя «лепестками» 2р‑АО, имеющими разные знаки, а ранее упоминалось, что эффективное перекрывание возможно только для имеющих одинаковые знаки АО. Это условие выполняется только тогда, когда р‑АО ориентирована параллельно линии связи, т. е. ко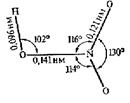 гда между s‑АО и р‑АО образуется s‑связь. Кратность связи – не обязательно целое число. На с. 60 уже говорилось о сложностях при трактовке ковалентности азота в его кислородных соединениях. Рассмотрим модель азотной
гда между s‑АО и р‑АО образуется s‑связь. Кратность связи – не обязательно целое число. На с. 60 уже говорилось о сложностях при трактовке ковалентности азота в его кислородных соединениях. Рассмотрим модель азотной  кислоты, основанную на реальном пространственном строении молекулы НNО3 (рис. 22). Структурные формулы кислоты и нитрат-иона изображены на схеме (рис. 23).
кислоты, основанную на реальном пространственном строении молекулы НNО3 (рис. 22). Структурные формулы кислоты и нитрат-иона изображены на схеме (рис. 23).
   H──O1
N+══O2
O3- H──O1
N+══O2
O3-
| O1- N+══O2 O3- | H O1 N+ O30,5- O20,5- |
Рис. 23. Структурные формулы НNО3 и NО3-
Реально расстояния между N и двумя не связанными с Н (концевыми) кислородами О2 и О3 одинаковы и равны 1,21 Å, что естественно – состояния этих двух атомов кислорода одинаково, они эквивалентны, в отличие от связанного одновременно с N и Н кислорода О1 (мостикового). Однако, как сказано выше, атом N способен образовать только три ковалентных связи по обменному механизму и не более четырёх – по донорно-акцепторному. Чтобы объяснить в рамках излагаемых представлений строение НNО3, приходится прибегать к различным допущениям. Первое из них – предположение о передаче одного из электронов азота концевому кислороду. Тогда центральный ион N+, имеющий, в отличие от нейтрального атома, ковалентность 4, может образовать четыре ковалентные связи: три s‑связи и одну p‑связь (левая формула на схеме). Но из этой формулы следует, что кислород О2 связан с азотом двойной связью, а О3 – одинарной, что не согласуется с экспериментом (см. рис. 22). Это противоречие устраняется понятием резонанса – принимается, что реальная молекула представляет собой среднее состояние между отображаемым двумя структурными формулами – изображенной на схеме слева и такой же, где двойная связь располагается между N и О3, а одинарная – между N и О2. Таким образом, связи второго и третьего кислорода с азотом имеют промежуточную кратность – 3/2. Это отражено в правой формуле на схеме: указанные связи показаны пунктирными линиями.
В центре схемы показана структурная формула иона NO3-. Ясно, что реально все три атома О эквивалентны – из эксперимента известно, что валентные углы O–N–O по 120°, все длины связей N–O равны, причем они больше, чем для двойной, но меньше, чем для одинарной N–O-связи. Такое строение иона отражается, кроме приведенной формулы, еще двумя резонансными структурами, в которых двойные связи с N образуют атомы О1 или О3. Кратность каждой N–О-связи в нитрат-ионе равна 4/3 (на три пары образующих связи атомов N и O приходится четыре связи – три s- и одна p-), т. е. они действительно должны быть короче, чем N–О1 в кислоте (кратность 1), но длиннее, чем N–О2 и N–О3 (кратность 3/2).
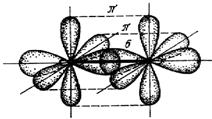
Такое выравнивание кратности связей называют сопряжением. Почему оно происходит? Электронные облака АО, участвующие в образовании сопряженных связей, образуют единое электронное облако вместо нескольких локализованных, это приводит к выравниванию электронной плотности и уменьшению межэлектронного отталкивания и в итоге к уменьшению энергии частицы.
Мы рассмотрели на примере NO3– p‑p‑сопряжение, возникающее тогда, когда чередуются p‑связи и параллельно ориентированные им в пространстве неподеленные p‑электронные пары. Широко известен пример p-p-сопряжения в бензоле и других ароматических углеводородах – при чередовании s- и p‑связей. Эффективное сопряжение происходит в таком случае, когда каждая p‑связь располагается через одну s‑связь. Если p‑связи следуют через большее количество s‑связей, то сопряжением можно пренебречь. Ещё раз подчеркнем, что сопряженная система связей может образоваться только тогда, когда s- и p‑связи (или p‑связи и р‑НП) ориентированы определенным образом в пространстве.
Если левая и центральная формулы (см. рис. 23) не передают правильного строения частиц, то зачем вообще их приводить и так подробно обсуждать? Дело в том, что они позволяют сохранить наглядность, свойственную структурным формулам, и центральное в излагаемом подходе (называемом теория или метод валентных схем – ВС) понятие ковалентности. Более поздняя концепция молекулярных орбиталей (МО) точнее отражает электронное строение частиц, позволяет удобнее производить различные расчеты, но совершенно не обладает наглядностью (по крайней мере, для многоатомных молекул). Поэтому всё изложение электронного строения молекул дано здесь по методу ВС, основанному на образовании связей между двумя атомами путем обобществления пары электронов. Если дополнить этот подход представлением о сопряжении как резонансе нескольких структур, то можно достаточно адекватно (и вместе с тем наглядно!) изложить строение большинства неорганических соединений. Некоторые примеры приведены в табл. 8.
Таблица 8
– Конец работы –
Эта тема принадлежит разделу:
Вопросы для самопроверки
На сайте allrefs.net читайте: "Вопросы для самопроверки"
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Ориентация связывающих пар: s- и p‑связи. Сопряжение
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов