рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Геометрия частиц по Гиллеспи
Реферат Курсовая Конспект
Геометрия частиц по Гиллеспи
Геометрия частиц по Гиллеспи - раздел Химия, Вопросы для самопроверки Сч Тип Располо-Жение Эп ...
| СЧ | Тип | Располо-жение ЭП | Геометрия частицы | Идеальные валентные углы | Примеры |
| АХ2Е0 | Линейное | Линейная | 180° | BeF2, CO2 | |
| АХ3Е0 | Треугольное | Треугольная | 120° | BF3, SO3 | |
| АХ2Е1 | Угловая | 120° | SnCl2, SO2 | ||
| АХ4Е0 | Тетраэдрическое | Тетраэдрическая | 109° | CH4, SO42- | |
| АХ3Е1 | Пирамидальная | 109° | H3O+, SO32- | ||
| АХ2Е2 | Угловая | 109° | H2O, ClO22- | ||
| АХ5Е0 | По ТБП | ТБП | 90° (6)[‡], 120° (3), 180° (1) | PF5, SiF5- | |
| АХ4Е1 | Искажённая тетраэдрич. («ходули») | 90° (3), 120° (1), 180° (1) | SF4, IOCl3 | ||
| АХ3Е2 | «Т»-образная | 90°(2), 180°(1) | ClF3, XeOF2 | ||
| АХ2Е3 | Линейная | 180° | ICl2-, XeF2 | ||
| АХ6Е0 | Октаэдрическое | Октаэдрическая | 90° | SF6, PCl6- | |
| АХ5Е1 | Квадратная пирамида | 90° | ClF5, TeCl5- | ||
| АХ4Е2 | Квадрат | 90° | ICl4-, XeF4 |
Поэтому для СЧ = 5, когда ЦА находится в центре тригональной бипирамиды (ТБП), по вершинам которой располагаются ЭП, отталкивание будет минимальным тогда, когда неподелённые пары будут максимально «разведены» в пространстве. Для ТБП имеется два неэквивалентных положения заместителей: экваториальное (в плоскости правильного треугольного основания) и аксиальное – в противоположных взаимно перпендикулярных вершинах и три различных значения валентных углов: ÐХэАХэ = 120° в плоскости основания (три угла), ÐХэАХа = 90° (шесть углов) и один угол ÐХаАХа =180°. Соответственно возможно три типа отталкивания между ЭП: максимальное отталкивание будет при наименьшем угле между ЭП. В соответствии с приведенным выше рядом отталкивания в зависимости от типа ЭП (НП или СП) неподелённые пары стремятся располагаться в экваториальном положении. Поэтому, как правило, приведенная в табл. 9 и на рис. 24 геометрия молекул типа АХ4Е1 («искаженный тетраэдр» или жаргонное наименование «ходули») более устойчива, чем тригональная пирамида, в которой ЦА находится в центре треугольного основания, а в вершинах заместители Х.
По тем же причинам молекулы типа АХ3Е2 – «Т-образные», а не плоские треугольные; АХ2Е3 – линейные; АХ4Е2 – квадратные.
Не следует смешивать разные понятия: геометрию расположения ЭП (т. е. А, Х и Е), целиком и однозначно задаваемую СЧ (линейная, треугольная, тетраэдрическая, ТБП, октаэдрическая), и геометрию самой частицы, т. е. взаимное расположение атомов (А и всех Х) в частице. Неподелённые пары – неотъемлемая часть центрального атома А, и их взаимное расположение имеет только вспомогательное значение для определения геометрии частицы АХn.

 На рис. 25приведены модели некоторых молекул, отражающие их строение в реальном масштабе. При этом следует помнить (см. разд. 2), что электронные облака, как и в изолированных атомах, не имеют четко очерченных границ.
На рис. 25приведены модели некоторых молекул, отражающие их строение в реальном масштабе. При этом следует помнить (см. разд. 2), что электронные облака, как и в изолированных атомах, не имеют четко очерченных границ.
Алгоритм определения геометрии частицы по методу Гиллеспи следующий (рассмотрим на примере SО2):
1. Исходя из электронных конфигураций атомов (S [Ne]3s23р4, О [He]2s22p4) определить их ковалентность: 2, 4 или 6 для S и 2 для О.
2. Из значений ковалентностей построить структурную формулу, т. е. определить строение частицы: число и расположение s- и p‑связей. В данном случае при ковалентности О, равной только двум, возможен единственный вариант: сера является центральным атомом, кислороды – концевые, связанные с S двойными s- и p-связями: О=S=О.
3. Определить число неподеленных пар центрального атома (число НП заместителей на геометрию не влияет). Всего валентных электронов у S 6, из них 4 участвуют в четырех связях, остается 2 – одна НП. Молекула типа АХ2Е1.
4. Найти стерическое число (СЧ = 2 + 1 = 3) и задаваемое им расположение ЭП: по вершинам правильного треугольника, под Ð120°.
5. Расположить НП так, чтобы отталкивание НП-НП и НП-СП было минимальным, и определить таким образом геометрию частицы. В данном случае имеется единственный вариант, так как все вершины правильного треугольника (как и тетраэдра и октаэдра) эквивалентны. Следовательно, молекула SО2 – угловая, валентный ÐОSО = 120°.
Заметим, что реально ÐОSО несколько меньше 120°, так как отталкивание между НП и заместителями больше, чем между двумя заместителями.
Изложенный подход применим и к более сложным ситуациям: когда заместители у ЦА разные (например, РСlF2), или центральных атомов несколько (Сl2O7), или ЦА – ион.
Для РСlF2 ЦА – Р, тип АХ3Е1 (точнее, АХ2Х’Е1 но важно, что заместителей 3, не важно, что они неэквивалентны), СЧ = 3 + 1 = 4, следовательно, ЭП расположены по вершинам тетраэдра, а сама молекула пирамидальная (и фосфор, и заместители находятся в вершинах тригональной пирамиды; валентные углы близки к тетраэдрическому углу 109°, но несколько меньше из-за более сильного отталкивания НП. Естественно, что, в отличие от правильных РF3 и РСl3, молекула РСlF2 будет иметь несколько искаженную форму.
| О О ½½ ½½ О=Сl¾О¾Cl=О ½½ ½½ О О |
Для Сl2O7 определяем, что такая частица может быть построена (ковалентность О – 2) только при ковалентности хлора 7, оба хлора центральные, каждый связан двойными связями с тремя концевыми О и еще одним центральным, мостиковым, кислородом – одинарной связью, НП у атомов хлора не остается. Следовательно, СЧ(Сl) = 4 (каждый хлор, рассматриваемый как ЦА частицы СlО4, типа АХ4Е0), атомы хлора расположены в центре, а кислороды в вершинах двух тетраэдров, причем тетраэдры имеют одну общую вершину – мостиковый кислород. Для этого кислорода СЧ(О) = 2 + 2 = 4 и заместители – атомы хлора – располагаются относительно него в вершинах тетраэдра (в двух других вершинах – две НП мостикового О). Величины всех валентных углов (ОСlO, ClOCl) – тетраэдрические, близки к 109°.
Подход применим не только к нейтральным молекулам, но и к ионам. Например, для определения геометрии Н3О+ будем формально рассматривать в качестве центрального ион О+, который имеет пять валентных электронов, одну неподеленную ЭП, ковалентность, равную 3, и СЧ(О+) = 3 + 1 = 4. Следовательно, ЭП располагаются относительно кислорода по вершинам тетраэдра, все валентные углы близки к 109°, частица – пирамидальная. Обратите внимание на то, что здесь одна из связей – донорно-акцепторная, но это никак не мешает применить метод Гиллеспи.
 Рассмотрим ещё один пример – частицу с сопряженными связями, нитрат-ион. Для определения геометрии NО3- удобно рассмотреть резонансную структуру, изображенную на рис. 23, с. 73. Центральным атомом здесь формально служит ион N+; СЧ(N+) = 3 + 0 = 3, следовательно, нитрат-ион – плоский, атом N расположен в центре правильного треугольника, три атома О – в его вершинах. Этот пример ещё раз показывает полезность метода ВС и резонансных структур. Здесь все три возможных резонансных структуры дают одинаковую геометрию, но возможны более сложные случаи, когда из них может быть предсказана различная геометрия частицы.
Рассмотрим ещё один пример – частицу с сопряженными связями, нитрат-ион. Для определения геометрии NО3- удобно рассмотреть резонансную структуру, изображенную на рис. 23, с. 73. Центральным атомом здесь формально служит ион N+; СЧ(N+) = 3 + 0 = 3, следовательно, нитрат-ион – плоский, атом N расположен в центре правильного треугольника, три атома О – в его вершинах. Этот пример ещё раз показывает полезность метода ВС и резонансных структур. Здесь все три возможных резонансных структуры дают одинаковую геометрию, но возможны более сложные случаи, когда из них может быть предсказана различная геометрия частицы.
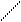
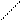

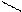
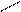

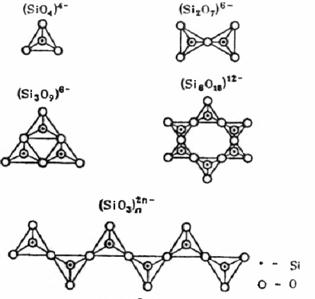
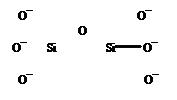 Очень важные для геологии объекты – силикаты. Изолированный ортосиликат-ион SiО44- – тетраэдрический (СЧSi = 4). Диортосиликат Si2О76-, как показано выше на схеме, представляет собой два кремнекислородных тетраэдра, связанных через мостиковый кислород, т. е. с общей вершиной. Аналогичным образом можно построить триортосиликат, объединив кремнекислородные тетраэдры в цепочку, [O3SiO(SiO2)OSiO3]8-, состав (Si3O10)8-. Но в природе встречаются трисиликаты иного строения, циклического – кольцо (Si3O9)6-, как в бенитоите BaTiSi3O9. Кольца из шести тетраэдров (Si6O18)12- встречаются в берилле. Из кремнекислородных тетраэдров можно составить бесконечные цепи, ленты, слои и т. п. Строение некоторых силикатов показано на рис. 26. Важно усвоить, что значения ковалентности кремния и кислорода и направленность ковалентной связи полностью обусловливает и строение многочисленных разновидностей силикат-анионов, включая полимерные. Их основная структурная единица – кремнекислородные тетраэдры, которые могут соединяться только через мостиковые атомы О, т. е. общими вершинами, но не ребрами или гранями.
Очень важные для геологии объекты – силикаты. Изолированный ортосиликат-ион SiО44- – тетраэдрический (СЧSi = 4). Диортосиликат Si2О76-, как показано выше на схеме, представляет собой два кремнекислородных тетраэдра, связанных через мостиковый кислород, т. е. с общей вершиной. Аналогичным образом можно построить триортосиликат, объединив кремнекислородные тетраэдры в цепочку, [O3SiO(SiO2)OSiO3]8-, состав (Si3O10)8-. Но в природе встречаются трисиликаты иного строения, циклического – кольцо (Si3O9)6-, как в бенитоите BaTiSi3O9. Кольца из шести тетраэдров (Si6O18)12- встречаются в берилле. Из кремнекислородных тетраэдров можно составить бесконечные цепи, ленты, слои и т. п. Строение некоторых силикатов показано на рис. 26. Важно усвоить, что значения ковалентности кремния и кислорода и направленность ковалентной связи полностью обусловливает и строение многочисленных разновидностей силикат-анионов, включая полимерные. Их основная структурная единица – кремнекислородные тетраэдры, которые могут соединяться только через мостиковые атомы О, т. е. общими вершинами, но не ребрами или гранями.

 Теперь можно вернуться к тонкостям геометрического строения молекул и объяснить, почему в Н2S и РН3 валентный угол близок к 90°, а в Н2О и NН3 – к тетраэдрическому. Метод отталкивания ЭП предсказывает для всех перечисленных частиц тетраэдрические валентные углы, так как везде СЧ = 4 (2 + 2 или 3 + 1). Отталкивание НП‑СП больше, чем СП‑СП, поэтому все валентные углы должны быть несколько меньше тетраэдрического (а ÐХАЕ несколько больше). Метод Гиллеспи – скорее качественный, чем количественный, и не может предсказать, насколько отклонится от идеального тетраэдрического значения валентный угол вследствие отталкивания связывающих пар неподеленными. В данном случае атомы S и Р существенно больше, чем О и N, поэтому и отталкивание НП-СП для них больше, и отклонение от тетраэдрического угла для них больше, достигая ~15°, тогда как для небольших О и N оно не превышает 5°. Впрочем, это объяснение не претендует на единственность, да и такие тонкости не столь существенны. Важно, что метод отталкивания ЭП позволяет уверенно предсказывать, будет ли данная частица линейной или угловой (здесь и Н2О и Н2S – угловые), треугольной или пирамидальной (NН3 и РН3 – пирамидальные), а отличия валентных углов на десяток градусов не слишком существенны.
Теперь можно вернуться к тонкостям геометрического строения молекул и объяснить, почему в Н2S и РН3 валентный угол близок к 90°, а в Н2О и NН3 – к тетраэдрическому. Метод отталкивания ЭП предсказывает для всех перечисленных частиц тетраэдрические валентные углы, так как везде СЧ = 4 (2 + 2 или 3 + 1). Отталкивание НП‑СП больше, чем СП‑СП, поэтому все валентные углы должны быть несколько меньше тетраэдрического (а ÐХАЕ несколько больше). Метод Гиллеспи – скорее качественный, чем количественный, и не может предсказать, насколько отклонится от идеального тетраэдрического значения валентный угол вследствие отталкивания связывающих пар неподеленными. В данном случае атомы S и Р существенно больше, чем О и N, поэтому и отталкивание НП-СП для них больше, и отклонение от тетраэдрического угла для них больше, достигая ~15°, тогда как для небольших О и N оно не превышает 5°. Впрочем, это объяснение не претендует на единственность, да и такие тонкости не столь существенны. Важно, что метод отталкивания ЭП позволяет уверенно предсказывать, будет ли данная частица линейной или угловой (здесь и Н2О и Н2S – угловые), треугольной или пирамидальной (NН3 и РН3 – пирамидальные), а отличия валентных углов на десяток градусов не слишком существенны.
В обоих изложенных подходах к геометрии молекул лежит одна идея – минимизация отталкивания всех ЭП ЦА, но в концепции Гиллеспи, в отличие от подхода гибридизации атомных орбиталей (см. подразд. 3.4), она выражена явно, и именно этот подход позволяет очень просто предсказывать геометрию частиц.
Вопросы для самопроверки
1. Какое предположение лежит в основе метода отталкивания ЭП?
2. Что такое стерическое число, координационное число?
3. Может ли ковалентность более чем в два раза превышать стерическое число?
4. Определите для ВF3 и NF3 стерическое число, расположение ЭП и геометрию. Почему геометрия этих молекул разная?
5. Для ВО33-, ВF4- и SО32- напишите структурные формулы, определите СЧ, расположение ЭП, геометрию и валентные углы.
6. Какие положения занимают неподеленные пары при СЧ = 5?
7. Сравните геометрию SiF4 и SF4, РF5 и ClF5.
8. Объясните геометрию С2Н2 и С2Н4, используя метод Гиллеспи.
9. Приведите примеры пирамидальных, тетраэдрических и октаэдрических частиц.
10. Приведите примеры линейных частиц разных типов АХ2Еm.
11. Анион NO3- - плоский. Приведите пример плоского двухзарядного аниона.
12. Какова геометрия циклического гексасиликата (Si6O18)12-? Какой состав и геометрия будут у линейного гексасиликата?
– Конец работы –
Эта тема принадлежит разделу:
Вопросы для самопроверки
На сайте allrefs.net читайте: "Вопросы для самопроверки"
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Геометрия частиц по Гиллеспи
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов