рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Донорно-акцепторный механизм образования связи
Реферат Курсовая Конспект
Донорно-акцепторный механизм образования связи
Донорно-акцепторный механизм образования связи - раздел Химия, Вопросы для самопроверки Возможен Другой Механизм Образования Ковалентной Связи, Когда Один Из...
Возможен другой механизм образования ковалентной связи, когда один из пары образующих связь атомов предоставляет пару электронов (донор), а другой принимает ее (акцептирует), предоставляя для этого вакантную АО: А¯ + В = А¯В или А: + В = А··В (пустой квадратик символизирует вакантную АО атома В). Это донорно-акцепторный механизм образования ковалентной связи.
По этому механизму образуются ионы гидроксония H3O+, аммония NH4+ и множество координационных (комплексных) соединений, таких, как [BF4]-. Например, кислород имеет ковалентность 2 в молекуле воды и ещё 2 неподеленные электронные пары; одна из них используется для образования донорно-акцепторной связи с Н+, предоставляющим для образования связи вакантную 1s-орбиталь.
| 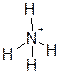
| F B- F F F | F – B F F F |
Важно, что все три связи О–Н в H3O+ ковалентные и совершенно одинаковые, все три водорода полностью эквивалентны, электрический заряд распределен по всем четырем атомам (в большей степени локализован на водородах и в значительно меньшей – на кислороде), так что нельзя говорить, что какая-то одна из этих связей «особая», не такая, как две другие. Необычную ковалентность О, равную трем в ионе гидроксония, можно трактовать по-разному: либо отнести здесь кислород к центральному атому в комплексных соединениях, для которых характерна необычная, более высокая ковалентность; либо (именно такой трактовки мы будем придерживаться далее) формально считать, что три – это ковалентность О+ (электронная конфигурация О+, как и у изоэлектронного атома N – [He]2s22р3), образующего три обычных, не донорно-акцепторных, связи с тремя атомами Н. В самом деле, почему свойства частицы H3O+ должны зависеть от пути её получения: из Н2О + Н+ или из О+ + 3Н?
Аналогично атом N в ионе аммония использует как донор свою неподелённую пару для образования связи с акцептором Н+, а донор электронной пары F- использует для образования связи вакантную 2р-АО атома В, являющегося в ионе [ВF4]- акцептором. Соответственно ковалентность 4 относится к N+ и B- (нейтральные атомы имеют ковалентность 3). Изображение заряда на каком-то выделенном атоме (О+, N+, B-) или за скобками ([Н3О]+, [ВF4]-) достаточно условно. О реальном распределении заряда в многоатомных частицах речь пойдет ниже.
Существует огромное количество комплексных (координационных) соединений, в которых имеются частицы с донорно-акцепторными связями между акцепторами – катионами (часто d‑элементов) и такими донорами НП, как Н2О, NН3, Cl-, С2О42- и т. п.: [Cr(H2O)6]3+, [Cu(NH3)4]2+, [Co(NH3)5Cl]2+, [AlF6]3- и многие другие, более сложного строения.
Атомы, имеющие на внешнем уровне только s- и р‑АО и не имеющие d‑АО (С, N, О, F и др.), могут быть либо донорами, либо акцепторами электронов. Атомы, внешняя оболочка которых включает и d‑АО, могут выступать одновременно как доноры и как акцепторы электронов. Такой механизм возникновения ковалентного связывания получил название дативного. Его простейший пример – взаимодействие двух атомов хлора, [Ne]3s23р5, в молекуле Сl2. На первый взгляд ковалентные связи в молекулах F2 и Сl2 одинаковы, разве что обобществляются по обменному механизму 2р‑электроны в первом и 3р – во втором случае. Однако энергия связи для Сl2 больше. Почему? Дело в том, что для хлора один из атомов передает часть электронной плотности неподеленных 3р‑электронов на вакантную 3d‑АО другого атома, а второй атом – точно так же часть своей электронной плотности неподеленных пар на 3d‑АО первого. В результате между атомами хлора возникает дополнительная электронная плотность (по сравнению с F2), т. е. дополнительное связывание, кроме s‑связи.
Вопросы для самопроверки
1. Приведите примеры тех атомов, которые могут служить донорами, и тех, которые могут быть акцепторами электронных пар.
2. Является ли донорно-акцепторная связь ковалентной?
3. Укажите донорные и акцепторные атомы в частицах РН4+ и SiF62–. Напишите их структурные и электронные формулы.
– Конец работы –
Эта тема принадлежит разделу:
Вопросы для самопроверки
На сайте allrefs.net читайте: "Вопросы для самопроверки"
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Донорно-акцепторный механизм образования связи
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?













Новости и инфо для студентов