рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Электроотрицательность атомов элементов по Полингу
Реферат Курсовая Конспект
Электроотрицательность атомов элементов по Полингу
Электроотрицательность атомов элементов по Полингу - раздел Химия, Вопросы для самопроверки Второй Период Li Be B ...
| Второй период | Li | Be | B | C | N | O | F |
| ЭО | 1,0 | 1,5 | 2,0 | 2,5 | 3,0 | 3,5 | 4,0 |
| Третий период | Na | Mg | Al | Si | P | S | Cl |
| ЭО | 0,9 | 1,2 | 1,5 | 1,8 | 2,1 | 2,5 | 3,0 |
Наиболее электроотрицательный элемент – фтор. Атом F – самый маленький (меньше только Н и не образующие соединений Не и Nе) и ему не хватает до завершения октета только одного электрона. Следующий по электроотрицательности элемент – О, за ним N и Сl. У атомов почти всех металлов ЭО меньше 1,9; ЭОН = 2,1.
В подразд. 3.2, с. 64, говорилось о стехиометрии соединений различных элементов с водородом: НЭ для подгруппы VIIА, Н2Э для VIА, Н3Э для VА, хотя для них имеются фториды ЭF7, ЭF6 и ЭF5 соответственно. Фтор – самый электроотрицательный элемент, и во всех фторидах электронная плотность смещена в его сторону. Степень окисления элементов +7, +6 и +5 соответственно (обозначается так: I(VII), S(VI), Р(V), F(-I) или I+7, S+6, Р+5, F-1. Значения степени окисления и ковалентности здесь совпадают. Каким образом атомы I, S, Р достигают ковалентностей 7, 6, 5, подробно обсуждено в подразд. 3.2 – путем возбуждения валентных электронов на d-подуровень. Если считать связи в рассматриваемых молекулах полностью ионными (I7+F1- и т. п.), то все 7 (6, 5) валентных электронов Э отдаются соответственно семи (шести, пяти) атомам фтора. Таким образом, и подход, основанный на ковалентности, и гипотетические ионные соединения должны обладать одинаковой стехиометрией.
Водород, наоборот, чаще имеет ЭО меньше, чем Э, его степень окисления H+1. Степень окисления элементов в соединениях с водородом I-1, S-2, Р-3, им не хватает до октета 1, 2 или 3 электрона. В НI, Н2S, РН3 атом Н отдает свой электрон атомам Э, которые не могут принять на свои АО более, чем 1, 2 или 3 электрона соответственно.
Электроотрицательность – относительная величина, но именно разность ЭО участвующих в связи атомов определяет ее полярность. При малой разнице (менее 0,5) связь можно считать практически неполярной, таковы важнейшие С¾Н‑связи в органических молекулах. А вот связи О¾Н (DЭО = 1,4), С¾О (DЭО = 1,0), N¾О (DЭО = 0,9) – полярные, что существенно проявляется в свойствах органических соединений. Если разность ЭО равна или больше 2, смещение электронной плотности к более электроотрицательному атому настолько велико, что можно говорить о практически полностью ионной связи (примеры – галогениды щелочных металлов).
Количественная мера полярности молекул – дипольный момент. Для двухатомных молекул его величина тем больше, чем больше величина реального электрического заряда на атомах q и чем больше длина связи ℓ: ре = qℓ. Дипольный момент имеет направление – принято, что он направлен от отрицательного заряда к положительному. В молекулах НF, НСl, НВr, НI с уменьшением DЭО величина заряда на атомах уменьшается, что должно приводить к уменьшению ре, но одновременное увеличение длины связи оказывает противоположное влияние, и априорно нельзя предсказать, будет ли в этом ряду увеличиваться дипольный момент. Экспериментальные измерения показали, что увеличение полярности преобладает над удлинением связи: изменение ре составляет от 1,91 (НF) до 0,42 D[§](НI). Молекула с полярными связями не обязательно сама будет полярной. Для многоатомных молекул дипольные моменты всех связей (а это векторы) суммируются по правилам сложения векторов:
(ре)S = Sqiri, где (ре)S– дипольный момент молекулы, qi и ri – соответственно заряды и расстояния до начала координат (независимо от его выбора) для всех атомов молекулы, от i = 1 до n. Кроме этого, в суммарный дипольный момент вносят вклад неподеленные пары электронов ЦА (дипольный момент НП направлен от НП к атому).
Естественно, что перераспределение электронной плотности при сопряжении связей влияет и на дипольный момент.

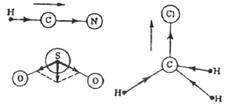 Так, связи С–О в молекуле СО2 полярные, но из-за линейности молекулы (СЧС = 2 + 0 = 2) дипольные моменты связей направлены противоположно, равные по величине ре(СО) компенсируются (вычитаются) и (ре)S(СО2) = 0. Напротив, для угловой молекулы SО2, направленные под углом 120° (СЧS = 2 + 1 = 3) складываются по правилу параллелограмма (рис. 27). Молекула имеет дипольный момент, численно равный (ре)S(SО2) = ре(SО) и направленный по биссектрисе валентного угла от атомов кислорода к сере. Линейная молекула НСN (H-СºN, СЧС = 2) имеет дипольный момент, равный разности дипольных моментов связей, направленный от азота к водороду. В тетраэдрической молекуле хлороформа СН3Сl результирующий дипольный момент трёх связей С-Н складывается с направленным параллельно дипольным моментом связи С-Сl.
Так, связи С–О в молекуле СО2 полярные, но из-за линейности молекулы (СЧС = 2 + 0 = 2) дипольные моменты связей направлены противоположно, равные по величине ре(СО) компенсируются (вычитаются) и (ре)S(СО2) = 0. Напротив, для угловой молекулы SО2, направленные под углом 120° (СЧS = 2 + 1 = 3) складываются по правилу параллелограмма (рис. 27). Молекула имеет дипольный момент, численно равный (ре)S(SО2) = ре(SО) и направленный по биссектрисе валентного угла от атомов кислорода к сере. Линейная молекула НСN (H-СºN, СЧС = 2) имеет дипольный момент, равный разности дипольных моментов связей, направленный от азота к водороду. В тетраэдрической молекуле хлороформа СН3Сl результирующий дипольный момент трёх связей С-Н складывается с направленным параллельно дипольным моментом связи С-Сl.
Распределение заряда внутри ионов обычно несущественно, так как для них важнее сам факт наличия электрического заряда.
Наличие и величина дипольного момента очень важны для понимания нековалентных взаимодействий (связей), строения жидкостей, растворов, кристаллов, и многих химических процессов.
Вопросы для самопроверки
1. Какие связи в приведенных молекулах полярные, какие нет: О2, СО, Н2О, Н2SО4, С2Н6, СН3СН2ОН?
2. Что такое электроотрицательность?
3. Расположите в порядке убывания ЭО: а) As, Br, Ca, Ga, Ge, K, Se; б) As, Bi, N, P, Sb.
4. Определите степени окисления атомов в соединениях: NаН, Н2S, Н2S2, Н2SО3, Н2SО4. Сравните их с ковалентностью.
5. Почему не существует соединение Н6S, хотя ковалентность 6 характерна для серы (приведите примеры)?
6. Что такое дипольный момент?
7. Бывают ли молекулы с полярными связями, но без дипольного момента; с неполярными связями, но с дипольным мометом?
8. Какие из приведенных молекул имеют дипольный момент: О2, СО, Н2О, ВеСl2, ВеСlВr, СF4, PF3, PF5?
9. Приведите примеры молекул типа АХ3 без дипольного момента.
10. Есть ли дипольный момент у молекулы СН2Сl2? Возможны ли для неё изомеры?
11. Предложите структуру молекулы SеF4Сl2, если известно, что она не имеет дипольного момента. Возможны ли для неё изомеры?
– Конец работы –
Эта тема принадлежит разделу:
Вопросы для самопроверки
На сайте allrefs.net читайте: "Вопросы для самопроверки"
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Электроотрицательность атомов элементов по Полингу
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов