рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Свойства гибридных атомных орбиталей
Реферат Курсовая Конспект
Свойства гибридных атомных орбиталей
Свойства гибридных атомных орбиталей - раздел Химия, Вопросы для самопроверки Гибридизация Ао, Участвующие В Гибридизации ...
| Гибридизация | АО, участвующие в гибридизации | Количество ГАО | Геометрия расположения ГАО | Валентные углы, (в градусах) |
| sp | s+px (или s+py, s+pz) | Линейная | ||
| sp2 | s+px+ру (s и любые две р) | Треугольник | ||
| sp3 | s+px+ру+рz | Тетраэдр | ||
| dsp2 | s+px+ру+dx2-y2 | Квадрат | ||
| dsp3 | s+px+ру+рz+dz2 | Тригональная бипирамида | 90; 120; 180 | |
| d2sp3 | s+px+ру+рz+dx2-y2+dz2 | Октаэдр |
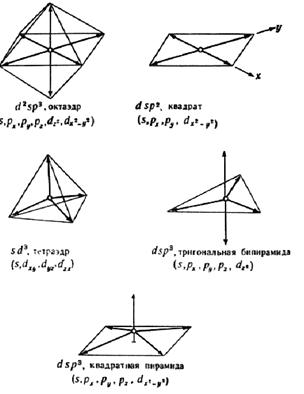 В табл. 7 приведены наиболее характерные примеры геометрии молекул и соответствующей гибридизации центрального атома. Взаимная ориентация ГАО приведена на рис. 19.
В табл. 7 приведены наиболее характерные примеры геометрии молекул и соответствующей гибридизации центрального атома. Взаимная ориентация ГАО приведена на рис. 19.
 Гибридизоваться могут не все орбитали, а только близкие по энергии (в пределах одного электронного слоя или с участием предвнеших d‑АО), и электронные облака должны размещаться в пространстве достаточно близко и компактно. Реально этим условиям удовлетворяют небольшие по размеру атомы 2-го периода (В, С, N, О), и метод ГАО получил особую популярность в органической химии. Для атомов 3-го и последующих периодов гибридизации фактически нет: валентные углы в H2S, H2Te, PH3 близки к 90º, а не к тетраэдрическому углу 109º, что указывает на перекрывание 1-s АО водорода с не гибридизованными nр-АО S, Te, P и т. п.
Гибридизоваться могут не все орбитали, а только близкие по энергии (в пределах одного электронного слоя или с участием предвнеших d‑АО), и электронные облака должны размещаться в пространстве достаточно близко и компактно. Реально этим условиям удовлетворяют небольшие по размеру атомы 2-го периода (В, С, N, О), и метод ГАО получил особую популярность в органической химии. Для атомов 3-го и последующих периодов гибридизации фактически нет: валентные углы в H2S, H2Te, PH3 близки к 90º, а не к тетраэдрическому углу 109º, что указывает на перекрывание 1-s АО водорода с не гибридизованными nр-АО S, Te, P и т. п.
Чтобы уяснить подход к описанию геометрии молекул через ГАО, следует обратить пристальное внимание на вторую колонку табл. 7 и вспомнить ориентацию электронных облаков для различных АО (см. рис. 6, с. 31). При комбинации s-, двух р- и одной d‑АО вовсе не обязательно образуются направленные к вершинам квадрата четыре ГАО, а только при смешении указанных в таблице АО. То же относится и к октаэдрической геометрии и вообще к любым ГАО с участием d‑АО ввиду их различной пространственной ориентации. Поэтому применение ГАО скорее может объяснить известную геометрию, чем предсказывать ее, и для неорганической химии предпочтительнее другой подход, основанный на минимизации отталкивания электронных пар, изложенный ниже в подразд. 3.6.
Вопросы для самопроверки
1. Что такое валентный угол?
2. Предскажите геометрию молекулы РН3, если считать, что гибридизации АО фосфора не происходит.
3. Приведите примеры частиц, в которых в состоянии sр3 находится: углерод; азот?
4. Какую гибридизацию можно ожидать для центрального атома в частицах: AsF5; SF6; SiF4; SiF62-; ХеF4?
– Конец работы –
Эта тема принадлежит разделу:
Вопросы для самопроверки
На сайте allrefs.net читайте: "Вопросы для самопроверки"
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Свойства гибридных атомных орбиталей
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов