рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Биология
- /
- Скользящие зажимы ДНК-полимераз и их погрузчики
Реферат Курсовая Конспект
Скользящие зажимы ДНК-полимераз и их погрузчики
Скользящие зажимы ДНК-полимераз и их погрузчики - раздел Биология, Эукариотические ДНК-полимеразы и ДНК-полимеразы археев 1.4.1. Скользящие Зажимы – Факторы Процессивности Днк...
1.4.1. Скользящие зажимы – факторы процессивности ДНК-полимераз
Особый класс субъединиц холоферментов ДНК-полимераз образуют белки-зажимы (clamps), которые связываются с другими компонентами комплекса (часто с каталитической субъединицей) и одновременно топологически ассоциируются с ДНК. Топологическая мода ассоциации означает, что в отличие от сайт-специфически связывающихся с ДНК белков (например, факторов транскрипции), во взаимодействии которых с определенными участками последовательности ДНК участвуют физические контакты (например, водородные связи), зажимы не образуют таких стабилизирующих связей и прикрепляются к ДНК только за счет их специфической топологии. Все белки-зажимы имеют форму кольца, надетого на дуплекс ДНК и способного достаточно свободно скользить вдоль ДНК в обоих направлениях. После погрузки на кольцевую ДНК такие скользящие зажимы остаются ассоциированными с нею длительное время, но после разрезания ДНК рестрикционными эндонуклеазами соскальзывают в месте двунитевого разрыва. В репликативных комплексах белки-зажимы располагаются позади ДНК-полимеразы, перемещающейся вдоль матричной нити. Главная функция скользящих зажимов состоит в повышении процессивности ДНК-полимераз.
Рассмотрим структурные особенности скользящих зажимов ДНК-полимераз на примерах бактериального белка DnaN (b-субъединицы ДНК-полимеразы III E. coli) и эукариотического белка PCNA. Белок DnaN имеет длину 366 остатков и состоит из 3 доменов длиной ~ 110 остатков, имеющих очень низкий уровень гомологии первичной последовательности. Тем не менее, все 3 домена имеют одинаковую общую структуру и состоят из двух a-спиралей и восьми b-нитей в линейной последовательности babbbbabbb (рис. 1.15, А). Эти участки в каждом домене белка DnaN уложены в одинаковые симметричные топологические структуры: в середине расположены две a-спирали, а по краям - два мотива греческого ключа, каждый из которых образован 4 b-нитями (рис. 1.16). Такая укладка наблюдается не только в центральном домене 2, но и продолжается в смежных доменах 1 и 3. Рентгеноструктурный анализ с разрешением 2,5 Å показал, что димерный белок DnaN состоит из 2 тождественных субъединиц, соединенных друг с другом в ориентации «голова к хвосту» (N-конец одной субъединицы взаимодействует с С-концом второй). Димер белка DnaN имеет форму тороидального кольца с внешним диаметром ~ 80

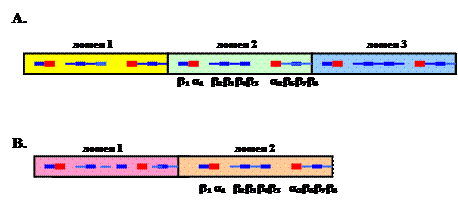
Рис. 1.15. Доменная организация скользящих зажимов ДНК-полимераз.
А – белок DnaN E. coli, В – эукариотический белок PCNA - ядерный антиген пролиферирующих клеток. В домене 2 указано взаимное расположение a-спиралей и b-нитей в первичных последовательностях этих белков, которое сохраняется и в доменах 1 и 2
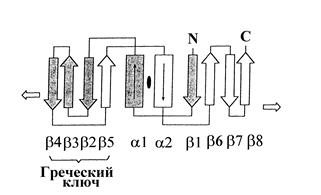
Рис. 1.16. Схема укладки a-спиралей и b-нитей в каждом домене скользящих зажимов ДНК-полимераз.
Стрелки указывают на переход в соседние домены с такой же организацией укладки



Рис. 1.17. Структура кольцевых форм скользящих зажимов ДНК-полимераз.
А. Димер бактериального белка DnaN; в центре – дуплекс ДНК.
В. Тример эукариотического белка PCNA (B).
Å, внутренним диаметром 38 Å и толщиной ~ 30 Å (рис. 1.17, А). Внутренний диаметр кольца b-субъединицы ДНК-полимеразы III позволяет пройти через центр кольца дуплексу ДНК в А-форме или В-форме (диаметр 21 и 18 Å соответственно). Толщина кольца DnaN соответствует длине одного витка двойной спирали ДНК.
Это кольцо имеет псевдо-6-кратную симметрию и состоит из 6 глобулярных доменов. В 3-мерной структуре DnaN слой из переплетенных b-нитей расположен на внесшей поверхности кольца, а внутреннюю поверхность канала, через который может проходить ДНК, выстилают 12 a-спиралей. Белок DnaN имеет большой валовой отрицательный заряд (-22), но большинство отрицательно заряженных остатков распределено по внешней поверхности, что исключает электростатическое взаимодействие свободного димера с отрицательно заряженной ДНК. С другой стороны, поверхность внутреннего канала заряжена положительно, так что фосфатные группы остова ДНК могут проходить через этот канал без электростатического отталкивания. Каждая из 12 центральных a-спиралей перпендикулярна двойной спирали ДНК в центре кольца. Это предотвращает тесный контакт белка DnaN с обеими канавками ДНК и ограничивает ДНК-белковые взаимодействия неспецифическими контактами a-спиралей с фосфатным остовом. Такая организация кольца DnaN обеспечивает тесное топологическое связывание с ДНК и в то же время не препятствует свободному скольжению вдоль ДНК. Контактная поверхность между субъединицами в димере DnaN похожа на продолжение b-слоя на междоменных границах в мономере. В стабилизацию этой контактной границы вносят вклад сильные водородные связи и электростатические взаимодействия между положительно заряженными остатками на N-конце одного мономера и отрицательно заряженными остатками на С-конце второго.
Эукариотический белок PCNA длиной 258 остатков короче, чем белок DnaN, и состоит из 2 доменов с такой же организацией, как и у доменов белка DnaN (рис. 1.15, В). Рентгеноструктурный анализ обнаружил, что PCNA образует кольцевые тримеры с организацией «голова к хвосту». Общая топология этих тримеров очень похожа на топологию димеров DnaN (рис. 1.17, В), хотя первичные последовательности этих белков не гомологичны. Кольцо белка PCNA также образовано 6 симметрично расположенными доменами и по размеру не отличается от кольца DnaN, только имеет чуть меньший диаметр внутреннего канала (34 Å). В кольце PCNA внутренний канал также состоит из 12 положительно заряженных a-спиралей, а большой отрицательный валовой заряд (-60) распределен по внешнему b-слою. Таким образом, белок PCNA также может связываться с ДНК топологически, сохраняя свободу миграции вдоль ДНК. Такой консерватизм 3-мерных структур про- и эукариотических зажимов хорошо соответствует их функциям как факторов процессивности ДНК-полимераз.
Кроме этой главной функции, белки DnaN и PCNA играют еще одну существенную роль: они организуют белок-белковые взаимодействия с другими компонентами репликативных комплексов, и, прежде всего с минимальными ферментами ДНК-полимераз. В случае бактериального белка DnaN во взаимодействии с a-субъединицей ДНК-полимеразы III E. coli участвует мотив MPMRL, расположенный на самом конце b-субъединицы и выступающий над поверхностью ее кольца. Партнером этого мотива в a-субъединице PolIII является область остатков 800-950, содержащая важный для связывания DnaN мотив QADMF в положениях около 920. У E.coli связывание свободного кольца DnaN с сердцевиной ДНК-полимеразы является довольно слабым, но оно усиливается после ассоциации PolIII с ДНК. Помимо главного репликативного фермента PolIII, белок DnaN может связываться и со всеми минорными ДНК-полимеразами, включая PolII, PolIV (DinB) и PolV (UmuC). Более того, бактериальный белок DnaN может связывать белок UmuC системы коррекции ошибочно спаренных оснований, а также ДНК-полимеразу I и ДНК-лигазу, участвующие в процессинге фрагментов Оказаки. Многие из бактериальных белков, связывающихся с DnaN, содержат консенсусный мотив QL[SD]LF, который, вероятно, необходим для стабилизации гидрофобных взаимодействий с комплементарной областью поверхности скользящего зажима.
Эукариотический белок PCNA также связывается не только с сердцевинами ДНК-полимераз d и e, но и со многими другими белками. Некоторые из этих взаимодействий могут играть регуляторную роль. Хорошо изученным партнером PCNA является ингибитор p21CIP1/WAF1 циклин-зависимых протеинкиназ, регулирующих движение по клеточному циклу. Белок р21 взаимодействует своей С-концевой с 4 петлями, расположенными вне кольца PCNA, включая большие междоменные петли (см. рис. 1.17, В). Три из этих внешних петель необходимы для связывания с ДНК-полимеразой d. Связывание р21 с PCNA конкурентно тормозит включение PCNA в холофермент ДНК-полимеразы и ингибирует элонгацию в репликации ДНК при участии Pold, но не влияет на активность Pold в эксцизионной репарации. Экспрессия белка р21, индуцируемая белком-регулятором клеточного цикла р53 в условиях повреждения ДНК, может понижать скорость движения репликативных вилок в фазе S и отсрочивать репликацию до завершения репарации поврежденной ДНК. С PCNA связываются также циклин-зависимые протеинкиназы и свободные циклины D. Это взаимодействие, вероятно, предотвращает преждевременный синтез ДНК во время фазы G1 клеточного цикла. За последнее время обнаружены новые взаимодействия PCNA: с белком XPG эксцизионной репарации, белками MSH3, MSH6, MLH1 и PMS2 системы коррекции ошибочно спаренных оснований и с эндонуклеазой Fen1 и ДНК-лигазой I, участвующими в созревании фрагментов Оказаки. Способностью вербовать в холоферменты ДНК-полимераз многочисленные вспомогательные белки PCNA напоминает С-концевой домен самой большой субъединицы эукариотической РНК-полимеразы II, с которым связываются разнообразные компоненты систем процессинга мРНК (сплайсинга и 3’-расщепления-полиаденилирования). Многие эукариотические белки ассоциирующиеся с PCNA, имеют в контактном участке для PCNA аминокислотный мотив QxxLxxFF, близкий к мотиву связывания бактериальных белков с белком DnaA.
– Конец работы –
Эта тема принадлежит разделу:
Эукариотические ДНК-полимеразы и ДНК-полимеразы археев
На сайте allrefs.net читайте: Эукариотические ДНК-полимеразы и ДНК-полимеразы археев...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Скользящие зажимы ДНК-полимераз и их погрузчики
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов