рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Образование
- /
- ПАВЛИЧЕНКО В. И АБРАМОВ А. В.
Реферат Курсовая Конспект
ПАВЛИЧЕНКО В. И АБРАМОВ А. В.
ПАВЛИЧЕНКО В. И АБРАМОВ А. В. - раздел Образование, ...
ПАВЛИЧЕНКО В. И.
АБРАМОВ А. В.

Предисловие
В соответствии с учебным планом подготовки врачей с 1 сентября 2005 года в медицинских ВУЗах Украины введен спецкурс «Современные проблемы молекулярной биологии».
Необходимыми предпосылками введения новой для студентов - медиков дисциплины явились достижения молекулярной биологии и генетики в изучении тонкой структуры генов эукариот, их картировании на хромосомах млекопитающих, и прежде всего человека, впечатляющие успехи проекта «Геном человека» в идентификации и клонировании генов, мутации которых приводят к многочисленным наследственным болезням, и, наконец, бурный рост в области биотехнологии и генной инженерии.
Последние 10 лет интенсивного развития генетики и особенно генетики человека обеспечили новый этап в развитии медицины и её переход на молекулярный уровень. Геномика человека является основой молекулярной медицины. Резкое увеличение геномной информации стало стартовой точкой для переосмысления процессов развития человека и его болезней. Развитие патологических процессов прослеживается на молекулярном уровне от первичного продукта гена до исхода заболевания.
Появилась возможность введения новых генов в различные организмы, что для врача имеет глубокий смысл, потому что коренным образом изменяется наша способность понимать, диагностировать и лечить болезни.
Принимая во внимание все преимущества новых терапевтических воздействий, современный врач должен детально понимать функции, развитие и рост клеток на молекулярном уровне.
Цель этой книги заключается в том, чтобы представить эту информацию четко, просто и кратко, что даст студентам возможность понять клеточную и молекулярную основу процессов заболевания.
Данное учебно-методическое пособие подготовлено в соответствии с учебной программой для студентов высших медицинских учебных заведений III-IV уровней аккредитации (протокол № 2 от 27.05.2005 г.).
Весь материал подразделяется на три части: «Молекулярные основы наследственности», «Молекулярные основы наследственных заболеваний», «Современные вопросы генных технологий».
В первой части пособия освещены этапы развития молекулярной биологии и генетики; структура и функции белков, ДНК, РНК; механизмы и регуляция экспрессии генов про- и эукариот; организация геномов неклеточных и клеточных организмов.
Во второй - раскрыты молекулярные механизмы генных, хромосомных и геномных мутаций у человека. Описаны моногенные наследственные заболевания, мутагенные факторы, генеративные и соматические мутации, апоптоз и генетические механизмы канцерогенеза.
В третьей – изложены современные методы исследования нуклеиновых кислот (полимеразная цепная реакция и др.), методы ДНК-диагностики, молекулярно-генетические методы исследований в судебной медицине, принципы конструирования рекомбинантных ДНК и трансгенных организмов, рекомбинантные лекарственные препараты, генные вакцины, генная терапия и терапевтическое клонирование.
Пособие иллюстрировано 60-ю рисунками и 10-ю таблицами, а «Приложение» содержит 160 контрольных тестов и терминологический словарь.
Материал пособия заложит студентам фундамент для дальнейшего усвоения ими знаний с профильных теоретических и клинических профессионально – практических дисциплин (биологической химии, микробиологии, патофизиологии, медицинской генетики, клинической иммунологии, внутренней медицины, педиатрии и др.).
Предложения, пожелания и критические замечания, направленные на улучшение учебно-методического пособия, авторы примут с благодарностью.
Авторы– Павличенко Виктор Иванович, кандидат биологических
наук, доцент кафедры медицинской биологии и генетики
Запорожского государственного медицинского университета;
Абрамов Андрей Владимирович, доктор медицинских наук,
профессор кафедры патофизиологии Запорожского
государственного медицинского университета.
«То, что мы знаем, так ничтожно по сравнению с тем,
что мы не знаем»- Пьер Симон Лаплас (1827).
Часть 1. Молекулярные основы наследственности
Введение в молекулярную биологию.
Предмет молекулярной биологии. Основные этапы развития молекулярной биологии и молекулярной генетики, их взаимосвязь с классической генетикой. Практическое значение молекулярной биологии. Современные важнейшие достижения биотехнологии, перспективы ее использования в клинической медицине. Понятие о молекулярной медицине.
Предмет молекулярной биологии. Молекулярная биология - наука, ставящая своей задачей познание природы явлений жизнедеятельности путём изучения биологических объектов и систем на уровне, приближающемся к молекулярному, а в ряде случаев и достигающем этого предела. Конечной целью при этом является выяснение того, каким образом и в какой мере характерные проявления жизни, такие, как наследственность, изменчивость, размножение, биосинтез, возбудимость, рост и развитие, хранение и передача информации, превращения энергии, подвижность и т. д., обусловлены структурой, свойствами и взаимодействием молекул биологически важных веществ, в первую очередь двух главных классов высокомолекулярных биополимеров — белков и нуклеиновых кислот. Отличительная черта молекулярной биологии — изучение явлений жизни на неживых объектах или таких, которым присущи самые примитивные проявления жизни. Таковыми являются биологические образования от клеточного уровня и ниже: субклеточные органеллы, такие, как изолированные клеточные ядра, митохондрии, рибосомы, хромосомы, клеточные мембраны; далее — системы, стоящие на границе живой и неживой природы, — вирусы, в т. ч. и бактериофаги, и кончая молекулами важнейших компонентов живой материи — нуклеиновых кислот и белков. В основе концепции молекулярной биологии лежит представление, что организмы – это динамические формы живой материи, частицы (молекулы) которой и силы, действующие на них, непрерывно изменяются и взаимодействуют друг с другом и с открытой средой.
Биологические процессы, происходящие в различных формах организмов, подчиняются общим законам физики и химии. В связи с этим при изучении структуры молекул, а также их систем, следует обращать особое внимание на химические связи, кинетику химических реакций и другие физические и химические внутри- и межмолекулярные взаимодействия.
Однако определенные стереохимические различия и индивидуализация молекул ДНК приводят к тому, что одни и те же химические компоненты связываются друг с другом в различных последовательностях, положениях, количествах, обеспечивая появление индивидуальных и различных форм жизни.
Конечный результат биохимического исследования может быть представлен в виде той или иной системы химических уравнений, обычно полностью исчерпываемой их изображением на плоскости, т. е. в двух измерениях. Отличительной чертой молекулярной биологии является её трёхмерность. Сущность молекулярной биологии усматривается М. Перуцем в том, чтобы истолковывать биологические функции в понятиях молекулярной структуры.
Решающую роль приобретают взаимное расположение атомов и их группировок в общей структуре макромолекулы, их пространственные взаимоотношения. Это касается как отдельных, индивидуальных, компонентов, так и общей конфигурации молекулы в целом. Именно в результате возникновения строго детерминированной объёмной структуры молекулы биополимеров приобретают те свойства, в силу которых они оказываются способными служить материальной основой биологических функций. Такой принцип подхода к изучению живого составляет наиболее характерную, типичную черту молекулярной биологии.
Предметом изучения молекулярной биологии является также исследование молекулярных факторов вирулентности и иммунохимической специфичности.
Молекулярные факторы вирулентности. Специфические участки и компоненты микробных макромолекул и более крупных структур, способные вызывать заметные физико-химические, функциональные и структурные изменения в более высокоорганизованной живой единице, такой, например, как человек, можно назвать факторами вирулентности.
У микроорганизмов, обитающих в более высокоразвитых хозяевах, основной механизм связи хозяин-паразит представляет собой специфическую реакцию на молекулярном уровне, вызывающую губительные изменения, как в хозяине, так и в паразите.
Взаимодействия между вирулентным агентом и мутантным хозяином, утратившим один или несколько своих ферментов или структур, необходимых для ассоциации паразита с хозяином и для репродукции вирулентного агента, не вызывают таких губительных последствий.
Очевидно, вирулентность зависит, в сущности, от взаимодействия между уникальными по конформации субъединицами патогенных микроорганизмов и комплементарными субъединицами в чувствительном хозяине. В результате этих взаимодействий в хозяине разрушаются жизненно важные биомолекулы и биоструктуры. Однако молекулярная природа вирулентности изучена недостаточно.
Молекулярные факторы иммунохимической специфичности. Иммунохимические свойства молекулы складываются из двух основных факторов. Первый – это иммуногенность или способность вызывать образование специфических иммуноглобулинов, содержащих участки (сайты), комплементарные специфическим областям поверхности молекулы. Второй – способность к объединению, направленная непосредственно на стереохимические сайты макромолекулы иммуноглобулина, комплементарной молекуле, индуцировавшей данную конфигурацию. Как следует из квантовой иммунохимии, иммунная реакция индуцируется в том случае, когда электроны атомов иммунокомпетентной клетки получают энергию от молекул антигена, в результате чего они переходят в возбужденное состояние с большей энергией. Поглощение энергии приводит к молекулярным перестройкам в клетках, которые передаются клеткам потомства. Эти клетки продуцируют молекулы иммуноглобулинов с определенной электронной конфигурацией, которые могут благодаря этому специфически реагировать с исходной молекулой антигена. Лишь молекулы антигена и антитела, образованные в результате поглощения и передачи квантов энергии и отличающиеся по энергии внешних орбиталей их электронов, могут взаимодействовать с образованием продуктов иммунной реакции. Для проявления иммуногенности необходимо, очевидно, наличие кольцевой структуры молекул. Так, простые сахара и олигосахариды становятся иммуногенами, если присоединяют по крайней мере одну молекулу с кольцевой структурой.
Антигенность молекул белков и пептидов в основном зависит от присутствия молекул определенных аминокислот, например тирозина или глутамина, расположенных на поверхности белковой или пептидной молекулы. Антигенный характер молекулы определяется расположением, пространственной конфигурацией и последовательностью аминокислот или моносахаридов на поверхности макромолекулы.
Иммунохимически активный участок (сайт) на белковой макромолекуле – это такой участок, в котором определенные остатки аминокислот приближаются к новосинтезирующейся молекуле иммуноглобулина на расстояние связи, составляющее примерно 0.2 нм.
Связывающий центр молекул иммуноглобулинов можно наглядно представить в виде неглубокой полости размером около 700 А0. В зависимости от класса иммуноглобулинов в молекуле антитела можно обнаружить от двух до десяти связывающих сайтов или комплементарных областей.
Задачи молекулярной биологии. В числе важнейших задач практического характера, ответ на которые ожидается от молекулярной биологии (М. б.), на первом месте стоит проблема молекулярных основ злокачественного роста, далее — пути предупреждения, а быть может, и преодоления наследственных заболеваний — молекулярных болезней. Большое значение будет иметь выяснение молекулярных основ биологического катализа, т.е. действия ферментов. К числу современных важнейших направлений М. б. следует отнести стремление расшифровать молекулярные механизмы действия гормонов, токсических и лекарственных веществ, а также выяснить детали молекулярного строения и функционирования таких клеточных структур, как биологические мембраны, участвующие в регуляции процессов проникновения и транспорта веществ. Более отдалённые цели М. б.— познание природы нервных процессов, механизмов памяти и т. д. Один из важнейших разделов М. б.— генная инженерия, ставящая своей задачей целенаправленное оперирование генетическим аппаратом (геномом) живых организмов, начиная с микробов и низших (одноклеточных) и кончая человеком (в последнем случае прежде всего в целях радикального лечения наследственных заболеваний и исправления генетических дефектов). В отношении микробов, растений, а возможно, и с.-х. животных такие перспективы весьма обнадёживающие (напр., получение сортов культурных растений, обладающих аппаратом фиксации азота из воздуха и не нуждающихся в удобрениях). Они основаны на уже достигнутых успехах: изолирование и синтез генов, перенос генов из одного организма в другой, применение массовых культур клеток в качестве продуцентов хозяйственных или медицинских веществ.
Основные этапы развития молекулярной биологии и молекулярной генетики, их взаимосвязь с классической генетикой. Молекулярная биология — новая область естествознания, тесно связанная с давно сложившимися направлениями исследований, которые охватываются биохимией, биофизикой и биоорганической химией. Разграничение здесь возможно лишь на основе учёта применяемых методов и по принципиальному характеру используемых подходов.
Фундамент, на котором развивалась М. б., закладывался такими науками, как генетика, биохимия, физиология элементарных процессов и т. д. По истокам своего развития М. б. неразрывно связана с молекулярной генетикой, которая продолжает составлять важную часть М. б., хотя, и сформировалась уже в самостоятельную, дисциплину.
Огромное значение исследований биологических проблем на молекулярном уровне предвидел И. П. Павлов, говоривший о последней ступени в науке о жизни — физиологии живой молекулы. Самый термин «Молекулярная биология» был впервые употреблён в начале 40-х годов английским учёным У. Астбери в приложении к исследованиям, касавшимся выяснения зависимостей между молекулярной структурой и физическими и биологическими свойствами фибриллярных (волокнистых) белков, таких, как коллаген, фибрин крови или сократительные белки мышц. Широко применять термин «Молекулярная биология» стали с начала 50-х гг. 20 в. Возникновение М. б., как сформировавшейся науки, принято относить к 1953г., когда Дж. Уотсоном и Ф. Криком в Кембридже (Великобритания) была раскрыта трёхмерная структура дезоксирибонуклеиновой кислоты (ДНК). Это позволило говорить о том, каким образом детали данной структуры определяют биологические функции ДНК в качестве материального носителя наследственной информации. В принципе, об этой роли ДНК стало известно несколько раньше (1944) в результате работ американского генетика О. Т. Эйвери с сотрудниками, но не было известно, в какой мере данная функция зависит от молекулярного строения ДНК. Это стало возможным лишь после того, как в лабораториях У. Л. Брэгга, Дж. Бернала и др. были разработаны новые принципы рентгеноструктурного анализа, обеспечившие применение этого метода для детального познания пространственного строения макромолекул белков и нуклеиновых кислот.
В 1957 Дж. Кендрю установил трёхмерную структуру миоглобина, а в последующие годы это было сделано М. Перуцем в отношении гемоглобина. Были сформулированы представления о различных уровнях пространственной организации макромолекул.
Наиболее наглядным примером того, как молекулярная трёхмерная структура определяет биологические функции молекулы, служит ДНК.
Так же и в случае гемоглобина оказалось, что его биологическая функция — способность обратимо присоединять кислород в лёгких и затем отдавать его тканям — теснейшим образом связана с особенностями трёхмерной структуры гемоглобина и её изменениями в процессе осуществления свойственной ему физиологической роли. При связывании и диссоциации О2 происходят пространственные изменения конформации молекулы гемоглобина, ведущие к изменению сродства содержащихся в нём атомов железа к кислороду. Изменения размеров молекулы гемоглобина, напоминающие изменения объёма грудной клетки при дыхании, позволили назвать гемоглобин «молекулярными лёгкими».
Одна из важнейших черт живых объектов — их способность тонко регулировать все проявления жизнедеятельности. Крупным вкладом М. б. в научные открытия следует считать раскрытие нового, ранее неизвестного регуляторного механизма обозначаемого как аллостерический эффект. Он заключается в способности веществ низкой молекулярной массы— т. н. лигандов — видоизменять специфические биологические функции макромолекул, в первую очередь каталитически действующих белков—ферментов, гемоглобина, рецепторных белков, участвующих в построении биологических мембран, в синаптической передаче.
В свете представлений М. б. совокупность явлений жизни можно рассматривать как результат сочетания трёх потоков: потока материи, находящего своё выражение в явлениях обмена веществ, т. е. ассимиляции и диссимиляции; потока энергии, являющейся движущей силой для всех проявлений жизнедеятельности; и потока информации, пронизывающего собой не только всё многообразие процессов развития и существования каждого организма, но и непрерывную череду сменяющих друг друга поколений. Именно представление о потоке информации, внесённое в учение о живом мире развитием М. б., накладывает на неё свой специфический уникальный отпечаток.
Молекулярная генетика (М.г.), раздел генетики и молекулярной биологии, ставящий целью познание материальных основ наследственности и изменчивости живых существ путём исследования протекающих на субклеточном, молекулярном уровне процессов передачи, реализации и изменения генетической информации, а также способа её хранения.
М. г. выделилась в самостоятельное, направление в 40-х гг. 20 в. в связи с внедрением в биологию новых физических и химических методов (рентгеноструктурный анализ, хроматография, электрофорез, высокоскоростное центрифугирование, электронная микроскопия, использование радиоактивных изотопов и т. д.), что позволило гораздо глубже и точнее, чем раньше, изучать строение и функции отдельных компонентов клетки и всю клетку как единую систему. С новыми методами в биологию пришли новые идеи физики и химии, математики и кибернетики. Большую роль в быстром развитии М. г. сыграло перенесение центра тяжести генетических исследований с высших организмов (эукариотов) — основных объектов классической генетики, на низшие (прокариоты) — бактерии и многие другие микроорганизмы, а также вирусы. Преимущества использования более простых форм жизни для решения генетических проблем заключаются в быстрой смене поколений у этих форм и возможности изучать одновременно огромное число особей; благодаря этому сильно возрастает разрешающая способность генетического анализа и повышается его точность. Кроме того, сравнительная простота организации бактерий и особенно вирусов облегчает выяснение молекулярной природы генетических явлений. Высказываемое иногда мнение о тождестве М. г. и генетики микроорганизмов ошибочно. М. г. изучает молекулярные основы генетических процессов как у низших, так и у высших организмов и не включает частной генетики прокариотов, занимающей видное место в генетике микроорганизмов.
За свою недолгую историю М. г. достигла значительных успехов, углубив и расширив представления о природе наследственности и изменчивости, и превратилась в ведущее и наиболее быстро развивающееся направление генетики.
Одно из главных достижений М. г.— выяснение химической природы гена. Классическая генетика установила, что все наследственные потенции организмов (их генетическая информация) определяются дискретными единицами наследственности — генами, локализованными гл. обр. в хромосомах клеточного ядра, а также в некоторых органеллах цитоплазмы (пластидах, митохондриях и др.). Однако методы классической генетики не позволяли вскрыть химическую природу генов, что было отмечено ещё в 1928г. выдающимся биологом Н. К. Кольцовым, обосновавшим необходимость изучения механизма наследственности на молекулярном уровне. Первый успех в этом направлении был достигнут при изучении генетической трансформации у бактерий. В 1944 американский учёный О. Т. Эйвери с сотрудниками обнаружил, что наследственные признаки одного штамма пневмококков могут быть переданы другому, генетически отличному штамму путём введения в его клетки дезоксирибонуклеиновой кислоты (ДНК), выделенной из первого штамма. Впоследствии подобная генетическая трансформация с помощью ДНК была открыта у других бактерий, а в последнее время — и у некоторых многоклеточных организмов (цветковые растения, насекомые). Т. о., было показано, что гены состоят из ДНК. Этот вывод был подтверждён опытами с ДНК-содержащими вирусами: для размножения вируса достаточно введения молекул вирусной ДНК в клетку восприимчивого хозяина; все другие компоненты вируса (белки, липиды) лишены инфекционных свойств и генетически инертны. Аналогичные опыты с вирусами, содержащими вместо ДНК рибонуклеиновую кислоту (РНК), показали, что у таких вирусов гены состоят из РНК. Выяснение генетической роли ДНК и РНК послужило мощным стимулом для изучения нуклеиновых кислот биохимическими, физико-химическими и рентгеноструктурными методами. В 1953 американский учёный Дж. Уотсон и английский учёный Ф. Крик предложили модель структуры ДНК, предположив, что её гигантские молекулы представляют собой двойную спираль, состоящую из пары нитей, образованных нуклеотидами, расположенными апериодически, но в определённой последовательности. Каждый нуклеотид одной нити спарен с противолежащим нуклеотидом второй нити по правилу комплементарности. Многочисленные экспериментальные данные подтвердили гипотезу Уотсона и Крика. Несколько позже было установлено, что аналогичной структурой обладают молекулы разных РНК, только они большей частью состоят из одной полинуклеотидной нити. Дальнейшие работы, в которых химические и физико-химические методы сочетались с точными генетическими методами (использование разнообразных мутантов, явлений трансдукции, трансформации и т. д.), показали, что разные гены различаются как числом входящих в них пар нуклеотидов (от нескольких десятков до полутора тысяч и более), так и строго определённой для каждого гена последовательностью нуклеотидов, в которой закодирована генетическая информация. Принципиально сходную химическую структуру имеют и гены, состоящие из РНК,— у вирусов РНК-типа.
Классическая генетика рассматривала ген как дискретную и неделимую единицу наследственности. Большое значение в пересмотре этой концепции имели работы А. С. Серебровского и его учеников, в 1930-х гг. впервые указавших на возможность делимости гена. Однако разрешающая способность методов классической генетики была недостаточной для изучения тонкого строения гена. Только с развитием М. г. удалось в 50—60-х гг. решить эту проблему. Многими работами, проведёнными сначала на бактериях и вирусах, а затем и на многоклеточных организмах, было выяснено, что ген обладает сложным строением: он состоит из десятков или сотен участков — сайтов, способных независимо мутировать и рекомбинировать. Пределом дробимости гена, а, следовательно, и минимальным размером сайта является одна пара нуклеотидов (у вирусов, которые содержат одну нить РНК,— один нуклеотид). Установление тонкого строения генов позволило значительно углубить представление о механизме генетической рекомбинации и закономерностях возникновения генных мутаций, оно способствовало также выяснению механизма функционирования генов.
Данные о химической природе и тонком строении генов позволили разработать методы их выделения. Впервые это было выполнено в 1969г. американским учёным Дж. Бэквитом с сотрудниками для одного из генов кишечной палочки. Затем то же удалось осуществить у некоторых высших организмов (земноводных). Ещё более значительный успех М. г. — первый химический синтез гена (кодирующего аланиновую транспортную РНК дрожжей), осуществлённый X. Корана в 1968г. Работы в этом направлении ведутся в ряде лабораторий мира. Для внеклеточного синтеза более крупных генов успешно применены новейшие биохимические методы, основанные на явлении так называемой обратной транскрипции. Используя эти методы, С. Спигелмен, Д. Балтимор, П. Ледер и их сотрудники (США) в 1972г. смогли синтезировать ген гемоглобина.
Таким образом, М. г. уже выяснила в принципе вопрос о том, как записана и хранится генетическая информация, получаемая потомками от родителей, хотя расшифровка конкретного содержания этой информации для каждого отдельного гена требует ещё огромной работы.
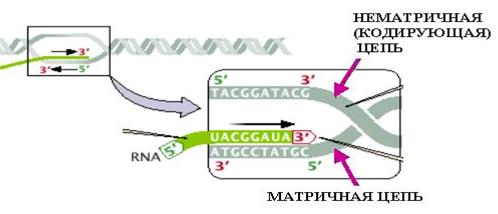
Установление структуры ДНК открыло возможности для экспериментального исследования биосинтеза молекул ДНК — их репликации. Этот процесс лежит в основе передачи генетической информации от клетки к клетке и от поколения к поколению, т. е. определяет относительное постоянство генов. Изучение репликации ДНК привело к важному выводу о матричном характере биосинтеза ДНК: для его осуществления необходимо наличие готовой молекулы ДНК, на которой, как на шаблоне (матрице), синтезируются новые молекулы ДНК. При этом двойная спираль ДНК раскручивается и на каждой её нити синтезируется новая, комплементарная ей нить, так что дочерние молекулы ДНК состоят из одной старой и одной новой нити (полуконсервативный тип репликации). Выделен белок, вызывающий раскручивание двойной спирали ДНК, а также ферменты, осуществляющие биосинтез нуклеотидов и их соединение («сшивание») друг с другом. Несомненно, что в клетке имеются механизмы, регулирующие синтез ДНК. Пути такой регуляции ещё во многом неясны, но очевидно, что она в большой степени определяется генетическими факторами.
М. г. достигла выдающегося успеха и в решении важнейшей задачи, сформулированной ещё классической генетикой,— каким образом ген определяет признак, или как происходит реализация генетической информации. Предпосылкой послужило сформулированное ещё в 1941 Дж. Бидлом и Э. Тейтемом положение «один ген — один фермент». Это положение позволило поставить вопрос в следующем виде: как гены, т. е., по сути дела, участки молекулы ДНК, определяют химическую структуру и свойства белков, специфичных для данного организма? Раскрытие химической структуры ДНК и белка дало возможность сопоставить эти два типа биополимеров, что привело к концепции генетического кода, согласно которой порядок чередования 4 сортов нуклеотидов в ДНК определяет порядок чередования 20 сортов аминокислот в белковой молекуле. От последовательности расположения аминокислот в белковой молекуле (её первичной структуры) зависят все её свойства. Расшифровка принципов, на которых основан генетический код, была осуществлена в 1962 Ф. Криком с сотрудниками в генетических опытах с мутантами одного бактериального вируса. Оказалось, что каждая тройка нуклеотидов в цепи ДНК (триплет, кодон) определяет, какая именно из 20 аминокислот займёт данное место в полипептидной цепи синтезируемого белка, т. е. каждый триплет кодирует определённую аминокислоту. Последующие работы позволили полностью расшифровать генетический код и установить его свойства.
Расшифровка генетического кода сыграла выдающуюся роль в выяснении механизма биосинтеза белка.
Как показали в 1961г. французские учёные Ф. Жакоб и Ж. Моно, биосинтез белка в бактерии находится под двойным генетическим контролем. Ими предложена и модель оперона.
С развитием М. г. более глубоким стало понимание мутационного процесса, т. е. изменения генетической информации. Было показано, что мутации представляют собой либо замены отдельных нуклеотидов, либо вставки или выпадения нуклеотидов в молекуле ДНК. Мутации возникают как вследствие случайных ошибок при репликации ДНК, так и в результате повреждающего нуклеиновые кислоты действия различных физических и химических агентов — мутагенов.
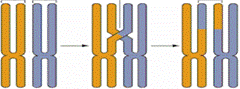
Изучение репарации открыло новые подходы к исследованию механизма рекомбинации сцепленных (т. е. лежащих в одной хромосоме) генов, представляющей одну из причин комбинативной изменчивости, которая наряду с мутациями играет важную роль в эволюции. Классической генетикой было показано, что рекомбинация сцепленных генов происходит путём обмена гомологичных хромосом участками (кроссинговер), но тонкий механизм такого обмена оставался неизвестным. Экспериментальные данные последних лет позволяют рассматривать внутрихромосомную и внутригенную (межсайтовую) рекомбинацию как ферментативный процесс, происходящий при взаимодействии молекул ДНК. Акт рекомбинации осуществляется путём разрывов и соединения в новом сочетании отрезков полинуклеотидных нитей.
М. г. своими замечательными открытиями оказала плодотворное влияние на все биологические науки. Она явилась той основой, на которой выросла молекулярная биология, значительно ускорила прогресс биохимии, биофизики, цитологии, микробиологии, вирусологии, биологии развития, открыла новые подходы к пониманию происхождения жизни и эволюции органического мира.
Так, исследования в области генетики микроорганизмов наряду с решением общебиологических проблем имеют и свои специфические микробиологические задачи. Основными из них являются познания молекулярных основ наследственности и изменчивости микробов, разработка методов и принципов управления их жизнедеятельностью и получение видов микробов, полезных для человека. Применительно к задачам медицинской микробиологии генетические исследования имеют целью познание генетических основ патогенности и иммуногенных свойств микробов, получение на основе этих данных вакцинных штаммов, продуцентов антибиотиков и устранение вредоносного действия микробов.
Многочисленные исследования изменчивости микробов, несомненно, имели и имеют важнейшее практическое значение. Они дают возможность ставить более точный микробиологический диагноз инфекционных заболеваний, выбирать наиболее полноценные штаммы для производства вакцин.
В конце 80-х годов XX ст. группа ученых во главе с Д. Уотсоном (один из авторов модели ДНК) составили программу расшифровки генома человека, работы над которой начались в 1990 г. Всего на ее выполнение израсходовано около 6 млрд долларов. Наряду с этим исследовались и геномы других организмов (около 820 видов).
Первым крупным успехом стало полное картирование в 1995 г. генома бактерии Haemophilus influenzae. Позднее были полностью описаны геномы еще более 20 бактерий, среди которых возбудители туберкулеза, сыпного тифа, сифилиса и др. В 1996 г. картировали ДНК первой эукариотической клетки - дрожжей, а в 1998 г. впервые был картирован геном многоклеточного организма - круглого червя Caenorhabditis elegans. К 1998 г. установлены последовательности нуклеотидов в 30 261 гене человека, т.е. расшифрована примерно половина, как тогда считали, генетической информация человека. Полученные данные позволили впервые реально оценить функции генов в организме человека.
В декабре 1999 г. исследователи Великобритании и Японии объявили об установлении структуры 22-й хромосомы. Это была первая декодированная хромосома человека. Она содержит 33 млн пар оснований, и в ее структуре остались нерасшифрованными 11 участков (около 3% длины ДНК). Для этой хромосомы определены функции примерно половины генов, из 545 обнаруженных. Установлено, например, что с дефектами этой хромосомы связано 27 различных заболеваний, среди которых такие, как шизофрения, миелоидная лейкемия и трисомия 22 - вторая по значению причина выкидышей у бременных.
В апреле 2000 года была расшифрована структура 21 хромосомы и выявлено 225 генов. Наличие данных о числе генов в двух разных хромосомах, на долю которых приходится 2 % ДНК генома, позволило рассчитать общее число генов в кариотипе человека равным 40 000.
В феврале 2001 г. было опубликовано две предшествующих версии генома человека. Это результат многолетней работы многих ученых, которые составили две группы. Первая из них — Международный некоммерческий проект «Геном человека» — Human Genom Ргоyесt (НGP) — объединил 20 лабораторий, сотни ученых из разных стран мира. Эта группа поставила перед собой цель расшифровку генома человека и получение данных, которые могло бы стать общедоступными. Частная же компания «Целера Геномикс» (Сеlега Gеnomics) также поставила перед собой задачу расшифровки генома человека, но планировала предоставлять полученную информацию на коммерческой основе.
Обе версии содержат еще много белых пятен и неточностей, поэтому работа продолжается. Тем не менее полученные результаты разрешили сопоставить геном человека с геномами других эукариотов (дрожжей, червя, мухи дрозофилы и растения). Установлено, что последовательность генома человека, как и других эукариотов, состоит из участков, которые кодируют белки (? 2 %), участков, которые кодируют РНК (? 20 %), а свыше 50 % составляют повторяемые последовательности, которые тяжело клонируются и потому создается много пробелов.
Итак, большая часть генома человека не кодирует белки. В эту часть входят фрагменты, которые кодируют только РНК и участки ДНК повторов.
Тысячи генов у человека только транскрибируются и продуцируют РНК, которая не кодирует белок (нкРНК). Идентифицировано также около 500 генов для транспортных РНК. Пока нет полных последовательностей для рибосомальних РНК (рРНК), хотя интерес к ним очень большой учитывая их роль в образовании пептидних связей при трансляции.
Кроме того, идентифицировано около 80 маленьких ядерных РНК, которые принимают участие в сплайсинге незрелой РНК, а также почти сотня генов маленьких ядрышковых РНК, которые принимают участие в процессинге.
Гены нкРНК и псевдогены, которые образовались из них, по своим размерам являются маленькими и не делятся на группы — это специфические структурные особенности, поиск их с помощью компьютерных методов очень труден, хотя они очень распространены в геноме человека.
В 2003 г Национальный институт геномных исследований (США) завершил расшифровку (секвенирование) генома человека.
Несмотря на определенные успехи в секвенировании генома человека (он просеквенирован на 99%), никто из генетиков не может с уверенностью назвать точное количество генов у человека. В последних данных упоминалась цифра в пределах 22-25 тысяч, однако американские ученые, в статье, опубликованной в журнале PLoS Computational Biology (2006), заявили о находке дополнительных 5286 регионов, которые могут транскрибироваться.
Основанием для такого утверждения является успешное применение нового подхода в обработке данных, позволяющего выявлять так называемые геномные отпечатки транскрипции, невидимые обычными методами. Ученые предполагают, что в большинстве случаев найденные ими гены не являются белок-кодирующими, но выполняют определенные, и пока неизвестные функции.
Расшифровка генома подняла научную планку в эмбриологии, вирусологии, клеточной биологии, теории эволюции, биотехнологии, медицинской генетике. Уже появился термин «new biology», новая биология - наука, которая началась еще в феврале 2001 года.
Структура генов человека намного более сложная, чем у других эукариотов. Часто они перерываются большими интронами, приблизительно 35 % генов могут считываться с разными рамками, 40 % иРНК могут подвергаться альтернативному сплайсингу. Итак, одна последовательность ДНК может кодировать больше, чем один тип иРНК.
Сама карта топографии генов на хромосомах напоминает глобус или контуры Земли, видимые из самолета. Основная часть генов сбита в большие и малые «города», которые разделены огромными безжизненными пространствами. Мужская половая хромосома, обедненная генами, напоминает Византийскую империю, уже пережившую эпоху взлета. За истекший период истории многие гены покинули эту территорию и перебрались в другие «страны».
Наоборот, девятнадцатая хромосома человека напоминает генетическую «столицу» - весь информационный хлам и старые отжившие постройки выкинуты с этой функционально продвинутой территории. С большим трудом на этой хромосоме удалось отыскать вакантные места, не застроенные генами, то есть не несущие в реальный мир проекты трехмерной жизни мира белков и белковых машин. Вот почему аномалии 19-й хромосомы заканчиваются смертью уже в утробе матери.
На техногенном языке - любая функция клетки закодирована устройством белковых машин. На девятнадцатой и двадцать первой хромосоме хорошо виден порядок жизни в «городах»: вдоль главной улицы кварталы застраиваются дупликацией генов, то есть все родственники селятся рядом. Хотя бывают исключения, когда новые отпрыски генов начинают осваивать далекие территории. Хромосомы человека отличаются от хромосом бактерий, дрозофилы и низших многоклеточных максимальными перепадами плотности генов по длине двойной спирали ДНК. У человека - максимальное число «мегаполисов» генов наряду с огромными пустыми пространствами бессмыслицы. Именно на границе «генных городов» и «пустырей» родятся новые проекты переустройства старых генов или правил использования старых генов для новой функции.
Практически каждый ген человека отличается вариабельностью. В геноме человека есть участки с повышенной и пониженной вариабельностью. Например, участки главного комплекса гистосовместимости (МНС), которые кодируют белки гистосовместимости, отличаются значительной вариабельностью, определяя иммунологическую индивидуальность человека.
Генетический полиморфизм имеет большое биологическое значение для человека. Так, полиморфизм гена апоЕ4 оказывает содействие увеличению плотности бляшек при болезни Альцгеймера, а делеция гена, который кодирует хемокиновый рецептор ССR 5, увеличивает стойкость иммунодефицита человека относительно вируса. Этот корецептор, вместе с рецептором СD4, является необходимым для связывания и проникновения вируса в Т-лимфоцит. При сравнении расположения и частоты одиночных замен у больных и здоровых людей обнаруживаются те замены, которые связанны с той или иной болезнью. Такие сопоставления дают возможность выяснить роль определенных генов в развитии мультифакториальных заболеваний. Исследования в этом направлении очень перспективны и интенсивно развиваются.
В 1994 г. в молекулярной биологии возник новый термин — протеом. Он, фактически, призван описать все совокупности белков, которые синтезируются на протяжении жизни клеток организма. Область исследования структуры и функции белков — продуктов функционирования генов —получила название протеомика. Ее значение в медицине является крайне важным, так как будут идентифицированы белковые маркеры различных болезней. Перспективно также изучение эффектов взаимодействия лекарственных веществ с геномом человека (фармакогеномика).
Следует отметить, что расшифровка первичной структуры белков на основе изученных генов, которые кодируют белки, еще не указывает на раскрытие функций тех или других продуктов генов. За этим будет следовать продолжительный систематический анализ протеома человека. Большое значение в расшифровке роли определенных генов, которые синтезируют белок, имеет сравнение первичной структуры белков с известными и неизвестными функциями, которые получены от представителей видов разного уровня эволюционного развития. Сегодня такая работа начинается. На основе выявления только первичной структуры белка нельзя установить его точную функцию. Тем не менее изучение генома дает важную информацию о возникновении белковых доменов, о расширении их семейств, семейств самих белков и т.д.
В геноме человека выявлены гены, гомологичные таким в геноме мухи (61 %), в геноме червя (43 %), в геноме дрожжей (46 %). Это основной набор генов, которые кодируют главные жизненные процессы в клетке: основной метаболизм, репликация и репарация ДНК, биосинтез белка.
Выявлено также свыше 220 генов, продукты которых похожи на белки бактерий, но не похожие на белки дрожжей, растений, беспозвоночных. Скорее всего, эти гены попали в геном человека от бактерий путем переноса.
Сопоставление генома человека и исследованных беспозвоночных дало возможность обнаружить значительно большее количество генов, которые отвечают за разные регуляторные функции в организме: защита и иммунитет; структура и функции центральной нервной системы; белков, которые принимают участие в построении цитоскелета и движении везикул; внутренне- и межклеточная сигнализация в развитии и гомеостазе; транскрипция и трансляция; гемостаз; апоптоз и др.
Секвенирование генома стало толчком к исследованию генов, которые «отвечают» за болезни человека. Необходимым является проведение функциональной классификации самих генов и их продуктов — белков. Все гены (923), которые вызывают моногенные заболевания или повышают вероятность возникновения болезни, характеризовались по функции их продуктов относительно патологического процесса и клинических проявлений. Наибольшую функциональную группу составляли ферменты (31 %). Вторая по величине группа — белки-активаторы и стабилизаторы, белки, которые принимают участие в правильном свертывании полипептидных цепей (14 %). Любая из остатка групп (рецепторы, факторы транскрипции, трансмембранные переносчики и др.) составляли менее 10 % от всех генов, которые вызывают болезни. Корреляционный анализ между функцией продуктов генных болезней и возрастом больных показал, что болезни, связанные с нарушениями функции ферментов, обнаруживаются на всех этапах развития. В тоже время болезни, связанные с генами, которые кодируют транскрипционные факторы, обнаруживаются на этапе внутриутробного развития.
Таким образом, секвенирование генома человека свидетельствует об усложнении генома в ходе эволюции — от дрожжей к человеку. Однако количество генов увеличилось лишь в 5 раз. Усложнение состоит в возникновении большого количества белков, а не генов, которые синтезируют белок. Организм человека, используя известные структурные конструкции, собирает новые белки с новыми функциями. Возможно, это достигается с помощью сложных механизмов посттранскрипционных процессов.
Следует отметить, что описанные достижения еще не являются расшифровкой генетического «текста». Настоящее чтение генетического текста, перевод его из языка молекул на язык характеристик морфологических и функциональных особенностей человека, его болезней только начинается.
Перспектива получить ответ на эти и прочие вопросы относительно генома человека появилась в декабре 2002 г., когда было завершено секвенирование генома мыши. Это шестой секвенированный эукариотический геном и второй после человека — млекопитающего.
Сравнение геномов человека и мыши позволит лучше понимать эволюцию и функционирование генома. По предварительным данным, у мыши количество генов, которые кодируют белок, ориентировочно составляет 27-35,5 тыс., а у человека, как уже было указано выше, — 30-40 тыс. Таким образом, у млекопитающих количество генов, которые кодируют белок, всего 30-40 тыс., а не 100 тыс., как прогнозировалось раньше. Вероятно, что дивергенция исходного генома общего предка началась 75-65 млн лет тому. При этом частота перестроек оказалась довольно низкой, а некоторые гены остались практически неизменными, благодаря чему стало возможным распознать синтенные районы, которые относительно сохраненными передалось от общего предка.
У мыши 99% генов имеют сходные к геному человека последовательности, 96 % из них находятся внутри синтенных участков хромосом мыши и человека. В геноме мыши определено 558 ортологосних маркеров для выявления консервативных синтенних участков. Оба генома можно распределить на 342 синтенных сегмента, то есть максимально длинные участки, в которых последовательности маркеров в хромосоме мыши и человека имеют одинаковый порядок. Около 90,2 % генома человека и 93,3 % генома мыши содержат консервативные синтенные сегменты.
Кроме того, было выявлено 217 синтенных блоков. Синтенный блок — один или больше синтенных сегментов, расположенных на одинаковой хромосоме у человека и мыши, но которые могут отличаться порядком расположения или ориентации. Например, Х-хромосома — целый синтенный блок, а хромосома 20 человека, кроме небольшого центрального сегмента, практически целиком отвечает хромосоме 2 мыши. Хромосома 17 человека отвечает части хромосомы 11 мыши. Другие хромосомы человека и мыши отличаются между собою значительно больше. Карта консервативных синтенных сегментов геномов мыши и человека дала возможность предположить минимальное количество перестроек, необходимое для трансформации одного генома в другой. С учетом 342 синтенных сегментов, это, за весьма скромными подсчетами, — 295 перестроек. Причем в некоторых участках хромосом перестройки могли происходить повторно. На основании знаний генома только двух видов млекопитающих невозможно определить порядок генов в хромосомах общего предшественника или восстановить точную последовательность перестроек.
Почти 40 % генома человека является родственным геному мыши на нуклеотидном уровне. Вероятно, это ортологосные последовательности, которые сохранилось от общего предка. Менее 1 % генома мыши не имеет гомологичных участков в геноме человека и наоборот. Сделан также вывод об идентичности аминокислотной последовательности в 78,5 % случаев. Он базируется на сходстве почти 13 тыс. генов человека и мыши.
Анализ генома мыши и сопоставление его с геномом человека дало возможность обнаружить новые гены человека, как, например, новый ген семейства АРОА -АРОАV, который принимает участие в метаболизме липидов, был выявлен при сравнении нуклеотидной последовательности мыши и синтенного участка хромосомы 11 человека.
Сравнение геномов двух видов предоставило возможность также определить отличия между механизмами, которые формировали геном, включая разность между мутационным и селективным давлением. В геноме мыши выявлена экспансия генов, которые «отвечают» за репродукцию, обоняние, защиту.
При сравнении двух геномов появились также и новые вопросы. Оказалось, что подобные типы повторяемых последовательностей накапливаются в соответствующих участках генома обоих организмов, что свидетельствует о некоторые дополнительных факторах, влияющих на перестройку генома транспозонами.
Завершение секвенирования генома мыши имеет важнейшее практическое значение. Оно даст возможность более точно моделировать биологические процессы и болезни человека. Лабораторная мышь — экспериментальный ключ к геному человека, который разрешит манипулировать каждым геном человека.
Мышь используется как объект лабораторных исследований на протяжении всего XX ст. В 1909 г. была выведена первая инбредная линия мышей DВА. На мышах инбредных линий было проведено огромное количество экспериментов, но данные, полученные в эксперименте на мышах, не всегда можно экстраполировать на человека, в особенности относительно медицинских аспектов. Проблема анализа болезней человека, которые моделируются на мышах, была частично разрешена путем создания трансгенних мышей, первую из которых было получено в 1982 г., когда в эмбрион мыши встроили ген гормона роста крысы под контролем Zn-зависимого промотора. В 1989 г. создали первую «нокаут» мышь с селективной инактивацией гена в эмбриональных стволовых клетках.
Знание нуклеотидних последовательностей и синтенных участков человека и мыши позволит целенаправлено встраивать определенные гены человека или инактивировать подобные участки ДНК мыши. Анализ фенотипов таких мышей дает возможность обнаружить неизвестную сейчас функцию отдельных генов человека. Изучение мышиных моделей полигенных болезней человека и наличие подобных последовательностей в геноме человека даст возможность обнаружить и локализовать гены, которые отвечают за развитие этих заболеваний. Знание отличий геномов также будет предотвращать создание неполноценных моделей при удалении одного гена в мыши, если в ее геноме он представлен несколькими копиями.
Знание соответствия между последовательностями ДНК мыши и человека разрешит точно встраивать гены человека в синтенные участки генома мыши и получить «очеловеченную» за определенными признаками мышь. Особый интерес такие мыши составляют для фармацевтической промышленности. Так, исследование генома мыши показало экспансию у нее четверых подсемейств генов цитохрома Р450. Эти гены отвечают за ферменты, которые активно участвуют в метаболизме ксенобиотиков, в том числе и лечебных средств. Генетически модифицированная по генам цитохромов мышь может стать точной моделью человека в процессе исследования биотрансформации лечебных препаратов.
С завершением в ближайшем будущем секвенирования генома еще одного лабораторного животного —крысы — моделирование болезней человека будет намного достовернее. Запланированное секвенирование геномов шимпанзе, собаки, коровы значительно увеличит наши знания о геноме млекопитающих и, соответственно, человека. Достижения в области молекулярной биологии на рубеже XX и XXI ст. оказало содействие возникновению молекулярной медицины — нового направления в естествознании. Это, в свою очередь, инициировало развитие прогрессивных технологий, которые совершенствовали старые и создавали новые методы. Подавляющее большинство этих методов автоматизированные и объединяются с компьютерными технологиями. Наглядными примерами этого являются автоматические подходы секвенирования генома человека и следующий этап — исследование человеческого протеома. Новые технологии дают возможность довольно быстро получить колоссальный объем информации о структуре до сих пор неизвестных белков. Дальнейшее выявление и изучение их функций сделает возможным совершенствование исследований клеточных процессов, механизмов индивидуального развития, эволюции живого мира.
Идентификация новых белков укрепит интеграцию биологии и фундаментальной медицины, которая приведет к открытию новых диагностических маркеров, выявлению белков-мишеней для фармакологических препаратов. Большие надежды полагаются на изучение протеома опухолей, что позволит улучшить их диагностику и в особенности лечение.
Парадоксальность ситуации, складывающейся сейчас в геномике, состоит в том, что объем информации, которым располагают исследователи, намного больше того, что можно осмыслить, проанализировать и использовать в экспериментальной работе. Поэтому развитие новых математических методов, вычислительной техники, программного обеспечения, совершенствование способов описания и хранения геномной информации становятся чрезвычайно актуальными. Этими проблемами активно занимается биоинформатика, включающая в себя и геноинформатику.
Биоинформатика анализирует ситуацию как бы на четырех тесно связанных друг с другом уровнях. Первый - это генетический текст, то есть нуклеотидная последовательность ДНК; второй - тоже текст, но сначала в форме РНК, а затем в форме аминокислотной последовательности белка; следующий, третий уровень - пространственная структура белка. Как известно, она целиком определяется первичной структурой, а экспериментально устанавливается с помощью рентгеноструктурного анализа кристаллов белков или с помощью ядерного магнитного резонанса в растворе для белков небольшого размера.
Хотя методы предсказания трехмерной структуры белка (вторичной и третичной структуры) по его аминокислотной последовательности все еще крайне неточны, тем не менее, благодаря тому, что в банках данных уже есть информация о трехмерной структуре сотен белков, можно на ее основе, используя сведения о нуклеотидной и аминокислотной последовательностях неизвестного белка, предсказывать во многих случаях и трехмерную структуру с достаточной точностью. Наконец, последний, четвертый уровень - это предсказание функции белка на основании знания его первичной структуры и предсказанной трехмерной структуры. Таким образом, структурная и сравнительная геномика через биоинформатику как бы переходят в новый раздел геномики, который обычно называют функциональной геномикой.
Все большее внимание ученых привлекает проблема разнообразия генома человека. Эти исследования направлены на решение фундаментальных научных проблем, связанных с происхождением человека, и на выяснение генных различий, связанных с чувствительностью или устойчивостью человека к различным заболеваниям и воздействиям среды.
Генетические тексты двух человек отличаются друг от друга примерно одной буквой из тысячи. Остальные 999 нуклеотидов у них одинаковы. Конечно же, замены не распределены равномерно в геноме - их больше в некодирующих участках. В каждой зародышевой клетке возникает несколько мутаций, отличающих ее геном от родительского. В некоторых участках хромосом, кодирующих особенно важные белки или рибосомную РНК, замены нуклеотидов встречаются относительно редко, в других частота обнаружения мутаций может быть в десятки раз выше. Наиболее часто встречаются мутации в гене рецептора гормона роста - в этом участке они обнаруживаются у одного из 100 000 человек.
Пока люди живут вместе, появляющиеся у них мутации распространяются по всей группе. Если же группы разделились, процесс накопления мутаций идет в них независимо. Способ датировки эволюционных событий по генетическим изменениям основан на постоянстве числа накопленных мутаций за определенный отрезок времени. Лишь небольшая часть этих мутаций (преимущественно в белок-кодирующих областях) вредна.
Большинство мутаций, по современным представлениям, нейтральны, то есть не оказывают какого-либо полезного или вредного влияния на их обладателя. Они не отсеиваются отбором и, раз появившись, передаются из поколения в поколение. Метод, предложенный английским биохимиком Лайнусом Полингом для аминокислотных замен в белках, был назван «молекулярными часами». Позже скорость хода «молекулярных часов» была установлена по скорости изменения ДНК тех видов, время расхождения которых было известно по ископаемым останкам. Однако точность этих методов по статистическим причинам не очень высока - ошибка в молекулярных датировках может составлять 20-30%.
«Молекулярные часы» помогли определить дату разделения ветвей человека и обезьян - от 5 до 7 млн лет назад. До этого палеонтологи полагали, что разделение произошло около 25 млн лет назад. Однако теперь «молекулярная» датировка является общепринятой. Считается, что предки человека и шимпанзе разделились около 5 млн лет назад, отделение горилл произошло раньше, и еще раньше, около 10-15 млн лет назад, отделилась ветвь орангутангов. Пересмотр представлений о происхождении человека связан с развитием методов молекулярной генетики, в частности, с внедрением в практику исследований полимеразной цепной реакций, которая позволяет быстро нарабатывать нужные для анализа количества ДНК даже если в образце присутствует всего несколько фрагментированных молекул, и с разработкой методов автоматического анализа ДНК и компьютерной обработки данных. Новые сведения получены также в связи с увеличением числа изученных останков древних гоминид и с развитием в последние десятилетия новых методов палеонтологии (датировка останков термолюминесцентными методами и методом электронного спинового резонанса), которые позволили уточнить даты в период 200 - 50 тыс. лет.
За последнее десятилетие молекулярная антропология и палеогенетика заняли достойное место в исследованиях антропогенеза. Для сравнительного исследования генетического родства популяций используют и ядерную ДНК, и ДНК, содержащуюся в клеточных органеллах митохондриях. Митохондрии человека содержат кольцевую молекулу ДНК (мтДНК), состоящую из 16 500 пар нуклеотидов - это совсем немного по сравнению с ДНК хромосом, находящихся в ядре клетки и состоящих из десятков и сотен миллионов пар оснований. Кроме того, мтДНК передается только по материнской линии и не участвует в рекомбинации, что упрощает ее анализ. Так как мтДНК мутирует в 10 раз чаще, чем ядерная ДНК, это делает «часы» более точными.
Получившие известность исследования, выявившие общность происхождения мтДНК ныне живущих людей, были проведены в 1987 г. Аланом Уилсоном и его коллегами из Калифорнийского университета в Беркли. Они изучили мтДНК представителей различных рас - африканцев, азиатов, европеоидов. Наибольший уровень разнообразия ДНК был найден в Восточной Африке, что указывает на африканское происхождение человека современного типа. По степени разнообразия мтДНК современных людей Уилсон оценил время существования предковой последовательности для всех изученных мтДНК. В соответствии с его выводами, общая «праматерь», к которой восходят все типы мтДНК современных людей, жила в Восточной Африке менее 200 000 лет назад. Обладательницу этой мтДНК тут же окрестили «митохондриальной Евой», что породило неверные толкования - будто все человечество произошло от одной женщины. Речь идет лишь о сохранении до настоящего времени одной из нескольких линий мтДНК, но не остальных генов. Современники «Евы» внесли свой генетический вклад. Изучение разнообразия ДНК других генов, находящихся в разных хромосомах, показало, что численность популяции в период видообразования составляла около 10 000 человек.
Близкие оценки времени существования общего предка получены и при изучении передающейся только по отцовской линии Y-хромосомы. К радости генетиков оказалось, что «Адам» жил в том же районе и примерно в то же время, что и «Ева». Эволюционная история мтДНК и Y-хромосомы отличается, так как связана с разными брачными традициями, разным поведением мужчин и женщин при переселениях, завоеваниях или колонизации. На основе распределения частот различных аллелей генов Y-хромосомы и мтДНК составлена карта расселения людей с Африканской прародины.
Различные группы генетиков, исходя из оценок генетического разнообразия современных популяций человека, пришли к выводу, что на протяжении последнего миллиона лет численность прямых предков человека колебалась от 40 до 100 тысяч. В период прохождения «бутылочного горлышка» 130 000 лет назад она сократилась до 10 тысяч индивидов, то есть на 75-90%, что привело к утрате значительной части генетического разнообразия.
Сравнительные исследование мтДНК разных популяций современных людей позволило выдвинуть предположение, что еще до выхода из Африки, около 60-70 000 лет назад (в этот период также наблюдалось снижение численности, но не столь значительное, как предыдущее) предковая популяция разделилась по крайне мере на три группы, давшие начало трем расам - африканской, азиатской и европейской.
Изучение генетического разнообразия популяций человека имеет существенное значение не только для понимания процесса антропогенеза, но и для понимания механизмов адаптации популяций к различным условиям обитания, устойчивости или восприимчивости к тем или иным заболеваниям, для разработки методов ДНК-идентификации личности и для ДНК-диагностики наследственных и онкологических заболеваний. Не только наследственные заболевания, но и предрасположенность к инфекционным заболеваниям имеет генетическую основу. Разные люди в разной степени восприимчивы к различным инфекциям. «Чума» ХХ века - СПИД - пока неизлечимое заболевание. Но некоторые люди (в Европе около 1-2 %) невосприимчивы к вызывающему СПИД вирусу иммунодефицита человека (ВИЧ) из-за мутации в гене хемокинового рецептора. Хемокиновый рецептор расположен на поверхности клеток и служит «посадочной площадкой» для вируса СПИДа. В отсутствии этого белка вирус, попав в организм, не способен проникнуть внутрь клетки и не приводит к заболеванию. Описаны и другие мутации, приводящие к повышенной устойчивости к ВИЧ.
Другой пример - эпидемия «коровьего бешенства» (губчатая болезнь мозга), распространившаяся в Англии в связи с изменением технологии приготовления костной муки, используемой в качестве кормовой добавки для скота (была снижена температура обработки) и поразившая 160 000 животных. Пик эпидемии пришелся на 1992 г. Заболевание вызывается белком-прионом - удивительным инфекционным агентом, не содержащим ДНК и вызывающим изменение конформации клеточных белков и нарушение функций клеток нервной системы. Хотя зараженную говядину употребляли многие, только два десятка человек заболели. Все заболевшие люди имели одну и ту же мутацию, известную ранее и считавшуюся нейтральной.
В последние годы особое внимание уделяют распространенности в различных популяциях аллелей генов предрасположенности к тем или иным заболеваниям и так называемых генов «внешней среды». В частности, это гены, контролирующие детоксикацию чужеродных веществ. Все вещества, поступающие в организм, метаболизируются в два этапа. На первом этапе образуются промежуточные генотоксические вещества. На втором этапе эти промежуточные метаболиты превращаются в безвредные растворимые соединения, которые выводятся из организма.
Показано, что при снижении активности детоксикационной функции плаценты (она связана с ферментом, называемым плацентарной глютатион-трансферазой) возрастает риск ранних спонтанных абортов.
То, как организм реагирует на вредные воздействия среды, например, на табачный дым, также в значительной мере определяется активностью системы детоксикации. Например, у 3% женщин встречается сочетание генов, ответственных за обезвреживание канцерогенов табачного дыма ферментами печени, которое в 10 раз повышает риск развития рака молочной железы. Таким женщинам курить строго противопоказано. Влияют гены и на эффективность лечения различными препаратами. Так, лечение эндометриоза - заболевания, встречающегося почти у 10% женщин белой расы - широко используемым препаратом циклофероном у части больных безрезультатно по причинам генетического характера.
Найдены гены, защищающие от заболевания некоторыми формами рака. Особенно эффективно они действуют в сочетании с благоприятными условиями среды. Например, вероятность развития рака толстой кишки снижается в присутствии некоторых аллелей генов детоксикации, также как и при употреблении в пищу капусты брокколи или зеленого чая.
Получение информации о собственных генетических особенностях для каждого человека из научной перспективы превращается в повседневную реальность. Это дает возможность еще до рождения предсказать, к каким наследственным заболеваниям будет предрасположен человек, какие меры профилактики и лечения могут быть приняты. Меньше известно о том, что можно получить и определенные рекомендации по выбору профессии, установить какая деятельность будет связана с повышенным риском для данного индивида.
Например, давно известна ассоциация между анилиновыми красителями и риском возникновения рака мочевого пузыря. Недавно, однако, было установлено, что такому грозному «производственному» осложнению особенно подвержены индивидуумы, у которых сочетается повышенная активность ферментов первой фазы детоксикации с пониженной активностью ферментов второй фазы.
С частотой 15% встречается аллель гена аполипопротеина Е (белок, отвественный за связывание липидов), приводящий к ухудшению регенерации нервных тканей после травм или сотрясений мозга, особенно если индивид гомозиготен по данному аллелю. Значит, таким людям не стоит выбирать профессию боксера или автогонщика. Другой пример - у носителей мутации, приводящей к талассемии (заболеванию крови) при повышенной физической нагрузке может наступить смерть от избытка кислорода в крови. Такие случаи зафиксированы в армии США - по этой причине погибло несколько темнокожих солдат. Очевидно, что тестирование талассемической мутации может быть целесообразным при отборе пилотов авиалайнеров – ведь им иногда приходится применять кислородные маски, которые в случае носительства мутации представляют угрозу жизни пилота, а тем самым и угрозу жизни всех пассажиров.
Прочтенный в 2005 году геном шимпанзе открыл перед биологами небывалые перспективы. Сравнивая геномы человека и его ближайшего родственника, ученые рассчитывают найти те генетические различия, которые, собственно, и делают нас людьми, а не обезьянами.
Геномы человека и шимпанзе идентичны на 98%. Очевидно, уникальные человеческие свойства зашифрованы в оставшихся двух процентах. Однако расшифровать их не так-то просто.
2% ДНК, отличные у нас и шимпанзе, должны создавать все радикальные различия между нами, в том числе и в строении головного мозга.
Согласно выводам международной исследовательской группы, человеческая ветвь отделилась от общего с приматами генеалогического дерева от 2 до 7 миллионов лет назад. Вероятной причиной этого могла быть утрата человеческими предками единственного гена, которая произошла буквально перед тем, как скромный предшественник великого Нomo sapiens поднялся на задние конечности, а, может, и вскоре после этого. Этот утраченный ген контролирует синтез одного из сахаров, который называется Neu5Gc и расположен на внешней стороне мембраны всех клеток организма.
Дело в том, что поверхность всех клеток нашего тела несет определённые молекулы, в частности, сахара, которые отвечают за большое количество функций. Например – за способность клетки захватывать из межклеточной жидкости те или другие вещества, за взаимную координацию клеток при росте организма и т.д. От этих молекул также зависит способность клетки быть поражённой вирусом или иным возбудителем: нет молекулы, с которой взаимодействуют рецепторы патогена, и организм устойчив к инфекции. Не исключено, что ген, отсутствующий у человека, мог отвечать за процессы формирования нервной ткани. Когда произошла его утрата, древние человекообразные существа уже сильно напоминали современного человека по строению конечностей и другим признакам, не исключено, также, что он уже был прямоходящим. Он был очень похож на современного человека, но не совсем. Основное отличие состояло в том, что объём головного мозга был не больше, чем у шимпанзе. Значит 2% ДНК, отличной у нас и шимпанзе, и должны создавать все радикальные отличия между нами, в том числе в строении головного мозга. И ген Neu5Gc, продукт деятельности которого представлен на каждой клетке организма, вполне претендует на эту роль. Сейчас учёные занимаются обработкой полученных результатов и прогнозами того, какие это может иметь последствия.
Сегодня ученые многих стран ведут охоту за «подлинно человеческими» особенностями в геноме человека, и первые результаты – один другого интереснее – уже получены. Например, выявлены различия в генах человека и шимпанзе, связанные с эмоциональной регуляцией поведения (эти различия могли изменить мотивацию наших поступков); найдено 1500 различий в генах, связанных с онкологией (это поможет выяснить, почему шимпанзе почти не болеют раком).
Недавно обнаружилось, что эволюционный путь от обезьяны к человеку сопровождался множеством потерь. Некоторые гены, которые у шимпанзе нормально работают, у человека выключились, превратились в молчащие «псевдогены». До сих пор было известно около десятка таких генов. В 1999 году М. Олсон предложил гипотезу, известную под названием «less is more» («меньше значит больше»), согласно которой утрата генов может открывать путь для прогрессивных преобразований. Например, выключение гена MYH16 привело к уменьшению (редукции) жевательной мускулатуры у предков рода Homo, а это, в свою очередь, позволило мозгу начать увеличиваться. Группа американских ученых обнаружила в геноме человека еще около 50 молчащих генов, аналоги которых у шимпанзе вполне нормально функционируют. Работают они и у других обезьян, фрагменты генома которых уже прочтены.
Среди выключившихся генов многие оказались связаны с обонянием и иммунитетом. Обонятельные гены могли отключиться просто «за ненадобностью». В борьбе за выживание хороший нюх едва ли давал нашим предкам большое преимущество, и естественный отбор не выбраковывал особей со слабым обонянием. Но как естественный отбор мог допустить потерю генов иммунной защиты? Ученые Мичиганского университета считают, что это объясняется изменением условий жизни наших предков, а также тем, что иммунная система иногда может вредить организму излишней бдительностью. Неумеренная агрессивность иммунной системы порой ведет к опасным «аутоиммунным» заболеваниям, таким как рассеянный склероз. У мышей с искусственно выключенным иммунным геном Mbl1 реже развивается сепсис, так что отключение этого гена повышает выживаемость.
Человеческий ген Mbl1, как выяснилось, выключен у 100% лиц внеафриканского происхождения и у 89% африканцев. «Испортившая» его мутация возникла около 60 тысяч лет назад, незадолго до выхода наших предков из африканской прародины. Носители мутации явно получили какое-то важное преимущество, потому что мутация начала быстро распространяться в популяции.
Об этом говорит анализ изменчивости прилегающих участков ДНК. Как и следовало ожидать, исходя из гипотезы о позитивном отборе, вариабельность этих участков оказалась ниже у лиц с выключенным геном по сравнению с носителями исходного «рабочего» варианта. Для остальных отключенных генов доказать прямое действие отбора сложнее: они замолчали раньше, и следы отбора уже стерлись. Но и одного примера достаточно, чтобы показать, что утрата генов могла быть выгодна нашим предкам.
Повышенный уровень отключения («псевдогенизации») среди обонятельных и иммунных генов может иметь и иное объяснение. Дело в том, что между обонятельной и иммунной системами существует глубокая и не до конца еще понятая связь. Согласно недавно выдвинутой гипотезе, обе эти системы играют важную роль в регуляции социальных отношений и выборе брачных партнеров: запах партнера, возможно, играет решающую роль при возникновении влечения. Возможно, отключение соответствующих генов в ходе эволюции человека было связано с растущей ролью разумной, сознательной регуляции общественных отношений, для которой более архаичные механизмы контроля социального поведения могли быть помехой.
Вместе с тем М. г., позволившая глубоко проникнуть в природу важнейших жизненных процессов и успешно продолжающая их исследование, отнюдь не претендует на решение многих, в т. ч. и генетических, проблем, касающихся целостного организма, а тем более совокупностей организмов — популяций, видов, биоценозов и т. д., где преобладают закономерности, изучение которых требует иных методов, чем те, какие использует М. г.
Достижения М. г., внёсшие огромный теоретический вклад в общую биологию, несомненно, будут широко использованы в практике. Возможно, наиболее ярко практический потенциал молекулярной генетики проявляется в биомедицинских исследованиях. Здесь использование молекулярно-генетических подходов многопланово:
—идентификация генов, ответственных за возникновение наследственных, приобретенных заболеваний и болезней, в которых значительную роль играют генетические факторы;
анализ генетических систем, ответственных за метаболизм лекарственных препаратов в организме (фармакокинетику), их полиморфизма и корреляции этого полиморфизма с различной устойчивостью индивидуумов и популяций к действию лекарственных препаратов;
анализ генетических систем, кодирующих мишени воздействия лекарственных препаратов в организме (фармакодинамику), их полиморфизма и роли этого полиморфизма в различной восприимчивости к лекарствам;
развитие систем лечения, основанных на введении в организм новой генетической информации, призванной исправлять наследственные или приобретенные генетические дефекты или подавлять генетические изменения, связанные с проникновением инфекционных агентов (генная терапия);
развитие группоспецифических средств лечения, основанных на нацеленном применении лекарственных препаратов в генетически охарактеризованных группах, проявляющих к ним восприимчивость и не подверженных побочным эффектам;
развитие интенсивных методов диагностики, основанных на выявлении генетических дефектов на уровне целого генома и продуктов его экспрессии;
переход в диагностике к скринингу популяций и от диагноза болезней к выявлению предрасположенности к болезни.
Перспективность практического применения достижений М. г. подтверждается успехами, достигнутыми на модельных объектах. Так, у наиболее изученных в генетическом отношении видов бактерий удаётся получать мутации любого гена, лишать клетку какого-либо гена или привносить в неё желаемый ген извне, регулировать функции многих генов. Так, еще в 1971 американский учёный С. Меррилл с сотрудниками, культивируя вне организма клетки человека, больного галактоземией (такие клетки неспособны вырабатывать один из ферментов, необходимых для утилизации молочного сахара, что и является причиной этой тяжёлой наследственнойI болезни), ввели в эти клетки неинфекционный для них бактериальный вирус, содержащий ген, кодирующий данный фермент. В результате клетки «излечились» — стали синтезировать недостающий фермент и передавать эту способность последующим клеточным поколениям. Уже сейчас данные М. г. используют при создании медикаментов, применяемых для профилактики и лечения новообразований, лейкозов, вирусных инфекций, лучевых поражений, при изыскании новых мутагенов и т. д.
Достижения молекулярной биологии и генетики успешно используются при производстве судебно-медицинской идентификационной экспертизы. Молекулярно-генетический идентификационный анализ, традиционно называемый геномной (генетической) «дактилоскопией» (термин введен в 1985 г. Джеффрисом), или генотипированием, по своей сути направлен на выявление индивидуальных особенностей генетической конституции конкретного человека. Этот подход не имеет аналогов среди использовавшихся ранее методов судебно-экспертной идентификации личности. Два основополагающих принципа - индивидуальная генетическая уникальность каждого организма и генетическая идентичность всех его клеток и тканей — составляют концептуальную основу молекулярно-генетической индивидуализации.
Молекулярно-генетический идентификационный анализ позволяет исследовать особые участки ДНК, строго специфичные для каждого индивидуума, и получить, таким образом, уникальный генетический «паспорт» или «удостоверение личности» человека, которое нельзя ни скрыть, ни изменить, ни подделать. Индивидуализирующие признаки, определяемые на уровне ДНК, характеризуются почти абсолютной устойчивостью, то есть сохраняются в организме человека неизменными всю его жизнь и неизменными отображаются в его биологических следах. Поэтому идентификационная значимость генетических признаков чрезвычайно высока.
Типирование ДНК ныне стало наиболее доказательным методом анализа биологического материала при производстве судебно-медицинской идентификационной экспертизы. Эти технологии прочно вошли в арсенал экспертной деятельности судебно-медицинских служб большинства развитых стран мира. Применительно к задачам судебно-медицинской экспертизы генетические методы особенно эффективны в двух случаях: идентификации личности и установления биологического родства.
В первую очередь, речь идет об идентификации личности при расследовании убийств, тяжких телесных повреждений, изнасилований и других преступлений, требующих судебно-медицинского исследования вещественных доказательств, а также при опознании расчлененных или сильно разрушенных трупов, например, в случаях массовых природных и техногенных катастроф и военных конфликтов. Однако геномная «дактилоскопия», в отличие от традиционной криминалистической дактилоскопии, позволяет не только однозначно устанавливать личность, но и определять кровное родство лиц. Это делает ее незаменимым экспертным методом в сложных случаях подмены, утери, похищения детей, определения родства малолетних или потерявших память лиц, выявления фактов кровосмешения. Метод также весьма эффективно используется и в решении гражданских дел - установлении отцовства или материнства. Возможно даже пренатальное исследование, позволяющее устанавливать отцовство в процессе беременности, то есть до рождения ребенка.
Молекулярная медицина. Благодаря стремительному развитию таких направлений биологической науки, как молекулярная биология, молекулярная генетика, генетическая инженерия и др. возникла абсолютно новая область науки молекулярная медицина. Расшифровка первичной структуры генома человека позволяет развивать такие разделы молекулярной медицины как функциональная геномика и геномная дактилоскопия, молекулярная диагностика, фармокогенетика и генная терапия.
Практическое приложение сведений о нуклеотидной последовательности геномов многих патогенных вирусов уже широко реализуется. Генно-инженерным путём создаются непатогенные фрагменты геномов вирусов в составе плазмидных векторов. Такие векторы с вирусом способны к экспрессии в высоких концентрациях белков вирусов, которые необходимы для приготовления диагностических и вакцинных препаратов. Развивается технология получения ДНК-вакцин против СПИДа, гепатита С и других вирусных инфекций. Создана эффективная рекомбинантная вакцина против гепатита В.
Как и в геномике патогенных бактерий, сведения о функциональных свойствах отдельных участков геномов вирусов служат основой для молекулярного дизайна лекарственных средств, эффективно подавляющих размножение вируса в клетке.
Научными задачами молекулярной медицины является идентификация структурных и регуляторных генов человека, изучение их экспрессии и регуляции, выяснение генной природы и молекулярных механизмов наследственных болезней, роли генетических факторов в этиологии и патогенезе различных патологических состояний, в том числе и инфекционной этиологии.
Для большинства наследственных болезней уже разработаны точные и эффективные методы диагностики на любой стадии онтогенеза, в том числе и пренатальной. Метод ДНК-диагностики позволяет установить нарушения в структуре и регуляции генов. Так, мышечная дистрофия Дюшена наиболее распространенное нервно-мышечное заболевание, которое встречается с частотой 1:5000 мальчиков – младенцев. Причиной болезни являются мутации гена белка дистрофина, который локализован в коротком плече Х-хромосомы.
Известны размеры гена (2,4 млн. пар оснований), размер матричной РНК (14 тысяч оснований) и белка дистрофина (427 кДа), а также функция последнего – стабилизация сарколеммы (цитоплазматическая мембрана) мышечного волокна. Мутации в этом гене вызывают или полное (миодистрофия Дюшена) или частичное (миодистрофия Беккера) отсутствие соответствующего белка, следствием чего является разрушение мышечных волокон. Тяжелые формы заболевания служат причиной ранней инвалидности и смерти больного.
Пока отсутствуют надежные методы терапии мышечной дистрофии Дюшена, а постановка диагноза с точной локализацией генетического дефекта до недавнего времени была невозможной – вплоть до установления полной последовательности нуклеотидов всех 85 экзонов гена. Сейчас это стало реально благодаря знанию первичной структуры гена, возможности синтезировать олигонуклеотидные праймеры, использовать полимеразную цепную реакцию (ПЦР) для синтеза соответствующих последовательностей и использования их в диагностике (гибридизация).
Для фундаментальной биологии, теоретической медицины и клиники принципиальное значение имеет молекулярная онкогенетика. Ее исследования проводятся в нескольких направлениях: 1) молекулярная диагностика наследственных форм рака; 2) диагностика и выяснение молекулярных механизмов вирусиндуцированных форм рака; 3) поиск и диагностика молекулярных маркеров неблагоприятного прогноза при раковых заболеваниях; 4) диагностика микрометастазов; 5) поиск и диагностика полиморфных ДНК-маркеров, для выявления предрасположенности к раку.
Знание молекулярной природы изменений, которые служат причиной опухолевого роста, дают возможность делать прогноз заболевания. Молекулярно-генетические методы ПЦР и гибридизация со специфическими ДНК-зондами дают возможность идентифицировать одиночные трансформированные или метастазные клетки среди большого количества нормальных клеток (1-2 на 106 клеток). Такого уровня чувствительности не дает ни один из известных биохимических или иммунологических методов.
Принципиально не отличается от диагностики наследственных и онкологических заболеваний генодиагностика инфекционных патологий. В этом случае выявляются гены, специфические для возбудителей или продуктов их экспрессии.
Результатом достижений молекулярной генетики явилось рождение новой области медицинской науки – генетической (генной) терапии (ГТ) – возможность использования функциональных генов в качестве лекарственных средств. По существу ГТ – это совокупность биомедицинских технологий, основанных на введении больному генетических конструкций: перенос генов ex vivo (подобно случаю с геном аденозиндеаминазы, проводится обычно на клетках крови); in situ (локальная ГТ, например, введение в трахею и бронхи при муковисцидозе или в массу опухоли в случае терапии злокачественных новообразований); in vivo (введение генетических конструкций непосредственно в эмбрион).
В мире зарегистрировано уже около 1000 клинических опытов ГТ и несколько тысяч пациентов имеют в своем теле генетически модифицированные клетки.
Имеется немало веществ, специфически ингибирующих транскрипцию. Наиболее известны из них a - аманитин (один из токсинов ядовитого гриба бледная поганка) и актиномицин Д (производное естественного антибиотика из Streptomyces).
Многие антибиотики (стрептомицин, тетрациклин, левомицетин, эритромицин) ингибируют трансляцию у бактерий. Однако это не означает полной безвредности антибиотиков. На организм пациента они могут оказывать немало побочных воздействий. Некоторые из них способны влиять на белковый синтез не только у бактерий, но и у эукариот (например, циклогексамид, пуромицин).
Хорошо изучено действие дифтерийного токсина на трансляцию в клетках слизистых оболочек верхних дыхательных путей, а также холерного токсина – в эпителиальных клетках кишечника.
Ингибируют трансляцию также интерфероны. Резко ограничивая синтез белков – как собственных белков клетки, так и вирусных. Ценой подавления клеточной активности и, возможно, даже гибели клетки предупреждается многократное увеличение числа вирусных частиц.
Существует группа тяжелых неврологических болезней, обусловленных «неправильным» фолдингом прионового белка. Образующиеся прионы являются уникальными инфекционными агентами, лишенными нуклеиновой кислоты. У коров они вызывают губчатую энцефалопатию (коровье бешенство), а у человека, употребившего мясо таких коров, болезнь Крейнцфельда – Якоба. Прионы очень устойчивы к протеазам, благодаря чему, им удается проникать в неизмененном виде из желудочно-кишечного тракта в нервную ткань, где запускается патологический процесс.
Макромолекулы как обьекты изучения молекулярной биологии
Белки, их роль в обеспечении биологической специфичности. Аминокислоты, их свойства. Формирование полипептидной цепи. Первичная, вторичная,… Макромолекулы клетки.Из простых органических молекул синтезируются более крупные макромолекулы. Макромолекула — это…Белки.
Клетки в значительной степени состоят из белков, на долю которых приходится более половины от сухого вещества. Белки определяют структуру и форму клетки; кроме того, они служат инструментами молекулярного узнавания и катализа. Белки непосредственно участвуют в процессах обмена веществ, метаболизме и поддержании всех функций клетки.
Белки – это полимерные биоорганические соединения, мономерами которых являются остатки аминокислот, соединенных кислото – амидными (пептидными) связями (─NH─C(O)─).
Аминокислоты. Аминокислотами называются соединения, содержащие одновременно амино- и карбоксильную группу:
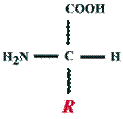
По числу аминных и карбоксильных групп, а также в зависимости от радикала R аминокислоты подразделяются на моноаминокарбоновые (глицин, аланин, валин, лейцин, изолейцин, серин, треонин, метионин, цистеин, цистин), диаминокарбоновые (лизин, аргинин), аминодикарбоновые (аспарагиновая и глутаминовая кислоты), ароматические (фенилаланин, тирозин) и гетероциклические (пролин, оксипролин, гистидин, триптофан).
Если принять во внимание полярность и заряд радикала R, то можно разделить аминокислоты на четыре класса:
–аминокислоты с неполярными (гидрофобными) R-группами (аланин, валин, лейцин, изолейцин, метионин, пролин, триптофан, фенилаланин);
–аминокислоты с полярными (гидрофильными) незаряженными R-группами (глицин, серин, треонин, цистеин, тирозин, аспарагин, глутамин);
–аминокислоты с отрицательно заряженными R-группами (кислые аминокислоты – аспарагиновая и глутаминовая кислоты);
–аминокислоты с положительно заряженными R-группами (основные аминокислоты – лизин, аргинин, гистидин).
Отмеченные 20 аминокислот входят в состав природных белков и пептидов и называются протеиногенными. Они имеют такие свойства: 1) кислотно – основные, т.е., являясь амфотерными электролитами, могут диссоциировать с образованием анионов или катионов; 2) полярность – могут быть гидрофильными или гидрофобными; 3) оптичность – ά-атом углерода представляет центр молекулы всех (кроме глицина) аминокислот и они поэтому являются оптически активными соединениями; 4) способность к образованию кислотно – амидных (пептидных) связей; 5) химические реакции (нингидриновая, флуорескаминовая, ксантопротеиновая, Милона, Сакагучи, Эрлиха, Фоля ), которые используются в аналитической и клинической биохимии для идентификации и количественного определения отдельных аминокислот(в плазме крови, моче и др.).
По своей абсолютной конфигурации протеиногенные аминокислоты являются стереоизомерами L- ряда (L- аминокислотами).D- аминокислоты в состав природных белков не входят. Они есть в некоторых антибиотиках – грамицидине и актиномицине D.
Из 20 протеиногенных аминокислот 10 являются для человека незаменимыми, то есть не синтезируемыми в организме - аргинин, лизин, валин, гистидин, лейцин, изолейцин, треонин, триптофан, метионин, фенилаланин. Исключение какой-либо незаменимой аминокислоты из пищи приводит к развитию отрицательного азотистого баланса, истощению, остановке роста. Дефицит в пище отдельных незаменимых аминокислот вызывает нарушение синтеза белка с последующими клиническими симптомами. Например, дефицит триптофана вызывает развитие катаракты, выпадение волос, поражение зубов, снижение массы тела. Триптофан является предшественником в биосинтезе таких физиологически активных соединений, гормонального и медиаторного действия, как серотонин и никотиновая кислота. Дефицит лизина вызывает повышенную восприимчивость к шуму, тошноту, головокружение. Отсутствие лейцина у молодых людей сопровождается головными болями, потерей аппетита, быстрой утомляемостью, психической подавленностью. При нарушении метаболизма лейцина, изолейцина и валина развивается болезнь «кленового сиропа» (замедление роста, нарушение питания, сонливость, неврологические состояния). Важным участником внутриклеточного метаболизма и донором метильной (─CH3) группы в многочисленных реакциях метилирования является метионин. Аргинин принимает участие в образовании мочевины – конечного продукта аминобмена. Кроме того, установлена роль аргинина как предшественника в генерации оксида азота (NO) – модулятора таких физиологических функций: регуляции тонуса гладких мышц, иммунных процессов и нейротрансмиссии. Фенилаланин и тирозин обеспечивают образование главных катехоламинов организма (дофамина, норадреналина, адреналина), тиреоидных гормонов и меланинов. Нарушение обмена этих аминокислот приводит к ряду заболеваний: фенилкетонурии, алкаптонурии, альбинизму, тирозинемии. Аминокислота гистидин путем декарбоксилирования превращается в гистамин – важнейший медиатор аллергии, а также физиологический регулятор деятельности различных клеток и систем, включая иммунокомпетентную систему.
Аминокислоты, поступающие в организм с пищей, образующиеся при катаболизме белков и в результате синтеза, формируют аминокислотный пул организма — источник аминокислот для образования различных веществ (рис.1).
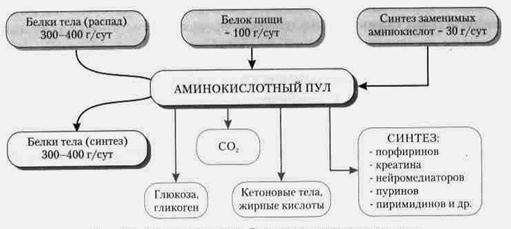
Рис.1. Пути превращения аминокислот
Обмен аминокислот в тканях можно условно разделить на общие и специфические пути превращения. К общим путям обмена аминокислот относятся:
дезаминирование;
трансаминирование;
декарбоксилирование.
Дезаминирование - процесс отщепления аминогруппы в виде аммиака с образованием а-кетокислоты.
Трансаминирование — процесс переноса аминогруппы аминокислоты на кетокислоту без промежуточного образования аммиака. Процесс трансаминирования имеет большое значение для синтеза заменимых аминокислот в организме животных и человека. Через а-кетоглутарат аммиак используется для синтеза заменимых аминокислот, этим же путем аминогруппа переносится на аминосахара, порфирины, креатин.
Нарушение процессов трансаминирования может быть следствием изменения соотношения продуктов реакции (избыток аминокислот в организме), нарушений в процессах окисления в цикле трикарбоновых кислот или синтеза трансаминаз.
Кроме приведенных 20 аминокислот (пролин – иминокислота), участвующих в построении молекул белков, в тканях живых организмов имеются и другие аминокислоты, важные промежуточные продукты обмена веществ (орнитин, цистатионин и др.).
Белки. Если от двух молекул аминокислот отнять одну молекулу воды, то образуются неполные ангидриды, которые называются дипептидами. Они имеют пептидную связь ─NH─C(O)─. Дипептид обладает способностью взаимодействовать с новой молекулой аминокислоты с образованием нового неполного ангидрида – трипептида. Таким же способом могут быть получены тетрапептиды, пентапептиды и т.д., носящие общее название полипептидов. Последние играют очень важную роль в построении молекул белков.
В макромолекулу белка входит одна или несколько пептидных цепей, связанных друг с другом поперечными химическими связями, чаще всего через серу (дисульфидные мостики, образуемые остатками цистеина). Химическую структуру пептидных цепей принято называть первичной структурой белка или секвенцией.
Для построения пространственной структуры белка пептидные цепи должны принять определенную, свойственную данному белку конфигурацию, которая закрепляется водородными связями, возникающими между пептидными группировками отдельных участков молекулярной цепи. По мере образования водородных связей пептидные цепи закручиваются в спирали (α-спираль), стремясь к образованию максимального числа водородных связей и соответственно к энергетически наиболее выгодной конфигурации.
В зависимости от образования определенной пространственной структуры (конформации) различают вторичную, третичную, четвертичную и доменную организацию белков (рис.2).
Вторичная структура белков – это ряд конформаций, образуемых водородными связями. Различают два основных типа упорядоченной вторичной структуры белковых молекул: правозакрученная α-спираль и β- структура. Последняя представляет собой слоистую молекулу, состоящую из зигзагообразных развернутых полипептидных цепей, расположенных рядом и соединенных водородными связями. Многие белки имеют оба типа вторичной структуры.
Третичная структура белков образуется путем укладки в трехмерном пространстве полипептидной цепи с определенной вторичной структурой. В образовании и стабилизации третичной структуры принимают участие водородные, ионные и гидрофобные связи. В зависимости от формы и особенностей трехмерной пространственной структуры, все белки делятся на два класса: глобулярные и фибриллярные. Глобулярные белки (ферменты, антитела, некоторые гормоны и др.) имеют округлую форму, а фибриллярные (коллаген, эластин, α-кератин и др.) – вытянутую.
Четвертичная структура белков (гемоглобин и др.) – результат объединения (агрегации) нескольких полипептидных цепей или протомеров, каждый из которых имеет свою типичную конформацию. Отдельные протомеры (субъединицы) в таких белках соединяются нековалентными связями, что приводит к их диссоциации и потере биологической активности при изменении условий среды.
Рис.2. Уровни структурной организации белков: а) - первичная структура - линейная последовательность аминокислот (образование полипептидов); б) — вторичная структура - образование спирали из полипептидной цепи или β-структуры; в) - третичная структура - образование глобулы из полипептидной спирали и β-структуры; г) - четвертичная структура - образование белкового комплекса, состоящего из нескольких полипептидных глобул
Доменная организация белков (р-53, фосфоглицераткиназа и др.) представляет собой глобулярные участки (100 – 150 аминокислотных остатков), расположенные в середине молекулы с третичной структурой. Отдельные домены – это относительно функциональные автономные образования в составе белковых молекул, связанные между собой пептидными фрагментами («шарнирными» участками), которые можно расщепить только при помощи протеолитических ферментов.
Процесс сворачивания пептидной цепи в пространственную структуру и достижение белком правильной конфигурации называется фолдингом. Для небольших белков характерно самопроизвольное образование третичной структуры, а для фолдинга крупных белков необходимы специальные вспомогательные белки – шапероны и ферменты - фолдазы. Фолдинг с участием фолдаз и шаперонов обычно приводит полипептидную цепь к «правильной», наиболее оптимальной в энергетическом и функциональном отношениях, структуре.
Однако бывают случаи «неправильного» фолдинга. Существует группа тяжелых неврологических болезней, которые обусловлены закономерно повторяющимся «неправильным» фолдингом одного, вполне определенного белка. Данный белок, если он находится в нормальной конформации, называется прион - протеином. Он кодируется геном, расположенным у человека в 20-й хромосоме. Белок входит в состав наружных клеточных мембран и участвует в эндоцитозе и катаболизме клеток. Его могут синтезировать многие клетки организма, но самый высокий уровень концентрации этого белка выявлен в нейронах. Роль нормального прион-протеина у здоровых индивидуумов еще до конца не установлена, но известно, что он поддерживает «циркадианные» ритмы, то есть околосуточные ритмы активности и покоя в клетках, тканях органах и в организме в целом.
К настоящему времени установлено 18 различных мутаций человеческого гена прион – протеина, которые связаны с различными прионовыми болезнями. В результате мутаций этого гена образуется белок с другой конформацией. Он имеет участки с β-структурой, почти отсутствующие в нативной форме, и повышенную склонность к агрегации. В данной форме он, видимо, не способен выполнять свои обычные функции и вызывает заболевание – прионовые энцефалопатии. Прионовые болезни уникальны с генетической и инфекционной точки зрения, т.е. они являются одновременно и наследственными (аутосомно–доминантный тип наследования), и инфекционными (трансмиссия инфекционного агента алиментарным или ятрогенным путем). При попадании инфекционного прионного белка в здоровый организм, его молекулы соединяются с молекулами клеточного (нормального) прион-протеина, в котором происходят конформационные изменения: две из четырех спирально завитых структур вытягиваются, и молекула такого белка становится инфекционной, т.е. происходит как бы фолдинг наоборот. Более того, процесс является автокаталитическим: вновь образовавшиеся порции «испорченного» белка начинают «портить» очередные порции нативного белка до тех пор, пока весь белок не оказывается «испорчен».
Таким образом, в отличие от всех известных инфекционных агентов, инфекционный прионный белок не синтезируется заново, а накапливается исключительно за счет превращения нормального клеточного белка в инфекционный. Процесс происходит относительно медленно – болезнь развивается в течение нескольких лет, но неотвратимо приводит к гибели животного или человека.
У коров инфекционные прионы вызывают губчатую энцефалопатию или коровье бешенство. Употребление человеком мяса таких коров вызывает новый вариант болезни Крейцфельда-Якоба (инкубационный период более 10 лет). При развитии клинических проявлений (нарушения психики, чувствительной и двигательной сферы) нет ни признаков воспаления, ни биологических аномалий в крови, ни тестов неинвазивных, ни прямых, ни косвенных, позволяющих уверенно поставить диагноз. Это заболевание опасно тем, что оно может передаться от заболевшей матери ребенку, вызвав всплеск преждевременных смертей в следующем поколении людей.
Начиная с 1995 года, в течение 5 лет от этой болезни умерло 86 человек. К прионовым болезням относятся также куру, которая поражает туземцев Новой Гвинеи, и скрепи (почесуха) овец.
Таким образом, как видим, фолдинг – очень важный этап в формировании белков.
Функции белков.Белки являются наиболее распространенными из всех классов биомолекул; они входят в состав всех клеточных компонентов микроорганизмов, растений, животных (ядра, биомембран, цитоплазмы) и межклеточных структур. Белковый состав живых клеток усложняется пропорционально степени сложности генома и этапов эволюционного развития организма.
Белковые молекулы - важнейшие нутриенты. Взрослый человек должен получать ежесуточно 100-120 г белка (при энергозатратах 12 000 кДж). Потребность в белке возрастает при физической нагрузке, беременности, лактации. При беременности (2 и 1 триместры) дополнительно требуется 6 г белка в сутки, во время лактации прием белка должен увеличиваться на 15 г.
При сбалансированном питании не менее 5% энергетических затрат должно покрываться за счет белков (оптимальным уровнем считается 18%).
Одним из путей превращения компонентов аминокислотного пула организма является синтез белков плазмы крови, принимающих участие в поддержании рН крови, определении вязкости, коллоидно-осмотического давления, в транспорте гормонов, липидов, жирных кислот, пигментов, жирорастворимых витаминов, поддержании уровня катионов крови, в свертывании крови, иммунных и других процессах.
Плазма содержит свыше 300 белков, но только незначительное их число определяется в повседневной клинической практике. Большинство белков плазмы — гликопротеины, количество углеводов в их составе варьирует от 1% до 40%. Исследования белков плазмы, кроме специфической нозологической информации, дают определенное представление о состоянии белкового обмена в целом. Основная масса белков плазмы синтезируется в печени. Гепатоциты участвуют в синтезе 95% альбуминов, в синтезе фибриногена, a- и b-глобулинов. компонентов свертывающей системы. Большая часть b- и y-глобулинов синтезируется в клетках иммунной системы.
Одно из центральных мест в диагностике патологических состояний организма человека занимают исследования белкового спектра, активности ферментов крови и других биологических жидкостей.
В соответствии с биологическими функциями можно выделить белки – переносчики, сигнальные, защитные, структурные, рецепторные, регуляторные, ферменты и др.
Ферментативная (каталитическая) функция. Все ферменты (биокатализаторы) по своей химической природе являются белками или комплексами белков с низкомолекулярными небелковыми соединениями (коферментами, кофакторами).
Ферменты (Ф) — протеины, содержащие хиральные распознающие участки для специфических субстратов, и, в силу этого, являющиеся высокоэффективными биокатализаторами, ускоряющими химические реакции в 10ю—1016 раз. Слово «фермент» — производное от латинского fermentum, т. е. «закваска», а часто употребляемый синоним «энзим» произошел от греческого «эн зюме», что означает «в дрожжах».
Энзимы могут быть однокомпонентными (простые белки), двухкомпонентными и многокомпонентными; большинство из них - глобулярные белки.
В составе Ф есть активный центр — особый участок в молекуле белка, с которым связывается субстрат с образованием фермент - субстратного комплекса (Ф—С). В полипептидной последовательности аминокислотные остатки, составляющие активный центр, могут находиться далеко друг от друга, однако благодаря специфичной для каждой белковой молекулы упаковке, эти фрагменты пространственно сближены. Формирование комплекса Ф-С осуществляется, как правило, без ковалентного связывания, за счет водородных связей, ион-дипольного, диполь-дипольного или ван-дер-ваальсового взаимодействия.
Во многих случаях в непосредственной близости к активному центру Ф находится небелковый компонент. Последний получил название кофермента (коэнзима) или кофактора, а белковая часть—апо-фермента (ароЕ). В качестве коферментов могут выступать как органические молекулы (главным образом витамины или их производные), так и ионы Са2+, Zn2+, Mn2+, Se2+, Cu2f, Fe2+ и др. В ряде случаев кофакторы образуют с Ф прочные связи. При этом небелковую часть Ф принято называть простетической группой.
В настоящее время зарегистрировано около 106 Ф, у млекопитающих их примерно 2400. Ф классифицируются не как индивидуальные химические соединения, а по типу катализируемых ими реакций. Выделяют шесть классов Ф, каждый из которых подразделяется на подклассы и более мелкие группы.
Оксидоредуктазы - окислительно-восстановительные Ф. Их систематическое название складывается из названия восстановителя (электронодонора), окислителя (электроно-акцептора) и названия класса. Например, Ф, катализирующий окисление этанола до ацетальдегида при участии NAD+ , носит название — алкоголь: NАD+-оксидоредуктаза или алкогольдегидрогеназа.
Известно более 200 биохимических реакций окисления спиртовых групп до карбонильных и несколько десятков превращений карбонильных групп в карбоксильные, протекающих при участии никотинамидных коферментов. Большинство из этих процессов обратимы. Однако, как правило, биологически значимым является только одно направление. Чрезвычайно важная роль в защите организма на молекулярном и клеточном уровнях от повреждающего действия сильного окислителя — радикала Н02- принадлежит супероксиддисмутазе. Этот Ф является металлопротеидом и может содержать в качестве кофактора ионы Zn2+, Mn2+, Cu2+, Fe2+.
Трансферазы. Катализируют перенос различных групп с одной молекулы на другую. Такого рода превращения играют чрезвычайно важную роль в синтезе пиримидиновых и пуриновых оснований. В качестве коферментов, переносящих одноуглеродные фрагменты, в этих реакциях выступают тетрагидрофолат и S-аденозилметионин. Последний является главным метилирующим агентом в клетках и участвует в десятках реакций, катализируемых метилтрансферазами. Энзимы, катализирующие перенос альдегидных и кетогрупп представлены транскетолазой и трансальдолазой, участвующие в синтезе моно- и полисахаридов.
Ацетилтрансферазы катализируют такие важные биохимические процессы как перенос ацильных остатков. Гликозилтрансферазы катализируют перенос гликозильных остатков. Эти Ф играют ведущую роль в синтезе и первом этапе деструкции полисахаридов.
Очень важной группой Ф являются аминотрансферазы. Они катализируют реакции образования и деградации аминокислот.
Гидролазы. Катализируют процессы гидролитического расщепления различных связей. Ф, гидролизующие внутренние пептидные связи в белках, называют протеазами, а катализирующие отщепление N-концевой аминокислоты — аминопептидазами, отщепление С-концевой аминокислоты — карбоксипептидазами, гидролиз нуклеиновых кислот — нуклеазами. Значительная часть гидролаз представлена пищеварительными ферментами (амилазы, липазы, фосфолипазы, пепсин и т. п.), с помощью которых поступающие с пищей полисахариды, жиры и протеины расщепляются соответственно до моносахаридов, глицерина и жирных кислот, пептидов и аминокислот. Последующая реутилизация образовавшихся мономеров в ходе анаболических процессов, протекающих согласно наследственным программам, приводит к построению новых биополимеров, присущих данному организму.
Кроме утилизирующей роли следует подчеркнуть и такую функцию протеаз, как процессинг белков и РНК. Процессингом называют образование «зрелых» молекул белков из их синтетических предшественников. Многие протеины, которые реализуют свою активность вне пределов синтезирующей их клетки (некоторые Ф, гормоны, иммуноглобулины), секретируются этими клетками в виде пробелков. Предшественники Ф носят название зимогенов. Последние имеют на N-конце первичной полипептидной цепи специальную сигнальную последовательность, состоящую из 15—20 аминокислотных остатков. После отщепления этой сигнальной последовательности с помощью мембранных протеаз белок активируется не сразу, а по достижении им определенной мишени.
Системы протеаз обеспечивают течение таких важных физиологических процессов, как свертывание крови, регуляция АД, расщепление чужеродных антигенов после их связывания с антителом и др. Нарушение нормального функционирования какого-либо из перечисленных процессов влечет за собой развитие серьезных патологических состояний. В этой связи многие протеазы являются мишенями для биологически активных веществ.
Лиазы. Они катализируют процессы негидролитического расщепления субстрата с образованием кратной связи (реже цикла), либо присоединения по такой связи. Декарбоксилазы катализируют отщепление С02 от карбоновых кислот. Например, образующаяся при спиртовом брожении глюкозы пировиноградная кислота декарбоксилируется под действием пируват декарбоксилазы с образованием уксусного альдегида.
Ферментативным путем происходит декарбоксилирование ряда аминокислот с образованием важных нейромедиаторов. Так, L-глутаминовая кислота под действием глутамат декарбоксилазы превращается в ГАМК. Другой Ф этой же группы — декарбоксилаза ароматических аминокислот — катализирует декарбоксилирование l-(3,4-диоксифенил) - аланина (L-ДОФА), превращая последний в норадреналин.
Изомеразы. Катализируют процессы изомеризации, с помощью которых происходит обращение конфигурации при асимметрическом атоме углерода. Энзим катализирует обращение конфигурации в обоих направлениях, что приводит к образованию рацемической смеси. Такие Ф получили название рацемаз.
При наличии в молекуле нескольких хиральных центров обращение конфигурации при одном из них приводит к образованию диастереомерной пары. Ф, катализирующие такие процессы, называют эпимеразами. Они играют важную роль во взаимопревращениях углеводов.
Следует отметить, что не все биохимические процессы, завершающиеся изомеризацией какого-либо субстрата, катализируют Ф этого класса. Например, превращение лимонной кислоты в изолимонную осуществляется при участии лиазы.
Лигазы (синтетазы). Катализируют реакции конденсации или присоединения, сопряженные с пиролизом одной из пирофосфатных связей в молекуле АТФ или ГТФ.
Ряд лиаз катализируют реакцию конденсации аминокислоты с ОН-группой З'-концевого аденозина в транспортной РНК (тРНК). В результате таких реакций, происходящих с каждой из входящих в состав белков 20 аминокислот, последние оказываются распределенными в строгом соответствии с тРНК. Это имеет решающее значение при сборке белковых молекул на рибосомах, где распознавание осуществляется не по аминокислотным остаткам, а по связанным с ними тРНК.
Принципы действия ферментов.В качестве модели Ф-С взаимодействия более 60 лет просуществовала аналогия «замок — ключ», предложенная в конце XIX в. Fisher. Суть ее в том, что к Ф (замку) подходит лишь свой субстрат (ключ). В 1959 г. Koshland была высказана гипотеза «индуцированного соответствия». Согласно этой общепризнанной в настоящее время модели связывание Ф с соответствующим ему субстратом индуцирует в белке небольшие конформационные изменения. В результате каталитические группы Ф ориентируются таким образом, что становится возможным превращение субстрата в продукт. Модель индуцированного соответствия допускает также некоторую конформационную перестройку в молекуле субстрата, которая получила название напряжения. Гипотеза о возникновении конформационных изменений в Ф и субстрате при их связывании позволяет объяснить тот факт, что молекулы, очень близкие по строению к истинному субстрату, могут связываться с Ф, но при этом не превращаются в продукт, т. е. действуют как ингибиторы.
Скорость (1010–1016) ферментативной реакции зависит от природы реагирующих веществ (субстрата и Ф), их концентраций, температуры (увеличивается до определенного предела, пока не начинается денатурация белка), концентрации коферментов, рН, а также от концентрации активаторов и ингибиторов ферментов.
Структурная функция. Белки входят в структуру биомембран, являются основой цитоскелета (микротрабекулярная сетка, микрофилламенты), межклеточного матрикса (коллаген, эластин) и определенных специализированных тканей (кератины).
Коллаген, наиболее распространенный белок млекопитающих, образует основу сухожилий, костей, кожи, зубов и хрящей. Структурной единицей коллагенового волокна является тропоколлагеновая молекула, состоящая из трех полипептидных цепей, каждая из которых содержит около 1000 аминокислотных остатков. В зависимости от функции коллагена его полипептидные цепи либо идентичны, либо имеют довольно близкие последовательности.
Аминокислотный состав коллагена необычен. Во-первых, примерно одну треть всех остатков составляют остатки глицина, и, во-вторых, имеется большое число остатков пролина. Кроме того, в коллагене встречаются остатки двух аминокислот, обычно не обнаруживаемых в белках,- гидроксипролина и гидроксилизина. Боковые цепи этих аминокислот содержат гидроксильную (ОН) группу, присоединенную к одному из углеродных атомов вместо атома водорода. Гидроксилирование осуществляется специфическими ферментами после включения пролина или лизина в полипептидную цепь коллагена.
Кератин - важный белковый компонент волос, шерсти, ногтей, когтей и перьев. В одной из форм, называемой ос-кератином, в основе структуры полипептидной цепи лежит правая а-спираль. В кератине две, а возможно и три цепи закручиваются одна вокруг другой, образуя некую витую (coiled-coil) структуру, называемую протофибриллой. 11 протофибрилл формируют микрофибриллу, а пучок микрофибрилл - кератиновое волокно. а-Кератины легкорастяжимы, поскольку при вытягивании разрываются водородные связи и полипептидные цепи приобретают β-структурную конформацию. При этом образуются межцепочечные водородные связи и формируются β-слои. Кератины с такой структурой называются β-кератинами.
Регуляторные белки. Во всех клетках экспрессия генов контролируется регуляторными белками, которые связываются с определенным участком ДНК и таким образом стимулируют или подавляют транскрипцию гена. Действие регуляторных белков обратимо и, как правило, требует присутствия лиганда. Постоянно открывают все новые и новые регуляторные белки, в настоящее время известна, вероятно, только малая их часть. Регуляторный белок, который влияет на транскрипцию генов, называют фактором транскрипции. Белок, подавляющий транскрипцию, называют репрессором, а стимулирующий — индуктором образования.
Регуляторные белки, чаще называемые гормонами, участвуют в различных физиологических процессах. Например, гормон инсулин состоит из двух a-цепей, соединенных дисульфидными мостиками. Инсулин регулирует обменные процессы с участием глюкозы, его отсутствие ведет к диабету.
В гипофизе мозга синтезируется гормон, регулирующий рост организма. Существуют регуляторные белки, контролирующие биосинтез различных ферментов в организме. Белковую и пептидную природу имеют многочисленные биорегуляторы – гормоны, медиаторы и модуляторы, которые вырабатываются в эндокринной системе, нейронах головного мозга, иммунной системе: простые белки (инсулин, глюкагон и т. д.), гликопротеины (тропные гормоны гипофиза и др.), низкомолекулярные пептиды (окситоцин, вазопрессин, опиоидные пептиды мозга, пептиди тимоцитов и т. д.).
Биорегуляторы - естественные регуляторы жизненно важных функций человеческого организма. Эта обширная группа биологически активных веществ, которая контролирует сердечную деятельность, дыхание, тонус мышц и сосудов, пищеварение, иммунитет, а также высшую психическую деятельность - эмоции, мышление, память. Биорегуляторы еще часто называют «гормональным» или «биохимическим» оружием.
Четкого определения термина «биорегулятор», как и классификации, на сегодняшний день не существует. Слишком многочисленна и разнообразна эта группа веществ. К биорегуляторам относят гормоны, цитокинины, простагландины, лейкотриены, медиаторы, ферменты и многие другие вещества. Наиболее общим признаком для всех этих соединений является высокая биологическая активность в сверхмалых дозах -1x10-15 и даже 1x10-18 молей.
Рецепторная функция. Белковую природу имеют мембранные рецепторы для физиологически активных соединений, которые принимают химический сигнал от гормонов, нейромедиаторов (адренорецепторы, холинорецепторы, гистаминовые рецепторы и др.), биологически активных веществ (БАВ) и др. Для врача и фармацевта очень важно знать принцип взаимодействия ЛЕКАРСТВО-РЕЦЕПТОР.
Клетки, как правило, содержат большое количество различных мембранных, цитоплазматических и ядерных рецепторов БАВ: ионные каналы, ферменты, нейромедиаторы, транспортные системы и гены. Они необходимы организму для нормального функционирования и адекватного реагирования на изменения внешней и внутренней среды и, в конечном счете, для поддержания гомеостаза. Наличие у живых существ органов, воспринимающих внешние сигналы, было отмечено учеными еще в глубокой древности. Однако понимание роли рецепторов как внутренней системы «органов чувств», позволяющей организмам адаптироваться к окружающей среде, стало складываться только в середине XIX в. Основоположником рецепторной теории действия лекарств следует признать P. Ehrlich (1907 г.). Он же впервые ввел термин «рецептор» и сформулировал основной постулат: «corpora non agun nisi fixata» — «вещества не действуют, если не фиксируются». Это обобщение стало теоретической базой химиотерапии. P. Ehrlich предполагал, что клетки содержат так называемые боковые ветви, или рецепторы, в результате селективного взаимодействия с которыми ЛВ индуцируют свой эффект. Согласно этой теории, лекарство имеет два структурных фрагмента, один из которых, соединяясь с рецептором, позволяет тем самым другому фрагменту осуществлять биологический ответ. Многочисленные исследования подтвердили правильность теории P. Ehrlich о рецепторах как участках тканей, селективно связывающих ЛВ и опосредующих реализацию их фармакологических эффектов.
В обобщенном виде понятие «рецептор» можно сформулировать следующим образом: рецептором может быть любая высокомолекулярная конформационно подвижная биоструктура, специфически связывающая химическое соединение (лиганд, лекарство) на поверхности или внутри клетки и трансформирующая полученную информацию в биологический ответ. К таким макромолекулам относятся белки и нуклеиновые кислоты. Специфическое взаимодействие лиганда с рецептором следует отличать от неспецифического связывания эндогенных или экзогенных БАВ с белками плазмы крови или мукополисахаридами соединительной ткани. Белковые структуры такого типа получили название «молчащих» рецепторов. В результате связывания с ними не реализуются никакие эффекты. Плазменные белки количественно, а не качественно влияют на проявление эффектов ЛВ.
К началу 90-х гг. было выявлено более 30 групп различных рецепторов. В последнее десятилетие, благодаря расшифровке генома человека, этот список значительно расширился и продолжает пополняться.
Во всем многообразии рецепторов выделяют 4 следующих типа:
· рецепторы, осуществляющие контроль за функцией ионных каналов (н-холинорецепторы, GАВАА-рецепторы, глутаматные рецепторы);
· рецепторы, сопряженные с эффектором через систему G-протеины — вторичные посредники или G-протеины — ионные каналы (рецепторы некоторых белковых гормонов и пептидов — ангиотензина, брадикинина, эндотелина и др.; биогенных аминов — адреналина, дофамина, гистамина, серотонина; липидов — канабиноидов, простагландинов, лейкотриенов, тромбоксанов; нуклеозидов и нуклеотидов — аденозина, АТФ, АДФ и др., а также ионов Са2+);
· рецепторы, осуществляющие прямой контроль за функцией эффекторного фермента (они непосредственно связаны с тирозинкиназой и регулируют фосфорилирование белков — рецепторы инсулина и гормонов роста);
· рецепторы, контролирующие транскрипцию ДНК — растворимые цитозольные или ядерные белки (рецепторы стероидных и тиреоидных гормонов).
Первые три типа рецепторов принадлежат к числу мембранных, а последний — к ядерным. Большинство рецепторов представляют собой белки, точнее липо- или гликопротеины, которые располагаются на цитоплазматической мембране или мембранах органелл клетки. Они могут пронизывать всю толщу мембраны или находиться с ее внутренней стороны. Если лиганды рецептора представляют собой гидрофильные молекулы, например, нейромедиаторы, то связывающие участки рецептора должны обязательно находиться с внешней стороны клетки. Рецепторы гидрофобных молекул слабо связаны с мембранами, и образующиеся комплексы с лигандами могут выходить из мембраны в цитоплазму.
В процессе эволюции образовались также рецепторы, локализованные внутри клеток. Их лиганды, например, стероидные или тиреоидные гормоны, обладают способностью за счет своих гидрофобных свойств проникать через мембраны путем пассивной диффузии или активного транспорта. Структура и функции внутренних рецепторов менее изучены, чем мембранных, поскольку первые труднее выделить, не изменив при этом их первоначальной структуры. Известно присутствие рецепторов различных лигандов па рибосомах (к антибиотикам), в ядре (к стероидным и тиреоидным гормонам, тиазолидиндионам, жирным эссенциальным кислотам, фибратам), в комплексе Гольджи (к гормонам), в микросомах (к гормонам). Биологический смысл такой внутриклеточной рецепции заключается в более глубоком и продолжительном изменении функций клетки в ответ на получение внешнего сигнала.
Белковые цепи и домены, образующие рецептор, имеют определенную организацию. Установлено, что в механизме, обеспечивающем закрытие ионного канала, ведущая роль принадлежит н-ацетилхолинорецептору, состоящему из пяти белковых субъединиц, каждая из которых имеет четыре трансмембранных домена. Последние образованы пронизывающими всю мембрану гидрофобными a-спиралями. Один из доменов — М2, выстилающий канал с внутренней стороны, гидрофилен. В нем преобладают ориентированные особым образом анионсодержащие фрагменты аминокислот, что обеспечивает распознавание катионов. При взаимодействии лиганда с таким рецептором, за счет изменений в трансмембранном домене М2, происходит конформационная перестройка белков, образующих стенки канала, и закрытие его просвета.
Представление о строении рецепторов, передача сигналов от котoрых осуществляется с участием G-протеинов, можно составить по (рис.3) из которого видно, что единственная полипептидная цепь имеет семь трансмембранных а-спиралей, а находящаяся вне мембраны цепь с терминальной NН2-группой, гликозилирована. Петли, выходящие в цитоплазму клетки, различаются по количеству аминокислотных остатков. Первая состоит из 10—20 аминокислот, вторая содержит до 20 и третья — до 50 аминокислотных остатков. На третьей петле расположены участки связывания с G-протеинами. Оканчивается G-сопряженный рецептор цепью из 100 аминокислот и содержит концевую карбоксильную группу, которая также обеспечивает связывание с G-белками. Сведения о пространственном строении рецепторов этого типа стали доступны лишь недавно. Благодаря рентгено-структурному исследованию (РСИ) бычьего родопсина была впервые предложена трехмерная (3D) модель рецептора, сопряженного с G-белками.
Рис.3. Схематическое изображение рецептора, связанного с G-белками: G — домены, обеспечивающие связывание с G-протеинами
В настоящее время в результате расшифровки генома человека выявлено несколько сотен рецепторов, сопряженных с G-белками. Из них только 30 являются мишенями широко распространенных ЛВ, а для 210 — идентифицированы лишь эндогенные лиганды. К этим группам принадлежат рецепторы пептидов, биогенных аминов, нуклеозидов и лейкотриенов. Примерно 160 рецепторов, выявленных в человеческом геноме, относят к так называемым «рецепторам-сиротам», т. к. их лиганды и физиологические функции пока не установлены.
Обособленную группу образует семейство рецепторов, в передаче сигналов от которых участвует тирозинкиназа. К их числу принадлежат инсулиновые рецепторы и рецепторы факторов роста. Тирозиновый домен находится внутри клетки. Экстрацеллюлярная часть содержит области, богатые цистеиновыми остатками, которые, вероятно, и обеспечивают вторичную структуру, необходимую для мест связывания лигандов.
Характерной особенностью внутриклеточных рецепторов стероидных гормонов является наличие домена, способного связывать полипептидные цепи с лигандом за счет Zn-пальцев: цистеиновые остатки окружают атомы Zn и обеспечивают связь с ДНК.
Взаимодействие лигандов с рецепторами осуществляется благодаря образованию либо водородных и координационных связей, либо комплексов с переносом заряда, ион-ионного, ион-дипольного или дисперсионного взаимодействия.
Транспортная функция. Белки связывают и осуществляют межклеточный и внутриклеточный (трансмембранный цитоплазматический) транспорт разных лигандов – биомолекул, ионов металлов, чужеродных химических соединений (ксенобиотиков). Транспортными белками крови являются сывороточные альбумины (переносят жирные кислоты, билирубин, лекарственные и токсические соединения), гемоглобин эритроцитов (транспортирует кислород), липопротеины (транспортируют липиды), трансферин (транспортирует железо).

Рис.4. Гемоглобин (тетрамер) с гемом в центре
Гемоглобин- это белок, переносящий кислород от легких к тканям и осуществляющий транспорт углекислого газа от тканей обратно к легким. Гемоглобин локализован в красных кровяных клетках-эритроцитах. Молекула гемоглобина состоит из четырех полипептидных цепей- двух идентичных α-цепей (обозначаемых α1 и α2) и двух идентичных β-цепей (обозначаемых β1 и β2). Каждая цепь связана с особой группой- гемом (рис.4).
Миоглобин- это белок, переносящий кислород в мышечных клетках. Он состоит из одной полипептидной цепи и имеет один гем.
Третичная структура α- и β-цепей гемоглобина и цепи миоглобина оказалась сходной. Гем состоит из атомов углерода, азота и водорода, образующих плоское кольцо, называемое порфирином. В центре этого кольца находится атом железа, связанный с атомами кольца четырьмя из шести своих возможных координационных связей.
Дезоксигемоглобин- это гемоглобин, не связанный с кислородом. В дезоксигемоглобине атом железа находится вне плоскости порфиринового кольца и, кроме того, имеется несколько солевых мостиков, и водородных связей, которых нет в оксигенированной форме белка.
Оксигемоглобин-это гемоглобин, связанный с кислородом. Кислород занимает шестое координационное положение атома железа гема и располагается рядом с дальним остатком гистидина. При связывании кислорода атом железа перемещается в плоскость порфиринового кольца. Одновременно с этим происходят и некоторые другие конформационные изменения.
Гемоглобин плода человека (фетальный гемоглобин) отличается от гемоглобина взрослых тем, что в нем две β-цепи заменены двумя γ-цепями. Гемоглобин плода связывает ДФГ менее сильно, чем дезоксигемоглобин взрослых, и поэтому имеет более высокое сродство к кислороду. В результате, когда кровь плода обогащается кислородом за счет материнской крови, что имеет место в плаценте, кислород переходит от матери к плоду с высокой эффективностью.
Серповидноклеточная анемия- заболевание, возникающее при замене остатка глутаминовой кислоты в шестом положении β-цепи гемоглобина на остаток валина. Это единственное изменение приводит к уменьшению растворимости дезоксигемоглобина и к появлению у него способности агрегировать с образованием длинных волокон. В результате эритроциты приобретают вытянутую форму, напоминающую серп. Деформированные таким образом, они могут закупоривать капилляры, нарушая нормальное кровообращение, либо легко подвергаться лизису, что и является непосредственной причиной наблюдаемой анемии.
 |
Рис.5. Схематическое строение белка миозина
Сократительная функция. Белки являются молекулярными структурами, которые реализуют сократительную функция мышц (актин, миозин), жгутиков и ресничек (тубулины, динеины). Сократительные и двигательные белки придают организму способность сокращаться, изменять форму и перемещаться, прежде всего, речь идет о мышцах. 40% от массы всех белков, содержащихся в мышцах, составляет миозин (mys, myos, греч. – мышца). Его молекула содержит одновременно фибриллярную и глобулярную часть (рис.5).
Такие молекулы объединяются в крупные агрегаты, содержащие 300–400 молекул. При изменении концентрации ионов кальция в пространстве, окружающем мышечные волокна, происходит обратимое изменение конформации молекул – изменение формы цепи за счет поворота отдельных фрагментов вокруг валентных связей. Это приводит к сокращению и расслаблению мышц, сигнал для изменения концентрации ионов кальция поступает от нервных окончаний в мышечных волокнах. Искусственное сокращение мышц можно вызвать действием электрических импульсов, приводящих к резкому изменению концентрации ионов кальция, на этом основана стимуляция сердечной мышцы для восстановления работы сердца.
Рис.6. Схематическое изображение структуры иммуноглобулина
Защитная функция. Белки выполняют функцию иммунной защиты (иммуноглобулины, лимфокины, интерлейкины), противодействуют кровотечению и тромбообразованию (белки сворачивающейся, антикоагулянтной и фибринолитической систем крови).
Защитные белки позволяют уберечь организм от вторжения атакующих его бактерий, вирусов и от проникновения чужеродных белков (обобщенное название чужеродных тел – антигены). Роль защитных белков выполняют иммуноглобулины (другое их название – антитела), они распознают антигены, проникшие в организм, и прочно связываются с ними. В организме млекопитающих, включая человека, есть пять классов иммуноглобулинов: M, G, A, D и E.
Их структура, как следует из названия, глобулярная, кроме того, все они построены сходным образом. Молекулярная организация антител показана на примере иммуноглобулина класса G (рис.6). Молекула содержит четыре полипептидные цепи, объединенные тремя дисульфидными мостиками S-S (на рис. они показаны с утолщенными валентными связями и крупными символами S), кроме того, каждая полимерная цепь содержит внутрицепные дисульфидные перемычки. Две большие полимерные цепи содержат 400–600 аминокислотных остатков. Две другие цепи почти вдвое короче, они содержат приблизительно 220 аминокислотных остатков. Все четыре цепи расположены таким образом, что концевые H2N-группы направлены в одну сторону.
Молекула состоит из четырех полимерных цепей, соединенных дисульфидными мостиками -S-S-, которые отмечены утолщенными валентными связями и крупными символами S. Области, захватывающие инородный белок – антиген, выделены светло-синим и светло-зеленым цветом. В центральной части молекулы находится шарнирная область, которая обеспечивает независимую подвижность областей захвата. Фрагмент реальной структуры иммуноглобулина показан в нижней части рисунка, справа. Это глобулярная молекула, содержащая b-структуры, соединенные одиночными цепями.
После контакта организма с чужеродным белком (антигеном), клетки иммунной системы начинают вырабатывать иммуноглобулины (антитела), которые накапливаются в сыворотке крови. На первом этапе основную работу совершают участки цепей, содержащие концевые H2N. Это области захвата антигенов. В процессе синтеза иммуноглобулина эти участки формируется таким образом, чтобы их строение и конфигурация максимально соответствовали структуре приблизившегося антигена (как ключ к замку, подобно ферментам, но задачи в данном случае иные). Таким образом, для каждого антигена в качестве иммунного ответа создается строго индивидуальное антитело. Столь «пластично» изменять строение в зависимости от внешних факторов, помимо иммуноглобулинов, не может ни один известный белок. Ферменты решают задачу структурного соответствия реагенту иным путем – с помощью гигантского набора разнообразных ферментов в расчете на все возможные случаи, а иммуноглобулины каждый раз заново перестраивают «рабочий инструмент». Сверх того, шарнирный участок иммуноглобулина обеспечивает двум областям захвата некоторую независимую подвижность, в результате молекула иммуноглобулина может «найти» сразу два наиболее удобных для захвата участка в антигене с тем, чтобы его надежно зафиксировать.
Далее включается цепь последовательных реакций иммунной системы организма, подключаются иммуноглобулины других классов, в результате происходит дезактивация чужеродного белка, а затем уничтожение и удаление антигена (постороннего микроорганизма или токсина).
После контакта с антигеном максимальная концентрация иммуноглобулина достигается (в зависимости от природы антигена и индивидуальных особенностей самого организма) в течение нескольких часов (иногда нескольких дней). Организм сохраняет память о таком контакте, и при повторной атаке таким же антигеном иммуноглобулины накапливаются в сыворотке крови значительно быстрее и в большем количестве – возникает приобретенный иммунитет.
Иммуноглобулин G. Приблизительно 75% иммуноглобулинов плазмы представлены IgG — основным классом антител, продуцируемых при вторичном ответе. IgG лучше, чем другие иммуноглобулины, диффундирует во внесосудистое пространство, а также проходит через плаценту, обеспечивая пассивный иммунитет новорожденным в первые недели жизни. Иммуноглобулины нейтрализуют бактериальные токсины и связываются с микроорганизмами, усиливают фагоцитоз.
Иммуноглобулин A — основной класс антител в секретах, таких, как слеза, слюна, респираторные секреты, мочеполовые и желудочно-кишечные секреты. Иммуноглобулины существуют в виде одиночных иммуноглобулиновых единиц или в виде димеров, связанных секреторной единицей (ММ 60 000) и дополнительной пептидной цепью (J-цепь, ММ 20000). IgA покрывают микроорганизмы и угнетают их способность прикрепляться к поверхности слизистых оболочек.
Иммуноглобулин M — основной класс антител, секретируемых на ранних стадиях первичного иммунного ответа. Эти иммуноглобулины являются полимерами пяти иммуноглобулиновых единиц, объединенных вокруг J-цепи. Они в основном прикреплены к поверхности сосудов и являются эффективными цитолитическими антителами. После рождения уровни IgM прогрессивно растут, так как новорожденные подвергаются антигенному стимулированию. Определение IgM у новорожденных используется как индикатор внутриматочной инфекции.
Иммуноглобулин D определен на поверхности неактивированных В-лимфоцитов, где он, вероятно, выполняет функцию рецепторов для антигенов. Концентрация иммуноглобулинов данного типа в плазме очень низка.
Иммуноглобулин Е представлен антителами, связанными с поверхностью тучных клеток. В плазме IgE присутствуют в незначительных количествах. Связывание антигена приводит к дегрануляции тучных клеток с высвобождением активных аминов (гистамин), повышающих реакции гиперчувствительности.
Приведенная функциональная классификация белков носит в определенной степени условный характер, например белок тромбин, упомянутый среди защитных белков, по существу представляет собой фермент, катализирующий гидролиз пептидных связей, то есть, относится к классу протеаз.
Белки как источники питания. Белки в живом организме постоянно расщепляются на исходные аминокислоты (с непременным участием ферментов), одни аминокислоты переходят в другие, затем белки вновь синтезируются (также с участием ферментов), т.е. организм постоянно обновляется. Некоторые белки (коллаген кожи, волос) не обновляются, организм непрерывно их теряет и взамен синтезирует новые. Белки как источники питания выполняют две основные функции: они поставляют в организм строительный материал для синтеза новых белковых молекул и, кроме того, снабжают организм энергией (источники калорий). Плотоядные млекопитающие (в том числе и человек) получают необходимые белки с растительной и животной пищей. Ни один из полученных с пищей белков не встраивается в организм в неизменном виде. В пищеварительном тракте все поглощенные белки расщепляются до аминокислот, и уже из них строятся белки, необходимые конкретному организму, при этом из 8 незаменимых кислот в организме могут синтезироваться остальные 12, если они не поступают в достаточном количестве с пищей, но незаменимые кислоты должны поступать с пищей непременно. Атомы серы в цистеине организм получает с незаменимой аминокислотой – метионином. Часть белков распадается, выделяя энергию, необходимую для поддержания жизнедеятельности, а содержавшийся в них азот выводится из организма с мочой. Обычно организм человека теряет 25–30 г. белка в сутки, поэтому белковая пища должны постоянно присутствовать в нужном количестве. Минимальная суточная потребность в белке составляет у мужчин 37 г, у женщин 29 г, однако рекомендованные нормы потребления почти вдвое выше. При оценке пищевых продуктов важно учитывать качество белка. При отсутствии или низком содержании незаменимых аминокислот белок считается малоценным, поэтому такие белки должны потребляться в большем количестве. Так, белки бобовых культур содержат мало метионина, а в белках пшеницы и кукурузы низкое содержанием лизина (обе аминокислоты незаменимые). Животные белки (исключая коллагены) относят к полноценным пищевым продуктам. Полный набор всех незаменимых кислот содержит казеин молока, а также приготовляемые из него творог и сыр, поэтому вегетарианская диета, в том случае, если она очень строгая, т.е. «безмолочная», требует усиленного потребления бобовых культур, орехов и грибов для снабжения организма незаменимыми аминокислотами в нужном количестве.
Конец XX и начало XXI столетий ознаменовались величайшими открытиями в области молекулярной биологии и генетики, которые революционым образом изменили наше представление о механизмах кодирования и реализации наследственной информации у эукариот, создали возможности для изучения генов и геномов.
В настоящее время можно говорит о создании нового направления в молекулярной генетике - геномики. К числу открытий геномики относятся расшифровка геномов многих микроорганизмов, ряда многоклеточных, в том числе лабораторных животных (дрозофила, мышь), и, наконец, практически полная расшифровка генома человека. Оказалось, что этот геном содержит значительно меньшее количество генов, чем предполагалось ранее. По предварительным оценкам, в геноме человека от 22000 до 25000 структурных генов. Однако они имеют чрезвычайно сложное строение и механизмы экспрессии. Классическая гипотеза «один ген - один фермент» претерпела существенные изменения: найдены механизмы кодирования нескольких белков одним геном. Общее количество синтезируемых у человека белков в периоде онтогенеза предположительно достигает 250 000. Совокупность белков, синтезируемых организмом в течение жизни, получила название протеом. В настоящее время понятно, что только изучение протеома позволит уточнить функции многих генов и завершит изучение генома человека. Поэтому появилось второе важное направление современной молекулярной биологии - протеомика. Слово «протеом» образовано от слова «протеин» (белок) и окончания слова «геном», так что в самом названии как бы слиты воедино белок и геном (ДНК). Это подчеркивает их теснейшую взаимосвязь. Однако между геномикой и протеомикой, между геномом и протеомом есть одно фундаментальное различие, которое вызывает к жизни совершенно новые методы исследования, новые стратегии.
Протеом - понятие динамическое, тогда как геном стабилен и постоянен, иначе было бы невозможно передать наследственные свойства от поколения к поколению, обеспечить сохранение видов и т.д. Изменчивость генома всегда происходит на фоне его высокой стабильности и ни в коей мере ее не отменяет. Протеом - набор белков данной клетки в данной фазе ее развития в данный момент времени - меньше генома по общему объему информации. В любой клетке человеческого организма никогда не функционируют все 22-25 тыс. генов, работает лишь их часть - иногда меньшая, иногда большая. Хотя точные цифры привести пока трудно, но в обычной специализированной клетке, например клетке печени или легкого, одновременно присутствуют, вероятно, не более 10 тыс. белков, причем в резко различных количествах - от нескольких молекул на клетку до нескольких процентов общего клеточного белка. Набор белков постоянно меняется в зависимости от фазы клеточного деления, тканевой специализации клетки, стадии ее дифференцировки, принадлежности к нормальным или злокачественным клеткам, состояния стресса или покоя, воздействия внеклеточных физиологически активных веществ и так до бесконечности. Поэтому белковый «портрет» клетки зависит от множества факторов и воздействий, подвержен практически непрерывным изменениям, что делает его изучение особенно трудным.
Изменчивость протеома связана не только с тем, что в данный момент времени работает одна часть генов, а в другой момент - иная. Набор белков сильно зависит от процессов, протекающих на пути от ДНК к матричной РНК (мРНК). Здесь большая часть первичных генных продуктов (РНК) подвергается так называемому альтернативному сплайсингу, суть которого состоит в том, что до образования зрелой матричной РНК из нее удаляются разные части молекулы. В результате один ген может породить множество белков, различающихся первичной структурой. Таким образом, стало очевидно, что одна из старых догм биохимии и молекулярной биологии - «Один ген - один фермент» - нуждается в модернизации. Для очень многих случаев справедлива формула: «Один ген - много белков».
Однако и это еще не все. После синтеза белки претерпевают множество химических изменений (модификаций), которые создают их огромное разнообразие, хотя исходно они кодированы одним геном. К числу таких модификаций относятся реакции фосфорилирования, ацетилирования, метилирования, гликозилирования и многие другие. Если учесть, что на большом белке есть множество мест, где эти модификации могут происходить, то легко себе представить, какое практически бесконечное разнообразие форм одной и той же белковой молекулы может возникнуть. Подавляющее большинство модификаций существенно сказывается на биологической активности данной молекулы белка, а также на ее способности взаимодействовать с другими белковыми молекулами. В итоге мы приходим к заключению, что когда в клетке работает, скажем, 10% всех генов, допустим 8 тыс., то количество разных белков может превысить эту величину в 10 раз. Исследователи и раньше догадывались, что такая ситуация возможна, однако только теперь реально представляют ее истинные масштабы. Крайне важным разделом протеомики, безусловно, следует считать изучение белок - белковых и белок - нуклеиновых взаимодействий. В течение жизни клетки практически каждый белок при своем функционировании взаимодействует с множеством макромолекул, а также низкомолекулярных лигандов. В связи с этим, один из руководителей проекта «Геном человека» Дж. Крейг Вентер считает, что для полного определения функций всех генов может потребоваться около ста лет.
Строение, функции и свойства ДНК.
В 1865г. Грегор Мендель открыл гены, а его современник Фридрих Мишер в 1869г.… Трансформация, трансдукция и размножение бактериофагов убедительно доказали генетическую роль ДНК. У РНК - содержащих…Репликация теломерных отделов ДНК.
2) Недорепликация ДНК ведет к старению клетки. ДНК – полимераза только удлиняет 3' конец уже имеющегося полинуклеотида, а… 3) В среднем в 1 молекуле яд-ДНК 120 млн. н.п., значит, укорочение ДНК за одно клеточное деление составит ~ 0,00005%.…Молекулярная организация генов.
Как уже отмечалось, в 1865 г. Г. Мендель открыл гены. В его понимании ген –… В 1934 г. в Нобелевской лекции Т. Морган сказал: «Среди генетиков нет согласия во взглядах на природу генов... Если…РНК и её роль в сохранении и реализации наследственной информации.
Химический состав, атипичные азотистые основания и макромолекулярная… ТРАНСПОРТНАЯ РНК (тРНК) узнает соответствующий кодон в мРНК и переносит нужную аминокислоту к растущей полипептидной…Лекарственные средства, влияющие на синтез нуклеиновых кислот и белков.
Рифамицин В — природный метаболит, выделенный из культуры Streptomyces mediterxanei. Он ингибирует ДНК-зависимую РНК-полимеразу, связываясь с ее… Наибольшее распространение в медицине среди полусинтетических аналогов… Ингибиторами синтеза белка на рибосомах являются аминогликозиды (аминоциклитолы), тетрациклины, макролиды и…Экспрессия генов и её регуляция
Механизмы генной экспрессии. Понятие об экспрессии генов. Современное состояние центральной догмы молекулярной генетики. Свойства генетического… Регуляция экспрессии генов. Регуляция экспрессии генов у прокариотов.…Регуляция экспрессии генов.
· на уровне транскрипции (контролируется время и характер транскрипции гена) · на уровне процессинга первичного транскрипта · при отборе зрелых мРНК для их транспорта в цитоплазмуКонтроль на уровне трансляции и посттрансляционных процессов.
Регуляция основана на том, что многие белки синтезируются в неактивной форме и должны еще пройти стадию модификации. Так, в ß-клетках… Роль пептидов вилона и эпиталона в генной экспрессии. Изучение… Так, при изучении действия пептидов вилона и эпиталона установлено, что они меняют профиль генной экспрессии в…Организация геномов неклеточных и клеточных организмов
Геномика. Организация геномов неклеточных организмов и прокариотов. Организация генома вирусов. Понятие о лизогенном и литическом циклах вирусов.… Организация генома эукариотов. Современные представления о геноме человека.…Типы вирусных геномов
РНК-геномы
Одноцепочечная нефрагментированная РНК, не обладающая матричной активностью (негативная, или РНК). Вирион имеет в своем составе фермент… Одноцепочечная фрагментированная РНК, не обладающая матричной активностью… Двухцепочечная фрагментированная РНК; вирион имеет транскриптазу. Реовирусы (10 фрагментов).ДНК-геномы
Одноцепочечная кольцевая ДНК. Фаги М13, ○Х174. Двухцепочечная линейная ДНК. Вирусы герпеса и другие; ранняя мРНК… Двухцепочечная кольцевая ДНК. Паповавирусы, вирус гепатита В и другие; ранняя мРНК синтезируется в ядре клеточным…Геном бактерий
1. Хромосомы бактерий (и, соответственно, плазмид) располагаются свободно в цитоплазме, не отграничены от нее никакими мембранами, но связаны с… 2. Хотя бактерии являются гаплоидными организмами, т. е. имеют один набор… 3. У бактерий в естественных условиях передача генетической информации происходит не только по вертикали, т. е. от…Особенности плазмид.
· Размножение плазмид происходит путем саморепликации их ДНК и не требует синтеза структурных белков и процессов самосборки. · Средой обитания плазмид являются только бактерии. · Плазмиды обладают системами генов, которые наделяют их способностью к самопереносу или к мобилизации на перенос из…Организация генома эукариот.
При половом размножении в процессе оплодотворения объединяются геномы двух родительских гамет, образуя генотип нового организма. Все соматические… Генотип человека сформировался эволюционно. Общая эволюция генотипа эукариот… Полиплоидия (увеличение количества ДНК и хромосом, кратное гаплоидному набору) увеличивает дозу всех генов и образует…Часть 2. Молекулярные основы наследственных заболеваний
Молекулярные механизмы генных, хромосомных и геномных мутаций
Мутационная изменчивость у человека. Молекулярные механизмы генных мутаций. Классификация генных мутаций. Понятие о моногенных наследственных… Мутационная изменчивость у человека. Стабильность генетического аппарата и обусловливаемый этим аппаратом консерватизм…Регуляция клеточного цикла. Апоптоз. Онкогенетика.
Митотический цикл и его регуляция. Роль циклинов и циклинзависимых киназ. Принципы передачи митогенного сигнала. Роль факторов роста, интегринов и… Генетические механизмы канцерогенеза. Общая характеристика генов, берущих…Часть 3. Современные вопросы генных технологий
Исследование нуклеиновых кислот. Методы ДНК-диагностики
Методы исследования нуклеиновых кислот. Методы выделения ДНК из растительных и животных тканей и её очищение. Ферменты, используемые для… Методы ДНК-диагностики. Показания к ДНК-диагностике. Прямые и непрямые методы.…Методы генной инженерии
Понятие о генной инженерии. Рекомбинантные ДНК, принципы их конструирования. Клонирование фрагментов нуклеиновых кислот in vivo. Определение по… Трансгенные организмы. Принцип конструирования трансгенных организмов.… Генная терапия. Принципы генной терапии. Генотерапия ex vivo и in vivo. Вирусные и невирусные векторы в генотерапии.…Клонирование организмов и клеток.
Клеточная инженерия. Понятие о клонировании. Природные и искусственные клоны. История клонирования организмов. Биологические и этичные проблемы… Клеточная инженерия. Понятие о клонировании. Термин «клон» происходит от греческого слова «klon», что означает…ПРИЛОЖЕНИЯ
КОНТРОЛЬНО-ОБУЧАЮЩИЕ ВОПРОСЫ
1.1
Объектом изучения МБ являются:
а) органеллы
б) вирусы
в) ДНК, РНК
г) растения
д) грибы
Отличительная черта МБ:
а) трехмерность
б) двухмерность
в) одномерность
Укажите достижения МБ:
а) синтез генов
б) синтез клеток
в) перенос генов
г) перенос клеток
Как наука МБ возникла в:
а) 1944г.
б) 1928г.
г) 1953г.
д) 1957г.
Генетическую роль ДНК установили:
а) Мендель и Мишер
б) Уотсон и Крик
в) Эйвери с сотрудниками
г) Кендрью и Перутц
Структуру ДНК установили:
а) Мендель и Мишер
б) Уотсон и Крик
в) Эйвери с сотрудниками
г) Кендрью и Перутц
Классическая генетика считала:
а) ген дискретен и неделим
б) ген дискретен и делим
в) ген содержит много сайтов
г) предел дробимости гена-
пара нуклеотидов
МГ установила:
а) ген дискретен и неделим
б) ген дискретен и делим
в) ген содержит много сайтов
г) предел дробимости гена-
пара нуклеотидов
Первый синтез гена осуществил:
а) Мендель - 1865
б) Уотсон - 1953
в) Эйвери - 1944
г) Корана – 1968
Впервые ввели ген в клетки человека в:
а) 1971г Мерилл с сотр.
б) 1981г Мерилл с сотр
в) 1991г Крик с сотр.
На базе МБ возникла новая область науки:
а) молекулярная медицина
б) молекулярная химия
в) молекулярная физика
Расшифровка генома человека позволяет развивать такие направления молекулярной медицины:
а) функциональную геномику
б) молекулярную диагностику
в) фармакогенетику
г) генную терапию
д) кариотипирование
Самые эффективные методы генодиагностики:
а) биохимические
б) иммунологические
в) ПЦР и ДНК- зонды
1.2
Белки состоят из:
а) нуклеотидов
б) аминокислот
в) аминогрупп
г) азотистых оснований
д) карбоксильных групп
Глицин входит в класс аминокислот:
а) моноамонокарбоновых
б) диаминокарбоновых
в) аминодикарбоновых
г) ароматических
д) гетероциклических
Лизин входит в класс аминокислот:
а) моноамонокарбоновых
б) диаминокарбоновых
в) аминодикарбоновых
г) ароматических
д) гетероциклических
Тирозин входит в класс аминокислот:
а) моноамонокарбоновых
б) диаминокарбоновых
в) аминодикарбоновых
г) ароматических
д) гетероциклических
Триптофан входит в класс аминокислот:
а) моноамонокарбоновых
б) диаминокарбоновых
в) аминодикарбоновых
г) ароматических
д) гетероциклических
Укажите незаменимые аминокислоты:
а) аргинин, лизин
б) валин, гистидин
в) лейцин, треонин
г) триптофан, метионин
д) пролин, серин
Укажите заменимые аминокислоты:
а) аргинин
б) глутамин
в) лейцин
г) аспарагин
д) серин
Дефицит триптофана вызывает:
а) развитие катаракты
б) выпадение волос
в) тошноту, головокружение
г) потерю аппетита, подавленность
Дефицит лизина вызывает:
а) развитие катаракты
б) выпадение волос
в) тошноту, головокружение
г) потерю аппетита, подавленность
Дефицит лейцина вызывает:
а) развитие катаракты
б) выпадение волос
в) тошноту, головокружение
г) потерю аппетита, подавленность
Образование первичной структуры белка обеспечивают связи:
а) водородные
б) пептидные
в) водородные, ионные, гидрофобные
Образование вторичной структуры белка обеспечивают связи:
а) водородные
б) пептидные
в) водородные, ионные, гидрофобные
Образование третичной структуры белка обеспечивают связи:
а) водородные
б) пептидные
в) водородные, ионные, гидрофобные
Домены - функциональные участки белков с:
а) первичной структурой
б) вторичной структурой
в) третичной структурой
Фолдингом называется образование:
а) первичной структуры
б) вторичной структуры
в) третичной структуры
г) правильной конфигурации
Прионовые болезни возникают при:
а) мутации гена прион - протеина
б) употреблении мяса с инфекционными протеинами
в) употреблении мяса коров
г) мутации генов
Оксидоредуктазы – это белки:
а) переносчики
б) сигнальные
в) защитные
г) ферменты
д) структурные
е) рецепторные
ж) регуляторные
Бомбезины - это белки:
а) переносчики
б) сигнальные
в) защитные
г) ферменты
д) структурные
е) рецепторные
ж) регуляторные
Гемоглобины - это белки:
а) переносчики
б) сигнальные
в) защитные
г) ферменты
д) структурные
е) рецепторные
ж) регуляторные
Лимфокины - это белки:
а) переносчики
б) сигнальные
в) защитные
г) ферменты
д) структурные
е) рецепторные
ж) регуляторные
Мономеры НК:
а) рибонуклеотиды
б) дезоксирибонуклеотиды
в) аминокислоты
г) пиримидины
д) пурины
Уотсон-криковское спаривание -это:
а) аденин - тимин
б) аденин - гуанин
в) аденин - урацил
г) гуанин - цитозин
Обычная форма ДНК:
а) А - ДНК
б) В - ДНК
в) Z - ДНК
Уникальная ДНК содержит:
а) транспозоны
б) гены синтеза т-РНК
в) структурные гены
г) гены рибосом
Преемственность между клетками обеспечивает:
а) репликация
б) транскрипция
в) репарация
г) трансляция
Фрагменты Оказаки образуют:
а) лидирующую цепь ДНК
б) лидирующую цепь РНК
в) отстающую цепь ДНК
г) отстающую цепь РНК
Теломеры – это участки хромосом:
а) концевые
б) срединные
в) центромерные
Теломеры обеспечивают:
а) «счетную функцию»
б) индивидуальность хромосом
в) парность хромосом
г) сайленсинг
Буферные участки на концах хромосом образованы:
а) ТТАГГГ
б) ТТТГГГ
в) ТАТГАГ
г) ГАГТАТ
Для синтеза теломерной ДНК используется:
а) ДНК- полимераза
б) обратная транскриптаза
в) топоизомераза
ДНК- фотолигаза разрушает связи между димерами:
а) тимин- тимин
б) тимин-цитозин
в) цитозин – цитозин
г) цитозин – гуанин
При эксцизионной репарации удаляются:
а) целые гены
б) только димеры
в) сотни нуклеотидов
При нарушении процесса рапарации развиваются:
а) синдром Кокейна
б) трихотиодистрофия
в) синдром Патау
г) синдром Эдвардса
Для прокариот характерны:
а) трансформация
б) трансдукция
в) коньюгация
г) копуляция
Для эукариот характерны:
а) равный кроссинговер
б) неравный кроссинговер
в) коньюгация
г) копуляция
Хромосомная теория Моргана базируется на:
а) равном кроссинговере
б) неравном кроссинговере
в) коньюгации
г) копуляции
Гомологическую рекомбинацию обеспечивает:
а) ревертаза
б) ренатураза
в) транскриптаза
г) топоизомераза
Генная конверсия - это:
а) внутренние изменения в повторах
б) однонаправленный перенос генетического материала
в) коньюгация
г) трансдукция
Регуляцию генов у прокариот открыли:
а) Бидл и Татум - 1940
б) Жакоб и Моно - 1961
в) Уотсон и Крик - 1953
г) Эвери и др. – 1944
Укажите структурные гены:
а) промоторы
б) операторы
в) уникальные гены
г) разделители
Укажите гигантские гены:
а) инсулин
б) альбумин
в) тиреоглобулин
г) дистрофин
Больше всего генов кодирующих:
а) рецепторы
б) ферменты
в) модуляторы функции белков
г) иммуноглобулины
Конститутивные гены – это гены:
а) белков рибосом
б) тРНК
в) рРНК
г) иРНК
Для эукариот характерна бикомбинативная регуляция:
а) фактор транскрипции + препромотор
б) фактор транкрипции + промотор
в) фактор транскрипции + энхансер
г) промотор + энхансер
В тРНК первое основание:
а) аденин
б) урацил
в) цитозин
г) гуанин
В тРНК имеются три петли:
а) антикодоновая
б) акцепторная
в) Т
г) D
Коэффициент седиментации рибосом прокариот:
а) 50S
б) 60S
в) 70S
г) 80S
Коэффициент седиментации рибосом эукариот:
а) 50S
б) 60S
в) 70S
г) 80S
Процессинг мРНК включает:
а) удаление концевых олигонуклеотидов
б) удаление интронов
в) удаление экзонов
г) сшивание экзонов
Класс малых РНК состоит из нуклеотидов:
а) 10 -20
б) 20-30
в) 20-300
За РНК- интерференцию отвечает нуклеотидов:
а) 10-20
б) 21-28
в) 21-23
Класс малых РНК состоит из:
а) однонитчатых РНК
б) двунитчатых РНК
в) РНК+ДНК(1 нить)
1.3
Генная экспрессия состоит из:
а) репликации
б) транскрипции
в) процессинга
г) трансляции
д) модификации
е) экспрессии
Центральная догма МБ запрещает передачу информации от:
а) ДНК к ДНК
б) ДНК к РНК
в) РНК к белку
г) белка к РНК
д) белка к ДНК
Укажите свойства генетического кода:
а) триплетность
б) перекрываемость
в) избыточность
г) неперекрываемость
д) линейность
е) универсальность и др.
Для инициации транскрипции прокариот необходимы:
а) холофермент
б) нуклеозидтрифосфат
г) промотор
д) р-белок
мРНК прокариот:
а) подвергаются процессингу
б) не подвергаются процессингу
в) содержат интроны
г) не содержат интроны
Транскрипцию эукариот обеспечивают:
а) ядрышковая полимераза 1
б) ядрышковая полимераза 2
в) полимераза 2 цитоплазмы
г) полимераза 3 цитоплазмы
Сплайсинг гетерогенной ядерной РНК это:
а) удаление интронов
б) соединение экзонов
в) соединение интронов
г) удаление экзонов
Каждый акт элонгации состоит из этапов:
а) узнавание кодона
б) образование пептидной связи
в) транслокация
г) трансляции
д) терминации
Функция шаперонов:
а) формирование полипептида
б) модификация белков
в) модификация аминокислот
г) модификация нуклеотидов
Оперон прокариот состоит из:
а) промотора
б) оператора
в) цистронов
г) репрессора
Преждевременную терминацию транскрипции обеспечивает:
а) корепрессор
б) репрессор
в) ааттенуатор
Белки – факторы транскрипции эукариот:
а) «цинковые пальцы»
б) «спираль-поворот-спираль»
в) «спираль-петля-спираль»
г) «лейциновая молния»
д) «лизиновая молния»
1.4
Геном состоит из:
а) гаплоидного набора хромосом
б) диплоидного набора хромосом
в) полного состава ДНК клетки
Укажите паразитов генетического уровня:
а) бактерии
б) бактериофаги
в) вирусы
г) ВИЧ
Для кого характерно перекрывание генов:
а) фаг Х174
б) фаг R17
в) вироиды
г) вирусы-сиротки
Диплоидный геном у:
а) пикорнавирусов
б) аденовирусов
г) ретровирусов
д) парвовирусов
Какие вирусы имеют экзоны и интроны:
а) пикорнавирусы
б) аденовирусы
г) ретровирусы
д) парвовирусы
У прокариот линейные ДНК характерны для:
а) эшерихий
б) бруцелл
в) боррелий
г) стрептомицесов
Укажите гены контроля вирулентности:
а) инвазины
б) порины,токсины
в) гемолизины, адгезины
г) лактозины
Укажите плазмиды, обеспечивающие лекарственную резистентность:
а) F
б) R
в) Col
г) Ent
д) Hly
Укажите плазмиды, обеспечивающие синтез гемолизинов:
а) F
б) R
в) Col
г) Ent
д) Hly
Геном человека содержит:
а) 95% ДНК хромосом
б) 5% ДНК митохондрий
в) 90% ДНК хромосом
г) 10% ДНК митохондрий
Гены гистонов образуют:
а) спейсеры
б) тандемы
в) кластеры
г) сателлиты
Однонуклеотидный полиморфизм встречается в:
а) экзонах
б) интронах
в) повторах
г) промоторах
Все известные гены, кодирующие белки, транскрибируются:
а) РНК-полимеразой 1
б) РНК-полимеразой 2
в) РНК-полимеразой 3
Укажите мультигенные семейства:
а) интерфероны
б) актины
в) тубулины
г) гемоглобины
Укажите суперсемейства генов:
а) интерфероны
б) актины
в) тубулины
г) гемоглобины
Псевдогены – это:
а) тупик эволюции
б) эффект перестроек генов
в) результат эволюции
Укажите особенности транспозонов:
а) перемещаются по сайтам
б) образуют копии
в) всегда обеспечивают преимущество
г) находятся под контролем
Микросателлитная ДНК:
а) 2-8 пар нуклеотидов
б) 10-80 пар нуклеотидов
в) 20-80 пар нуклеотидов
г) 10-100000 пар нуклеотидов
Минисателлитная ДНК:
а) 2-8 пар нуклеотидов
б) 10-80 пар нуклеотидов
в) 20-80 пар нуклеотидов
г) 10-100000 пар нуклеотидов
Гены митохондриальной ДНК:
а) плазмагены
б) псевдогены
в) кластеры
г) тандемы
Причины частых мутаций митохондриальной ДНК:
а) слабая система репарации
б) радикалы кислорода
в) отсутствие кроссинговера
г) кольцевая ДНК
Геном митохондрий:
а) непрерывен
б) имеет гетероплазмию
в) имеет гомоплазмию
г) имеет комбинативную изменчивость
Геном митохондрий наследуется по материнской линии поэтому используется для изучения:
а) родственных связей
б) эволюции человека
в) миграции населения
г) комбинативной изменчивости
Укажите митохондриальные болезни:
а) молочнокислый ацидоз
б) Альцгеймера
в) Паркинсона
г) энцефалопатия
д) синдром Кокейна
2.1
Каждый человек наследует новые вредные мутации:
а) 2-3
б) 5-8
в) 10
г) 10-15
Примеры сбалансированного полиморфизма:
а) группы крови АВО
б) группы резус
в) гены муковисцидоза
г) летальные гены
Укажите результаты мутационного груза:
а) 15%-спонтанные аборты
б) 1%-мертворождения
в) 84%-живорождения
Укажите структурные изменения генов:
а) транспозиция
б) инверсия
в) дупликация
г) гетероплоидия
К чему приводит замена азотистых оснований?
а) В 25% образуются триплеты - синонимы
б) В 5% - нонсенс -кодоны
в) В 70% - мутации генов
г) В 100%- мутации генов
Мутон - это:
а) 1пара нуклеотидов
б) 1 нуклеотид
в) 1 пара комплементарных нуклеотидов
г) 1 ген
Укажите генные болезни:
а) муковисцидоз
б) гемофилия
в) фенилкетонурия
г) анемия
д) «крик кошки»
Частота новорожденных с генными болезнями:
а) 1%
б) 3%
в) 5%
г) 0,5%
Для изучения кариотипа деление клеток останавливают
на стадии:
а) профазы
б) метафазы
в) анафазы
г) телофазы
При дифференциальной окраске хромосом можно выявить:
а) 10-20 участков
б) 200-400 участков
в) эухроматин
г) гетерохроматин
Метод FISH обеспечивает:
а) определение места гена
б) расшифровку перестроек между многими хромосомами
в) изучение полиплоидии
Классификация мутаций по причине возникновения:
а) спонтанные
б) генеративные
в) соматические
г) индуцированные
2.2
В какой фазе клеточного цикла клетка вступает в процесс дифференцировки?
а) S
б) G2
в) M
г) G1
Укажите самую короткую фазу клеточного цикла:
а) S
б) G2
в) M
г) G1
В какой фазе клеточного цикла находится «точка рестрикции»?
а) S
б) G2
в) M
г) G1
Какие протеинкиназы запускают клеточный цикл?
а) циклин D – Cdk4
б) циклин D – Cdk6
в) циклин E – Cdk2
г) циклин B – Cdk1
Какие протеинкиназы «вводят» клетку в митоз?
а) циклин D – Cdk4
б) циклин D – Cdk6
в) циклин E – Cdk2
г) циклин B – Cdk1
Укажите последовательность действия митогенного сигнала:
а) протеинкиназы
б) тирозинкиназа
в) гены раннего ответа
г) транскрипционные факторы
Укажите стимуляторы пролиферации клеток:
а) эритропоэтин
б) интегрины
в) кадгерины
г) убиквитинлигаза
Медикаментозная терапия онкологических больных заключается в действии на фазу:
а) S
б) G2
в) M
г) G1
Роль белка р53:
а) «страж генома»
б) «диспетчер апоптоза»
в) опухолевый супрессор
г) фактор роста
Укажите необратимые стадии апоптоза:
а) активация эндонуклеаз
б) дробление ДНК
в) дезинтеграция клетки
г) ассимиляция макрофагами
Снижение какого гормона вызывает апоптоз в женских половых органах?
а) тестостерона
б) эстрадиола
в) прогестерона
Множественная лекарственная устойчивость опухолевых клеток формируется на:
а) мутации гена р53
б) гиперэкспрессии Вс1-1, Вс1-х
в) активации каспаз
г) активации эндонуклеаз
3.1
Укажите ферменты, используемые в генной инженерии:
а) рестриктазы
б) нуклеазы
в) полимеразы
г) убиквитинлигаза
д) ДНК-лигаза
Наиболее эффективным методом диагностики малярии является:
а) иммунологический
б) ДНК-зонд
в) видоспецифический ДНК-зонд
г) гибридизация ДНК
Какое количество нуклеотидов образует «молекулярный маяк» и гибридизуется с ДНК- и РНК- мишенью?
а) 25
б) 15 средних
в) 15 средних комплементарных
г) 50
Полимеразная цепная реакция включает стадии:
а) денатурация ДНК-940 С
б) отжиг праймеров-600 С
в) элонгация – 720 С
г) денатурация ДНК-500 С
Укажите фермент, используемый в ПЦР:
а) ДНК-полимераза
б) РНК-полимераза
в) Таg-полимераза
Когда применяются прямые методы ДНК-диагностики?
а) ген заболевания клонирован
б) известна нуклеотидная последовательность гена
в) ген не клонирован
г) заболевание гетерогенно
Укажите метод, позволяющий определять гетерозиготные мутации:
а) SSCP
б) HA
в) DGGE
г) CCM
Укажите метод, позволяющий определять точковые мутации (замены):
а) SSCP
б) HA
в) DGGE
г) CCM
Какие повторы нуклеотидов являются маркерами в ДНК – диагностике?
а) СА
б) ТА
в) GС
г) CC
Наиболее информативны маркеры рестриктазных фрагментов ДНК:
а) диаллельные локусы
б) гипервариабельные локусы
в) VNTR - блоки
Укажите особенности мтДНК:
а) маркер материнской линии наследования
б) анализ древних останков
в) представляет «единый» локус
г) подвержена рекомбинации
д) малоизменчива
3.2
Генная инженерия состоит из последовательных этапов:
а) получение нужных генов
б) их включение в вектор
в) введение вектора в клетку
г) рестрикция ДНК
д) построение рестриктазных карт
Укажите свойства плазмид:
а) имеют много копий
б) сами реплицируются
в) малы по размерам
г) не имеют копий
д) сами не реплицируются
Расположите векторы по величине включения чужой ДНК:
а) Искусственные хромосомы
б) плазмиды
в) космиды
г) бактериофаги
Укажите три основных элемента искусственных хромосом:
а) 2 теломера
б) точки инициации репликации
в) точки терминации
г) центромера
Оптимальная интеграция и экспрессия генов наблюдается при их введении в:
а) женский пронуклеус
б) мужской пронуклеус
в) цитоплазму ооцита
г) цитоплазму зиготы
Укажите рекомбинантные лекарственные препараты:
а) инсулин
б) люциферин
в) интерферон
г) соматотропин
Двудольные трансгенные растения получены на основе:
а) бактериального переноса
б) агробактериального переноса
в) «генных пушек»
г) «дробовика»
Укажите животное - биореактор, продуцирующее Hb-человека:
а) корова
б) кролик
в) коза
г) свинья
Аэрозольная генотерапия используется для лечения:
а) прогрессирующей меланомы
б) муковисцидоза
в) иммунодефицита
г) рака легких
На стадии клинических испытаний находится генокоррекция заболеваний:
а) цитрулинемия
б) иммунодефицит АДА
в) болезнь Хантера
г) муковисцидоз
д) гипераммонемия
Успешно проводится испытание ДНК-вакцин против:
а) туберкулеза
б) гепатита В и С
в) герпеса
г) муковисцидоза
д) цитрулинемии
3.3
Пример природного клонирования человека:
а) монозиготные близнецы
б) дизиготные близнецы
в) родные брат и сестра
Что обеспечивает клонирование любой растительной клетки?
а) сохранение тотипотентности
б) потеря тотипотентности
в) дифференцировка
Успешно клонировал шелкопряд:
а) А.Тихомиров
б) В. Струнников
в) Б. Астауров
г) Г. Лопашов
Дж. Гердон в 1962г в опытах с южноафриканскими жабами успешно клонировал:
а) зародышевые клетки
б) клетки эпителия кишечника головастика
в) клетки эпителия кишечника жабы
Овца Долли была получена клонированием в:
а) 1992г
б) 1994г
в) 1996г
г) 1998г
Эмбрионы овец сохраняют свою тотипотентность на стадии:
а) 8 клеток
б) 10 клеток
в) 14 клеток
г) 16 клеток
Для клонирования овцы Долли взято ядро из:
а) клетки молочной железы
б) клетки эпителия
в) клетки эмбриона
Клеточная инженерия сокращает сроки выведения новых сортов растений до:
а) 10 лет
б) 8 лет
в) 6 лет
г) 3 лет
Человеческий соматотропин вырабатывают клетки:
а) риса
б) табака
в) кукурузы
г) кирказона маньчжурского
Препарат кардиотропного действия получают из трансгенной культуры:
а) риса
б) табака
в) кукурузы
г) кирказона маньчжурского
Геномный импринтинг – это:
а) идентичность отцовского и материнского генома
б) из двух аллелей гена работает один – отцовский или материнский
в) работают оба аллеля одного гена
Вводить пациенту необходимо клетки:
а) мультипотентные
б) тотипотентные
в) плюрипотентные
Ответы на контрольно – обучающие вопросы
1.1
1.а,б,в 2.а 3.а,в,г 4.г 5.в 6.б 7.а 8.б,в,г 9.г 10.а 11.а 12.а,б,в,г 13.в
1.2
1.б 2.а 3.б 4.г 5.д 6.а,б,в,г 7.б,г,д 8.а,б 9.в 10.г 11.б 12.а 13.в 14.в 15.г 16.а,б 17.г 18.ж 19.а 20.в 21.а,б 22.а,в,г 23.б 24.в 25.а 26.в 27.а 28.а,б 29.а 30.б 31.а,б,в 32.а,в 33.а,в 34.а,б,в 35.а,б,г 36.а 37.б 38.а,б 39.б 40.в 41.в,г 42.б 43.а,б,в 44.а 45.г 46.а,в,г 47.в 48.г 49.а,б,г 50.в 51.б,в 52.б
1.3
1.б,в,г,д,е 2.г,д 3.а,в,г,д,е 4.а,б,в 5.б,г 6.а,в 7.а,б 8.а,б,в 9.б 10.а,б,в 11.в 12.а,б,в,г
1.4
1.в 2.б,в,г 3.а,б 4.г 5.г 6.в,г 7.а,б,в 8.б 9.д 10.а,б 11.в 12.а,б,в 13.б 14.б,в 15.а,б 16.а,б 17.а,б,г 18.а 19.г 20.а 21.а,б 22.а,б,в 23.а,б,в 24.а,б,в,г
2.1
1.а 2.а.б,в 3.а,б 4.а,б,в 5.а,б,в 6.в 7.а,б,в 8.а 9.б 10.б,в,г 11.а,б 12.а,г
2.2
1.г 2.в 3г 4.а,б 5.в 6.б,а,г,в 7.а,б,в 8.в 9.а,б.в 10.б.в,г 11.в 12.а.б,в
3.1
1.а,б,в,д 2.в,г 3.а,в 4.а,б,в 5.в 6.а,б 7.б 8.г 9.а 10.б,в 11.а.б.в
3.2
1.а,б,в 2.а,б,в 3.б,г.в,а 4.а,б,г 5.б 6.а,в,г 7.б 8.г 9.б.г 10.б,г 11.а,б,в
3.3
1.а 2.а 3.б 4.б 5.в 6.г 7.а 8.г 9.б 10.г 11.б 12.а
Терминологический словарь
Аберрация хромосомная (или хромосомная аномалия) — обобщенное название любого из типов хромосомных мутаций: делеций, транслокаций, инверсий,… Аденин [Adenine] – 6-альфа-аминопирин. Одно из пуриновых оснований.… Активатор [Activator] – 1. Вещество, стимулирующее транскрипцию специфического гена или оперона. 2. Белок,…Рестрикция [Restriction] – процесс разрыва ДНК под действием специфических ферментов – рестриктаз. Разные рестриктазы узнают и расщепляют разные нуклеотидные последовательности.
Ретровирусы [Retroviruses] – группа РНК-содержащих вирусов, содержащих обратную транскриптазу; синтезированная на РНК-матрице двухцепочечная ДНК может встраиваться в хромосому инфицированной этим вирусом клетки.
Рецессивный — признак или соответствующий аллель, который проявляется только в гомозиготном состоянии.
Рибозим [Ribozyme] – молекула РНК, обладающая ферментативной активностью.
РНК [RNA] – присутствует во всех клетках, содержит в качестве сахара рибозу, а в качестве азотистых оснований – аденин, гуанин, цитозин и урацил. Состоит из мономеров – дезоксирибонуклеотидов, соединенных через остатки фосфорной кислоты в определенной последовательности, специфичной для каждой
индивидуальной РНК. В каждой клетке имеются рибосомные, транспортные и информационные РНК.
РНК-полимераза [RNA polymerase, RNA synthetase] – фермент, осуществляющий синтез РНК из рибонуклеозидтрифосфатов. Матрицей может служить ДНК или РНК, соответствующие РНК-полимеразы называют ДНК- или РНК зависимыми.
Сайт встраивания (клонирования) [Cloning site] – специфический участок векторной молекулы, в который встраивают фрагмент чужеродной ДНК. Очень часто это уникальный сайт рестрикции.
Сайт рестрикции [Restriction site] – нуклеотидная последовательность в
молекуле ДНК, узнаваемая рестриктазой.
Сайт-специфический мутагенез [Site-specific mutagene-sis] – внесение in vitro мутации в конкретный сайт клонированной последовательности. Позволяет идентифицировать функциональные участки в молекулах белков и получать белки с заранее заданными свойствами. Иногда называется олигонуклеотид-направленным мутагенезом.
Самореплицирующийся элемент [Self-replicating element] – внехромосомная молекула нуклеиновой кислоты, способная к независимой от хромосомной ДНК(автономной) репликации. Примером такого элемента служит плазмида.
Саузерн-блоттинг [Southern blotting] – обнаружение специфических нуклеотидных последовательностей путем переноса денатурированных молекул ДНК, подвергнутых электрофорезу, с агарозного геля на нитроцеллюлозный или нейлоновый фильтр за счет капиллярного эффекта и гибридизации с меченым зондом, комплементарным искомой последовательности.
Сексдукция [Sexduction] – перенос генов во время конъюгации от одной бактерии к другой.
Сигма-фактор [Sigma factor] – бактериальный белок, обеспечивающий узнавание ДНК-полимеразой ее участка связывания в молекуле ДНК и инициацию транскрипции.
Сигнал полиаденилирования [Polyadenylation sygnal] – нуклеотидная последовательность, ответственная за окончание транскрипции и детерминирующая ферментативное присоединение остатков аденина к 3'-концу молекулы мРНК.
Сигнальная последовательность [Signal region, initiator element] – нуклеотидная последовательность в гене, служащая местом связывания белка (фактора транскрипции), который регулирует транскрипцию.
Сигнальный пептид, сигнальная последовательность, лидерный пептид [Signal peptide] – n-концевой участок белковой молекулы длиной 15—30 аминокислот, обеспечивающий секрецию белка (перенос через мембрану). После секреции этот участок отщепляется от белковой молекулы.
Скрининг [Screening] – метод (или комплекс методов) идентификации единичного объекта (особи в популяции, клетки с искомыми свойствами, участка нуклеотидной последовательности и т.д.) путем перебора большого числа объектов.
Соматическая гибридизация – обмен генетическим материалом между неполовыми (соматическими) клетками, например, при слиянии протопластов.
Сплайсинг [Splicing] – вырезание из предшественника мРНК нитронов и ковалентное соединение экзонов с образованием зрелых мо-лекул мРНК.
Стоп-кодон — нуклеотидный триплет, являющийся сигналом окончания трансляции.
Структурный ген [Structural gene] – ген, кодирующий какой-либо белок.
Ступенчатый разрыв [Staggered cut] – разрезание двухцепочечной ДНК, при котором разрывы в комплементарных цепях располагаются не строго один напротив другого, а немного смещены.
Субклонирование [Subcloning] – перенос части уже клонированной молекулы ДНК в другой клонирующий вектор.
Супрессия[Supression] – явление, препятствующее проявлению у организма признака, появившегося в результате мутации. Приводит к частичному или полному восстановлению функции организма.
Ti-плазмида [Ti plasmid] – плазмида почвенной бактерии Agrobacterium tumefaciens, Т-участок которой способен включаться в их ядерную ДНК, что приводит к образованию опухолей.
Тандемный повтор [Tandem array] – нуклеотидная последовательность, состоящая из нескольких одинаковых элементов, соединенных «голова-к-хвосту».
ТАТА-бокс [TATA box] – участок, располагающийся в промоторной области генов эукариот за 25 нуклеотидов до сайта инициации транскрипции, с которым связывается РНК-полимераза. Другое название — бокс Хогнесса. Аналогом у прокариот служит бокс Прибнова.
Т-ДНК [T-DNA] – фрагмент Ti-плазмиды, который встраивается в ядерную ДНК клетки-хозяина и стабильно наследуется ею. Вызывает образование опухоли у растений (корончатого галла).
Терапевтический ген [Therapeutical gene, therapeutic gene] – под генной терапией соматических клеток понимают коррекцию специфического наследственного заболевания путем введения в клетки организма нормально функционирующего гена, способного благоприятно повлиять на течение болезни.
Терминальная трансфераза [Terminal transferase, deoxynucleotidyl transferase] – фермент, катализирующий присоединение к З'-концу молекулы ДНК дезоксинуклеозидмонофосфатов. Используется для клонирования кДНК при участии комплементарных гомополимерных «хвостов» [poly (A) — poly (Т)].
Терминация [Termination] – остановка синтеза макромолекулы
Терминирующий кодон [Terminating codon] – стоп-кодон. Указывает на окончание считывания (окончание процесса построения молекулы белка).
Тимидилатсинтаза [Thymidylate synthase] – фермент, катализирующий метилирование урацила с превращением его в тимин.
Тимин, Т [Thymine] – 5-метилурацил, пиримидиновое основание. Входит в состав ДНК и ряда коферментов, небольшое количество содержится в транспортной РНК. С углеводом дезоксирибозой образует нуклеозид – тимидин.
Т.п.н. [T.p.n.] – единица измерения длины генов, означает количество тысяч пар нуклеотидов.
Транзиции[Transition] – вид мутаций, возникающий в результате ошибки при спаривании азотистых оснований. При этом в процессе редупликации ДНК происходит замена одного пуринового основания другим или одного пиримидинового основания другим.
Трансверсии [Transversion] – вид мутаций, возникающий в результате ошибки при спаривании азотистых оснований. В процессе редупликации происходит замена одного пуринового основания другим и наоборот.
Трансгенный организм [Transgenic organism] – организм, геном которого содержит генетический материал, включенный методами генной инженерии.
Трансгенез [Transgenosis] – процесс генетического изменения животных путем введения генов в оплодотворенные яйцеклетки называют трансгенной технологией, или трансгенезом.
Трансгеноз [Transgenesis] – введение чужеродного гена в растительную или животную клетку и его передача в ряду поколений.
Трансгены[Transgenes] – ДНК, вводимая в оплодотворенные яйцеклетки для изменения животных.
Трансдукция [Transduction] – перенос генетического материала из одной бактериальной клетки в другую с помощью бактериофага.
Транскрипт [Transcript] – молекула РНК, синтезированная на специфической ДНК как на матрице.
Транскрипционное картирование [Transcription mapping] – «привязка» индивидуальных транскриптов (клонов кДНК или экспрессированных последовательностей-мишеней) к хромосомным районам с помощью метода флуоресцентной гибридизации in situ, ПЦР и т.д.
Транскрипция [Transcription] – процесс синтеза РНК, катализируемый РНК-полимеразой, в котором в качестве матрицы используется одна из цепей ДНК.
Транслокация [Translocation] – 1. Хромосомная перестройка, заключающаяся в переносе участка хромосомы в новое положение на той же или на другой хромосоме или в переносе целой хромосомы на другую хромосому.
2. Перемещение молекулы мРНК во время трансляции на один кодон.
Трансляция [Translation] – 1. Синтез полипептидной цепи рибосомой с
использованием в качестве матрицы мРНК.
2. Перевод информации с 4-буквенного кода (по числу нуклеотидов) на 20-буквенный код (по числу аминокислот), осуществляемый в процессе синтеза белка при участии РНК и рибосом.
Трансляция in vitro [In vitro translation] – синтез белков, который осуществляется либо на очищенной ДНК с использованием бактериальных экстрактов, либо на мРНК с использованием экстрактов зародышей пшеницы или ретикулоцитов кролика. Экстракты содержат рибосомы, тРНК и белковые факторы; в реакционную смесь добавляют также ATP, GTP и аминокислоты.
Транспозаза [Transposase] – фермент, участвующий в транспозиции (перемещении из одного сайта в другой) некоторых мобильных генетических элементов.
Транспозиция [Transposition] – перемещение мобильного генетического элемента из одного локуса в другой.
Транспозоны[Transposones] – мобильные генетические элементы, несущие структурные гены, которые детерминируют функции, не связанные с самим процессом перемещения (например, гены устойчивости к антибиотикам).
Транспортная РНК, тРНК [Transfer RNA] – молекула РНК, выступающая в роли адаптера при специфическом переносе аминокислот к растущей полипептидной цепи в процессе трансляции.
Трансфекция [Transfection] – искусственное введение в эукариотические клетки изолированных молекул ДНК.
Трансфицирование – 1. изменение состава или структуры. 2. (в молекулярной биологии) трансформация клеток с помощью изолированной вирусной ДНК
Трансформация[Transformation] – 1. Перенос генетической информации в бактериальные клетки с участием плазмид или без них, но всегда — без участия вирусов; часто приводит к изменению фенотипа реципиентной клетки.
2. Превращение нормальных клеток животных в опухолевые.
Триплет [Triplet] – комбинация из трех последовательно расположенных нуклеотидов в молекуле нуклеиновой кислоты. С помощью триплетов в информационных РНК закодирована последовательность расположения аминокислот в белках. Специальные триплеты определяют, кроме того, начало (инициирующие кодоны) и конец (терминирующие кодоны) синтеза цепи белка.
Тупой конец [Blunt end] – конец двухцепочечной молекулы ДНК, у которого не выступает ни одна из цепей.
Улавливание экзона [Exon trapping] – метод идентификации и клонирования экзонов из геномных клонов. Фрагменты геномной ДНК (1—6 т.п.н.) встраивают в полилинкер вектора, расположенный внутри интрона, фланкированного двумя экзонами. Полученным искусственным геном (экзон 1— интрон—экзон 2) трансфицируют клетки E.coli, в которых происходит его транскрипция и сплайсинг мРНК. Если в интроне присутствует экзон, то зрелая мРНК будет иметь большую длину, чем ожидалось. мРНК можно подвергнуть обратной транскрипции, провести ПЦР и выделить экзон.
Урацил, U [Uracil] – пиримидиновое основание; одно из четырех азотистых оснований, входящих в состав РНК.
Фактор транскрипции [Transcription factor] – белок, помогающий РНК-полимеразе пройти все этапы транскрипции и обеспечивающий избирательность этого процесса.
Фенотип [Phenotype] – совокупность всех признаков особи, формирующаяся в процессе взаимодействия ее генотипа и внешней среды.
Фетоскопия — процедура, позволяющая визуально обследовать плод в матке при помощи волоконно-оптической техники.
Фетотерапия (плодная терапия; пренатальная терапия) — лечение плода до рождения.
Физическая карта [Physical map] – расположение генов на хромосоме, установленное с помощью различных методов (электронная микроскопия, секвенирование, рестрикционное картирование). Расстояние на такой карте измеряется в числе пар нуклеотидов.
Фосфодиэфирные связи – связь между фосфатными группами при 3'- и 5'- углеродных атомах соседних нуклеотидов одной полинуклеотидной цепи (или другими веществами), при которой каждый нуклеозид связан с молекулой фосфорной кислоты. Эта молекула служит как бы мостиком между двумя нуклеозидами (или другими веществами, которые этой связью связаны).
Фрагментация ДНК [Shearing] – разрыв молекул ДНК под действием гидродинамических сил (например, при пропускании раствора ДНК через иглу шприца). Гидродинамические силы в растворе возникают в результате скольжения одного слоя жидкости относительно другого.
Фрагмент Кленова [Klenov fragment] – более крупный из двух фрагментов ДНК-полимеразы I E.coli, образующийся при ее протеолитическом расщеплении.
Сохраняет полимеразную активность в направлении 5'–>3' и экзонуклеазную – в направлении 3'–>5'. Используется, в частности, при секвенировании ДНК.
Функциональная мРНК – передачу записанной в ДНК информации к месту синтеза белка осуществляет матричная или информационная РНК (мРНК). В клетке первичная РНК, синтезированная на такой ДНК, подвергается модификации, в процессе которой участки, соответствующие интронам, вырезаются, а экзонные последовательности сшиваются. В результате образуется зрелая мРНК, на которой синтезируется белок.
Функциональное картирование [Functional cloning] – идентификация гена исходя из известной аминокислотной последовательности его продукта.
Хромосома [Chromosome] – структура, основу которой составляет конденсированная молекула ДНК; носитель генетической информации. Способна к воспроизведению с сохранением структурно-функциональной индивидуальности в ряду поколений. У эукариот находится в ядре клетки, у прокариот — непосредственно в цитоплазме.
Хромосомные аберрации [Chromosome abberration] – отклонения в строении и функциях хромосом. Вызываются ионизирующим излучением, химическими мутагенными факторами, вирусами (краснухи, гепатита, ветряной оспы), различными расстройствами обмена веществ.
Хромосомный сайт интеграции [Chromosomal integration site] – место в хромосоме, куда может встроиться чужеродная ДНК, часто без всяких последствий для организма-хозяина.
Х-сцепленное наследование — тип наследования признаков, гены которых локализованы в Х-хромосоме.
Цистрон [Cistron] – генетическая единица, эквивалентная гену и кодирующая отдельный белок.
Цитозин, С [Cytosine] – одно из четырех азотистых оснований, входящее в состав ДНК и РНК.
Экзогенная ДНК [Exogenous DNA] – ДНК, выделенная из организма-донора и встроенная в вектор или хромосомную ДНК организма-хозяина. Называется также чужеродной (Foreign) и гетерологичной (Heterologous) ДНК.
Экзон [Eхоn] – участок гена, входящий в состав первичного транскрипта, который остается в нем после процессинга (вырезания интронов). Вместе с другими экзонами образует зрелую мРНК.
Экзонуклеаза HI [Exonuclease III] – экзонуклеаза E.coli, отщепляющая нуклеотиды с 3'-концов двухцепочечной ДНК.
Экспансия тринуклеотидных повторов — патологическое увеличение числа копий внутригенных тандемных последовательностей, состоящих из 3 нуклеотидов; этот тип мутаций называют также динамическими мутациями.
Экспрессия генов – реализация закодированной в ДНК информации через цепь событий: ДНК - РНК - белок.
Экспрессирующий вектор [Expression vector] – плазмидный вектор, сконструированный таким образом, чтобы клонированный ген экспрессировался только в определенной фазе клеточного цикла и только в течение определенного времени. Для этого в плазмиду встраивают сильный регулируемый промотор.
Экспрессивность [Expressivity] – степень фенотипического выражения наследственного признака, кодируемого данным аллелем. Различают постоянную экспрессивность (в отсутствие изменчивости признака) и вариабельную.
Экспрессия[Expression] – транскрипция и трансляция гена.
Экспрессия рекомбинантных ДНК – чтобы достичь высокого уровня экспрессии гена, введенного в эукариотическую клетку, его нужно встроить вблизи отактивного промотора транскрипции. Образующаяся при этом м-РНК будет эффективно транслироваться. Для обеспечения активной экспрессии используются, как правило, промоторы фаговых и хромосомных генов, включаемые в плазмидный вектор.
Электропорация[Electroporation] –образование пор в клеточных мембранах под действием электрического тока. Через эти поры в летки проникает чужеродная ДНК.
Электрофорез [Electrophoresis] – метод разделения заряженных молекул (ДНК, РНК или белков), основанный на разной скорости их перемещения в электрическом поле.
Элонгация [Elongation] – последовательное присоединение мономеров к полимерной цепи.
Эндонуклеаза [Endonuclease] – фермент, гидролизующий внутренние
фосфодиэфирные связи и расщепляющий молекулы ДНК и РНК. Эндонуклеазы участвуют в рекомбинации, репарации и рестрикции; в последнем случае называются рестриктазами (рестрицирующими эндонуклеазами).
Ядерное клонирование [Nuclear cloning] – получение живого организма из безъядерной яйцеклетки с вживленным диплоидным соматическим ядром.
ЛИТЕРАТУРА
1. Альбертс Б. И др.. Молекулярная билогия клетки: В 3-х т. - М.: Мир, 1994.- 504с.
2. Белясова Н.А. Биохимия и молекулярная биология. - Книжный дом, 2004.-415с.
4. Борисов Л.Б.,: Медицинская микробиология, вирусология, иммунология: учебник.- М.:000 «Медицинское информационное агентство»,2005,-736с.
3. Биология. Под ред. В.Н.Ярыгина, в 2кн.- 3-ое изд. М.: Высш. Шк.,2000- 742с.
5. Бочков Н.П. Клиническая генетика. - М.: ГЭОТАР-мед, 2002.-448с.
6.Бугаевская Т.И. Основы медицинской генетики.-Киш.:Здоровья. -2001.-134с.
7.Геннис Р. Биомембраны. Молекулярная структура и функции. -М.: Мир, 1997.-624с.
8.Глик Б., Пастернак Дж. Молекулярная биотехнология. -М.:Мир, 2002.-589с.
9.Горбунова В.Н., Баранов В.С..Введение в молекулярную диагностику и генотерапию наследственных заболеваний.- СПБ.: Специальная литература, 1997.-285с.
10. Дикий И.Л., Холупяк И.Ю., Шевелева Н.Е., Стегний М.Ю.,: Микробиология: Учебник для фармацевтических ВУЗов и фармацевтеических факультетов медицинских институтов- 2-ое издание.- К.: ИД «Профессионал», 2004,-624с.
11. Дранник Г.Н.,: Клиническая иммунология и аллерология - М.: 000 «Медицинское информационное агентство», 2003. -604с.
12. Жегунов Г.Ф., Жегунова Г.П.,: Цитогенетические основы жизни: учебное пособие для студентов высших учебных заведений. -Х.: «Золотые страници», 2004.-672с.
13. Инге-Вечтомов С.Г.,: Генетика с основами селекции: учебник для биологических специальностей университетов.- М.: «Высшая школа», 1989. - 591с.
14. Кларк Д., Рассел Л. Молекулярная биология: простой и занимательный подход.- М.: КОНД, 2004. -466с.
15. Коничев А.С. Молекулярная биология.- М.: Академия, 2003. -400с.
16. Медична біологія/ За ред. В.П. Пішака, В.П. Бажори. Підручник.- Вінниця: Нова книга, 2004.- 656с.
17. Молекулярная клиническая диагностика. Методы.: Пер. с англ../Под ред. С Херрингтона.- М.:Мир, 1999. -558с.
18. Молекулярные основы генетики. Г.Ф. Жегунов, Б.И. Кулаченко. Учебное пособие для студентов 1 курса.-Харьков, 2001. -74с.
19. Мушкамбаров Н.Н., Кузнецов С.Л.: Молекулярная биология: Учебное пособие для студентов медицинских вузов. - М.: 000 «Медицинское информационное агенство», 2003. -544с.
20. Орлов В.Д., Липсон В.В., Иванов В.В: Медицинская химия: Учебник для студентов высших учебных заведений. - Х.: «Фолио», 2005. -461с.
21. Рис Э., Стернберг М. Введение в молекулярную биологию.- М.: Мир, 2002. -142с.
22. Сингер М., Берг П. Гены и геномы / В 2-х т. Пер. с англ.- М.: Мир, 1998.
23. Фаллер Д.М., Шилдс Д. Молекулярная биология клетки. Руководство для врачей. Пер. с англ.- М.: БИНОМ-Пресс, 2003. -272с.
Приносим благодарность авторам и издательствам, чьи иллюстрации использованы нами в данной книге.
Авторы
СОДЕРЖАНИЕ
Предисловие. 2
Часть 1. Молекулярные основы наследственности. 4
1.1 Введение в молекулярную биологию. 4
1.2. Макромолекулы как обьекты изучения молекулярной биологии. 23
1.3. Экспрессия генов и её регуляция. 76
1.4. Организация геномов неклеточных и клеточных организмов. 100
Часть 2. Молекулярные основы наследственных заболеваний. 138
2.1. Молекулярные механизмы генных, хромосомных и геномных мутаций. 138
2.2. Регуляция клеточного цикла. Апоптоз. Онкогенетика. 160
Часть 3. Современные вопросы генных технологий. 193
3.1 Исследование нуклеиновых кислот. Методы ДНК-диагностики. 193
3.2 Методы генной инженерии. 221
3.3 Клонирование организмов и клеток. 241
ПРИЛОЖЕНИЯ.. 259
КОНТРОЛЬНО-ОБУЧАЮЩИЕ ВОПРОСЫ... 259
Ответы на контрольно – обучающие вопросы.. 270
Терминологический словарь. 271
ЛИТЕРАТУРА.. 291
УДК 577.2+575(075.8)
ББК 28я73
Рекомендовано Центральным методическим Советом
Запорожского государственного медицинского университета
(протокол № 2 от 30.11.2006г)
В.И. Павличенко, А.В. Абрамов
В книге, написанной в соответствии с официальной программой, в максимально… Книга предназначена для студентов и преподавателей медицинских и биологических специальностей вузов.ББК 28я73
©Павличенко В.И., Абрамов А.В.
©ЗГМУ
– Конец работы –
Используемые теги: павличенко, Абрамов0.054
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: ПАВЛИЧЕНКО В. И АБРАМОВ А. В.
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов