рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Образование
- /
- Сравните найденную рефракцию с вычисленной по таблицам атомных рефракций и рефракций связей
Реферат Курсовая Конспект
Сравните найденную рефракцию с вычисленной по таблицам атомных рефракций и рефракций связей
Сравните найденную рефракцию с вычисленной по таблицам атомных рефракций и рефракций связей - раздел Образование, Сравните Найденную Рефракцию С Вычисленной По Таблицам Атомных Рефракций И Ре...
Сравните найденную рефракцию с вычисленной по таблицам атомных рефракций и рефракций связей.
Решение: Формула четыреххлористого углерода CCl4.
1. Определяем молярную рефракцию CCl4 по правилу аддитивности, суммируя:
а) рефракции атомов
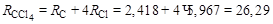 см3/моль;
см3/моль;
б) рефракции связей 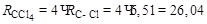 см3/моль.
см3/моль.
2. Вычисляем молярную рефракцию CCl4 по формуле Лорентца–Лоренца, используя опытные данные:
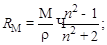
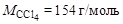 ,
,
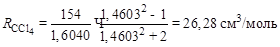 .
.
Теоретическое значение R(CCl4) и рассчитанное по рефракциям атомов хорошо согласуются.
Пример 2. Для определения состава водно-ацетоновых растворов были определены показатели преломления стандартных растворов, приведенных ниже:
| Содержание ацетона, % | |||||
| Показатель преломления | 1,3340 | 1,3410 | 1,3485 | 1,3550 | 1,3610 |
Построить калибровочный график для определения ацетона, вывести уравнение зависимости показателя преломления от концентрации и определить по графику и уравнению содержание ацетона в растворе, показатель преломления которого равен 1,3500.
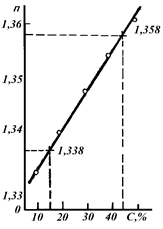
Решение. Строим график зависимости показателя преломления n от концентрации w (%) (см. рисунок).
1. Уравнение калибровочного графика определяем методом избранных точек. Для этого выбираем на концах прямой точки: для концентрации 15 % n= 1,338 и для концентрации 45 % n= 1,358. Составим два уравнения:
1,358 = А + В×45,
1,338 = А + В×15.
 Решаем эти уравнения и получаем:
Решаем эти уравнения и получаем:
А = 1,3279 и В = 6,7×10–4.
Следовательно, искомое уравнение имеет вид
2. По калибровочному графику находим, что показателю преломления 1,3500 соответствует концентрация 33 %. Подставив значение показателя преломления в… 1,3500 = 1,3279 + 6,7×10–4 ×w. Отсюда находим массовую долю ацетона в водно-ацетоновой смеси:Пример 1.
Для определения меди в цветном сплаве навеску 1,5 г сплава после растворения обработали аммиаком и получили 500 мл окрашенного раствора, оптическая плотность которого при толщине слоя 5 см равна 0,127. Молярный коэффициент поглощения аммиаката меди равен 423. Определите массовую долю меди в сплаве.
Решение: для решения задачи используем уравнение Бугера–Ламберта–Бера.
1. Рассчитываем концентрацию меди (в моль/л):
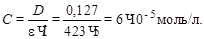
2. Определяем содержание меди в 500 мл раствора (г):
6×10–5×63,54 г – 1000 мл
х г – 500 мл
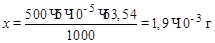 ,
,
где 63,54 – молярная масс атома меди.
3. Определяем массовую долю в сплаве (в %):
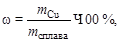
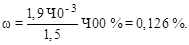
Пример 2.
Какая толщина окрашенного раствора необходима для ослабления светового потока в 10 раз, если молярный коэффициент поглощения равен 4700, а концентрация раствора 10–4 моль/л?
Решение: используем уравнение Бугера–Ламберта–Бера 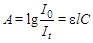 .
.
Зная, что 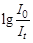 есть ослабление светового потока, после подстановки данных в уравнении получим: lg 10 = 4700×10–4 × l.
есть ослабление светового потока, после подстановки данных в уравнении получим: lg 10 = 4700×10–4 × l.
Откуда
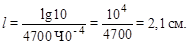
Пример 3.
Для определения кремния в сталях в виде кремнемолибденового комплекса был построен градуировочный график в координатах оптическая плотность А – концентрация диоксида кремния  по следующим данным:
по следующим данным:
 , мг/мл , мг/мл
| 0,2 | 0,4 | 0,6 | 0,8 | 1,0 |
| А | 0,15 | 0,29 | 0,43 | 0,61 | 0,74 |
Навеску стали 0,253 г растворили в кислоте и после соответствующей обработки получили 100 мл окрашенного раствора кремнемолибденового комплекса с оптической плотностью 0,56.
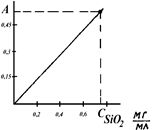 Определить содержание Si (в %) в стали.
Определить содержание Si (в %) в стали.
Решение
2. По графику при А = 0,56 определяем = 0,75 мг/мл. 3. Рассчитываем содержание SiO2 (в г) в 100 мл раствора: х = 100 × 0,75… 4. Определяем содержание Si в навеске:Пример 1
Определить удельное вращение плоскости поляризации рафинозы С18Н32О16.×5Н2О, если раствор, содержащий 5 г рафинозы в 1 л, при длине трубки 25 см вращает плоскость поляризации вправо на 1,3°.
Решение: подставляя приведенные данные в уравнение a = [a] × C × l, получаем:
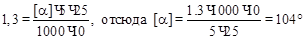 .
.
Пример 2
Удельное вращение плоскости поляризации никотина С10H14N2 для желтой линии натрия равно 162°. Определить концентрацию раствора никотина (в моль/л), который в трубке длиной 10 см вращает плоскость поляризации влево на 0,52°.
Решение: подставляя приведенные данные в уравнение a = [a] × C × l, получаем 0,52 = 162С × l, откуда С = 0,52/162 = 3,2×10–3 г/мл.
Молярная масса никотина М = 162 г/моль. Находим концентрацию никотина в моль/л:
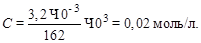
Пример 3
При построении калибровочного графика для винной кислоты были получены следующие данные на клиновом поляриметре:
| Концентрация винной кислоты, % | ||||
| Показания поляриметра, мм | 9,9 | 19,1 | 27,3 | 34,9 |
Сколько граммов винной кислоты надо растворить в 250 мл воды, чтобы отсчет по шкале был 23,5 мм.
Решение: строим график зависимости концентрации винной кислоты (%) от отсчета по шкале.
Для 23,5 мм по графику находим w = 24,7% и рассчитываем навеску винной кислоты (g):
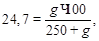 отсюда
отсюда 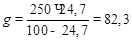 г.
г.
4. Потенциометрический метод анализа
Решение задач сводится к трем типам расчетов:
1. Расчет равновесного напряжения гальваноцепи, состоящей из электрода сравнения с постоянным потенциалом и индикаторного электрода (электрода измерения) с переменным потенциалом, зависящим от концентрации вещества в растворе.
В качестве электрода сравнения используют стандартный водородный электрод Pt½H2½2H+, каломельный Hg(ж)½Hg2Cl2(к)½KCl или хлорсеребряный Ag ½AgCl(к)½KCl электроды.
Электрод с меньшей величиной электродного потенциала играет роль анода. На аноде идет процесс окисления. На другом электроде с большим значением электродного потенциала – катоде идет процесс восстановления.
Е = Е(+) – Е(–),
где Е – напряжение, Е(+) и Е(–) – электродные потенциалы катода и анода соответственно.
2. Расчет рН исследуемой системы, состоящей из таких же пар электродов, погруженных в раствор определяемого вещества.
3. Расчет либо содержания вещества в титруемом растворе, либо потенциала индикаторного электрода в различные моменты титрования. Такое титрование и расчеты возможны для реакций окисления–восстановления, образования и разрушения комплексных соединений, нейтрализации (кислотно-основное взаимодействие), которые сопровождаются изменением равновесного напряжения системы.
4.1. Вычисление электродных потенциалов и напряжения
Пример 1
Для гальванического элемента (ГЭ), составленного из стандартного водородного электрода и цинкового электрода в 10–3М растворе ZnSO4 при 25 °С обозначьте ГЭ, запишите уравнения электродных процессов, уравнение суммарной реакции. Рассчитайте равновесное напряжение.
Решение: 1. Для обозначения ГЭ определяем потенциалы электродов: 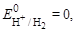 а
а 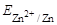 рассчитываем по уравнению Нернста:
рассчитываем по уравнению Нернста:
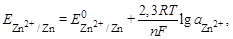
где Е0 – стандартный электродный потенциал; R – универсальная газовая постоянная (8,31 Дж/моль×К); F – число Фарадея (96500 Кл/моль-экв); n – число электронов, участвующих в процессе.
В разбавленных растворах активность ионов а можно считать равной концентрации С. Значение коэффициента 2,3 RT/F при температуре 25 °С равно 0,059.
Так как 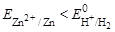 , то цинковый электрод будет анодом.
, то цинковый электрод будет анодом.
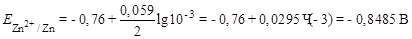 .
.
2. Обозначим ГЭ
А(–) ZnïZn2+ïï2H+ïH2ïPt (+)K.
3. Электродные процессы:
на аноде Zn° = Zn2+ + 2e–
на катоде 2Н+ + 2е– = Н2.
4. Уравнение суммарной реакции:
Zn + 2H+ = Zn2+ + H2 (ионно-молекулярная форма);
Zn + H2SO4 = ZnSO4 + H2 (молекулярная форма).
4. Рассчитаем напряжение ГЭ:
Е = Е(+) – Е(–) = 0 – (– 0,8485) = 0,8485 В.
Пример 2
Напишите реакцию и рассчитайте напряжение ГЭ, составленного из двух электродов:
Agï AgCl(к)ïKCl (0,04 M) и Н+ (0,007 М)ï H2(0,4 атм) ïPt
Решение: 1. Рассчитаем электродные потенциалы.
Потенциал водородного электрода:
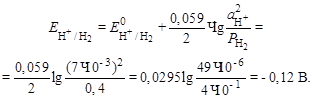
Потенциал хлорсеребряного электрода:
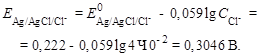
2. Рассчитаем напряжение: так как 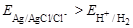 , поэтому хлорсеребряный электрод – катод.
, поэтому хлорсеребряный электрод – катод.
Е = Е(+) – Е(–) = 0,3046 – (– 0,120) = 0,4246 В.
3. Для составления уравнения реакции в ГЭ запишем уравнения электродных процессов:
| А: Н2 = 2Н+ + 2е– | |
| К: AgCl + e– = Ag + Cl– | ´2. |
Уравнение реакции:
2 AgCl + H2 = 2Ag + 2Cl– + 2 H+.
4.2. Потенциометрическое определение
рН – прямая потенциометрия
Мерой концентрации ионов водорода в растворе служит водородный показатель рН =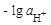 .
.
При расчете рН необходимо вначале найти величину Егэ, составленного из индикаторного электрода и электрода сравнения. В качестве индикаторного электрода используют электроды, потенциал которых зависит от рН раствора. Это водородный, хингидронный и стеклянный электроды.
Электроды сравнения – стандартный водородный, каломельный и хлорсеребряный. Величина потенциала электродов сравнения остается неизменной при изменении рН раствора. Потенциалы электродов см. в приложении 3.
Пример 1
Вычислить рН раствора по следующим данным: индикаторный электрод – водородный, Р(Н2) = 1 атм, электрод сравнения – насыщенный каломельный, Е = 0,590 В.
Решение: Е = Е(+) – Е(–) = Екал. – 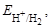
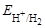 = 0 – 0,059× рН; отсюда 0,590 = 0,2415 + 0,059×рН;
= 0 – 0,059× рН; отсюда 0,590 = 0,2415 + 0,059×рН;
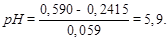
Пример 2
Вычислить рН раствора по следующим данным: индикаторный электрод – хингидронный, электрод сравнения – хлорсеребряный (х.с.) в 1 н. растворе KCl, Егэ = 0,20 В, t = 25 °С.
Решение: Ех.с.(1 н. KCl) = 0,22 В (см. приложение 3);
Ехингид. = Е°хингид. – 0,059× рН = 0,70 – 0,059×рН.
Так как Ехингидр.> Ех.с., то хлорсеребряный электрод в гальваноцепи играет роль анода, а хингидронный – катода.
Е = Е(+) – Е(–) = Ехингидр. – Ех.с.; 0,2 = 0,7 – 0,059 ×рН –0,22,
отсюда 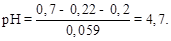
4.3. Потенциометрическое титрование
Титрование, при котором точка эквивалентности (ТЭ) (в которой количество эквивалентов определяемого вещества и титранта равны) определяется по скачку потенциала индикаторного электрода, называется потенциометрическим.
Кислотно-основное титрование
При кислотно-основном титровании для каждой точки титрования, указанной в задаче, рассчитывают рН или Егэ, состоящего из индикаторного электрода и электрода сравнения. Затем строят кривую титрования в координатах Егэ – объем титранта или рН – объем титранта, по кривой находят ТЭ.
Пример 1
Вычислить рН и Егэ в процессе титрования 0,1 н. раствора уксусной кислоты 0,1 н. раствором NaOH. Используется индикаторный электрод хингидронный, электрод сравнения – 1 н. каломельный, температура 20 °С. Расчетные точки: начальная, оттитровано 90 % кислоты; ТЭ.
Решение: 1. Для начальной точки титрования рассчитаем рН и Егэ. В начальной точке присутствует только слабый электролит – уксусная кислота.
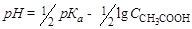
где рКа – константа диссоциации кислоты (находим в приложении 4).
рКа = – lg Ka = – lg (1,82×10–5) = 4,74;
pH = 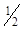 ×4,74 –
×4,74 – 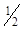 lg10–1 = 2,37 + 0,5 = 2,87.
lg10–1 = 2,37 + 0,5 = 2,87.
2. Определяем потенциал хингидронного электрода по уравнению Нернста:
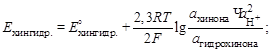
так как ахинона = агидрохинона, то
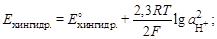
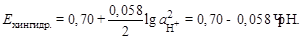
Потенциал 0,1 н. каломельного электрода находим в приложении 3:
Екалом. = 0,337 В.
Егэ = Ехингидр.– Екалом. = 0,70 – 0,058×рН – 0,337 = 0,363–0,058.×2,87 = 0,197 В.
3. Когда будет оттитровано 90 % уксусной кислоты, то получим буферный раствор, состоящий из уксусной кислоты и ацетата натрия. рН буферного раствора рассчитывается по уравнению:
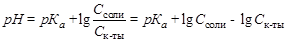
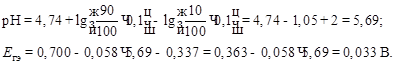
4. В ТЭ вся указанная кислота будет оттитрована, в растворе будет находиться только продукт нейтрализации кислоты – ацетат натрия CH3COONa, который подвергается гидролизу:
CH3COONa + Н2О = СН3СООН + NaOH,
рН раствора соли вычисляется по формуле:
рН = 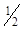 рКводы +
рКводы + 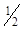 рКа +
рКа + 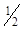 lg Ссоли =
lg Ссоли =
= 7 + 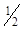 .4,74 + 1/2 lg 0,1 = 7 + 2,37 –0,5 = 8,87;
.4,74 + 1/2 lg 0,1 = 7 + 2,37 –0,5 = 8,87;
Егэ = 0,70 –0,058 × 8,87 – 0,337 = –0,151 В.
4.4. Окислительно-восстановительное титрование
Если в растворе протекает окислительно-восстановительная реакция
mOx.1 + nRed.2 ó mRed.1 + nOx.2,
где Ох – окисленная форма, Red – восстановленная форма, то ей соответствуют следующие электрохимические процессы: Ох1 + n e– ó Re d1
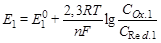
после ТЭ: Ох2 + m e– ó Red2
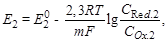
в ТЭ: ЕТЭ = Е1 = Е2:
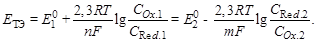
Сложив оба уравнения и предварительно умножив их на n и m, получим:
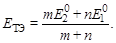
Например, при титровании солей железа(II) перманганатом калия:
5Fe2+ + MnO4– + 8H+ ó 5Fe3+ + Mn2+ +4H2O;
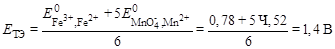 .
.
Система электродов: электрод сравнения и инертный Pt электрод, на котором происходит реакция окисления – восстановления.
Пример 2
Построить кривую титрования 100 мл 0,1 н. раствора Cu2SO4 0,1 н. раствором K2Cr2O7 в 1 н. H2SO4, температура опыта 20 °С.
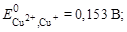
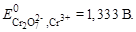
Решение: 1. Составим ионно-молекулярное уравнение окислительно-восстановительной реакции:
| Сu+ ó Cu2+ + e– | ´6 | |
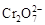 + 14 H+ + 6e– ó 2Cr3+ + 7H2O + 14 H+ + 6e– ó 2Cr3+ + 7H2O
| . |
6Cu+ + 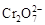 + 14 H+ = 6Cu2+ + 2Cr3+ + 7H2O
+ 14 H+ = 6Cu2+ + 2Cr3+ + 7H2O
2. Рассчитаем потенциалы в процессе титрования, используя уравнение Нернста. До ТЭ (избыток Cu+) потенциалопределяющей является реакция:
Cu+ ó Cu2+ + e–:
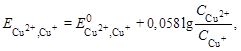
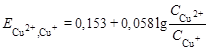 .
.
Для расчета потенциала нужно знать молярные концентрации окисленной (Cu2+) и восстановленной (Cu+) форм вещества. Для примера рассчитаем С(Сu2+) и C(Cu+) для точки, когда прилито 10 мл раствора K2Cr2O7 (без учета разбавления раствора).
С(Сu2+) = 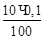 = 10–2 моль/л; С(Сu+) = 0,1 – 0,01 = 0,09 моль/л,
= 10–2 моль/л; С(Сu+) = 0,1 – 0,01 = 0,09 моль/л,
тогда
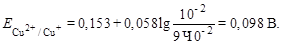
| Объем раствора K2Cr2O7, мл | 99,9 | ||||
| С(Сu2+), моль/л | 0,01 | 0,05 | 0,09 | 0,099 | 0,0999 |
| C(Cu+), моль/л | 0,09 | 0,05 | 0,01 | 0,001 | 0,0001 |
| Е(Сu2+, Cu+), В | 0,098 | 0,153 | 0,211 | 0,269 | 0,327 |
3. Рассчитаем потенциал в ТЭ:
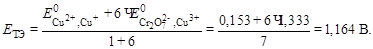
4. Рассчитаем потенциал после ТЭ, когда в избытке 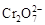 и протекает реакция:
и протекает реакция:
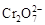 + 14 H+ + 6e– ó 2Cr3+ + 7H2O
+ 14 H+ + 6e– ó 2Cr3+ + 7H2O
Концентрация Cr3+ считаем постоянной и равной 0,1 моль/л.
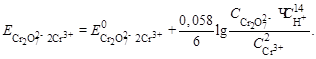
Считаем, что С(Н+) = 1 моль/л.
| Объем раствора K2Cr2O7, мл | 100,01 | 100,1 | |
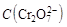 , моль/л , моль/л
| 10–5 | 10–4 | 10–3 |
| C(Cr3+), моль/л | 0,1 | 0,1 | 0,1 |
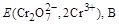
| 1,301 | 1,314 | 1,323 |
Для примера рассчитаем Е для точки, когда прилито 100,01 мл K2Cr2O7 (без учета разбавления):
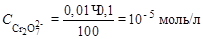
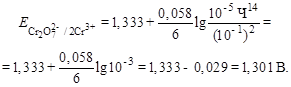
Потенциометрическое титрование по методу осаждения
В качестве индикаторных электродов в методе осаждения используют металлические серебро и ртуть, что позволяет определять концентрацию ионов серебра и ртути 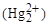 , а также
, а также 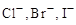 и др. ионы, которые образуют с ионами серебра и ртути малорастворимые соединения.
и др. ионы, которые образуют с ионами серебра и ртути малорастворимые соединения.
Электродами сравнения служат каломельный или хлорсеребряный электроды, контакт которых с исследуемым раствором осуществляется при помощи электролитического ключа с KNO3.
Рассмотрим титрование галогенид-ионов ионами серебра с серебряным индикаторным электродом. В растворе идет химическая реакция:
Ag+ + Hal–= Ag Hal(тв.), Кs(AgHal) = [Ag+] × [Hal–].
До точки эквивалентности потенциал электрода вычисляют по формуле:
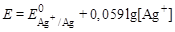 .
.
Концентрацию ионов Ag+ рассчитываем из произведения растворимости Ks: 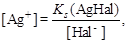 тогда
тогда
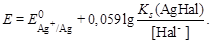
В точке эквивалентности [Ag+] = [Hal–] = 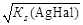 и потенциал электрода:
и потенциал электрода:
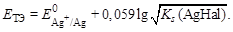
После ТЭ потенциал электрода рассчитывают по уравнению:
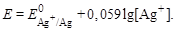
Пример
Рассчитать потенциалы серебряного электрода при титровании 0,1 н. раствора KSCN 0,1 н. раствором AgNO3 до начала титрования, в ТЭ, а также величину скачка потенциала в ТЭ.
Решение: 1. Уравнение реакции осаждения:
Ag+ + SCN– = AgSCN(тв.), Ks = 1 × 10–12.
Определяем потенциал серебряного электрода до титрования:
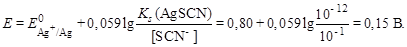
В точке эквивалентности:
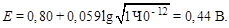
В начале скачка потенциала [SCN–] = 10–4 моль/л, так как недотитровано 0,1 % KSCN:
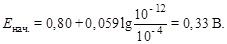
В конце скачка потенциала [Ag+] = 10–4 моль/л, так как избыток AgNO3 (0,1 н.) составляет 0,1 %. Тогда Екон. = 0,80 + 0,059× lg 10–4 = = 0,564 В.
Скачок потенциала равен Екон. – Енач. = 0,564 – 0,33 = 0,234 В.
5. Кондуктометрический метод анализа
Кондуктометрический метод анализа или кондуктометрия основана на измерении электропроводности растворов.
Электропроводность g – это величина обратная сопротивлению R.
Удельная электропроводность s представляет собой электропроводность 1 см3 раствора, находящегося между параллельными электродами, площадью 1 см2 каждый, расположенными на расстоянии 1 см.
Молярная электропроводность l – это электрическая проводимость раствора, содержащего 1 моль вещества, если раствор помещен между двумя параллельными электродами, расположенными на расстоянии 1 см.
Для решения задач рекомендуем использовать таблицу основных величин, применяемых в кондуктометрии (см. таблицу).
Основные величины, используемые в кондуктометрии
Пример 1
Сопротивление 0,1 н. раствора хлорида калия в ячейке с электродами площадью 1,2 см2 и расстоянием между ними 1,0 см, равно 21,5 Ом. Определите удельную и молярную электрическую проводимости.
Решение: 1. Определяем электропроводность раствора:
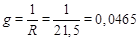 Ом–1.
Ом–1.
2. Определяем удельную электропроводность раствора:
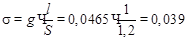 Ом–1×см–1.
Ом–1×см–1.
3. Определяем молярную электропроводность раствора:
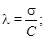
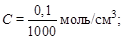
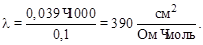
Пример 2
Определить удельную и молярную электропроводности 0,04 М раствора нитрата серебра в ячейке с круглыми электродами диаметром 1,2 см и расстоянием между ними 1,5 см. К ячейке приложено напряжение 0,6 В. Сила тока 5 мА.
Решение: для определения удельной электропроводности воспользуемся формулой:
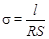 .
.
Рассчитаем площадь электрода: 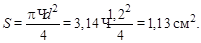
Рассчитаем сопротивление проводника:
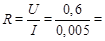 120 Ом.
120 Ом.
Подставим величины l, S и R в формулу:
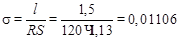 Ом–1×см–1.
Ом–1×см–1.
Определяем молярную электропроводность:
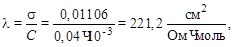
где С – концентрация раствора, моль/см3.
6. Кулонометрический метод анализа
Кулонометрический метод анализа основан на законе Фарадея, согласно которому количество прореагировавшего вещества прямо пропорционально количеству электричества, прошедшего через электрохимическую систему.
Математическая запись закона Фарадея:
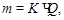
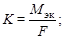
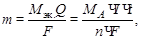
где К – электрохимический эквивалент, г/Кл; m – масса вещества, участвующего в электрохимических превращениях на электроде, г; Q – количество электричества, Кл; Q = I×t (где I – ток, А; t – время, с);
Мэк – молярная масса эквивалента, г/моль; Мэк = МА/n (где МА – молярная масса атома элемента, г/моль; n – валентность элемента);
F – постоянная Фарадея; F = 96500 Кл/моль-экв. = 26,8 А×ч/моль-экв.
Пример
При кулонометрическом титровании 10 мл бихромата калия раствором, содержащим железо (II), на восстановление 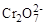 потребовалось 25 минут, при силе тока 100 мА. Определите Сэк раствора бихромата калия.
потребовалось 25 минут, при силе тока 100 мА. Определите Сэк раствора бихромата калия.
Решение: 1. Определяем количество электричества:
Q = It = 25× 60× 0,1 = 150 Кл;
2. Определяем количество эквивалентов K2Cr2O7
96500 Кл – 1 моль-экв
150 Кл – х х = 150/96500 = 0,0015 моль-экв.
3. Определяем Сэк раствора
0,0016 моль-экв – 10 мл
Сэк – 1000 мл Сэк = 0,16 моль/л.
7. Полярография и амперометрия
Пример 1. При полярографировании стандартных растворов свинца (II) получили следующие результаты:
| СPb×106, г/мл | 0,25 | 0,50 | 0,75 | 1,0 | 1,25 |
| h, мм | 2,0 | 4,0 | 6,0 | 8,0 | 10,0 |
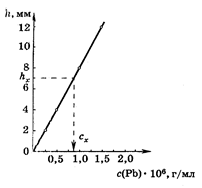 Навеску алюминиевого сплава массой 4,848 г растворили и раствор разбавили до 50,00 мл. Высота полярографической волны свинца в полученном растворе оказалась равной hх = 7,0 мм.
Навеску алюминиевого сплава массой 4,848 г растворили и раствор разбавили до 50,00 мл. Высота полярографической волны свинца в полученном растворе оказалась равной hх = 7,0 мм.
Вычислите массовую долю (%) свинца в образце.
Решение. Строим градуировочный график (см. рисунок) в координатах h – CPb.
По графику находим Сх =
= 0,87×10–6 г/мл, соответствующую
hx = 7,0 мм, и рассчитываем массовую долю (%) свинца в сплаве:
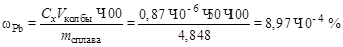
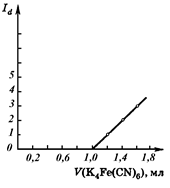
Пример 2. При амперометрическом титровании 10,00 мл раствора сульфата цинка с Т(ZnSO4/Zn) = 3,00×10–4 мг/мл поместили в мерную колбу вместимостью 50,00 мл и довели водой до метки. Аликвоту полученного раствора (10,00 мл) оттитровали раствором K4[Fe(CN)6)]. Результаты титрования:
| V(K4[Fe(CN)6], мл | 0,0 | 0,2 | 0,4 | 0,6 | 0,8 | 1,0 | 1,2 | 1,4 | 1,6 |
| Id, мА |
Вычислить условный титр раствора K4[Fe(CN)6] по цинку.
Решение. Строим кривую амперометрического титрования (рисунок) в координатах Id –V(K4[Fe(CN)6]) и находим, что в точке эквивалентности объем титранта равен: V(K4[Fe(CN)6]) = 1 мл.
 Вычисляем условный титр раствора K4[Fe(CN)6 по цинку:
Вычисляем условный титр раствора K4[Fe(CN)6 по цинку:
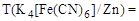
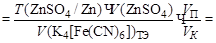
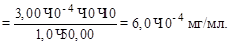
Пример 3. Навеску сульфата кобальта массой 2,500 г растворили, добавили НCl, желатину, пиридин и довели водой до метки в колбе на 100 мл.
Аликвоту раствора объемом 50,0 мл полярографировали и получили диффузионный ток 1,35 мкА. Затем в полярографическую ячейку добавили 5,00 мл стандартного раствора, содержащего 10–2 моль/л NiCl2, и получили диффузионный ток 3,8 мкА. Вычислить массовую долю (%) Ni в образце.
Решение. В соответствии с уравнением Ильковича
I1 = kC1; I2 = kC2,
где I1, I2 – диффузионные токи до и после прибавления стандартного раствора; С1 – начальная концентрация никеля, С2 – концентрация никеля после добавления стандартного раствора.
Если Сст – концентрация стандартного раствора, V – начальный объем раствора в полярографической ячейке, Vст – объем прибавленного стандартного раствора, то
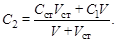
Отношение I1/I2 = c1/c2 преобразуем относительно с1:
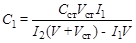 , или
, или 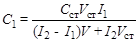 .
.
Подставляем числовые значения:
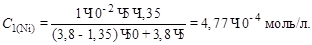
Массовая доля (%) никеля равна:
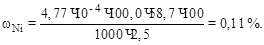
8. Хроматографический метод анализа
Метод заключается в предварительном разделении исследуемой смеси веществ на отдельные компоненты при пропускании ее через слой сорбента.
Качественный хроматографический анализ сводится к обнаружению компонентов смеси путем «проявления» – окрашивания пятен хроматограммы реагентами – проявителями. Количественный хроматографический анализ показывает содержание компонентов или по площади их пятен на хроматограмме, или по высоте в осадочной хроматографии, или по площади пиков в газожидкостной хроматографии.
Важной характеристикой ионитов в ионообменной хроматографии является значение их обменной емкости. Обменная емкость – число миллимоль эквивалентов поглощенных ионов, приходящееся на 1 г сухого ионита или 1 мл набухшего ионита (ммоль/г, ммоль/мл). В статических условиях – это статическая обменная емкость. В динамических условиях может быть определена полная динамическая обменная емкость (ПДОЕ):
- емкость ионита при полном его насыщении поглощенными ионами, а также динамическая обменная емкость (ДОЕ);
- емкость ионита до проскока поглощаемых ионов.
Пример 1 (качественный хроматографический анализ).
Смесь катионов, содержащихся в молоке, при разделении в тонком слое оксида алюминия с помощью ацетона, содержащего 12 % воды и 12 % конц. HCl, дала после проявления K4[Fe(CN)6] три пятна со значениями Rf 0,37; 0,66; 0,79 соответственно.
Пробы катионов-свидетелей, помещенных на ту же пластинку, дали Rf Ni2+ – 0,37; Co2+ – 0,54; Cu2+ – 0,67; Fe3+ – 0,79. Определить катионы, входящие в состав молока.
Решение: Rf – коэффициент пробега, равный отношению длины пробега данного вещества от стандартной линии до центра пятна к длине пробега растворителя. Rf всегда меньше 1. Так как одинаковые вещества имеют в одних и тех же условиях разделения одинаковый Rf , то сравнивая длину пробега веществ-свидетелей и пятен компонентов смеси, можно сделать вывод о присутствии в смеси веществ, идентичных свидетелям.
Следовательно, в смеси присутствуют катионы: Ni2+, Cu2+, Fe3+.
Пример 2, 3, 4, 5 (количественный хроматографический анализ).
Пример 2
Для определения никеля в ферритах методом бумажной хроматографии по площади пятна на бумаге, пропитанной диметилглиоксимом с водой в качестве растворителя, были получены следующие данные:
| Концентрация Ni, С, мг/0,2 мл | 0,12 | 0,14 | 0,90 | 1,29 | 1,65 |
| Площадь пятна, мм2 | 26,0 | 44,0 | 66,5 | 83,0 | 105,0 |
При анализе феррита его навеску 500 мг растворили в кислоте и разбавили до 25 мл. Пипеткой на хроматографическую бумагу нанесли 0,2 мл раствора и после хроматографического разделения определили площадь пятна S. Получили S = 52,5 мм2. Определить содержание никеля в феррите (в %).
Решение: 1. Строим градуировочный график в координатах S – CNi.
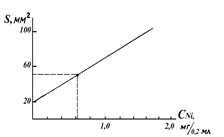 2. По графику находим
2. По графику находим
CNi мг/0,2 мл, соответствующую
S = 52,5 мм2;
CNi = 0,63 мг/0,2 мл.
3. Находим содержание СNi в мг/25 мл раствора:
0,2 мл раствора – 0,63 мг Ni
25 мл р-ра – х
х = 78,75 мг.
4. Находим процентное содержание Ni в навеске 500 мг феррита:
500 мг – 100%
78,75 мг – х х = 15,76 %.
Пример 3
Для хроматографического определения никеля на бумаге, пропитанной диметилглиоксимом с водой в качестве растворителя, приготовили три стандартных раствора. Для этого навеску NiCl2.5H2O, равную 200 мг, растворили в мерной колбе на 50 мл. Затем из этой колбы взяли 5, 10 и 20 мл раствора и разбавили в мерной колбе на 50 мл. Высота пиков стандартных растворов равна h1, h2, h3, а исследуемого hx.
| Высота пиков, мм | |||
| h1 | h2 | h3 | hx |
| 20,5 | 41,0 | 82,0 | 33,0 |
Определить содержание никеля (мг) в исследуемом растворе.
Решение: высота пиков в осадочной хроматографии пропорциональна количеству вещества. Для определения содержания никеля в растворе необходимо построить градуировочный график в координатах h – CNi. Поэтому рассчитаем концентрацию никеля, соответствующую высоте пика:
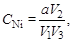
где а – навеска, мг; V – объемы: V1 = 50 мл, V2 = 5, 10, 20 мл соответственно, V3 = 50 мл. Тогда
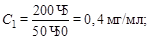
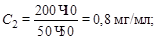
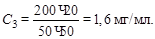
По найденным значениям CNi строим градуировочный график (см. рисунок).
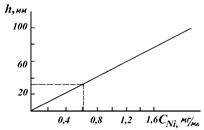 По графику находим концентрацию никеля в исследуемом растворе (Сх), соответствующую hx = 33 мл;
По графику находим концентрацию никеля в исследуемом растворе (Сх), соответствующую hx = 33 мл;
Сх = 0,65 мг/мл.
Находим содержание никеля в мг в 50 мл исследуемого раствора (ах):
ах = СхV = 0,65 . 50 = 32,5 мг.
Пример 4
Через колонку, содержащую 5,0 г катионита, пропустили 250,0 мл 0,050 М ZnSO4. Вытекающий из колонки раствор собирали порциями по 50,0 мл, в каждой порции определяли содержание ионов цинка
и получили следующие значения концентрации (моль/л): 1 – 0,008;
2 – 0,029; 3 – 0,038; 4 – 0,050; 5 – 0,050.
Определить полную динамическую емкость (ммоль/г) катионита.
Решение: вычисляем количество эквивалента Zn2+, поглощенное катионитом из каждой порции раствора, принимая молярную массу эквивалента равной M(1/2 Zn2+):
1) 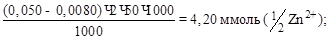
2) 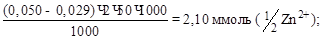
3) 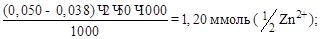
4 и 5) 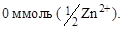
Всего в пяти порциях раствора поглощено:
4,20 + 2,10 + 1,20 = 7,50 ммоль(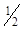 Zn2+).
Zn2+).
Отсюда полная динамическая емкость катионита для иона цинка равна:
К = 7,5/5 = 1,50 ммоль/г (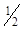 Zn2+).
Zn2+).
Пример 5
Определить массовую долю (%) компонентов газовой смеси по следующим данным:
| Компонент смеси | Пропан | Бутан | Пентан | Циклогексан |
| S, мм2 | ||||
| k | 0,68 | 0,68 | 0,69 | 0,85 |
Решение: расчеты проводим по методу внутренней нормализации, согласно которому
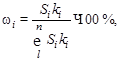
где wi – массовая доля i-го компонента в смеси, %; Si – площадь пика i-го компонента; ki – поправочный коэффициент, определяемый чувствительность детектора хроматографа к i-му компоненту.
Найдем приведенную суммарную площадь пиков:
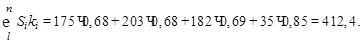
Отсюда массовая доля (%) пропана равна:
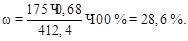
Аналогично находят массовые доли остальных компонентов смеси: w (бутана) = 33,46 %, w (пентана) = 30,46 %, w (циклогексана) = = 7,22 %.
При выполнении анализа по методу внутреннего стандарта расчет проводят по формуле:
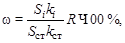
где Sст – площадь пика вещества, введенного в качестве внутреннего стандарта; kст – его поправочный коэффициент; R – отношение массы внутреннего стандарта к массе анализируемой пробы.
Список литературы
1. Крешков А.П. Основы аналитической химии. – М.: Химия, 1977. – Т. 3.
2. Практикум по физико-химическим методам анализа / Под ред. О.М. Петрухина. – М.: Химия, 1987.
3. Физико-химические методы анализа / Под ред. В.Б. Алесковского. – Л.: Химия, 1988.
4. Ляликов Ю.С. Физико-химические методы анализа. – М.: Химия, 1974.
5. Васильев В.П. Теоретические основы физико-химических методов анализа. – М.: Высшая школа, 1979.
6. Барковский В.Ф., Горелик С.М., Городенцева Т.В. Физико-химические методы анализа. – М.: Высшая школа, 1972.
7. Лабораторные работы по физико-химическим методам анализа. – Новосибирск: НГТУ, 2004.
Приложение 1
Атомные, групповые рефракции и рефракции связей
| Атомные рефракции | Групповые рефракции | Рефракции связей | |||
| Атом | RА | ||||
| Н С О в: гидроксиле эфирах карбониле Сl – Br – I – N в алифатических аминах: первичных вторичных третичных N в нитрилах Инкремент: С=С связи СºС связи | 1,100 2,418 1,525 1,643 2,211 5,967 8,865 13,900 2,322 2,502 2,840 3,070 1,733 2,298 | СН3 – С2Н5 – С3Н7 – СН2 – С3Н5 – (аллил) НО – (спирты) – СОО (сложные эфиры) – СООН – С – || О (кетоны) | 5,653 10,3 14,965 4,647 14,52 2,546 6,2 7,226 4,601 | С – Н С – С С = С С – С (циклогексан) С = С (ароматич.) С – F C – Cl C – Br C – I C = O (спирты, простые эфиры) – C = O С – N O – H (спирты) О – Н (кислоты) N – H | 1,676 1,296 4,17 1,27 2,688 1,44 6,51 9,39 14,61 1,54 3,32 1,57 1,66 1,80 1,76 |
Приложение 2
Стандартные окислительно-восстановительные (редокс) потенциалы
в водных растворах при 25 °С
| Символ элемента | Уравнение реакции | Е0, В |
| Ag Al As Br C Ce Cd Cl Co Cr Cu Ga Fe I In | Ag+ + e ó Ag Al3+ + 3e ó Al As5+ + 2e ó As3+ H3AsO4 + 2H+ + 2e ó HAsO2 + 2H2O AsO43– + 2H2O + 2e ó AsO2– + 4OH– Br2 + 2e ó 2Br– BrO3– + 6H+ + 6e ó Br– + 3Н2О BrO3– + 2H2O + 4e ó BrO– + 4OH– HCOOH +4H+ + 4e ó CH3OH + H2O 2CO2 +2H+ + 2e ó H2C2O4 Ce4+ + e ó Ce3+ Cd2+ + 2e ó Cd Cl2 + 2e ó 2Cl– ClO3– + 6H+ + 6e ó Cl– + 3H2O ClO3– + 3H2O + 6e ó Cl– + 6OH– Co3+ + e ó Co2+ Co3+ +3e ó Co Co2+ + 2e ó Co Cr3+ + e ó Cr2+ Cr2+ +2е ó Cr Cr2O72– + 14H+ + 6e ó 2Cr3+ + 7H2O Cu2+ + 2e ó Cu Cu2+ + e ó Cu+ Ga3+ +3e ó Ga Fe2+ + 2e ó Fe Fe3+ + e ó Fe2+ I2 + 2e ó 2I– IO3– +6H+ + 6e ó I– + 3H2O In3+ + 3e ó In | 0,799 –1,662 0,56 0,56 –0,71 1,087 1,45 0,54 0,125 –0,49 1,44 –0,403 1,36 1,45 0,63 1,84 0,33 –0,28 –0,41 –0,91 1,33 0,337 0,153 –0,56 –0,44 0,77 0,54 1,08 –0,33 |
О к о н ч а н и е п р и л. 2
| Символ элемента | Уравнение реакции | Е0, В |
| Mn N Ni O Pb S Sn Ti V Zn | MnO2 + 4H+ + 2eó Mn2+ +2H2O MnO4– + e ó MnO42– MnO4– + 4H+ +3e ó MnO2 + 2H2O MnO4– + 2H2O +3e ó MnO2 + 4OH– MnO4– + 8H+ + 5e ó Mn2+ + 4H2O NO3– + H2O + 2e ó NO2– + 2OH– NO3– + 4H+ + 3e ó NO + 2H2O HNO2 + H+ + e ó NO + H2O Ni2+ + 2e ó Ni O2 + 4H+ + 4e ó 2H2O O2 + 2H+ + 2e ó H2O2 Pb2+ + 2e ó Pb Pb4+ + 2e ó Pb2+ PbO2 + 4H+ + 2e ó Pb2+ + 2H2O PbSO4 +2e ó Pb + SO42– 2SO32– + 6H+ +4e ó S2O32– +3H2O SO42– + 2H+ + 2e ó SO32– + H2O SO42– + H2O + 2e ó SO32– + 2OH– Sn2+ + 2e ó Sn Sn4+ + 2e ó Sn2+ Ti2+ + 2e ó Ti VO2+ + 2H+ + e ó VO2+ + H2O Zn2+ + 2e ó Zn | 1,23 0,56 1,69 0,6 1,51 0,01 0,96 0,99 –0,236 1,23 0,68 –0,126 1,8 1,455 –0,356 0,71 0,22 –0,93 –0,14 0,15 –1,63 1,00 –0,76 |
Приложение 3
Потенциалы электродов сравнения при 25 °С
| Электрод | Уравнение реакции | Е, В |
| Каломельный 0,1 н KCl 1,0 н KCl нас. KCl Хлорсеребряный 1 н KCl нас. KCl | Hg2Cl2(к) + 2е ó 2 Hg(ж) + 2Cl– AgCl(к) + е ó Ag(к) + Сl– | 0,337 0,282 0,2415 0,220 0,204 |
Приложение 4
Константы ионизации некоторых кислот (Ка) и оснований
(Кb) при 25 °С
| Кислота | Ка | рКа |
| HNO2 HCN HClO H2S H3BO3 H3PO4 CH3COOH | 5,1×10–6 6,2×10–10 5×10–8 К1 = 1,1×10–7 К2= 1,3×10–13 К1 = 5,8×10–10 К1 = 7,6×10–3 К2 = 6,2×10–8 К3 = 4,2×10–13 К1 = 1,75×10–5 | 5,3 9,21 7,3 6,99 12,89 9,24 2,12 7,21 12,38 4,76 |
| Основание NH4OH Pb(OH)2 | Кb 1,76×10–5 K1 = 9,55×10–4 K2 = 3×10–8 | pKb 4,755 3,02 7,52 |
Приложение 5
Произведения растворимости малорастворимых в воде
соединений (при 25 °С)
| Формула вещества | Произведение растворимости Кs |
| AgBr | 4,4×10–13 |
| AgCl | 1,6×10–10 |
| AgCNS | 1,1×10–12 |
| PbI2 | 9,8×10–9 |
| CdS | 1,2×10–28 |
| CuC2O4 | 3×10–8 |
ОГЛАВЛЕНИЕ
I. Общие методические указания ................................................................................. 3
II. Рабочая программа .................................................................................................... 3
III. Контрольные задания............................................................................................... 3
1. Рефрактометрический метод анализа..................................................................... 6
1.1. Задание ................................................................................................................ 6
1.2. Вопросы и упражнения.................................................................................... 7
2. Фотометрический метод анализа............................................................................. 9
2.1. Задание................................................................................................................. 9
2.2. Задание............................................................................................................... 11
2.3. Вопросы и упражнения ................................................................................. 14
3. Поляриметрический метод анализа...................................................................... 15
Задание ..................................................................................................................... 15
4. Потенциометрический метод анализа.................................................................. 16
4.1. Задание .............................................................................................................. 16
4.2. Задание. Прямая потенциометрия.............................................................. 18
4.3. Задание. Потенциометрическое титрование........................................... 18
4.4. Задание. Окислительно-восстановительное титрование..................... 20
4.5. Вопросы и упражнения ................................................................................. 20
5. Кондуктометрический метод анализа ................................................................. 22
5.1. Задание............................................................................................................... 22
5.2. Вопросы и упражнения.................................................................................. 24
6. Кулонометрический метод анализа...................................................................... 26
6.1. Задание............................................................................................................... 26
6.2. Вопросы и упражнения.................................................................................. 27
7. Полярография и амперометрическое титрование............................................. 28
7.1. Задание. Полярография ................................................................................ 28
7.2. Задание. Амперометрическое титрование............................................... 31
7.3. Вопросы и упражнения ................................................................................. 32
8. Хроматографический метод анализа.................................................................... 34
8.1 Задание................................................................................................................. 34
8.2. Вопросы и упражнения................................................................................... 42
IV. Примеры решения задач по разделам................................................................ 43
1. Рефрактометрический метод анализа.......................................................... 43
2. Фотометрический метод анализа ................................................................. 45
3. Поляриметрический метод анализа ............................................................. 47
4. Потенциометрический метод анализа ......................................................... 49
5. Кондуктометрический метод анализа ......................................................... 58
6. Кулонометрический метод анализа.............................................................. 61
7. Полярография и амперометрическое титрование .................................... 62
8. Хроматографический метод анализа ......................................................... 64
Список литературы ....................................................................................................... 68
Приложение 1. Атомные, групповые рефракции и рефракции связей ............. 69
Приложение 2. Стандартные окислительно-восстановительные (редокс) потенциалы в водных растворах при 25 °С ....................................................................................................... 70
Приложение 3. Потенциалы электродов сравнения при 25 °С ......................... 71
Приложение 4. Константы ионизации некоторых кислот (Ка) и оснований (Кb) при 25 °С 72
Приложение 5. Произведения растворимости малорастворимых в воде соединений (при 25 °С) 72

Аналитическая химия
Программа
Методические указания
Редактор Л.Н. Ветчакова Технический редактор Г.Е. Телятникова Компьютерная верстка В.Ф. Ноздрева– Конец работы –
Используемые теги: Сравните, найденную, рефракцию, вычисленной, таблицам, атомных, рефракций, рефракций, связей0.122
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Сравните найденную рефракцию с вычисленной по таблицам атомных рефракций и рефракций связей
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов