рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Б) Реакции гидроксильной группы
Реферат Курсовая Конспект
Б) Реакции гидроксильной группы
Б) Реакции гидроксильной группы - раздел Химия, ПРОГРАММА БЛОКА ГЕТЕРОФУНКЦИОНАЛЬНЫЕ УГЛЕВОДОРОДЫ 1. Реакция Ацилирования.При Ацилировании Гидроксикарбоно...
1. Реакция ацилирования.При ацилировании гидроксикарбоновых кислот галогенангидридами получаются сложные эфиры. Для ацилирования можно использовать и ангидриды кислот:
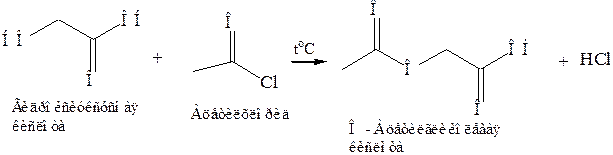
2. Реакция с галогеноводородами.Происходит нуклеофильное замещение спиртовой гидроксильной группировки на галоген и получаются галоген замещенные кислоты:
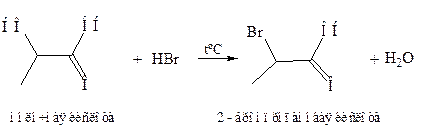
3. Реакция окисления.При окислении гидроксикислот получаются оксокарбоновые кислоты (альдегидо- и кетокислоты).
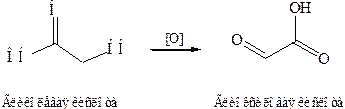
4. Совместные реакции гидроксильной и карбоксильной групп.Взаимодействие гидроксильных и карбоксильных групп может привести к образованию циклических сложных эфиров лактонов или лактидов. Слабые α-лактоны до сих пор не получены.
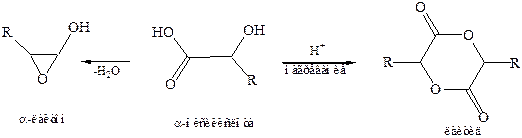
5. Рекция α-оксикислоты в растворе серной концентрированной кислоты.В ходе реакции оксикислота расщепляется с выделением СО и Н2О, в результате α-оксикислоты превращаются в альдегиды или кетоны:
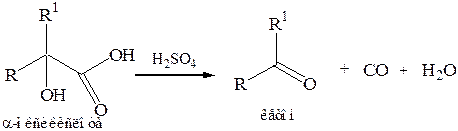
6. Стереохимия реакций присоединения к этиленовой связи на примере галогенирования цис- и транс-бутенов, малениновой и фумаровой кислот. Интересно проследить взаимоотношение цис-транс-изомеров и оптических изомеров. Его можно проиллюстрировать на отношении малеиновой и фумаровой кислот к винным. Оказывается, при окислении перманганатом в воде (по Вагнеру) фумаровая кислота образует рацемическую смесь левой и правой винных кислот, а малеиновая — мезовинную кислоту:
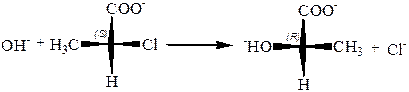
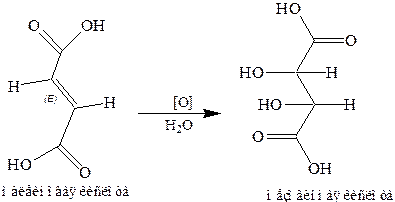
Течение процессов становится ясным при взгляде на формулы, а еще лучше – на модели. Однако только окисление по Вагнеру может служить методом отличия цис-изомеров от транс-изомеров по оптической деятельности продукта присоединения (конечно, после разделения рацемата на антиподы) или не деятельности и не расщепления продукта реакции на антиподы. Другие присоединения по ϭ-связи, например присоединение молекулы брома, проходят, наоборот, в цис-транс-положение. Чтобы понять это, необходимо познакомиться с так называемым валъденовским обращением (или оптической инверсией, 1896 г.).
7. Вальденовское обращение.Смысл явления состоит втом, что нуклеофильное замещение типа SN1 у асимметрического углеродного атома, где это легко обнаружить, а на деле у всякого предельного углеродного атома, протекает с обращением конфигурации. Пример вальденовского обращения:
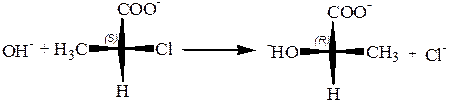
Согласно гипотезе Хьюза и Уинстейна реакция протекает с двойным обращением:
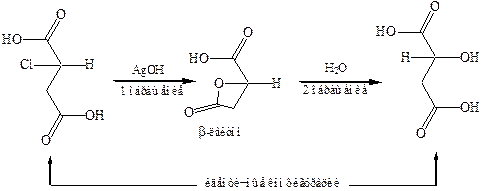
Реакции бимолекулярного нуклеофильного замещения у неасимметрического предельного углеродного атома, конечно, проходят по этому же типу: с атакой нуклеофильного заместителя с противоположной стороны от замещаемого атома, выплощением в переходном состоянии остальных групп, связанных с углеродом, и выворачиванием их в конечном продукте:
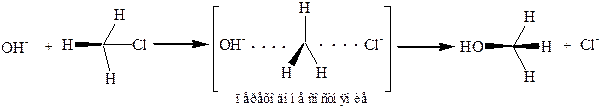
Вальденовское обращение является правилом для реакций нуклеофильного замещения, протекающих как реакции второго порядка (SN2). Единственное исключение – это реакции «с участием соседнего атома», подобные приведенной выше реакции с промежуточной циклизацией в лактон.
Однако это является исключением лишь в том смысле, что изолируемый конечный продукт реакции имеет ту же конфигурацию, что исходный. По существу, эти реакции протекают с двойным вальденовским обращением и, значит, являются не исключением, а подтверждением общего правила.
Реакции нуклеофильного замещения первого порядка (SN1) протекают с предварительной диссоциацией исходного соединения на катион и анион:
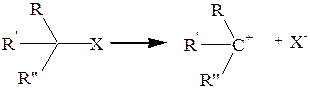
и в принципе должны иметь результатом рацемизацию, так как катион должен приобрести плоскую конфигурацию, и нуклеофил, заменяющий X, может атаковать его как справа, так и слева. Фактически рацемизация иногда бывает частичной, поскольку катион не всегда успевает до атаки выплощиться, а анион X не всегда успевает отойти достаточно далеко и экранирует одну сторону плоскости (иногда в экранировании принимает участие и растворитель.)
Оксикислоты в природе.α-гидроксикарбоновые кислоты широко распространены в природе, причем встречаются в природных источниках только в виде L-элементов. Многие алифатические оксикислоты имеют природное происхождение и встречаются в различных растениях, а также участвуют в обменных процессах живого организма.
Гликолевая кислота встречается в свекле и винограде, молочная кислота, как уже отмечалось выше, является продуктом жизнедеятельности некоторых бактерий, например, обеспечивающих молочнокислое брожение молока и многих овощей при консервировании, квашении капусты и засолке огурцов.
Молочная кислота является естественным консервантом, и се накапливание предохраняет продукты от дальнейшего разложения. В организме человека D-молочная кислота образуется в мышцах при физической нагрузке в результате расщепления глюкозы через стадию образования простейшей кетокислоты - пировиноградной кислоты, и се повышенная концентрация воспринимается как мышечная усталость.
Яблочная кислота содержится в недозрелых яблоках, рябине, клюкве и многих других плодах. Там же находится и D-винная кислота, которая в виде калиевой соли выпадает в осадок при брожении вина, откуда се и получают. Много лимонной кислоты, естественно, содержится в лимонах, однако поскольку в нашей стране лимоны не растут, то ее выделяют из махорки после предварительного извлечения никотина, а также из зеленой массы хлопчатника.
Салициловая кислота известна главным образом как предшественник ацетилсалициловой кислоты – аспирина. Метилсалицилат и салол также являются лекарственными препаратами.
Широко распространены в природе полиоксибензойиые кислоты, которые содержатся в виде гликозидов во многих растениях: протокатеховая кислота (1) и ее производные – ванилиновая (2), изованилиновая (3) кислоты. Из триоксибензойных кислот наибольшее значение имеет галловая кислота, которая в виде производных широко распространена в природе, в частности она находится в коре дуба, гранатового дерева, листьях чая и чернильных орешках – наростах на тканях растений, образующихся в результате некоторых заболеваний, вызываемых паразитами. Ранее из чернильных орешков, содержащих производные галловой кислоты, изготавливали чернила. Соли оксикислот. входящих в состав чернильных орешков, с двухвалентным железом, неокрашены и растворимы в воде. На воздухе они легко окисляются в производные трехвалентного железа, имеющие черный цвет и нерастворимые в воде. Реакция окисления идет во времени, и для того чтобы чернила были видны на бумаге сразу после нанесения, в них добавляли краситель синего цвета.
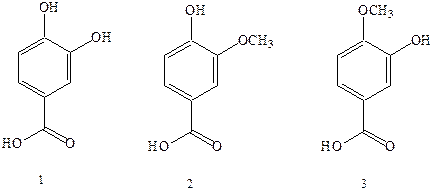
Другое название чернильных орешков – дубильные орешки – обусловлено тем, что из них извлекают таннин – вещество, обладающее дубильными свойствами, то есть способностью превращать шкуру животного в кожу. Процесс дубления основан на сшивке белковых цепей в трехмерную структуру, обеспечивающую высокую прочность кожи.
Применение оксикислот.Оксикислоты широко распространены в растительном мире. Гликолевая кислота встречается во многих растениях (свекла, виноград). Молочная кислота является продуктом жизнедеятельности ряда бактерий. Она с незапамятных времен используется как консервирующее и предохраняющее от гниения вещество. Кислое молоко, простокваша, кефир, варенец – продукты молочнокислого брожения молока: молочный сахар – лактоза превращается в молочную кислоту, и она свертывает, «створаживает» белок (казеин молока). Приготовление кислой капусты, моченых яблок, солка огурцов, помидоров, арбузов и т. д. – этовсе процессы молочнокислого брожения сахаров,содержащихся в этиховощах и плодах. Накапливающаяся молочная кислота обеспечивает сохранность заготовленных овощей. Силос – продукт молочнокислого брожения ботвы и зелени. Все сказанное относится к L- и D-молочным кислотам. В мышцах содержится мясомолочная кислота, которая образуется изглюкозы подобным образом и накапливается во время работы мышцы. Ее предшественником является простейшая кетокислота пировиноградная, восстанавливающаяся в молочную.
Яблочная кислота найдена врябине, незрелых яблоках, листьях махорки и многих другихплодах. Яблочную кислоту используют в органическом синтезе и медицине. Соли ее называют малаты.
Лимонная кислота находится во многих растениях, в том числе в плодах лимона, откуда и добывается. У нас эту кислоту добывают из махорки после извлечения никотина, а также из ботвы хлопчатника (А.С Садыков). Ее получают также особым лимоннокислым брожением сахаров (глюкозы, мальтозы, патоки) с помощью цитромицетов.
Все эти оксикислоты безвредны для человека и многие их них (молочную, винную, лимонную) применяют в кулинарии и для изготовления напитков.
Лимонная кислота распространена в природе (лимонный сок, табачные листья). Лимонную кислоту применяют в пищевой промышленности и фармакологии. Сложные эфиры лимонной кислоты используют в качестве пластификаторов. Ее соли называют цитраты.
Салициловая кислота встречается в природных продуктах, в основном в виде метилового эфира. Синтетически получают из фенола. Соли ее – салицилаты. Салициловую кислоту и ее производные используют в медицине, например ацетилсалициловою (аспирин), фениловый эфир салициловой кислоты (салол).
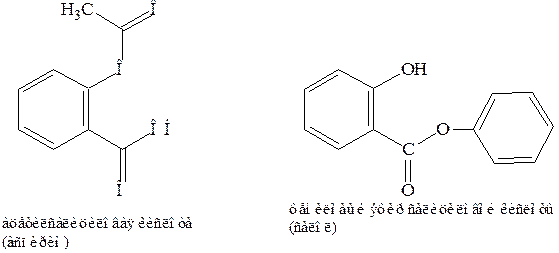
Галловая кислота содержится в природных продуктах (дубильных веществах, танине), из которых ее и получают.
Водные растворы дубильных веществ используют для денатурации белков (главным образом при обработке кожевенного сырья). Дубильные вещества содержатся в чернильных (дубильных) орешках, листьях чая и в дубовой коре. Главной составной частью дубильных веществ являются танины. Некоторые танины представляют собой гликозиды галловой кислоты. Галловую кислоту используют для синтеза красителей, для получения пирогаллола и в качестве аналитического реагента, а так же в качестве консерванта для многих пищевых продуктов (жиры, молочные продукты, рыба). Обычно для консервации используют соединения галловой кислоты, например гликозиды.
– Конец работы –
Эта тема принадлежит разделу:
ПРОГРАММА БЛОКА ГЕТЕРОФУНКЦИОНАЛЬНЫЕ УГЛЕВОДОРОДЫ
ГЕТЕРОФУНКЦИОНАЛЬНЫЕ УГЛЕВОДОРОДЫ УГЛЕВОДЫ Углеводы служат основным... НЕСАХАРОПОДОБНЫЕ ПОЛИСАХАРИДЫ Строение высших... АМИНОКИСЛОТЫ...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Б) Реакции гидроксильной группы
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов