ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫ С НЕСКОЛЬКИМИ ГЕТЕРОАТОМАМИ - раздел Химия, ПРОГРАММА БЛОКА ГЕТЕРОФУНКЦИОНАЛЬНЫЕ УГЛЕВОДОРОДЫ Среди Гетероциклических Соединений Наиболее Многочисленна И Разнообразна Груп...
Среди гетероциклических соединений наиболее многочисленна и разнообразна группа пятичленных гетероциклов, содержащих более одного гетероатома. Большинство этих циклических систем можно формально получить из фурана, пиррола и тиофена заменой одной или более групп — СН на гетероатом азота. Возможность варьирования числа и расположения атомов азота в кольце приводит к структурному многообразию гетероциклов.
Имидазол – более сильное основание, чем пиразол, что проявляется в образовании межмолекулярных водородных связей, а, следовательно, и в более высокой температуре его кипения по сравнению с пиразолом:
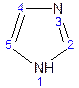
Оба атома азота в имидазоле (как и в пиразоле), эквивалентны и атом водорода легко мигрирует между ними. Имидазол образует соли как с сильными кислотами, так и со щелочными и щелочноземельными металлами. Водородные связи имидазола:
Ароматическая p-электронная система имидазола (как и пиразола), образована за счет трех электронов атомов углерода и трех электронов атомов азота. Однако следует отметить, что в 6 p-электронном сопряжении атомы азота участвуют неодинаково: один из атомов азота отдает в p-электронную систему электрон (пиридиновый азот), а другой атом азота – два электрона (пиррольный азот).
Реакции электрофильного замещения в ряду имидазола могут протекать либо по атомам азота (алкилирование и ацилирование), либо по атомам углерода в положения 4 и 5 по месту наибольшей электронной плотности: нитрование, сульфирование, галогенирование. Механизм и ориентация реакции электрофильного замещения:
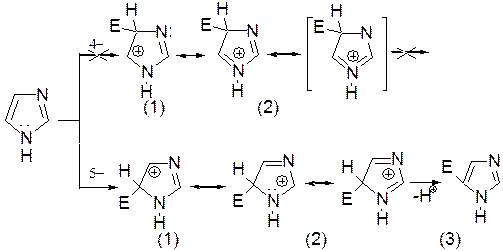
Замещенный 4,5-диметилимидазол не вступает в реакцию нитрования:
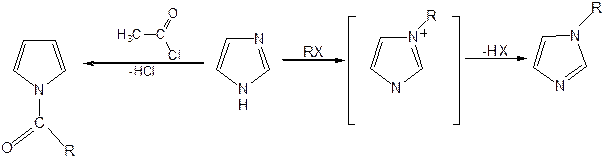
Ацилирование имидазола имеет большое биологическое значение: с помощью N-ацилимидазолов осуществляются реакции ферментативного переацилирования.
Пиразол.Введение второго атома азота в пиррол сильно стабилизирует молекулу, понижая электронную плотность в цикле, поэтому пиразол вступает в реакции электрофильного замещения намного труднее, чем пиррол:
Ароматическая природа пиразола связана с наличием сопряженной 6 p-электронной системы, в которую входят три электрона от атомов углерода и три электрона от атомов азота и имеют равную принадлежность протона каждому из этих атомов.
Расположенные рядом два атома азота в силу своей электро-отрицательности являются источником сильного –I эффекта. Соседние с атомами азота углеродные атомы вследствие этого несут некоторый избыток положительного заряда. Поэтому реакции электрофильного замещения в пиразоле идут в положении 4, как наиболее удаленном от атомов азота:
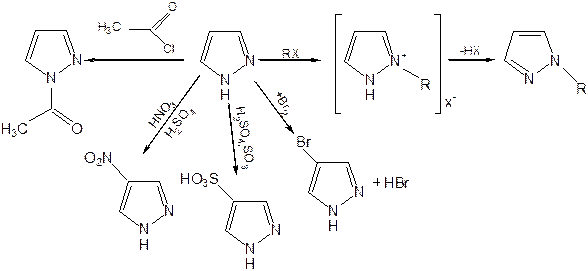
Пиразол является слабым основанием и слабой кислотой. Атом водорода при азоте довольно легко замещается на щелочные металлы, магний, серебро. Ряд производных пиразола применяются как лекарственные препараты, красители, люминесцентные вещества и др. Среди фармацевтических препаратов это - антипирин, пирамидон, анальгин:
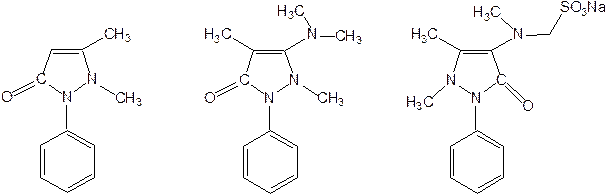
Все темы данного раздела:
ПРОГРАММА БЛОКА ГЕТЕРОФУНКЦИОНАЛЬНЫЕ УГЛЕВОДОРОДЫ.
Углеводы. Моносахариды.Определение, общая формула. Классификация. Номенклатура, изомерия. Структурные и проекционные формулы, антиподы, диастереомеры. D- и L-ряды. Фо
УГЛЕВОДЫ
Углеводы являются важным классом природных органических соединений. Значение углеводов определяется той доминирующей ролью, которая отводится им в живых организмах, и сложностью выполняемых ими фун
МОНОУГЛЕВОДЫ
Классификация. Моносахариды (монозы) классифицируют по количеству атомов углерода и по характеру карбонильной группы.
По количеству атомов углерода:
Химическое строение моносахаридов
Карбонильные формы моносахаридов.Для выяснения строения и стереохимии моносахаридов химикам потребовалось более ста лет. В результате многолетних исследований было установлено,
Способы получения моносахаридов
1. Гидролиз ди- и полисахаридов, который происходит под действием кислот или ферментов, водные растворы щелочей не способствуют гидролизу:
Реакции карбонильных форм моносахаридов
1.1 Окисление. Реакции окисления используют в структурных исследованиях и биохимических анализах для обнаружения моносахаридов. Монозы легко окисляются, причем в зависимости от
Реакции с участием всех гидроксильных групп
2.2.1 Алкилирование. При действии на моносахариды более сильных алкилирующих агентов, например алкилгалогенидов, наряду с гликозидным гидроксилом в реакцию вступают все спиртов
ОЛИГОСАХАРИДЫ
Олигосахариды – сахароподобные сложные углеводы, характеризую-щиеся сравнительно невысокой (несколько сотен) молекулярной массой, хорошей растворимостью в воде, легкой кристаллизацией и, как правил
ДИСАХАРИДЫ
Строение дисахаридов.В зависимости от моносахаридных компонентов олигосахариды (подобно полисахаридам) делятся на:
· гомоолигосахариды, построенные из молекул одного монос
Получение дисахаридов
Практически дисахариды извлекают из природных источников в виде гликозидов. Некоторые из них могут быть получены путем неполного гидролиза полисахаридов. Природные источники являются в настоящее вр
Номенклатура олигосахаридов
Большинство встречающих в природе олигосахаридов имеют тривиальные, общеупотребимые названия (целлобиоза, лактоза, мальтоза, трегалоза, стахиоза, сахароза, рафиноза и целлотриоза), которые им были
Свойства дисахаридов
Дисахариды представляют собой твердые вещества или некристаллизующиеся сиропы, которые растворимы в воде. Как аморфные, так и кристаллические дисахариды плавятся в некотором интервале температур и,
Отдельные представители дисахаридов
Мальтоза, солодовый сахар.Дисахарид получается из крахмала при действии солода, содержащего фермент b-амилазу. Солод (от лат. maltum) – это проросшие, а затем высушенные
Отдельные представители трисахаридов
Принципы построения трисахаридов такие же, как и дисахаридов, т. е. трисахариды могут быть как восстанавливающие, так и невосстанавливающие. Многие из трисахаридов содержатся в растениях. Из трисах
Природные гликозиды
Гликозиды – это простые или сложные эфиры моносахаридов и олигосахаридов, образованные с участием полуацетального гидроксила. Гликозиды чрезвычайно распространены в животном и особенно в растительн
Строение высших полиоз
Несахароподобные полиозы – высокомолекулярные соединения, содержащие сотни и тысячи остатков моносахаридов. Остатки моноз связаны между собой кислородными мостиками, образованными за счет полуацета
ГОМОПОЛИСАХАРИДЫ
Крахмал представляет собой не однородное вещество, а смесь полисахаридов, отличающихся не только степенью полимеризации, но и строением. Изучение химических превращений крахмала бы
ГЕТЕРОПОЛИСАХАРИДЫ
Пектиновые вещества – широко распространенные в природе соединения. Различают растворимые пектиновые вещества и нерастворимые (протопектин). Растворимые пектиновые вещества содержа
Изомерия.
Структурная:
· скелетная;
· взаимного положения;
· метамерия.
Пространственная:
· оптическая
Все природные ам
Получение α-аминокислот
1.1 Из природных веществ. Белки при гидролизе в водных растворах в присутствии кислоты дают смесь α-аминокислот, которые можно выделить и разделить. Все они оптичес
Кислотно-основные свойства аминокислот
Аминокислоты – амфотерные вещества, которые могут существовать в виде катионов или анионов. Это свойство объясняется наличием как кислотной (–СО2Н), так и основной (–NH2
Изоэлектрическая точка аминокислот
Если раствор аминокислоты поместить в электрическое поле, то в зависимости от кислотности или основности раствора будет наблюдаться различная картина. В сильнощелочном растворе концентрация анионов
Комплексные соли с ионами меди
Аминокислоты с ионами переходных металлов (Сu, Zn, Co, Pb, Ag, Hg) образуют прочные хелатные комплексы (от греч. сhele – клешня). Малорастворимые хелаты меди (II) имеют глубокую синюю
Образование сложных эфиров (этерификация).
Карбоксильная группа аминокислоты легко этерифицируется обычными методами. Например, метиловые эфиры получают, пропуская сухой газообразный хлористый водород через раствор аминокислоты в метаноле.
Качественные реакции аминокислот
Особенностью химии аминокислот является многочисленность качественных (цветных) реакций, которые необходимы при исследовании их физико-химическими методами (хроматография, электрофорез).
Практическое применение аминокислот
Аминокислоты широко используются в современной медицине в качестве лекарственных средств. К таким аминокислотам относится глутаминовая кислота, метионин, гистидин, глицин, цистеин.
Глут
ОКСИКИСЛОТЫ
Оксикислотами называются карбоновые кислоты, в которых на ряду с карбонильной группой содержится гидроксильная группа.
Классификация оксикислот, как и других бифункциональ
Способы получения оксикарбоновых кислот.
1. Гидролиз α-галогенкарбоновых кислот
Cинтез из ненасыщенных кислот.
9. Дегидратация (образование лактона).Д
Химические свойства оксикарбоновых кислот.
Оксикислоты, благодаря наличию спиртовой группы, реагируют не только, как кислоты, но и как спирты; гидроксильная группа в этих соединениях может быть замещена галогеном или ацилирована. Некоторые
Оксикислоты
Характерным отличием β-оксикислот от -оксикислот является легкость, с кото
Реакции нуклеофильного замещения α-галогенкарбоновых кислот.
Галоген в α-галогенкарбоновых кислотах легко замещается под действием различных нуклеофильных агентов. В результате этих реакций из α-галогенокарбоновых кислот получают &
Реакции со щелочами
.
2. Взаимодействие со спиртами.
Б) Реакции гидроксильной группы
1. Реакция ацилирования.При ацилировании гидроксикарбоновых кислот галогенангидридами получаются сложные эфиры. Для ацилирования можно использовать и ангидриды кислот:
ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
Гетероциклическими соединениями называют соединения, содержащие циклы, в которых имеется один или несколько гетероатомов – N, О, S или другие атомы, способные образовывать не м
ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫ С ОДНИМ ГЕТЕРОАТОМОМ
Общая характеристика пятичленных гетероциклов с одним гетероатомом.К простейшим ароматическим пятичленным гетеро-циклическим соединениям с одним гетероатомом относятся фуран, пирро
Представители пятичленных гетероциклических соединений с одним гетероатомом
Фуран представляет собой пятичленный ароматический гетероцикл с атомом кислорода в кольце:
Производные фурана
Тетрагидрофуран.Тетрагидрофуран получается гидрированием фурана в присутствии никелевого катализатора.
Химические свойства
1. Реакция галогенирования. Для галогенирования тиофена можно использовать бром или хлор при низкой температуре, при этом могут образовываться как моно-, так и полигалогентиофе
Практическое применение тиофена и его производных
Циклическая система тиофена встречается в природе в некоторых продуктах растительного происхождения, но гораздо большее значение имеет это соединение в составе синтетических лекарственных препарато
Основные способы получения
1. Сухой перегонкой аммонийной соли слизевой кислоты или действием аммиака на фуран в присутствии оксида алюминия:
Химические свойства
1.Галогенирование. Осуществляется с помощью хлористого сульфурила, брома в спиртовом растворе и триодид-иона (йод в растворе иодида калия), причем в результате иодирования обра
Применение пиррола и его производных
Пиррол содержится в каменноугольной смоле. Цикл пиррола – структурный фрагмент природных пигментов (например, гема, хлорофиллов, желчи, витамина В12, некоторых антибиотиков), а та
Гемоглобин
Строение и функции гемоглобина.Гемоглобин вляется переносчиком кислорода от легких к тканям тела, представляет собою белок глобин, координационно связанный с гемом (гем – по
Химические свойства
Реакции индола и его простых производных сходны с реакциями пиррола.
1. Индол обладает слабоосновными свойствами и в то же время слабокислыми, образует металлические производные –
Триптофан.
Триптофан [2-амино-3-(3'-индолил)-пропионовая кислота] — бесцветное кристаллическое вещество, Тш = 283–285 °С, растворим в воде, плохо растворим в этаноле и не растворим в
Оксазол
Электронное строение.Ароматические свойства оксазола связаны с наличием циклической сопряженной π-электронной системы, построенной из двух π-электронов связ
Пиридин
Способы получения пиридина и пиридиновых оснований. В небольших количествах пиридини его метил- и этилпроизводные получают из каменноугольной смолы, которая содержит около 0,2 % см
Химические свойства
1. Восстановление водородом. При восстановлении водородом в момент выделения (действуя натрием на спиртовой раствор пиридина А.Н. Вешнеградский) или над катализатором пиридин п
ШЕСТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫ С НЕСКОЛЬКИМИ ГЕТЕРОАТОМАМИ
Пиримидин. Является важнейшим из шестичленных гетероциклов с двумя атомами азота. Пиримидиновый цикл входит в многочисленные природные соединения: нуклеиновые кислоты, витамины, коферменты, являетс
Химические свойства
1. Основные свойства:
Образование солей:
ШЕСТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫ С ДВУМЯ РАЗНЫМИ ГЕТЕРОАТОМАМИ
Оксазины. Оксазиновое кольцо входит в состав многих органических веществ, имеющих большое практическое значение. Среди последних – широко распространенные красители, лекарст
Нобелевские премии по органической химии
Герман Эмиль Фишер
"За эксперименты по синтезу веществ с сахаридными и пуриновыми группами".
Адольф фон Бай

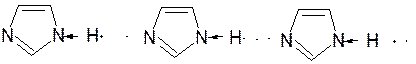
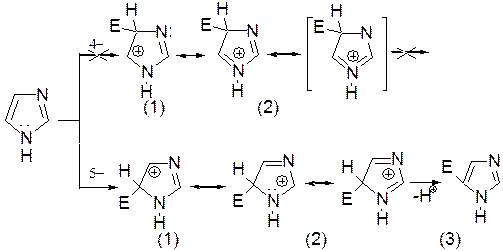
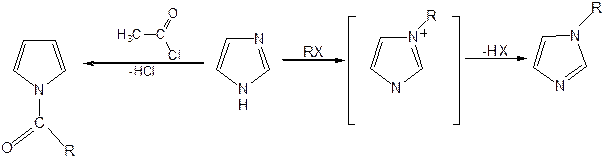
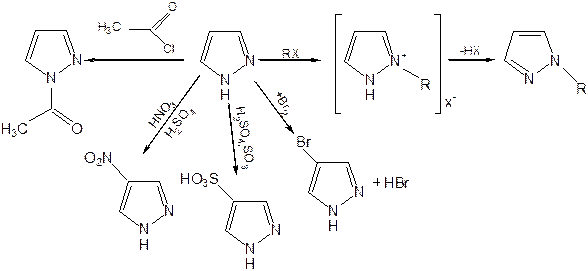
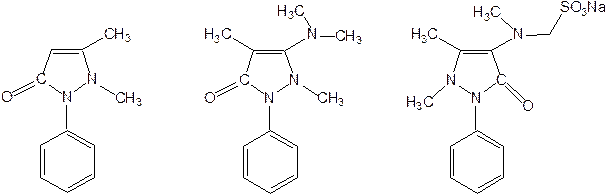







Новости и инфо для студентов