рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Химическое строение моносахаридов
Реферат Курсовая Конспект
Химическое строение моносахаридов
Химическое строение моносахаридов - раздел Химия, ПРОГРАММА БЛОКА ГЕТЕРОФУНКЦИОНАЛЬНЫЕ УГЛЕВОДОРОДЫ Карбонильные Формы Моносахаридов.Для Выяснения Строения ...
Карбонильные формы моносахаридов.Для выяснения строения и стереохимии моносахаридов химикам потребовалось более ста лет. В результате многолетних исследований было установлено, что моносахариды по химической природе являются полиоксиальдегидами или полиоксикетонами. Большинство моносахаридов имеет линейную цепь углеродных атомов. Важнейшими представителями моносахаридов являются гексозы – глюкоза (виноградный сахар) и фруктоза (фруктовый сахар). Обе гексозы являются изомерами и имеют одну молекулярную формулу С6Н12О6 [C6(H2O)6] . Шесть атомов углерода глюкозы образуют прямую неразветвленную цепь:
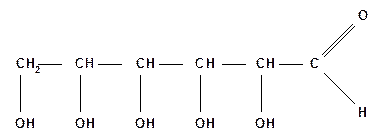
Это доказано восстановлением её в 2-иодгексан при действии йодистого водорода:
реакция
Наличие альдегидной группы было доказано тем, что к глюкозе, так же как и к альдегидам, присоединяется синильная кислота (Килиани, 1887 г.):
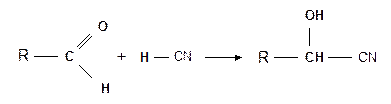 ,
,
где R = С5H11O5
Кроме этого, глюкоза дает качественные реакции на альдегидную группу: “серебряного зеркала“ при взаимодействии с [Аg (NH)2]OH и с фелинговой жидкостью. В обоих случаях альдегидная группа окисляется до карбоксильной и образуется глюконовая кислота:
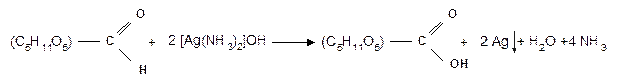
В 1869 г. А.А. Колли установил, что глюкоза реагирует с пятью молекулами уксусного ангидрида, образуя при этом пять сложноэфирных группировок, и поэтому является пятиатомным спиртом:
реакция
Фруктоза при восстановлении иодистым водородом также дает 2-иодгексан, что доказывает ее линейное строение. Наличие карбонильной группы можно доказать реакциями взаимодействия с синильной кислотой или с солянокислым гидроксиламином:
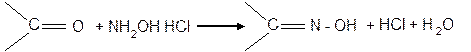
Месторасположение карбонильной группы в углеродной цепи доказывается тем, что окисление фруктозы происходит с разрывом углеродной цепи и образованием щавелевой и винной кислот:
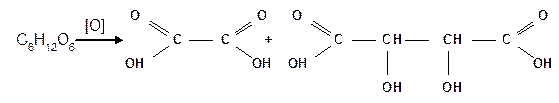
Как и глюкоза, фруктоза реагирует с пятью молекулами уксусного ангидрида, образуя пять сложноэфирных группировок, следовательно, она содержит пять гидроксильных групп.
Таким образом, фруктоза представляет собой пятиатомный кетоспирт:
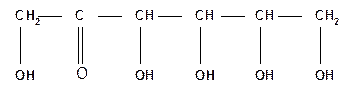
Это так называемые открытые, цепные формы моносахаридов (оксоформы).
Циклические формы моносахаридов. В растворах моносахаридов наряду с альдегидными или кетонными формами всегда содержатся циклические полуацетальные формы (оксиформы), причем содержание открытой формы мало (доли процента). В кристаллическом индивидуальном состоянии все моносахариды (кроме триоз) представляют собой внутренние полуацетали полиоксиальдегидов или полиоксикетонов. Структура полиацеталей аналогична структуре полуацеталей, возникающих при присоединении молекулы спирта к альдегиду:
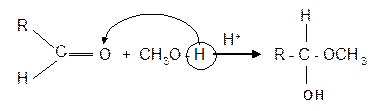
В случае моносахаридов эта реакция происходит внутримолекулярно с наиболее “удобно” расположенным гидроксилом. Обычно полуацетали неустойчивы, но у моносахаридов полуацетальная форма устойчива, так как образование циклической полуацетальной формы происходит внутримолекулярно. Циклические формы моносахаридов возникают в результате взаимодействия альдегидной (кетонной) группы с гидроксильной группой у пятого или у четвертого углеродного атома. Образуются устойчивые циклические полуацетальные формы – пиранозная (шестичленный цикл) либо фуранозная (пятичленный цикл). Эти формы получили название от соответствующих гетероциклических соединений, шестичленные – от пирана (точнее тетрагидропирана), а пятичленные – от фурана (точнее тетрагидрофурана). Следует отметить, что гидроксил, образованный на месте бывшей карбонильной группы, называется полуацетальным или гликозидным и отличается по свойствам от спиртовых гидроксилов.
Для указания размера кольца в циклической форме моносахарида две последние буквы названия моносахарида («оза») заменяют окончанием «фураноза» в случае пятичленного кольца или «пираноза» – в случае шестичленного кольца.
В циклической форме монозы нет альдегидной или кетонной группы, имеются только гидроксильные группы. Эти гидроксилы разные: один гидроксил полуацетальный появился в результате внутримолекулярного взаимодействия карбонильной и спиртовой групп, для сахаров этот гидроксил называют еще гликозидным; остальные гидроксилы спиртовые, при этом в глюкозе один из них у шестого атома углерода первичный, остальные – вторичные.
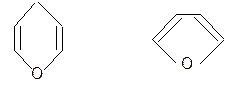
| пиран | фуран |
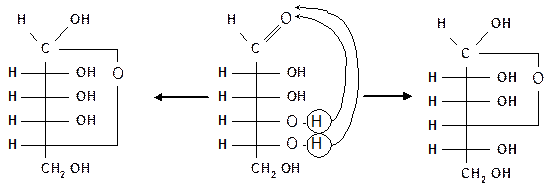
| оксиформа циклическая, пиранозная форма | оксоформа открытая карбонильная форма | оксиформа циклическая, фуранозная форма |
Стереохимия.Для углеводов свойственна оптическая изомерия.
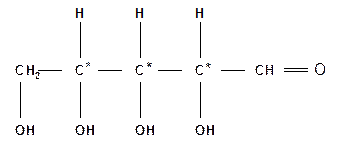
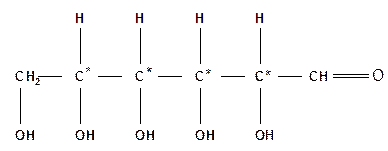
1. Открытые формы моносахаридов. В молекулах моносахаридов имеются асимметрические атомы углерода (хиральные центры), что служит причиной существования большого числа стереоизомеров, соответствующих одной и той же структурной формуле.

| 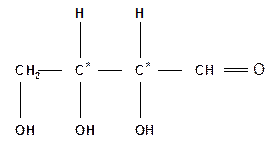
|
| альдотриоза | Альдотетроза |
|
| альдопентоза |
|
| альдогексоза |

|
| кетогексоза |
Проекционные формулы Фишера, D- и L – ряды. Для изображения стереоизомеров удобно пользоваться проекционными формулами Э. Фишера. Для получения проекционной формулы углеродную цепь моносахарида располагают по вертикали с оксогруппой в верхней части цепи, а сама цепь должна иметь форму полукольца, обращенного выпуклостью к наблюдателю. Все асимметрические углеродные атомы находятся в заслоненной конформации, и группы Н и ОН направлены к наблюдателю (рис.2).
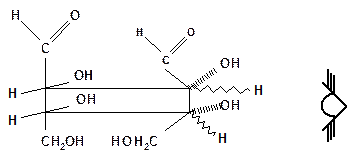
Рисунок 2 – Получение проекционной формулы тетрозы ( эритрозы ).
Так как энантиомеры – это пространственные изомеры, являющиеся зеркальным отражением друг друга, то каждой паре энантиомеров дано одно название и указывается их противоположная конфигурация (D и L). Например, для глюкозы:
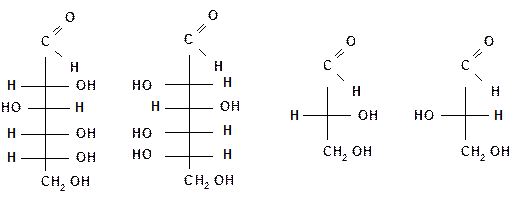
| D (+) глюкоза | L(-) глюкоза | D (+) глицериновый альдегид | L(-) глицериновый альдегид |
Относительная конфигурация моносахаридов (отношение к D- или L- ряду) определяется по конфигурационному стандарту – глицериновому альдегиду. С конфигурацией его хирального центра сравнивается конфигурация наиболее удаленного от карбонильной группы («концевого») асимметрического атома углерода, имеющего наибольший номер. В альдопентозах таким атомом будет С4, а в альдогексозах – С5, в кетогексозах – С5 и т. д. Если у моносахарида эта ОН-группа находится справа, как у D- глицеринового альдегида, то моносахарид относится к D- ряду. Знак вращения плоскости поляризации поляризованного света моносахаридами непосредственно нельзя связать с их принадлежностью к D- и L- ряду, он определяется экспериментально. Так, среди альдопентоз и альдогексоз D-стереохимического ряда имеются как лево-, так и правовращающие соединения. Например, природные фруктоза и глюкоза обозначается: D(–) фруктоза (или раньше D, l фруктоза), т. е. фруктоза обладает левым вращением; D(+) глюкоза (или раньше D,d глюкоза), т. е. глюкоза обладает правым вращением. D(+) и L(–) глицериновые альдегиды являются родоначальниками генетических рядов сахаров (альдоз). Каждый моносахарид в этом ряду, начиная с глицеринового альдегида, при введении еще одного атома углерода дает два стереоизомера (диастереомера) – (рис. 3). Семейство кетоз (рис. 4) формально можно произвести от дигидроксиацетона путем последовательного наращивания цепи на один атом углерода.
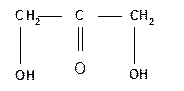
кетотриоза
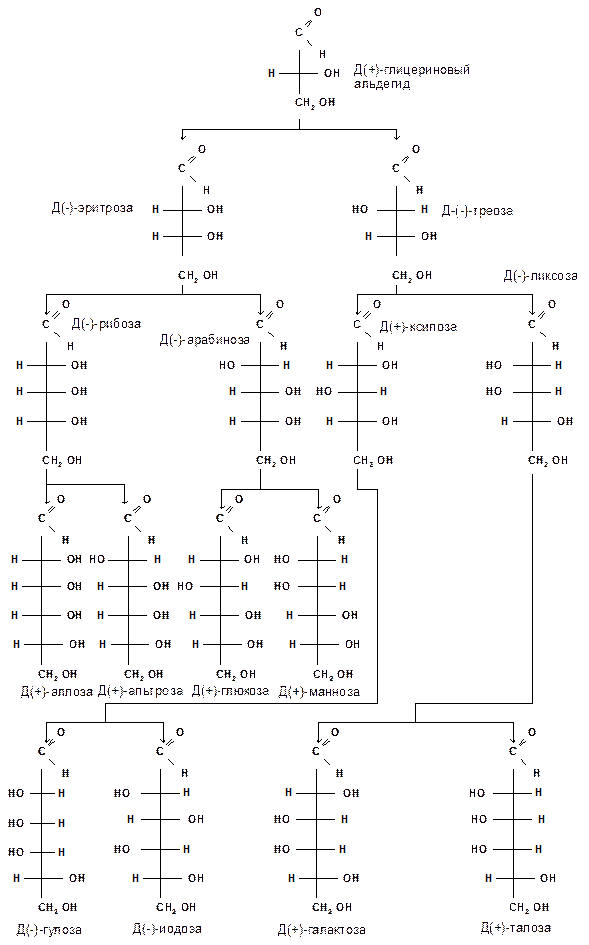
Рисунок 3 – Генетический D-ряд альдоз
Рисунок 4 – Генетический D-ряд кетоз
Подавляющее большинство природных моносахаридов принадлежит к D-ряду. Каждой альдозе D-ряда соответствует энантиомер L-ряда с противоположной конфигурацией всех (!) центров хиральности.
Как следует из схемы, восемь стереоизомеров Д-альдогексоз имеют одинаковое химическое строение, но отличаются конфигурацией одного или нескольких асимметрических атомов углерода, т. е. являются диастереоизомерами и поэтому каждый из них имеет свое название (глюкоза, манноза, галактоза и т. д.). Альдозы, отличающиеся одна от другой конфигурацией только одного соседнего с карбонильной группой асимметрического атома углерода, называются эпимерами. Так, глюкоза и манноза, рибоза и арабиноза являются эпимерами. Эпимеры – частный случай диастереоизомеров.
Понятие о конформационной изомерии. Для сахаров в циклической форме возможен еще один вид пространственной изомерии – конформационная изомерия, связанная с расположением в пространстве углеродных атомов шестичленного цикла. Однако, если для циклогексана известно всего две конформации – «кресло» и «ванна», то для моносахаридов в пиранозной форме известно 8 конформаций – две креслообразных и шесть типа ванны ввиду присутствия в шестичленном цикле гетероатома – кислорода. Шесть ваннообразных конформаций энергитически менее выгодны и их существование можно не учитывать. Из двух креслообразных конформаций
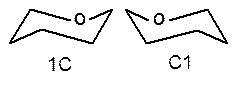
С1 – изомер более предпочтителен, так как подавляющее число заместителей в нем ориентировано в экваториальном, совпадающем с плоскостью цикла, направлении. Именно в виде С1 – конформации существует большинство моносахаридов, например, для D-глюкопиранозы в этой конформации первичноспиртовая СН2ОН-группа и гидроксильные группы занимают экваториальные положения. При этом полуацетальный гидроксил у b-аномера находится в экваториальном, а у a-аномера – в оксиальном положениях. Поэтому b-аномер D-глюкозы преобладает в равновесной смеси над a-аномером:
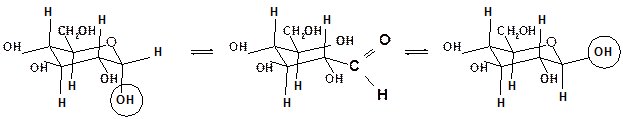
| a-D-глюкопираноза (36%) | D-глюкоза | b-D-глюкопираноза (64%) |
Аномеры образуются не в равных количествах, а с преобладанием термодинамически более устойчивого диастереоизомера.
Конформационное строение D-глюкопиранозы обьясняет уникальность этого моносахарида. b-D-глюкопираноза – моносахарид с полным экваториальным расположением объемных заместителей. Обусловленная этим высокая термодинамическая устойчивость – основная причина широкой распространенности ее в природе.
Конформационное строение моносахаридов обуславливает формирование пространственного строения длинных полисахаридных цепей, т. е. вторичную структуру.
Наличие в пиранозном цикле атома кислорода определяет ряд дополнительных факторов, влияющих на устойчивость аномеров. Например, при замещении в молекуле D-глюкопиранозы полуацетальной гидроксильной группы на алкоксильную (при образовании гликозидов) более выгодной может стать a-аномерная форма. Стремление алкоксильной группы занять аксиальное положение связано с так называемым аномерным эффектом, который проявляется как результат отталкивания между сближенными в пространстве электронными парами двух атомов кислорода – циклического и входящего в состав алкосиальной группы. В a-аномере такое отталкивание электронных пар отсутствует, т. к. атомы кислорода пространственно удалены.
R-, S- номенклатура моносахаридов. D, L- система обозначений для моносахаридов не вполне универсальна, так как основывается на конфигурации одного из многих центров хиральности. Однако она используется в химии углеводов и лишь в редких случаях заменяется R-, S- номенклатурой.
Например, D-глюкоза получает название (2R,3S,4R,5R)-2,3,4,5,6-пентагидроксигексаналь:

| D-глюкоза | R по С2 | S по С3 | R по С4 и С5 |
В циклических формах моносахаридов независимо от размера кольца (пиранозное или фуранозное) атом углерода карбонильной группы становится асимметрическим и он также имеет 2 зеркальные конфигурации. Например, для D-глюкозы:
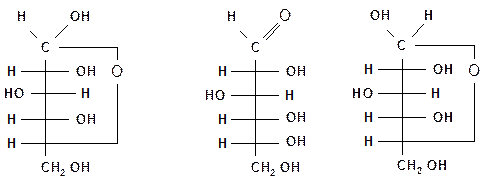
| a-D-глюкопираноза | D-глюкоза | b-D-глюкопираноза |
С1 – новый хиральный центр, этот атом называют аномерным. Две стереоизомерные формы глюкозы отличаются конфигурацией одного хирального центра С1 и называются a- и b-формами, a- и b-аномерами. У a-аномера конфигурация аномерного центра одинакова с конфигурацией «концевого» хирального центра, определяющего принадлежность к D- или L-ряду, а у b-аномера – противоположна, т. е. эти ОН-группы находятся на противоположных сторонах. Аномерные префиксы a- и b- используют только в сочетании с конфигурационными префиксами (D- и L-). Но в целом a- и b-аномеры из-за наличия еще нескольких центров хиральности являются не энантиомерами (зеркальными изомерами), а диастерео-изомерами. Циклические формы моносахаридов, следовательно, содержат на один асимметрический атом углерода больше, чем открытые, поэтому у них в два раза больше оптически активных изомеров, т. е. N = 25 = 32.
Перспективные формулы Хеуорса. Для изображения циклических форм моносахаридов можно пользоваться более наглядными перспективными формулами Хеуорса. Формулы Хеуорса представляют собой шестиугольники и пятиугольники, изображенные в перспективе – цикл лежит в горизонтальной плоскости, связи, расположенные ближе к наблюдателю, изображаются более жирными линиями. Атом кислорода располагается в пиранозном цикле в правом верхнем углу, в фуранозном - за плоскостью цикла, углеродные атомы, входящие в цикл, не пишутся, а только нумеруются от кислорода по часовой стрелке. Все группы (Н и ОН), расположенные справа в формуле Фишера, пишут под плоскостью цикла, а расположенные слева – над плоскостью цикла, концевая СН2ОН группа располагается сверху от плоскости молекулы, если моносахарид относится к D-ряду, и снизу от плоскости, если он относится к L-ряду.
Таким образом, в формулах Хеуорса полуацетальный гидроксил и концевая СН2ОН группа располагаются у a-аномеров по разные стороны кольца, а у b-аномеров – по одну сторону (кружком обведены полуацетальные гидроксилы):
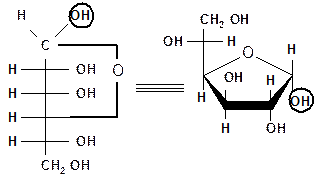
| a-D-глюкофураноза |
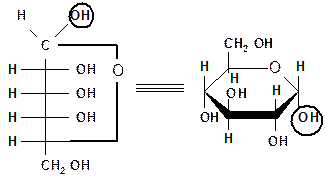
| a-D-глюкопираноза |
Аналогично можно осуществить переход от формул Фишера к формулам Хеуорса на примере одного из аномеров фуранозной формы D-фруктозы:
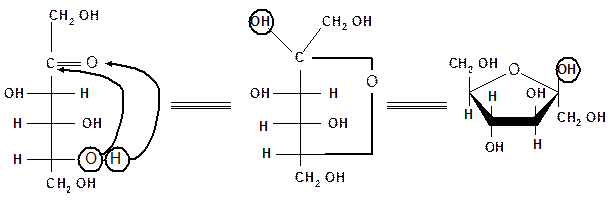
| b-D-фруктофураноза |
Таутомерия моносахаридов в растворах. Характерной особенностью моносахаридов является их ярко выраженная способность к таутомерным превращениям. Углеводы были исторически одними из первых веществ, для которых наблюдалось явление таутомерии. Различают два вида изомерии моносахаридов в растворах:
· кето-енольную;
· кольчато-цепную или оксо-окси-таутомерию.
Кето-енольная таутомерия моносахаридов происходит при действии щелочей и состоит в переходе карбонильной формы (альдегидной или кетонной) в ендиольную с двумя ОН-группами при атомах углерода, связанных двойной связью, т. е. в образовании ендиола общего для эпимерных моносахаридов. Благодаря кето-енольной таутомерии, эпимерные моносахариды могут превращаться друг в друга. Например, в щелочной среде фруктоза претерпевает таутомерное превращение в глюкозу, которая и реагирует с фелинговой жидкостью:
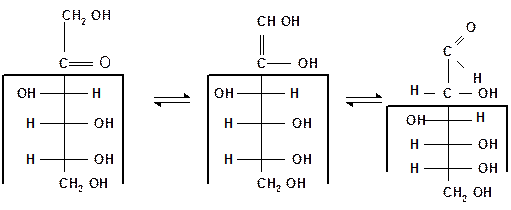
| D-фруктоза | Енол (ендиол) | D-глюкоза |
Кольчато-цепная таутомерия моносахаридов заключается в существовании кольчатых (циклических) форм и цепной (т. е. с открытой углеродной цепью) формы моносахарида, находящихся в растворе в динамическом равновесии. Обычно циклические формы моносахаридов преобладают над открытой цепной формой. Например, известно, что в водных растворах глюкоза находится, главным образом, в виде a- и b- глюкопираноз, в меньшей степени – в виде a- и b-глюкофураноз и совсем небольшое количество глюкозы – в виде открытой, альдегидной формы (0,024 %). В целом пиранозные формы резко преобладают над фуранозными формами. В растворах установление равновесия между четырьмя циклическими таутомерами моносахаридов протекает через открытую форму - оксо-форму:

| a-D-глюкофураноза | a-D-глюкопираноза | ||
| b-D-глюкофураноза | b-D-глюкопираноза |
В зависимости от условий реакции и примененных реагентов моносахариды реагируют в одной из таутомерных форм: пиранозной, фуранозной или ациклической, оксо-форме, так как расходование одной из них в ходе реакции сдвигает таутомерное равновесии в сторону реагирующей формы. Например, несмотря на незначительное содержание оксо-формы, глюкоза вступает в реакции, характерные для альдегидной группы. Таутомерия лежит в основе множественности химических свойств моносахаридов. Аналогичные таутомерные превращения происходят в растворах со всеми моносахаридами и большинством известных дисахаридов. Так, для важнейшего представителя кетогексоз D-фруктозы схема таутомерных превращений имеет следующий вид:

| a-D-фруктопираноза | a-D-фруктофураноза | ||
| b-D-фруктопираноза | b-D-фруктофураноза |
Мутаротация. Кольчато-цепная таутомерия моносахаридов является причиной любопытного свойства простых углеводов. В кристаллическом состоянии моносахариды находятся только в циклической форме. В зависимости от условий кристаллизуется либо a-, либо b-форма. Так, при кристаллизации из воды глюкоза получается в виде a-D-глюкопиранозы, а при кристаллизации из пиридина – в виде b-D-глюкопиранозы. После растворения a-D-глюкопиранозы в воде вначале наблюдается характерное для нее значение удельного вращения, равное [a] = +112,2 0. Однако при стоянии раствора эта величина постепенно снижается и наконец достигает устойчивого значения +52,50. Это явление получило название мутаротации.
Мутаротация – явление самопроизвольного изменения угла вращения плоскости поляризации или изменение оптической активности при стоянии свежеприготовленного раствора сахара, связаное с тем, что в растворе устанавливается равновесие между циклическими a- и b-пиранозными формами, которые переходят друг в друга в результате раскрытия пиранозного цикла с образованием открытой оксо-формы.
Взаимопревращение a- и b-аномеров друг в друга через промежуточную оксо-форму называется аномеризацией.
– Конец работы –
Эта тема принадлежит разделу:
ПРОГРАММА БЛОКА ГЕТЕРОФУНКЦИОНАЛЬНЫЕ УГЛЕВОДОРОДЫ
ГЕТЕРОФУНКЦИОНАЛЬНЫЕ УГЛЕВОДОРОДЫ УГЛЕВОДЫ Углеводы служат основным... НЕСАХАРОПОДОБНЫЕ ПОЛИСАХАРИДЫ Строение высших... АМИНОКИСЛОТЫ...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Химическое строение моносахаридов
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов