рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Электроника
- /
- В новом столетии будут продолжать развиваться на хорошем уровне плазменная, высокочастотная, индукционная, электронная термическая обработка
Реферат Курсовая Конспект
В новом столетии будут продолжать развиваться на хорошем уровне плазменная, высокочастотная, индукционная, электронная термическая обработка
В новом столетии будут продолжать развиваться на хорошем уровне плазменная, высокочастотная, индукционная, электронная термическая обработка - раздел Электроника, Введение Увеличение В Ххi Веке Доли Пластмасс, Керам...
ВВЕДЕНИЕ
Увеличение в ХХI веке доли пластмасс, керамики и композитов сопровождается созданием качественно новых видов материалов, значительно превосходящих по свойствам многие металлические. Уменьшение доли металлических материалов сопровождается также качественным их изменением: практически все новые материалы имеют высоко-, сверх- или ультравысокие свойства.
В начале третьего тысячелетия наиболее распространенными среди металлических материалов останутся железные сплавы и прежде всего –стали.
Конец ХХ столетия характеризовался переходом к применению материалов в метастабильном состоянии, увеличился удельный вес обработки поверхности стали, использования в качестве теплового источника концентрированного потока энергии: наибольшее развитие получили вакуумные, ионные, лазерные и другие процессы.
В новом столетии будут продолжать развиваться на хорошем уровне плазменная, высокочастотная, индукционная, электронная термическая обработка.
В области инженерии поверхности интенсивное развитие в начале ХХI века получат комбинированные процессы, которые резко повышают эксплуатационные свойства поверхности. К ним прежде всего нужно отнести сочетание классических диффузионных процессов насыщения поверхности с нанесением на них покрытий толщиной 3-5 мкм методом химического и физического осаждения и паровой фазы.
Задачей курса «Материаловедение» (раздел металлов и сплавов) является возможность дать студентам - машиностроителям сведения о металлах и сплавах, путях улучшения их механических и эксплуатационных свойств.
1. ЦЕЛИ И ЗАДАЧИ МАТЕРИАЛОВЕДЕНИЯ. ОСНОВНЫЕ ПОНЯТИЯ О МАТЕРИАЛАХ И ИХ СВОЙСТВАХ
Материаловедение – наука, изучающая металлические и неметаллические материалы, применяемые в технике, объективные закономерности зависимости их свойств от химического состава, структуры, способов обработки и условий эксплуатации и разрабатывающая пути управления свойствами (рис. 1.1).
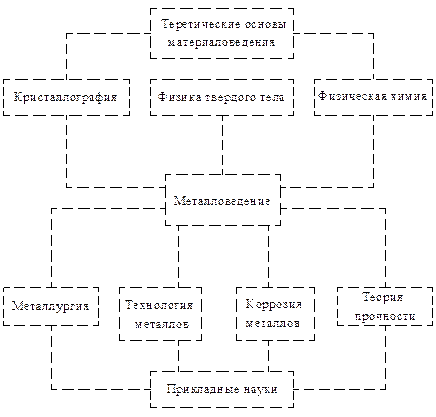
Рис. 1.1. Положение металловедения в общей структуре наук
Цель – познание свойств материалов в зависимости от состава и обработки, методов их упрочнения для наиболее эффективного использования в технике, а также создание материалов с заранее заданными свойствами: высокая прочность и пластичность, высокая электропроводность или высокое сопротивление, специальные магнитные свойства, сочетание различных свойств в одном материале (композиционные материалы).
Основные задачи материаловедения:
- раскрыть физическую сущность явлений, происходящих в материалах при воздействии на них различных факторов в условиях производства и эксплуатации;
- установить зависимость между составом, строением и свойствами материалов;
- изучить теорию и практику различных способов упрочнения материалов для повышения высокой надёжности и долговечности деталей, инструмента и изделий;
- изучить основные группы современных материалов, их свойства и области применения;
- дать понятия о современных методах исследования структуры и прогнозирования эксплуатационных свойств материалов и изделий.
Знакомство с основами материаловедения необходимо не только инженерам и научным работникам, но и любому современному человеку.
Как показывает практика и обширные научные исследования в области физики твердого тела (ФТТ) и материаловедения, наличие тех или иных свойств определяется внутренним строением сплавов. В свою очередь, строение сплава зависит от состава и характера предварительной обработки. Таким образом, можно установить следующие связи между характеристиками материала (рис. 1.2):
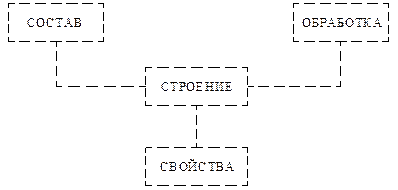
Рис. 1.2. Схема связей между характеристиками материала
Изучение представленных связей составляет предмет материаловедения. В результате изучения предмета студент должен уметь:
- правильно выбрать материал для изделия;
- назначать его обработку с целью получения заданной структуры и свойств;
- оценивать поведение материала при воздействии на него различных эксплуатационных факторов;
- определять опытным путем основные характеристики материалов.
Основную часть всех материалов составляют металлы.
В физике деление на металлы и неметаллы определяется по поведению электросопротивления материала: у металлов оно определяется электронным строением оболочек и при Т ® 0 К r ® 0, в то же время у неметаллов, т.е. полупроводников и диэлектриков при Т ® 0 r ® ¥.
Все металлы делятся на две большие группы: черные металлы и цветные металлы. В свою очередь, эти две группы делятся на подгруппы (рис. 1.3).
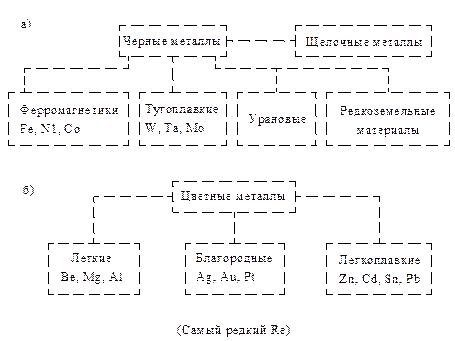
Рис. 1.3. Классификация металлов: а- черных; б- цветных
В зависимости от температуры и давления (для металлов в основном от температуры, Р-соnst) все вещества могут находиться в четырёх агрегатных состояниях: плазмообразном, газообразном, жидком и твердом.
Плазма – ионизированный газ, в котором объёмные плотности положительных и отрицательных электрических зарядов равны.
В газообразном состоянии атомы практически не связаны друг с другом и хаотически перемещаются в пространстве.
В жидком состоянии атомы слабо связаны друг с другом, существует ближний порядок, вещество занимает форму сосуда, части легко отделимы друг от друга.
В твердом состоянии атомы взаимодействуют друг с другом по определенному закону, в структуре имеется как ближний, так и дальний порядок, атомы образуют кристаллическую решетку того или иного вида.
Переход между агрегатными состояниями сопровождается изменением свободной энергии:
F = U – TS,
где U – внутренняя энергия;
T – температура;
S = q / T – энтропия (связана с теплом).
Исторически сложились два подхода к трактовке свойств и явлений, происходящих в твердых веществах, в частности в металлах:
- макроскопический или феноменологический;
- микроскопический или атомистический.
В макроскопическом подходе характерна трактовка твердого тела как сплошной среды без детализации его внутреннего строения. Подход взят на вооружение сопротивлением материалов и другими науками.
В микроскопическом подходе описание и объяснение свойств твердых тел основано на законах взаимодействия составляющих его частиц, т.е. на атомном уровне. В этом подходе реализуется цепочка: структура – свойство. Микроскопический подход на сегодня является единственным строго научным подходом к интерпретации наблюдаемых свойств и явлений в твердых телах.
2. АТОМНО-КРИСТАЛЛИЧЕСКОЕ СТРОЕНИЕ МЕТАЛЛОВ
Металлические материалы. 83 из известных 112 химических элементов таблицы Менделеева Д. И. являются металлами. Они обладают рядом характерных свойств:
- высокой тепло- и электропроводностью;
- положительным коэффициентом электросопротивления (с повышением температуры электросопротивление растет);
- термоэлектронной эмиссией (испусканием электронов при нагреве);
- хорошей отражательной способностью (блеском);
- способностью к пластической деформации;
- полиморфизмом.
Наличие перечисленных свойств обусловлено металлическим состоянием вещества, главным из которых является наличие легкоподвижных коллективизированных электронов проводимости.
Металлическое состояние возникает в совокупности атомов, когда при их сближении внешние (валентные) электроны теряют связь с отдельными атомами, становятся общими и свободно перемещаются между положительно заряженными, периодически расположенными ионами. Силы притяжения (силы связи) в твердых телах существенно отличаются по своей природе. Обычно рассматривают четыре основных типа связей в твердых телах: ван-дер-ваальсовые, ковалентные, металлические, ионную.
Под атомно-кристаллической структурой понимают взаимное расположение атомов в кристалле. Кристалл состоит из атомов (ионов), расположенных в определенном порядке, который периодически повторяется в трех измерениях. Наименьший комплекс атомов, который при многократном повторении в пространстве позволяет воспроизвести пространственную кристаллическую решётку, называют элементарной ячейкой.
Для характеристики элементарной ячейки используют параметры кристаллической решётки: три ребра а, в, с, измеряемых в ангстремах (1Å = 1* 10-8см) или в килоиксах – kX (1kX = 1,00202 Å) и три угла a, b, g, а также компактность структуры h - отношение объема, занимаемого атомами, к объёму ячейки ( для решётки ОЦК h = 64 %, для решётки ГЦК h = 74 %) и координационное числоК - число ближайших соседей данного атома: для решётки ОЦК это число равно 8, т.е. атомы, находящиеся в вершине, принадлежат восьми элементарным ячейкам (рис.2.1.а), для решётки ГЦК это число равно 12, т.е. атомы, находящиеся в вершине, принадлежат двенадцати элементарным ячейкам (рис. 2.1.б).
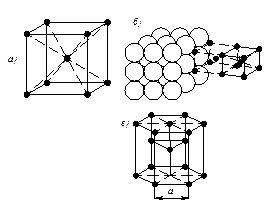
Рис.2.1. Схема определения координационного числа кристаллической решётки: а – ГЦК; б – ОЦК; в – ГПУ
Простейшим типом кристаллической ячейки является кубическая решётка. В простой кубической решётке атомы расположены (упакованы) недостаточно плотно.
Стремление атомов металла занять места, наиболее близкие друг к другу, приводит к образованию решеток других типов (рис. 2.2):
- объёмноцентрированной кубической решётки (ОЦК) (рис.2.2а) с параметром
а = 0,28 – 0,6мм = 2,8 – 6,0 Å
- гранецентрированной кубической решётки (ГЦК) (рис.2.2б) с параметром
а = 0,25мм
- гексагональной плотно упакованной решётки (ГПУ) (рис.2.2в) с параметром
с / а » 1,633

Рис. 2.2. Кристаллические решётки: а – гранецентрированный куб (ОЦК); б – объемноцентрированный куб (ГЦК); в- гексагональная плотно упакованная (ГПУ)
Узлы (положения атомов), направления в плоскости и в пространстве обозначаются с помощью так называемых индексов Миллера (рис. 2.3). Индексы узла записываются – (mnp), индексы направления - [mnp], индекс плоскости - (hk1).
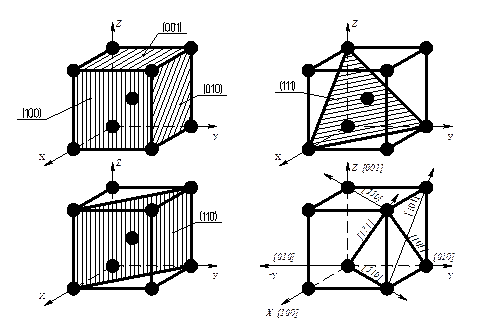
Рис. 2.3. Символы некоторых важнейших узлов, направлений и плоскостей в кубической решётке
Вследствие неодинаковой плотности атомов в различных плоскостях и направлениях решётки многие свойства отдельно взятого кристалла (химические, физические, механические) по данному направлению отличаются от свойств в другом направлении и, естественно, зависят от того, сколько атомов встречается в этом направлении. Различие свойств в зависимости от направления испытания носит название анизотропии. Все кристаллы анизотропны. Анизотропия – особенность любого кристалла, характерная для кристаллического строения.
Технические металлы являются поликристаллами, т.е. состоят из совокупности кристаллитов с различной ориентацией. При этом свойства во всех направлениях усредняются.
2.1. Строение реальных кристаллов
Реальный кристалл состоит из скопления большого числа мелких кристаллов неправильной формы, которые называются зернами или кристаллитами (рис. 2.4).
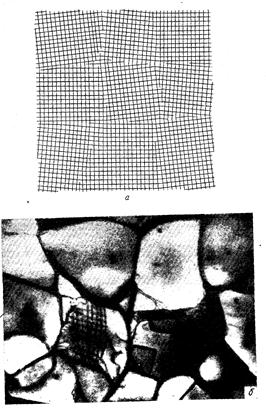
Рис. 2.4. Блочная структура кристалла: схема (а); реальная блочная структура в алюминии (б), наблюдаемая в электронном микроскопе на просвет, (х 35000)
Зерно не является монолитным кристаллом, построенным из строго параллельных атомных слоев. В действительности оно состоит как бы из мозаики отдельных блоков, кристаллографические плоскости в которых повернуты друг относительно друга на небольшой угол – порядка нескольких минут. Такое строение зерна носит название мозаичной структуры, а составляющие ее блоки называются блоками мозаики.
Часто блоки объединяются в более крупные агрегаты – так называемые фрагменты. Фрагменты в свою очередь разориентированы относительно друг друга в несколько градусов. Зерна ориентированы случайно по отношению друг к другу. Преимущественная ориентация зерен называется текстурой. Поверхность раздела зерен называется границей.
Технические металлы являются поликристаллами, т.е. состоят из совокупности кристаллитов с различной ориентацией, что приводит к изменению свойств металлов при различных процессах их обработки.
При определенных условиях, обычно при очень медленном контролируемом отводе тепла при кристаллизации, может быть получен кусок металла, представляющий собой один кристалл, который называют монокристаллом.
2.2. Дефекты кристаллического строения
Строение реальных кристаллов отличается от идеальных. Реальные кристаллы всегда содержат несовершенства (дефекты) кристаллического строения, которые нарушают связи между атомами и оказывают влияние на свойства металлов.
Дефекты в кристаллах принято классифицировать по характеру их измерения в пространстве:
1. Точечные. Точечными дефектами называются нарушения периодичности кристалла, размеры которых сопоставимы с размерами атома во всех измерениях.
К точечным дефектам относятся вакансии, межузельные атомы, примеси замещения, примеси чужеродных атомов внедрения (рис. 2.5).
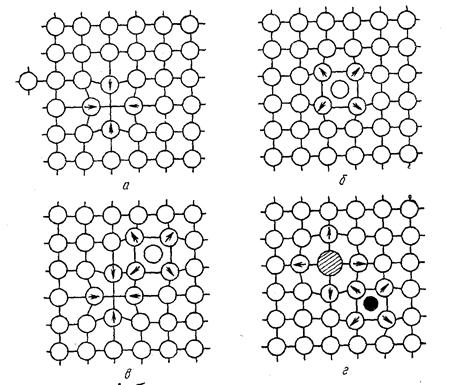
Рис. 2.5.Точечные дефекты в кристаллической решетке: а- вакансия;
б - межузельный атом; в- дефект Френкеля; г- примесные атомы замещения (большой) и внедрения (маленький).
Стрелками указаны направления смещений атомов в решетке.
Вакансии и межузельные атомы появляются в кристаллах при любой температуре выше абсолютного нуля из-за тепловых колебаний атомов. Каждой температуре соответствует равновесная концентрация вакансий, а также межузельных атомов. Например, в меди при температуре 20-25 оС содержится 10-13 ат. % вакансий, а вблизи точки плавления - уже 0,01 ат. % (одна вакансия приходится на 104 атомов).
Пересыщение точечными дефектами достигается при резком охлаждении после высокотемпературного нагрева, при пластическом деформировании и при облучении нейтронами. Чем выше температура, тем больше концентрация вакансий и тем чаще они переходят от узла к узлу. Вакансии являются самой важной разновидностью точечных дефектов; они ускоряют все процессы, связанные с перемещениями атомов: диффузию, спекание порошков и т. д.
2. Линейные. Линейные дефекты в кристаллах характеризуются тем, что их поперечные размеры не превышают нескольких межатомных расстояний, а длина может достигать размера кристалла. К линейным дефектам относятся дислокации – линии, вдоль и вблизи которых нарушено правильное периодическое расположение атомных плоскостей кристалла.
Важнейшие виды линейных несовершенств - краевые и винтовые дислокации (рис.2.6).
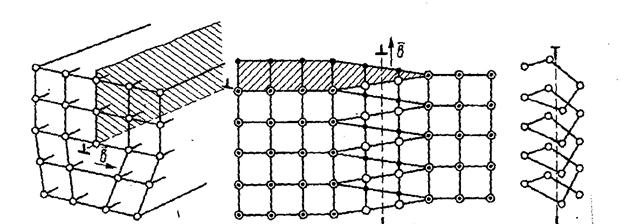
а б
Рис. 2.6. Схема дислокаций: а – краевая; б - винтовая
Краевая дислокация в сечении представляет собой край «лишней» полуплоскости в решетке (рис.2.7)
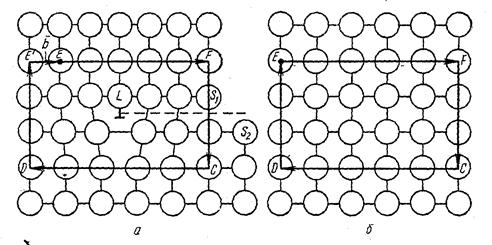
Рис. 2.7. Сечение простой кубической решетки: а - с краевой дислокацией; б - без дислокации.
Вокруг дислокаций решетка упруго искажена. Схема образования атмосферы Коттрелла в кристалле представлена на рисунке 2.8.
| |

Рис. 2.8. Образование атмосферы Коттрелла: а – атомы примеси замещения (заштрихованы) и внедрения беспорядочно расположены в решетке; б, в – атомы примеси переместились к дислокации, в результате чего энергия решетки понизилась.
3. Поверхностные (двумерные). Под этими дефектами понимают нарушения, которые обладают большой протяженностью в двух измерениях и протяженностью лишь в несколько межатомных расстояний в третьем измерении.
К поверхностным дефектам относятся дефекты упаковки, двойниковые границы, границы зерен.
4.Объемные (трехмерные). Под ними понимают нарушения, которые в трех измерениях имеют неограниченные размеры. К таким нарушениям относят трещины, поры, усадочные раковины.
2.3. Превращения в твердом состоянии. Полиморфизм
Атомы данного элемента могут образовать, если исходить только из геометрических соображений, любую кристаллическую решетку. Однако устойчивым, а следовательно, реально существующим типом является решетка, обладающая наиболее низким запасом свободной энергии.
Так, разные металлы образуют разные виды кристаллической решетки:
- Li, Na, K, Mo, W – ОЦК;
- Al, Ca, Cu, Au, Pt – ГЦК;
- Mg, Zr, Hf, осмий – ГПУ.
Однако в ряде случаев при изменении температуры или давления может оказаться, что для одного и того же металла более устойчивой будет другая решетка, чем та, которая существует при данной температуре или давлении. Так, например, существует железо с решетками объемно-центрированного и гранецентрированного кубов, обнаружен кобальт с гранецентрированной и с гексагональной решетками.
Существование одного и того же металла (вещества) в нескольких кристаллических формах носит название полиморфизма или аллотропии. Различные кристаллические формы одного вещества называются полиморфными или аллотропическими модификациями (таблица 2.1).
Таблица 2.1
Аллотропические модификации металлов
| Металл | Группа | Модификация | Кристаллическая решетка | |||
| Кальций | II-A | Сaa до 450 Caab 450-851 | Кубическая гранецентрированная Гексагональная плотноупакованная | |||
| Галлий | III-B | Gaa Gab | Ромбическая Тетрагональная | |||
| Таллий | III-B | Tla до 262 Tlb 262-304 | Гексагональная плотноупакованная Кубическая объемноцентрированная | |||
| Титан | IV-A | Tia до 882 Tib 882-1725 | Гексагональная плотноупакованная Кубическая объемноцентрированная | |||
| Цирконий | IV-A | Zra до 862 Zrb 862-1830 | Гексагональная плотноупакованная Кубическая объемноцентрированная | |||
| Гафний | IV-A | Hfa до 1610 Hfb 1610-1952 | Гексагональная Кубическая объемноцентрированная | |||
| Олово | IV-B | Sna до 18` Snb 18-232 | Алмазная Тетрагональная объемноцентрированная | |||
| Вольфрам | VI-A | Wa до 650 Wb 650-3400 | Кубическая объемноцентрированная Сложная (нерасшифрованная) | |||
| Уран | VI-A | Ua до 660 Ub 660-770 Ug 770- 1133 | Ромбоэдрическая Тетрагональная Кубическая объемноцентрированная | |||
| Марганец | VII-A | Mna до 742 Mnb 742-1080 Mng 1080-1180 Mnd 1180-1242 | Кубическая сложная « « Тетрагональная гранецентрированная Неизвестна | |||
| Железо | VIII | Fea до 910 1401-1539 Feg 910-1401 | Кубическая объемноцентрированная Кубическая гранецентрированная | |||
| Кобальт | VIII | Coa до 477 Cob 477-1490 | Гексагональная плотноупакованная Кубическая гранецентрированная | |||
Аллотропические формы обозначаются греческими буквами a, b, g и т.д., которые в виде индексов добавляют к символу, обозначающему элемент. Аллотропическая форма при самой низкой температуре, обозначается буквой a, следующая - b и т. д.
Явление полиморфизма основано на едином законе об устойчивости состояния с наименьшим запасом энергии. Запас свободной энергии зависит от температуры. Поэтому в одном интервале температур более устойчивой является одна модификация, а в другом – другая. Температура, при которой осуществляется переход из одной модификации в другую, носит название температуры полиморфного (аллотропического) превращения.
Механизм роста кристаллов новой фазы может быть нормальным кристаллизационным и мартенситным. Нормальный механизм роста – это зарождение новой фазы на границах зерен, блоков, фрагментов при малых степенях переохлаждения (Sna « Snb).
Мартенситный механизм реализуется при низких температурах и большой степени переохлаждения, при малой диффузионной подвижности атомов путем их сдвига (смещения) по определенным кристаллографическим плоскостям и направлениям. Новая фаза имеет форму игл и растет очень быстро (Coa «Cob).
Аллотропическое превращение сопровождается изменением свойств, объема и появлением внутренних напряжений.
3. КРИСТАЛЛИЗАЦИЯ МЕТАЛЛОВ И СПЛАВОВ
3.1. Энергетические условия процесса кристаллизации
В зависимости от температуры любое вещество (система) может быть в твердом, жидком или в газообразном состояниях. В физической химии системой называют совокупность индивидуальных веществ (химические элементы, независимые химические соединения), между которыми или частями которых обеспечена возможность обмена энергией, а также процессов диффузии.
Вещества, которые образуют систему, называются компонентами системы. Компоненты в системе присутствуют в разных фазах.
Фазой называется однородная часть системы, ограниченная от других частей системы поверхностью раздела, при переходе через которую свойства изменяются скачком.
Процесс перехода из жидкого или газообразного состояния в твердое, в результате чего образуется кристаллическая решетка и возникают кристаллы, называется кристаллизацией.
Чем объясняется существование при одних температурах жидкого, а при других температурах твердого состояния и почему превращение происходит при строго определенных температурах?
В природе все самопроизвольно протекающие превращения, а следовательно, кристаллизация и плавление обусловлены тем, что новое состояние в новых условиях является энергетически более устойчивым, обладает меньшим запасом энергии.
Энергетическое состояние системы, имеющей огромное число охваченных тепловым движением частиц (атомов, молекул), характеризуется особой термодинамической функцией (F ), называемой свободной энергией, которая определяется:
F= U – TS,
где U – внутренняя энергия системы;
Т - абсолютная температура;
S - энтропия
Можно сказать, что чем больше свободная энергия системы, тем система менее устойчива, и если имеется возможность, то система переходит в состояние, где свободная энергия меньше.
С изменением внешних условий, например температуры, свободная энергия системы изменяется по сложному закону, но различно для жидкого и твердого состояний (рис. 3.1).
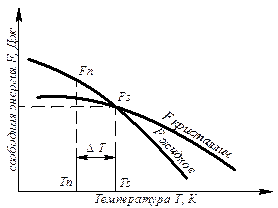
Рис. 3.1. Изменение свободной энергии жидкого и кристаллического состояний в зависимости от температуры
Выше температуры Тs меньшей свободной энергией обладает вещество в жидком состоянии, ниже Ts – вещество в твердом состоянии. Следовательно, выше Ts вещество должно находиться в жидком состоянии, а ниже Ts – в твердом, кристаллическом.
Очевидно, что при температуре, равной Ts свободные энергии жидкого и твердого состояний равны, металл в обоих состояниях находится в равновесии. Эта температура Ts и есть равновесная или теоретическаятемпература кристаллизации. Однако, при Ts Fж = Fкр, и процесс кристаллизации (плавления) не может идти, так как при равенстве свободных энергий обеих фаз плавление (кристаллизация) не будут сопровождаться уменьшением свободной энергии.
Для начала кристаллизации необходимо, чтобы процесс был термодинамически выгоден системе и сопровождался уменьшением свободной энергии системы. Их кривых (рис. 3.1) видно, что это возможно только тогда, когда жидкость будет охлаждена ниже точки Ts.
Температура, при которой практически начинается кристаллизация, может быть названа фактической температурой кристаллизации.
Охлаждение жидкости ниже температуры кристаллизации называется переохлаждением.
Обратное превращение из кристаллического состояния в жидкое может произойти только выше температуры Ts, это явление называется перенагреванием.
Величиной или степенью переохлаждения называют разность между теоретической и фактической температурами кристаллизации T = Ts - Tф.
Процесс перехода металла из жидкого состояния в кристаллическое можно изобразить кривыми в координатах время – температура (рис. 3.2).
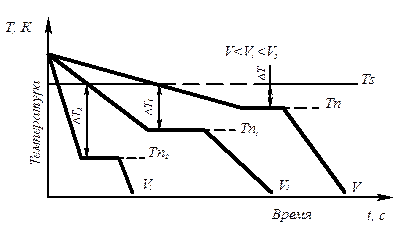
Рис. 3.2. Кривые охлаждения, полученные при кристаллизации металла
Охлаждение металла в жидком состоянии сопровождается плавным понижением температуры и может быть названо простым охлаждением, так как при этом нет качественного изменения состояния. При достижении температур кристаллизации на кривой температура – время появляются горизонтальные площадки (рис.3.2), так как отвод тепла компенсируется выделяющейся при кристаллизации скрытой теплотой кристаллизации.
3.2. Механизм процесса кристаллизации
Процесс кристаллизации состоит из двух элементарных процессов. Первый процесс заключается в зарождении мельчайших частиц кристаллов, которые называются зародышами или центрами кристаллизации. Второй процесс состоит в росте кристаллов из этих центров.
Модель кристаллизации металла в первые 7 секунд охлаждения представлена схемой процесса кристаллизации (рис.3.3) и кинетической кривой кристаллизации (рис.3.4).
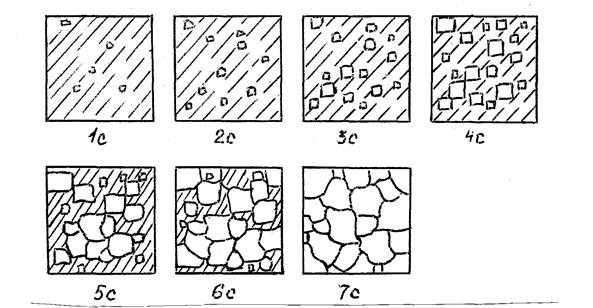
Рис. 3.3. Схема процесса кристаллизации
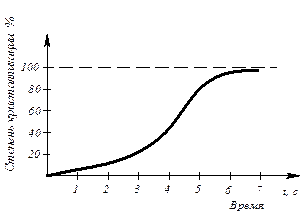
Рис. 3.4. Кинетическая кривая кристаллизации
По мере развития кристаллизации в нем участвуют все большее и большее число кристаллов. Поэтому процесс вначале ускоряется, пока в какой-то момент взаимное столкновение растущих кристаллов начинает заметно препятствовать их росту. Рост кристаллов замедляется еще и потому, что количество жидкости, в которой образуются новые кристаллы, становится все меньше. В процессе кристаллизации, пока кристалл окружен жидкостью, он часто имеет правильную форму, но при столкновении и срастании кристаллов их правильная форма нарушается. Внешняя форма кристалла оказывается зависимой от условий соприкосновения растущих кристаллов. Вот почему кристаллы металла - зерна (кристаллиты) не имеют правильной формы.
Скорость всего процесса кристаллизации количественно определяется двумя величинами: скоростью зарождения центров кристаллизации и скоростью роста кристаллов (рис.3.5).
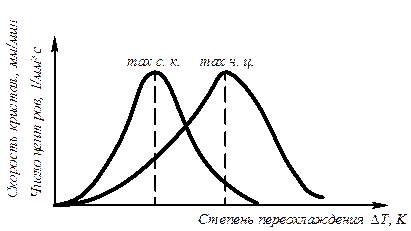
Рис. 3.5. Зависимость скорости кристаллизации (СК) и скорости зарождения центров кристаллизации (ЧЦ) от степени переохлаждения
Величины оптимального переохлаждения до достижения максимальной скорости кристаллизации (СК) и до образования максимального числа центров кристаллизации (ЧЦ) не совпадают.
Размер образовавшихся кристаллов зависит от соотношения СК и ЧЦ. При большом значении СК и малом значении ЧЦ образуется мало крупных кристаллов. При малых значениях СК и больших ЧЦ образуется большое число мелких кристаллов.
Размер зерна определяется по формуле
N = k Ö СК / ЧЦ,
где N – размер зерна;
k - коэффициент пропорциональности;
СК – скорость кристаллизации;
ЧЦ – число центров кристаллизации
Минимальный размер способного к росту зародыша называется критическим размером зародыша.
3.3. Аморфное состояние металлов
В соответствии с кривыми зависимости скорости кристаллизации и скорости зарождения центров кристаллизации от степени переохлаждения (рис. 3.5), при сверхвысоких скоростях охлаждения из жидкого состояния (> 106 оС/с) диффузионные процессы настолько замедляются, что подавляется образование зародышей и рост кристаллов, жидкость сохраняется не превращенной, не закристаллизовавшейся. В этом случае при затвердевании образуется аморфная структура. Материалы с такой структурой получили название аморфные сплавы или металлическиестекла.
Аморфное состояние обеспечивает металлическим материалам свойства, значительно отличающиеся от свойств соответствующих материалов с кристаллической структурой. Аморфные металлические материалы удачно сочетают высокие прочность, твердость и износостойкость с хорошей пластичностью и коррозионной стойкостью. Большое практическое значение имеет также и возможность получения аморфных металлов в виде ленты, проволоки диаметром несколько микрометров непосредственно при литье, минуя такие дорогостоящие операции, как ковка, прокатка, волочение, промежуточные отжиги, зачистки, травление.
Затвердевание с образованием аморфной структуры принципиально возможно практически для всех металлов. В настоящее время аморфная структура получена у более чем 20 чистых металлов и полупроводниковых материалов и более 110 сплавов.
Сверхвысокие скорости охлаждения для получения аморфной структуры можно получить такими способами, как катапультирование капли на холодную пластину, центрифугирование капли или струи, распыление струи газом или жидкостью с высокой охлаждающей способностью и др. Наиболее эффективными способами получения лент, пригодных для практического применения, считают охлаждение жидкого металла на внешней или внутренней поверхностях вращающихся барабанов, изготовленных из материалов высокой теплопроводности, прокатку между холодными валками металла, подаваемого в виде струи.
Тонкий слой аморфного металла получают при расплавлении поверхности изделий лазерным лучом благодаря быстрому отводу теплоты при затвердевании массой основного металла.
Металлические материалы с аморфной структурой можно получить не только при затвердевании из жидкого состояния, но и путем сверхбыстрого охлаждения из газовой среды (парообразного или ионизированного состояния), электролизом и катодным распылением с высокими скоростями осаждения.
3.4. Реальная форма кристаллических образований
Реально протекающий процесс кристаллизации усложняется действием различных факторов:
- скорости и направления отвода тепла;
- наличия нерастворившихся частиц (центров кристаллизации);
- конвекционных токов жидкости.
В направлении отвода тепла кристалл растет быстрее, чем в другом направлении.
Если на боковой поверхности растущего кристалла возникнет бугорок, то кристалл приобретает способность расти и в боковом направлении. В результате образуется древовидный кристалл, так называемый дендрит (рис.3.6).
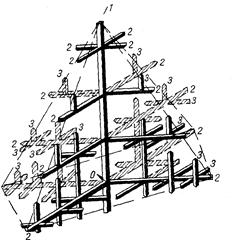
Рис. 3.6. Схема строения дендрита: 1, 2 и 3 – оси соответственно первого, второго и третьего порядков
Дендритное строение типично для литого металла. Дендрит состоит из ствола (ось первого порядка), от которого идут ветви (оси второго и третьего порядков). Чем быстрее было охлаждение при кристаллизации, тем меньше размеры (высота) дендрита и меньше расстояния между ветвями второго порядка. Если условия благоприятны, охлаждение медленное, то могут вырасти огромного размера дендриты. В обычных слитках массой в сотни килограммов или несколько тонн, дендриты имеют размеры несколько десятков миллиметров и меньше.
3.5. Получение монокристаллов
Большое научное и практическое значение имеют монокристаллы, которые отличаются минимальными структурными несовершенствами. Получение монокристаллов позволяет изучать свойства металлов, исключив влияние границ зерен.
Монокристаллы можно получить, если создать условия для роста кристалла только из одного центра кристаллизации. Существует несколько методов, в которых использован этот принцип. Важнейшими из них являются методы Бриджмена и Чохральского (рис. 3.7).
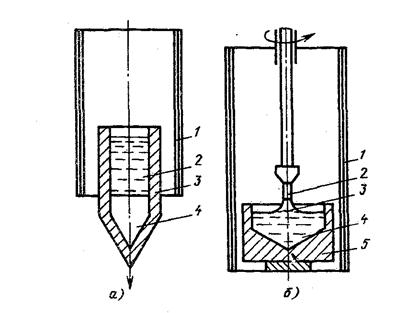
Рис. 3.7. Схемы установок для выращивания монокристалла: а – метод Бриджмена; б – метод Чохральского
Метод Бриджмена (рис.3.7а) состоит в следующем: металл, помещенный в тигель с коническим дном 3, нагревается в вертикальной трубчатой печи 1 до температуры на 50-100 оС выше температуры его плавления. Затем тигель с расплавленным металлом 2 медленно удаляется из печи. Охлаждение наступает в первую очередь в вершине конуса, где и появляются первые центры кристаллизации. Монокристалл 4 вырастает из того зародыша, у которого направление преимущественного роста совпадает с направлением перемещения тигля. При этом рост других зародышей подавляется. Для непрерывного роста монокристаллов необходимо выдвигать тигель из печи со скоростью, не превышающей скорость кристаллизации данного металла.
Метод Чохральского (рис. 3.7б) состоит в вытягивании монокристалла из расплава. Для этого используется готовая затравка 2 – небольшой образец, вырезанный из монокристалла по возможности без структурных дефектов. Затравка вводится в поверхностный слой жидкого металла 4, имеющего температуру чуть выше температуры плавления. Плоскость затравки, соприкасающаяся с поверхностью расплава, должна иметь кристаллографическую ориентацию, которую желательно получить в растущем монокристалле 3 для обеспечения наибольших значений тех или иных свойств. Затравку выдерживают в жидком металле для оплавления и установления равновесия в системе жидкость – кристалл. Затем затравку медленно, со скоростью, не превышающей скорости кристаллизации (»1-2 мм/мин), удаляют из расплава.
Очень перспективно выращивание монокристаллов в космосе, где удачно сочетаются глубокий вакуум и невесомость. Монокристаллы, выращенные в космосе, совершеннее по структуре и распределению легирующих добавок (примесей), лучше по свойствам и значительно больше по размерам.
3.6. Жидкие кристаллы
Жидкие кристаллы – это жидкости с упорядоченной молекулярной структурой. Благодаря упорядочению молекул они занимают промежуточное положение между кристаллами и обычными жидкостями с беспорядочным расположением молекул. Жидкие кристаллы текучи, как обычные жидкости, но в то же время обладают анизотропией свойств, как кристаллы.
Известно несколько сотен жидких кристаллов, важное место среди них занимают некоторые органические вещества, у которых молекулы имеют удлиненную форму.
По структуре жидкие кристаллы разделяют на три класса (рис. 3.8):
- I (нематические);
- II (смектические);
- III (холестерические).
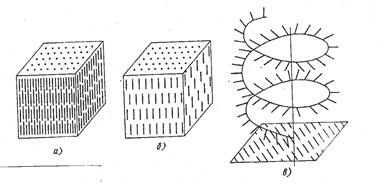
Рис. 3.8. Типы структур жидких кристаллов: а – нематические; б – смектические; в - холестерические
Ориентационный порядок в расположении молекул создает анизотропию: показатель преломления света, диэлектрическая проницаемость, удельное электрическое сопротивление, вязкость и многие другие свойства зависят от направления, вдоль которого измеряют их величины, например, параллельно или перпендикулярно осям молекул.
Структура жидких кристаллов легко изменяется под действием давления, электрического поля, нагрева. Это явление дает возможность управлять их свойствами путем слабых воздействий и делает жидкие кристаллы незаменимыми материалами для изготовления особо чувствительных индикаторов.
Способность изменять оптические свойства жидких кристаллов первого класса, а также кристаллов третьего класса под влиянием электрического поля и температурных условий широко используется в приборостроении.
В жидких кристаллах первого класса наблюдается электрооптический эффект динамического рассеяния света.
Жидкие кристаллы используют в цветных индикаторах и других цветовых устройствах. Для цветных изображений применяют смеси жидких кристаллов с красителями, также имеющими продолговатые молекулы.
На основе жидких кристаллов изготовляют медицинские термометры, датчики температуры для контроля перегрева узлов и деталей, преобразователи невидимого инфракрасного излучения в видимый свет. В последнем случае поглощение инфракрасного излучения нагревает жидкий кристалл так, что изменяется окраска отраженного света. Жидкие кристаллы применяют в модуляторах, системах отображения информации – калькуляторах, ручных часах, измерительных приборах автомобилей, устройствах для отклонения светового потока и др.
3.7. Строение стального слитка
Различные сочетания факторов, влияющих на кристаллизацию, приводят к своеобразной структуре стальных слитков.
Типичная структура слитка состоит из трех основных зон (рис.3.9).
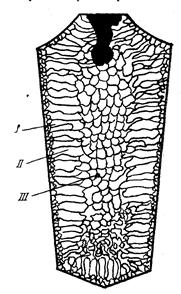
Рис. 3.9. Схема строения стального слитка
Первая зона – наружная мелкозернистая корка I, состоящая из дезориентированных мелких кристаллов – дендритов. При первом соприкосновении со стенками изложницы в тонком прилегающем слое жидкого металла возникает резкий градиент температур и , как следствие, явление переохлаждения, ведущее к образованию большого количества центров кристаллизации. В результате корка получает мелкозернистое строение.
Вторая зона – зона столбчатых кристаллов II. После образования самой корки условия теплоотвода меняются (из-за теплового сопротивления, из-за повышения температуры стенки изложницы и других причин), градиент температур в прилегающем слое жидкого металла резко уменьшается и, следовательно, уменьшается степень переохлаждения стали. В результате, из небольшого числа центров кристаллизации начинают расти нормально ориентированные к поверхности корки (т.е. в направлении отвода тепла) столбчатые кристаллы.
Третья зона слитка – зона равноосных кристаллов III. В центре слитка уже нет определенной направленности отдачи тепла. Температура застывающего металла успевает почти уравняться в различных точках, и жидкость обращается как бы в кашеобразное состояние вследствие образования в различных ее точках зачатков кристаллов. Далее зачатки разрастаются осями – ветвями по различным направлениям, встречаясь друг с другом. В результате этого процесса образуется равноосная структура. Зародышами кристалла здесь являются обычно различные мельчайшие включения, присутствующие в жидкой стали или случайно в нее попавшие, или не растворившиеся в жидком металле.
Применяя различные технологические приемы, можно изменить количественное соотношение зон или исключить из структуры слитка какую-либо зону вообще (рис.3.10).
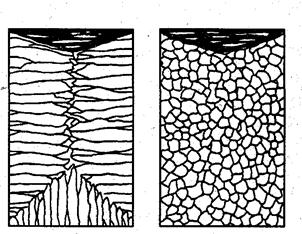
а б
Рис. 3.10. Схемы макроструктур слитков: а – столбчатые кристаллы;
б – равноосные кристаллы
Например, перегрев сплавов перед разливкой и быстрое охлаждение при кристаллизации приводят к формированию структуры, состоящей практически из одних столбчатых кристаллов (рис.3.10а). Такая структура называется транскристаллической. Подобную структуру имеют слитки очень чистых металлов. Зона столбчатых кристаллов характеризуется наибольшей плотностью, но в месте стыка столбчатых кристаллов собираются нерастворимые примеси, и слитки с транскристаллической структурой часто растрескиваются. Транскристаллическая структура в сварных швах уменьшает прочность.
На практике для измельчения структуры металлов и сплавов широко применяют технологическую операцию, называемую модифицированием. Она состоит во введении в жидкий сплав перед разливкой специальных добавок (модификаторов). В качестве модификаторов используют поверхностно-активные вещества (например, бор в стали, натрий в алюминии и его сплавах) и элементы, образующие тугоплавкие тонкодисперсионные частицы (например, титан, цирконий в алюминии и его сплавах; алюминий, титан в стали). Модификаторы добавляют в сплавы в количествах от тысячных до десятых долей процента.
Слитки сплавов имеют неоднородный состав. Неоднородность сплава по химическому составу, структуре и неметаллическим включениям, образующаяся при кристаллизации слитка, называется ликвацией.
Химическая неоднородность по отдельным зонам слитка называется зональной ликвацией. Она отрицательно влияет на механические свойства. В реальных слитках помимо зональной встречаются и другие виды ликвации: внеосевая, дендритная, карбидная, подусадочная, угловая, гравитационная.
Так, гравитационная ликвация образуется в результате разницы в удельных весах твердой и жидкой фаз, а также при кристаллизации несмешивающихся жидких фаз.
Жидкий металл имеет больший объём, чем закристаллизовавшийся, поэтому залитый в форму металл в процессе кристаллизации сокращается в объёме, что приводит к образованию пустот, называемых усадочными раковинами. Усадочные раковины могут быть сконцентрированы в одном месте, либо рассеяны по всему объёму слитка или по его части. Они могут быть заполнены газами, растворимыми в жидком металле, но выделяющимися при кристаллизации.
В хорошо раскисленной, так называемой спокойной стали, отлитой в изложницу с утепленной подложкой, усадочная раковина образуется в верхней части слитка и в объёме всего слитка содержится малое количество газовых пузырей и раковин. Недостаточно раскисленная, так называемая кипящая сталь, содержит раковины и пузыри во всем объёме. Поэтому спокойный металл более плотный, чем кипящий.
3.8. Методы исследования структуры
Исследование структуры металлов может проводиться:
- методом световой микроскопии;
- методом электронной микроскопии;
- рентгеноструктурный анализ;
- рентгеноспектральный анализ;
- дополнительные методы исследования.
При методе световой микроскопии с помощью различных микроскопов можно увидеть размер, форму и взаимное расположение зерен, достаточно крупные включения, некоторые крупные дефекты кристаллического строения. Для исследования готовят микрошлифы (поверхность образца должна быть отполирована до зеркального блеска, а затем протравлена специальными реактивами).
Метод электронной микроскопии проводится с помощью электронных микроскопов, которые делятся на просвечивающие электронные микроскопы (ПЭМ) и растровые электронные микроскопы (РЭМ). Метод основан на прохождении, преломлении, рассеивании и отражении электронного пучка от поверхности исследуемого микрошлифа. При этом можно увидеть детали структуры менее 0,1мкм, однако, этот метод требует сложной подготовки образца, особенно при исследовании на просвечивающем электронном микроскопе.
Рентгеноструктурный анализ изучает строение решетки и основан на исследовании микрошлифа путем рассеивания рентгеновских лучей.
Методом спектрального анализа и аналитической химии можно определить состав сплава, при этом достигается высокая точность при определении распределения компонентов.
К дополнительным методам для определения тонкой структуры металлов и сплавов, включая дефекты типа вакансий и дислокаций, относятся:
- нейтронография;
- ядерный гамма-резонанс;
- автоионная микроскопия;
- оже-электронная спектроскопия.
4. МЕХАНИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ И СПЛАВОВ
4.1. Упругая и пластическая деформация. Несовершенства решетки и прочность металлов.
Из свойств, которыми могут обладать материалы, механические свойства в большинстве случаев являются важнейшими. Все наиболее ответственные детали и изделия изготавливают из металлов.
Для металлов характерна металлическая связь, когда в узлах кристаллической решетки расположены положительно заряженные ионы, окруженные электронным газом. Наличие металлической связи придает материалу (металлу) способность к пластической деформации и к самоупрочнению в результате пластической деформации.
Способность металла сопротивляться воздействию внешних сил характеризуется механическими свойствами. Поэтому при выборе материала для изготовления деталей машин необходимо, прежде всего, учитывать его механические свойства: прочность, упругость, пластичность, ударную вязкость, твердость и выносливость. Эти свойства определяют по результатам механических испытаний, при которых металлы подвергают воздействию внешних сил (нагрузок). Внешние силы могут быть статическими, динамическими или циклическими (повторно-переменными). Нагрузка вызывает в твердом теле напряжение и деформацию.
Напряжение – величина нагрузки, отнесенная к единице площади поперечного сечения испытуемого образца.
Деформация – изменение формы и размеров твердого тела под влиянием приложенных внешних сил. Деформация может быть упругой, исчезающей после снятия нагрузки, и пластической, остающейся после снятия нагрузки.
Пластичность – свойство твердых тел, не разрушаясь, необратимо изменять свои внешние формы (пластически течь) под действием внешних сил или внутренних напряжений. Пластические изменения формы металлического тела называют пластической деформацией.
Пластическая деформация может осуществляться скольжением и двойникованием, обычно при участии дислокационных дефектов (рис. 4.1).
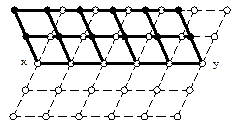
Рис. 4.1. Схема процесса скольжения и двойникования
Чем больше в металле плоскостей и направлений скольжения, тем выше его способность к пластической деформации (рис. 4. 2). Металлы, имеющие кристаллическую решетку ОЦК и ГЦК, пластичны.
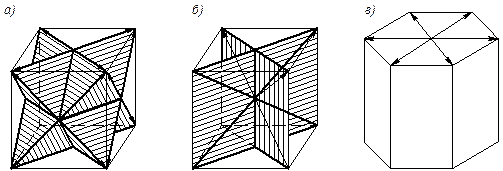
Рис. 4.2. Плоскости и направления (заштрихованные плоскости) скольжения в кристаллической решетке: а – ГЦК; б – ОЦК; в – ГПУ
Скольжение – последовательное перемещение одной части кристалла по отношению к другой в результате перемещения уже имеющихся в кристалле дислокаций или только возникающих (рис. 4.3).
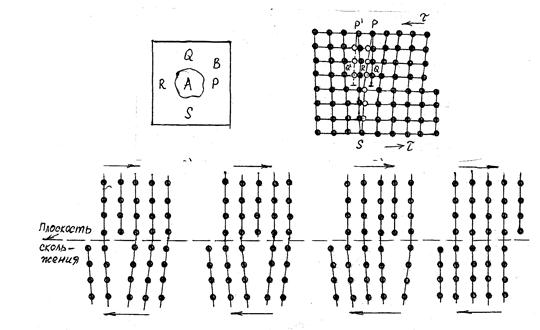
Рис. 4.3. Схема дислокационного механизма пластической деформации
Чтобы представить особенности движения дислокаций на разных стадиях деформирования, на рис. 4.4 показана кривая деформационного упрочнения, типичная для монокристалла с решеткой ГЦК.

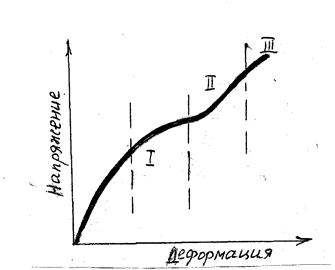
Рис. 4.4. Кривая деформационного упрочнения, типичная для монокристаллов ГЦК
Упрочняемость металла зависит от количества дислокаций, участвующих в процессе пластической деформации, и характера их движения.
На стадии I (рис. 4.4) наблюдается скольжение единичных дислокаций (ламинарное движение), торможение которых (упрочнение) осуществляется только границами субзерен и поэтому невелико.
На стадии II начинается турбулентное скольжение большого числа дислокаций. Упрочнение происходит за счет малоподвижных порогов и барьеров. Скорость упрочнения максимальная.
На стадии III скольжение идет преимущественно за счет поперечного скольжения винтовых дислокаций.
Для различных металлов степени развития этих стадий различны.
Упрочнение (наклеп) при пластической деформации обусловлено образованием малоподвижных порогов и барьеров при пересечении дислокаций, увеличением плотности дислокаций, измельчением зерна.
Формоизменение поликристаллического тела при обработке давлением – более сложный процесс. Пластическая деформация происходит в каждом из зерен, которые различно ориентированы по отношению друг к другу и к деформирующей нагрузке, различны по форме и размерам и обладают неодинаковыми физико-механическими свойствами. Кроме того, при пластической деформации поликристаллов большую роль играют межкристаллитные прослойки – границы зерен (рис. 4.5).
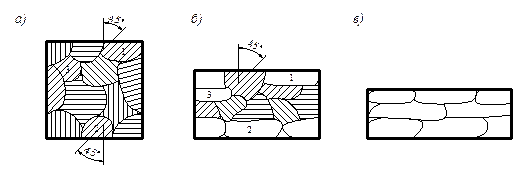
Рис. 4.5. Схема образования текстуры в поликристаллитном теле: а – расположение зерен; б – изменение формы зерен в направлении главной деформации; в - текстура
Различают два вида деформации: внутрикристаллитную (по зерну) и межкристаллитную (по границам зерен).
Внутрикристаллитная деформация осуществляется путем сдвига, скольжения, двойникования, как в монокристалле.
Межкристаллитная деформация осуществляется путем поворота, перемещения одних зерен относительно других.
Оба вида деформации протекают одновременно. Деформация начинается в зернах, плоскости скольжения которых составляют угол 45о с направлением усилия (рис.4.5 а).
При большой деформации в результате процессов скольжения зерна меняют свою форму, вытягиваются в направлении главной деформации (рис. 4.5 б) и образуют волокнистую или слоистую структуру. Такую структуру называют текстурой (рис. 4.5 в), приводящей к анизотропии свойств металла.
Металлы с ГЦК - решеткой упрочняются сильнее, чем с ОЦК- решеткой.
В результате пластической деформации с ростом плотности дислокаций возрастает предел прочности металла, образуется текстура, возрастают сопротивляемость металла деформации и твердость, уменьшается пластичность и ударная вязкость, повышаются электросопротивление и коэрцитивная сила, уменьшается магнитная проницаемость.
С увеличением напряжений выше предела прочности возникают магистральные трещины, и материал разрушается по вязкому или хрупкому механизму.
4.2. Методы испытания металлов и сплавов
Для установления комплекса механических свойств металлов образцы из исследуемого материала подвергают статическим и динамическим испытаниям.
Статическими называются испытания, при которых прилагаемая к образцу нагрузка возрастает медленно и плавно.
4.2.1. К статическим испытаниям относят испытание на растяжение, сжатие, кручение, изгиб, а также определение твердости.
В результате испытаний на статическое растяжение, которое проводят на разрывных машинах, получают диаграмму растяжения (рис.4.6 а) и диаграмму условных напряжений (рис. 4.6 б) пластичного металла.

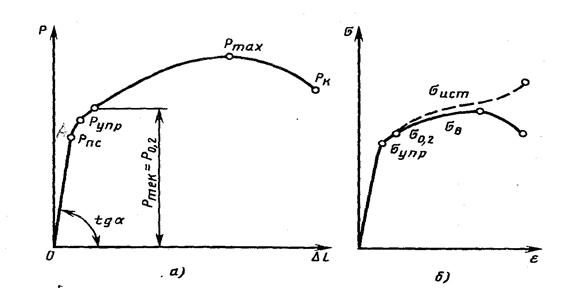
Рис. 4.6. Изменение деформации в зависимости от напряжения:
а – диаграмма растяжения пластичного материала; б – диаграмма условных напряжений пластичного материала
Из графика видно, что сколь бы ни было мало приложенное напряжение, оно вызывает деформацию, причем начальные деформации являются всегда упругими и величина их находится в прямой зависимости от напряжения. На кривой, приведенной на диаграмме(рис. 4.6), упругая деформация характеризуется линией ОА и ее продолжением.
Выше точки А нарушается пропорциональность между напряжением и деформацией. Напряжение вызывает уже не только упругую, но и пластическую деформацию.
Представленная на рис. 4.6 зависимость между приложенным извне напряжением и вызванной им относительной деформацией характеризует механические свойства металлов:
- наклон прямой ОА (рис. 4.6а) показывает жесткость металла или характеристику того, как нагрузка, приложенная извне, изменяет межатомные расстояния, что в первом приближении характеризует силы межатомного притяжения; тангенс угла наклона прямой ОА пропорционален модулю упругости (Е), который численно равен частному от деления напряжения на относительную упругую деформацию (Е= s / e);
- напряжение sпц (рис. 4.6б), которое называется пределом пропорциональности, соответствует моменту появления пластической деформации. Чем точнее метод измерения деформации, тем ниже лежит точка А;
- напряжение sупр (рис. 4.1б), которое называется пределом упругости, и при котором пластическая деформация достигает заданной малой величины, установленной условиями. Часто используют значения остаточной деформации 0,001; 0,005; 0,02 и 0,05%. Соответствующие пределы упругости обозначают s0,005, s0,02 и т.д. Предел упругости – важная характеристика пружинных материалов, которые используют для упругих элементов приборов и машин;
- напряжение s0,2, которое называется условным пределомтекучести и которому соответствует пластическая деформация 0,2 %. Физический предел текучести sт определяется по диаграмме растяжения, когда на ней имеется площадка текучести. Однако при испытаниях на растяжение большинства сплавов площадки текучести на диаграммах нет Выбранная пластическая деформация 0,2 % достаточно точно характеризует переход от упругих деформаций к пластическим, а напряжение s0,2 несложно определяется при испытаниях независимо от того, имеется или нет площадка текучести на диаграмме растяжения. Допустимое напряжение, которое используют в расчетах, выбирают обычно меньше s0,2 в 1,5 раза;
- максимальное напряжение sв, которое называется временным сопротивлением, характеризует максимальную несущую способность материала, его прочность, предшествующую разрушению, и определяется по формуле
sв = Р max / Fo
Допустимое напряжение, которое используют в расчетах, выбирают меньше sв в 2,4 раза.
Пластичность материала характеризуется относительным удлинением d и относительным сужением y:
d = [( lк – lо) / lо] * 100,
y = [( Fо – Fк) / Fо] * 100,
где lо и Fо – начальные длина и площадь поперечного сечения образца;
lк - конечная длина образца;
Fк – площадь поперечного сечения в месте разрыва.
4.2.2. Твердость– способность материалов сопротивляться пластической или упругой деформации при внедрении в него более твердого тела, которое называется индентором.
Существует разные методы определения твердости.
Твердость по Бринеллю определяется как отношение нагрузки при вдавливании стального шарика в испытуемый материал к площади поверхности полученного сферического отпечатка (рис. 4.7а).
HB = 2P / pD [D - Ö D2 – d2],
где Р – нагрузка, кгс;
D – диаметр шарика, мм;
d – диаметр лунки, мм
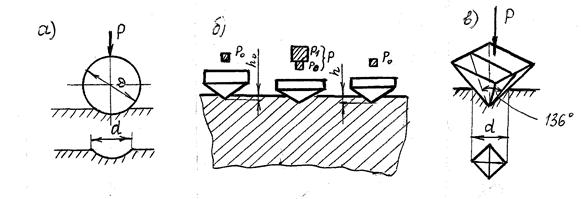
Рис. 4.7. Схемы испытания на твердость: а – по Бринеллю; б – по Роквеллу; в – по Виккерсу
Твердость по Роквеллу определяется глубиной проникновения в испытуемый материал алмазного конуса с углом при вершине 120о или закаленного шарика диаметром 1,588 мм (рис. 4.7.б).
Конус или шарик вдавливают двумя последовательными нагрузками:
- предварительной Ро = 10 н;
- общей Р = Ро + Р1, где Р1 – основная нагрузка.
Твердость обозначается в условных единицах:
- для шкал А и С HR = 100 – (h – ho) / 0,002
- для шкалы В HR = 130 – (h – hо) / 0,002
Для определения твердости используется алмазный конус при нагрузке 60 Н (HRA), алмазный конус при нагрузке 150 Н (HRC) или стальной шарик диаметром 1,588 мм (HRB).
Твердость по Виккерсу измеряют для деталей малой толщины и тонких поверхностных слоев, полученных химико-термической обработкой.
Эта твердость определяется как отношение нагрузки при вдавливании в испытуемый материал алмазной четырехгранной пирамиды с углом между гранями 136о к площади поверхности полученного пирамидального отпечатка (рис. 4.7.в):
HV = 2P * sin a/2 / d2 = 1,854 P/d2,
где P – нагрузка, кгс;
a = 136о – угол между гранями;
d – среднее арифметическое длин обеих диагоналей, мм.
Величину HV находят по известному d согласно формуле или по расчетным таблицам согласно ГОСТ 2999-75.
Микротвердость, учитывая структурную неоднородность металла, применяют для измерения малых площадей образца. При этом вдавливают пирамиду как при определении твердости по Виккерсу, при нагрузке Р = 5-500 Н, а среднее арифметическое длин обеих диагоналей (d) измеряется в мкм. Для измерения микротвердости используется металлографический микроскоп.
4.2.3. Сопротивление материала разрушению при динамических нагрузках характеризует ударная вязкость. Её определяют (ГОСТ 9454-78) как удельную работу разрушения призматического образца с концентратором (надрезом) посередине одним ударом маятникового копра (рис. 4.8): КС = К / So ( К – работа разрушения; So – площадь поперечного сечения образца в месте концентратора).
Рис. 4.8. Схема испытаний на ударную вязкость
Ударную вязкость (МДж/м2) обозначают KCU, KCV и KCT. Буквы КС означают символ ударной вязкости, буквы U, V, T – вид концентратора: U-образный с радиусом надреза rн = 1 мм, V-образный с rн = 0,25 мм; T – трещина усталости, созданная в основании надреза; KCU – основной критерий ударной вязкости; KCV и KCT используют в специальных случаях.
Работа, затраченная на разрушение образца, определяется по формуле
Ан = Р * l1( cos b - cos a),
где Р - масса маятника, кг;
l1 – расстояние от оси маятника до его центра тяжести;
b - угол после удара;
a - угол до удара
4.2.4. Циклическая долговечность характеризует работоспособность материала в условиях многократно повторяющихся циклов напряжений. Цикл напряжений – совокупность изменения напряжения между двумя его предельными значениями smax и smin в течение периода Т (рис. 4.9).
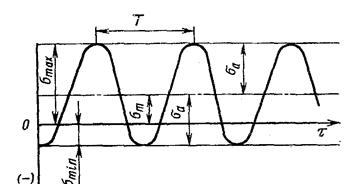
Рис. 4.9. Синусоидальный цикл изменения напряжений
Различают симметричные циклы (R = -1) и асимметричные (R изменяется в широких пределах). Различные виды циклов характеризуют различные режимы работы деталей машин.
Процессы постепенного накопления повреждений в материале под действием циклических нагрузок, приводящие к изменению его свойств, образованию трещин, их развитию и разрушению, называют усталостью, а свойство противостоять усталости – выносливостью (ГОСТ 23207 – 78).
На усталость деталей машин влияют ряд факторов (рис. 4.10).
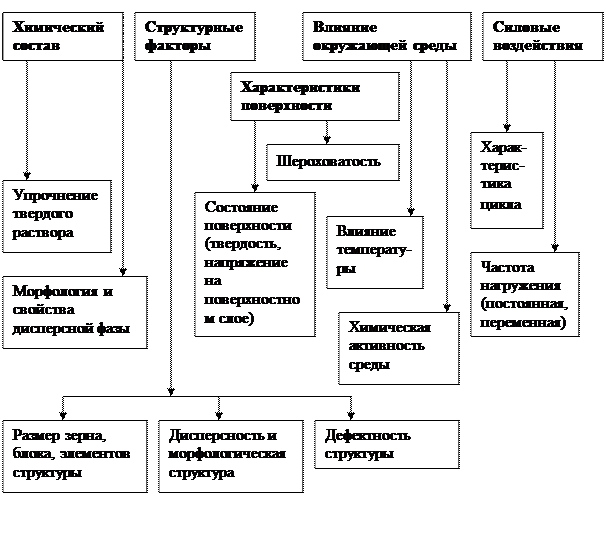
Рис. 4.10. Факторы, влияющие на усталостную прочность
Разрушение от усталости по сравнению с разрушением от статической нагрузки имеет ряд особенностей:
- оно происходит при напряжениях, меньших, чем при статической нагрузке, меньших пределах текучести или временного сопротивления;
- разрушение начинается на поверхности (или вблизи от нее) локально, в местах концентрации напряжений (деформации). Локальную концентрацию напряжений создают повреждения поверхности в результате циклического нагружения либо надрезы в виде следов обработки, воздействия среды;
- разрушение протекает в несколько стадий, характеризующих процессы накопления повреждений в материале, образования трещин усталости, постепенное развитие и слияние некоторых из них в одну магистральную трещину и быстрое окончательное разрушение;
- разрушение имеет характерное строение излома, отражающее последовательность процессов усталости. Излом состоит из очага разрушения (места образования микротрещин) и двух зон – усталости и долома (рис. 4.11).
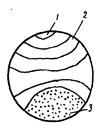
Рис. 4.11. Схема излома усталостного разрушения: 1 – очаг зарождения трещины; 2 – зона усталости; 3 – зона долома
4.3. Конструкционная прочность металлов и сплавов
Конструкционная прочность металлов и сплавов – это комплекс прочностных свойств, которые находятся в наибольшей корреляции со служебными свойствами данного изделия.
Сопротивление материала хрупкому разрушению является важнейшей характеристикой, определяющей надежность работы конструкции.
Переход к хрупкому разрушению обусловлен рядом факторов:
- природой сплава (типом решетки, химическим составом, величиной зерна, загрязнением сплава);
- особенностью конструкции (наличием концентраторов напряжений);
- условиями эксплуатации (температурным режимом, наличием нагрузки на металл).
Существует несколько критериев оценки конструкционной прочности металлов и сплавов:
- критерии, определяющие надежность металлов против внезапных разрушений (критическая температура хрупкости; вязкость разрушения; работа, поглощаемая при распространении трещины; живучесть при циклическом нагружении);
- критерии, определяющие долговечность материала (усталостная прочность; контактная выносливость; износостойкость; коррозионная стойкость).
Для оценки надежности материала используют также параметры: 1) ударную вязкость KCV и КCT; 2) температурный порог хладноломкости t 50. Однако эти параметры только качественные, непригодные для расчета на прочность.
Параметром KCV оценивают пригодность материала для сосудов давления, трубопроводов и других конструкций повышенной надежности.
Параметр KCT, определяемый на образцах с трещиной усталости у основания надреза, более показателен. Он характеризует работу развития трещины при ударном изгибе и оценивает способность материала тормозить начавшееся разрушение. Если материал имеет KCT = 0, то это означает, что процесс его разрушения идет без затраты работы. Такой материал хрупок, эксплуатационно ненадежен. И, наоборот, чем больше параметр KCT, определенный при рабочей температуре, тем выше надежность материала в условиях эксплуатации. KCT учитывают при выборе материала для конструкций особо ответственного назначения (летательных аппаратов, роторов турбин и т. п.).
Порог хладноломкости характеризует влияние снижения температуры на склонность материала к хрупкому разрушению. Его определяют по результатам ударных испытаний образцов с надрезом при понижающейся температуре.
На переход от вязкого разрушения к хрупкому указывают изменения строения излома и резкое снижение ударной вязкости (рис.4.12), наблюдаемое в интервале температур (tв – tх) (граничные значения температур вязкого и хрупкого разрушения).
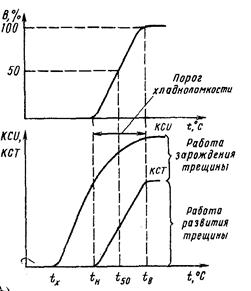
Рис. 4.12. Влияние температуры испытания на процент вязкой составляющей в изломе (В) и ударную вязкость материала KCV, KCT
Строение излома изменяется от волокнистого матового при вязком разрушении (t > tв) до кристаллического блестящего при хрупком разрушении (t < tх). Порог хладноломкости обозначают интервалом температур (tв – tн) либо одной температурой t50, при которой в изломе образца имеется 50 % волокнистой составляющей, и величина КСТ снижается наполовину.
О пригодности материала для работы при заданной температуре судят по температурному запасу вязкости, равному разности температуры эксплуатации и t 50. При этом, чем ниже температура перехода в хрупкое состояние по отношению к рабочей температуре, тем больше температурный запас вязкости и выше гарантия от хрупкого разрушения.
4.4. Пути повышения прочности металлов
Принято различать техническую и теоретическую прочность. Техническую прочность определяют значением свойств: предела упругости (s0,05); предела текучести (s0,2); предела прочности (sв); модуля упругости (Е); предела выносливости (sR).
Под теоретической прочностью понимают сопротивление деформации и разрушению, которое должны были бы иметь материалы согласно физическим расчетам с учетом сил межатомного взаимодействия и предположения, что два ряда атомов одновременно смещаются относительно друг друга под действием напряжения сдвига.
Исходя из кристаллического строения и межатомных сил можно ориентировочно определить теоретическую прочность металла по следующей формуле:
tтеор » G / 2p,
где G – модуль сдвига.
Теоретическое значение прочности, рассчитываемое по указанной формуле, в 100 – 1000 раз больше технической прочности. Это связано с дефектами в кристаллическом строении, и прежде всего с существованием дислокаций. Прочность металлов не является линейной функцией плотности дислокаций (рис. 4.13).
| |
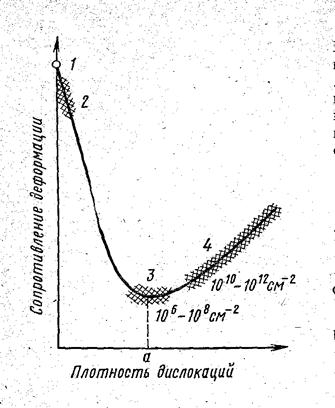
Рис. 4.13. Схема зависимости сопротивления деформации от плотности и других дефектов в металлах:1 – теоретическая прочность; 2-4 – техническая прочность (2 – усы; 3 – чистые неупрочненные металлы; 4 –сплавы, упрочненные легированием, наклепом, термической или термомеханической обработкой)
Как видно из рисунка 4.13, минимальная прочность определяется некоторой критической плотностью дислокаций а, приближенно составляющей 106 – 108 см-2. Эта величина относится к отожженным металлам. Величина s0,2 отожженных металлов составляет 10-5 – 10-4 G. Если а > 1012 – 1013 см-2, то в этом случае могут образоваться трещины.
Если плотность дислокаций (количество дефектов) меньше величины а (рис.4.13), то сопротивление деформации резко увеличивается и прочность быстро приближается к теоретической.
Повышение прочности достигается:
- созданием металлов и сплавов с бездефектной структурой, т.е. получение нитевидных кристаллов («усов»);
- повышение плотности дефектов, в том числе дислокаций, а также структурных препятствий, затрудняющих движение дислокаций;
- создание композиционных материалов.
4.5. Влияние нагрева на строение и свойства деформированного металла (рекристаллизация)
Пластическая деформация (рис. 4.14) приводит к созданию неустойчивого состояния материала из-за возросшей внутренней энергии (внутренних напряжений). Деформирование металла сопровождается его упрочнением или так называемым наклепом. Самопроизвольно должны происходить явления, возвращающие металл в более устойчивое структурное состояние.
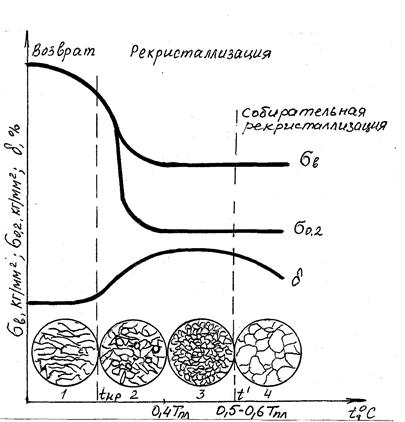
Рис. 4.14. Влияние нагрева на механические свойства и структуру нагартованного металла
К самопроизвольным процессам, которые приводят пластически деформированный металл к более устойчивому состоянию, относятся снятие искажения кристаллической решетки, другие внутризеренные процессы и образование новых зерен. Для снятия напряжений кристаллической решетки не требуется высокой температуры, так как при этом происходит незначительное перемещение атомов. Уже небольшой нагрев (для железа 300 –400 оС) снимает искажения решетки, а именно уменьшает плотность дислокаций в результате их взаимного уничтожения, слияния блоков, уменьшения внутренних напряжений, уменьшения количества вакансий и т.д.
Исправление искаженной решетки в процессе нагрева деформированного металла называется возвратом или отдыхом. При этом твердость металла снижается на 20-30 % по сравнению с исходным, а пластичность возрастает.
Параллельно с возвратом при температуре 0,25 – 0,3 Тпл происходит полигонизация (сбор дислокаций в стенки) и образуется ячеистая структура.
Одним из способов снятия внутренних напряжений при деформации материалов является рекристаллизация. Рекристаллизация, т.е. образование новых зерен, протекает при более высоких температурах, чем возврат, может начаться с заметной скоростью после нагрева выше определенной температуры. Чем выше чистота металла, тем ниже температура рекристаллизации. Между температурами рекристаллизации и плавления существует связь:
Трек = а * Тпл,
где а – коэффициент, зависящий от чистоты металла.
Для технически чистых металлов а = 0,3 – 0,4, для сплавов а = 0,8.
Температура рекристаллизации имеет важное практическое значение. Чтобы восстановить структуру и свойства наклепанного металла (например, при необходимости продолжить обработку давлением путем прокатки, протяжки, волочения и т.п.), его надо нагреть выше температуры рекристаллизации. Такая обработка называется рекристаллизационным отжигом.
Процесс рекристаллизации можно разделить на два этапа:
- первичную рекристаллизацию или рекристаллизацию обработки, когда вытянутые вследствие пластической деформации зерна превращаются в мелкие округлой формы беспорядочно ориентированные зерна;
- вторичную или собирательную рекристаллизацию, заключающуюся в росте зерен и протекающую при более высокой температуре.
Первичная кристаллизация заключается в образовании новых зерен. Это обычно мелкие зерна, возникающие на поверхностях раздела крупных деформированных зерен. Хотя в процессе нагрева и происходят внутризеренные процессы устранения дефектов (возврат, отдых), все же они, как правило, полностью не заканчиваются, с другой стороны, вновь образовавшееся зерно уже свободно от дефектов.
К концу первой стадии рекристаллизации можно получить структуру, состоящую только из очень мелких зерен, в поперечнике имеющих размер в несколько микрон. Но в этот момент наступает процесс вторичной кристаллизации, заключающийся в росте зерна.
Возможны три существенно различных механизма роста зерна:
- зародышевый, состоящий в том, что после первичной кристаллизации вновь возникают зародышевые центры новых кристаллов, их рост приводит к образованию новых зерен, но их меньше, чем зерен в исходном состоянии, и поэтому после завершения процесса рекристаллизации зерна в среднем станут крупнее;
- миграционный, состоящий в перемещении границы зерна и увеличении его размеров. Крупные зерна растут за счет «поедания» мелких;
- слияние зерен, состоящее в постепенном «растворении» границ зерен и объединении многих мелких зерен в одно крупное. При этом образуется разнозернистая структура с низкими механическими свойствами.
Реализация одного из основных механизмов роста зависит:
- от температуры. При низких температурах рост идет за счет слияния зерен, при высоких – за счет миграции границ зерен;
- от исходного состояния ( от степени деформации). При малой степени деформации (3-8%) первичная рекристаллизация затруднена, и рост зерна идет за счет слияния зерен. В конце процесса образуются гигантские зерна. При большой степени деформации (более 10 %) слияние зерен затрудняется, и рост идет за счет миграции границ зерен. Образуются более мелкие зерна. Таким образом, после отжига получается равновесная структура, изменяются механические свойства, снимается наклеп металла, повышается пластичность.
5. ОСНОВЫ ТЕОРИИ СПЛАВОВ
5.1. Строение сплавов
Чистые металлы обладают низкой прочностью и не обеспечивают требуемых механических и технологических свойств, поэтому наиболее широко в технике (промышленности) используют сплавы.
Металлическим сплавом называется вещество, полученное сплавлением двух и более исходных веществ, преимущественно металлических, и обладающее металлическими свойствами.
В настоящее время сплавы получают:
- сплавлением;
- спеканием (порошковая металлургия);
- электролизом;
- возгонкой (сублимацией);
- плазменным напылением и др.
Вещества, образующие сплав, называются компонентами.
В сплавах компоненты могут различно взаимодействовать друг с другом, образуя те или иные фазы.
Фазой называется однородная по химическому составу, кристаллической структуре, физическим свойствам часть гетерогенной термодинамической системы, отделенная от других ее частей поверхностью раздела, при переходе через которую химический состав или структура изменяются скачком.
Система – это совокупность фаз, находящихся в равновесии и разграниченных поверхностями раздела.
При кристаллизации сплавов могут образовываться следующие основные твердые фазы: твердые растворы, химические соединения, механические смеси.
Твердыми растворами называют фазы, в которых один из компонентов сплава сохраняет свою кристаллическую решетку, а атомы другого или других компонентов располагаются в кристаллической решетке первого компонента (растворителя), изменяя ее размеры (периоды).
Твердые растворы имеют металлический тип связей. По характеру распределения атомов растворенного вещества в кристаллической решетке растворителя различают твердые растворы: замещения, внедрения, вычитания (рис. 5.1).
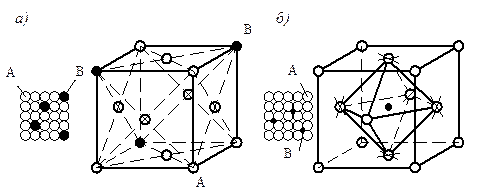
Рис. 5.1. Схема строения кристаллических решеток: а – твердый раствор замещения; б – твердый раствор внедрения.
Твердые растворы замещения образуются при замене атомов в кристаллической решетке растворителя атомами растворенного компонента (рис. 5.1а). Твердые растворы замещения могут быть с ограниченной и
неограниченной растворимостью и могут быть образованы при соблюдении следующих условий:
- компоненты должны обладать одинаковыми по типу кристаллическими решетками;
- различие в атомных радиусах компонентов не должно быть больше 8-13 % (при разности атомных радиусов меньше 8 % происходит полная взаимная растворимость одного компонента в другом и образуется неограниченный твердый раствор; при разности атомных радиусов в пределах 8-13 % получаются растворы ограниченной растворимости одного компонента в другом; при разности атомных радиусов больше 15 % имеет место полная взаимная нерастворимость и образование механической смеси или химического соединения);
- компоненты должны принадлежать к одной и той же группе периодической системы элементов или к смежной, обладать близким строением валентной оболочки атомов (чем больше разница в валентности элементов, вступающих во взаимодействие, тем меньше растворимость).
Например: В одновалентной меди (Cu), имеющей гранецентрированную кубическую решетку (ГЦК) растворяется 38 % Zn (2-валентного), 9 % Al (3 – валентного), 6 % As ( 5 – валентного). В системе Au – Ag существует полная взаимная растворимость.
Твердые растворы внедрения (рис.5.1б)образуются только в том случае, если внедряемые атомы имеют малые размеры и проникают в поры кристаллической решетки растворителя (H, C, N, B).
Твердые растворы вычитания образуются на базе металлических соединений (интерметаллидов), в структуре которых имеются узлы кристаллической решетки, не занятые атомами одного из компонентов.
Твердые растворы обозначаются малыми буквами греческого алфавита (рис.5.2)

Рис. 5.2. Схема структуры твердого раствора (компонента В в А)
При определенных условиях атомы растворенного элемента могут занимать определенные места в решетке, т.е. упорядоченно располагаться. Такие твердые растворы называются упорядоченными твердыми растворами (рис.5.3).
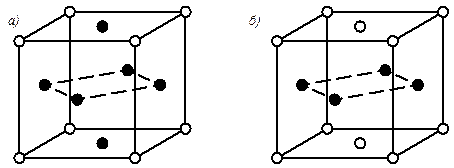
Рис. 5.3. Кристаллические решетки упорядоченных твердых растворов в системе Cu – Au
При упорядочении решетки (диффузионный отжиг) изменяется период решетки, но тип решетки остается. Например, упорядоченный раствор CuAu (1:1) имеет гранецентрированную тетрагональную решетку с отношением периодов с / а = 0,935, а неупорядоченный раствор – кубическую гранецентрированную с отношением периодов с / а = 1.
Твердые растворы составляют основу большинства промышленных конструкционных и инструментальных сплавов и обладают хорошей технологической пластичностью.
5.2. Химические соединения
Характерными особенностями химических соединений являются:
- кристаллическая решетка отличается от решеток компонентов, образующих соединение (рис.5.4). Атомы в решетке химического соединения располагаются упорядоченно, т.е. атомы каждого компонента расположены закономерно и по определенным узлам решетки. Большинство химических соединений имеют сложную кристаллическую структуру;
- в соединении всегда сохраняется простое кратное соотношение компонентов. Это позволяет выразить их состав простой формулой АnBm, где А и В – соответствующие элементы; n и m – простые числа. Например, у CuAl2 соотношение количества атомов Cu и Al – 1: 2;
- свойства соединения резко отличаются от свойств образующих его компонентов;
- температура плавления (диссоциации) постоянная;
- образование химического соединения сопровождается значительным тепловым эффектом.
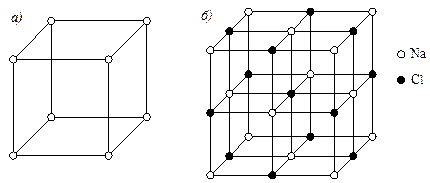
Рис. 5.4. Кристаллические решетки: а - Na; б – химического соединения NaCl
Химические соединения делятся на две группы:
- соединения с нормальной валентностью, т.е. соединения металлов с типичными неметаллами. Такими соединениями являются оксиды, сульфиды, хлориды. В сплавах эти соединения присутствуют в виде так называемых неметаллических включений;
- металлические соединения, которые отличаются разнообразием типов межатомных связей (металлической, ковалентной, ионной) и благодаря этому характеризуются металлическим блеском, электропроводностью и в отдельных случаях сверхпроводимостью. Металлические соединения при обычных температурах тверды и хрупки, однако при нагреве до температур, равных 70…90 % от температуры плавления, эти соединения очень пластичны, что объясняется увеличением при нагреве доли металлической связи между атомами.
При промежуточных значениях разности атомных размеров также возможно образование химических соединений. К ним относятся:
- Фазы Лавеса ( устойчивое химическое соединение с ионным типом связи), образующееся между элементами различной природы, атомные диаметры которых находятся приблизительно в соотношении 1: 1,2. Эти фазы удовлетворяют условиям, характеризующим химическое соединение с соотношением атомов, которое укладывается в формулу АВ2. Например: MgZn2, MgNi2..
Фазы Лавеса встречаются как упрочняющие интерметаллидные фазы в жаропрочных сплавах.
- Фазы внедрения, которые образуют металлы переходных групп с металлоидами, имеющими малый атомный радиус. Фазы внедрения образуются, если отношение атомного радиуса металлоида к атомному радиусу металла равно или меньше 0,59. В отличие от фаз Лавеса, при образовании фаз внедрения металлы образуют простые кристаллические решетки (обычно ОЦК, ГЦК, ГПУ). В этом случае образуются химические соединения, которые имеют соотношение атомов, укладывающиеся в простые формулы. Например:
Ме4Х: Fe4N, Mn4N;
Ме2Х: W2C, Mo2C, Fe2N;
МеХ: WC, VC, TiC, NbC, TiN.
Карбиды и нитриды, встречающиеся в сталях, являются фазами внедрения.
5.3. Электронные соединения (фазы Юм – Розари)
Этот вид соединений образуется между двумя металлами группы: Cu, Ag, Au, Fe, Co, Ni, Pt, Pd c металлами группы Be, Zn, Cd, Al, Sn, Si. Соединения этого типа имеют определенное отношение числа валентных электронов к числу атомов, т.е. определенную электронную концентрацию. Каждому соотношению числа валентных электронов и числу атомов соответствует определенный тип кристаллической решетки: при соотношении 3 : 2 (1,5) образуется ОЦК-решетка (b - фаза). Например, химические соединения Cu-Zn, Cu-Be, Cu5Sn, NiAl; при соотношении 21: 13 (1,62) образуется сложная кубическая решетка (g - фаза). Например, химические соединения Cu5Zn8, Cu3Cd8, Cu81Sn8; при соотношении 7: 4 (1,75) образуется гексагональная решетка (e - фаза). Например, химические соединения CuZn3, CuCd3, Cu3Si, Cu3Sn.
При сплавлении переходных металлов, имеющих близкие размеры атомов, образуются фазы переменного состава (s - фаза). Эти фазы имеют частично упорядоченную сложную решетку.
В железных сплавах, содержащих больше 20 % Cr, которые используются как коррозионно-стойкие конструкционные материалы, очень медленное охлаждение из области твердого раствора или изотермические выдержки при 800-600 оС приводят к образованию кристаллов s - фазы, которое сопровождается резким увеличением твердости и охрупчиванием сплавов.
5.4. Механические смеси
Механические смеси образуются при сплавлении компонентов с большим различием атомных радиусов, значительным различием электромеханических свойств, когда их взаимная растворимость очень мала и они не вступают в химическую реакцию с образованием химического соединения. При этих условиях сплав будет состоять из кристаллов (рис. 5.5) исходных компонентов (например: сплавы Pb-Sb, Zn-Sn, Pb-Bi и др.).
Механическая смесь может быть образована:
- в результате кристаллизации, когда из жидкости одновременно кристаллизуются компоненты А и В (эвтектика – ж ® А + В)
- в результате кристаллизации, когда из жидкости одновременно кристаллизуются твердые растворы a и b (эвтектика – ж ® a + b );
- в результате распада твердого раствора на две твердые фазы (эвтектоид – g®a + А nBm).
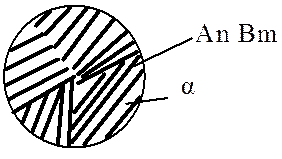
Рис. 5.5. Условное обозначение механических смесей
6. ДИАГРАММА СОСТОЯНИЯ
Диаграмма состояния – это графическое изображение фазового состояния сплавов в зависимости от температуры и концентрации компонентов в условиях равновесия.
Между тем, следует помнить, что абсолютное отсутствие взаимной растворимости в реальных сплавах не встречается. Компоненты в сплаве обозначают символами их элементов.
Диаграмма состояния позволяет:
- определить для каждого сплава, какие фазы, при каких температурах находятся в равновесии;
- установить состав и количественное соотношение находящихся в равновесии фаз;
- предсказать приблизительно структуру сплава, а иногда определить количественное соотношение структурных составляющих.
Общие закономерности сосуществования устойчивых фаз, отвечающих условиям равновесия, могут быть выражены в математической форме, называемой правилом фаз или законом Гибса.
Правило фаз (или закон Гибса) дает количественную зависимость между степенью свободы системы и количеством фаз и компонентов:
C = K – F + 2,
где (если считать для металлов давление постоянным, т.е. Р - const )
C – число степеней свободы, т.е число внешних ( температура и давление) и внутренних ( концентрация) факторов, которые можно изменить без изменения числа фаз;
K – число компонентов в системе;
F – число фаз.
Пример: если С = 0, то любое изменение температуры вызывает изменение числа фаз; если С = 1, то возможно изменение температуры без изменения числа фаз.
В жидком состоянии:
F = 1 – одна фаза;
К = 1 – один компонент (чистый металл);
С = 1- 1 + 1 = 1 – можно изменять температуру без изменения агрегатного состояния.
В момент кристаллизации:
F = 2 – две фазы (жидкость + кристаллы)
K = 1 – один компонент (чистый металл);
C = 1 – 2 + 1 = 0 – равновесие при строго определенной температуре (Тпл)
Определив степень свободы для чистого металла и сплава в жидком состоянии и в момент кристаллизации, можно построить кривые нагрева в координатах температура – время (рис.6.1, 6.2).
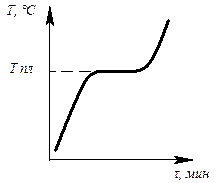
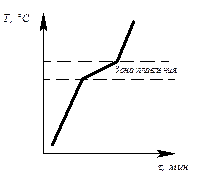
Рис. 6.1. Кривая нагрева Рис. 6.2. Кривая нагрева
чистого металла сплава
Степень свободы для сплава в момент кристаллизации:
F = 2 - две фазы;
K = 2 – два компонента;
С = 2 – 2 + 1.
6.1. Построение диаграмм состояния (равновесия)
Для построения диаграмм состояния, особенно для определения температур затвердевания сплава, используется термический анализ. Для изучения превращений в сплаве в твердом состоянии используют методы физико-химического анализа:
- микроанализ;
- рентгеноструктурный;
- дилатометрический;
- электросопротивления;
- акустический.
Последовательность построения диаграмм термическим методом (компоненты А и В, фазы a , L):
- изготавливают несколько сплавов с известной концентрацией (сплав I, II, III, компоненты А и В) (рис. 6.3);
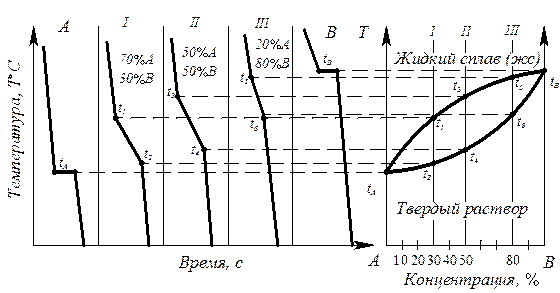
Рис. 6.3. Диаграмма состояния с образованием неограниченных твердых растворов, построенная термическим методом (диаграмма II рода)
- для каждого сплава строят кривые охлаждения в координатах температура – время, по которым определяют температуры начала и конца кристаллизации сплава;
- строят диаграмму состояния в координатах температура – концентрация, где отмечают точки начала и конца кристаллизации, найденные на кривых охлаждения.
Диаграмма состояния получается при соединении критических точек tA, t1, t3, t5, tB, t6, t4, t2, tA плавными кривыми. Полученная кривая tA t1 t3 t5 tB - геометрическое изображение на диаграмме состояния (точка, линия или поверхность) зависимости температур начала кристаллизации (или завершения расплавления) от химического состава сплава. Такая линия называется линия ликвидус. Кривая tA t2 t4 t6 t8 – геометрическое изображение (точка, линия или поверхность) на диагрмме состояния зависимости температуры конца кристаллизации (или начала плавления) от химического состояния сплава Такая линия называется линия солидус.
6.2. Правило отрезков или правило рычага
В процессе кристаллизации изменяются концентрация компонента в фазах и количество фаз. Для их определения служит правило фаз.
Рассмотрим процесс кристаллизации произвольного сплава (рис.6.4) состава 50 % А и 50 % В при очень медленном охлаждении (когда успевают проходить диффузионные процессы).
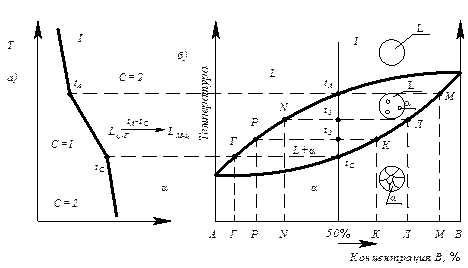
Рис. 6.4. Кривая охлаждения сплава (а) и диаграмма состояния сплава с неограниченной растворимостью в твердом состоянии (б)
При температуре tA начинается кристаллизация.
В процессе кристаллизации в интервале температур tА и tс в жидкой фазе выделяются кристаллы a(альфа) твердого раствора различного состава.
За счет диффузионных процессов (при медленном охлаждении) состав жидкой фазы изменяется по кривой линии tА ® N ® P ® Г (линия ликвидус) (рис.6.4). Состав кристаллов изменяется по линии солидус М®Л®К® tc (aM – tс) (рис.6.4).
В момент окончания кристаллизации (точка tС) состав кристаллов такой, как и состав исходной фазы (рис.6.4).
В реальных условиях быстрого охлаждения состав кристаллов будет неоднороден (рис.6.4), так как скорость кристаллизации больше скорости диффузии. Неоднородность химического состава внутри зерна называется дендритной ликвацией.
Чтобы определить концентрации компонентов в фазах, через данную точку, характеризующую состояние сплава (рис. 6. 4), проводят горизонтальную линию (коноду) до пересечения с линиями, ограничивающими данную область; проекции точек пересечения коноды с линиями диаграммы на ось концентраций показывают составы фаз.
Например, при температуре tA химический состав первичных кристаллов a определяется проекцией точки М на ось концентраций; при температуре t1 состав жидкой фазы определится проекцией точки N на ось концентраций, а состав твердой фазы – проекцией точки Л.
Для того, чтобы определить количественное соотношение фаз, через заданную точку проводят горизонтальную линию (коноду). Отрезки этой линии между заданной точкой и точками, определяющими составы фаз, обратно пропорциональны количествам этих фаз.
Например, при t1 (рис.6.4) количество жидкой фазы определяется отношением отрезков: t1Л / NЛ * 100 %; количество твердой фазы - отношением Nt1 / NЛ * 100 %.
6.3. Диаграмма состояния для сплавов, образующих механические смеси из чистых компонентов ( I рода)
Оба компонента А и В в жидком состоянии неограниченно растворимы, а в твердом – совсем не растворимы и не образуют химических соединений (свинец – сурьма) (рис. 6.5). Компоненты А и В взаимодействуют между собой при кристаллизации и образуют механическую смесь.
Механическая смесь двух или более видов кристаллов, одновременно кристаллизующихся из жидкой фазы называется эвтектикой. Это превращение идет при постоянной температуре и степени свободы, равной нулю. Такое превращение называется нонвариантным и может быть выражено схемой:
t - const
Lc ® A + B
Согласно рис. 6.5:
АСВ – линия ликвидус (линия начала кристаллизации);
ДСЕ – солидус (эвтектическая горизонталь), линия конца кристаллизации.
На кривой охлаждения (рис. 6.5) сплава 1:
участок 0 –1 соответствуют охлаждению жидкого сплава;
участок 1 – 2 – выделению кристаллов А;
участок 2 - 2¢ - совместному выделению кристаллов А и В.
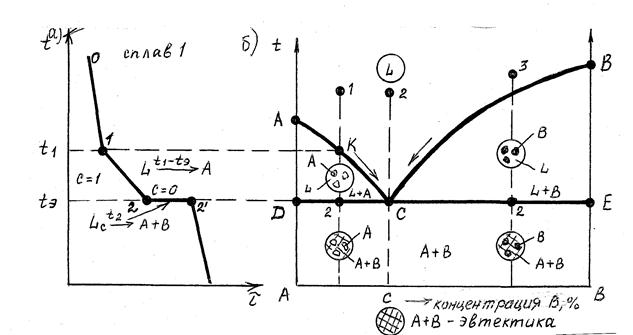
Рис. 6.5. Кривая охлаждения сплавов (а) и диаграмма I рода (б)
Сплавы с концентрацией компонента В до точки С называются дозвтектическими, с концентрацией компонента В больше точки С – заэвтектическими.
6.4. Диаграмма состояния для сплавов с ограниченной растворимостью в твердом состоянии (III рода)
Диаграмма III рода характеризует два компонента А и В, неограниченно растворимых в жидком состоянии, ограниченно – в твердом и не образующих химических соединений (олово – свинец).
При кристаллизации компоненты А и В вступают во взаимодействие и могут образовывать фазы (рис. 6.6):
a - твердый раствор компонента В в А;
b - твердый раствор компонента А в В;
aI, bII – вторичные кристаллы (из твердых кристаллов за счет уменьшения растворимости).
а) б)
|
| |
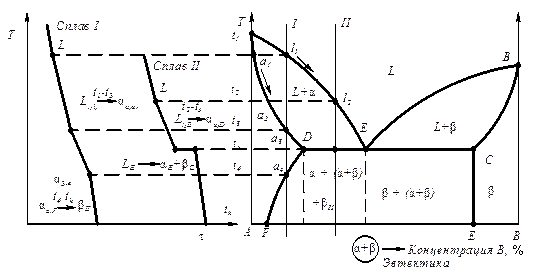
Рис. 6.6. Кривая кристаллизации (а) и диаграмма состояния с эвтектикой (б)
Предельную растворимость компонента В в компоненте А определяет точка D (рис. 6.6). С изменением температуры изменяется растворимость компонента В в А по линии DF, за счет изменения этой растворимости идет выделение вторичных кристаллов bII (рис. 6.7). Точка С определяет предельную растворимость компонентов А в В. В зависимости от температуры растворимость компонента А в В не меняется (линия CE, рис.6.6, б), а поэтому нет вторичных кристаллов aII. Линия DF называется линией сольвиус.
Сольвиус – это графическое изображение (точка, линия, поверхность) на диаграмме состояния зависимости температуры предельной растворимости элементов в твердом состоянии от химического состава.

Рис. 6.7. Схема кристаллизации сплава I

Рис. 6.8. Схема кристаллизации сплава II
Вторичная кристаллизация может происходить из-за изменения растворимости.
Кристаллизация сплава II (рис. 6.7) (доэвтектического) заканчивается образованием эвтектики (рис. 6.8), т. е. три фазы находятся в равновесии, другими словами, происходит нонвариантное превращение (С = 0), и на кривой охлаждения оно отражено горизонтальной площадкой (рис. 6.6 а).
6.5. Диаграмма с перитектикой
Другой тип нонвариантного превращения (трехфазного превращения) происходит, когда жидкая фаза взаимодействует с ранее выпавшими кристаллами (b - фазы) и они образуют новый вид кристаллов (a - фазы) (рис.6.9): Lc + bД t const® aР.
|
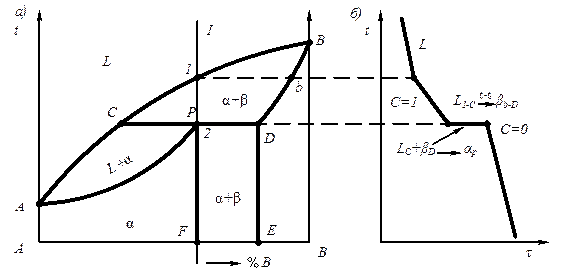
Рис. 6.9. Диаграмма состояния с перитектикой (а) и кривая
охлаждения сплава I(б)
6.6. Диаграмма состояния для сплавов, образующих химическое соединение (IV рода)
Так как компоненты А и В образуют химическое соединение АnBm, то на диаграмме (рис. 6.10) имеем перпендикулярную линию, соответствующую соотношению компонентов в химическом соединении (n : m).
Устойчивое химическое соединение имеет постоянную температуру плавления, поэтому его можно рассматривать как самостоятельный компонент и диаграммы IV рода можно рассматривать как две диаграммы с компонентами A + AnBm и AnBm + B. Вид диаграммы зависит от взаимодействия компонентов А и В между собой и химическим соединением.

Рис. 6.10. Диаграммы состояния с химическим соединением: а – по типу диаграммы I рода; б – по типу диаграммы III рода
6.7. Диаграмма состояния для сплавов, испытывающих полиморфные превращения
Превращения, связанные с кристаллизацией или плавлением сплавов, называются первичными, превращения в твердом состоянии – вторичными.
К вторичным превращениям относятся:
- изменение растворимости в твердом состоянии;
- полиморфные или аллотропические превращения;
- распад твердых растворов;
- упорядочение твердых растворов и промежуточных фаз;
- магнитные превращения.
Таким образом, превращения в твердом состоянии наблюдаются во всех случаях, при которых хотя бы один из компонентов обладает полиморфизмом.
Пример (рис. 6.11): Верхняя часть диаграммы характеризует первичную кристаллизацию, нижняя – вторичную. Компоненты А и В полиморфны, низкотемпературные модификации ограниченно растворимы друг в друге, а высокотемпературные – неограниченно, т.е. получаем сочетание диаграмм I и II родов. При температуре, соответствующей линии DСЕ, происходит распад b - твердого раствора с одновременным выделением a¢ и a¢¢ - твердых растворов:
b = a¢ + a¢¢
Превращение протекает аналогично кристаллизации эвтектики, но исходным раствором является не жидкость, а твердый раствор. Подобное превращение называется эвтектоидным, а смесь полученных кристаллов – эвтектоидом.

Рис. 6.11. Диаграмма с эвтектоидным превращением
6.8. Связь диаграммы состояния сплава с его свойствами
Вид диаграммы зависит от того, какие фазы образуют оба компонента. Свойства сплава также зависят от того, какие соединения или какие фазы образовали компоненты сплава. Поэтому между видом диаграммы состояния и свойствами сплава существует определенная связь. На рис. 6.12 приведены основные виды диаграмм состояния и соответствующие им закономерности изменения свойств сплава с изменением концентрации. Метод изучения изменений свойств в зависимости от изменения состава и построения диаграммы «состав – свойства» был положен Н.С.Курнаковым в основу разработанного им физико – химического анализа сплавов.
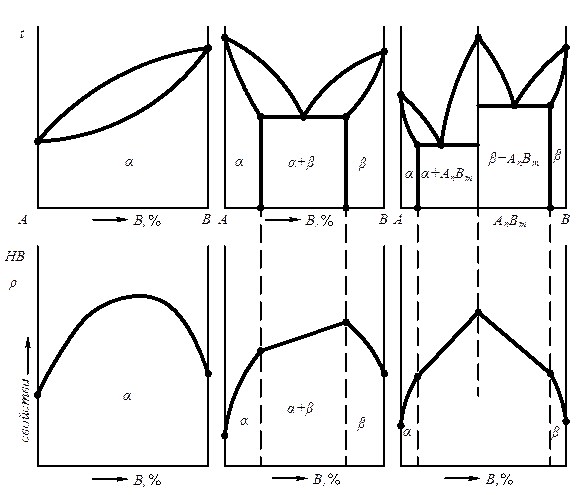
Рис. 6.12. Зависимость между строением сплавов (диаграммой состояния) и их свойствами
По А.А.Бочвару существует связь между типом диаграммы и технологическими свойствами.
Сплавы со структурой твердых растворов пластичны, легко деформируются (прокатываются, куются, прессуются).
Сплавы, имеющие в структуре эвтектическую составляющую, обладают хорошими литейными свойствами (жидкотекучестью, низкой усадкой, концентрированной усадочной раковиной).
7 АНАЛИЗ ДИАГРАММЫ «ЖЕЛЕЗО - УГЛЕРОД»
Компоненты системы – железо Fe и углерод С (рис. 7.1).
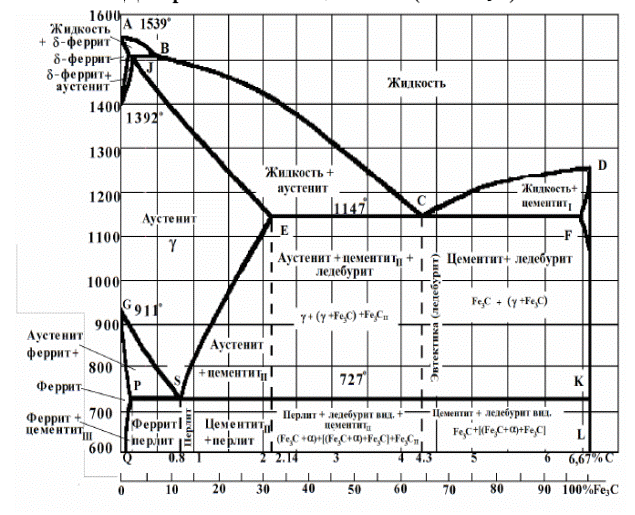
Рис. 7.1. Диаграмма состояния «Железо – карбид железа» (Fe – Fe3C)
Особенности диаграммы определяются полиморфизмом железа и углерода, а также ферромагнетизмом железа:
- от 1539 – 1392 оС железо имеет решетку ОЦК, такая модификация железа называется d (Fe);
- от 1392 – 911 оС железо имеет решетку ГЦК, такая модификация железа называется g(Fe);
- ниже 911 оС железо имеет решетку ОЦК, такая модификация называется a(Fe);
- при температуре 768 оС железо теряет магнитные свойства, и эта температура называется точкой Кюри.
В каждой модификации железа растворяется строго определенное количество углерода с образованием твердых растворов внедрения:
- d - феррит – раствор углерода в d(Fe) с ОЦК решеткой. Максимальная растворимость углерода в d(Fe) составляет 0,1 % при температуре 1499 оС;
- аустенит – твердый раствор углерода в g(Fe) с ГЦК решеткой. Максимальная растворимость углерода в g(Fe) составляет 2,14 % при температуре 1147 оС;
- a - феррит – твердый раствор углерода в a(Fe) с ОЦК решеткой. Максимальная растворимость углерода в a(Fe) составляет 0,025 % при температуре 727 оС.
Кроме указанных выше твердых растворов в системе Fe – С образуются две высокоуглеродистые фазы:
- цементит – химическое соединение Fe3С со сложной орторомбической решеткой, которое содержит 6,67 % углерода и имеет температуру плавления Тпл = 1260 оС . Эта фаза метастабильная, способная к распаду (Fe3С ® 3Fe + Сгр);
- графит – модификация углерода с ГПУ решеткой. Эта фаза стабильная, состоит на 100 % из углерода и имеет температуру плавления Тпл = 3600 оС.
В дополнение к фазам в виде твердых растворов на диаграмме имеются области существования механических смесей:
- перлит – механическая смесь (эвтектоид) феррита и цементита, содержащая 0,8 % С (рис. 7.1, точка S);
- ледебурит – механическая смесь (эвтектика) аустенита и цементита в интервале температур 1147 – 727 оС или перлита и цементита при температурах ниже 727 оС, содержащая 4,3 % углерода (рис. 7.1, точка С).
Сплошными линиями изображена диаграмма Fe – Fe3C, штриховыми – диаграмма Fe – С (рис.7.1). Основной является диаграмма Fe – Fe3С. Однофазные области диаграммы:
- выше линии ABCD (линия ликвидус) – жидкость (L);
- область AHN – область d - феррита;
- область NJESG – область аустенита;
- область GPQ – область a - феррита;
- линия LD или KD – область цементита Fe3C.
Остальные области диаграммы (рис. 7.1) – двухфазные: ледебурит, перлит и их комбинации.
7.1. Характеристика линий и точек диаграммы Fe – Fe3C
Линия АВСD - линия ликвидус – линия начала кристаллизации сплава и состоит она из трех частей:
- AB – начало образования d- феррита;
- BC – начало кристаллизации аустенита;
- CD – начало кристаллизации цементита Fe3C.
Линия AHJECF – линия солидус – линия конца кристаллизации сплава и состоит она из нескольких частей:
- AH – конец кристаллизации d- феррита;
- JE – конец кристаллизации аустенита;
- HJB - линия перитектического превращения:
Жв + FedH 1499 ® FegJ или ЖВ + ФH 1499® A аусJ
- ECF – линия эвтектического превращения:
Жс 1147® gЕ + Fe3CF или Жс 1147® АЕ + ЦI
Остальные линии соответствуют превращениям в твердом состоянии:
- NH и NJ (А4) – линии начала и конца полиморфного превращения Fed « Feg;
- GS (А3) и GP – линии начала и конца полиморфного превращения Feg « Fea;
- ES(Аст) – линия выделения вторичного цементита из аустенита (Fe3CII) за счет изменения растворимости углерода в g-железе. Эта линия называется линия сольвиус;
- PQ – линия выделения третичного цементита (Fe3CIII) за счет изменения растворимости углерода в a- железе;
- PSK (А1) – линия эвтектоидного превращения во всех сплавах независимо от содержания углерода:
FegS 727 ® FeaP + Fe3Ck или Ауст ® ФР + ЦII
- KD – линия существования химического соединения Fe3C (цементит);
- MO (А2) – 768 оС - линия магнитного превращения феррита (потеря магнитных свойств железа).
Физический смысл точек диаграммы:
- A – температура плавления и кристаллизации чистого железа;
- B – перитектическая точка;
- C – эвтектическая точка;
- D – температура плавления и кристаллизации цементита;
- N и G - температуры полиморфных превращений чистого железа;
- H – предельная растворимость углерода в d - железе;
- E – предельная растворимость углерода в g - железе;
- S – эвтектоидная точка;
- P и Q – точки предельной растворимости углерода в a - железе;
- M – точка магнитного превращения железа (точка Кюри).
А1, А2, А3, А4 – принятые условные обозначения фазовых превращений.
7.2. Практическое применение диаграммы Fe – Fe3C
Диаграмма Fe – Fe3C позволяет:
- определить температуры фазовых превращений (плавления, кристаллизации, полиморфных превращений, температуры растворимости фаз;
- определить температурные интервалы термической обработки, горячей и холодной обработки металлов давлением.
7.3. Классификация сплавов системы Fe – Fe3C
Сплавы железа с углеродом делятся на две группы:
- стали: сплавы железа с углеродом, содержащие до 2,14 %С, кристаллизация которых заканчивается образованием аустенита, они обладают высокой пластичностью, хорошо деформируются;
- чугуны: сплавы железа с углеродом, содержащие более 2,14 %С и кристаллизация которых заканчивается образованием эвтектики (ледебурита). Чугуны менее пластичны, обладают хорошими литейными свойствами.
7.3.1. Углеродистые стали классифицируются:
- по химическому составу, структуре;
- по способу выплавки;
- по степени раскисления;
- по качеству;
- по назначению.
По химическому составу и микроструктуре стали делятся на три группы:
- доэвтектоидные, которые содержат от 0,02 до 0,8 % углерода и имеют структуру феррит (Ф) или феррито-перлитную (Ф + П) (рис. 7.2а);
- эвтектоидные, которые содержат 0,8 % углерода и имеют структуру 100 % перлита (рис. 7.2б);
- заэвтектоидные, которые содержат от 0,8 до 2,14 % углерода и имеют структуру перлито – цементитную (П + Ц) (рис. 7.2в).
Сплав, содержащий углерода менее 0,02 % углерода и имеющий структуру 100 % феррита (Ф), называется техническим железом (Армко).
Для изменения химического состава и, соответственно, свойств стали в нужном направлении, в нее вводят специальные примеси, которые называются легирующими, а сами стали называются легированными.
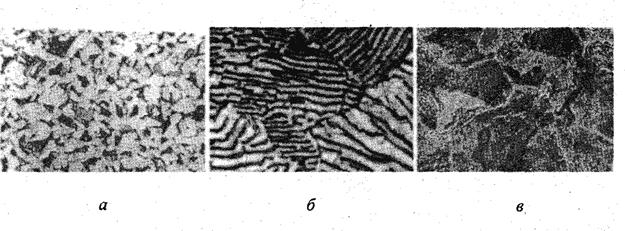
Рис. 7.2. Микроструктуры углеродистых сталей: а – доэвтектоидных; б – эвтектоидных; в – заэвтектоидных
Углеродистые стали – основной конструкционный материал, свойства которого зависят от количества углерода, структуры и содержания примесей. С ростом содержания углерода меняется структура, уменьшается количество феррита, увеличивается количество перлита, а, соответственно, увеличиваются прочность и твердость и уменьшается пластичность (рис. 7.3)
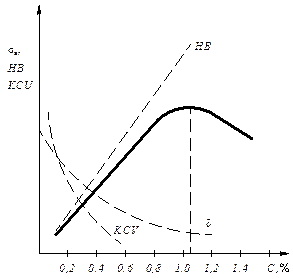
Рис. 7.3. Влияние углерода на механические свойства стали
Прочность стали (sВ) растет только до содержания углерода 1,0 %, а затем падает за счет образования сетки вторичного цементита по границам зерен (рис. 7.4).
Рис. 7.4. Микроструктура стали с сеткой вторичного цементита по границам зерен
По способу выплавки стали делятся на мартеновскую, электросталь, выплавленную в электродуговых печах и конверторную, выплавленную в кислородно-конверторных печах.
По способу раскисления различают стали спокойные (сп), полуспокойные (псп), кипящие (кп).
По качеству, которое определяют постоянные в стали вредные примеси (S, P), стали делятся на стали общего назначения, качественные и высококачественные.
В конструкционных углеродистых сталях общего назначения допускается до 0,05 % серы и до 0,04 % фосфора. В качественных конструкционных сталях допускается содержание серы и фосфора менее 0,04 %. Высококачественные стали содержат серы и фосфора менее 0, 035 %. Особо высококачественные стали (только легированные) содержат серы менее 0,015 % и фосфора менее 0,025 %.
Сера нерастворима в железе и образует с ним химическое соединение FeS. Следствие чего – красноломкость, т.е. сталь становится хрупкой при повышенных температурах.
Фосфор растворяется в феррите, уменьшая пластичность, склонен к ликвации на границах зерен и вызывает хладноломкость.
Скрытые примеси (газы азот, кислород, водород), содержание которых составляет 10-2 - 10-4 %, ухудшают пластические свойства стали.
Знак качества обозначается буквой А и проставляется в конце обозначения марки стали. Например: сталь инструментальная У10А, содержащая 1 % углерода.
По назначению стали делятся на конструкционные и инструментальные.
7.3.2. Чугуны, в зависимости от того, в какой форме присутствует углерод в сплавах, различают белые, серые, высокопрочные и ковкие. Высокопрочные чугуны являются разновидностью серых, но из-за повышенных механических свойств их выделяют в особую группу.
Белыми называют чугуны, в которых весь углерод находится в связанном состоянии в виде цементита. Эти чугуны, фазовые превращения которых протекают согласно диаграмме состояния Fe – Fe3C, подразделяют на доэвтектические, эвтектические и заэвтектические.
Из-за большого количества цементита белые чугуны тверды (4500-5500 НВ), хрупки и для изготовления деталей машин мало используются. Ограниченное применение имеют отбеленные чугуны – отливки из серого чугуна со слоем белого чугуна в виде твердой корки на поверхности. Из них изготовляют прокатные валки, лемехи плугов, тормозные колодки и другие детали, работающие в условиях износа.
В промышленности широко применяют серые, высокопрочные и ковкие чугуны, в которых весь углерод или часть его находится в виде графита. Графит обеспечивает пониженную твердость, хорошую обрабатываемость резанием, а также высокие антифрикционные свойства вследствие низкого коэффициента трения. Вместе с тем включения графита снижают прочность и пластичность, так как нарушают сплошность металлической основы сплава. Серые, высокопрочные и ковкие чугуны различаются условиями образования графитных включений и их формой, что отражается на механических свойствах отливок.
Серыми называют чугуны с пластинчатой формой графита.
По химическому составу серые чугуны разделяют на обычные (нелегированные) и легированные. Обычные серые чугуны – сплавы сложного состава, содержащие основные элементы: Fe-C-Si и постоянные примеси: Mn, P, S. В небольших количествах в обычных чугунах может содержаться Cr, Ni и Cu, которые попадают из руды. Почти все эти элементы влияют на условия графитизации, количество графитных включений, структуру металлической основы и, как следствие, свойства чугуна.
Углерод оказывает определяющее влияние на качество чугуна, изменяя количество графита и литейные свойства. Чем выше концентрация углерода, тем больше выделений графита в чугуне и тем ниже его механические свойства.
Кремний обладает сильным графитизирующим действием; способствует выделению графита в процессе затвердевания чугуна и разложению выделившегося цементита.
Марганец затрудняет графитизацию чугуна, несколько улучшает его механические свойства, особенно в тонкостенных отливках.
Сера – вредная примесь. Она ухудшает механические и литейные свойства чугунов: понижает жидкотекучесть, увеличивает усадку и повышает склонность к образованию трещин.
Фосфор в количестве до 0,3 % растворяется в феррите. При большей концентрации он образует с железом и углеродом тройную «фосфидную» эвтектику. Она имеет низкую температуру плавления (950 оС), что увеличивает жидкотекучесть чугуна, но дает высокую твердость и хрупкость.
Таким образом, степень графитизации в чугуне возрастает с увеличением содержания углерода и кремния.
Кроме химического состава, структура чугуна и его свойства зависят от технологических факторов, главным из которых является скорость охлаждения. С уменьшением скорости охлаждения увеличивается количество графита, с увеличением – количество химически связанного углерода.
Ухудшая механические свойства, графит в то же время придает чугуну ряд ценных свойств. Он измельчает стружку при обработке резанием, оказывает смазывающее действие и, следовательно, повышает износостойкость чугуна, придает ему демпфирующую способность. Кроме того, пластинчатый графит обеспечивает малую чувствительность чугуна к дефектам поверхности. Благодаря этому сопротивление усталости деталей из чугуна соизмеримо со стальными деталями.
В чугунах с высоким содержанием кремния при медленном охлаждении отливки первичная кристаллизация происходит в соответствии со стабильной диаграммой Fe – C (рис. 7.1); в этом случае графит появляется непосредственно из жидкой фазы. С увеличением скорости охлаждения создаются условия для первичной кристаллизации в соответствии с метастабильной диаграммой Fe – Fe3C (рис. 7.1); из жидкой фазы выделяется цементит, а графит образуется вследствие его распада при дальнейшем охлаждении.
Чем крупнее и прямолинейнее форма графитовых включений, тем ниже сопротивление серого чугуна разрыву. И, наоборот, чем мельче и разобщеннее графитовые включения, тем меньше их отрицательное влияние.
По структуре металлической основы серые чугуны разделяют на три вида.
1. Серый перлитный со структурой (рис.7.5а) перлит + графит (рис. 7.6, область III). В этом чугуне количество связанного углерода составляет » 0,8 %.
2. Серый ферритно-перлитный со структурой (рис.7.5б) феррит + перлит + графит (рис.7.6, область IIIа). Количество связанного углерода в нем менее 0,8 % .
3. Серый ферритный со структурой (рис.7.5в) феррит + графит (рис.7.6, область IIIб). В это чугуне весь углерод находится в виде графита.
4.

Рис. 7.5. Микроструктуры серых чугунов: а – перлитного; б – ферритно-перлитного; в – ферритного
| |
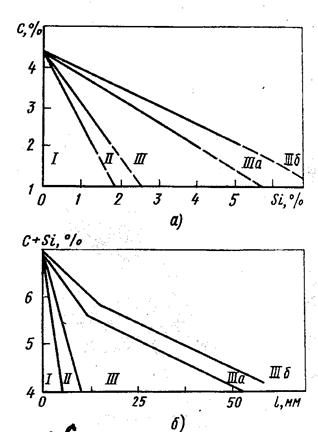
Рис. 7.6. Структурная диаграмма чугунов в зависимости от содержания кремния и углерода (а) и толщины стенки отливки (б): I – белый чугун; II – половинчатый чугун; III, IIIа, IIIб – серый перлитный, ферритно-перлитный и ферритный чугун соответственно
Механические свойства серого чугуна зависят от свойств металлической основы и, главным образом, количества, формы и размеров графитных включений. Прочность, твердость и износостойкость чугунов растут с увеличением количества перлита в металлической основе, которая по строению аналогична сталям. Решающее значение графита обусловлено тем, что его пластинки, прочность которых ничтожно мала, действуют как надрезы или трещины, пронизывающие металлическую основу и ослабляющие ее.
Номенклатура отливок из серого чугуна и их масса разнообразны: от деталей в несколько граммов (например, поршневые кольца двигателей) до отливок в 100 т и более (станины станков). Выбор марки чугунов для конкретных условий работы определяется совокупностью технологических и механических свойств (таблица 7.1).
Таблица 7.1
Механические свойства некоторых марок серых чугунов (ГОСТ 1412-85)
| Чугун | sв, МПа | d, % | НВ | Структура металлической основы |
| СЧ 15 СЧ 25 СЧ 40 СЧ 45 | - - - - | 1630-2290 1800-2500 2070-2850 2290-2890 | Феррит Феррит + перлит Перлит Перлит |
Марка серого чугуна состоит из букв СЧ (серый чугун) и цифры, показывающей значение временного сопротивления при растяжении в кгс/см2
Высокопрочными чугунами называют чугуны, в которых графит имеет шаровидную форму. Их получают модифицированием магнием, который вводят в жидкий чугун в количестве 0,02-0,08 %. Ввиду того, что модифицирование чугунов чистым магнием сопровождается сильным пироэффектом, чистый магний заменяют лигатурами (например, сплавом магния и никеля).
По структуре высокопрочный чугун может быть ферритным, ферритно-перлитным или перлитным (рис.7.7).
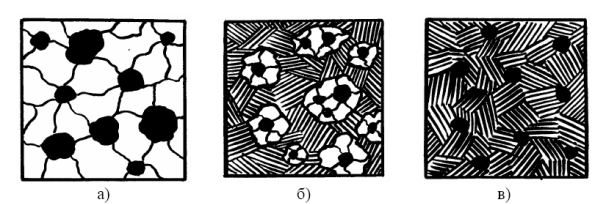
Рис. 7.7. Микроструктура высокопрочного чугуна, (х 300): а – ферритный; б - ферритно-перлитный; в – перлитный
Шаровидный графит – менее сильный концентратор напряжений, чем пластинчатый графит, и поэтому меньше снижает механические свойства основы. Чугуны с шаровидным графитом обладают более высокой прочностью и некоторой пластичностью. Маркируют высокопрочные чугуны по пределу прочности и относительному удлинению (таблица 7.2).
Таблица 7.2
Механические свойства некоторых высокопрочных чугунов
(ГОСТ 7293-85)
| Чугун | sв, МПа | d, % | НВ | Структура металлической основы |
| ВЧ 38-17 ВЧ 42-12 ВЧ 50-7 ВЧ 60-2 ВЧ 80-2 ВЧ 120-2 | 1400-1700 1400-2000 1710-2410 2000-2800 2500-3300 3020-3800 | Феррит с небольшим количеством перлита Перлит с небольшим количеством феррита |
Высокопрочные чугуны применяют в различных отраслях техники, эффективно заменяя сталь во многих изделиях и конструкциях. Из них изготовляют оборудование прокатных станов (прокатные валки массой 12 т), кузнечно-прессовое оборудование (траверса пресса, шабот ковочного молота), в турбостроении – корпус паровой турбины, лопатки направляющего аппарата, в дизеле-, тракторо- и автомобилестроении – коленчатые валы, поршни и многие другие ответственные детали, работающие при высоких циклических нагрузках и условиях изнашивания.
В некоторых случаях для улучшения механических свойств применяют термическую обработку отливок; для повышения прочности – закалку и отпуск при 500-600 оС; для увеличения пластичности – отжиг, способствующий сфероидизации перлита.
Ковкими называют чугуны, в которых графит имеет хлопьевидную форму. Их получают отжигом белых доэвтектических чугунов. По этой причине графит ковких чугунов называют углеродом отжига. Такой графит, в отличие от пластинчатого, меньше снижает механические свойства металлической основы, вследствие чего ковкий чугун по сравнению с серым обладает более высокой прочностью и пластичностью.
Отливки из белого чугуна, подвергаемые отжигу на ковкий чугун, изготовляют тонкостенными. Они не должны иметь сечение более 50 мм, иначе в сердцевине при кристаллизации выделяется пластинчатый графит, чугун становится непригодным для отжига.
По структуре металлической основы, которая определяется режимом отжига, ковкие чугуны бывают ферритными и перлитными (рис. 7.8).

Рис. 7.8. Микроструктура ковких чугунов, (х 300): а – ферритный; б – ферритно – перлитный; в - перлитный
Отжиг на ферритные чугуны проводят по режиму 1 (рис. 7.9), обеспечивающему графитизацию всех видов цементита белого чугуна. Перлитный ковкий чугун получают отжигом, который проводят в окислительной среде по режиму 2 (рис. 7.9).
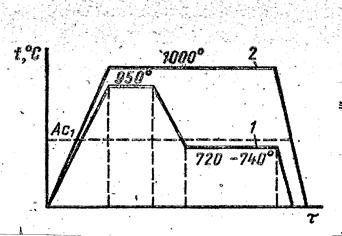
Рис. 7.9. Схема отжига белого чугуна на ковкий: 1 – на ферритный;
2 – на перлитный
Графитизация цементита перлита практически не происходит, чугун приобретает структуру, состоящую из перлита и углерода отжига. Отсутствие литейных напряжений, которые полностью снимаются во время отжига, компактная форма и изолированность графитных включений обусловливают высокие механические свойства ковких чугунов. Принцип их маркировки тот же, что и высокопрочных чугунов : КЧ sв - d (таблица 7.3).
Таблица 7.3
Механические свойства некоторых марок ковких чугунов (ГОСТ 1215-79)
| Чугун | sв, МПа | d, % | НВ | Структура металлической основы |
| КЧ 30-6 КЧ 35-10 КЧ 37-12 КЧ 45-7 КЧ 60-3 КЧ 80-1,5 | 1,5 | 1000-1630 1000-1630 1100-1630 1500-2070 2000-2690 2700-3200 | Феррит + (10-3 %) перлита Перлит + (20-0 %) феррита |
Из таблицы видно, что ферритные чугуны имеют более высокую пластичность, а перлитные – более высокую прочность и твердость.
Ковкие чугуны нашли широкое применение в сельскохозяйственном, автомобильном и текстильном машиностроении, в судо-, котло-, вагоно- и дизелестроении. Из них изготовляют детали высокой прочности, работающие в тяжелых условиях износа, способные воспринимать ударные и знакопеременные нагрузки. Большая плотность отливок ковкого чугуна позволяет изготовлять детали водо- и газопроводных установок; хорошие литейные свойства исходного белого чугуна – отливки сложной формы.
Недостаток ковких чугунов – повышенная стоимость из-за продолжительного дорогостоящего отжига.
8. ОСНОВЫ ТЕОРИИ ТЕРМИЧЕСКОЙ ОБРАБОТКИ
Свойства сплавов определяются его структурой (внутренним строением), которая зависит от температуры нагрева и скорости охлаждения. Основной способ изменить структуру, а, следовательно, свойства – это термическая обработка.
Термическая обработка – это совокупность операций нагрева, выдержки и охлаждения, проводимых в определенной последовательности с целью изменения внутреннего строения сплава и получения необходимых физико-механических свойств.
В основе термической обработки лежат фазовые превращения в твердом состоянии.
8.1. Четыре основные превращения в сталях
В сталях основными являются три структуры: аустенит – твердый раствор углерода в γ – Fe [Fe γ(С)]; мартенсит – пересыщенный, частично упорядоченный твердый раствор углерода в α – Fe [Fe γ(С)]; перлит – эвтектоидная смесь феррита и цементита [Feα + Fe3 С]. Переход из одной структуры в другую характеризует основные превращения при термической обработке:
- первое превращение – это превращение перлита в аустенит, которое происходит при нагреве: П→А (рис. 8.1).
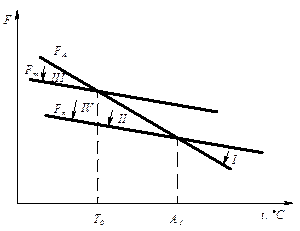
Рис. 8.1. Изменение энергии фаз в зависимости от температуры
- второе превращение – это превращение аустенита в феррито-цементитные смеси разной дисперсности в зависимости от скорости охлаждения: А→Ф+Ц;
- третье превращение заключается в превращении аустенита в мартенсит А→М при быстром охлаждении (при закалке);
- четвертое превращение заключается в разложении мартенсита при отпуске закаленной стали (М → продукты распада).
Любой технологический процесс термической обработки состоит из определенных комбинаций этих четырех превращений.
8.2. Превращения в стали при нагреве - образование аустенита (I превращение)
Превращение П → А - процесс кристаллизационного типа и подчиняется закономерностям кристаллизации, т. е. зарождаются центры новой фазы (А) и они растут (рис. 8.2). Перекристаллизация перлита в аустенит сопровождается размельчением зерен. Размер зерен вновь образовавшегося аустенита, который называется начальным, не зависит от размера исходного зерна, а зависит от степени дисперсности фаз в перлите. Чем выше дисперсность, тем мельче получается аустенитное зерно.
Превращение П→А носит диффузионный характер и сопровождается значительным перемещением атомов углерода.

Рис. 8.2. Превращение перлита в аустенит: а - зарождение новой фазы аустенита в зерне перлита; б, в - рост фазы аустенита и степень растворения цементита (Fe3С) в аустените Feγ(С); г - получение гомогенного начального зерна аустенита
Превращение состоит из двух параллельно идущих процессов:
- полиморфного Feα→ Feγ превращения;
- растворения цементита (Fe3С) в аустените Feγ(С).
Превращение П→А может идти изотермически при температуре 727 °С (см. рис. 7.1, т. Ас1 и при непрерывном нагреве (рис. 8.3)
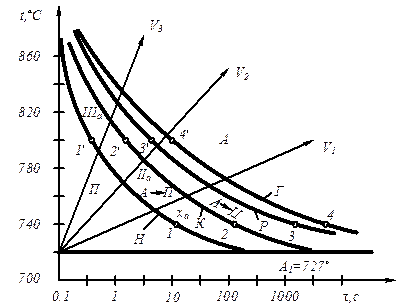
Рис. 8.3. Диаграмма изотермического превращения перлита в аустенит для стали с 0,8 % С
Процесс перехода П →А при непрерывном нагреве со скоростью V1 и V2 (рис. 8.3) изучают путем построения диаграммы изотермического образования аустенита. Образцы нагревают до температур выше А1 последовательно и выдерживают сплав при этих температурах, фиксируя начало и конец превращения;
Н - начало превращения П→А;
К - конец превращения П→А;
Р - конец растворения углерода в аустените;
Г - конец гомогенизации аустенита.
Из диаграммы (рис. 8.3) видно: время превращения П→А зависит существенно от степени перегрева (нагрева выше А1).
С увеличением перегрева уменьшается размер критического зародыша аустенита, увеличивается скорость возникновения зародышей и скорость их роста, происходит измельчение зерна стали, что используется в практике термической обработки (отжиг, закалка). При обработке токами высокой частоты (ТВЧ) можно получить очень мелкие зерна аустенита.
Влияние нагрева на продолжительность (τпрев) превращения показывают лучи скоростей V1 и V2. При меньшей скорости нагрева (V1 < V2< V3) (рис. 8.3) превращение происходит при более низких температурах, за больший промежуток времени.
В доэвтектоидных сталях при нагреве от А1 до А3 происходит превращение избыточного феррита в аустенит (рис. 8.4).
В заэвтектоидных сталях при нагреве от А1 до Аст происходит растворение цементита вторичного (Fe3С) в аустените (рис. 8.4). При этом выравнивается концентрация углерода и укрупняется зерно аустенита. С повышением температуры нагрева, в результате собирательной рекристаллизации, аустенитное зерно растет (рис. 8.4). Крупные зерна растут, поглощая мелкие. Скорость роста зерен при перегреве зависит от способа выплавки стали, полноты раскисления и наличия легирующих элементов. Природным зерном называется зерно аустенита, образующееся после трехчасовой выдержки при 930°С.
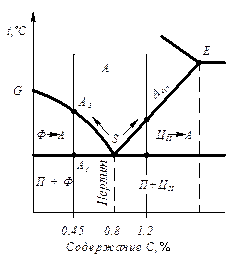
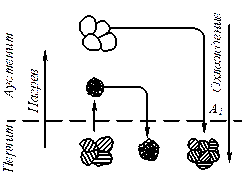
Рис. 8.4. Часть диаграммы Рис. 8.5. Схема изменения размера
«железо-углерод» зерна перлита в зависимости
от нагрева в аустенитной области
По склонности к росту аустенитного зерна стали делят на две группы: наследственно-крупнозернистые и наследственно - мелкозернистые.
При последующем охлаждении стали зерна аустенита не измельчаются. Размер зерна при комнатной температуре называется действительным зерном и зависит от температуры нагрева, продолжительности выдержки, склонности стали к росту зерна при нагреве. Это необходимо учитывать при назначении режимов термической обработки. Температура нагрева под закалку для доэвтектоидной стали не должна превышать: А3 + (30…50°С) (рис. 8.4). Для заэвтектоидной стали не должна превышать А1 + (30...50°С). Нагрев заэвтектоидной стали до температуры, значительно превышающий А3 и Асm, приводит к образованию крупного действительного зерна. Такой нагрев называют перегревом.
Нагрев до еще более высоких температур в окислительной атмосфере сопровождающийся образованием по границам зерен окислов железа с частичным оплавлением, называется пережогом.
Перегрев и пережог являются браком при термической обработке. Причем перегрев можно исправить охлаждением и последующим повторным нагревом до необходимой температуры, а пережог является неисправимым браком. Свойства стали зависят от размеров действительного зерна.
Мелкозернистые стали имеют значительно более высокую вязкость, несколько более высокую прочность и твердость в сравнении с крупнозернистыми.
Крупнозернистые стали имеют также ряд преимуществ. Эти стали имеют лучшую прокаливаемость; жаропрочные аустенитные стали с крупным зерном лучше сопротивляются ползучести. Магнитомягкие стали имеют меньшую коэрцитивную силу и тем самым меньшие потери.
8.3. Превращения в стали при охлаждении (II превращение)
При медленном охлаждении происходит эвтектоидное превращение аустенита
Feγ(С)→ Feα + Fe3С; А→Ф+ЦII
0,8 %С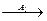 0,2 %С+6,67 %С
0,2 %С+6,67 %С
Рассмотрим закономерность превращения переохлажденного аустенита эвтектоидного состава (0,8 % С) на n-ом количестве образцов. Для этого:
1) образцы нагревают до однородного аустенита выше Ас1+ (30…50 °С)≈770 °С, дают выдержку;
2) образцы переносятся в термостаты с заданной температурой ниже линии А1 (727 °С), интервал между изотермами 25-50°С;
3) в процессе изотермической выдержки наблюдают за происходящими в аустените превращениями (измеряют твердость, плотность, магнитную восприимчивость);
4) строят серию кинетических кривых в координатах «время - количество расплавившегося аустенита».
Отрезки ОН1, ОН2 (рис.8.6) и т.д. называются инкубационным или подготовительным периодом.
|
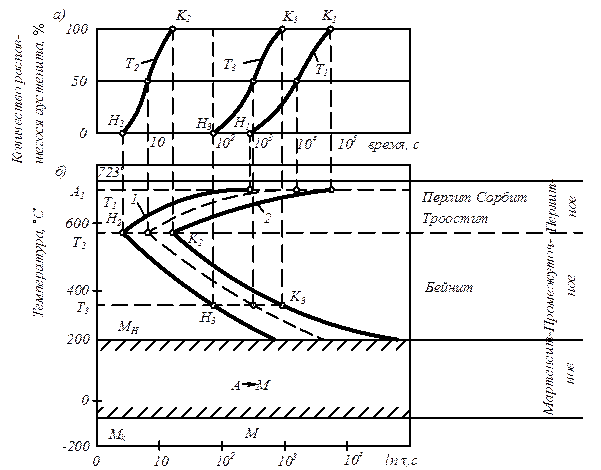
Рис. 8.6. Кинетические кривые изотермического превращения аустенита (а) и построенная по ним диаграмма (б)
Превращение протекает с различной скоростью и достигает максимума при 50 % распавшегося аустенита.
С увеличением переохлаждения устойчивость аустенита уменьшается (ОН1 > ОН2), минимум устойчивости приходится на переохлаждение в 150-200 °С ниже А1 (500 - 550 °С).
При дальнейшем увеличении переохлаждения устойчивость растет (ОН3).
Строят диаграмму изотермического превращения переохлажденного аустенита в координатах t° - lgτ. Такая диаграммы в координатах называется диаграммой изотермического превращения аустенита или С- образной диаграммой:
- левая кривая - начало превращения переохлажденного аустенита в зависимости от степени переохлаждения;
- правая кривая - конец превращения аустенита. Она показывает время, необходимое при данном переохлаждении для полного превращения аустенита в феррито-цементитную смесь;
- точка Н2 соответствует переохлаждению 150-200 °С ниже А1 и показывает интервал минимальной устойчивости аустенита.
8.4. Перлитное превращение
Распад аустенита состоит из двух одновременно протекающих процессов:
- перехода Feγ→ Feα (бездиффузионного процесса) и образования цементита Fe3С (диффузионного процесса).
При перлитном превращения ведущей фазой является цементит (Fe3С). Зарождение зародыша Fe3С происходит на границе зерна, далее пластинка прорастает в середину зерна, а соседние участки обедняются углеродом и образуется феррит (рис. 8.7).
С увеличением степени переохлаждения увеличивается разность энергии аустенита и перлита (ΔF = FА – FП) (рис. 8. 1). Это приводит к повышению дисперсности образующихся фаз. Структуру феррито-цементитной смеси различной дисперсности называют перлитом, сорбитом, трооститом.
Рис. 8.7. Последовательность образования перлита в аустенитном зерне:
а - первичные пластинки цементита в феррите; б - вторичные пластинки цементита в феррите; в – колонии перлита

Рис. 8.8. Микроструктура перлита, (×1500)
На рисунке 8.8 по ориентировке пластин можно различить два зерна перлита (две колонии).
Дисперсность - суммарная толщина соседних пластинок Feα + Fe3С (рис. 8.9).

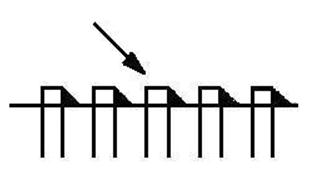
Рис. 8.9. Схема расположения пластинок цементита (а) и феррита (б) в перлите на поверхности протравленного шлифа. Стрелкой показано направление освещения под микроскопом
Дисперсность структуры определяет механические свойства стали: перлит имеет твердость 200НВ, сорбит – 300НВ, троостит – 400НВ
8.5. Бейнитное превращение
Бейнитное промежуточное превращение идет в интервале температур 550 – Мн. Образующаяся структура представляет собой двухфазную смесь кристаллов феррита к цементита. Основная особенность промежуточного превращения состоит в том, что полиморфный переход Feγ→ Feα происходит по мартенситному механизму – бездиффузионно, а образование цементита (Fe3С) – идет диффузионным путем.
Превращение начинается в интервале температур 550 – Мн с перераспределения углерода в аустените. Диффузионное перераспределение приводит к обеднению одних и обогащению других зон (скорость диффузии углерода в интервале 550 - Мн достаточна, а скорость диффузии железа стремится к нулю).
Уменьшение количества растворенного углерода приводит к повышению температуры мартенситного превращения, поэтому в обедненных углеродом зонах γ - твердого раствора происходит мартенситное превращение.
Образование концентрационной неоднородности приводит к возникновению напряжения, и процесс полиморфного превращения носит сдвиговый характер. Кристаллы феррита (Feα) пересыщены углеродом до 0,1-0,2 % получают тетрагональную решетку. При этом структура верхнего бейнита получается перистой, а нижнего - игольчатой.
8.6. Превращение аустенита при непрерывном охлаждении
Сталь, нагретая до аустенитного состояния, может быть охлаждена с различной скоростью. Наложим кривые охлаждения образцов углеродистой эвтектоидной стали на диаграмму изотермического распада аустенита (рис. 8.6) построена в координатах “температура - время”, поэтому на нее можно наложить графики скоростей охлаждения V1 < V2 < V3< Vкр < V4 (рис. 8.10)

Рис. 8.10. Наложение графиков скоростей непрерывного охлаждения на диаграмму изотермического распада аустенита. Увеличение скорости охлаждения от V до Vкр
8.7. Мартенситное превращение ( III превращение)
При больших степенях переохлаждения и скоростях, превышающих Vкр, скорости диффузии железа и углерода равны нулю, ЕА>>ЕМ, поэтому превращение Feγ(С)→ Feα(С) происходит бездиффузионным путем (без изменения концентрации реагирующих фаз) за счет сдвига. Образуется мартенсит - пересыщенный, частично упорядоченный, твердый раствор внедрения углерода в альфа - железо (Feα) с тетрагональной решеткой (с/а >1) (рис. 8.11).
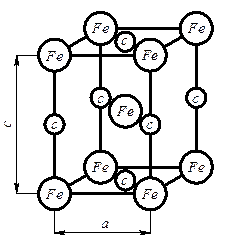
Рис. 8.11. Объемно-центрированная тетрагональная решетка мартенсита
Степень искажения решетки с/а прямо пропорциональна концентрации углерода. Поскольку мартенситное превращение состоит в перестройке решетки аустенита, в которой атомы не меняются местами (бездиффузионно), а смещаются (сдвигаются) друг относительно друга, то кристаллы имеют ориентационную связь (рис. 8.12). В углеродистых сталях существует две ориентационные связи, получившие название ориентировка Курдюмова-Закса и ориентировка Нишияма. Ориентировка кристаллов мартенсита (пластин или линз) идет по определенным плоскостям и направлениям (рис. 8.12) (направление (111) // (101)), плоскости ([101] // [111]). Следствием сдвигового механизма превращения на полированной поверхности шлифа является характерный рельеф.
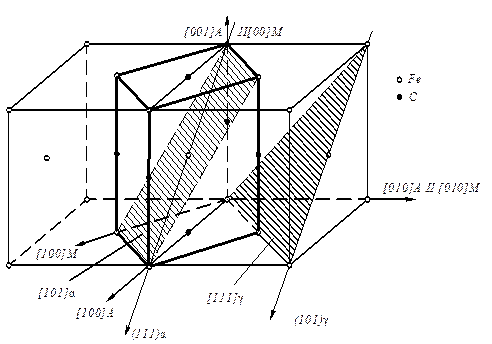
Рис. 8.12. Атомно-кристаллический механизм перестройки
Согласно теории, мартенситный кристалл образуется на плоскости сдвига в момент ее образования. Главную роль играют напряжения. Источниками напряжений являются: градиент температур по сечению; анизотропия механических свойств; неоднородность химического состава; структурные несовершенства; разная ориентировка кристаллов в пространстве; различный удельный объем аустенита и мартенсита; различные коэффициенты линейного расширения фаз.
Удельный объем аустенита при количестве углерода от 0,2-1,4 % составляет 0,12227 – 0,12528 см3/г; мартенсита – 0,12708 – 0,13061 см3/г.
Напряжения, возникающие в результате изменения температуры концентрируются в отдельных участках аустенита, образуя энергетические флуктуации. Релаксация (разряжение) напряжений происходит путем сдвига по определенным плоскостям и направлениям (рис. 8.12). В момент сдвига образуется порция мартенситных пластин (игл). Время образования порции мартенситных пластин (игл) изменяется в пределах от 0,5×10-7 до 5,7×10-8 в зависимости от размера пластин. Средняя скорость роста составляет около 103 м/с (1 км/с), близка к скорости звука в твердом теле и не зависит от температуры превращения. Кристаллы растут до определенных размеров, после чего рост прекращается.
Аустенитно-мартенситное превращение (рис. 8.13, б) проходит в интервале температур Мн – Мк (Мн, Мк – мартенситные точки: н – начало, к – конец превращения). При данной температуре с огромной скоростью образуется только определенное количество (порция) мартенсита, остается остаточный аустенит. Для возобновления процесса нужно дополнительное охлаждение.
Рис. 8.13. Мартенситная кривая (а) и зависимость мартенситных точек от содержания углерода (б)
Мартенситное (А →М) превращение не идет до конца, в стали всегда остается остаточный аустенит (рис. 8. 13, а).
Положение точек мартенситного превращения зависит от состава стали. Сильно снижает положение точек Мн и Мк концентрация углерода (рис. 8.13, б).
Итак, особенностями мартенситного превращения являются:
1) бездиффузионный сдвиговый механизм;
2) ориентированность кристаллов в пространстве;
3) ультразвуковая скорость образования порции кристаллов мартенсита;
4) тетрагональность решетки (с/а);
5) незаконченность превращения А → М;
6) необратимость превращений А → М;
7) очень высокая твердость мартенсита (HRC 55-65) и хрупкость из-за повышенной плотности дефектов (дислокаций) внутри кристалла мартенсита.
8.8. Превращения в закаленной стали при нагреве (IV превращение)
Различают 4 основных превращения при нагреве закаленной стали (рис. 8.14). Все процессы идут внутри мартенситных пластин (игл) поэтому характер игольчатой структуры сохраняется до высоких температур.
Первое превращение при отпуске происходит в интервале 80-200°С и называется «двухфазным» или «гетерогенным» расплавом мартенсита. Выделяются тончайшие пластины карбида (ε - карбид или FexС), уменьшается степень тетрагоналъности с/а→1, образуется «отпущенный мартенсит». Это превращение сопровождается сокращением объема образца.
Рис. 8.14. Дилатометрическая кривая отпуска закаленной стали
Второе превращение происходит в интервале от 200 - 300°С. Одновременно идут процессы:
- образуются ε - и FexС – карбиды, когерентно связанные с решеткой мартенсита;
- остаточный аустенит переходит в «отпущенный мартенсит» (рис. 8.15) (бейнит нижний). Процесс сопровождается увеличением объема (рис. 8.14);
- продолжается выделение углерода из мартенсита (с/а→1);
- начинается карбидное обособление - образование карбида железа по схеме:
FexС→ Fe2С→ Fe5С→ Fe3С
Третье превращение происходит в интервале от 350-450°С. Увеличивается скорость диффузии, карбид железа выделяется из решетки мартенсита. Степень тетрагональности с/а →1. Образуется дисперсная смесь феррита и цементита (троостит отпуска).
Четвертое превращение происходит выше 400-450°С. Растут частицы карбида (коагуляция) и сливаются, округляются (сфероидизация). Тонкая феррито-цементитная структура троостита отпуска превращается при температуре 500-550°С в сорбит отпуска, а при более высоких температурах (600-650°С) - в перлит.
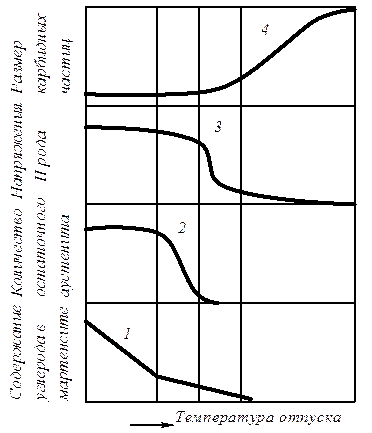
Рисунок 8.15 - Схема процессов, совершающихся при отпуске: 1 – выделение углерода из тетрагонального мартенсита; 2 – распад остаточного аустенита; 3 – снятие внутренних напряжений; 4 – коагуляция карбидных частиц
Возврат и рекристаллизация в α – Фазе (Feα) происходят в широком интервале температур отпуска. Развитие этих процессов сдерживается частицами карбидных выделений, закрепляющих отдельные дислокации, дислокационные стенки. После длительного отпуска при температуре 600°С, когда в результате коагуляции цементитных частиц закрепление границ ослабевает, происходит рекристаллизационный рост зерен миграцией высокоугольных границ. Микроструктура при этом теряет характерные морфологические признаки реечного мартенсита. Закалка + высокий отпуск называется улучшением.
9. ТЕХНОЛОГИЯ ТЕРМИЧЕСКОЙ ОБРАБОТКИ
9.1. Основные составляющие технологического процесса термической обработки
При разработке технологии термической обработки необходимо установить:
- режим нагрева детали или заготовки, в который входят температура нагрева, допустимые скорость и время нагрева;
- характер среды, где должен идти нагрев;
- условия охлаждения (выбор охлаждающей среды);
- производительность труда при термообработке;
- экономичность выбранного процесса.
Режим термообработки назначают до критическим точкам (Ас1, Ас3, Асm) диаграммы Fe-Fe3С (рис.7.1) и С - образной диаграммы превращения аустенита (рис.8.6).
Условия нагрева определяются видом нагревательного устройства, к которым относятся нагревательные печи (топливные или электрические), соляные ванны или ванны с расплавленным металлом, установки индукционного нагрева токами промышленной частоты или токами высокой частоты.
9.2. Классификация видов термической обработки
Схема классификации основных видов термической обработки показана на рис. 9.1.

Рис. 9.1. Классификация основных видов термической обработки
Вид термической обработки определяется не характером изменения температуры во времени, а типом фазовых и структурных изменений в металле.
Собственная термообработка заключается только в термическом воздействии на металл или сплав.
Химико-термическая обработка заключается в сочетании термического и химического воздействия на поверхность.
Термомеханическая обработка заключается в сочетании термического воздействия и пластической деформации.
Отжиг I рода частично или полностью устраняет отклонения от равновесного состояния, возникающие при предыдущей обработке (литье, ковке, штамповке и т.д.), причем при его проведении не происходит фазовых превращений.
К отжигу I рода (рис. 9.1) относятся:
- гомогенизационный (диффузионный);
- рекристаллизационный и дорекристализационный;
- уменьшающий напряжения.
Цельгомогенизационного отжига - устранение ликвации (выравнивание химического состава) в отливках, в слитках, в легированной стали.
Режим гомогенизационного отжига: нагрев до 1050-1200 оС, выдержка 8-10 часов, охлаждение с печью до 200-250 оС. Продолжительность процесса около 80-100 часов (рис. 9.2).
Цель рекристаллизационного отжига – устранение наклёпа холоднокатанной стали, содержащей 0,1 – 0,2 % С.
Режим рекристаллизационного отжига: нагрев до 600-700 оС (Трекр = 0,4 Тпл по абсолютной шкале), выдержка, которая зависит от геометрии изделий (для тонких листов 25-30 мин.) и охлаждение с печью.
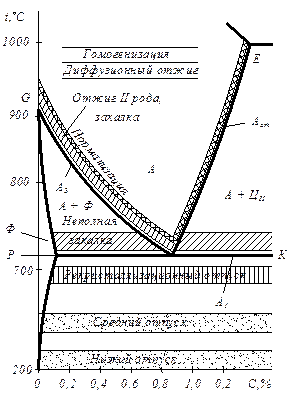
Рис. 9.2. Левый угол диаграммы Fe – Fe3 С и температурные области при термической обработке сталей
Цель отжига для снятия напряжений - снятие напряжений в деталях из углеродистой стали.
Режим отжига для снятия напряжений: нагрев до 400 – 600 оС, выдержка 2,5 мин на 1 мм толщины детали, охлаждение с печью.
Отжиг II рода основан на использовании диффузионных (нормальных) фазовых (полиморфных) превращений при охлаждении. Целесообразность отжига II рода определяется тем, насколько сильно структурные изменения влияют на свойства металла или сплава.
Различают следующие разновидности отжига второго рода: полный, неполный, изотермический, нормализационный (нормализация).
Полный отжиг используется для доэвтектоидных сталей (рис. 9.2). Режим такого отжига - нагрев до А3 + (20-30 оС), выдержка, медленное охлаждение со скоростью 100-200 оС в час до 500 оС вместе с печью, далее охлаждение на воздухе. При нагреве структура (Ф + П) превращается в мелкую структуру аустенита, при последующем охлаждении получим мелкую феррито-перлитную структуру.
Заэвтектоидные стали полному отжигу не подвергают, так как получается цементитная сетка по границам зерен перлита. Для заэвтектоидных сталей применяют неполный отжиг: нагрев до температуры между линиями А1 и Асm (рис.9.2), выдержка, медленное охлаждение (с печью). При нагреве немного выше А1 и последующем медленном охлаждении, когда еще мало зерно аустенита, концентрация которого неоднородна и в его составе содержится еще большое количество нерастворившихся карбидов, образуется зернистый перлит. Неполный отжиг для заэвтектоидных сталей называют сфероидизирующим.
Одного нагрева выше А1 и медленного охлаждения иногда бывает недостаточно для полной сфероидизации; эту операцию следует повторять несколько раз, т.е. сталь при отжиге нагревают до 730-740 оС, затем медленно охлаждают до 680 оС, затем снова нагревают до 730-740 оС и т.д. Такой отжиг называется циклическим или маятниковым, и он обеспечивает хорошую сфероидизацию цементита.
Цель такого отжига - получать структуру зернистого перлита и цементита в инструментальных сталях для улучшения обрабатываемости на металлорежущих станках. Стали с зернистым перлитом имеют твердость 160-180 НВ. Пластинчатый перлит имеет твердость 180-250 НВ.
Изотермический отжиг - нагрев стали до А3 + (20-30 оС), выдержка, быстрое охлаждение ниже А1(до 700-680 оС), при которой сталь выдерживается определенное время для полного изотермического превращения аустенита и образования феррито-перлитной структуры.
Преимущества изотермического отжига перед полным отжигом – это сокращение времени отжига и получение более однородной структуры.
Нормализационный отжиг (нормализация) (рис. 9.2) – это такой вид термической обработки, при которой сталь нагревается выше точки А3 на 30-50 оС для доэвтектоидных сталей и выше точки Асm для заэвтектоидных сталей с последующим охлаждением на спокойном воздухе.
В результате получают:
- более тонкое строение эвтектоида (тонкий перлит или сорбит);
- меньшие внутренние напряжения;
- выше твердость и прочность, чем после отжига;
- заэвтектоидные стали без грубой сетки вторичного цементита.
Главное при нормализации - экономия времени и энергии по сравнению с отжигом.
Нормализацию используют как промежуточную технологическую операцию вместо отжига или как окончательную при изготовлении сортового проката (рельсов, уголков, швеллеров и т.д.).
Для всех видов отжига применяют камерные толкательные печи, а также специальные агрегаты.
Закалка - термическая обработка с нагревом стали до температур, превышающих температуры фазовых превращений с выдержкой и последующим охлаждением металла или сплава со скоростью, превышающей критическую, с целью получения неравновесной структуры (мартенсита), либо пересыщенного раствора.
Результат закалки - повышение твердости и прочности.
Температура нагрева под закалку для доэвтектоидных сталей: А3 + (30-50 оС). Если нагрев проводится в интервале температур А1 – А3, то происходит неполная закалка. В этом случае оставшийся в структуре остаточный феррит ухудшает свойства доэвтектоидной стали.
Заэвтектоидные стали нагревают до температуры А1 + (40-60 оС ) и после охлаждения получают мартенсит с включениями вторичного цементита. Такая структура обеспечивает высокую твердость и износостойкость режущего инструмента.
Если температура нагрева заэвтектоидной стали выше Асm (рис. 9.2) то после закалки получают дефектную структуру грубоигольчатого мартенсита.
Время нагрева при закалке зависит от типа нагревательных устройств, размеров детали, химического состава (теплопроводности) стали, способа загрузки деталей в нагревательное устройство.
Скорость охлаждения при закалке устанавливают в зависимости от того, какую структуру в детали необходимо получить. Скорость охлаждения зависит от охлаждающей среды, формы изделия, теплопроводности стали.
В качестве охлаждающих сред применяют воду (при разных температурах от 18-50 °С), 10 %-ный раствор NaOH в воде, 10 %-ный раствор NaCl в воде, минеральное масло, спокойный воздух.
9.3. Способы закалки
В зависимости от состава стали, формы и размеров детали и требуемых в термически обработанной детали свойств выбирают оптимальный способ закалки, наиболее просто осуществимый и одновременно обеспечивающий нужные свойства.
Чем сложнее форма термически обрабатываемой детали, тем тщательнее следует выбирать условия охлаждения, потому что чем сложнее деталь, тем больше различие в сечениях детали, тем бớльшие внутренние напряжения возникают в ней при охлаждении.
Чем больше углерода содержит сталь, тем больше объёмные изменения при превращении, тем при более низкой температуре происходит превращение аустенита в мартенсит, тем больше опасность возникновения деформаций, трещин, напряжений и других закалочных пороков, тем тщательнее следует выбирать условия закалочного охлаждения для такой стали.
К основным способам закалки относятся:
1. Закалка в одном охладителе (рис. 9.3, кривая 1) – наиболее простой способ. Нагретую до определенных температур деталь погружают в закалочную жидкость, где она остается до полного охлаждения. Применяют этот способ при закалке несложных деталей из углеродистых и легированных сталей. При этом для углеродистых сталей диаметром более 2-5 мм закалочной средой служит вода, а для меньших размеров и для многих легированных сталей – масло.
Для уменьшения внутренних напряжений деталь иногда не сразу погружают в закалочную жидкость, а некоторое время охлаждают на воздухе, «подстуживают». Такой способ закалки называется закалкой с подстуживанием (рис. 9.3, кривая 5).
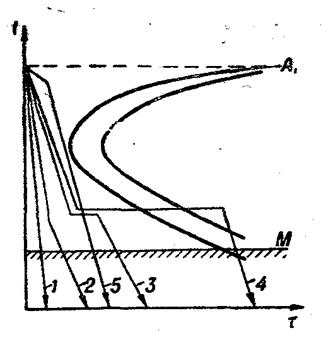
Рисунок 9.3 - Схема режимов охлаждения при различных способах закалки: 1 – непрерывная закалка в одном охладителе; 2- прерывистая закалка, или закалка в двух средах; 3 - ступенчатая закалка; 4 - изотермическая закалка; 5 – закалка с подстуживанием
2. Прерывистая закалка или закалка в двух средах (рис.9.3, кривая 2) используется для деталей сложной формы. Нагретую до температуры закалки деталь (инструмент из углеродистой стали) охлаждают сначала в быстро охлаждающей среде, а затем в медленно охлаждающей. Обычно первое охлаждение проводят в воде, а затем деталь переносят в масло, или охлаждают на воздухе. В мартенситном интервале сталь охлаждается медленно, что способствует уменьшению внутренних напряжений.
3. Ступенчатая закалка (рис.9.3, кривая 3).
Режим ступенчатой закалки: деталь нагревают до температуры закалки .Ас3 + (30-50 оС), выдерживают и быстро переносят в охладитель с температурой на 110-150 оС выше мартенситной точки (Мн); выдерживают а нем короткое время (расчетное), затем изделие охлаждают до комнатной температуры на воздухе, но это не должно вызвать превращения аустенита в бейнит.
Преимущества ступенчатой закалки:
- уменьшаются объемные изменения, вследствие присутствия большого количества остаточного аустенита и возможности самоотпуска мартенсита;
- уменьшается коробление в результате того, что мартенситное превращение протекает почти одновременно во всех участках изделия;
- меньше опасность появления трещин;
- во время фазовых превращений (мартенситного) снижается прочность стали и повышается пластичность.
Горячие, а следовательно, сравнительно медленно охлаждающие среды не позволяют достигнуть критической скорости закалки для более или менее крупных сечений. Поэтому ступенчатая закалка для углеродистой стали применима лишь для деталей диаметром не более 10-12 мм, а для легированных сталей до 20-30 мм.
4. Изотермическая закалка (рис.9.3, кривая 4). В отличие от ступенчатой при изотермической закалке необходимо выдерживать сталь в закалочной среде столько времени, чтобы успело закончиться изотермическое превращение аустенита.
Режим изотермической закалки: нагрев до температуры закалки A3 + (30-50 оС ), выдержка и быстрый перенос в закалочную среду, температура которой выше точки Мн на 100-150 оС, затем дается длительная выдержка, чтобы полностью прошли превращения переохлажденного аустенита. При выдержке происходит распад аустенита с образованием структуры нижнего бейнита с хорошим коплексом механических свойств.
5. Закалка с самоотпуском.
Режим закалки: нагрев до температуры закалки А3 + (30-50 оС), выдержка и охлаждение в одном охладителе; прерывание охлаждения с тем, чтобы сердцевина сохранила запас тепла. Под действием теплообмена за счет внутреннего тепла снова нагревается поверхность. Тем самым происходит отпуск поверхности стали (самоотпуск). Сталь приобретает сочетание высокой твердости на поверхности детали с повышенной вязкостью в сердцевине. Примененяется такая закалка для изготовления зубил, кернов, кувалд и слесарных молотков.
Поверхностная закалка.
Долговечность деталей, работающих в условиях изнашивания (валы, шестерни), зависит от сопротивления поверхности износу. Разрушение деталей, работающих при изгибающих нагрузках в условиях циклических… При поверхностной закалке нагрев только поверхности можно проводить :Стали, работающие при низких климатических температурах (до -50оС), - это стали северного исполнения; от комнатной температуры до -80 оС (4,2 К - температура кипения жидкого гелия) - это криогенные стали аустенитного класса, одновременно нержавеющие.
Сталь 12X18H20 - сталь со стабильным аустенитом, который не претерпевает превращений при низких температурах. При всех температурах σ0,2 / σв = 0,5 (12Х18H10, 12X13AГ19).
Хромоникелевые стали имеют:
- высокую ударную вязкость KCV > 2000 кДж/м2 при комнатной температуре и всех температурах вплоть до –253 °С (кипение жидкого водорода);
- вязкий излом.
Никель снижает порог хладноломкости, повышает прочность стали (σв), увеличивает ударную вязкость (KСV) при -196 °С.
Стали 07Х21Г7АН5 с σ0,2 = 400 МПа и 03Х13Н9Д2ТМ с σ0,2 = 800 МПа являются высокопрочными криогенными сталями.
17.4. Магнитные стали и сплавы
Основными характеристиками магнитных сталей и сплавов являются магнитные свойства:
- остаточная индукция Br (измеряется в гауссах (Гс));
- коэрцетивная сила Нс (измеряется в эрстедах (Э));
- магнитная проницаемость (измеряется в Гc/Э).
Магнитная проницаемость определяется по формуле: μ = В /Нс. Если μ > 1, то материал парамагнитен, если μ < 1 – материал диамагнитный.
К ферромагнитным материалам относятся Fe, Co, N1, имеющие μ »1.
Магнитные сплавы в зависимости от коэрцетивной силы (Нс ) и магнитной проницаемости (μ ) делятся на:
- магнитотвердые сплавы с большой Нс и малой μ, применяющиеся для изготовления постоянных магнитов. Эти высокоуглеродистые, легированные сплавы (ЕХ, ЕХ3, ЕХ5К5, сплав ЮНДК24) имеют высокую твердость, хрупкость и не обрабатываются резанием. Магниты из магнитотвердых сплавов изготавливают литьём или спеканием из порошков;
- магнитомягкие сплавы с малой Нс и высокой μ.
К ним относятся :
- электротехническое железо (Армко) марок Э, ЭА, ЭАА для изготовления сердечников, полюсных наконечников электромагнитов, реле;
- электротехническая сталь, которая по содержанию кремния делится на низколегированную (0,8 – 1,8 % Si) (динамная сталь), среднелегированную (1,8 - 2,8 % Si), повышенно-легированную (2,8 – 3,8 % Si) и высоколегированную (3,8 – 4,8 % Si) (трансформаторная сталь);
- железоникелевые сплавы (пермаллои), содержащие 45-80 % Ni, дополнительно легированные Cr, Si, Mo и имеющие высокую магнитную проницаемость. Пермаллой 79НМ (79 % N1, 4 % Мо) после специальной термической обработки имеет магнитную проницаемость μ0 - 30 000 и μmax - 22O 000 Гс/Э. Применяют эти сплавы в телефонах и радио (слабые электромагнитные поля).
- ферриты, получаемые спеканием порошков ферромагнитной окиси железа Fe2O3 и окислов двухвалентных металлов МО (ZnO, NiО, MgO). В отличие от других магнитомягких материалов у ферритов очень высокое электросопротивление (1012 0м * см), и работают они в области высоких и сверхвысоких частот.
17.5. Сплавы с особенностями электросопротивления
Сплавы с особенностями электросопротивления делятся на три группы:
- проводниковые;
- с высоким электросопротивлением;
- диэлектрики.
К проводниковым сплавам предъявляются следующее эксплуатационные и технологические требования:
- малое электрическое сопротивление;
- высокая прочность (для предохранения от провисания);
- высокая пластичность и способность к холодному и горячему деформированию;
- хорошая коррозионная стойкость;
- легкость пайки и сварки (при монтаже).
Этим требованиям удовлетворяют (в различной степени) Ag, Си, А1, Fe.
Одним из важнейших проводниковых материалов является медь (Сu), которая по свойствам близка к серебру ( плотность ρ = 8,9 г/см2 при 20 оС, удельное электросопротивление – 0,017( Ом*мм)/м2. Кристаллическая решётка меди – ГЦК с параметром а = 0,36 Нм. Удельное электросопротивление меди принимается за эталон.
Марки меди: M1 (99,9 %), Тпл = 1083 оС; МО (99,95 %), Ткип = 2360 °С; МОО (99,99 %). В технической меди могут присутствовать вредные примеси: висмут (≤ 0,002 %), свинец (≤ 0,005 %), сера, кислород, которые уменьшают пластичность меди.
Чистая медь имеет малую прочность, поэтому её легируют кадмием (Cd), что приводит к незначительной потере электропроводности при сохранении достаточно высокой прочности. Проводимость таких сплавов составляет 80-90 % от проводимости чистой меди. Сплав, упрочненный наклепом, имеет проводимость 98 % от проводимости меди.
Алюминий (А1) имеет электросопротивление больше, чем у меди в 1,7 раза, но он легче. Для линий передач применяют сплав альдрей (0,4 % Mg, 0,6 % Si, 0,25 % Fe). К таким сплавам относятся АД000, АД0.
Большую прочность имеют биметаллы системы Fe - A1. Биметаллический провод (стальной провод, покрытый медью) используют при передаче переменных токов повышенной частоты.
Железо (Fe) имеет электросопротивление в 6-7 раз ниже электросопротивления меди. Сплавы железа (сталь с 0,1 – 0,15 % С) применяются для шин, рельсов электрических железных дорог и метро.
17.6. Сплавы с высоким электросопротивлением
Сплавы с высоким электросопротивлением применяют для изготовления элементов сопротивления реостатов и нагревательных элементов. Структура таких сплавов формируется на базе твердых растворов и к ним предъявляются следующие требования:
- они должны обладать высоким удельным электросопротивлением;
- должны иметь малый температурный коэффициент электросопротивления;
- должны обладать высокой окалиностойкостью (жаропрочностью);
- в них должны отсутствовать структурные превращения при нагревах и охлаждениях.
Для элементов сопротивления реостатов применяются сплавы:
- манганин – МНМц 3-12 (11,5-13 % Mn, 2,5-3,5 % Ni,остальное Сu);
- константан - МНМц 40-1,5 (1-2%. Mn, 39-41 % Ni, остальное Сu).
Эти сплавы имеют малый коэффициент электросопротивления: манганин в интервале температур от – 60 до +80 °С и константан в интервале температур от - 60 до + 350 °С.
Для нагревательных элементов применяют сплавы:
- железоалюминиевые: фехраль - Х13Ю4 (≤ 0,15 % С, 13 % Сu, 4 % Al), хромалъ - ОХ23Ю5 (≤ 0,05 % С, 23 % Сr, 5 % Al);
- никелевые: ферронихром - X15H60 (25 % Fe), нихром -Х20Н80. Сплав для деталей нагревательных приборов выпускается в виде проволоки или ленты.
17.7. Сплавы с заданным коэффициентом теплового расширения
К сплавам с заданным коэффициентом теплового расширения относятся железо-никелевые сплавы:
- сплав ИНВАР - 36Н (≤ 0,05 % С и 35-37 % Ni). Он почти не расширяется при температуре от -60 до +100 °С и применяется в специальных приборах (альтиметрах, барографах) высокой точности, работающих при переменных нагрузках и климатических изменениях температуры;
- сплав КОВАР - 29НК (0,03 % С, 29 % Ni, 17-18 % Со). Он имеет низкий коэффициент теплового расширения в интервале температур от -70 до + 420 оС и применяется для деталей, впаиваемых в стекло при создании вакуумноплотных спаев.
- сплав платинит - H42 (42-48 % Ni, остальное Fe). Он имеет коэффициент теплового расширения, равный коэффициенту теплового расширения платины и стекла.
Технические железоникелевые сплавы относятся к сталям аустенитного класса.
17.8. Сплавы с заданными упругими свойствами
В приборостроении для изготовления упругих элементов (пружин) требуется материал, обладающий высоким значением упругих свойств, достаточной пластичностью, прямолинейным кодом изменения модуля упругости в широком интервале температур, а также немагнитностью и коррозионной стойкостью.
К таким сплавам относятся:
- сплав 40KXHM (0,07-0,12 % С, 15-17 % Ni, 19-21 % Cr, 6,4-7,4 % Мо, 39-41 % Со). Это высокопрочный, с высокими упругими свойствами, немагнитный, коррозионностойкий в агрессивных средах сплав, который применяется для заводных пружин часовых механизмов,а также для витых цилиндрических пружин, работающих при температурах до 400 оС;
- сплав 42НХТЮ ( < 0,05 % С, ~42 % Ni). Это высокопрочный сплав с низким температурным коэффициентом модуля упругости при температуре до 100 оС, который применяется для упругих чувствительных элементов, работающих до температуры +100 оС.
18. ЦВЕТНЫЕ МЕТАЛЛЫ И СПЛАВЫ
18.1. Медные сплавы
Медные сплавы делятся на две группы:
- латуни. Это сплавы меди с цинком. Цинк повышает прочность и пластичность сплава. Максимальной пластичностью обладает сплав с 30 % Zn.
Латуни (в особенности однофазные) легко поддаются деформации и поэтому из латуни изготавливают катаный полуфабрикат (листы, ленты, профили и т.д.). Латуни с содержанием цинка до 40 % пластичны, хорошо обрабатываются давлением в горячем состоянии, коррозионностойки.
Кроме простых латуней – сплавов только меди и цинка, применяют специальные латуни, в которых для придания тех или иных свойств дополнительно вводят различные элементы: свинец для улучшения обрабатываемости (автоматная латунь ЛС59, содержащая 40 % Zn и 1-2 % Pb), олово для повышения сопротивления коррозии в морской воде (морская латунь), алюминий и никель для повышения механических свойств.
Практически применяемые латуни в зависимости от структуры при комнатной температуре разделяются на две категории:
- α – латуни, содержащие меди не менее 61 %. Марки этих латуней Л62, Л68 и др. Их изготавливают в виде тонких листов, лент др. α – Латуни с более высоким содержанием меди (Л80) имеют цвет золота, и их применяют для ювелирных и декоративных изделий. Латуни, содержащие высокий процент меди, называют томпаком.
- α + β – латуни, содержащие 55 – 61 % меди. Наиболее распространенная марка Л59, из которой изготавливают прутки, а из них с помощью обработки резанием – различные детали.
Латуни с содержанием цинка до 40 % - пластичны, хорошо обрабатываются давлением в горячем состоянии, коррозионностойки.
- бронзы. Это сплавы меди с оловом, алюминием, кремнием и другими элементами, обладающие хорошими литейными свойствами (малой усадкой) и использующиеся как антифрикционные сплавы.
Маркировка бронзы: БрОЦС8-4-3, содержащая 8 % Sn, 4 % Zn, 3 % Pb, остальное - медь.
В зависимости от вида легирующего элемента различают:
- оловянистые бронзы , содержащие до 5 % Sn. Они устойчивы к действию атмосферы, морской воды;
- алюминиевые бронзы, содержащие 9-11 % А1. Они обладают хорошими технологическими и механическими свойствами. Их применяют для изготовления зубчатых колес, сальников, деталей турбин;
- кремнистые бронзы, содержащие 1-3 % А1. Они обладают хорошими литейными и антикоррозионными свойствами, высокой упругостью, выносливостью;
- бериллиевые бронзы, содержащие 2-2,5 % Ве; 0,5 % Ni,остальное медь. Эти бронзы относятся к разряду дорогих и используются в приборостроении для изготовления пружин, мембран и др.
- медно-никелевые сплавы, в которых основным легирующим элементом является никель. Эти сплавы можно разделить на конструкционные и электротехнические.
К первой группе относятся коррозионно-стойкие и высокопрочные сплавы типа мельхиор (МНЖМц30-1-1), нейзильбер (МНЦ15-20), куниаль (МНА13-3). В качестве дополнительных легирующих элементов в них добавляют Mn, Al, Zn, Fe, Co, Pb. Изготавливают из этих сплавов украшения, столовые и чайные приборы.
- сплав монель, содержащий 66 % Ni + 28 % Cu + Mn + Fe. Он применяется для изготовления монет, хирургического инструмента, так как обладает высокой коррозионной стойкостью, прочностью, хорошей обрабатываемостью.
18.2. Алюминиевые сплавы
Алюминий - один из наиболее легких конструкционных металлов (ρ = 2,7кг/м3). Он обладает высокой пластичностью. В чистом виде алюминий имеет небольшую прочность, кристаллическую решётку ГЦК с параметром а = 0,404 Нм и обладает высокой коррозионной стойкостью из-за образования на поверхности пленки, содержащей химическое соединение Al2O3.
Алюминий и его сплавы используют в качестве проводниковых материалов (провода в быту). Электропроводность равна 34*10 Ом-1* см-1, что составляет 57 % от электропроводности меди. В электротехнике используют алюминий марок A00 (99,7 %), А0 (99,6 %) и Al(99,5 %).
По технологическому признаку алюминиевые сплавы делятся на деформируемые (термически не упрочняемые и упрочняемые) и литейные (рис. 18.1).
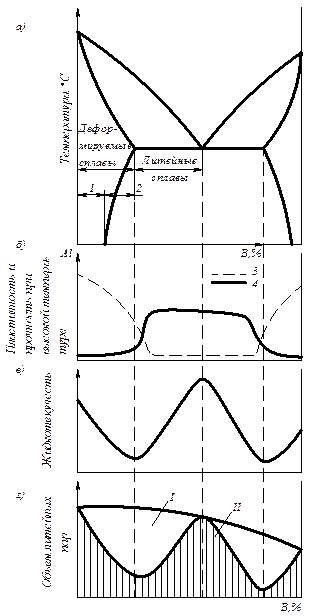
Рис. 18.1. Классификация алюминиевых сплавов по диаграмме состояния (а) и технологические свойства сплавов с ограниченной
растворимостью (б – г)
Как видно из рисунка 18.1. различные участки диаграммы соответствуют:
1 – сплавам, не упрочняемым термической обработкой;
2 – сплавам, упрочняемым термической обработкой;
3 – изменению пластичности;
I – образованию рассеянных пор;
II- образованию сконцентрированных пор.
К деформируемым алюминиевым сплавам относятся:
- сплавы алюминия с марганцем АМц (АМц3) и сплавы алюминия с магнием АМг (Амг6). Марганец и магний повышают прочность алюминия в три раза. Используют эти сплавы при изготовлении сварных емкостей для горючего, азотной и других кислот, трубопроводов, средне-нагруженных деталей конструкций;
- дюралюмины - сплавы алюминия с медью (2,2-4,8 %),магнием (0,4-2,4 %), марганцем (0,4-0,8 %). Это термически упрочняемые сплавы. Обозначение дюралюминов: Д1, Д6, Д16 (номера условные).
Для защиты дюралюминов от коррозии используют так называемое плакирование (покрытие тонким защитным слоем из чистого алюминия);
- сплав В95 - наиболее прочный алюминиевый сплав (2 % Си, 2,5 % Mg, 0,5 % Mn; 6 % Zn, 0,15 % Сr, 0,5 %Si, 0,5 % Fe) и используется он для изготовления элементов летательных аппаратов;
- ковочные сплaвы (АК) для деталей, изготавливаемых ковкой и давлением. Обозначение: АК1, АК5 (номер условный).
Эти сплавы обладают способностью сохранять механические свойства при повышенных температурах.
К литейным алюминиевым сплавам относятся сплавы алюминия с кремнием (так называемые силумины), содержащие 4-13 % Si.
Силумины маркируют: АЛ2, АЛ13 (порядковый номер). Применяют такие сплавы для изготовления литых деталей приборов, корпусов турбонасосов, тонкостенных отливок сложной формы.
В настоящее время вводится единая цифровая маркировка алюминиевых сплавов. Первая цифра обозначает основу всех сплавов (алюминию присвоена цифра 1); вторая – главный легирующий элемент или группа главных легирующих элементов; третья или третья со второй – соответствует старой маркировке; четвертая цифра – нечетная (включая 0) указывает, что сплав деформируемый, четная – что сплав литейный.
Например, сплав Д1 обозначают 1110, Д16 – 1160, АК4 1140, Амг5 – 1550, АК6- 1360 и т. д. Некоторые новые сплавы имеют только цифровую маркировку – 1915, 1925 и др.
18.3. Магниевые сплавы
В качестве легирующих добавок в магниевых сплавах используют алюминий, цинк и марганец, растворяющиеся в магнии. Растворимость падает с уменьшением температуры, что позволяет применять для этих сплавов термическую обработку, заключающуюся в закалке с последующим старением.
Магниевые сплавы делятся на деформируемые (МА) и литейные (МЛ). Эти сплавы очень легкие и используются для изготовления деталей в авиастроении.
18.4. Титан и его сплавы.
Титан – это серебристо-белый металл с малой плотностью (4,5 г/см3) и высокой температурой плавления (1672 оС), имеющий две аллотропические модификации: α – низкотемпературную с плотноупакованной гексагональной решёткой и β – высокотемпературную с кубической объёмноцентрированной решёткой. Температура перехода α ↔ β равна 882 оС.
Для улучшения прочностных и пластических свойств титан легируется различными элементами, содержание которых, в общей сложности, не превышает 10 –15 %. Легирующие элементы смещают температуру аллотропического превращения титана. Алюминий, кислород, азот, углерод стабилизируют α –фазу ; железо, молибден, тантал, вольфрам, хром, марганец, никель стабилизируют β –фазу;
Титан имеет высокую коррозионную стойкость в большом количестве агрессивных сред, превосходя в этом отношении нержавеющую сталь. При нагреве до 500 оС титан становится активным и поглощает из атмосферы газы (кислород, азот, водород), что сильно влияет на его механические свойства.
Технический титан маркируется в зависимости от содержания примесей: BT1-00 (сумма примесей менее 0,398 %), ВТ1-0 (сумма примесей менее 0,55 %).
Титановые сплавы классифицируются:
- по технологии изготовления на деформируемые, литейные и изготовленные методами порошковой металлургии. Для маркировки деформируемых титановых сплавов используется буквенно-цифровой код:
- ОТ4-0, ОТ4-1, ОТ4 - сплавы, в которых основными легирующими добавками являются алюминий и марганец;
- ВТ5, ВТ5-1, ВТ3-1, ВТ6, ВТ9 и т.д. – сплавы, легированные алюминием или алюминием и вольфрамом.
Стоящие за буквами цифры являются условным порядковым номером.
Особенности маркировки литейных титановых сплавов – наличие буквы Л в конце обозначения марки: ВТ5Л, ВТ3-1Л и др.
Для изготовления деталей методом порошковой металлургии используют сплавы ВТ5, ВТ5-1, ОТ4 и др. Порошковые сплавы маркируются так же, как и деформируемые.
Литейные сплавы титана обладают более низкими механическими свойствами, чем соответствующие деформируемые;
- по способу упрочнения на термически упрочняемые и не упрочняемые термической обработкой;
- по структуре на однофазные α – сплавы (не содержат b-стабилизаторов); псевдо –а - сплавы (коэффициент b- стабилизации не более 0,25); (a + b)-сплавы (коэффициент b-стабилизации от 0,3 до 0,9); псевдо-b-сплавы (коэффициент b-стабилизации от 1,4 до 4,4) и b-сплавы (коэффициент b-стабилизации > 2,5).
Преимуществом титановых сплавов, по сравнению с техническим титаном, являются следующие свойства:
- сочетание высокой прочности (σв = 800-1500 МПа) с хорошей пластичностью (δ = 18-25 %);
- малая плотность и высокая удельная прочность (σв/γ до 40);
- хорошая жаропрочность (до 600-700 оС);
- высокая коррозионная стойкость;
- низкая пластичность при комнатной температуре;
- высокая чувствительность к поверхностным дефектам.
Все титановые сплавы подвергаются термообработке, ХТО и ТМО и для повышения их износостойкости возможно применение цементации и азотирования.
Основными недостатками титана и его сплавов являются:
- высокая способность при повышенных температурах к взаимодействию со всеми газами, а также с материалами плавильных печей;
- невысокие антифрикционные свойства;
- плохая обрабатываемость резанием;
- невысокая жесткость конструкции из-за низкого значения модуля упругости.
Титановые сплавы используют в авиа- и ракетостроении (корпуса двигателей, баллоны для газов, сопла, диски, детали крепежа, фюзеляжа), в химической промышленности (компрессоры, клапаны, вентили), в изготовлении криогенной техники.
18.5. Антифрикционные сплавы
Антифрикционные сплавы применяют для изготовления подшипников качения и скольжения. К таким сплавам предъявляются следующие требования:
- низкий коэффициент трения;
- хорошая прирабатываемость;
- микрокапиллярность для смазки;
- хорошая теплопроводность.
К антифрикционным сплавам относятся:
- свинцовистые бронзы (до 25-30 % РЬ) (БрС30 И БРОС5-25;
- антифрикционные чугуны (чугун с перлитной основой и повышенным количеством графита);
- баббиты - сплавы олова с сурьмой и медью (Б88, Б89),а также сплавы свинца с кальцием и натрием (Б16, БКА).
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
1. Гуляев, А.П. Металловедение: учебник для вузов / А.П.Гуляев. - М.: Металлургия, 1986.- 541 с.
2. Мозберг, Р.К. Материаловедение: учебник для вузов / Р.К.Мозберг. - М.: Металлургия, 1991. - 500 с.
3. Лахтин, Ю.М. Основы металловедения: учебник для вузов / Ю.М.Лахтин. – М.: Металлургия, 1988. – 400 с.
4. Новиков, И.И. Теория термической обработки: учебник для вузов / И.И.Новиков. – М.: Металлургия, 1988. – 479 с.
5. Конструкционные материалы: Справочник / под ред. Б.Н.Арзамасова. – М.: Машиностроение, 1990. – 687 с.
6. Арзамасов, Б.Н. Материаловедение: учебник для вузов / Б.Н.Арзамасов. – М.: Машиностроение, 1986. –383 с.
7. Башнин, Ю.А. Технология термической обработки / Ю.А.Башнин, Б.К.Ушаков, А.Г.Секей. – М.: Металлургия, 1986. – 424 с.
8. Гольдштейн, М.И. Специальные стали / М.И.Гольдштейн, С.В.Грачев, Ю.Г.Веслер. – М.: металлургия, 1985. – 407 с.
СОДЕРЖАНИЕ
| ВВЕДЕНИЕ | |
| 1. ЦЕЛИ И ЗАДАЧИ МАТЕРИАЛОВЕДЕНИЯ. ОСНОВНЫЕ ПОНЯТИЯ О МЕТАЛЛАХ И ИХ СВОЙСТВАХ | |
| 2. АТОМНО-КРИСТАЛЛИЧЕСКОЕ СТРОЕНИЕ МЕТАЛЛОВ | |
| 2.1. Строение реальных кристаллов | |
| 2.2. Дефекты кристаллического строения | |
| 2.3. Превращения в твердом состоянии. Полиморфизм | |
| 3. КРИСТАЛЛИЗАЦИЯ МЕТАЛЛОВ И СПЛАВОВ | |
| 3.1. Энергетические условия процесса кристаллизации | |
| 3.2. Механизм процесса кристаллизации | |
| 3.3. Аморфное состояние металлов | |
| 3.4. Реальная форма кристаллических образований | |
| 3.5. Получение монокристаллов | |
| 3.6. Жидкие кристаллы | |
| 3.7. Строение стального слитка | |
| 3.8. Методы исследования структуры | |
| 4. МЕХАНИЧЕСКИЕ СВОЙСТЬВА МЕТАЛЛОВ И СПЛАВОВ | |
| 4.1. Упругая и пластическая деформация. Несовершенства решетки и прочность металлов | |
| 4.2. Методы испытаний металлов и сплавов | |
| 4.3. Конструкционная прочность металлов и сплавов | |
| 4.4. Пути повышения прочности металлов | |
| 4.5. Влияние нагрева на строение и свойства деформированного металла (рекристаллизация) | |
| 5. ОСНОВЫ ТЕОРИИ СПЛАВОВ | |
| 5.1. Строение сплавов | |
| 5.2. Химические соединения | |
| 5.3. Электронные соединения (фазы ЮМ-РОЗАРИ) | |
| 5.4. Механические смеси | |
| 6. ДИАГРАММА СОСТОЯНИЯ | |
| 6.1. Построение диаграмм состояния (равновесия) | |
| 6.2. Правило отрезков или правило рычага | |
| 6.3. Диаграмма состояния для сплавов, образующих механические смеси из чистых компонентов (I рода) | |
| 6.4. Диаграмма состояния для сплавов с ограниченной растворимостью в твердом состоянии (III рода) | |
| 6.5. Диаграмма с перитектикой | |
| 6.6. Диаграмма для сплавов, образующих химические соединения (IV рода) | |
| 6.7. Диаграмма состояния для сплавов, испытывающих полиморфные превращения | |
| 6.8. Связь диаграммы состояния сплава с его свойствами | |
| 7. АНАЛИЗ ДИАГРАММЫ «ЖЕЛЕЗО – УГЛЕРОД» | |
| 7.1. Характеристика линий и точек диаграммы «железо-углерод» | |
| 7.2. Практическое применение диаграммы «железо-углерод» | |
| 7.3. Классификация сплавов системы «железо-углерод» | |
| 8. ОСНОВЫ ТЕОРИИ ТЕРМИЧЕСКОЙ ОБРАБОТКИ | |
| 8.1. Четыре основные превращения в стали | |
| 8.2. Превращения в стали при нагреве – образование аустенита (I превращение) | |
| 8.3. Превращение в стали при охлаждении (II превращение) | |
| 8.4. Перлитное превращение | |
| 8.5. Бейнитное превращение | |
| 8.6. Превращение аустенита при непрерывном охлаждении | |
| 8.7. Мартенситное превращение (III превращение) | |
| 8.8. Превращение в закаленной стали при нагреве (IV превращение) | |
| 9. ТЕХНОЛОГИЯ ТЕРМИЧЕСКОЙ ОБРАБОТКИ | |
| 9.1. Основные составляющие технологического процесса термической обработки | |
| 9.2. Классификация видов термической обработки | |
| 9.3. Способы закалки | |
| 9.4. Закаливаемость и прокаливаемость | |
| 10. ВНУТРЕННИЕ НАПРЯЖЕНИЯ | |
| 11. ОТПУСК | |
| 12. ХИМИКО - ТЕРМИЧЕСКАЯ ОБРАБОТКА (ХТО) | |
| 12.1. Цементация стали | |
| 12.2. Азотирование стали | |
| 13. ТЕРМОМЕХАНИЧЕСКАЯ ОБРАБОТКА | |
| 14. ЛЕГИРОВАННЫЕ СТАЛИ И СПЛАВЫ | |
| 14.1. Влияние легирующих элементов на превращения в сталях | |
| 14.2. Влияние легирующих элементов на кинетику распада аустенита | |
| 14.3. Влияние легирующих элементов на мартенситное превращение | |
| 14.4. Классификация легированных сталей | |
| 14.5. Принцип комплексного легирования | |
| 14.6. Технологические особенности термической обработки легированной стали | |
| 14.7. Особенности отпуска легированной стали | |
| 15. КОНСТРУКЦИОННЫЕ МАТЕРИАЛЫ | |
| 15.1. Классификация конструкционных сталей | |
| 16. ИНСТРУМЕНТАЛЬНЫЕ СТАЛИ И СПЛАВЫ | |
| 16.1. Режущие стали | |
| 16.2. Быстрорежущие стали | |
| 16.3. Твердые режущие стали | |
| 16.4. Штамповые стали | |
| 16.5. Стали для измерительных инструментов | |
| 17. СТАЛИ И СПЛАВЫ С ОСОБЫМИ СВОЙСТВАМИ | |
| 17.1. Нержавеющие (коррозионностойкие) стали | |
| 17.2. Жаростойкие и жаропрочные стали | |
| 17.3. Криогенные стали и сплавы | |
| 17.4. Магнитные стали и сплавы | |
| 17.5. Сплавы с особенностями электросопротивления | |
| 17.6. Сплавы с высоким электросопротивлением | |
| 17.7. Сплавы с заданным коэффициентом теплового расширения | |
| 18. ЦВЕТНЫЕ МЕТАЛЛЫ И СПЛАВЫ | |
| 18.1. Медные сплавы | |
| 18.2. Алюминиевые сплавы | |
| 18.3. Магниевые сплавы | |
| 18.4. Титан и его сплавы | |
| 18.5. Антифрикционные сплавы |
– Конец работы –
Используемые теги: Новом, столетии, будут, продолжать, развиваться, хорошем, уровне, плазменная, Высокочастотная, индукционная, Электронная, термическая, обработка0.136
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: В новом столетии будут продолжать развиваться на хорошем уровне плазменная, высокочастотная, индукционная, электронная термическая обработка
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов