рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Образование
- /
- Лекция 9. Строение атома
Реферат Курсовая Конспект
Лекция 9. Строение атома
Лекция 9. Строение атома - раздел Образование, Лекция 9. Стр&#...
Лекция 9. Строение атома
Sect; 1 Атом. Химический элемент. Простое и сложное вещества .
Атом -химически неделимая, электронейтральная частица, которая состоит из нуклонов* – протонов ( 11р), нейтронов (01 n) и электронов е- . Это понятие имеет важное значение для описания химических превращений. ______________________________________________________________
_*) Строго говоря, нуклоны не являются неделимыми, а состоят из кварков
Отметим, что химический элемент- это совокупность атомов с определенным одинаковым зарядом ядра. Простое вещество- то вещество, которое состоит из атомов одного и того же элемента. Сложное вещество состоит из атомов разных элементов.
Sect; 2. Как обнаружить атом?
а) процесс электролиза, б) явление… в)…Sect; 3. Электронное строение атома . Модель Бора.
Электронное строение атома определяется, во-первых, энергией электронов и , во-вторых, тем как они распределены в пространстве.
Если пропустить свет от газоразрядной лампы сквозь щель и образовавшийся луч направить на призму, а затем на экран, то на нем образуется система полос, или линейчатый спектр испускания ( Рис 2 ).
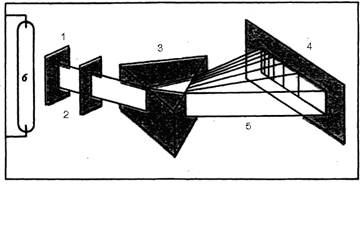
Рис2. Линейчатый спектр испускания. 1- пучок лучей, 2- щели, 4- экран, 5- линейчатый спектр, газоразрядная лампа.
Этот факт связан с квантованием (порционностью) энергии электронов. Первая квантовая модель электронного строения атомов создана Нильсом Бором. Её основные положения следующие:
1.Отрицательно заряженные электроны двигаются вокруг положительно заряженного ядра по орбитам ( Рис 3 ).
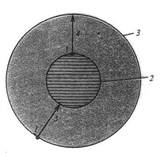
Рис 3.Схема орбит. 1- электрон, 2 и 3 орбиты с энергиями Е1 и Е2, 4 - ν частота испускаемого света ν = (Е2 – Е1)/ h
2. Каждая орбита характеризуется определенной энергией Е и её номером т.е. квантовым числом n . Орбита с самой низкой энергией
Каждая орбита характеризуется определенной энергией Е и её номером т.е. квантовым числом n . Орбита с самой низкой энергией
( ближайшая к ядру) характеризуется квантовым числом n = 1. Следующим уровням соответствуют квантовые числа 2, 3 и т.д. (Рис 4)
Рис.4. Уровни энергии для некоторых значений квантового числа п
Штриховая линия соответствует уровню, на котором электрон обладает энергией, достаточной для того, чтобы покинуть атом: происходит ионизация атома
3.Переходы электронов между орбиталями с энергиями Е1 и Е2 связаны с изменением энергии ∆ Е и обуславливают не непрерывное, а квантовое
( порционное) поглощение или испускание света с частотой (ν) , или длиной волны (λ)
∆ Е = Е2 – Е1 = h ν = hc/ λ ( 1 )
где h- постоянная Планка (6.62 10-34 Дж с), а с – скорость света. Спектр поглощения возникает, когда электроны с низких орбит возбуждаются и переходят на более верхние орбиты. Спектр испускания возникает в обратном случае, если электроны с возбужденных , верхних орбит
« падают» обратно на орбиты с меньшей энергией. Такие электроны отдают энергию, испуская её в виде светового излучения с частотой (ν), определяемой уравнением Планка (1)
Sect; 4. Корпускулярно- волновой дуализм электронов.
Ряд экспериментальных фактов показывает, что электроны имеют двойственные (дуалистические) свойства. Во- первых, они могут проявлять волновые свойства, а во-вторых вести себя как частицы (карпускулы). В 1895 году английский ученый Крукс проводил эксперименты с электрическими разрядами в газах при низких давлениях.
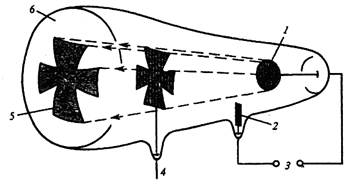
Рис. 5 Трубка Крукса с препятствием в виде креста на пути катодных лучей: 1 — катод; 2 — анод; 3 — источник высокого напряжения; 4 — препятствие на пути катодных луче (мальтийский крест); 5 —тень от препятствия; 6 — покрытый люминофором экран, светящийся под действием катодных лучей
Используя стеклянную трубку ( Рис 5 ) он наблюдал свечение стекла при низких
( 10-4 атм) давлениях газа. Стеклянный экран ( 6 ) покрытый фосфоресцирующим материалом и расположенный напротив катода (1 ) при включении источника высокого напряжения (3 ) начинал сильно светиться. Когда же внутри трубки помещалось препятствие в форме креста, то в области свечения появлялась его тень ( 5 ). Отсюда был сделан вывод. что поток электронов , исходящих из катода, подобен световым лучам (волнам). В отличие от обычных световых волн поток электронов отклонялся как магнитным, так и электрическим полями. Направление отклонения указывало на то, что наблюдаемые лучи были заряжены отрицательно. Однако кроме волновых, эти лучи (поток электронов) обладали и свойствами частиц: они крутили колесико с лопастями, помещенное в разрядной трубке. Подобно частицам, поток электронов способен передавать кинетическую энергию предметам, которые встречались на его пути. Кроме того, волновой характер электронов доказывает дифракция электронов при прохождении электронов через кристаллическое вещество, корпускулярный – явление фотоэффекта.
Двойственный ( как волны и как частицы) характер поведения электронов модель Бора не могла объяснить. Оказалось, , что поведение микрочастиц таких, как электроны в атоме, нельзя рассматривать в рамках классической механики или термодинамики. Для систем, состоящих их микрочастиц, например, электронов, необходимо было ввести принципиально новую систему координат и связывающих их уравнений, которые описывала бы состояние системы и процессы в ней, связанные с изменением энергии. В 1926 г. австрийский физик Э.Шредингер предложил для решения этих вопросов квантово-механическую модель электронного строения атомов.
Sect; 5. Квантово-механическая модель электронного строения атомов.
Для описания микроскопических систем предложил новую волновую Ψ функцию, а также уравнение связи между ней, новыми координатами и энергией состояния системы..
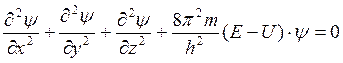 ( 2 ),
( 2 ),
Где x ,y, z – координаты электрона, Е- его полная энергия, U- потенциальная энергия, m- масса , h- постоянная Планка. Волновую функцию Ψ называют атомной орбиталью и получают её решением уравнения Шредингера ( 2 ). Квадрат волновой функции  2 называют плотностью вероятности, которая характеризует вероятность нахождения электрона в некоторой области пространства. Величина Ψ зависит от координат микроскопического состояния
2 называют плотностью вероятности, которая характеризует вероятность нахождения электрона в некоторой области пространства. Величина Ψ зависит от координат микроскопического состояния
Ψ = Ψ (n , l, ml , mS ) ( 3 ):
n- главное квантовое число принимает целочисленные значения, характеризует квантование энергии и определяет энергию орбитали (состояния). l =n - 1 орбитальное квантовое число характеризует форму орбитали. Они принимают значения 0, 1, 2, 3… и обозначаются соответственно буквенными символами s, p, d, f… Форма s, p d орбиталей показана на рис 6 , ml = 2l + 1 – характеристика пространственного расположения ( ориентации) орбитали; mS = +1/2 или – ½ спиновое квантовое число характеризует вращение электрона вокруг собственной оси.
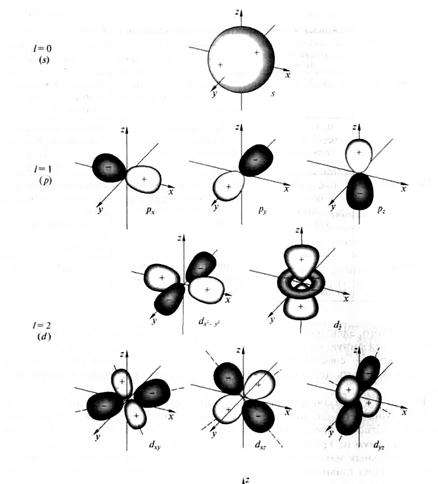
Рис. 6. Форма s-, p- и d- атомных орбиталей.
Таким образом состояние электрона в атоме определяется четырьмя квантовыми числами и описывается атомной волновой функцией ( 3 ). Энергии орбиталей возрастают по мере увеличения главного квантового числа n. При данном значении n энергии s-, p-, d- подуровней оказываются неодинаковыми: s < p < d.
Sect; 6. Электронная конфигурация атомов.
Распределение энергий атомных орбиталей представлено на рис. 7. Чем ближе к ядру расположена орбиталь , тем более отрицательно её значение. По мере возрастания главного квантового числа разница в энергиях уровней уменьшается
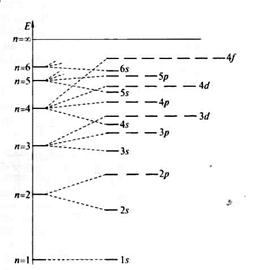
Рис. 7 . Распределение энергий атомных орбиталей. n –главное квантовое число.
Электронная конфигурация- это распределение электронов по энергетическим уровням орбиталей. Для построения электронной конфигурации атомов используются следующие правила заполнения орбиталей электронами.
1. Правило наименьшей энергии. В первую очередь заполняются с наименьшей энергией, т.е. выполняется последовательность: 1s < 2s <2p <3s<3p < 4s……
2. Принцип Паули. На одной орбитали может находиться не более двух электронов с разными значениями спинового квантового числа.
3.. Правило Хунда. В пределах одного подуровня электроны располагаются так, чтобы максимальный спин был максимальным. Это значит, что сначала на каждой орбитали данного подуровня электроны размещаются по одному. Когда же все орбитали окажутся занятыми наполовину, на них может появиться второй электрон.
Примеры электронных конфигураций атомов приведены на рис 8

Рис. 8. Примеры электронных конфигураций атомов.
Для описания электронной конфигурации атомов и построения молекулярных орбиталей важное значение имеет характер изменения взаимного расположения энергий 2s- и 2р- орбиталей (Рис9).
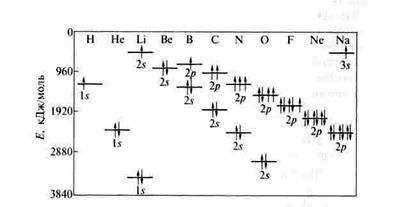
Рис. 9. Изменение энергии 1s-, 2s- и 2p-орбиталей у атомов
2-го периода Периодической системы.
Главная особенность этого изменения в том, что от Li к Ne увеличивается разность энергии 2s- и 2p-орбиталей. Почему?- Потому, что с ростом заряда ядра 2s-орбитали , во-первых, приближаются по энергии к ядру и во-вторых, начинают сильнее экранировать 2р- орбитали., которые поэтому удаляются от ядра и энергия их повышается. Таким образом в рассматриваемом ряду от Li к Ne увеличивается разность энергии 2s- и 2p-орбиталей.
Sect; 7 Периодический закон и периодическая система элементов.
Естественный ряд химических элементов 1Н, 2Не, 3Li……108Hs, 109Mt образует систему с периодическим изменением электронной конфигурации атомов и свойств химических элементов.
Такую периодичность Д.И.Менделеев сформулировал в виде периодического закона, который в современной виде записывается в виде : Свойства простых веществ, а также формы и свойства химических соединений элементов находятся в периодической зависимости от заряда ядра.Периодичность свойств основана на сходстве конфигураций внешних электронных орбиталей атомов и определяется периодичностью их повторения . Например, галогены F, Cl, Dr, I, Ft имеют на внешнем электронном уровне одинаковое число электронов ( ns2 np5 ) и сходные химические свойства.
Графическим представлением периодического закона является периодическая система элементов.Элементы расположены в таблице в порядке увеличения заряда ядра. Вертикальные ряды называются группами, а горизонтальные- периодами.По типу валентных орбиталей элементы делятся на блоки: s- блок объединяет элементы с электронной конфигурацией ns1 и ns2 , у элементов р- блока происходит заполнение р – подуровня, d- и f –блоки объединяют элементы с заполняющимися (n – 1)d- (n- 2) f- орбиталями соответственно. f-элементы выделяют в отдельные семейства лантаноидов (4 f) и актиноидов (5f ) .
Периоды объединяют элементы, в атомах которых заполняются одинаковые электронные уровни. Номер же периода совпадает с главным квантовым числом
( n ). Каждый период завершается элементом с завершенной электронной конфигурацией ns2 np6. Далее происходит заполнение ( n +1)) уровня. Различие в последовательности заполнения внешних и более близких к ядру уровней объясняет причину различной длины периодов. 1-ый период содержит два элемента, 2-ой и 3-ий – по восемь элементов каждый, 4-ый и 5-ый по 18, а 6-ой -32 элемента.
Группы объединяют элементы, атомы которых имеют одинаковое число электронов на внешнем уровне. Согласно системе , рекомендованной ИЮПАК*, Периодическая таблица имеет 18 периодов, которые обозначаются арабскими цифрами от 1 до 18. В старом коротком варианте имеется 8 периодов, которые обозначаются римскими цифрами от I до VIII.
Sect; 8 Основные характеристические свойства атомов.
Основные свойства атомов, особенно, их размер и энергия, связанные с отдачей или принятием электронов, периодически изменяются с изменением заряда ядра. Эти изменения позволяют объяснять наблюдаемые явления и предсказывать химические свойства и структурные особенности элементов и их соединений без использования табличных данных.
§ 8.1.Атомные и ионные радиусы.
Квантовая модель строения атомов не дает точного значения атомного и ионного радиусов, так как на больших расстояниях волновая функция электрона экспоненциально уменьшается с увеличением расстояния от ядра. Несмотря на невозможность получить точное значение радиуса, можно ожидать, что атом с большим числом электронов будет больше, чем атом, в котором всего несколько электронов. Такой подход позволяет предложить различные способы определения атомных радиусов на основе экспериментальных данных.
Металлический радиус определяется как половина найденного расстояния между ядрами соседних атомов в металле. Ковалентный радиус неметаллического элемента определяется как половина межядерного расстояния для соседних атомов одного элемента в молекуле. Кратные связи короче одинарных. И металлические и ковалентные радиусы называют просто атомными.Ионный радиус элемента определяется расстоянием между ядрами соседних катионов и анионов. Обычно радиус иона О2- принимают равным 1.40 Å. Например ионный радиус Mg2+ вычитанием этой величины из экспериментального межядерного расстояния между ионами Mg2+ и О2- в твердом MgO.
Атомные радиусы увеличиваются сверху вниз внутри одной группы элементов, так как электроны располагаются на орбиталях с возрастающим квантовым числом и с ростом числа электронов увеличивается их отталкивание. При движении же по периоду слева направо эффективный заряд ядра увеличивается, что приводит к уменьшению атомного радиуса. Отметим, что размер анионов больше размера катионов.
§8.2. Энергии ионизации.
Минимальная энергия , которую необходимо затратить для удаления от атома в газообразном состоянии называют энергией ионизации I
Агаз → А+ газ + е-
Первая энергия ионизации равна энергии высшей заполненной орбитали, взятой с обратным знаком. Изменение первой энергии ионизации в зависимости от атомного номера элемента представлено на рис 10. Значения энергии ионизации коррелируют со значениями атомных
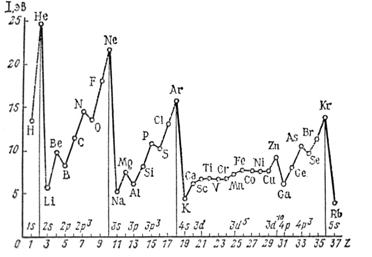 |
Рис. 10. Изменение первой энергии ионизации в зависимости от атомного номера.
радиусов. У элементов с маленькими радиусами энергии ионизации обычно высоки, так как электрон в них находится вблизи ядра и испытывает сильное электростатическое притяжение.
Изменение энергии ионизации в периоде имеет некоторые аномалии. Например, энергия ионизации атома бора меньше, чем бериллия, несмотря на то, что у первого больше заряд ядра. Эта аномалия объясняется тем, что при переходе к бору электрон занимает внешнюю 2р-орбиталь и , следовательно, связан с ядром слабее, чем электрон на 2s- орбитали. Понижение энергии ионизации при переходе от азота к кислороду объясняется иначе. Рассмотрим электронные конфигурации атомов азота и кислорода
N: [He] 2s2 2px12py12pz1 ; O: [He] 2s2 2px22py12pz1
В атоме О два электрона занимают одну 2р- орбиталь. Они находятся на близком расстоянии и поэтому испытывают сильное отталкивание друг о друга, что уменьшает эффективный заряд ядра, к которому они притягиваются. Дополнительный вклад дает также более низкая энергия иона О+, который имеет наполовину заполненную 2р- орбиталь [He] 2s2 2p3 , что понижает энергию. Изменение энергий ионизации в вертикальных рядах Периодической системы рассматривается в лекциях, посвященных химии элементов.
Sect;8.3 Сродство к электрону.
Агаз + е- → А-газ ; ∆ср-ва Н 0 Сродство к…– Конец работы –
Используемые теги: 1077, 1094, 1103, 1057, 1088, 1077, 1080, 1072, 1086, 10720.119
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Лекция 9. Строение атома
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов