рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Физика
- /
- Вид работы: Конспекты Лекций
- /
- Строение и свойства атома водорода. Конспект лекции с демонстрациями
Реферат Курсовая Конспект
Строение и свойства атома водорода. Конспект лекции с демонстрациями
Строение и свойства атома водорода. Конспект лекции с демонстрациями - Конспект Лекций, раздел Физика, Строение И Свойства Атома Водорода ...
Строение и свойства атома водорода
Конспект лекции с демонстрациями
Аннотация: традиционное изложение темы, дополненное двумя демонстрациями на компьютерных моделях и доказательством актуальности изучения водородоподобных систем в настоящее время.
Содержание

Надежные сведения о свойствах атомов получены при спектральном анализе излучения, испускаемого атомами при возбуждении. Еще в XIX-ом веке Бальмер показал, что длины волн четырех линий излучения водорода, лежащих в видимой части, могут быть очень точно представлены эмпирической формулой
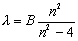 ,
,
где вместо n следует подставлять целые числа 3, 4, 5 и 6, а B – эмпирическая константа. Закономерность, выражаемая формулой Бальмера, становится особенно наглядной, если записать ее для частот линий
 ,
,
где R – постоянная Ридберга. Вы можете ознакомиться со спектральными линиями водорода и установить, какими переходами в атоме они обусловлены, на имеющейся компьютерной модели. Линии видимой части спектра - сплошные, остальные - штриховые.
Классическая физика не давала объяснения существованию линейчатых спектров. Трудности только возросли после опытов Э.Резерфорда, показавших, что в атоме есть массивное положительно заряженное ядро. Электроны, движущиеся с ускорением как планеты вокруг Солнца, должны излучать непрерывный спектр и терять энергию. Следовательно, атом должен быстро прекратить свое существование. Глубокий смысл этой формулы и подобных ей для серий Лаймана, Пашена... открылся после формулировки Н.Бором квантовых постулатов (1913 г.). В то время ему пришлось действовать логически противоречивым методом: сначала задача о движении электрона в атоме решалась при помощи классической механики, а затем из непрерывного множества состояний отбирались на основании специального постулата избранные, квантовые состояния. Успех модели произвел потрясающее впечатление на современников.
Теперь теория Н.Бора утратила свое значение. Но в свое время она была революционной: до 1913 г. представление о стационарных состояниях атома отсутствовало, после 1913 г. оно вошло в жизнь.
В 1922 г. Нильсу Бору была присуждена нобелевская премия :


1922
NIELS BOHR for his services in the investigation of the structure of atoms and of the radiation emanating from them.
(за заслуги в исследовании строения атомов и испускаемого ими излучения)
Вы можете посмотреть текст лекции, с которой при вручении премии выступил Н.Бор "The structure of the atom"( файл pdf 333 кб).
Постановка задачи:
Мы будем рассматривать свойства атома водорода и водородоподобных атомов, состоящих из ядра и одного электрона: H, He+, Li++... Заряд ядра равен Ze, где Z - порядковый номер элемента (число протонов в ядре). Масса электрона - me, масса ядра – M. Энергия взаимодействия электрона с ядром выражается формулой
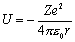 .
.
Мы имеем задачу о движении двух тел. Из курса механики известно, что такие задачи сводятся к задаче о движении тела с приведенной массой
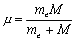
относительно неподвижного центра (в нашей задаче me << M и μ ~ me). Решаем задачу о движении заряженной частицы с массой μ в кулоновском поле U(r) неподвижного центра.
Грубая оценка энергии электрона:
Для оценки значения импульса электрона воспользуемся соотношением неопределенности Гейзенберга в виде
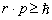 ,
,
где r – размер атома, p – импульс электрона. Чтобы значение импульса имело смысл, величину его принимаем бóльшей неопределенности Δp (p ≥ Δp). Тогда кинетическая энергия электрона равна
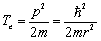 .
.
Полная энергия атома (задача нерелятивистская, энергия покоя не меняется и ее опускаем)
 .
.
Оценим энергию основного состояния, в котором она минимальна.
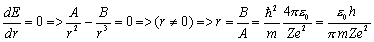 .
.
Подставим найденное значение r в выражение для полной энергии и получим
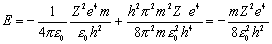 .
.
Для водорода (Z = 1) r = 0.53·10-10м, E = 13.6 эВ. Это радиус первой боровской орбиты и |E| – точное значение энергии связи электрона. Решение довольно грубое, но дает правильную зависимость энергии от m, Z, e и h.
Этот пример приведен исключительно для иллюстрации пользы оценочных расчетов. Грубые физически оправданные оценки дают правильный порядок величин.
Точное решение задачи о движении электрона:
Выпишем уравнение Шредингера
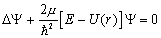 .
.
Поскольку нас интересует связанное состояние электрона, в этом уравнении E < 0 (значения E > 0 соответствуют задаче о рассеянии электрона ядром). Подставим выражение для потенциальной энергии (1):
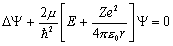 .
.
Т.к. потенциальная энергия зависит только от расстояния до центра взаимодействия, удобно решать задачу в сферической системе координат {r, θ, φ}. Волновую функцию в этом случае можно представить в виде произведения Ψ(r, θ, φ) = R(r)·Y(θ, φ). Функция R(r) зависит только от радиуса и является решением для сферически симметричных состояний атома, для которых угловая часть Y(θ, φ) = const. В приложении показано, как найти решение для сферически симметричных состояний (функцию R(r)). Там показано: чтобы полученное решение удовлетворяло требованиям, предъявляемым к волновым функциям, необходимо принять дискретность значений энергии
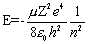 ,
,
где n = 1, 2, 3,... – так называемое главное квантовое число, определяющее энергию атома.
Ранее мы видели, что в трехмерном пространстве решение зависит от трех квантовых чисел. Другие два квантовых числа называются: l – орбитальное квантовое число и m – магнитное квантовое число. l может принимать одно из значений 0, 1, ...,(n - 1), а m – одно из значений -l, l + 1, ..., 0, ..., l - 1, l. Так для n = 1 разрешенными являются только l = 0 и m = 0. Эти довольно сложные правила являются следствием вида потенциала U(r) и условий, налагаемых на волновую функцию. Никаких специальных допущений для данной задачи делать не надо. Значения орбитального квантового числа 0, 1, 2, 3, ... принято обозначать буквами s, p, d, f, ... . Значения главного квантового числа указывается перед условным обозначением квантового числа l цифрой. Таким образом, например, 2p обозначает состояние атома, для которого n = 2 и l = 1.
Основное состояние водородоподобного атома
Самая простая волновая функция атома водорода имеет вид ( n = 1, l = 0, m = 0, состояние 1s ):
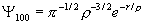 .
.
Здесь введена постоянная ρ, равная
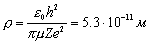 .
.
Волновая функция 1s - состояния изображена на рисунке ниже в левой части. Интерес представляет вероятность нахождения электрона между r и r + dr. Эта вероятность равна
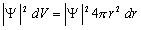 .
.
Элемент объема dV – это шаровой слой радиуса r и толщиной dr, величина его быстро растет с увеличением r (значения |Ψ|2 при бóльших r имеют бóльший вес).
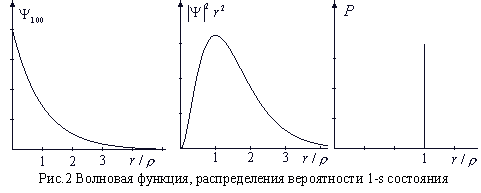
Поэтому для наглядного представления распределения вероятности построен график |Ψ|2·r2 (в центре рисунка). Из кривой видно, что среднее расстояние электрона от протона равно примерно 3/4·10-10м. Резкой границы атома не существует, но вероятность того, что электрон будет находиться от протона на расстоянии, превышающим среднее, скажем в 2 раза, весьма мала. На правом графике показано, как выглядело бы распределение вероятности в случае боровских орбит. Плотность вероятности отлична от нуля только при r = ρ. Результаты опытов по рассеянию электронов на атомарном водороде позволяют сделать выбор между этими распределениями в пользу функции, вытекающей из решения уравнения Шредингера. Вы можете сами в этом убедиться на компьютерной модели.
Рассчитаем еще среднее значение потенциальной энергии в 1s состоянии
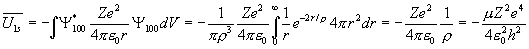 .
.
Оно равно точно удвоенному значению полной энергии. Следовательно, среднее значение кинетической энергии равно модулю полной энергии
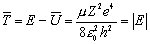 .
.
Возбужденные состояния водородоподобного атома
Энергии, которые может иметь атом водорода, отображены на схеме. Энергия E зависит только от главного квантового числа n. При данном n возможно
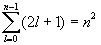
состояний (говорят, n2 - кратное вырождение уровня). Это отображено на схеме уровней.
Наиболее простой вид имеет волновая функция возбужденного состояния 2s
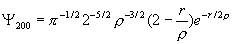 .
.
Плотность вероятности для состояния 2s (|Ψ|2·r2) изображена на рисунке. 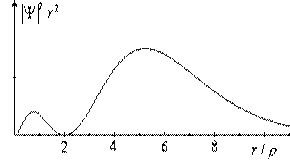 Электрон в этом состоянии в среднем в 4 раза дальше от ядра, чем в состоянии 1s. При этом средняя потенциальная энергия и полная энергия по абсолютной величине в четыре раза меньше. Волновые функции состояний 2p (n = 2, l = 1, m = 0 или ±1) невозможно наглядно изобразить в двух измерениях, т.к. они зависят от θ и φ.
Электрон в этом состоянии в среднем в 4 раза дальше от ядра, чем в состоянии 1s. При этом средняя потенциальная энергия и полная энергия по абсолютной величине в четыре раза меньше. Волновые функции состояний 2p (n = 2, l = 1, m = 0 или ±1) невозможно наглядно изобразить в двух измерениях, т.к. они зависят от θ и φ.  Они имеют одинаковую форму, но одна из них (m = 0) цилиндрически симметрична относительно оси z, две других - относительно осей x и y. Представление о них может дать рисунок справа. Волновые функции состояний с n = 3 имеют радиальную протяженность, примерно в 9 раз бóльшую, чем в состоянии 1s. Форма их еще сложнее. Но для всех состояний нет ничего похожего на боровские орбиты. Радиусы боровских орбит лишь указывают на наиболее вероятное удаление электрона от ядра.
Они имеют одинаковую форму, но одна из них (m = 0) цилиндрически симметрична относительно оси z, две других - относительно осей x и y. Представление о них может дать рисунок справа. Волновые функции состояний с n = 3 имеют радиальную протяженность, примерно в 9 раз бóльшую, чем в состоянии 1s. Форма их еще сложнее. Но для всех состояний нет ничего похожего на боровские орбиты. Радиусы боровских орбит лишь указывают на наиболее вероятное удаление электрона от ядра.
Значение квантового числа l определяет величину момента количества движения (момента импульса) M
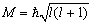 .
.
Для всех s - состояний этот момент равен нулю. (Попробуйте представить, как выглядит движение с нулевым моментом?) Т.к. значения l дискретны, то величина M квантована. Если атом обладает не равным нулю моментом количества движения, то он будет иметь и пропорциональный ему магнитный момент μ, т.к. движущийся электрон заряжен.
Сравним размеры атома в различных состояниях. С помощью волновых функций электрона можно подсчитать средний радиус атома в каждом состоянии
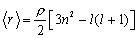 .
.
В отличие от энергии, которая определяется только числом n, величина зависит и от орбитального квантового числа l.  Как видно из формулы, наиболее "раздут" атом в сферически симметричном состоянии (когда l = 0): в нем электрон в среднем более всего удален от ядра. На рисунке справа изображены вместе распределения плотности вероятности для электрона в 1s -, 2s - и 3s - состояниях. Видно, что характерный размер атома действительно быстро растет; электронное облако как бы выталкивается к периферии по мере возбуждения атома.
Как видно из формулы, наиболее "раздут" атом в сферически симметричном состоянии (когда l = 0): в нем электрон в среднем более всего удален от ядра. На рисунке справа изображены вместе распределения плотности вероятности для электрона в 1s -, 2s - и 3s - состояниях. Видно, что характерный размер атома действительно быстро растет; электронное облако как бы выталкивается к периферии по мере возбуждения атома.
Наглядное представление волновых функций, описывающих движение электрона в возбужденных состояниях атома водорода, дает интересный апплет (разработка davidson.edu).
Излучение водородоподобного атома
Состояние 1s – основное. В этом состоянии атом имеет минимальную энергию. Чтобы перевести атом в одно из возбужденных состояний, ему надо сообщить энергию. Это можно осуществить за счет теплового удара (соударения с другим атомом в нагретом газе), за счет электронного удара (например, в электрическом разряде) или за счет поглощения атомом фотона. Характерное время жизни атома в возбужденном состоянии составляет 10-8 с. Далее происходит спонтанный переход в одно из нижележащих состояний. Переход атома из состояния 2 в состояние 1 будет сопровождаться излучением кванта с энергией
hν = E2 - E1,
где E2 и E1 - энергии соответствующих состояний. В квантовой механике доказывается, что возможны только такие переходы, при которых орбитальное квантовое число l меняется на единицу. Говорят, квантовое число l имеет правило отбора
Δl = ±1.
Это правило есть следствие закона сохранения момента количества движения. Изменение главного квантового числа n может быть любое. Возможные переходы показаны на схеме уровней.
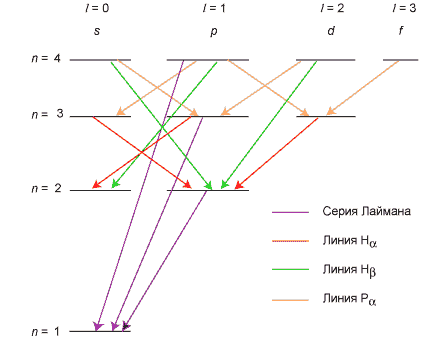
Пользуясь условными обозначениями состояний атома, переходы, приводящие к появлению серии Лаймана, можно записать в виде np → 1s ( n = 2, 3, ...). Общая формула для частот всех линий спектра выглядит следующим образом
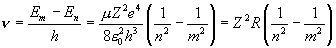 ,
,
где константу R назвали постоянной Ридберга, n и m – целые числа (n < m). Если n = 1, получаем серию Лаймана (в ультрафиолетовой области), при n = 2 – серию Бальмера (первые линии в видимой области), при n = 3 – серию Пашена (инфракрасный диапазон), и так далее.
Насколько точны квантовые расчеты можно судить, сравнивая теоретическое значение постоянной Ридберга 109737,309 1/см и значение, полученное из спектроскопических измерений 109736.807 1/см.
Обратите внимание: в атоме водорода есть состояние, переход из которого запрещен правилами отбора. На схеме уровней видно, что это 2s - состояние. Атом в таком состоянии называют метастабильным. Время жизни может быть очень продолжительным. Возбужденный атом водорода в метастабильном состоянии 2s существует ~2 мс. Благодаря значительному времени жизни метастабильные атомы могут накапливаться до относительно высоких концентраций 1012 - 1014 см-3, оставаясь возбужденными. Снятие возбуждений в таких системах происходит вследствие межатомных столкновений и может затягиваться на макроскопические времена.
При комнатной температуре практически все атомы водорода находятся в основном состоянии, т.к. для перевода атома в первое возбужденное состояние требуется затратить 10.2 эВ, а тепловая энергия kT имеет порядок 10-2 эВ. Полезно вычислить относительные числа атомов, находящихся в различных квантовых состояниях при температуре T. Пусть N2 – число атомов в состоянии с энергией E2, а N1 – в состоянии с энергией E1. Тогда отношение
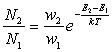 ,
,
где w2 и w1 число состояний с энергиями E2 и E1, соответственно (вспомним, что одну энергию могут иметь несколько состояний). w2 и w1 называют статистическими весами состояний. Для основного состояния атома водорода w = 2 (для n = 1 электрон может иметь одну из двух возможных проекций спина), для первого возбужденного w = 8 (вообще w = 2·n2). Если разность энергий E2 - E1 в несколько раз больше, чем kT, то значение экспоненты очень мало, практически все атомы будут находиться в нижнем энергетическом состоянии.
День сегодняшний
Как это не странно, интерес к водородоподобным атомам до сих пор сохраняется. Высоковозбужденные атомы, когда n >> 1, называют ридберговскими. Для атомов всех элементов высоковозбужденные состояния водородоподобны. Причина в том, что при n >> 1 внешний электрон почти все время удален от иона на очень большие расстояния. Тем самым он движется в поле положительно заряженного атомного остатка (как в водородном атоме вокруг ядра). Отклонения от этой модели заметны только на близких расстояниях от центра. Энергии ридберговского атома весьма точно описываются формулой
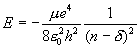 ,
,
где δ - это поправка Ридберга, иначе называемая квантовым дефектом, которая отражает факт отклонения поля от кулоновского. Главная особенность ридберговских состояний – универсальный для всех атомов характер, т.е. все подобные атомы по свойствам схожи. Время жизни этих состояний растет пропорционально n9/2 и может достигать миллисекундных значений и более в зависимости от того, насколько велико главное квантовое число n. Оказалось, газ возбужденных атомов конденсируется, конденсированное возбужденное состояние энергетически более выгодно по сравнению с газовым (как в металле, электрон не принадлежит отдельному атому). В 1990 г. К.Аман, Дж.Петтерсон и Л.Холмлид из Гётеборгского университета экспериментально наблюдали большие кластеры из возбужденных атомов цезия, масса которых достигала примерно 40 тысяч атомной массы цезия. Для теории здесь интересны два момента. Во-первых – поиски и разработка новых подходов к анализу возбужденного состояния, в котором возбуждений настолько много, что они не могут больше рассматриваться как независимые. Такие условия часто наблюдаются (возможно, в шаровой молнии). Во-вторых – собственно создание теории конденсированного возбужденного состояния вещества. Заложены только ее контуры, поле для работы лишь обозначено. Ридберговское вещество – это аккумулятор энергии возбуждений, и оно могло бы использоваться как рабочее тело для сверхмощных лазеров.
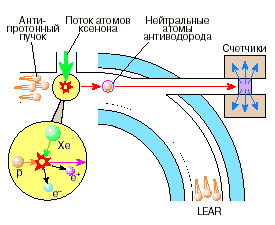 И, наконец, в сентябре 1996 года в Европейском центре ядерных исследований (ЦЕРН) получены первые атомы антиводорода, состоящего из антипротона и позитрона. Справа схема установки, на которой они получены. Для атомов антиводорода предполагается измерение частоты электронного перехода 1s - 2p (из основного состояния в первое возбужденное) методами лазерной спектроскопии высокого разрешения. (Частота этого перехода в водороде известна с точностью до 1.8·10–14 – не зря же водородный мазер считается стандартом частоты.) Согласно теории, они должны быть таким же, как и у обычного водорода. Если же, например спектр поглощения, окажется другим, то придется вносить коррективы в фундаментальные основы современной физики.
И, наконец, в сентябре 1996 года в Европейском центре ядерных исследований (ЦЕРН) получены первые атомы антиводорода, состоящего из антипротона и позитрона. Справа схема установки, на которой они получены. Для атомов антиводорода предполагается измерение частоты электронного перехода 1s - 2p (из основного состояния в первое возбужденное) методами лазерной спектроскопии высокого разрешения. (Частота этого перехода в водороде известна с точностью до 1.8·10–14 – не зря же водородный мазер считается стандартом частоты.) Согласно теории, они должны быть таким же, как и у обычного водорода. Если же, например спектр поглощения, окажется другим, то придется вносить коррективы в фундаментальные основы современной физики.
Подведем итоги:
· Квантовая теория прекрасно описывает экспериментальные результаты;
· энергия в атоме квантована и значение ее пропорционально 1/n2;
· n2 состояний имеют одну энергию;
· у атома нет четкой границы;
· в любом из состояний излучения нет, оно возникает только при переходах атома из одного состояния в другое;
· частоты в спектре излучения подчиняются простой закономерности;
· квантовая механика позволяет рассчитать вероятности переходов, т.е. определить интенсивности линий спектра;
· изучение водородоподобных систем актуально и в наше время.
Если возникли какие-либо вопросы, напишите мне.
– Конец работы –
Используемые теги: Строение, Свойства, атома, водорода, Конспект, Лекции, демонстрациями0.102
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Строение и свойства атома водорода. Конспект лекции с демонстрациями
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов