рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Наименование НТЗ: Теоретические и методические аспекты решения задач по химии Расположение НТЗ: T: estКяров А
Реферат Курсовая Конспект
Наименование НТЗ: Теоретические и методические аспекты решения задач по химии Расположение НТЗ: T: estКяров А
Наименование НТЗ: Теоретические и методические аспекты решения задач по химии Расположение НТЗ: T: estКяров А - раздел Химия, Уникальный Идентификатор Нтз: Id = 266133758 ...
Уникальный идентификатор НТЗ: ID = 266133758
Наименование НТЗ: Теоретические и методические аспекты решения задач по химии
Расположение НТЗ: T: estКяров А.Атеоретические и методические аспекты решения задач (3курс бак., химики и 1 курс химики спец.).ast
Авторский коллектив НТЗ: Кяров А.А.
Дата создания НТЗ: 01.11.2007
Дата конвертации НТЗ: 21.02.2008
СОДЕРЖАНИЕ И СТРУКТУРА ТЕСТОВЫХ МАТЕРИАЛОВ
Тематическая структура
Задание {{ 98 }} ТЗ № 1
Отметьте правильный ответ
Химия изучает…
£ химические свойства
£ химические реакции
R вещества, их строение, свойства и превращения
£ строение атома
Задание {{ 99 }} ТЗ № 2
Отметьте правильный ответ
Какое из следующих явлений химическое
£ плавление льда
£ испарение воды
R фотосинтез
£ возгонка йода
Задание {{ 100 }} ТЗ № 3
Отметьте правильный ответ
В каком случае речь идет о кислороде как простом веществе
R кислород входит в состав воздуха
£ кислород входит в состав воды
£ кислород входит в состав углекислого газа
£ кислород входит в состав глюкозы
Задание {{ 101 }} ТЗ № 4
Отметьте правильный ответ
Химический элемент характеризуется …
£ числом нейтронов
£ числом нуклонов
R зарядом ядра
£ массой атома
Задание {{ 102 }} ТЗ № 5
Отметьте правильный ответ
Какое из приведенных веществ является простым
Задание {{ 103 }} ТЗ № 6
Отметьте правильный ответ
Укажите основные законы химии
£ периодический закон, закон кратных отношений
£ закон Авогадро; закон постоянства состава
£ закон Гесса, закон Дальтона
R периодический закон, закон сохранения массы и энергии
Задание {{ 104 }} ТЗ № 7
Отметьте правильный ответ
Простейшая (эмпирическая формула) указывает …
£ число атомов в молекуле
R соотношение между числом атомов в веществе
£ порядок соединения атомов в молекуле
£ молекулярную массу вещества
Задание {{ 105 }} ТЗ № 8
Отметьте правильный ответ
Индивидуальным веществом является
£ чугун
R хлорид лития
£ соляная кислота
£ воздух
Задание {{ 106 }} ТЗ № 9
Отметьте правильный ответ
Элемент, который образует простое вещество, состоящее из трехатомных молекул, - это
£ азот
£ бром
R кислород
£ водород
Задание {{ 107 }} ТЗ № 10
Отметьте правильный ответ
Закон о равенстве числа молекул в равных объемах различных газов при одинаковых условиях открыл …
£ Гесс
R Авогадро
£ Гей-Люссак
£ Дальтон
Задание {{ 108 }} ТЗ № 11
Отметьте правильный ответ
Что означает число 1,00797 в первой клетке Периодической таблицы
£ Массу атома водорода (в атомных единицах массы)
£ Среднюю массу протона и электрона (в атомных единицах массы) с учетом их распространенности в земной коре
£ Массу протона (в атомных единицах массы)
R Среднюю массу изотопов водорода (в атомных единицах массы) с учетом их распространенности в земной коре
Задание {{ 109 }} ТЗ № 12
Отметьте правильный ответ
Относительная молекулярная масса …
£ имеет размерность "г"
£ имеет размерность "г/моль"
£ имеет размерность "а.е.м."
R безразмерная
Задание {{ 110 }} ТЗ № 13
Отметьте правильный ответ
Моль - это …
£ £ R единица, которой в химии измеряют количество вещества
£ число молекул, содержащихся в 22,4л газа (н.у.)
Задание {{ 111 }} ТЗ № 14
Отметьте правильный ответ
Укажите аллотропное видоизменение кислорода
£ кварц
£ серный цвет
R озон
£ корунд
Задание {{ 112 }} ТЗ № 15
Отметьте правильный ответ
Все индивидуальные неорганические вещества подразделяются на …
R простые и сложные
£ солеобразующие и несолеобразующие
£ ионные и ковалентные
£ твердые и жидкие
Задание {{ 113 }} ТЗ № 16
Отметьте правильный ответ
Число простых веществ в ряду озон, азот, этанол, бромоводород, сера, карбид кальция, графит равно
£ 1
£ 2
£ 3
R 4
Задание {{ 114 }} ТЗ № 17
Отметьте правильный ответ
Свойства веществ определяются
£ только качественным составом
R составом и строением молекул
£ только количественным составом
£ только строением
Задание {{ 115 }} ТЗ № 18
Отметьте правильный ответ
Массовая доля азота является наибольшей в нитриде
£ индия
£ галлия
R бора
£ алюминия
Задание {{ 116 }} ТЗ № 19
Отметьте правильный ответ
В равных массах каких двух веществ число атомов кислорода одинаково
Задание {{ 117 }} ТЗ № 20
Отметьте правильный ответ
Одинаковые массы каких двух газов при одинаковых условиях занимают равные объемы
Задание {{ 118 }} ТЗ № 21
Отметьте правильный ответ
Число атомов водорода одинаково в равных массах
Задание {{ 119 }} ТЗ № 22
Отметьте правильный ответ
Сколько молей составляют 5,6л азота (при н.у.)
£ 0,025
£ 0,04
R 0,25
£ 0,5
Задание {{ 120 }} ТЗ № 23
Отметьте правильный ответ
£ 100,8
£ 12,4
R 1,008
£ 0,56
Задание {{ 121 }} ТЗ № 24
Отметьте правильный ответ
Найти плотность газа в г/л, если 2,00л его имеют массу 2,86г
R 1,43
£ 0,715
£ 1,95
£ 2,38
Задание {{ 122 }} ТЗ № 25
Отметьте правильный ответ
Найти молекулярную массу газа, если его плотность по воздуху равна
£ 44
R 28
£ 72
£ 56
Задание {{ 123 }} ТЗ № 26
Отметьте правильный ответ
Найти молярную массу газа, 1л которого имеет массу 1,25г
R 28
£ 56
£ 44
£ 34
Задание {{ 124 }} ТЗ № 27
Отметьте правильный ответ
Какое количество вещества содержится в оксиде углерода (IV) массой 8,8г
£ 0,3
£ 0,1
R 0,2
£ 0,05
Задание {{ 125 }} ТЗ № 28
Отметьте правильный ответ
Сколько структурных единиц содержится в молекулярном кислороде массой 64г
£ 1,204 * 1023
£ 5,6 * 1022
R 12,04 * 1023
£ 1,505 * 1024
Задание {{ 126 }} ТЗ № 29
Отметьте правильный ответ
Найти среднюю молярную массу смеси, состоящей из 20% кислорода и 80% углекислого газа (по объему)
R 41,6
£ 32,8
£ 56,2
£ 44,8
Задание {{ 127 }} ТЗ № 30
Отметьте правильный ответ
Найти среднюю молекулярную массу смеси, состоящей из 50% гелия и 50% хлора (по объему)
£ 40,4
£ 30,5
R 37,5
£ 42,8
Задание {{ 128 }} ТЗ № 31
Отметьте правильный ответ
Сколько молей вещества составляют 30г дигидрофосфата натрия
£ 0,5
£ 0,35
R 0,25
£ 0,15
Задание {{ 129 }} ТЗ № 32
Отметьте правильный ответ
Какой из газов легче воздуха
£ фтор
£ оксид азота (II)
£ кислород
R аммиак
Задание {{ 130 }} ТЗ № 33
Отметьте правильный ответ
Рассчитайте массовую долю (%) кальция в карбонате кальция
£ 60
£ 50
R 40
£ 25
Задание {{ 131 }} ТЗ № 34
Отметьте правильный ответ
При образовании хлорида железа (III) железо и Cl2 реагируют в мольном отношении
£ 1:1
£ 1:2
£ 1:3
R 2:3
Задание {{ 132 }} ТЗ № 35
Отметьте правильный ответ
Простейшей формулой вещества, в котором массовые доли углерода и водорода равны соответственно 80 и 20%, является
£ СН
£ СН2
R СН3
£ СН4
Задание {{ 133 }} ТЗ № 36
Отметьте правильный ответ
Найдите формулу кислоты, содержащей 1,25% водорода, 38,75% фосфора и 60,00% кислорода. В ответе укажите число атомов водорода в молекуле
R 1
£ 3
£ 2
£ 4
Задание {{ 134 }} ТЗ № 37
Отметьте правильный ответ
Вычислите массовую долю (%) кристаллизационной воды в пентагидрате сульфата меди (II)
R 36
£ 64
£ 44
£ 56
Задание {{ 135 }} ТЗ № 38
Отметьте правильный ответ
Определите простейшую формулу соединения, содержащего 33,33% натрия, 20,29% азота, 46,38% кислорода. В ответе укажите общее число атомов в соединении
R 4
£ 3
£ 5
£ 6
Задание {{ 136 }} ТЗ № 39
Отметьте правильный ответ
Определите молярную массу неизвестного газа, если его плотность по фтору равна 1,16
£ 22
R 44
£ 56
£ 28
Задание {{ 137 }} ТЗ № 40
Отметьте правильный ответ
Установите формулу кристаллогидрата сульфата железа (II), если известно, что эта соль содержит 45,32% воды по массе. В ответе укажите количество кристаллизационной воды
£ 3
£ 6
R 7
£ 10
Задание {{ 138 }} ТЗ № 41
Отметьте правильный ответ
Определите формулу химического соединения, если массовые доли (%) составляющих его элементов равны: водорода - 1,59%; азота - 22,22%; кислорода - 76,19%. В ответе укажите его молярную массу
R 63
£ 47
£ 85
£ 69
Задание {{ 139 }} ТЗ № 42
Отметьте правильный ответ
Найдите молярную массу кристаллогидрата, имеющего следующий состав (%): натрия - 14,92; серы - 9,94; кислорода - 19,87; воды - 55,90
£ 142
£ 180
R 322
£ 216
Задание {{ 140 }} ТЗ № 43
Отметьте правильный ответ
При сжигании 0,90г газообразного органического вещества получено 1,32г оксида углерода (IV) и 0,54г воды. Рассчитать молярную массу органического вещества
R 27
£ 35
£ 54
£ 62
Задание {{ 141 }} ТЗ № 44
Отметьте правильный ответ
При сжигании 5,4г неизвестного вещества образовалось 2,8г азота, 8,8г углекислого газа и 1,8г воды. Найти молярную массу вещества по простейшей формуле
R 27
£ 35
£ 54
£ 62
Задание {{ 142 }} ТЗ № 45
Отметьте правильный ответ
Вещество состоит из углерода, водорода и хлора. При сжигании 9,56г вещества образуется 3,52г углекислого газа и 0,72г воды. Найти его молярную массу
R 119,5
£ 85
£ 50,5
£ 154
Задание {{ 143 }} ТЗ № 46
Отметьте правильный ответ
Вещество состоит из углерода, водорода и кислорода в массовом отношении 6:1:8. Плотность его по водороду равна 30. Определите молярную формулу вещества
£ СН2О
R С2Н4О2
£ С3Н6О6
£ С2Н6О
Задание {{ 144 }} ТЗ № 47
Отметьте правильный ответ
При восстановлении водородом оксида железа было получено 0,84г железа и 0,36г воды. Вывести формулу этого оксида. В ответе укажите его молярную массу
R 232
£ 72
£ 160
£ 172
Задание {{ 145 }} ТЗ № 48
Отметьте правильный ответ
Определите плотность по водороду газовой смеси, имеющей следующий объемный состав (%): оксида углерода (IV) - 20; оксида углерода (II) - 50 и азота - 30
R 15,6
£ 1,56
£ 22
£ 28
Задание {{ 146 }} ТЗ № 49
Отметьте правильный ответ
Найти молекулярную массу кристаллогидрата хлорида кальция, зная, что 7,3г его при нагревании теряют 3,6г воды
R 219
£ 165
£ 237
£ 147
Задание {{ 147 }} ТЗ № 50
Отметьте правильный ответ
Сколько молекул воды входит в состав одного из кристаллогидратов сульфата натрия, если при его обезвоживании потеря массы составляет 47% от массы кристаллогидрата
£ 1
R 7
£ 5
£ 6
Задание {{ 148 }} ТЗ № 51
Отметьте правильный ответ
Определите молекулярную формулу вещества, если при сгорании 4,6г его образуется 0,2 моля углекислого газа и 0,3 моля воды. Известно так же, что в молекуле вещества 2 атома углерода
R С2Н6О
£ С2Н4О2
£ С2Н6
£ С2Н4
Задание {{ 149 }} ТЗ № 52
Отметьте правильный ответ
Определить плотность по гелию газовой смеси, состоящей из 20% кислорода и 80% азота (по объёму)
R 7,2
£ 3,6
£ 5,6
£ 14,1
Задание {{ 150 }} ТЗ № 53
Отметьте правильный ответ
При нагревании 12,25г некоторого вещества выделилось 3,36л кислорода (н.у.) и образовалось 7,45г хлорида калия. Определите молекулярную массу этого вещества
R 122,5
£ 138,5
£ 74,5
£ 149
Задание {{ 151 }} ТЗ № 54
Отметьте правильный ответ
Сколько граммов кислорода содержится в 0,3 молях железного купороса
R 52,8
£ 23,6
£ 60,4
£ 35,6
Задание {{ 152 }} ТЗ № 55
Отметьте правильный ответ
Сколько граммов хлора содержится в 49г бертолетовой соли
R 14,2
£ 28,4
£ 3,55
£ 21,3
Задание {{ 153 }} ТЗ № 56
Отметьте правильный ответ
Вычислите объемную долю (%) оксида углерода (IV) в газовой смеси, содержащей угарный и углекислый газы, если плотность её по водороду равна 18,8
R 60
£ 40
£ 45
£ 55
Задание {{ 154 }} ТЗ № 57
Отметьте правильный ответ
Плотность газа по воздуху равна 2. Какова масса 5,6л (н.у.) этого газа
£ 29
R 14,5
£ 10,4
£ 15,6
Задание {{ 155 }} ТЗ № 58
Отметьте правильный ответ
Масса 12л газовой смеси (н.у.), состоящей из аммиака и оксида углерода (IV), равна 18г. Определите объемную долю (%) аммиака в смеси с точностью до десятых
£ 61,5
R 38,5
£ 40,5
£ 55,5
Задание {{ 156 }} ТЗ № 59
Отметьте правильный ответ
При разложении 24,5г соединения выделился кислород, занимающий при н.у. 6,72л. Полученное после разложения соединение содержит 52,35% К и 47,65% Cl. Определите простейшую формулу соединения. В ответе укажите число атомов в его молекуле
£ 2
R 5
£ 3
£ 6
Задание {{ 157 }} ТЗ № 60
Отметьте правильный ответ
Масса 1л смеси оксида углерода (II) и бутилена при н.у. равна 2г. Вычислите объемную долю (%) бутилена в смеси
£ 40
R 60
£ 30
£ 70
Строение атома, периодическая система, химическая связь
Задание {{ 158 }} ТЗ № 1
Отметьте правильный ответ
Электронную формулу атома 1S22S22P63S23P63d64S2 имеет химический элемент
£ марганец
R железо
£ кобальт
£ азот
Задание {{ 159 }} ТЗ № 2
Отметьте правильный ответ
Электронная формула внешнего энергетического уровня атома элемента, имеющего формулы газообразного водородного соединения RН3 и высшего оксида R2O5 (n – номер внешнего энергетического уровня)
£ nS2np5
R nS2nP3
£ nS2nP1
£ nS2nP2
Задание {{ 160 }} ТЗ № 3
Отметьте правильный ответ
Электронная формула атома 1S22S22P3. Формулы водородного соединения и высшего оксида этого элемента
£ H2S и SO3
R NH3 и N2O5
£ PH3 и P2O5
£ Общей формуле ЭО3 соответствует высший оксид элемента, атом которого имеет строение внешнего электронного слоя
£ 3S23P1
£ 4S24P6
R 5S25P4
£ 2S22P3
Задание {{ 162 }} ТЗ № 5
Отметьте правильный ответ
Атомный номер элемента показывает
£ число элементарных частиц в атоме
£ число нуклонов в атоме
£ число нейтронов в атоме
R число протонов в атоме
Задание {{ 163 }} ТЗ № 6
Отметьте правильный ответ
Электронная формула внешнего энергетического слоя атома наиболее активного металла
£ 2S1
R 3S1
£ 3S2
£ 3S23P1
Задание {{ 164 }} ТЗ № 7
Отметьте правильный ответ
Атомы состоят из …
£ протонов и нейтронов
£ молекул
R атомных ядер и электронов
£ нуклонов
Задание {{ 165 }} ТЗ № 8
Отметьте правильный ответ
Заряд атома равен …
R нулю
£ порядковому номеру элемента
£ числу электронов
£ общему числу протонов и нейтронов
Задание {{ 166 }} ТЗ № 9
Отметьте правильный ответ
Чем различаются атомы двух изотопов одного и того же элемента
R числом нейтронов
£ числом электронов
£ зарядом ядра
£ ничем
Задание {{ 167 }} ТЗ № 10
Отметьте правильный ответ
Распределение электронов по орбиталям в основном состоянии атома определяется …
£ принципом запрета Паули
£ правилом Хунда
£ принципом наименьшей энергии
R всеми перечисленными выше признаками
Задание {{ 168 }} ТЗ № 11
Отметьте правильный ответ
Большинство неметаллов относится к электронному семейству
£ S - элементов
R P - элементов
£ d - элементов
£ f - элементов
Задание {{ 169 }} ТЗ № 12
Отметьте правильный ответ
Наибольший радиус имеет атом элемента
£ кальция
£ стронция
£ бария
R радия
Задание {{ 170 }} ТЗ № 13
Отметьте правильный ответ
Какой тип связи в молекуле Н2
£ водородная
R ковалентная неполярная
£ донорно-акцепторная
£ Ван-дер-ваальсовая
Задание {{ 171 }} ТЗ № 14
Отметьте правильный ответ
Орбитали S-S и S-P перекрываются только в молекулах соответственно
R Н2 и HCl
£ O2 и CH4
£ S8 и CO2
£ Химическая связь в РН3 и CaCl2 соответственно
£ ионная и ковалентная полярная
R ковалентная полярная и ионная
£ ковалентная полярная и металлическая
£ ковалентная неполярная и ионная
Задание {{ 173 }} ТЗ № 16
Отметьте правильный ответ
Химическая связь в хлориде натрия, азота и метане соответственно
£ ковалентная неполярная, ионная и ковалентная полярная
R ионная, ковалентная неполярная и ковалентная полярная
£ ковалентная полярная, ионная и ковалентная неполярная
£ ионная, ковалентная полярная и ковалентная неполярная
Задание {{ 174 }} ТЗ № 17
Отметьте правильный ответ
Вещество, между молекулами которого существует водородная связь, - это
£ этан
£ оксид углерода (II)
£ фторид натрия
R этанол
Задание {{ 175 }} ТЗ № 18
Отметьте правильный ответ
Сколько химических связей (и каких) может образовать атом углерода, находящийся в невозбужденном состоянии
£ четыре ковалентные связи, т.к. валентность углерода всегда равна IV
£ две (за счёт двух неспаренных электронов)
R три (две по обменному механизму за счёт неспаренных электронов и одному донорно-акцепторному за счёт неподеленной пары электронов)
£ ни одной, т.к. атом углерода в невозбужденном состоянии химических связей не образует
Задание {{ 176 }} ТЗ № 19
Отметьте правильный ответ
В какой частице есть связи, образованные по донорно-акцепторному механизму
£ O2
£ N2
R H3O+
£ H2O2
Задание {{ 177 }} ТЗ № 20
Отметьте правильный ответ
Главное квантовое число характеризует …
£ молекулярную орбиталь
£ ориентацию орбитали в пространстве
£ число электронов в атоме
R общую энергию электрона
Задание {{ 178 }} ТЗ № 21
Отметьте правильный ответ
Укажите, в каком из случаев орбитали перечислены в порядке увеличения их энергии
£ 2S, 2P, 2d
R 3S, 3P, 3d
£ 4f, 5S, 6d
£ 3P, 3d, 3f
Задание {{ 179 }} ТЗ № 22
Отметьте правильный ответ
Сколько электронов находится на 2Р-подуровне в основном состоянии атома азота
£ 5
R 3
£ 7
£ 1
Задание {{ 180 }} ТЗ № 23
Отметьте правильный ответ
Какой из атомов в основном состоянии содержит два неспаренных электрона на внешнем уровне
R кислород
£ гелий
£ азот
£ магний
Задание {{ 181 }} ТЗ № 24
Отметьте правильный ответ
Какую из перечисленных электронных конфигураций может иметь атом хлора
£ 1S22S22P5
R 1S22S22P63S23P43d1
£ 1S22S22P63S23P6
£ 1S22S22P63S23P54S1
Задание {{ 182 }} ТЗ № 25
Отметьте правильный ответ
В атоме элемента находиться четыре электронных слоя. На последнем энергетическом уровне - два электрона, на предпоследнем - 18. Написать электронную формулу элемента. В ответе указать порядковый номер элемента
£ 28
R 30
£ 32
£ 36
Задание {{ 183 }} ТЗ № 26
Отметьте правильный ответ
Какая из электронных конфигурации валентных электронов описывает элемент, проявляющий в соединениях максимальную степень окисления +7
£ 2S22P5
£ 3S22d5
R 4S23d5
£ 4S23d7
Задание {{ 184 }} ТЗ № 27
Отметьте правильный ответ
Расположите номера следующих соединений в порядке возрастания полярности химической связи элементов с кислородом:
SnO; 2) B2O3; 3) NO; 4) H2O
R 3421
£ 1243
£ 2341
£ 3412
Задание {{ 185 }} ТЗ № 28
Отметьте правильный ответ
Расположите номера следующих соединений в порядке возрастания степени окисления атома хлора.
1) SOCl2; 2) HClO; 3) KClO4; 4) Cl2; 5) KClO3
R 14253
£ 12435
£ 42315
£ 21435
Задание {{ 186 }} ТЗ № 29
Отметьте правильный ответ
Расположите номера следующих соединений в порядке возрастания степени окисления атома азота. 1) NH4Cl; 2) N2H5Cl; 3) NaNO3; 4) N2O4; 5) KNO2
£ 13452
R 12543
£ 23145
£ 12453
Задание {{ 187 }} ТЗ № 30
Отметьте правильный ответ
Укажите вещества, молекулы которых связаны водородной связью. В ответе запишите номера выбранных соединений в возрастающем порядке
1) уксусный альдегид (ж); 2) бензол; 3) метанол (ж); 4) H2O; 5) этан; 6) этанол; 7) уксусная кислота; 8) ацетон
R 3467
£ 3568
£ 1478
£ 4567
Задание {{ 188 }} ТЗ № 31
Отметьте правильный ответ
Укажите вещества, молекулы которых связаны водородной связью. В ответе запишите номера выбранных соединений в возрастающем порядке.
1) HF (ж); 2) формальдегид; 3) аммиак (ж); 4) муравьиная кислота; 5) метан;
6) диэтиловый эфир; 7) вода
R 1347
£ 2345
£ 2367
£ 3457
Задание {{ 189 }} ТЗ № 32
Отметьте правильный ответ
В каких из перечисленных соединений связь ковалентная полярная?
1) Cl2; 2) H2S; 3) KF; 4) NH3; 5) P4; 6) HBr (газ.). В ответе запишите номера соединений в возрастающем порядке
£ 234
R 246
£ 1234
£ 2346
Задание {{ 190 }} ТЗ № 33
Отметьте правильный ответ
Укажите (в порядке возрастания) номера ковалентных сульфидов.
1) K2S; 2) BaS; 3) CS2; 4) Li2S; 5) H2S; 6) Rb2S
£ 1245
£ 234
R 35
£ 345
Задание {{ 191 }} ТЗ № 34
Отметьте правильный ответ
Указать характер химической связи в соединениях:
HCl (г); KI (кр.); NaF (кр.); F2 (г)
1) металлическая;
2) ковалентная неполярная;
3) ковалентная полярная;
4) ионная.
(В ответе записать цифры в таком порядке, в каком соединения записаны в задании).
R 3442
£ 1234
£ 2413
£ 3411
Задание {{ 192 }} ТЗ № 35
Отметьте правильный ответ
Сколько веществ с атомной кристаллической решеткой приведено в скобках? (Белый фосфор, красный фосфор, медь, парафин, алмаз, иод, кварц, лёд)
£ одно
£ два
R три
£ четыре
Задание {{ 193 }} ТЗ № 36
Отметьте правильный ответ
В каких соединениях имеет место SP2 – гибридизация:
1) C6H6; 2) C2H5OH; 3) HCOOH; 4) CH3Cl.
Указать номер или сумму номеров правильного ответа
R 4
£ 3
£ 7
£ 5
Задание {{ 194 }} ТЗ № 37
Отметьте правильный ответ
В каких соединениях имеет место SP3 – гибридизация:
1) CCl4; 2) C2H6; 3) C2H2; 4) C2H4; 5) C3H8.
(Указать номер или сумму номеров правильного ответа)
R 8
£ 5
£ 7
£ 9
Задание {{ 195 }} ТЗ № 38
Отметьте правильный ответ
Какую кристаллическую решетку имеют вещества: алмаз, хлорид калия, железо, диоксид углерода? 1) атомную; 2) металлическую; 3) молекулярную; 4) ионную. (В ответе указать число, составленное из цифр, соответствующих типу решетки в таком порядке, в каком соединения записаны в задании.)
R 1423
£ 2314
£ 2213
£ 4213
Задание {{ 196 }} ТЗ № 39
Отметьте правильный ответ
Какой тип кристаллической решетки характерен для соединений S - металлов с Р - элементами, имеющими большую электроотрицательность
£ металлическая
R ионная
£ атомная
£ молекулярная
Задание {{ 197 }} ТЗ № 40
Отметьте правильный ответ
Число орбиталей на третьем энергетическом уровне равно …
£ 4
£ 5
R 9
£ 8
Задание {{ 198 }} ТЗ № 41
Отметьте правильный ответ
Угол между SP2 – гибридизованными орбиталями составляет
(в градусах) …
R 120
£ 109
£ 180
£ 90
Задание {{ 199 }} ТЗ № 42
Отметьте правильный ответ
Наиболее полярными являются связи в молекуле
R HCl
£ AsH3
£ PH3
£ H2S
Задание {{ 200 }} ТЗ № 43
Отметьте правильный ответ
Написать электронную формулу атома химического элемента, заряд ядра которого равен 28. Сколько электронов в атоме этого элемента находится на последнем уровне
£ 10
R 16
£ 8
£ 18
Задание {{ 201 }} ТЗ № 44
Отметьте правильный ответ
Внешний электронный слой атома химического элемента описывается формулой 4S24P4. Написать формулу оксида, в котором элемент проявляет высшую степень окисления. (В ответе указать общее количество атомов в молекуле оксида)
R 4
£ 3
£ 6
£ 5
Задание {{ 202 }} ТЗ № 45
Отметьте правильный ответ
У атомов каких элементов внешний электронный слой имеет конфигурацию: a) 2S22P1; б) 4S24P5? Какова формула соединения, образуемого атомами этих элементов друг с другом?
(В ответе указать общее количество атомов в молекуле)
£ 6
R 4
£ 5
£ 3
Задание {{ 203 }} ТЗ № 46
Отметьте правильный ответ
Написать электронные формулы атома магния и иона Mg2+. Нейтральный атом какого элемента содержит такое же количество электронов, что и ион Mg2+? (В ответе указать число протонов в ядре атома этого элемента)
R 10
£ 14
£ 8
£ 12
Задание {{ 204 }} ТЗ № 47
Отметьте правильный ответ
Написать электронную формулу атома натрия и иона Na+. Электронные формулы каких частиц будут совпадать с электронной формулой иона Na+:
1)атома магния; 2) иона Mg2+; 3) атома неона; 4) атома фтора; 5) фторид-иона F-. (Указать номер или сумму номеров правильного ответа.)
£ 8
R 10
£ 9
£ 11
Задание {{ 205 }} ТЗ № 48
Отметьте правильный ответ
В атоме элемента находится четыре электронных слоя. На последнем энергетическом уровне - два электрона, на предпоследнем - 18. Написать электронную формулу элемента. (В ответе указать порядковый номер элемента)
R 30
£ 28
£ 32
£ 34
Задание {{ 206 }} ТЗ № 49
Отметьте правильный ответ
Написать электронные формулы лития и иона Li+. Нейтральный атом какого элемента имеет такую же электронную формулу, что и ион Li+?
(В ответе указать число протонов в ядре атома этого элемента)
R 2
£ 4
£ 3
£ 1
Задание {{ 207 }} ТЗ № 50
Отметьте правильный ответ
Написать электронные формулы атома хлора и иона Cl-. Нейтральный атом какого элемента имеет такую же электронную формулу, что и ион Cl-?
(В ответе указать число протонов в ядре атома этого элемента)
£ 19
R 18
£ 16
£ 21
Задание {{ 208 }} ТЗ № 51
Отметьте правильный ответ
Какого типа связь возникает между элементами, заряд ядер которых +3 и +9, при образовании соединения между ними
R ионная
£ ковалентная полярная
£ ковалентная неполярная
£ металлическая
Задание {{ 209 }} ТЗ № 52
Отметьте правильный ответ
Какого типа связь возникает между элементами, заряды ядра которых +8 и +16, при образовании соединения между ними
£ ионная
R ковалентная полярная
£ ковалентная неполярная
£ донорно-акцепторная
Задание {{ 210 }} ТЗ № 53
Отметьте правильный ответ
В каких парах молекул в образовании связей участвует одна электронная пара
£ N2 и H2
R Cl2 и H2
£ O2 и N2
£ Cl2 и N2
Задание {{ 211 }} ТЗ № 54
Отметьте правильный ответ
Какая из приведенных частиц образовалась по донорно-акцепторному механизму
£ F2
£ HF
R BF4-
£ BF3
Задание {{ 212 }} ТЗ № 55
Отметьте правильный ответ
В каком из предложенных рядов элементов сродство к электрону возрастает (слева направо). Ответ обосновать
Задание {{ 213 }} ТЗ № 56
Отметьте правильный ответ
Чему равны массовые доли (%) изотопов 20Ne и 22Ne в природном газе, имеющем среднюю относительную атомную массу 20,2? В ответе укажите массовую долю (%) 20Ne
R 90
£ 10
£ 70
£ 50
Задание {{ 214 }} ТЗ № 57
Отметьте правильный ответ
Химический элемент состоит из двух изотопов. Ядро первого изотопа содержит 10 протонов. В ядре второго изотопа нейтронов на два больше. На 9 атомов более легкого изотопа приходится 1 атом тяжелого изотопа. Вычислите среднюю относительную атомную массу элемента
R 20,2
£ 35,5
£ 63,5
£ 65,4
Задание {{ 215 }} ТЗ № 58
Отметьте правильный ответ
Относительная молекулярная масса оксида некоторого металла в 1,40 раза меньше относительной молекулярной массы его сульфида. Какой это металл? (В ответе укажите число протонов в ядре атома этого металла)
£ 11
R 12
£ 13
£ 19
Задание {{ 216 }} ТЗ № 59
Отметьте правильный ответ
При сжигании 10,0г металла было получено 18,9г оксида, при этом металл окислился до степени окисления (+3). Что это за металл? (В ответе укажите молярную массу металла)
£ 56
R 27
£ 24
£ 65
Задание {{ 217 }} ТЗ № 60
Отметьте правильный ответ
Для реакции с 9,58г металла, высший оксид которого имеет состав MeO2, потребовалось 8,96л хлора (н.у.). Какой это металл
£ Pb
R Ti
£ Zr
£ Sn
Задание {{ 218 }} ТЗ № 61
Отметьте правильный ответ
Плотность по воздуху паров хлорида и бромида одного и того же элемента равно соответственно 5,31 и 11,45. Что это за элемент
R C
£ Si
£ S
£ Se
Задание {{ 219 }} ТЗ № 62
Отметьте правильный ответ
Соотношение молекулярных масс высших хлорида и оксида элемента, расположенного в IV группе периодической системы, составляет 17:6. (В ответе укажите число протонов в ядре атома этого элемента)
£ 22
R 14
£ 12
£ 32
Задание {{ 220 }} ТЗ № 63
Отметьте правильный ответ
Из 3,42г гидроксида элемента, находящегося во II группе периодической системы, получено 5,94г его бромида. Определите формулу гидроксида
R Ba(OH)2
£ Mg(OH)2
£ Ca(OH)2
£ Sr(OH)2
Задание {{ 221 }} ТЗ № 64
Отметьте правильный ответ
При нагревании 4,80г оксида некоторого металла в токе водорода образовалось 1,62г воды. При нагревании этого металла в токе хлора образуется трихлорид. Какой оксид был восстановлен? (В ответе укажите молярную массу металла)
R 56
£ 27
£ 70
£ 119
Задание {{ 222 }} ТЗ № 65
Установите соответствие между формулой частицы и общим числом электронов, содержащихся в ней
| Al3+ | |
| Mg0 | |
| P-3 | |
| K0 | |
Задание {{ 223 }} ТЗ № 66
Установите соответствие между химической формулой соединения и значением степени окисления азота в нем
| +5 | HNO3 |
| -3 | (NH4)2CO3 |
| +4 | N2O4 |
| +3 | KNO2 |
| +2 |
Задание {{ 224 }} ТЗ № 67
Установите соответствие между названием соединения и типом гибридизации атомных орбиталей углерода в нем
| бензол | SP2 |
| этилен | SP2 |
| метанол | SP3 |
| ацетилен | SP |
Задание {{ 225 }} ТЗ № 68
Установите соответствие между формулой соединения и типом химической связи в нем
| ковалентная полярная | HCl |
| ионная | KI |
| ионная | NaF |
| ковалентная не полярная | F2 |
| донорно-акцепторная | |
| металлическая |
Задание {{ 226 }} ТЗ № 69
Установите соответствие между элементом и электронной конфигурацией атомов
| Не | 1S2 |
| N | 1S22S22P3 |
| В | 1S22S22P1 |
| C | 1S22S22P2 |
| 1S22S2 |
Задание {{ 227 }} ТЗ № 70
Установите соответствие между видом связи в веществе и формулой химического соединения
| ионная | BaF2 |
| металлическая | Ba |
| ковалентная полярная | HF |
| ковалентная неполярная | H2 |
Задание {{ 228 }} ТЗ № 71
Отметьте правильный ответ
Закономерность изменения радиуса атома химического элемента в зависимости от его порядкового номера в Периодической системе химических элементов Д.И.Менделеев отражена на графике
Задание {{ 229 }} ТЗ № 72
Отметьте правильный ответ
Зависимость относительной электроотрицательности химического элемента от его порядкового номера представлена на графике
Задание {{ 230 }} ТЗ № 73
Отметьте правильный ответ
Изменение электроотрицательности атомов одного периода с увеличением порядкового номера элемента изображено на графике
Задание {{ 231 }} ТЗ № 74
Отметьте правильный ответ
Изменение электроотрицательности атомов элементов одной группы с увеличением их порядковых номеров изображено на графике
Задание {{ 232 }} ТЗ № 75
Отметьте правильный ответ
Элемент, имеющий конфигурацию1S22S22P63S23P63d104S2 образует оксид и гидроксид, имеющие свойства
£ оксид - амфотерные, гидроксид - основные
R оба амфотерные
£ оксид - основные, гидроксид - амфотерные
£ оба основные
Задание {{ 233 }} ТЗ № 76
Отметьте правильный ответ
Элементы с электронной конфигурацией валентных электронов 4S2 и 2S22P3 образуют химическую связь
£ металлическую
£ ковалентную неполярную
£ ковалентную полярную
R ионную
Задание {{ 234 }} ТЗ № 77
Дополните
Ядра изотопов одного и того же химического элемента отличаются числом
Правильные варианты ответа: НЕЙТРОНОВ; нейтронов;
Задание {{ 235 }} ТЗ № 78
Дополните
Донорно-акцепторный механизм образования ковалентной связи заключается в том, что один атом, имеющий название........, представляет на образование связи орбиталь с двумя электронами, другой же атом - свободную орбиталь
Правильные варианты ответа: ДОНОР; донор; донора; ДОНОРА;
Задание {{ 236 }} ТЗ № 79
Дополните
............. гидроксидам соответствуют два вида солей, в которых один и тот же элемент входит в состав либо катионов, либо анионов
Правильные варианты ответа: амфотерным; Амфотерным; АМФОТЕРНЫМ;
Задание {{ 237 }} ТЗ № 80
Дополните
В главных подгруппах Периодической системы химических элементов Д.И. Менделеева с возрастанием порядковых номеров прочность водородных соединений, образованных неметаллами ......
Правильные варианты ответа: Уменьшается; уменьшается; УМЕНЬШАЕТСЯ;
Задание {{ 238 }} ТЗ № 81
Дополните
Вещество имеет высокие температуры плавления и кипения. Раствор данного вещества в воде проводит электрический ток. Это вещество имеет............кристаллическую решетку
Правильные варианты ответа: Ионную; ионную; ИОННУЮ;
Задание {{ 239 }} ТЗ № 82
Отметьте правильный ответ
Число водородных связей, которое может образовать каждая молекула глицерина, равно
£ 3
£ 1
R 2
£ 0
Задание {{ 240 }} ТЗ № 83
Отметьте правильный ответ
Понятие "молекула" не применимо по отношению к структурной единице вещества
£ хлороформа
£ кислорода
R алмаза
£ озона
Задание {{ 241 }} ТЗ № 84
Отметьте правильный ответ
Энергия связи между атомами углерода в ряду одинарная - двойная - тройная
£ уменьшается
R увеличивается
£ не изменяется
£ увеличивается, а затем уменьшается
Задание {{ 242 }} ТЗ № 85
Отметьте правильный ответ
Длина связи Э - Н у элементов V группы А подгруппы периодической системы соответственно
£ уменьшается и уменьшается
£ увеличивается и увеличивается
R увеличивается и уменьшается
£ уменьшается и увеличивается
Задание {{ 243 }} ТЗ № 86
Отметьте правильный ответ
Соединения, образованные только ковалентной полярной связью, перечислены в ряду
£
C2H6, CH3COONa, KNO3, CH3OH
R
CH4, H2O, HNO3, C2H2
£
NH3, SCl2, SiO2, Na2SiO3
£
H2SO4, Al4C3, Al2O3, Al(OH)3
Задание {{ 244 }} ТЗ № 87
Отметьте правильный ответ
При комнатной температуре вещество газообразное, плохо растворимое в воде, не электропроводное. Его кристаллическая решетка
£ атомная
R молекулярное
£ ионная
£ металлическая
Задание {{ 245 }} ТЗ № 88
Отметьте правильный ответ
В каком из перечисленных ниже соединений присутствуют связи, образованные по донорно-акцепторному механизму
£ CCl4
R NH4NO3
£ Al(OH)3
£ AgCl
Задание {{ 246 }} ТЗ № 89
Отметьте правильный ответ
Число электронов, которые участвуют в образовании химических связей в молекуле аммиака
£ 8
R 6
£ 10
£ 2
Задание {{ 247 }} ТЗ № 90
Отметьте правильный ответ
Заполнение d- подуровня начинается у элементов следующего периода. Ответ укажите обычной арабской цифрой
£ 4
£ 3
£ 5
R 6
Задание {{ 248 }} ТЗ № 91
Отметьте правильный ответ
Орбитальное квантовое число у 3Р- электрона равно
R 24
£ 35
£ 25
£ 36
Задание {{ 249 }} ТЗ № 92
Отметьте правильный ответ
Порядковый номер самого электроотрицательного элемента IV периода
£ 24
R 35
£ 25
£ 36
Задание {{ 250 }} ТЗ № 93
Отметьте правильный ответ
Кристалл поваренной соли состоит из…
£ молекул NaCl
£ молекул Na и Cl2
1) R ионов Na +и Cl-
£ атомов натрия и хлора, соединенных полярными ковалентными связями
Задание {{ 251 }} ТЗ № 94
Отметьте правильный ответ
Количество энергетических уровней, занятых электронами у иона К+ равно
£ 4
£ 2
R 3
£ 1
Задание {{ 252 }} ТЗ № 95
Отметьте правильный ответ
Ион некоторого элемента с зарядом "2-" имеет такую же электронную конфигурацию, как инертный газ аргон. Определите заряд ядра этого элемента. В ответе приведите только число, без знака "+"
£ 17
R 16
£ 18
£ 15
Задание {{ 253 }} ТЗ № 96
Отметьте правильный ответ
Количество электронов, которое должен принять атом 15-го элемента Периодической системы, чтобы приобрести устойчивую электронную конфигурацию инертного газа, равно
£ 5
R 3
£ 2
£ 4
Задание {{ 254 }} ТЗ № 97
Отметьте правильный ответ
Формула высшей кислородосодержащей кислоты, образованной некоторым элементом, -НЭО4. Конфигурация валентных электронов этого элемента в основном состоянии следующая
£
2S22P5
£
3S23P5
£
4S24d5
R
4d7
Задание {{ 255 }} ТЗ № 98
Отметьте правильный ответ
Формула высшего оксида некоторого элемента – Э2О7.Конфигурация валентных электронов этого элемента в основном состоянии следующая
£
3d7
£
2S22P5
R
3S23P5
£
4S24 d 5
Задание {{ 256 }} ТЗ № 99
Отметьте правильный ответ
Выберите атом в котором больше всего электронов
£
1Н
£
40Ar
£
41Ar
R
39K
Задание {{ 257 }} ТЗ № 100
Отметьте правильный ответ
Формула высшей кислородосодержащей кислоты, образованной некоторым элементом, - Н2ЭО4. Конфигурация валентных электронов этого элемента в основном состоянии следующая
£
2S22P4
R
3S23P4
£
4S24d 4
£
4f 6
Химическая кинетика и химическое равновесие, основы термодинамики
Задание {{ 1 }} ТЗ № 1
Отметьте правильный ответ
Закон, выражающий зависимость скорости реакции от концентрации реагирующих веществ:
£ закон кратных отношений
£ закон Вант-Гоффа
R закон действующих масс
£ закон постоянства состава
Задание {{ 2 }} ТЗ № 2
Отметьте правильный ответ
как влияет повышение температуры на скорость экзотермических реакций:
£ повышает
R понижает
£ на влияет
Задание {{ 3 }} ТЗ № 3
Отметьте правильный ответ
Раздел химии, изучающий скорость и механизм химических реапкций, называется ...
£ химическая термодинамика
£ термохимия
R химическая кинетика
£ калориметрия
Задание {{ 4 }} ТЗ № 4
Отметьте правильный ответ
Скорость химической реакции это - ...
£ время, за которое полностью расходуется одно из исходных веществ
£ время, за которое заканчивается реакция
R изменение количества реагентов (или продуктов реакции) в единицу времени в единице объема
£ количество вещества продуктов реакции к моменту окнчания реакции
Задание {{ 5 }} ТЗ № 5
Отметьте правильный ответ
Укажите гомогенную систему:
£ CaCO3 ¬® CaO + CO2
£ CO2 +C ® 2CO
R 2CO + O2 ® 2 CO2
£ C + O2 ® CO2
Задание {{ 6 }} ТЗ № 6
Отметьте правильный ответ
Укажите правильное выражение скорости для системы
2Al + 3Cl2 ® 2AlCl3
£ v = k [Al]2[Cl2]3
£ v = k [3Cl2]
£ v = k [2Al] [3Cl2]
R v = k [Cl2]3
Задание {{ 7 }} ТЗ № 7
Отметьте правильный ответ
Химичесчкме реакции, протекающие в противоположных напрвлениях, называются ...
£ кинетическими
£ термохимическими
R обратимыми
£ каталитическими
Задание {{ 8 }} ТЗ № 8
Отметьте правильный ответ
Химическое равновесие - это состояние обратимой реакции, при котором ...
£ константы скоростей прямой и обратной рекции равны
£ концентрации реагентов и продуктов реакции равны
R скорости прямой и обратной реакции равны
£ скорости обратимой реакции равны нулю
Задание {{ 9 }} ТЗ № 9
Отметьте правильный ответ
Катализатор - это вещество, которое ...
£ увеличивает число столкновений молекул реагентов в единицу времени
£ увеличивает скорости движения молекул реагентов
R уменьшает энергию активации реакции
£ увеличивает теповой эффект реакции
Задание {{ 10 }} ТЗ № 10
Отметьте правильный ответ
В любом процессе соблюдается закон сохранения энергии; ему отвечает равенство
R Q = DH + A
£ A = Q + DU
£ DU = Q + A
£ DH = cDt
Задание {{ 11 }} ТЗ № 11
Дополните
Для расчета энергии кристаллической решетки часто пользуются термомеханическим циклом, известным как цикл ...
Правильные варианты ответа: Борна-Габера;
Задание {{ 12 }} ТЗ № 12
Дополните
Для неорганических соединений тепловые эффекты однотипных процессов являются периодической функцией ... номера элемента
Правильные варианты ответа: порядкового;
Задание {{ 13 }} ТЗ № 13
Дополните
Тепловой эффект, измеренный при постоянном объеме, называется ... тепловым эффектом.
Правильные варианты ответа: изохорным;
Задание {{ 14 }} ТЗ № 14
Отметьте правильный ответ
Изобарный тепловой эффект меньше изохорного теплового эффекта для реакции, идущей с увеличением числа молей газообразных веществ, на величину, равную работе расширения и может быть выражена соотношением:
R Qp = Qv – A = Qv - pDV
£ Qv = Qp – A
£ DH = DU + pDV
£ A = Qv + Qp
Задание {{ 15 }} ТЗ № 15
Дополните
Первый закон термодинамики имеет несколько формулировок, но все они выражают одну идею: неуничтожимость и ...... различных видов энергии при их видимых переходах.
Правильные варианты ответа: эквивалентность;
Задание {{ 16 }} ТЗ № 16
Отметьте правильный ответ
Математическое выражение первого начала термодинамики:
R DU = q – A
£ DU = q + A
£ DU = DH + pDV
£ DU = - Qv
Задание {{ 17 }} ТЗ № 17
Дополните
Энтальпия разложения химического соединения равна, но противоположна по знаку энтальпии его ..... из тех же продуктов разложения, находящихся в том же состоянии при тех же условиях.
Правильные варианты ответа: образования;
Задание {{ 18 }} ТЗ № 18
Дополните
Логарифмическое выражение термодинамической вероятности существования системы называется .....
Правильные варианты ответа: энтропией; энтропия;
Задание {{ 19 }} ТЗ № 19
Дополните
Все самопроизвольные реакции характеризуются отрицательным значением изменения ..... потенциала: dG<0
Правильные варианты ответа: изобарного;
Задание {{ 20 }} ТЗ № 20
Дополните
Если DН <0 и DS>0, то всегда D…<0, т.е. реакция с выделением теплоты и увеличением степени беспорядка возможна при всех температурах.
Правильные варианты ответа: G;
Задание {{ 21 }} ТЗ № 21
Дополните
Если DН > 0 и DS < 0, то всегда D……>0, т.е. реакция с поглощением теплоты и увеличением степени беспорядка невозможна ни при каких условиях.
Правильные варианты ответа: G;
Задание {{ 22 }} ТЗ № 22
Дополните
В качестве основной формулировки 2 закона термодинамики приводится следующее: теплота не может самопроизвольно переходить от холодного тепла к .....
Правильные варианты ответа: теплому;
Задание {{ 23 }} ТЗ № 23
Дополните
Теория химической кинетики основывается на двух методах, представляющих собой различные подходы это теория активных соударений и теория ...... комплекса.
Правильные варианты ответа: активированного;
Задание {{ 24 }} ТЗ № 24
Дополните
, называется ...... реакции.
Правильные варианты ответа: молекулярностью; молекулярность;
Задание {{ 25 }} ТЗ № 25
Дополните
Избыточное количество энергии, котрой должна обладать молекула в момент столкновения, чтобы быть способной к химическому вхаимодействию называется - ..... активации.
Правильные варианты ответа: энергия; энергией;
Задание {{ 26 }} ТЗ № 26
Дополните
Уравнение Аррениуса показывает, что при постоянной температуре константа скорости определяется энергией ......
Правильные варианты ответа: активации;
Задание {{ 27 }} ТЗ № 27
Дополните
Лимитирующей (ограничивающей стадией процесса является та, у которой более высокая ..... активации.
Правильные варианты ответа: энергия;
Задание {{ 28 }} ТЗ № 28
Отметьте правильный ответ
Константы равновесия, выраженные через концентрации Кс и через парциальные давления веществ Кр связаны между собой выражением:
R Kp = Kc (RT)Dn
£ Kc = Kp (RT)Dn
£ Kp - Kc = (RT)Dn
£ Kc + Kp = (RT)1/Dn
Задание {{ 29 }} ТЗ № 29
Отметьте правильный ответ
Не производя вычислений, определите знак изменения энтропии в следующей реакции:
NH4NO3(к)=NO2(г) + 2H2O(г)
R DS > 0
£ DS < 0
£ DS = 0
£ Не знаю
Задание {{ 30 }} ТЗ № 30
Отметьте правильный ответ
В каком из следующих случаев реакция возможна при любых температурах:
R DH < 0; DS > 0
£ DH < 0; DS < 0
£ DH > 0; DS > 0
£ DH = 0; DS > 0
Задание {{ 31 }} ТЗ № 31
Отметьте правильный ответ
В каком из следующих случаев реакция неосуществима при любых тепературах:
£ DH > 0; DS > 0
R DH < 0; DS < 0
£ DH > 0; DS = 0
Задание {{ 32 }} ТЗ № 32
Отметьте правильный ответ
Какими воздействиями на систему А(г) + В(г) ¬® АВ(г) можно увеличить равновесную концентрацию продукта АВ, если DН0<0:
£ Понижением температуры
R Повышением температуры
£ Введением в систему катализатора
£ Введением в систему дополнительного количества АВ
Задание {{ 33 }} ТЗ № 33
Отметьте правильный ответ
Тепловой эффект химической реакции при постоянном давлении - это:
R количество выделевшейся или поглащенной теплоты в результате взаимодействия между собой строго определенных количеств веществ
£ изменение внутренней энергии в результате химической реакции
£ изменения энтальпии в результате хиической реакции
£ работа, выполненная а ходе химической реакции
Задание {{ 34 }} ТЗ № 34
Отметьте правильный ответ
Какая из нижеперечисленных реакций является эндотермической?
£ 1/2N2 + 3/2H2 = NH3; DH0298= -46 кДж/моль
£ H2 + ½ O2 = H2O; DH0298 = -242 кДж/моль
R 1/2N2 + ½ O2 = NO; DH0298= 90 кДж/моль
£ 2NO + O2 = 2NO2; DH0298= -113 кДж/моль
Задание {{ 35 }} ТЗ № 35
Отметьте правильный ответ
C + O2 ® CO2
£ N2 + O2 ® 2NO
£ 2H2 + O2 ® 2H2O
£ 2NO + O2 ® 2NO2
Задание {{ 36 }} ТЗ № 36
Отметьте правильный ответ
Реакцию уравнение которой 3Н2 + N2 ¬® 2NH3 + Q относят к реакциям
R обратимым, экзотермическим
£ необратимым, экзотермическим
£ обратимым, эндотермическим
£ необратимым, эндотермическим
Задание {{ 37 }} ТЗ № 37
Отметьте правильный ответ
Скорость прямой реакции N2 + 3H2 ¬® 2NH3 + Q возрастает при:
R увеличении концентрации азота
£ уменьшении концентрации азота
£ увеличении концентрации амиака
£ уменьшении концентрации водорода
Задание {{ 38 }} ТЗ № 38
Отметьте правильный ответ
При повышении температуры равновесие химической реакции смещается в сторону
£ продуктов реакции
£ исходных веществ
R эндотермической реакции
£ экзотермической реакции
Задание {{ 39 }} ТЗ № 39
Отметьте правильный ответ
Скорость химической реакции между металлами и серой не зависит от
£ температуры
£ площади поверхности соприкосновения веществ
R давления
£ природы металла
Задание {{ 40 }} ТЗ № 40
Отметьте правильный ответ
реакция протекающая на границе разделла двух фаз, называется
R гетерогенной
£ окислительно-восстановительной
£ гомогенной
£ каталитической
Задание {{ 41 }} ТЗ № 41
Отметьте правильный ответ
Во сколько раз возрастает скорость реакции при повышении температуры на 30 градусов
£ 9
R 27
£ 81
£ 90
Задание {{ 42 }} ТЗ № 42
Отметьте правильный ответ
На сколько градусов следует повысит температуру, чтобы скорость реакции возрасла в 8 раз
£ 20
£ 40
R 30
£ 50
Задание {{ 43 }} ТЗ № 43
Отметьте правильный ответ
Во сколько раз возрастает скорость реакции при повышении температуры на 50 градусов? температурный коэффициент равен 2.
£ 16
£ 64
R 32
£ 18
Задание {{ 44 }} ТЗ № 44
Отметьте правильный ответ
Реакция протекает по уравнению СаО + СО2 = СaCO3. Во сколько раз увеличивается скорость этой реакции, если давление в системе увеличить в 2 раза.
R 2
£ 4
£ 6
£ 8
Задание {{ 45 }} ТЗ № 45
Отметьте правильный ответ
В какую сторону сместиться равновесие реакции Fe + H2O(пар) ¬® FeO + H2 при повышении давления
£ влево
£ вправо
R не сместиться
Задание {{ 46 }} ТЗ № 46
Отметьте правильный ответ
Газовая смесь состоит из водорода и хлора. Реакция протекает по схеме: H2 + Cl2 = 2HCl. Во сколько раз увеличится скорость реакции, если увеличить давление в 3 раза.
£ 27
£ 6
R 9
£ не изменится
Задание {{ 47 }} ТЗ № 47
Отметьте правильный ответ
Каким путем можно повысить выход СО2 в реакции 2СО + О2 ¬® 2СО2
£ увеличив концентрацию СО2
R увеличив давление
£ увеличив объем
£ уменьшив концентрацию СО
Задание {{ 48 }} ТЗ № 48
Отметьте правильный ответ
В какую сторону сместиться равновесие в системе PCl5 ¬® PCl3 + Cl2 – Q при её охлаждении:
£ вправо
R влево
£ не сместиться
Задание {{ 49 }} ТЗ № 49
Отметьте правильный ответ
Каким путем можно повысить выход NO в реакции N2 + O2 ¬® 2NO - Q
£ увеличесием давления
£ увеличесием объема
R повышением температуры
£ ожлаждением системы
Задание {{ 50 }} ТЗ № 50
Отметьте правильный ответ
В какую сторону сдвинется равновесие вследствие увеличения температуры в системе
N2 + 3H2 ¨ 2NH3 + Q
£ вправо
R влево
£ не сдвинется
Задание {{ 51 }} ТЗ № 51
Отметьте правильный ответ
Как повлияет уменьшение давления на химическое равновесие в системе
Fe2O3(к) + 3H2(г) ¬® 2Fe(к) + 3H2O(г)
£ сместится влево
£ сместится вправо
R не повлияет
Задание {{ 52 }} ТЗ № 52
Отметьте правильный ответ
Во сколько раз увеличится скорость химической реакции
2Al + 3Cl2 = 2AlCl3, если давление системы увеличить в 2 раза
R 8
£ 6
£ 27
£ 32
Задание {{ 53 }} ТЗ № 53
Отметьте правильный ответ
Во сколько раз изменится скорость прямой реакции N2 + 3H2 ¬® 2NH3, при увеличении давления в 10 раз
£ 100
£ 300
£ 1000
R 10000
Задание {{ 54 }} ТЗ № 54
Отметьте правильный ответ
Вычислить теплоту образования силиката кальция (кДж/моль) CaSiO3 (ТВ), если теплота образования оксида кремния (IV) равна +865,4 кДж/моль, оксида кальция + 635,7 кДж/моль, а тепловой эффект реакции взаимодействия СаО с SiO2 равен +87,9 кДж
R 1589
£ 723,6
£ 953,3
£ 1501,1
Задание {{ 55 }} ТЗ № 55
Отметьте правильный ответ
Чему равна теплота растворения карбоната натрия в воде (в кДж), если известно, что при растворении 6,36 г карбоната натрия выделяется 1,5 кДж теплоты
£ 132
R 234
£ 528
£ 264
Задание {{ 56 }} ТЗ № 56
Отметьте правильный ответ
Кислород и водород смешали в объёмном отношении 1:2. Какое количество теплоты выделится при взрыве 8,4 л (н.у.) этой смеси, если термохимическое уравнение реакции горения водорода имеет вид: 2H2(г) + O2(г) = 2H2O(г) + 484,0 кДж
R 60,5
£ 30,5
£ 145,2
£ 80,5
Задание {{ 57 }} ТЗ № 57
Отметьте правильный ответ
Термомеханическое уравнение реакции
С2Н4 + 3 О2 = 2СО2 + 2Н2О + 1400 кДж.
Сколько теплоты выделится (в кДж с точностью до целых), если в реакционном сосуде поджечь смесь, состоящую из 3,36 л водорода (н.у.) и 2,8 г этилена.
R 70
£ 35
£ 140
£ 210
Задание {{ 58 }} ТЗ № 58
Отметьте правильный ответ
При 20градусах по Цельсию реакция, температурный коэффициент которой равен 2, заканчивается за 3 минуты. За сколько секунд она протекает при 60 градусах по Цельсию.
R 37,5
£ 18,75
£ 35,5
£ 23,5
Задание {{ 59 }} ТЗ № 59
Отметьте правильный ответ
Исходя из термохимических уравнений реакций
KClO3 ® KCl +3/2 O2; DH0298 = - 49,4 кДж/моль
KClO4 ® KCl + 2 O2; DH0298 = 33 кДж/моль
Рассчитайте DH0298 реакции (кДж/моль)
4KClO3 ® 3KClО4 + KCl
R -296,6
£ -164,6
£ -263,6
£ -197,6
Задание {{ 60 }} ТЗ № 60
Отметьте правильный ответ
При определенной температуре в химическом реакторе установилось равновесие химической реакции: 3А(г) + 2В(г) = 2С(г) +Q. затем одновременно увеличили давление в 3 раза и повысили температуру на 20 градусов. В какую сторону сместиться химическое равновесие, если температурный коэффициент прямой реакции равен 2, а обратной - 4.
R вправо
£ влево
£ не изменится
Задание {{ 61 }} ТЗ № 61
Отметьте правильный ответ
В трех закрытых сосудах одинакового объёма проводят независимо друг от друга реакции. Через 1 минуту после начала реакции в первом сосуде получено 21,9 г HCl; во втором сосуде получено 24,3 HBr; в третьем сосуде получено 25,6 г HI. Укажите номер сосуда, в котором реакция протекает с наибольшей скоростью.
R 1
£ 2
£ 3
£ во всех сосудах скорость реакции одинакова
Задание {{ 62 }} ТЗ № 62
Отметьте правильный ответ
Исходные концентрации азота и водорода в реакционной смеси для получения аммиака составили 4,0 и 10,0 моль/л соответственно. При наступлении равновесия прореагировало 50,0% азота. Вычислить равновесные концентрации азота, водорода и аммиака (с точностью до целых). В ответе укажите равновесную концентрацию водорода.
£ 2
£ 6
R 4
£ 8
Задание {{ 63 }} ТЗ № 63
Отметьте правильный ответ
С большей скоростью при обычных условиях происходит взаимодействие между:
£ C(тв) и О2(г)
R Na (тв) и H2O
£ N2 (г) и О2 (г)
£ Fe (тв) и H2O
Задание {{ 64 }} ТЗ № 64
Отметьте правильный ответ
Химическое равновесие в системе
C4H8(г) + H2(г) ¬® C4H10(г) + Q
смещается в сторону исходных веществ в результате:
R повышения температуры
£ увеличения концентрации бутилена
£ повышения давления
£ использования катализатора
Задание {{ 65 }} ТЗ № 65
Отметьте правильный ответ
В системе
2 SO2(г) + О2(г) ¬® 2 SO3(г) + Q
смещение химического равновесия вправо произойдет при:
£ добавлении катализатора
£ повышении температуры
£ увеличении концентрации оксида серы (VI)
R повышении давления
Задание {{ 66 }} ТЗ № 66
Дополните
В результате реакции, термохимическое уравнения которой
2AgNO3(тв) = 2Ag(тв) + 2NO2(г) + O2(г) -317 кДж
поглотилось 1,585 кДж теплоты. Масса разложившегося нитрата серебра составляет … г. (Ответ привести с точностью до десятых.)
Правильные варианты ответа: 1,7; 1.7; 1,7г; 1.7г; 1,7 г; 1.7 г;
Задание {{ 67 }} ТЗ № 67
Дополните
Теплота образования 1 моль метана из простых веществ составляет 74,5 кДж. Количество теплоты, равное 596 кДж, выделится при взаимодействии водорода с углеродом массой … .
(Запишите число с точностью до целых)
Правильные варианты ответа: 96;
Задание {{ 68 }} ТЗ № 68
Дополните
Химическое равновесие в системе NH3×H2O ¬®NH4+ + OH-
Сместится в сторону образования NH3×H2O при добавлении к водному раствору аммиака … ионов. (Запишите название ионов в именительном падеже)
Правильные варианты ответа: гидроксид;
Задание {{ 69 }} ТЗ № 69
Отметьте правильный ответ
Согласно термохимическому уравнению
3Fe3O4(k) + 8Al(k) = 9Fe(k) + 4Al2O3(k) + 3330 кДж
можно утверждать, что при образовании 2 моль оксида алюминия:
R выделяется 1665 кДж
£ выделяется 3330 кДж
£ поглощается 1665 кДж
£ поглощается 3330 кДж
Задание {{ 70 }} ТЗ № 70
Отметьте правильный ответ
Изменение давления не оказывает влияния на смещение равновесия в следующей реакции:
£ CO(г) + CI2(г) ¬®COCI2(г)
£ CO2(г) + С(тв) ¬® 2СО(г)
R CO2(г) + H2(г) ¬® СО(г) + H2О(г)
£ 2NO2(г) ¬®N2O4(ж)
Задание {{ 71 }} ТЗ № 71
Установите соответствие между значением константы равновесия (Кр) и уравнением обратимой химической реакции:
| Kp = [COCI2]/[CO][CI2] | CO(г) + СI2(г) ¬® COCI2(г) |
| Kp = [CO]2/[CO2] | CO2(г) + С(тв) ¬® 2СО(г) |
| Kp = [CI2]2[H2O]2/[HCI]4[O2] | 4HCI(г) + O2(г) ¬® 2CI2(г) + 2H2O(г) |
| Kp = [CO][H2O]/[CO2][H2] | CO2(г) + H2(г) ¬® CO(г) + H2O(г) |
Задание {{ 72 }} ТЗ № 72
Установите соответствие между уравнением обратимой химической реакции и значением скорости химической реакции:
| 3Fe(тв) + 4H2O(г) ¬® Fe3O4(тв) + 4H2(г) | V = k[H2O]4 |
| 2SO2(г) + O2(г) ¬® 2SO3(г) | V = k[SO2]2[O2] |
| CO2(г) + C(тв) ¬® 2CO(г) | V = k[CO2] |
| CS2(г) + 4H2(г) ¬® CH4(г) + 2H2S(г) | V = k[CS2][H2]4 |
Задание {{ 73 }} ТЗ № 73
Дополните
Согласно термохимическому уравнению реакции
CH4(г) + 2O2(г) = CO2(г) + 2H2O(г) + 802 кДж
Количество теплоты, выделившейся при сжигании 42 г метана,
равно … кДж.
(Запишите число с точностью до целых)
Правильные варианты ответа: 2105;
Задание {{ 74 }} ТЗ № 74
Дополните
Термохимическое уравнение реакции имеет следующий вид:
CO(г) + 1/2O2(г) ¬® CO2(г) + 282 кДж
Найдите количество выделившейся теплоты, если в реакцию вступило
56 л О2 (н.у.). Ответ … кДж. (Запишите число с точностью до целых)
Правильные варианты ответа: 1410;
Задание {{ 75 }} ТЗ № 75
Отметьте правильный ответ
Среди перечисленных реакций:
1. С + O2 = CO2
2. CaCO3 = CaO + CO2
3. Ca(OH)2 = CaO + H2O
4. H2 + CI2 = 2HCI2
Количество экзотермических равно:
£ 1
R 2
£ 3
£ 4
Задание {{ 76 }} ТЗ № 76
Отметьте правильный ответ
При одновременном понижении давления и повышении температуры химическое равновесие сместится вправо в реакции:
£ H2 + S(г) ¬® H2S + Q
£ 2SO2 + O2 ¬® 2SO3 + Q
R 2NH3 ¨ N2 + 3H2 - Q
£ 2HCI ¬® H2 + CI2 -Q
Задание {{ 77 }} ТЗ № 77
Дополните
В соответствии с термохимическим уравнением реакции
2CI2O7 = 2CI2 + 7O2 + 570 кДж
При разложении оксида хлора массой 18,3 г выделится теплота
количеством … кДж. (Запишите число с точностью до целых)
Правильные варианты ответа: 29;
Задание {{ 78 }} ТЗ № 78
Дополните
Согласно принципу Ле-Шателье увеличение температуры вызывает смещение равновесия в сторону реакции, идущей с ... тепла.
Правильные варианты ответа: поглащением; Поглащением;
Задание {{ 79 }} ТЗ № 79
Отметьте правильный ответ
Приведет к смещению равновесия в реакции
2HCI ¨ H2 + CI2 - Q
£ перемешивание смеси
£ повышение давления
£ применение катализатора
R понижение температуры
Задание {{ 80 }} ТЗ № 80
Отметьте правильный ответ
Равновесие реакции 2NO + O2 ¬® 2NO2 + Q сместится вправо при:
£ уменьшении давления и повышении температуры
R увеличении давления и снижении температуры
£ увеличении давления и повышении температуры
£ уменьшении давления и снижении температуры
Задание {{ 81 }} ТЗ № 81
Дополните
Если обратимая реакция протекает в растворе, то на смещение равновесия не влияет изменение ... .
Правильные варианты ответа: давления; Давления;
Задание {{ 82 }} ТЗ № 82
Отметьте правильный ответ
Увеличение давления сместит равновесие в сторону исходных веществ в реакции:
£ 2NO ¬® N2O4
£ C + 2H2 ¬® CH4
R CH4 + H2O ¨ 3H2 + CO
£ N2 + O2 ¬® 2NO
Задание {{ 83 }} ТЗ № 83
Дополните
Давление может оказывать воздействие на смещение равновесия только в том случае, если при неизменном давлении изменится ... системы.
Правильные варианты ответа: объем; Объем;
Задание {{ 84 }} ТЗ № 84
Отметьте правильный ответ
При окислении аммиака без катализатора образовалось 2,24 л (н.у.) и выделилось 76,5 кДж тепла. Определите тепловой эффект приведенной выше реакции горения аммиака.
(Ответ округлите до целого числа)
R 1530
£ 3060
£ 765
£ 2295
Задание {{ 85 }} ТЗ № 85
Отметьте правильный ответ
По термохимическому уравнению C + O2 = CO2 + 402 кДж
Рассчитайте, сколько образовалось углекислого газа, если выделилось 40,2 кДж теплоты:
£ 0,4 г
£ 10 г
£ 10 молей
R 0,1 моля
Задание {{ 86 }} ТЗ № 86
Отметьте правильный ответ
Не приведет к смещению равновесия в какую-либо сторону в реакции
4NH3 + 5O2 ¨ 4NO + 6H2O + Q
£ увеличение концентрации кислорода
£ понижение температуры
£ увеличение давления
R применение катализатора
Задание {{ 87 }} ТЗ № 87
Дополните
Горение бензола протекает по уравнению:
2С6Н6 + 15О2 = 12СО2 + 6Н2О + 6294 кДж
При сгорании 1 г бензола выделится ………. кДж тепла.
Ответ округлите до целого числа.
Правильные варианты ответа: 40;
Задание {{ 88 }} ТЗ № 88
Отметьте правильный ответ
Если в реакции с соляной кислотой кусочек цинка массой 10 г разделить на 10 частей, то:
£ увеличится объем выделившегося водорода
R увеличится скорость реакции
£ уменьшится масса полученного продукта
£ ничего не изменится
Задание {{ 89 }} ТЗ № 89
Дополните
Все химические реакции в живых организмах протекают в присутствии биологических катализаторов, называемых ......
Правильные варианты ответа: ферменты; ферментами; фермент;
Задание {{ 90 }} ТЗ № 90
Отметьте правильный ответ
Максимальная скорость горения сероводорода в кислоде (реакция необратимая) может быть при:
£ уменьшении температуры и увеличении давления
R увеличении температуры и давления
£ увеличении температуры и уменьшении давления
£ уменьшении температуры и давления
Задание {{ 91 }} ТЗ № 91
Отметьте правильный ответ
Рассчитать константу равновесия при некоторой заданной температуре для обратимой реакции:
СО(г) + Н2О(г) ¬® СО2(г) + Н2(г)
Учитывая, что в состоянии равновесия концентрации участвующих в ней веществ были равны (моль/л) [CO] = 0,16 [H2O] = 0,32 [H2] = 0,64
R 4
£ 0,25
£ 1
£ 10
Задание {{ 92 }} ТЗ № 92
Дополните
Равновесие реакции
CO + Cl2 ¨ COCl2
Устанавливается при концентрациях (в моль/л):
[CO] = 0,55 [Cl2] = 0,05 [COCl2] = 0,95
Исходная концентрация оксида углерода равна ……….
Запишите число с точностью до десятых.
Правильные варианты ответа: 1,5; 1.5;
Задание {{ 93 }} ТЗ № 93
Дополните
Исходные концентрации хлорида натрия и серной кислоты в реакции
NaCl + H2SO4 ¨ NaHSO4 + HCl
Равны соответственно 1 и 2,5 моль/л. После установления равновесия концентрация хлористого водорода стала 0,75 моль/л. Константа равновесия равна ……..
Запишите число с точностью до десятых.
Правильные варианты ответа: 1,3; 1.3;
Задание {{ 94 }} ТЗ № 94
Дополните
В реакции между раскаленным железом и паром
3Fe(тв) + 4H2O(г) ¬® Fe3O4(тв) + 4H2(г)
При достижении равновесия парциальные давления водорода и пара равны 3,2 и 2,4 кПа соответственно. Константа равновесия……..
Запишите число с точностью до десятых.
Правильные варианты ответа: 3,2; 3.2;
Задание {{ 95 }} ТЗ № 95
Отметьте правильный ответ
При синтезе аммиака N2 + 3H2 ¬® 2NH3 равновесие установилось при следующих концентрациях реагирующих веществ (моль/л):
СN2 =2,5 CH2 = 1,8 CNH3= 3,6.
Константа равновесия этой реакции и исходная концентрация водорода соответственно равны:
R 0,89 7,2
£ 1,08 3,6
£ 2,05 4,3
£ 0,35 6,8
Задание {{ 96 }} ТЗ № 96
Дополните
Равновесие реакции 2СО + 2Н2 ¬® СН4 + СО2 при увеличении концентрации всех реагирующих веществ в 3 раза сместится …….
Правильные варианты ответа: вправо;
Задание {{ 97 }} ТЗ № 97
Дополните
Равновесие реакции 2NO + O2 ¬® 2NO2 установилось при следующих концентрациях реагирующих веществ (моль/л): СNO = 0,5; СО2 = 0,7; СNO2 = 2,1. Уменьшение давления в 2 раза сместит равновесие …….
Правильные варианты ответа: влево;
Общая химия
Задание {{ 258 }} ТЗ № 1
Отметьте правильный ответ
Растворами называются
£ изолированные системы, отделенные от окружающей среды реальной или воображаемой поверхностью раздела
£ гомогенные системы, не способные к обмену веществом с окружающей средой
R гомогенные системы, содержащие не менее двух веществ
£ гетерогенные смеси, содержащие не менее двух веществ
Задание {{ 259 }} ТЗ № 2
Отметьте правильный ответ
В зависимости от агрегатного состояния растворителя растворы бывают
R твердыми, жидкими, газообразными
£ жидкими, прозрачными, окрашенными
£ твердыми, аморфными, стеклообразными
£ газообразными, жидкими, мутными
Задание {{ 260 }} ТЗ № 3
Отметьте правильный ответ
Наиболее распространенным растворителем является
£ спирт
£ бром
£ царская водка
R вода
Задание {{ 261 }} ТЗ № 4
Отметьте правильный ответ
Известны две основные теории растворов
£ химическая и электролитическая
R физическая и химическая
£ кинетическая и каталитическая
£ молекулярная и ионная
Задание {{ 262 }} ТЗ № 5
Отметьте правильный ответ
С повышением температуры растворимость в воде почти всех твердых веществ
£ не изменяется
R увеличивается
£ сначала увеличивается, проходит через максимум и затем уменьшается
£ уменьшается
Задание {{ 263 }} ТЗ № 6
Отметьте правильный ответ
Количественный состав раствора чаще всего выражается с помощью понятия
£ парциального давления
R концентрации
£ плотности
£ аддитивности
Задание {{ 264 }} ТЗ № 7
Отметьте правильный ответ
Под концентрацией раствора понимается
£ соотношение между количествами растворенного вещества и растворителя
R содержание растворенного вещества (в определенных единицах) в единице массы и объема
£ давление насыщенных паров растворителя в зависимости от количества растворенного вещества
£ плотность этого раствора
Задание {{ 265 }} ТЗ № 8
Отметьте правильный ответ
Все вещества, способные к образованию растворов, в зависимости от того, а)проводят или б) не проводят их растворы (или расплавы) электрический ток, делят на две категории, называемые
£ а) металлами и б) неметаллами
£ а) окислителями и б) восстановителями
R а) электролитами и б) неэлектролитами
£ а) проводниками и б) изоляторами
Задание {{ 266 }} ТЗ № 9
Отметьте правильный ответ
Положительные ионы называют
R катионами
£ анионами
£ ассоциатами
£ катодами
Задание {{ 267 }} ТЗ № 10
Отметьте правильный ответ
Процесс электролитической диссоциации является
£ неравновесным
£ экзотермическим
£ эндотермическим
R обратимым
Задание {{ 268 }} ТЗ № 11
Отметьте правильный ответ
Неэлектролитами являются
R сахароза (водн. р-р) и этанол
£ уксусная кислота и хлорид аммония
£ крахмал и муравьиная кислота (водн. р-р)
£ нитрат кальция (водн. р-р) и метанол
Задание {{ 269 }} ТЗ № 12
Отметьте правильный ответ
Лампочка прибора для испытания веществ на электрическую проводимость загорится при погружении электродов в
£ водный раствор сахарозы и глицерин
R водный раствор хлорида натрия и уксусную кислоту
£ ацетон и крахмальный клейстер
£ глицерин и гидроксид натрия (расплав)
Задание {{ 270 }} ТЗ № 13
Отметьте правильный ответ
Слабым электролитом является
£ гидроксид бария
£ хлорид кальция
£ соляная кислота
R угольная кислота
Задание {{ 271 }} ТЗ № 14
Отметьте правильный ответ
Формула сильного электролита в водном растворе
£ H2SО3
£ CH3COOH
R HNО3
£ NH4OH
Задание {{ 272 }} ТЗ № 15
Отметьте правильный ответ
Лампочка прибора для испытания веществ на электрическую проводимость не загорится при погружении электродов в
£ расплав гидроксида натрия
£ водный раствор сульфата калия
£ муравьиную кислоту (водн. р-р)
R водный раствор этанола
Задание {{ 273 }} ТЗ № 16
Отметьте правильный ответ
Какой электролит при диссоциации образует только ОН- - ионы
£ Н2О
£ Zn(OH)2
R NaOH
£ СН3СООН
Задание {{ 274 }} ТЗ № 17
Отметьте правильный ответ
Какой электролит наиболее сильный
£ КОН
£ NaOH
R RbOH
£ LiOH
Задание {{ 275 }} ТЗ № 18
Отметьте правильный ответ
£ CuSO4 (p.p) и Fe(OH)3
£ CuO и Ва(ОН)2 (р.р)
R СuС12 (р-р) и NaOH (p.p)
£ CuO и Н2O
Задание {{ 276 }} ТЗ № 19
Отметьте правильный ответ
R NH4Cl и Са(ОН)2
£ NH4C1 и Н2O
£ NH3 и Н2O
£ NH3 и HC1
Задание {{ 277 }} ТЗ № 20
Отметьте правильный ответ
£ хлорида алюминия с водой
£ алюминия с водой
R хлорида алюминия с щелочью
£ алюминия со щелочью
Задание {{ 278 }} ТЗ № 21
Отметьте правильный ответ
Суммы всех коэффициентов в полном и сокращенном ионных уравнениях реакции между гидроксидом бария и серной кислотой равны
£ 9 и 3
£ 10 и 3
£ 12 и 6
R 9 и 9
Задание {{ 279 }} ТЗ № 22
Отметьте правильный ответ
Суммы всех коэффициентов в полном и сокращенном ионных уравнениях реакции между слабой пропионовой кислотой и гидроксидом натрия равны
£ 10 и 3
£ 7 и 3
R 6 и 4
£ 12 и 4
Задание {{ 280 }} ТЗ № 23
Отметьте правильный ответ
Суммы всех коэффициентов в полном и сокращенном ионных уравнениях реакции между гидроксидом железа (III) и серной кислотой равны
£ 16 и 22
R 22 и 8
£ 28 и 18
£ 14 и 10
Задание {{ 281 }} ТЗ № 24
Отметьте правильный ответ
Суммы всех коэффициентов в полном и сокращенном ионных уравнениях реакции между карбонатом натрия и уксусной кислотой (с образованием углекислого газа) равны
£ 11 и 6
£ 10 и 6
R 11 и 7
£ 10 и 7
Задание {{ 282 }} ТЗ № 25
Отметьте правильный ответ
В уравнении реакции алюминия с соляной кислотой суммы коэффициентов перед формулами неэлектролитов равны
£ 3
£ 4
R 5
£ 6
Задание {{ 283 }} ТЗ № 26
Отметьте правильный ответ
Суммы всех коэффициентов в полном и сокращенном ионных уравнениях реакции между гидроксидом натрия и сульфатом магния равны
£ 10 и 3
£ 12 и 6
R 10 и 4
£ 12 и 4
Задание {{ 284 }} ТЗ № 27
Отметьте правильный ответ
В уравнении реакции оксида алюминия с серной кислотой сумма коэффициентов перед формулами сильных электролитов равна
£ 3
R 4
£ 5
£ 6
Задание {{ 285 }} ТЗ № 28
Отметьте правильный ответ
£ оксида кремния (IV) с водой
£ оксида кремния (IV) с серной кислотой
R силиката натрия с серной кислотой
£ силиката кальция с серной кислотой
Задание {{ 286 }} ТЗ № 29
Отметьте правильный ответ
Слили два раствора, которые содержали по одному молю хлорида бария и сульфата натрия. Сколько видов ионов будет в образовавшемся растворе
£ 4
R 2
£ 3
£ в образовавшемся растворе нет ионов
Задание {{ 287 }} ТЗ № 30
Отметьте правильный ответ
Написать уравнение первой стадии гидролиза карбоната натрия в сокращенном ионно-молекулярном виде. (В ответе указать суммарный заряд ионов в правой части уравнения по абсолютному значению)
R 2
£ 4
£ 3
£ 5
Задание {{ 288 }} ТЗ № 31
Отметьте правильный ответ
Какое вещество служит реактивом на хлорид-ион? Написать сокращенное ионно-молекулярное уравнение реакции между этим веществом и хлоридом железа (III). (В ответе указать общую сумму коэффициентов в уравнении.)
R 3
£ 6
£ 9
£ 4
Задание {{ 289 }} ТЗ № 32
Отметьте правильный ответ
Составить уравнение первой ступени гидролиза (ионное и молекулярное) сульфита калия. Определите реакцию среды. (Указать правильный ответ)
£ кислая
£ нейтральная
R щелочная
Задание {{ 290 }} ТЗ № 33
Отметьте правильный ответ
Написать уравнение первой стадии гидролиза хлорида алюминия в сокращенном ионно-молекулярном виде. (В ответе указать количество ионов различного вида.)
£ 3
R 4
£ 2
£ все ионы одинакового вида
Задание {{ 291 }} ТЗ № 34
Отметьте правильный ответ
Какие ионы совместно могут находиться в растворе
R Na+ и ОН-
£ Zn2+ и ОН-
£ А13+ и ОН-
£ Сu+ и ОН-
Задание {{ 292 }} ТЗ № 35
Отметьте правильный ответ
В каком случае реакция между ионами не протекает
£ Ag+ + Cl-
£ Са2++ СO2-3
R 3К++ РO3-4
£ Ва2++ SO2-4
Задание {{ 293 }} ТЗ № 36
Отметьте правильный ответ
£ метанол и муравьиная кислота
R метанол и пропионовая кислота
£ этанол и муравьиная кислота
£ этанол и пропионовая кислота
Задание {{ 294 }} ТЗ № 37
Отметьте правильный ответ
Вычислите массовую долю (%) соли в растворе, содержащем 50г соли и 200г воды
£ 25
R 20
£ 4
£ 5
Задание {{ 295 }} ТЗ № 38
Отметьте правильный ответ
Сколько граммов хлорида натрия содержится в 250г его 10%-ного раствора
R 25
£ 20
£ 240
£ 220
Задание {{ 296 }} ТЗ № 39
Отметьте правильный ответ
Определить молярную концентрацию раствора, в 2л которого содержится 0,3моля вещества
£ 0,60
R 0,15
£ 0,35
£ 0,55
Задание {{ 297 }} ТЗ № 40
Отметьте правильный ответ
Сколько молей вещества содержится в 0,5л его 1,2М раствора
R 0,6
£ 6,0
£ 2,4
£ 0,42
Задание {{ 298 }} ТЗ № 41
Отметьте правильный ответ
В скольки литрах 1,25М раствора содержится 1моль вещества
£ 1,6
£ 1,25
£ 800
R 0,8
Задание {{ 299 }} ТЗ № 42
Отметьте правильный ответ
Сколько граммов воды содержится в 10г 20%-ного раствора кислоты
£ 0,8
R 8
£ 0,2
£ 2
Задание {{ 300 }} ТЗ № 43
Отметьте правильный ответ
В 100мл воды растворили 20г пентагидрата сульфата меди (II). Массовая доля (%) сульфата меди в полученном растворе равна ...
R 10,7
£ 16,7
£ 9
£ 7,5
Задание {{ 301 }} ТЗ № 44
Отметьте правильный ответ
Сколько граммов нитрата алюминия потребуется для приготовления 1500мл 0,5М раствора
£ 106,5
R 159,75
£ 426
£ 319,5
Задание {{ 302 }} ТЗ № 45
Отметьте правильный ответ
Сколько граммов 5% раствора хлорида натрия надо прибавить к 100г 80% раствора, чтобы получить 30% раствор
£ 100
R 200
£ 150
£ 180
Задание {{ 303 }} ТЗ № 46
Отметьте правильный ответ
Сколько граммов 30%-го раствора уксусной кислоты нужно прибавить к 250мл воды, чтобы получить 10%-ный раствор
£ 250
£ 500
R 125
£ 175
Задание {{ 304 }} ТЗ № 47
Отметьте правильный ответ
Сколько граммов воды необходимо для растворения 44,8л хлороводорода (н.у.), чтобы получить 14,6%-ный раствор соляной кислоты
R 427
£ 383
£ 146
£ 954
Задание {{ 305 }} ТЗ № 48
Отметьте правильный ответ
В каком объеме воды (в мл) надо растворить 200г хлорида железа (Ш), чтобы получить 20%-ный раствор
£ 1000
R 800
£ 400
£ 1200
Задание {{ 306 }} ТЗ № 49
Отметьте правильный ответ
Один литр 40% раствора серной кислоты (пл. 1,3г/мл) упарили до 1000г. Какова массовая доля (%) серной кислоты в полученном растворе
R 52
£ 26
£ 76
£ 82
Задание {{ 307 }} ТЗ № 50
Отметьте правильный ответ
Смешали 300г 20%-го раствора и 500г 40%-го раствора нитрата аммония. Какое количество вещества нитрата аммония будет содержаться в 2000г раствора. Ответ дать с точностью до целых
£ 4
R 8
£ 3
£ 10
Задание {{ 308 }} ТЗ № 51
Отметьте правильный ответ
Сколько граммов бертолетовой соли выкристаллизуется из 700г насыщенного при 80°С раствора, если его охладить до 20°С. Растворимость КСO3 при 20 и 80°С равна соответственно 5 и 40г на 100г воды
£ 220
R 175
£ 150
£ 310
Задание {{ 309 }} ТЗ № 52
Отметьте правильный ответ
Какие массы 10%-ного и 20%-ного раствора NaCl необходимо взять, чтобы получить раствор с массовой долей 12% массой 300г
£ 200 и 100
£ 250 и 50
£ 50 и 250
R 240 и 60
Задание {{ 310 }} ТЗ № 53
Отметьте правильный ответ
Растворимость хлорида алюминия при 0°С равна 44,Зг, а при 80°С - 48г (на 100г воды). Сколько граммов соли выпадет в осадок, если 592г раствора охладить от 80 до 0°С
R 14,8
£ 7,6
£ 18,2
£ 20,2
Задание {{ 311 }} ТЗ № 54
Отметьте правильный ответ
Растворимость сульфата меди при 30°С равна 25г. Какова массовая доля (%) сульфата меди в насыщенном растворе
£ 25
R 20
£ 35
£ 40
Задание {{ 312 }} ТЗ № 55
Отметьте правильный ответ
Сколько граммов хлорида натрия выкристаллизуется из 600г раствора, насыщенного при 80°С, при охлаждении его до 0°С. Растворимость хлорида натрия при 80°С - 38г, а при 0°С - 35,7г (в 100г Н20)
R 10
£ 35
£ 12
£ 7,8
Задание {{ 313 }} ТЗ № 56
Отметьте правильный ответ
Сколько молей катионов натрия образуется при диссоциации 4молей гидрофосфата натрия, если считать, что диссоциирует 98% взятого гидрофосфата натрия
R 7,84
£ 1,96
£ 8
£ 2,16
Задание {{ 314 }} ТЗ № 57
Отметьте правильный ответ
Сколько всего молей катионов натрия образуется при диссоциации солей в растворе, содержащем 28,4г сульфата натрия и 8,5г нитрата натрия. Считать, что соли диссоциируют полностью
£ 1,0
R 0,5
£ 1,5
£ 2,5
Задание {{ 315 }} ТЗ № 58
Отметьте правильный ответ
Оксид фосфора (V), получившийся при окислении фосфора, растворен в 25% растворе гидроксида натрия (р=1,28г/мл) с образованием 24г дигидрофосфата натрия. Рассчитайте, сколько мл раствора
гидроксида натрия израсходовано
R 25
£ 17
£ 28
£ 32
Задание {{ 316 }} ТЗ № 59
Отметьте правильный ответ
Сколько граммов медного купороса нужно добавить к 270г воды, чтобы получить 10% раствора сульфата меди
£ 25
R 50
£ 75
£ 35
Задание {{ 317 }} ТЗ № 60
Отметьте правильный ответ
Сколько граммов кристаллогидрата Cu(N03)2·3H20 нужно растворить в 606,4г воды, чтобы получить 18,8% раствора нитрата меди. (Ответ с точностью до десятых.)
R 193,6
£ 185,8
£ 203,4
£ 148,7
Задание {{ 318 }} ТЗ № 61
Отметьте правильный ответ
Сколько граммов оксида натрия нужно растворить в 1014г раствора, содержащего 240г гидроксида натрия, чтобы образовался 40% раствор гидроксида натрия
R 186
£ 138
£ 208
£ 142
Задание {{ 319 }} ТЗ № 62
Отметьте правильный ответ
Найдите массовую долю (%) вещества (какого?) в растворе, полученном при взаимодействии 4,6г металлического натрия с 75,6мл Н20
R 10
£ 8
£ 12
£ 15
Задание {{ 320 }} ТЗ № 63
Отметьте правильный ответ
Какая масса металлического натрия должна прореагировать с 89мл воды, чтобы получился раствор с массовой долей щелочи 20%
£ 19,5
R 11,5
£ 15,2
£ 10,8
Задание {{ 321 }} ТЗ № 64
Отметьте правильный ответ
Для окисления Fe (II) до Fe (III) в растворе сульфата железа (II), подкисленном серной кислотой (масса раствора 800г), потребовалось 316г раствора с массовой долей КМnO4 2%. Найдите массовую долю FeSO4 в
растворе
R 3,8
£ 1,9
£ 2,5
£ 4,2
Задание {{ 322 }} ТЗ № 65
Установите соответствие между составом соли и реакцией среды ее водного раствора
| нитрат натрия | нейтральная |
| сульфат аммония | кислая |
| сульфид калия | щелочная |
| ортофосфат калия | щелочная |
Задание {{ 323 }} ТЗ № 66
Установите соответствие между сокращенными ионными уравнениями реакций обмена и исходными веществами
| Н+ + ОН=Н2O | КОН и HNО3 |
| Ва2++ СО32- = ВаСО3 | ВаС12 и Na2CO3 |
| Fe3++ 3ОН-= Fe(OH)3 | Fe2(SO4)3 и КОН |
| Ва2+ + SO32- = BaSO3 | Ва(ОН)2 и Na2SO3 |
| Н3РО4 и Ва(ОН)2 |
Задание {{ 324 }} ТЗ № 67
Установите соответствие между составом соли и реакцией среды в ее водном растворе
| нитрат калия | нейтральная |
| хлорид железа (III) | кислая |
| иодид аммония | кислая |
| ацетат натрия | щелочная |
Задание {{ 325 }} ТЗ № 68
Установите соответствие между реагентами и ионно-молекулярным уравнением реакции
| NaOH + HNO3 | ОН- + Н+ = Н2O |
| Na2CO3+ HC1 | СO32- +2Н+ = СO2 + Н2O |
| Na2CO3 + СO2+ Н2O | CO32- + CO2 + H2O = HCO3 - |
| СаСO3 + HC1 | СаСО3 + 2Н+ = Са2+ + Н2O + СO2 |
| СО32- + Н2O = НСO3- + ОН- |
Задание {{ 326 }} ТЗ № 69
Установите соответствие между реагирующими веществами и продуктами их взаимодействия
| Ca(OH)2 + N2O3 | Ca(NO2)2 + Н2O |
| Са(ОН)2 + N2O5 | Ca(NO3)2 + H2O |
| Са(ОН)2 + SO2 | CaSО3+H2О |
| Ca(OH)2 + SO3 | CaSO4+H2O |
| Ca(NO3)2+H2 | |
| CaSO4+H2 |
Задание {{ 327 }} ТЗ № 70
Отметьте правильный ответ
Большее количество (в молях) ионов образуется при растворении 1 моля
£ сахара
£ хлорида аммония
R сульфата железа (III)
£ уксусной кислоты
Задание {{ 328 }} ТЗ № 71
Отметьте правильный ответ
Не будет происходить видимых изменений, если в растворе одновременно окажутся ионы
£
Na+, SO42- , OH-, Ba2+
R
Na+, SO42-, ОН-, К+
£
Mg2+, SO42-, ОН-, К+
£
H+, SO42-, CO32-, K+
Задание {{ 329 }} ТЗ № 72
Отметьте правильный ответ
Кислая среда в водных растворах солей ряда
£ NaBr, ВаС12
£ А1С13, Ba(NO3)2
£ Na2CO3, Na2S
R ZnCl2,(NH4)2SO4
Задание {{ 330 }} ТЗ № 73
Отметьте правильный ответ
Краткие ионные уравнения взаимодействия одинаковы для следующих пар веществ
£ Nа(ОН) и H2SO4, Ва(ОН)2 и H2SiO3
£ Ва(ОН)2 и H2SO4 , Na(OH) и НС1
R Na(OH) и H2SO4 , Ва(ОН)2 и HC1
£ А1(ОН)3 и НС1, Са(ОН)2 и HNO3
Задание {{ 331 }} ТЗ № 74
Отметьте правильный ответ
Щелочная среда в растворе каждого вещества из следующих пар солей
£ ZnBr2, FeCl2
£ BaCl2, Na2CO3
£ NaCO3,Na2SO4
R K2SiO3, СН3СООК
Задание {{ 332 }} ТЗ № 75
Отметьте правильный ответ
Лучшей электропроводностью будет обладать 1 л водного раствора 0,1 моля
£ углекислого газа
R хлорида бария
£ хлора
£ аммиака
Задание {{ 333 }} ТЗ № 76
Отметьте правильный ответ
В водном растворе гидросульфата натрия
£ универсальный индикатор станет синим
R лакмус станет красным
£ фенолфталеин малиновым
£ метилоранж станет желтым
Задание {{ 334 }} ТЗ № 77
Отметьте правильный ответ
Для ослабления гидролиза хлорида алюминия в водный раствор соли следует добавить
R соляную кислоту
£ раствор гидроксида бария
£ раствор гидрокарбоната натрия
£ дистиллированную воду
Задание {{ 335 }} ТЗ № 78
Отметьте правильный ответ
Для ослабления гидролиза сульфида натрия в его водный раствор следует добавить
R раствор гидроксида натрия
£ разбавленную серную кислоту
£ раствор карбоната калия
£ дистиллированную воду
Задание {{ 336 }} ТЗ № 79
Отметьте правильный ответ
Сульфат калия массой 34,8 г растворили в воде и довели объем раствора до 1 л. В полученном растворе концентрация ионов калия равна 0,38 моль/л. Расчитайте степень диссоциации (%) сульфата калия в растворе
£ 52.6
R 95
£ 98
£ 190
Задание {{ 337 }} ТЗ № 80
Отметьте правильный ответ
Рассчитайте количество положительных ионов (в моль) в 140г 20%-ного раствора гидроксида натрия, если степень диссоциации основания равна 90%
R 0.63
£ 0.70
£ 3.89
£ 0.78
Задание {{ 338 }} ТЗ № 81
Отметьте правильный ответ
Рассчитайте количество гидроксид-ионов (в моль) в 0,5 л раствора гидроксида калия (молярная концентрация 3 моль/л), если степень диссоциации основания равна 92%
R 1,38
£ 1,50
£ 1,63
£ 2,76
Задание {{ 339 }} ТЗ № 82
Дополните
Количество отрицательных ионов (в моль) в 120г 10%-ного раствора нитрата аммония со степенью диссоциации 90% равна …… моль. Запишите число с точностью до тысячных
Правильные варианты ответа: 0,135; 0.135;
Задание {{ 340 }} ТЗ № 83
Дополните
Хлорид бария массой 41,6 г растворили в воде. В полученном растворе содержится 0,35 моль хлорид-ионов. Степень диссоциации (%) хлорида бария равна …….. %. Запишите число с точностью до десятых
Правильные варианты ответа: 87,5; 87.5;
Задание {{ 341 }} ТЗ № 84
Дополните
В одном литре водного раствора сульфата натрия содержится 1,38 моль ионов Na+ и SO42-. Степень диссоциации соли равна 92%. Молярная концентрация сульфата натрия в растворе равна ……… моль/л. Запишите число с точностью до десятых
Правильные варианты ответа: 0,5; 0.5;
Задание {{ 342 }} ТЗ № 85
Дополните
В одном литре водного раствора хлорида алюминия с концентрацией 0,5 моль/л содержится 1,29 моль хлорид-ионов. Степень диссоциации (%) соли в растворе равна …….. %. Запишите число с точностью до целых
Правильные варианты ответа: 86;
Задание {{ 343 }} ТЗ № 86
Дополните
При охлаждении 150г 40%-ного раствора вещества выпало 15 г осадка (не содержащего воды). Осадок отфильтровали. Концентрация полученного раствора (масс%) равна ……. %. Запишите число с точностью до десятых
Правильные варианты ответа: 33,3; 33.3;
Задание {{ 344 }} ТЗ № 87
Дополните
В 16 %-ном растворе сульфата магния содержится 0,2 моль соли. Масса раствора (г) равна …….. г. Запишите целое число
Правильные варианты ответа: 150;
Задание {{ 345 }} ТЗ № 88
Дополните
Масса хлороводорода (г) в 200 мл 20%-ной соляной кислоты (плотность раствора 1,1 г/мл)) равна ……. г. Запишите целое число
Правильные варианты ответа: 44;
Задание {{ 346 }} ТЗ № 89
Дополните
Для получения 20%-ного раствора хлорида натрия к 200 г 10%-ного надо добавить хлорид натрия массой ……. Запишите целое число
Правильные варианты ответа: 25;
Задание {{ 347 }} ТЗ № 90
Дополните
К 120 мл 15%-ного раствора гидрата аммиака (NH3·H20) плотностью 0,94 г/мл прилили 120 мл 28%-ного раствора азотной кислоты плотностью 1,15г/мл. Реакция среды полученного раствора ……… Запишите слово в именительном падеже
Правильные варианты ответа: кислая; КИСЛАЯ;
Задание {{ 348 }} ТЗ № 91
Дополните
К 200 мл 0,03М раствора ортофосфорной кислоты прилили 400 мл 0,015 М раствора гидроксида бария. Укажите массу соли (г) с точностью до десятых долей …….. г
Правильные варианты ответа: 1,2; 1.2;
Задание {{ 349 }} ТЗ № 92
Дополните
Объем (л) 2М раствора гидроксида натрия, необходимый для нейтрализации 4л 0,5М раствора серной кислоты равен …… Запишите целое число
Правильные варианты ответа: 2;
Задание {{ 350 }} ТЗ № 93
Дополните
Смешали 10г 30%-ного раствора нитрата серебра и 15,5 г 3%-ного раствора хлорида калия. Масса (г) образовавшегося осадка (с точностью до десятых долей) равна …..
Правильные варианты ответа: 0,9; 0.9;
Задание {{ 351 }} ТЗ № 94
Дополните
К 70мл хлороводородной кислоты прибавили нитрат серебра до прекращения образования осадка. В результате реакции образовалось 0,8 г хлорида серебра. Молярная концентрация соляной кислоты равна …... моль/л. Ответ представьте с точностью до сотых долей
Правильные варианты ответа: 0,08; 0.08;
Задание {{ 352 }} ТЗ № 95
Дополните
Объем сероводорода (л) н.у., растворенного в 60 мл воды для получения раствора с массовой долей 1,5%, равен …… л. Запишите число с точностью до десятых
Правильные варианты ответа: 0,6; 0.6;
Задание {{ 353 }} ТЗ № 96
Дополните
Через 100 г 10%-ного раствора соляной кислоты пропустили 2,66л хлористого водорода. Массовая доля (%) кислоты в полученном растворе равна …… %. Запишите число с точностью до десятых
Правильные варианты ответа: 13,7; 13.7;
Задание {{ 354 }} ТЗ № 97
Дополните
Плотность 26%-ного гидроксида калия равна 1,24 г/мл. Молярная концентрация гидроксида калия в этом растворе равна …… моль/л.Запишите число с точностью до сотых
Правильные варианты ответа: 5,76; 5.76;
Задание {{ 355 }} ТЗ № 98
Дополните
Число молей серной кислоты, содержащихся в 2 л раствора с массовой долей 60% (плотность равна 1,5 г/мл) равно ……. моль. Запишите число с точностью до сотых
Правильные варианты ответа: 18,37; 18.37;
Задание {{ 356 }} ТЗ № 99
Дополните
К раствору, содержащему 0,15 моль хлорида меди(П), прилили 75 мл 4% раствора гидроксида натрия (плотность равна 1,05 г/мл). Масса образовавшегося осадка (г) равна ……. г. Запишите число с точностью до десятых
Правильные варианты ответа: 3,8; 3.8;
Задание {{ 357 }} ТЗ № 100
Дополните
Масса (г) гексагидрата хлорида кальция, которую необходимо добавить к 200 мл 5%-ного раствора хлорида кальция для получения 20%-ного раствора этой соли ……. г. Запишите число с точностью до десятых
Правильные варианты ответа: 97,8; 97.8;
Задание {{ 358 }} ТЗ № 101
Дополните
Смеси, в процессе образования которых тепловые и объемные эффекты отсутствуют, т.е. ΔН=0 и ΔV=0, называются…….. растворами
Правильные варианты ответа: идеальными; ИДЕАЛЬНЫМИ; Идеальными;
Задание {{ 359 }} ТЗ № 102
Отметьте правильный ответ
Выражение С1/С2 = К – это
R закон распределения
£ закон разбавления
£ закон смещения
£ закон растворения
Задание {{ 360 }} ТЗ № 103
Отметьте правильный ответ
Растворимость газа при постоянной температуре пропорциональна его давлению. Это закон
R Генри
£ Рауля
£ Гесса
£ Кольрауша
Задание {{ 361 }} ТЗ № 104
Дополните
Понятие растворимости в присутствии солей называется .....
Правильные варианты ответа: высаливанием; Высаливанием; ВЫСАЛИВАНИЕМ;
Задание {{ 362 }} ТЗ № 105
Отметьте правильный ответ
Относительное понижение давления насыщенного пара растворителя над растовром равно мольной долей растворенного вещества в растворе - это первый закон
R Рауля
£ Гесса
£ Коновалова
£ Семенченко
Задание {{ 363 }} ТЗ № 106
Отметьте правильный ответ
Второму закону Рауля соответствуют математические выражения
R ΔТкип = Em и ΔТотв = Km
£ 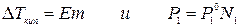
£ 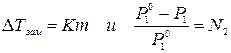
£ 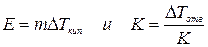
Задание {{ 364 }} ТЗ № 107
Отметьте правильный ответ
Зависимость осмотического давления от концентрации описывается формулой Pосм = С·RT, где
R С - молярная концентрация
£ С - нормальность
£ С - моляльность
£ С - массовая доля растворенного вещества
Задание {{ 365 }} ТЗ № 108
Отметьте правильный ответ
Для растворов электролитов используются следующие формулы ΔР = iC; ΔTкип = iEm; ΔTотв = iKm; Pосм = iCRT, где i – это
R изотонический коэффициент
£ изобарический коэффициент
£ изохорический коэффициент
£ адиабатический коэффициент
Задание {{ 366 }} ТЗ № 109
Дополните
Основные положения теории электролитической диссоциации Аррениуса охватывают лишь крайне ...... растворы слабых электролитов
Правильные варианты ответа: Разбавленные; РАЗБАВЛЕННЫЕ; разбавленные;
Задание {{ 367 }} ТЗ № 110
Дополните
Уравнение 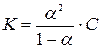 называется законом ……. Оствальда
называется законом ……. Оствальда
Правильные варианты ответа: разбавления; Разбавления; РАЗБАВЛЕНИЯ;
Задание {{ 368 }} ТЗ № 111
Дополните
Для удобства при оценке кислотности и щелочности среды пользуются не концентрацией ионов водорода, а величиной водородного показателя .....
Правильные варианты ответа: рН; pH;
Задание {{ 369 }} ТЗ № 112
Дополните
Сревнительно грубое, но быстрое определение рН можно произвести с помощью специальных реактивов ......
Правильные варианты ответа: Индикаторов; индикаторов; ИНДИКАТОРОВ;
Задание {{ 370 }} ТЗ № 113
Отметьте правильный ответ
R 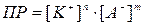
£ 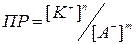
£ 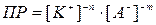
£ 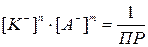
Задание {{ 371 }} ТЗ № 114
Дополните
Если соль содержит однозарядный катион (анион) и многозарядный анион (катион), то возможен .... гидролиз
Правильные варианты ответа: ступенчатый; Ступенчатый; СТУПЕНЧАТЫЙ;
Задание {{ 372 }} ТЗ № 115
Дополните
Количественно гидролиз характеризуется ….. гидролиза 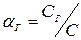
Правильные варианты ответа: Степенью; степенью; СТЕПЕНЬЮ;
Задание {{ 373 }} ТЗ № 116
Отметьте правильный ответ
Константа гидролиза (КГ) для солей, подвергающихся гидролизу по аниону равна
R 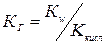
£ 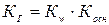
£ 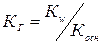
£ 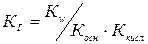
Задание {{ 374 }} ТЗ № 117
Дополните
Правильные варианты ответа: усиливается; Усиливается; УСИЛИВАЕТСЯ;
Задание {{ 375 }} ТЗ № 118
Дополните
В соответствии с принципом Ле-Шаталье направление вызывает ..... гидролиза
Правильные варианты ответа: УСИЛЕНИЕ; усиление; Усиление;
Задание {{ 376 }} ТЗ № 119
Дополните
Согласно электролитической теории кислот и оснований, основание - это вещество, поставляющее электронные пары для образования химической связи - ..... электронных пар
Правильные варианты ответа: донор; Донор; ДОНОР;
Задание {{ 377 }} ТЗ № 120
Дополните
Согласно электронной теории кислот и оснований, кислота - вещество, принимающее электронные пары - .....электронных пар
Правильные варианты ответа: акцептор; АКЦЕПТОР; Акцептор;
ОВР
Задание {{ 389 }} ТЗ № 4
Отметьте правильный ответ
Из перечисленных ниже веществ самым сильным окислителем является:
R фтор
£ кислород
£ платина
£ плавиковая кислота
Задание {{ 390 }} ТЗ № 5
Отметьте правильный ответ
Степень окисления кислорода а) в воде и б) в пероксиде водорода соответственно равны:
£ а) -2; б) +2
£ а) -2; б) -2
R а) -2; б) -1
£ а) +2; б) 0
Задание {{ 391 }} ТЗ № 6
Отметьте правильный ответ
Степень окисления хрома а) в хромате и б) дихромате калия соответственно равны:
R а) +6 и б) +6
£ а) +6 и б) +3
£ а) +3 и б) +6
£ а) -6 и б) +6
Задание {{ 392 }} ТЗ № 7
Отметьте правильный ответ
Степень окисления марганца а) в перманганате калия и б) в манганате натрия соответственно равны:
R а) +7; б) +6
£ а) +6 и б) +3
£ а) +3 и б) +6
£ а) -6 и б) +6
Задание {{ 393 }} ТЗ № 8
Отметьте правильный ответ
Степень окисления марганца а) в перманганате калия и б) в манганате натрия соответственно равны:
R а) +7; б) +6
£ а) +7; б) +4
£ а) +3 и б) +6
£ а) -6 и б) +6
Задание {{ 394 }} ТЗ № 9
Отметьте правильный ответ
Окислительно-восстановительной является реакция:
£ t
NH4Cl ® NH3 + HCl
R t
2NaNO3 ® 2NaNO2 + O2
£ Na2O + SO3 ® Na2SO4
£ t
2Fe(OH)3 ® Fe2O3 + 3H2O
Задание {{ 395 }} ТЗ № 10
Отметьте правильный ответ
Среди следующих процессов окислением является:
£ MnO4- + 8H+ + 5e- ® Mn2+ + 4H2O
£ Cu2+ + 2e- ® Cu0
£ Cl2 + 2e- ® 2Cl
R S2- + 4H2O ® SO42- + 8H+ + 8e-
Задание {{ 396 }} ТЗ № 11
Отметьте правильный ответ
Какой из следующих процессов не является окислительно-восстановительным:
£ фотосинтез
R гашение извести
£ горение природного газа
£ коррозия металла
Задание {{ 397 }} ТЗ № 12
Отметьте правильный ответ
Какое из перечисленных веществ может проявлять только восстановительные свойства:
£ сульфит натрия
R сульфид натрия
£ сульфат натрия
£ сера
Задание {{ 398 }} ТЗ № 13
Отметьте правильный ответ
Ниже перечислены вещества, способные проявлять как окислительные, так и восстановительные свойства:
£ H2O, Li, HNO3
R H2O2, SO2, HNO2
£ F2, HF, HClO
£ Na, Ne, O3
Задание {{ 399 }} ТЗ № 14
Отметьте правильный ответ
Укажите уравнение реакции, в котором атом - окислитель и атом - восстановитель находятся в составе одной и той же молекулы:
£ 4FeS2 + 11O2 = 2Fe2O3 + 8SO2
R 2KClO3 = 2KCl + 3O2
£ CuO + CO = Cu + CO2
£ £ гидролизом
£ электрификацией
R электролизом
£ этерификацией
Задание {{ 401 }} ТЗ № 16
Отметьте правильный ответ
Какое из веществ даёт одинаковые продукты при электролизе водного раствора и расплава:
R CuCl2
£ KBr
£ NaOH
£ таких веществ не бывает
Задание {{ 402 }} ТЗ № 17
Отметьте правильный ответ
Какой продукт не образуется при электролизе раствора KJ:
R K
£ KOH
£ H2
£ J2
Задание {{ 403 }} ТЗ № 18
Отметьте правильный ответ
При электролизе раствора нитрата серебра на катоде выделятся:
R серебро
£ водород
£ серебро и водород
£ кислород и водород
Задание {{ 404 }} ТЗ № 19
Отметьте правильный ответ
Какое из следующих схем представляет собой процесс восстановления:
£ Sn0 ® Sn4+
£ K0 ® K+
R 2JO3- ® J2
£ MnO42- ® MnO4-
Задание {{ 378 }} ТЗ № 75
Дополните
Масса дихромата калия (в присутствии серной кислоты), необходимое для окисления 14г железа равна ____ г.
Запишите число с точностью до сотых.
Правильные варианты ответа: 36,75; 36.75;
Задание {{ 379 }} ТЗ № 76
Дополните
При взаимодействии иодида калия с перманганатом калия в сернокислом растворе образовалось 1,2г сульфата марганца (II). Масса вступившего в реакцию иодида калия равна ______ г. Запишите число с точностью до сотых.
Правильные варианты ответа: 6,64; 6.64;
Задание {{ 380 }} ТЗ № 77
Дополните
Хлорид железа (II) окислили хлором до хлорида железа (III), при этом получили 3,25г хлорида железа (III), что составило 80% от теоретического. Объем хлора (н.у.), израсходованный при этом равен ______г.
Правильные варианты ответа: 0,28;
Задание {{ 381 }} ТЗ № 78
Дополните
Алюминий массой 0,81г внесли в раствор массой 200г с массовой долей серной кислоты 2,45%. Объем водорода (н.у.), выделившийся при этом равен ____ л.
Запишите число с точностью до тысячных.
Правильные варианты ответа: 1,008; 1.008;
Задание {{ 382 }} ТЗ № 79
Дополните
Газ, полученный при действии избытка концентрированного раствора серной кислоты на 3,84г меди, пропущен через раствор, содержащий 7,84г гидроксида калия. Масса образующейся соли равна ___ г.
Запишите число с точностью до сотых.
Правильные варианты ответа: 9,48; 9.48;
Задание {{ 383 }} ТЗ № 80
Дополните
В реакцию, выражаемой схемой
KMnO4 + HCl ® MnCl2 + Cl2 + KCl + H2O
вступило 6,32г перманганата калия. Объем выделившегося при этом хлора (измерен при 250 и давлении 200кПа) равен ______ л. Запишите число с точностью до сотых.
Правильные варианты ответа: 1,24; 1.24;
Задание {{ 384 }} ТЗ № 81
Дополните
В реакцию, выражаемой схемой
H2O2 + KMnO4 + H2SO4 ® O2 + K2SO4 + MnSO4 + H2O
вступило 6,8г пероксида водорода. Объем кислорода (н.у.), образовавшийся при этом равен ______ л.
Запишите число с точностью до сотых.
Правильные варианты ответа: 4,48; 4.48;
Задание {{ 385 }} ТЗ № 82
Дополните
Через расплавленный оксид алюминия пропускали постоянный ток силой 16А в течении трех часов. Масса алюминия, выделившегося на катоде равна _____ г.
Запишите число с точностью до десятых.
Правильные варианты ответа: 16,1; 16.1;
Задание {{ 386 }} ТЗ № 1
Отметьте правильный ответ
Любая окислительно-восстановительная реакция (ОВР) включает два процесса:
£ гидролиз и диссоциацию
£ ионизацию и диссоциацию
R окисление и восстановление
£ выделение и поглощение теплоты
Задание {{ 387 }} ТЗ № 2
Отметьте правильный ответ
Окислитель - это атом, молекула или ион, который …
£ увеличивает свою степень окисления
R принимает электроны
£ окисляется
£ отдает свои электроны
Задание {{ 388 }} ТЗ № 3
Отметьте правильный ответ
Степень окисления - это …
£ отрицательный логарифм концентрации ионов окислителя в растворе
R условный заряд атома в молекуле, вычисленный исходя из предположения, что все связи в молекуле - ионные
£ число, показывающее, со сколькими одновалентными атомами может соединяться атом данного элемента
£ условный заряд атома в молекуле, вычисленный исходя из предположения, что все связи в молекуле - ковалентные
Задание {{ 405 }} ТЗ № 20
Отметьте правильный ответ
Указать в какой из приведенных схем происходит окисление азота:
£ NO3- ® NO
£ NO2 ® NO2
R NH4+ ® N2
£ N2 ® NH4+
Задание {{ 406 }} ТЗ № 21
Отметьте правильный ответ
В какой из нижеприведенных схем реакций хлор восстанавливается:
£ HCl + MnO2 = Cl2 + MnCl2 + H2O
R H2S + HClO ®H2SO4 + HCl
£ AgNO3 + NaCl ® AgCl + NaNO3
£ KOH + HCl ® KCl + H2O
Задание {{ 407 }} ТЗ № 22
Отметьте правильный ответ
В какой из приведенных схем реакций марганец восстанавливается:
£ K2MnO4 + Cl2 ® KMnO4 + KCl
£ MnSO4 + NaBiO3 + HNO3 ® HMnO4 + Bi(NO3)2 + Na2SO4 + NaNO3 + H2O
£ MnCl2 + H2O ® MnOHCl + HCl
R H2S + KMnO4 + H2SO4 ® S + MnSO4 + H2SO4 + H2O
Задание {{ 408 }} ТЗ № 23
Отметьте правильный ответ
Допишите схему реакции
Cu + HNO3(разб.) ®
укажите верный коэффициент перед окислителем
R 8
£ 4
£ 10
£ 16
Задание {{ 409 }} ТЗ № 24
Отметьте правильный ответ
Допишите схему реакции окисления-восстановления:
Cu + HNO3(конц.) ®
укажите верную сумму всех коэффициентов
R 10
£ 13
£ 8
£ 12
Задание {{ 410 }} ТЗ № 25
Отметьте правильный ответ
Коэффициент перед формулой окислителя в уравнении реакции между алюминием и бромом равен:
£ 1
R 3
£ 2
£ 4
Задание {{ 411 }} ТЗ № 26
Отметьте правильный ответ
Коэффициенты перед формулами восстановителя и окислителя в уравнении реакции, схема которой
P + KClO3 ® KCl + P2O5,
£ 5 и 6
R 6 и 5
£ 3 и 5
£ 5 и 3
Задание {{ 412 }} ТЗ № 27
Отметьте правильный ответ
Коэффициент перед формулой восстановителя в уравнении реакции, схема которой
Mg + HNO3 ® N2O + Mg(NO3)2 + H2O,
равен
£ 3
R 4
£ 5
£ 6
Задание {{ 413 }} ТЗ № 28
Отметьте правильный ответ
В схеме реакции
C + HNO3 ® NO2 + CO2 + H2O
коэффициент перед формулой восстановителя равен
R 1
£ 2
£ 3
£ 4
Задание {{ 414 }} ТЗ № 29
Отметьте правильный ответ
Подберите коэффициенты методом электронного баланса в уравнении реакции окисления-восстановления.
HClO3 ® HClO4 + ClO2 + H2O
Укажите коэффициент перед HClO3
R 3
£ 5
£ 4
£ 7
Задание {{ 415 }} ТЗ № 30
Отметьте правильный ответ
Подберите коэффициенты методом электронного баланса в уравнении реакции
MnO2 + KClO3 + KOH ® K2MnO4 + KCl + H2O
укажите верный коэффициент перед восстановителем
£ 5
£ 7
R 3
£ 1
Задание {{ 416 }} ТЗ № 31
Отметьте правильный ответ
Закончите уравнение реакции и подобрате коэффициенты:
Ca + HNO3(конц.) ® N2O + …
и укажите общую сумму коэффициентов в уравнении
£ 19
R 24
£ 14
£ 15
Задание {{ 417 }} ТЗ № 32
Отметьте правильный ответ
Подберите коэффициенты в уравнении окисления-восстановления
S + KOH ® K2S + K2SO3 + H2O
и укажите общую сумму коэффициентов в уравнении
R 15
£ 9
£ 11
£ 13
Задание {{ 418 }} ТЗ № 33
Отметьте правильный ответ
При электролизе водных растворов каких веществ на катоде будет выделяться водород:
£ CuSO4
R K2SO4
£ NiSO4
£ H2SO4
Задание {{ 419 }} ТЗ № 34
Отметьте правильный ответ
В какой последовательности восстанавливаются данные металлы при электролизе растворов их солей:
£ Au, Cu, Ag, Fe
£ Cu, Ag, Fe, Au
£ Fe, Cu, Ag, Au
R Au, Ag, Cu, Fe
Задание {{ 420 }} ТЗ № 35
Отметьте правильный ответ
Какой коэффициент должен стоять перед восстановителем в реакции: H2S + H2SO4 ® S + H2O
£ 2
R 3
£ 5
£ 6
Задание {{ 421 }} ТЗ № 36
Отметьте правильный ответ
Какой из нижеприведенных ионов может являться только восстановителем:
£ Na+
£ S+4
£ N+4
R S-2
Задание {{ 422 }} ТЗ № 37
Отметьте правильный ответ
Во время превращения SO2-3 ® SO2-4 степень окисления одного из элементов повышается (от ® до)
£ от +3 до +7
£ от +3 до +5
£ от +6 до +7
R от +4 до +6
Задание {{ 423 }} ТЗ № 38
Отметьте правильный ответ
В результате реакции
H2S + SO2 ® S + H2O, когда начальный объем сероводорода равен 22,4л (н.у.), получается сера массой:
£ 24
£ 32
R 48
£ 64
Задание {{ 424 }} ТЗ № 39
Отметьте правильный ответ
При электролизе водного раствора сульфата меди с инертным анодом образуются следующие продукты:
R на катоде - медь, на аноде - кислород, в растворе - серная кислота
£ на катоде - водород, на аноде сера, в растворе - сульфат меди
£ на катоде - медь, на аноде - сера, в растворе - гидроксид меди
£ на катоде - водород, на аноде - сера, в растворе - вода
Задание {{ 425 }} ТЗ № 40
Отметьте правильный ответ
При электролизе водного раствора нитрата калия с инертным анодом образуются следующие продукты:
R на катоде - водород, на аноде - кислород, в растворе - нитрата калия
£ на катоде - калий, на аноде - кислород, в растворе - азотная кислота
£ на катоде - калий, на аноде - азот, в растворе - гидроксид калия
£ на катоде - водород, на аноде - оксид азота (IV), в растворе - вода
Задание {{ 426 }} ТЗ № 41
Отметьте правильный ответ
В раствор медного купороса погрузили железную пластинку. Определите сколько граммов меди на ней выделилось, если масса её увеличилась на 1,2г.
£ 4,8
R 9,6
£ 10,2
£ 5,1
Задание {{ 427 }} ТЗ № 42
Отметьте правильный ответ
Кусок марганца опустили в раствор сульфата олова (II). Масса образца марганца увеличилась на 1,28г. Сколько граммов марганца перешло в раствор.
R 1,1
£ 2,3
£ 1,5
£ 2,8
Задание {{ 428 }} ТЗ № 43
Отметьте правильный ответ
На сколько граммов изменится масса пятиграммовой железной пластинки при выдерживании её в растворе, содержащем 1,6г сульфата меди.
R 0,08
£ 1,05
£ 0,04
£ 0,16
Задание {{ 429 }} ТЗ № 44
Отметьте правильный ответ
В раствор нитрата серебра погрузили медную пластинку массой 40г. После полного вытеснения серебра масса пластинки стала равной 43,04г. Сколько граммов нитрата серебра содержалось в растворе.
R 6,8
£ 3,4
£ 5,6
£ 7,2
Задание {{ 430 }} ТЗ № 45
Отметьте правильный ответ
Сколько граммов йода выделится на аноде при электролизе расплава иодида натрия, если на катоде выделится натрий массой 69г.
£ 190,5
R 381
£ 127
£ 254
Задание {{ 431 }} ТЗ № 46
Отметьте правильный ответ
При электролизе водного раствора гидроксида калия с инертными электродами на катоде выделился молекулярный водород, объем которого (при н.у.) равен 33,6л. Какой объём в литрах кислорода выделится при этом на аноде.
R 16,8
£ 11,2
£ 22,4
£ 5,6
Задание {{ 432 }} ТЗ № 47
Отметьте правильный ответ
Сколько граммов гидроксида натрия образуется в растворе при электролизе водного раствора хлорида натрия, если на катоде выделяется 7,84л газа (н.у.).
R 28
£ 56
£ 16
£ 64
Задание {{ 433 }} ТЗ № 48
Отметьте правильный ответ
Сколько граммов азотной кислоты образуется в растворе при электролизе водного раствора нитрата меди, если на катоде выделяется 16г вещества.
R 31,5
£ 63
£ 21,5
£ 42,5
Задание {{ 434 }} ТЗ № 49
Отметьте правильный ответ
Сколько граммов газа выделится на аноде при полном электролизе 160г 5% водного раствора сульфата меди.
R 0,8
£ 1,6
£ 6,4
£ 3,2
Задание {{ 435 }} ТЗ № 50
Отметьте правильный ответ
В раствор нитрата серебра погрузили медную пластинку массой 80г. После полного вытеснения серебра масса пластинки увеличилась на 7,6%. Сколько граммов серебра содержалось в растворе.
£ 4,32
R 8,64
£ 2,16
£ 6,48
Задание {{ 436 }} ТЗ № 51
Отметьте правильный ответ
При электролизе раствора медного купороса на аноде выделилось 2,8л газа (н.у.). Сколько граммов вещества выделилось на катоде.
R 16
£ 32
£ 8
£ 48
Задание {{ 437 }} ТЗ № 52
Отметьте правильный ответ
В результате электролиза расплава хлорида металла, образующего трехзарядный катион, на аноде выделилось 672мл газа (н.у.), а на катоде - 0,54г металла. Хлорид какого металла подвергли электролизу. (укажите верную молярную массу хлорида.)
R 133,5
£ 162,5
£ 118,5
Задание {{ 438 }} ТЗ № 53
Отметьте правильный ответ
В разбавленной азотной кислоте было растворено 2 моля магния. Сколько граммов азотной кислоты было израсходовано только на процесс окисления магния, если одним из продуктов реакции является азот.
R 50,4
£ 25,2
£ 28,6
£ 63,6
Задание {{ 439 }} ТЗ № 54
Отметьте правильный ответ
В разбавленной азотной кислоте было растворено 24г металлической меди. Сколько граммов азотной кислоты было израсходовано только на процесс солеобразования.
R 47,25
£ 48,95
£ 50,35
£ 28,95
Задание {{ 440 }} ТЗ № 55
Отметьте правильный ответ
Сколько граммов 7,45%-го раствора хлорида калия следует подвергнуть электролизу, чтобы выделившийся газ вытеснить 16г брома из бромида калия.
R 200
£ 150
£ 400
£ 380
Задание {{ 441 }} ТЗ № 56
Отметьте правильный ответ
Продуктами электролиза расплава гидроксида калия являются (анод нерастворимый):
R K, O2, H2O
£ H2, O2, H2O
£ K2O, O2, H2
£ KO2, H2, H2O
Задание {{ 442 }} ТЗ № 57
Отметьте правильный ответ
Продуктами электролиза раствора гидроксида натрия являются (анод инертный):
R H2 и O2
£ Na2O и H2
£ H2O и O2
£ H2O и H2
Задание {{ 443 }} ТЗ № 58
Дополните
Электролиз раствора сульфата меди сопровождается выделением газа
Правильные варианты ответа: кислорода; кислород; Кислорода; Кислород;
Задание {{ 444 }} ТЗ № 59
Дополните
При электролизе водных растворов, содержащих смесь катионов Ag+, Fe2+, Cu2+ и Zn2+, раньше восстанавливаются на катоде катионы
Правильные варианты ответа: Серебра; серебра; Серебро; серебро;
Задание {{ 445 }} ТЗ № 60
Отметьте правильный ответ
Одинаковые продукты электролиза получаются при электролизе расплава и раствора следующего соединения:
R CuCl2
£ CuSO4
£ Cu(NO3)2
£ KCl
Задание {{ 446 }} ТЗ № 61
Отметьте правильный ответ
Из указанных окислительно-восстановительных процессов с участием воды протекает:
£ электролиз
NaCl + ... ® Na + Cl2
R CaH2 + ... ® Ca(OH)2 + H2
£ 2ZnS + ... ® 2SO2 + 2ZnO
£ электролиз
2CuSO4 + ... ® 2Cu + O2 + 2SO3
Задание {{ 447 }} ТЗ № 62
Отметьте правильный ответ
В реакции магния с концентрированной азотной кислотой окислителем является
£ Mg2+
£ H+
£ Mg0
R NO3-
Задание {{ 448 }} ТЗ № 63
Отметьте правильный ответ
При электролизе водного раствора нитрата натрия на аноде выделяется
£ NO2
£ N2
£ H2
R O2
Задание {{ 449 }} ТЗ № 64
Отметьте правильный ответ
Сульфит калия в водных растворах
£ проявляет только окислительные свойства
£ проявляет только восстановительные свойства
R проявляет как окислительные, так и восстановительные свойства
£ не проявляет окислительно-восстановительных свойств
Задание {{ 450 }} ТЗ № 65
Отметьте правильный ответ
Сульфид натрия в водных растворах
£ проявляет только окислительные свойства
R проявляет только восстановительные свойства
£ проявляет как окислительные, так и восстановительные свойства
£ не проявляет окислительно-восстановительных свойств
Задание {{ 451 }} ТЗ № 66
Отметьте правильный ответ
Продуктами электролиза водного раствора сульфата ртути (II) на инертных электродах являются
R Hg, O2, H2SO4
£ HgO, H2, H2SO4
£ Hg2O, H2, O2
£ Hg, H2, H2O
Задание {{ 452 }} ТЗ № 67
Отметьте правильный ответ
Наиболее сильным окислителем является
£ O2
£ N2
R F2
£ I2
Задание {{ 453 }} ТЗ № 68
Дополните
При электролизе раствора иодида натрия у катода окраска лакмуса в растворе
Правильные варианты ответа: синяя; Синяя;
Задание {{ 454 }} ТЗ № 69
Дополните
При электролизе раствора сульфата меди у анода окраска лакмуса в растворе
Правильные варианты ответа: красная; Красная;
Задание {{ 455 }} ТЗ № 70
Дополните
При электролизе раствора сульфата калия окраска фенолфталеина (раствор)
Правильные варианты ответа: бесцветная; Бесцветная;
Задание {{ 456 }} ТЗ № 71
Отметьте правильный ответ
Среди следующих процессов окислением является
£ MnO4- + 8H+ + 5e ® Mn2+ + 4H2O
£ Cu2+ + 2e ® Cu0
£ Cl2 + 2e ® 2Cl-
R S2- + 4H2O ® SO42- + 8H+ + 8e
Задание {{ 457 }} ТЗ № 72
Дополните
В реакции
KMnO4 + K2SO3 + KOH → K2MnO4 + K2SO4 + H2O
Элементом – восстановителем является( Запишите название элемента)…
Правильные варианты ответа: сера; Сера;
Задание {{ 458 }} ТЗ № 73
Дополните
Сумма коэффициентов в левой части уравнения реакции
Cu + HNO3 ® Cu(NO3)2 + NO + H2O равна (ответ дать цифрами)..
Правильные варианты ответа: 11;
Задание {{ 459 }} ТЗ № 74
Дополните
Сумма коэффициентов в уравнении реакции
As2S3 + HNO3 + H2O ® H3AsO4 + H2SO4 + NO равна (ответ дать цифрами)
Правильные варианты ответа: 78;
Металлы и их соединения
Задание {{ 460 }} ТЗ № 1
Отметьте правильный ответ
Какой из приведенных металлов взаимодействует с водой при повышенных температурах
£ Li
£ К
R Fe
£ Са
Задание {{ 461 }} ТЗ № 2
Отметьте правильный ответ
Какой из приведенных металлов взаимодействует с разбавленной серной кислотой
£ Ag
£ Cu
£ Hg
R Fe
Задание {{ 462 }} ТЗ № 3
Отметьте правильный ответ
Какой металл не будет растворяться в концентрированной серной кислоте
£ Cu
£ Ag
R Au
£ Hg
Задание {{ 463 }} ТЗ № 4
Отметьте правильный ответ
Какой металл не растворяется в концентрированной азотной кислоте
£ Ag
£ Cu
£ Pb
R Au
Задание {{ 464 }} ТЗ № 5
Отметьте правильный ответ
При взаимодействии щелочных металлов с водой образуются
R щелочи и водород
£ гидриды и кислород
£ пероксиды и водород
£ супероксиды и озон
Задание {{ 465 }} ТЗ № 6
Отметьте правильный ответ
Самым распространенным металлом на Земле является
£ натрий
£ кальций
£ железо
R алюминий
Задание {{ 466 }} ТЗ № 7
Отметьте правильный ответ
Какой металл растворяется и в соляной кислоте и в растворе гидроксида натрия
R Al
£ Fe
£ Cu
£ Mg
Задание {{ 467 }} ТЗ № 8
Отметьте правильный ответ
Металл, образующий оксиды трех типов (основной, амфотерный, кислотный) - это
R хром
£ алюминий
£ железо
£ барий
Задание {{ 468 }} ТЗ № 9
Отметьте правильный ответ
В виде свободного металла алюминий в природе не встречается, он входит в состав нескольких руд и минералов, например таких, как…
£ мрамор кварц, бура
£ асбест, битум, гликоль
£ бирюза, малахит, пирит
R боксит, глинозем, нефелин
Задание {{ 469 }} ТЗ № 10
Отметьте правильный ответ
При высоких температурах алюминий реагирует с азотом, образуя
R нитриды
£ нитриты
£ нитраты
£ нейтроны
Задание {{ 470 }} ТЗ № 11
Отметьте правильный ответ
Медь, серебро и золото проводят электрический ток несравненно лучше других металлов. Это объясняется…
R их внешней электронной конфигурацией md10ns1
£ их большой плотностью
£ их высокими температурами плавления
£ их высокой пластичностью
Задание {{ 471 }} ТЗ № 12
Отметьте правильный ответ
Хром, также как алюминий и железо
R пассивируется холодными концентрированными HNO3 и H2SO4
£ образует типичный кислотный оксид
£ способен образовывать соединения со степенью окисления +6
£ образует оксид со степенью окисления +3 зеленого цвета
Задание {{ 472 }} ТЗ № 13
Отметьте правильный ответ
Оксид хрома (VI) - это
R ангидрид хромовой и дихромовой кислот
£ типичный амфотерный оксид
£ легколетучая жидкость при комнатной температуре
£ идеальный растворитель органических соединений
Задание {{ 473 }} ТЗ № 14
Отметьте правильный ответ
Цинк - металл серебристо-белого цвета. В лабораториях его часто используют
R для получения водорода из разбавленной соляной кислоты
£ в качестве катализатора органических реакций
£ как осушитель от паров воды
£ для получения озона при взаимодействии с пероксидом водорода
Задание {{ 474 }} ТЗ № 15
Отметьте правильный ответ
Серебро так же, как и медь, не может
R реагировать с разбавленными соляной и серной кислотами
£ растворяться в концентрированной серной кислоте
£ растворяться в разбавленной азотной кислоте
£ образовывать соединения со степенью окисления +1
Задание {{ 475 }} ТЗ № 16
Отметьте правильный ответ
С водой при комнатной температуре реагируют оба металла, указанные в паре
£ барий и медь
£ цинк и ртуть
R кальций и калий
£ серебро и натрий
Задание {{ 476 }} ТЗ № 17
Отметьте правильный ответ
Какой из приведенных металлов взаимодействует с водой при повышенных температурах
£ Li
£ K
R Fe
£ Ca
Задание {{ 477 }} ТЗ № 18
Отметьте правильный ответ
Все элементы главных подгрупп I и II групп периодической системы, а также гелий относят к …
£ типичным окислителям
£ типичным металлам
£ переходным элементам
R s-элементам
Задание {{ 478 }} ТЗ № 19
Отметьте правильный ответ
Все s-элементы, кроме водорода и гелия, являются…
£ газообразными веществами без цвета и запаха
£ жидкостями при комнатной температуре
R металлами
£ полупроводниками
Задание {{ 479 }} ТЗ № 20
Отметьте правильный ответ
Назовите металл, который почти вдвое легче воды
R литий
£ радий
£ натрий
£ стронций
Задание {{ 480 }} ТЗ № 21
Отметьте правильный ответ
Гидроксид алюминия проявляет амфотерные свойства при взаимодействии
£ только со щелочью
£ только с кислотой
R с кислотой и щелочью
£ с солью и кислотой
Задание {{ 481 }} ТЗ № 22
Отметьте правильный ответ
Все щелочные металлы горят в атмосфере кислорода, образуя
£ пероксиды состава Ме2О2
£ оксиды состава Ме2О
£ супероксиды состава МеО2
R пероксиды Ме2О2 или супероксиды МеО2
Задание {{ 482 }} ТЗ № 23
Отметьте правильный ответ
С каким из водных растворов электролитов будет реагировать железо
£ KCl
£ MnSO4
R HCl
£ ZnSO4
Задание {{ 483 }} ТЗ № 24
Отметьте правильный ответ
При взаимодействии металлов с водой образуются
£ гидриды и кислород
R щелочи и водород
£ пероксиды и водород
£ супероксиды и озон
Задание {{ 484 }} ТЗ № 25
Отметьте правильный ответ
Амид бария имеет формулу
£ BaH2
£ Ba3N2
£ Ba(NO2)2
R Ba(NH2)2
Задание {{ 485 }} ТЗ № 26
Отметьте правильный ответ
Электролиз водного раствора хлорида натрия - это способ одновременного получения…
£ натрия и кислорода
£ гидрида натрия, хлора и кислорода
R гидроксида натрия, хлора и водорода
£ натрия, хлора и водорода
Задание {{ 486 }} ТЗ № 27
Отметьте правильный ответ
В схеме превращений
+A +Б +В
FeCl3  Fe(OH)3
Fe(OH)3 FeCl3
FeCl3 AgCl
AgCl
Веществами А, Б, В соответственно являются
£ Н2O, NaOH, AgNO3
R NaOH, HCl, AgNO3
£ H2O, HCl, AgNO3
£ NaOH, NaCl, AgNO3
Задание {{ 487 }} ТЗ № 28
Отметьте правильный ответ
C концентрированной азотной кислотой не будет взаимодействовать
£ Cu
R Al
£ Zn
£ Ag
Задание {{ 488 }} ТЗ № 29
Отметьте правильный ответ
Горение калия в кислороде приводит к образованию
£ K2O
R K2O2
£ KO2
£ K3O
Задание {{ 489 }} ТЗ № 30
Отметьте правильный ответ
При взаимодействии 3,42г щелочного металла с водой выделяется 448мл водорода (н.у.). Этот щелочной металл
£ К
£ Na
R Rb
£ Cs
Задание {{ 490 }} ТЗ № 31
Отметьте правильный ответ
Временная жесткость воды обусловлена присутствием в ней
R Ca(HCO3)2; Mg(HCO3)2
£ CaCO3; MgCO3
£ CaCl2; MgCl2
£ CaSO4; MgSO4
Задание {{ 491 }} ТЗ № 32
Отметьте правильный ответ
Масса (г) гидроксида кальция, получаемая из 6,4г карбида кальция, равна
£ 14,8
R 7,4
£ 3,7
£ 5,6
Задание {{ 492 }} ТЗ № 33
Отметьте правильный ответ
В железной руде обычно присутствует сера в виде FeS2 . Сера в процессе обжига превращается в
R SO2
£ H2S
£ CS2
£ SO3
Задание {{ 493 }} ТЗ № 34
Отметьте правильный ответ
При взаимодействии 2,12г карбоната одновалентного металла с кислотой выделилось 448 мл углекислого газа (н.у.). Молярная масса этого карбоната равна
R 106
£ 138
£ 84
£ 160
Задание {{ 494 }} ТЗ № 35
Отметьте правильный ответ
Какую кислоту следует взять для растворения медно-серебряного сплава
£ соляную
R азотную
£ фосфорную
£ угольную
Задание {{ 495 }} ТЗ № 36
Отметьте правильный ответ
Серебро, так же как и медь, не может
£ растворяться в концентрированной серной кислоте
£ растворяться в разбавленной азотной кислоте
R реагировать с разбавленными соляной и серной кислотами
£ образовывать соединения со степенью окисления +1
Задание {{ 496 }} ТЗ № 37
Отметьте правильный ответ
Оксид цинка ZnO - это
£ один из сильнейших окислителей
R амфотерное вещество
£ ангидрид цинковатистой кислоты
£ газообразное вещество
Задание {{ 497 }} ТЗ № 38
Отметьте правильный ответ
Для качественного обнаружения катионов Fe2+ используют реакцию с
£ желтой кровяной солью
£ гексацианоферратом (II) калия
£ роданидом аммония
R красной кровяной солью
Задание {{ 498 }} ТЗ № 39
Отметьте правильный ответ
При внесении гидроксида цинка в раствор едкого натра
£ образуется цинкат натрия Na2ZnO2 и водород
£ выделяется осадок пентагидрата цинката натрия и кислород
R образуется комплексная соль тетрагидроксицинката натрия Na2[Zn(OH)4]
£ реакция не происходит, поскольку Zn(OH)2 не растворим в щелочах
Задание {{ 499 }} ТЗ № 40
Отметьте правильный ответ
При взаимодействии железа с концентрированной хлороводородной кислотой образуется
£ FeCl3 и H2
R FeCl2 и H2
£ Fe(OH)Cl3 и H2O
£ Fe(OH)2Cl и H2
Задание {{ 500 }} ТЗ № 41
Отметьте правильный ответ
Как можно очистить раствор сульфата железа (II) от примеси сульфата меди(II)
£ добавить раствор BaCl2
£ добавить раствор AgNO3
R опустить в раствор на некоторое время железный гвоздь
£ осторожно прилить к раствору царскую водку
Задание {{ 501 }} ТЗ № 42
Отметьте правильный ответ
Литий массой 10,50г вступил в реакцию с 300г воды. Раствор какого вещества получился при этом? Массовая доля его в растворе в % равна
£ 10,53
R 11,65
£ 12,65
£ 13,65
Задание {{ 502 }} ТЗ № 43
Отметьте правильный ответ
После пропускания 11,2 л СО2 (н.у.) через раствор КОН образовалось 57,6г смеси кислой и средней солей. Определите массу средней соли
R 27,6
£ 31,5
£ 24,7
£ 30,1
Задание {{ 503 }} ТЗ № 44
Отметьте правильный ответ
Железную пластинку массой 5,2г продолжительное время выдерживали в растворе, содержащем 2,6г сульфата меди. По окончании реакции пластинку вынули из раствора и высушили. Чему стала равна ее масса
R 5,28
£ 6,03
£ 4,75
£ 7,15
Задание {{ 504 }} ТЗ № 45
Отметьте правильный ответ
К раствору, содержащему 20г гидроксида натрия, прибавили 70г 30%-ного раствора азотной кислоты. Какой цвет будет иметь лакмус в полученном растворе
£ красный
£ фиолетовый
R синий
£ желтый
Задание {{ 505 }} ТЗ № 46
Отметьте правильный ответ
Какую массу (г) алюминия нужно ввести в реакцию с 7,6г оксида хрома (III), чтобы получить чистый хром
£ 0,27
£ 5,4
R 2,7
£ 0,54
Задание {{ 506 }} ТЗ № 47
Отметьте правильный ответ
Полная взаимная растворимость серебра и золота объясняется тем, что
£ оба металла имеют близкие физические свойства
£ атомы обоих металлов имеют полное заполнение d-орбиталей и помещаются в I группе периодической системы
R оба металла имеют одинаковые кристаллические структуры и почти одинаковые атомные радиусы
£ оба металла имеют разные физические свойства
Задание {{ 507 }} ТЗ № 48
Отметьте правильный ответ
При полном восстановлении порошка оксида меди (II) массой 79,5г водородом образовалась металлическая медь массой
£ 32,75
R 63,6
£ 79,5
£ 54,1
Задание {{ 508 }} ТЗ № 49
Отметьте правильный ответ
При полном восстановлении водородом 14,4г оксида металла (II) образовалось 11,2г этого металла. Оксид какого металла был подвергнут восстановлению? В ответе укажите его химический символ
£ Cu
£ Mg
R Fe
£ Ba
Задание {{ 509 }} ТЗ № 50
Отметьте правильный ответ
Характерные степени окисления элементов II группы главной подгруппы равны
£ +1
£ +2
£ +1; +2
R 0; +2
Задание {{ 510 }} ТЗ № 51
Отметьте правильный ответ
В схеме превращений
+H2O +H2SO4 + BaCl2
Na  X1
X1  X2
X2  X3 веществами Х1, Х2 Х3 являются соответственно
X3 веществами Х1, Х2 Х3 являются соответственно
R NaOH, Na2SO4, BaSO4
£ Na2O, Na2SO4, NaOH
£ Na2O, Na2SO4, BaSO4
£ Na2O2, NaOH, BaSO4
Задание {{ 511 }} ТЗ № 52
Отметьте правильный ответ
Постоянная жесткость воды обусловлена присутствием
£ сульфатов и хлоридов натрия и калия
R сульфатов и хлоридов кальция и магния
£ карбонатов и гидрокарбонатов кальция и магния
£ сульфатов и хлоридов натрия и магния
Задание {{ 512 }} ТЗ № 53
Отметьте правильный ответ
При взаимодействии с щелочью 4,5г сплава алюминия с магнием выделилось 3,36л водорода (н.у.). Какова массовая доля (%) алюминия в сплаве
R 60
£ 40
£ 30
£ 75
Задание {{ 513 }} ТЗ № 54
Отметьте правильный ответ
При взаимодействии алюминия массой 8,1г с галогеном образовался галогенид алюминия массой 80,1г. Какой галоген был взят
£ F2
£ Cl2
R Br2
£ I2
Задание {{ 514 }} ТЗ № 55
Отметьте правильный ответ
Сплав железа с углеродом массой 5г поместили в соляную кислоту (кислота в избытке). По окончании реакции объем выделившегося водорода составил 1,96л (н.у.). Массовая доля углерода в сплаве равна
£ 1%
R 2%
£ 3%
£ 4%
Задание {{ 515 }} ТЗ № 56
Отметьте правильный ответ
Через раствор бихромата калия, содержащий 25г соли, пропустили 22,4л сероводорода (н.у.) (реакцию проводили в кислой среде). Масса образовавшейся серы в граммах равна
R 8,16
£ 9,16
£ 5,06
£ 18,6
Задание {{ 516 }} ТЗ № 57
Отметьте правильный ответ
Из 240кг пирита было получено 294кг серной кислоты. Рассчитайте выход серной кислоты
£ 89%
R 75%
£ 50%
£ 39,5%
Задание {{ 517 }} ТЗ № 58
Отметьте правильный ответ
1г смеси железа, оксида железа (II) и оксида железа (III) обработали избытком раствора соляной кислоты; при этом выделилось 112мл водорода (н.у.). При полном восстановлении водородом другой порции исходной смеси массой 1г получили 0,2115г воды. Определите массовые доли (%) компонентов в исходной смеси. В ответе укажите массовую долю оксида железа (II) с точностью до целых
R 36
£ 28
£ 16
£ 32
Задание {{ 518 }} ТЗ № 59
Отметьте правильный ответ
12,8г сплава меди с алюминием обработали избытком соляной кислоты. Остаток промыли и растворили в концентрированной азотной кислоте. Сухой остаток, полученный при выпаривании раствора прокалили, в результате осталось 4г твердого вещества. Массовая доля (%) меди в сплаве равна
R 25
£ 35
£ 65
£ 70
Задание {{ 519 }} ТЗ № 60
Отметьте правильный ответ
При взаимодействии 1,28г неизвестного металла с концентрированным раствором азотной кислоты образуется соль двухвалентного металла и выделяется 896 мл (н.у.) газа, содержащего 30, 43% азота и 69,57 % кислорода. Плотность газа по водороду равна 23,0. Установите неизвестный металл (В ответе укажите число протонов в атоме)
R 29
£ 22
£ 19
£ 26
Задание {{ 520 }} ТЗ № 61
Отметьте правильный ответ
Имеется смесь гашенной извести, карбоната и сульфата кальция. При обработке 31г этой смеси соляной кислотой выделилось 2,24л газа (н.у.) и осталось 13,6г твердого остатка. Определите состав смеси и в ответе укажите массу (г) гашенной извести с точностью до десятых
R 7,4
£ 13,6
£ 5,6
£ 11,2
Задание {{ 521 }} ТЗ № 62
Отметьте правильный ответ
Медь реагирует с концентрированной серной кислотой. При взаимодействии образовавшегося газа с избытком сероводорода получено 9,6г твердого вещества желтого цвета. Масса меди в граммах, вступившей в реакцию равна
£ 1,4
R 6,4
£ 7,4
£ 8,4
Задание {{ 522 }} ТЗ № 63
Отметьте правильный ответ
При обработке избытком соляной кислоты 15,5г смеси алюминия, магния и меди выделилось 7,84л (н.у.) газа. Нерастворившийся в соляной кислоте остаток растворился в концентрированной азотной кислоте с выделением 5,6л газа (н.у.). Масса магния (г) смеси равна
£ 3,8
R 4,8
£ 5,8
£ 6,8
Задание {{ 523 }} ТЗ № 64
Отметьте правильный ответ
Получение алюминия в промышленности основано на реакции
£ AlCl3 + 3K  Al + 3KCl
Al + 3KCl
R 2Al2O3  4Al + 3O2
4Al + 3O2
£ Al2(SO4)3 + 3Mg  2Al + 3MgSO4
2Al + 3MgSO4
£ Na3AlF6  3Na + Al + 3F2
3Na + Al + 3F2
Задание {{ 524 }} ТЗ № 65
Отметьте правильный ответ
Получение железа в промышленности основано на реакции
£ FeSO4 + Zn  ZnSO4 + Fe
ZnSO4 + Fe
£ 2FeCl3  2Fe + 3Cl2
2Fe + 3Cl2
R 2Fe2O3 + 3C  4Fe + 3CO2
4Fe + 3CO2
£ 3Fe3O4 + 8Al  9Fe + 4Al2O3
9Fe + 4Al2O3
Задание {{ 525 }} ТЗ № 66
Отметьте правильный ответ
Разложение нитрата железа (II) при нагревании описывается уравнением
£ Fe(NO3)2  Fe(NO2)2 + O2
Fe(NO2)2 + O2
£ 3Fe(NO3)2  2Fe(NO3)2 + Fe
2Fe(NO3)2 + Fe
£ Fe(NO3)2  FeO + N2O5
FeO + N2O5
R 4Fe(NO3)2  2Fe2O3 + 8NO2 + O2
2Fe2O3 + 8NO2 + O2
Задание {{ 526 }} ТЗ № 67
Отметьте правильный ответ
Растворение железа в 90%-ной серной кислоте при нагревании описывается уравнением
£ Fe + H2SO4  FeSO4 + H2
FeSO4 + H2
£ 2Fe + 3H2SO4  Fe2(SO4)3 + 3H2
Fe2(SO4)3 + 3H2
£ Fe + 2H2SO4  FeSO4 + SO2 + 2H2O
FeSO4 + SO2 + 2H2O
R 3Fe + 6H2SO4  Fe2(SO4)3 + 3SO2
Fe2(SO4)3 + 3SO2 + 6H2O
+ 6H2O
Задание {{ 527 }} ТЗ № 68
Отметьте правильный ответ
Растворение железа в 20%-ной азотной кислоте описывается уравнением
£ Fe + 2HNO3  Fe(NO3)2 + H2
Fe(NO3)2 + H2
£ Fe + 6HNO3  2Fe(NO3)2 + 3H2
2Fe(NO3)2 + 3H2
£ 3Fe + 8HNO3  3Fe(NO3)3 + 2NO
3Fe(NO3)3 + 2NO + 4H2O
+ 4H2O
R Fe + 4HNO3  Fe(NO3)3 + NO + H2O
Fe(NO3)3 + NO + H2O
Задание {{ 528 }} ТЗ № 69
Дополните
Масса алюминия, требуемая для получения водорода, необходимого для восстановления до металла оксида меди, который образовался при термическом разложении 6,66г малахита (CuOH)2CO3, равна ….. г. Запишите число с точностью до сотых
Правильные варианты ответа: 1,08; 1.08;
Задание {{ 529 }} ТЗ № 70
Дополните
При взаимодействии с кислотой 14,0г железа выделился водород в количестве, достаточном для восстановления 10,3г марганца из его оксида Mn3O4. При растворении в кислоте железо окислилось до степени окисления…. Запишите число без знака
Правильные варианты ответа: 2;
Задание {{ 530 }} ТЗ № 71
Отметьте правильный ответ
Две порции металлического алюминия, имеющие одинаковые массы, растворили: одну в растворе KOH, другую - в соляной кислоте. Объемы выделившихся газов (измеренные при одинаковых условиях) относятся между собой
£ 1:2
R 3:2
£ 1:3
£ 2:3
Задание {{ 531 }} ТЗ № 72
Отметьте правильный ответ
При действии избытка соляной кислоты на смесь алюминия с неизвестным одновалентным металлом выделилось 6,72л водорода (н.у.), а масса маталлов уменьшилось вдвое. При действии на нерастворившийся остаток азотной кислотой выделилось 0,5г NO. Молярное соотношение между алюминием и неизвестным металлом равно
R 4:1
£ 3:2
£ 3:4
£ 1:2
Задание {{ 532 }} ТЗ № 73
Дополните
При взаимодействии с кислородом литий образуется оксид, а остальные щелочные металлы.......... Запишите название образующихся соединений
Правильные варианты ответа: пероксиды; ПЕРОКСИДЫ; Пероксиды;
Задание {{ 533 }} ТЗ № 74
Отметьте правильный ответ
В ряду щелочных металлов от Li к Cs происходит
R увеличение восстановительных свойств
£ уменьшение радиуса атома
£ увеличение электроотрицательности
£ увеличение энергии ионизации
Задание {{ 534 }} ТЗ № 75
Отметьте правильный ответ
Основной способ получения щелочных металлов
R электролиз расплавов солей
£ электролиз растворов щелочей
£ электролиз растворов солей
£ восстановлением оксида водородом
Задание {{ 535 }} ТЗ № 76
Дополните
При взаимодействии щелочных металлов с водой выделяется...... Запишите название газа
Правильные варианты ответа: водород; Водород; ВОДОРОД;
Задание {{ 536 }} ТЗ № 77
Отметьте правильный ответ
Наиболее важными минералами натрия и калия является
R сильвинит
£ кальцит
£ доломит
£ нефелин
Задание {{ 537 }} ТЗ № 78
Отметьте правильный ответ
Жесткость воды - совокупность свойств, обусловленных содержанием в ней ионов
R Ca2+ и Mg2+
£ Al3+ и Mg2+
£ Na+ и K+
£ Ba2+ и Ca2+
Задание {{ 538 }} ТЗ № 79
Отметьте правильный ответ
Постоянная жесткость воды не может быть устранена
R кипячением воды
£ добавлением гашеной извести
£ добавлением соды
£ добавлением ортофосфата натрия
Задание {{ 539 }} ТЗ № 80
Отметьте правильный ответ
При действии воды на гидрид металла массой 0,84г выделился водород объемом 896л (н.у.). Определите, гидрид какого элемента был взят, если известно, что элемент проявляет степень окисления +2. В ответе укажите порядковый номер металла
R 20
£ 38
£ 56
£ 30
Задание {{ 540 }} ТЗ № 81
Отметьте правильный ответ
Верны ли следующие суждения о соединениях железа? А. Формула высшего оксида железа Fe2O3, Б. Оксид железа (III) проявляет только основные свойства
R верно только А
£ верно только Б
£ верны оба суждения
£ оба суждения неверны
Задание {{ 541 }} ТЗ № 82
Установите соответствие между формулами исходных веществ и названиями продуктов их взаимодействия
| тетрагидроксоалюминат калия и водород | Al и KOH(р-р) |
| сульфат алюминия и водород | Al и H2SO4(разб.) |
| гидроксид алюминия и сероводород | Al2S3 и H2O |
| гидроксид алюминия и водород | Al + H2O |
| гидроксид алюминия и сера | |
| сульфит алюминия и водород |
Задание {{ 542 }} ТЗ № 83
Установите соответствие между формулами реагентов и продуктами их взаимодействия
t
Cu2O + H2SO4(конц.) 
| CuSO4 + SO2 + H2O |
t
CuS + HNO3(конц.) 
| Cu(NO3)2 + NO2 + S + H2O |
CuO + HCl 
| CuCl2 + H2O |
t
CuCl + H2SO4(конц.) 
| CuSO4 + SO2 + HCl + H2O |
| Cu2SO4 + H2O | |
| Cu(NO3)2 + NO + H2S |
Задание {{ 543 }} ТЗ № 84
Установите соответствие между металлом и формулой его высшего хлорида
| Mg | MeCl2 |
| Na | MeCl |
| Fe | MeCl3 |
| Li | MeCl |
| MeCl4 |
Задание {{ 544 }} ТЗ № 85
Установите соответствие между исходными веществами и продуктами их взаимодействия
Fe + HCl 
| FeCl2 + H2 |
Fe + Cl2 
| FeCl3 |
Cu + AgCl2 
| CuCl2 + Ag |
| CuCl2 | |
| FeCl2 | |
| FeCl3 + H2 |
Задание {{ 545 }} ТЗ № 86
Установите соответствие между исходными веществами и продуктами реакций
сплавление
AlCl3 + KOH 
| KAlO2 + KCl + H2O |
AlCl3 + KOH(недост.) 
| Al(OH3) + KCl |
AlCl3 + KOH(изб.) 
| K3[Al(OH)6] + KCl |
AlCl3 + H2O 
| AlOHCl2 + HCl |
| Al(OH)3 + HCl | |
| K3AlO3 + HCl |
Задание {{ 546 }} ТЗ № 87
Установите соответствие между реагирующими веществами и продуктами взаимодействия
MgO + SO2 
| MgSO3 |
MgO + SO3 
| MgSO4 |
MgO + H2SO3 
| MgSO3 + H2 |
MgO + H2SO4 
| MgSO4 + H2O |
| MgSO3 + H2O | |
| MgSO4 + H2 |
Задание {{ 547 }} ТЗ № 88
Установите соответствие между исходными веществами и продуктами реакции
CuO + HCl 
| CuCl2 + H2O |
CuO + H2 
| Cu + H2O |
CuO + CO 
| Cu + CO2 |
t
Cu(NO3)2 
| CuO + NO2 + O2 |
| Cu2O + O2 | |
| Cu(OH)2 + H2 |
Задание {{ 548 }} ТЗ № 89
Установите соответствие между реагирующими веществами и продуктаи их взаимодействия
MnO2 + Si 
| Mn + SiO2 |
t
Mn(OH)2 
| MnO + H2O |
t
KMnO4 
| K2MnO4 + MnO2 + O2 |
KMnO4 + KNO2 + KOH 
| K2MnO4 + MnO2 + O2 |
| MnO2 + KNO3 + H2O | |
| MnCl2 + Cl2 + H2O | |
| MnO2 + HNO3 + KNO3 |
Задание {{ 549 }} ТЗ № 90
Установите соответствие между реагирующими веществами и продуктами их взаимодействия
Cr2O3 + HCl 
| CrCl3 + H2O |
сплавление
C2O3 + KOH 
| KCrO2 + H2O |
Cr(OH)2 + O2 + H2O 
| Cr(OH)3 |
Cr(OH)2 + O2 + H2O 
| CrCl2 + H2 |
| Cr(OH)3 + HCl | |
| H2CrO3 + H2Cr2O7 |
Задание {{ 550 }} ТЗ № 91
Дополните
Осуществите следующие превращения. В ответе запишите его название вещества А
+NaOH
Fe(NO3)3  Fe2O3
Fe2O3  Fe
Fe  FeCl3
FeCl3  A
A
Правильные варианты ответа: гидроксид железа (III); гидроксид железа (3); Гидроксид железа (III); Гидроксид железа (3); ГИДРОКСИД ЖЕЛЕЗА (3); ГИДРОКСИД ЖЕЛЕЗА (III);
Задание {{ 551 }} ТЗ № 92
Дополните
Осуществите ряд следующих превращений в ответе укажите название вещества А, содержащего хром HCl
(NH4)2Cr2O7  Cr2O3
Cr2O3  Cr
Cr  Cr2(SO4)3
Cr2(SO4)3  Na2CrO4
Na2CrO4  Na2Cr2O7
Na2Cr2O7  А
А
Правильные варианты ответа: хлорид хрома (III); ХЛОРИД ХРОМА (III); хлорид хрома (3); ХЛОРИД ХРОМА (3);
Задание {{ 552 }} ТЗ № 93
Отметьте правильный ответ
Медь нельзя получить по следующей схеме
£ CuO + C 
£ Cu2S + O2 
£ электролиз раствора CuCl2
R t
Cu(OH)2 
Задание {{ 553 }} ТЗ № 94
Дополните
Продуктом взаимодействия металлического цинка с очень разбавленной азотной кислотой является....... Запишите название продукта восстановления азотной кислоты
Правильные варианты ответа: нитрат аммония; НИТРАТ АММОНИЯ; Нитрат аммония;
Задание {{ 554 }} ТЗ № 95
Дополните
При растворении в водном растворе гидроксида калия 8г сплава кремния и цинка выделяется 6,72л (н.у.) водорода. Массовая доля (%) цинка равна........ Запишите ответ с точностью до десятых
Правильные варианты ответа: 60,5; 60.5;
Задание {{ 555 }} ТЗ № 96
Дополните
При обработке образца смеси цинка и железа хлороводородной кислотой выделилось 0,896л (н.у.) газа, а при действии раствора щелочи на такой же образец смеси получили 0,448л газа. Массовая доля (%) железа в образце равна.........
Правильные варианты ответа: 46,3; 46.3;
Задание {{ 556 }} ТЗ № 97
Дополните
Железную пластину опустили в раствор, содержащий смесь хлорида меди (II) и хлорида железа (II). После окончания реакции масса пластины возросла на 1,6г. Масса хлорида меди (II) в исходном растворе равна...........г. Запишите целое число
Правильные варианты ответа: 27;
Задание {{ 557 }} ТЗ № 98
Дополните
К 15,8г раствора перманганата калия с массовой долей 10% добавили избыток раствора нитрита натрия. Реакцию проводили в нейтральной среде. Выделившийся осадок растворили в избытке соляной кислоты. Объем газа (н.у.) равен..........л. Запишите число с точностью до сотых
Правильные варианты ответа: 2,24; 2.24;
Задание {{ 558 }} ТЗ № 99
Дополните
Соль натрия желтого цвета массой 6,48г растворили в воде, подкислили серной кислотой, получив оранжевый раствор. При добавлении избытка раствора сульфита натрия образовался раствор зеленовато-фиолетового цвета. Масса металлического хрома, которая может быть выделена при электролизе полученного раствора равна.......г. Запишите с точностью до сотых
Правильные варианты ответа: 2,08; 2.08;
Задание {{ 559 }} ТЗ № 1
Отметьте правильный ответ
Литий обнаруживает диагональное сходство в периодической системе с:
R Mg
£ Ca
£ Ga
£ AI
Задание {{ 560 }} ТЗ № 2
Отметьте правильный ответ
Из щелочных металлов самый легкий:
R Li
£ K
£ Na
£ Cs
Задание {{ 561 }} ТЗ № 3
Отметьте правильный ответ
Литий получают электролизом расплава эвтектической смеси:
R LiCI – KCI
£ LiCI – MgCI2
£ Li2SO4 – K2SO4
£ LiF – NaF
Задание {{ 562 }} ТЗ № 4
Дополните
Важнейшая область применения лития - атомная энергетика. Его используют как источник получения ... . (Запишите название изотопа на русском языке)
Правильные варианты ответа: трития; Трития;
Задание {{ 563 }} ТЗ № 5
Дополните
Продуктом окисления лития кислородом является ... .
Правильные варианты ответа: оксид; Оксид;
Задание {{ 564 }} ТЗ № 6
Отметьте правильный ответ
Атомная масса лития представленная в виде природной смеси изотопов 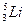 (7,42 %) и
(7,42 %) и 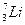 (92,58 %) равна:
(92,58 %) равна:
R 6,854
£ 7,238
£ 8,940
£ 6,572
Задание {{ 565 }} ТЗ № 7
Отметьте правильный ответ
Продуктами разложения гидрида лития водой является:
R LiOH и H2
£ Li2O и H2O
£ Li2O2 и H2
£ LiOH и H2O
Задание {{ 566 }} ТЗ № 8
Отметьте правильный ответ
Добавление каких из указанных веществ усилит гидролиз карбоната натрия:
R ZnCI2
R H2O
£ NaOH
£ K2S
Задание {{ 567 }} ТЗ № 9
Отметьте правильный ответ
При электролизе водного раствора гидроксида натрия на аноде выделилось 2,8 л кислорода (н.у.). Объем водорода, выделившегося на катоде, равен (л):
R 5,6
£ 2,8
£ 11,2
£ 22,4
Задание {{ 568 }} ТЗ № 10
Отметьте правильный ответ
Период полураспада 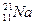 с радиоактивной постоянной l =0,0304с-1
с радиоактивной постоянной l =0,0304с-1
равен (с): (ответ с точностью до десятых)
R 22,8
£ 25,7
£ 44,2
£ 28,9
Задание {{ 569 }} ТЗ № 11
Отметьте правильный ответ
Рассчитайте массу нитрата калия (г), подвергшегося термическому разложению, если газ, выделившийся при этой реакции, занимает такой же объем, как и газы, полученные при термическом разложении 993 г нитрата свинца:
R 1515
£ 3030
£ 303
£ 2121
Задание {{ 570 }} ТЗ № 12
Отметьте правильный ответ
При прокаливании 63,3 г кристаллогидрата карбоната натрия выделилось 39,6 г воды. Определите формулу кристаллогидрата:
R Na2CO3·10H2O
£ Na2CO3·7H2O
£ Na2CO3·H2O
£ Na2CO3·6H2O
Задание {{ 571 }} ТЗ № 13
Дополните
При взаимодействии с кислородом натрий, в отличие от лития, образует не оксид, а ... .
Правильные варианты ответа: пероксид;
Задание {{ 572 }} ТЗ № 14
Дополните
Оксид натрия получают косвенным путем восстанавливая ... металлическим натрием.
Правильные варианты ответа: пероксид натрия; Пероксид натрия;
Задание {{ 573 }} ТЗ № 15
Отметьте правильный ответ
Формула каустической соды выглядит следующим образом:
R NaOH
£ NaHCO3
£ Na2CO3
£ Na2CO3·10H2O
Задание {{ 574 }} ТЗ № 16
Отметьте правильный ответ
Питьевой соды соответствует формула:
R NaHCO3
£ Na2CO3·10H2O
£ NaOH
£ Na2CO3·H2O
Задание {{ 575 }} ТЗ № 17
Отметьте правильный ответ
Наиболее важными минералами калия являются:
R сильвин
R сильвинит
£ мирабилит
£ криолит
Задание {{ 576 }} ТЗ № 18
Отметьте правильный ответ
Надпероксид калия разлагается соляной кислотой по схеме
KO2 + HCI®KCI + …
(Укажите продукты реакции)
R H2O2 и O2
£ H2O и H2
£ H2O и O2
£ H2O и KOH
Задание {{ 577 }} ТЗ № 19
Отметьте правильный ответ
Озонид калия сильный окислитель. Его можно получить при действии озона на твердый гидроксид калия по схеме
KOH + O3®KO3 + …
(Дополните уравнение реакции и укажите сумму коэффициентов при продуктах реакции)
R 7
£ 5
£ 8
£ 15
Задание {{ 578 }} ТЗ № 20
Отметьте правильный ответ
Химическая активность в ряду
Li2O – Na2O – K2O – Rb2O – Cs2O:
R усиливается
£ ослабевает
£ практически не изменяется
Задание {{ 579 }} ТЗ № 21
Дополните
Амфотерным элементом второй группы главной подгруппы ПСХЭ является ... . (Запишите название элемента)
Правильные варианты ответа: бериллий; Бериллий;
Задание {{ 580 }} ТЗ № 22
Дополните
Бериллий подобно алюминию, реагирует с кислотами и щелочами, образуя катионные и анионные комплексы, при этом выделяется ... .
Правильные варианты ответа: водород; Водород;
Задание {{ 581 }} ТЗ № 23
Отметьте правильный ответ
Координационное число бериллия в комплексах равно:
R 4
£ 2
£ 6
£ не образует комплексных соединений
Задание {{ 582 }} ТЗ № 24
Отметьте правильный ответ
Фторобериллату калия соответствует:
R K2[BeF4]
£ K3[BeF6]
£ K2[BeF6]
£ K2[BeF5]
Задание {{ 583 }} ТЗ № 25
Отметьте правильный ответ
Нитрид бериллия разлогается водой с выделением аммиака. Напишите уравнение реакции и укажите коэффициент при втором продукте:
R 3
£ 2
£ 4
£ 5
Задание {{ 584 }} ТЗ № 26
Отметьте правильный ответ
– Конец работы –
Используемые теги: Наименование, НТЗ, Теоретические, методические, аспекты, решения, задач, химии, Расположение, НТЗ, estКяров0.117
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Наименование НТЗ: Теоретические и методические аспекты решения задач по химии Расположение НТЗ: T: estКяров А
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов