рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Энергетика
- /
- Классификация ХИТ
Реферат Курсовая Конспект
Классификация ХИТ
Классификация ХИТ - раздел Энергетика, ...

Классификация ХИТ


 | |||
 | |||
 |  | ||||
 | |||||

Первичные, или гальванические элементы
Одноразового действия; работают, пока есть запас активных реагентов. Процессы на аноде и катоде – необратимые.
Вторичные, или аккумуляторы
Работают в режиме заряда-разряда.
Выдерживают большое число циклов. При разряде работают как источник тока, при заряде – как электролизер. Процессы на электродах – обратимые.
Топливные элементы
Работают, пока подводятся реагенты (топливо и окислитель) к электродам. Работают как источник тока. Реагенты хранятся вне ТЭ.
Преимущества ХИТ :
● автономность -возможность использованияв космосе и под водой, в переносных устройствах , медицине, на транспорте и т. п.;
● высокий КПД;
● бесшумность;
Экологичность - относительная безвредность.
Основные характеристики ХИТ
► ЭДС ЕЭ , (В) – электродвижущая силаравнаразности равновесных потенциалов катода и анода. ЕЭ = ЕрК - ЕрА
Определяется термодинамикой процессов в ХИТ.
Еэ = -ΔG/nF ; Еэ0 = -ΔG0/nF
► Напряжение U, (В) - всегда меньше ЭДС :
U= ЕЭ - ∆E - I(R1+R2)
При разряде напряжение элемента постепенно снижается.
Чем меньше изменение напряжения Þ тем лучше элемент.
Емкость элемента Q ,(Кл, А.ч) – количество электричества, которое ХИТ отдает при разряде.
Q = f { - массы запасенных реагентов в элементе;
Степени их превращения.
При ↑I и ↓Т Þ ↓ степень превращения, ↓емкость элемента.
Удельная емкость q, (А.ч/кг) – емкость, отнесенная к единице массы или объема элемента.
Более высокую q можно получить в элементах с малой m.
Энергия элемента W, (Вт.ч) – равна произведению его емкости на напряжение: W= Q . U
Удельная энергия w , ( Вт.ч/кг или Вт.ч/м3 ) - энергия, отнесенная к единице массы или объема элемента.
При ↑I Þ ↓U Þ ↓W , ↓w .
Более высокую w можно получить в элементах с:
- малой m ,
- большой ЭДС, ЕЭ ,
Высокой степенью превращения реагентов.
►Мощность элемента P , (Вт) – энергия, отдаваемая за единицу времени.
Р = U. I = ( ЕЭ – ΔE – IR) .I
Все факторы, повышающие напряжение элемента Þ увеличивают его мощность.
Зависимость Р = f ( I ) проходит через максимум.
► Удельная мощность , ( Вт/кг или Вт/м3 ) – мощность, отнесенная к массе или объему элемента.
Сохраняемость – срок хранения ХИТ, в течение которого его характеристики остаются в заданных пределах.
Требования к современным ХИТ : · Возможно большая величина ЭДС;Гальванические элементы - первичные элементы.
Реагенты (окислитель и восстановитель)
входят непосредственно в состав гальванического элемента,
Расходуются в процессе его работы.
Может работать непрерывно или с перерывами.
После расхода реагентов элемент не может больше работать.
THORN; это источник тока одноразового действия.
Примеры:
Сухой» марганцево - цинковый элемент
Широко применяется для питания радиоаппаратуры, аппаратуры связи, магнитофонов, карманных фонарей и др.
Анод - цинковый электрод;
катод - электрод из смеси диоксида марганца с графитом (МnО2+С);
токоотвод - графит;
Электролит - паста из раствора хлорида аммония NH4Cl с загустителем или бумага, пропитанная раствором NH4Cl .
 |
Устройство первичного элемента МnО2 - Zn с солевым электролитом:
1 - цинковый анод; 2 - электролит; 3 – катод (МnО2+С);
Графитовый токоотвод катода; 5 - пространство для сбора газов; 6 - крышка; 7 - уплотнение; 8 - стойка; 9 - футляр; 10 – дно.
Схема элемента:
(-) Zn | NH4Cl| MnO2 , С (+)
на аноде - окисление цинка:
Zn + 2NH4 +-2e→[Zn(NH3)2]2++2H+
на катоде - Мn(IV) восстанавливается до Мn(III):
MnO2 + 2H+ + 2e → 2MnOOH
Суммарное уравнение ТОР:
Zn + 2NH4Cl + 2MnO2 = [Zn(NH3)2]Cl2 + 2MnOOH
Щелочной марганцево-цинковый элемент
Такой же элемент, но с щелочным электролитом.
Его характеристики лучше.
Схема элемента:
(-) Zn | КОН | MnO2 , С (+)
на аноде - окисление цинка:
Zn + 2OH --2e→ Zn(OH)2 = ZnO+H2O,
на катоде - Мn(IV) восстанавливается до Мn(III):
MnO2 + H2O + e → MnOOH+ OH-
Элементы с литиевыми анодами
Разработаны в последние десятилетия. Большой прогресс, так как имеют существенно более высокие характеристики, особенно при низких температурах.
Электролиты – обязательно неводные (пропиленкарбонат ПК, тионилхлорид и др.), т.к. в присутствии воды или кислорода литий быстро окисляется. Необходима полная герметичность при изготовлении и использовании.
Катодные материалы – на основе MnO2, FeS2, CFx , SOCl2
Преимущества:
● стабильное напряжение,
● высокая удельная энергия,
● длительная сохраняемость,
Способность работать при отрицательных Т (до -50оС).
Применение: электронная аппаратура, часы, портативные ЭВМ, кинокамеры, медицинские приборы, военная техника.
ПРИМЕР гальванический элемент Li / SOCl2
Схема элемента:
(-) Li | LiAlCl4 ,SOCl2 | SOCl2 (+)
Токообразующая реакция:
SOCl2 + 4Li → S + SO2 + 4LiCl
на аноде - окисление лития:
Li – e → Li+
на катоде - восстановление тионилхлорида SOCl2 :
2SOCl2 +4е→S + SO2 + 4Cl-
Параметры первичных элементов
Аккумуляторы – вторичные ХИТ.
В аккумуляторах под воздействием внешнего источника тока накапливается (аккумулируется) химическая энергия (заряд аккумулятора), которая затем самопроизвольно переходит в электрическую (разряд аккумулятора).
…при заряде аккумулятор работает как электролизер,
При разряде - как гальванический элемент .
Процессы заряда-разряда аккумуляторов осуществляются
Многократно.
Примеры:
Свинцовые кислотные аккумуляторы.
Наиболее распространены в настоящее время: - стартерные,
Стационарные.
Электролит - раствор Н2SО4 (поэтому «кислотный»).
Электроды - свинцовые решетки с активной массой из РbSО4, разделены раствором Н2SО4 и пористыми сепараторами.
Решетки вначале заполняются оксидом свинца, который при взаимодействии с Н2SО4 превращается в РbSО4).
Аккумуляторы соединяют в батарею, которую помещают в баки из эбонита или полипропилена.
Процессы на электродах:
На отрицательном электроде при работе аккумулятора протекают реакции, при которых степень окисления свинца меняется от +2 до 0 и обратно:
Заряд 0
 РbSO4 +2е Pb + SО42-; Е0Рb/PbSО4= - 0,36 В,
РbSO4 +2е Pb + SО42-; Е0Рb/PbSО4= - 0,36 В,
Разряд
(-) электрод: при заряде – катод;
При разряде – анод.
На положительном электроде степень окисления свинца меняется от +2 до +4 и обратно:
Заряд +4
 РbSO4 + Н2О PbО2 + SО42- + 4Н++ 2e;
РbSO4 + Н2О PbО2 + SО42- + 4Н++ 2e;
разряд Е°РbО2/PbSО4 = 1,68 В.
(+) электрод: при заряде – анод;
При разряде – катод.
Суммарная реакция в аккумуляторе:
Заряд
 2РbSO4 + 2Н2О Рb + PbО2 + 4Н+ + 2SО42-
2РbSO4 + 2Н2О Рb + PbО2 + 4Н+ + 2SО42-
Разряд
ЭДС аккумулятора
= разности потенциалов электродов, может быть рассчитана по уравнению:
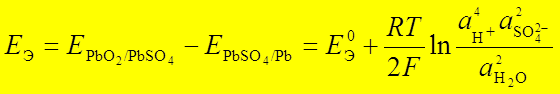
Где Е0э = Е0РbО2/РbSО4– Е0РbSО4/Рb = 1,68 В - (- 0,36) В = 2,04 В.
Еэ – зависит от концентрации H2SO4, оптимум -32-39%
При заряде Uзаряда=ЕЭ + ∆E + I(R1+R2) Þ Uзаряда >ЕЭ
При разряде Uразряда=ЕЭ - ∆E - I(R1+R2) Þ Uразряда< ЕЭ
Достоинства свинцовых аккумуляторов:
● высокий КПД (около 80 %),
● высокая ЭДС,
● относительно малое ее изменение при разряде,
● простота,
Невысокая цена.
Недостатки свинцовых аккумуляторов:
● небольшая удельная энергия,
● саморазряд аккумулятора при хранении,
Малый срок службы (2 - 5 лет).
Щелочные никель-кадмиевые и никель-железные
Аккумуляторы .
(+) электрод содержит гидроксид никеля,
Электрод - соответственно кадмий или железо.
Ионный проводник – 20-23% раствор КОН.
Суммарные реакции (в упрощенном виде):
Разряд
NiOOH + Cd + 2H2О↔ 2Ni(OH)2 + Cd(OH)2 , E0 = 1,45 В
Заряд
Разряд
NiOOH + Fe + 2H2O ↔ 2Ni(OH)2 + Fe(OH)2 , E0 = 1,48 В
Заряд
Достоинства:
● большой срок службы,
Высокая механич.прочность.
Недостатки:
● невысокие КПД,
● невысокое напряжение,
Токсичность Cd.
Литий-ионные аккумуляторы
Разработаны в последнее время.
Отрицательный электрод – литий.
Положительный электрод – на базе оксидов ванадия,
Никеля, кобальта, марганца.
Неводный раствор электролита: пропиленкарбонат,
Этиленкарбонат, диэтилкарбонат
На электродах происходит интеркалация - внедрение в
кристаллическую решетку (соответственно, в оксиды и графит) ионов лития:
→ разряд
На (- ) электроде: LixC ↔ xLi+ + C + xe
Заряд
→ разряд
На (+) электроде: xLi+ + MOn+ xe ↔ LixMOn
Заряд
Суммарно: LixC + MOn↔ C + LixMOn
Достоинства: высокая удельная энергия.
Недостаток: работают пока на малых токах (электронная, слаботочная аппаратура).
Параметры аккумуляторов
Топливные элементы.
В топливных элементах (ТЭ) окислитель и восстановитель хранятся вне элемента,
В процессе работы подаются к электродам.
THORN; топливный элемент может работать длительное время.
На электродах
Химическая энергия .
Восстановителя (топлива) Þ в электрическую энергию.
И окислителя .
Восстановители (топливо), жидкие или газообразные, - водород, метанол, метан, в последние годы некоторые другие восстановители, например боргидрид натрия.
Окислители - обычно кислород воздуха.
ТЭ состоит из двух электродов с электродными камерами и ионного проводника (электролита) между ними.

Схема кислородно-водородного топливного элемента:
Анод; 2- электролит; 3- катод
Классификация ТЭ по типу ионного проводника (электролита):
● с щелочным (95-100 С),
● фосфорнокислым (200 С),
● протонпроводящим или твердополимерным (95-100 С),
● расплавленным карбонатным (высокотемпературный 700 С),
● твердооксидным (1000 С0).
ПРИМЕР
Кислородно-водородный щелочной топливный элемент
Схема кислородно-водородного ТЭ
Н2, М½КОН½М, О2

М - проводник 1-го рода -
Катализатор процесса и токоотвод (Pt,Pd).
Каждый электрод - сложная многокомпонентная система.
К аноду подводится топливо – водород, идет его окисление:
Н2 + 2ОН- - 2е = 2Н2О
К катоду подводится окислитель - чистый кислород или кислород воздуха, идет его восстановление:
1/2О2+Н2О+2е=2ОН-
Токообразующая реакция:
Н2 + 1/2О2 = Н2О(ж)
или
Н2 + 1/2О2 = Н2О(г)
Во внешней цепи - движение электронов от анода к катоду,
В растворе - движение ОН- от катода к аноду.
Еэ = -ΔGТОР /nF Еэ0 = -ΔG0ТОР /nF
Стандартная ЭДС зависит от температуры в соответствие с уравнением:
Еэ0 = -ΔН0/nF + TΔS0/nF
где ΔН0 - энтальпия,
S0 – энтропия токообразующей реакции.
Стандартные термодинамические характеристики
Токообразующих реакций при 298 К
….. Электрохимическая энергоустановка. состоит из:Системы хранения, обработки и подвода топлива и
окислителя,
▬ системы отвода продуктов реакции,
Системы поддержания и регулирования температуры в
элементах,
Системы преобразования тока и напряжения.
Достоинства:
● Электрохимические энергоустановки имеют более высокий КПД (в 1,5 - 2,0 раза) по сравнению с тепловыми машинами;
Существенно меньше загрязняют окружающую среду.
– Конец работы –
Используемые теги: Классификация, ХИТ0.047
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Классификация ХИТ
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов