рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Образование
- /
- Периодическая система и строение атома
Реферат Курсовая Конспект
Периодическая система и строение атома
Периодическая система и строение атома - раздел Образование, Министерство Общего И Профессионального Образования Све...
Министерство общего и профессионального образования Свердловской области
ГБОУ СПО СО «Екатеринбургский экономико-технологический колледж»

 |
Екатеринбург 2012г.
Химические знания необходимы каждому человеку, они определяют рациональное поведение человекаЧасть I.
Практическая работа №1.Периодическая система и строение атома
Лабораторная работа №1. Электролитическая диссоциация.
Лабораторная работа №2. Гидролиз солей.
Практическая работа №2. Взаимодействие азотной кислоты с металлами
Лабораторная работа №3. Общие свойства металлов.
Лабораторная работа №4. Алюминий.
Лабораторная работа №5. Углерод и его соединения.
Часть II.
Лабораторная работа №7. Непредельные углеводороды. Лабораторная работа №8. Спирты и их свойства. Лабораторная работа №9. Альдегиды и их свойства.По теме: «Электролитическая диссоциация».
Оборудование: 1. Таблица растворимости – раздаточный материал. 2. Штатив с пробирками.Вывод:______________________________________________________________________________________________________________________________
Опыт 2. Взаимодействие хлорида бария с серной кислотой.
В пробирку налейте 1мл. хлорида бария и 1мл. серной кислоты.
Наблюдение: __________________________________________________________________
__________________________________________________________________
 Уравнение реакции: составить молекулярное и ионное уравнение (полное и краткое).
Уравнение реакции: составить молекулярное и ионное уравнение (полное и краткое).
ВаCl2 + H2SO4 →
Ba2+ + 2Cl- + 2H+ + SO42- →
Вывод:______________________________________________________________________________________________________________________________
Опыт 3. Взаимодействие хлорида бария с сульфатом натрия.
В пробирку налейте 1мл. хлорида бария и 1мл. сульфата натрия.
Наблюдение: __________________________________________________________________
__________________________________________________________________
 Уравнение реакции: составить молекулярное и ионное уравнение (полное и краткое).
Уравнение реакции: составить молекулярное и ионное уравнение (полное и краткое).
ВаCl2 + Na2SO4 →
Ba2+ + 2Cl- + 2Na+ + SO42- →
Вывод:____________________________________________________________
Опыт 4. Взаимодействие сульфата меди с гидроксидом натрия.
В пробирку налейте 1мл. сульфата меди и 1мл. гидроксида натрия.
Наблюдение: __________________________________________________________________
__________________________________________________________________
Уравнение реакции: составить молекулярное и ионное уравнение (полное и краткое).
CuSO4 + 2NaOH →
Cu2+ + SO42- + 2Na+ + 2OH- →
Вывод:______________________________________________________________________________________________________________________________
Опыт 5. Взаимодействие карбоната натрия с соляной кислотой.
В пробирку налейте 1мл. карбоната натрия и 1мл. соляной кислоты.
Наблюдение: __________________________________________________________________
__________________________________________________________________
Уравнение реакции: составить молекулярное и ионное уравнение (полное и краткое).
Na2CO3 + 2HCl →
2Na+ + CO32- + 2H+ + 2Cl- →
Вывод:______________________________________________________________________________________________________________________________
3.  Выполнить упражнение:
Выполнить упражнение:
1. Какие из перечисленных попарно ионов могут одновременно находиться в растворе?
а) Ba2+ u Cl-
б) Ba2+ u SO42-
в) H+ u OH-
г) Na+ u Cl-
д) SiO32- u H+
е) Fe2+ u NO3-
2. Указать на какие ионы диссоциируют следующие электролиты:
а)Al(NO3)3 ↔
б) H3BO3 ↔
в)CsOH ↔
г) K3PO4 ↔
3. Чему равна степень диссоциации электролита, если из каждых 20 молекул
ɑ = ------------------------- * 100%
Лабораторная работа № 2.
По теме: «Гидролиз солей».
Цель: Изучить гидролиз солей. Научиться составлять краткие уравнения гидролиза. Оборудование: 1. Таблица растворимости – раздаточный материал.Особенности взаимодействия НNO3 с металлами.
2. Водород никогда не выделяется, он окисляется, образуя воду. 3. Концентрированная HNO3 при обыкновенной температуре не взаимодействует с… 4. HNO3 не реагирует с Pt, Rt, Li, Au.По теме: «Общие свойства металлов».
Оборудование: 1. Периодические системы элементов Д.И. Менделеева – раздаточный материал; 2. Таблица растворимости – раздаточный материал;Вывод:______________________________________________________________________________________________________________________________
2.В пробирку с 1мл. воды поместите литий. Наблюдайте, когда и как идет реакция?
Проверьте продукты реакции зажженной спичкой и фенолфталеином. Сделайте вывод, запишите уравнение реакции, подобно опыту 1. Отметьте наибольшую активность у этих металлов.
Наблюдение: _________________________________________________________________
__________________________________________________________________
Уравнение реакции: составить уравнение реакции и методом электронного баланса расставьте коэффициенты в уравнении.
Li + Н2О →
Вывод:______________________________________________________________________________________________________________________________
 Опыт 2. Отношение металлов к кислотам:
Опыт 2. Отношение металлов к кислотам:
1.В пробирки с 1мл. соляной кислоты поместите цинк.
Наблюдайте протекание реакции. По возможности проверьте выделяющийся газ зажженной спичкой.
Наблюдение: _________________________________________________________________
__________________________________________________________________
Уравнение реакции: составить уравнение реакции и методом электронного баланса расставьте коэффициенты в уравнении.
Zn + НCl →
Вывод:______________________________________________________________________________________________________________________________
2.В пробирки с 1мл. соляной кислоты поместите железо.
Наблюдайте протекание реакции. По возможности проверьте выделяющийся газ зажженной спичкой.
Наблюдение: __________________________________________________________________
__________________________________________________________________
Уравнение реакции: составить уравнение реакции и методом электронного баланса расставьте коэффициенты в уравнении.
Fe + НCl →
Вывод:______________________________________________________________________________________________________________________________
3.В пробирки с 1мл. соляной кислоты поместите медь.
Наблюдайте протекание реакции. По возможности проверьте выделяющийся газ зажженной спичкой.
Наблюдение: __________________________________________________________________
__________________________________________________________________
 Уравнение реакции: составить уравнение реакции и методом электронного баланса расставьте коэффициенты в уравнении.
Уравнение реакции: составить уравнение реакции и методом электронного баланса расставьте коэффициенты в уравнении.
Cu + НCl →
Вывод:______________________________________________________________________________________________________________________________
Опыт 3. Отношение металлов к солям.
Наблюдение:… __________________________________________________________________По теме: «Алюминий».
Цель работы: Изучение амфотерности алюминия и его гидроксида. Оборудование:По теме: «Углерод и его соединения».
Оборудование: 1. Периодические системы элементов Д.И. Менделеева – раздаточный материал; … 2. Таблица растворимости – раздаточный материал;Приложение А.
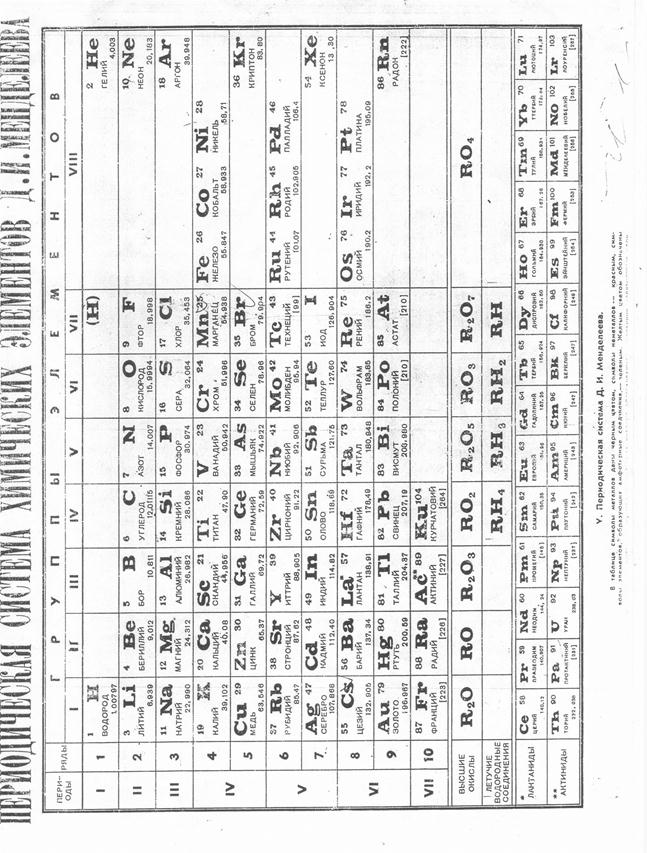
Приложение Б.
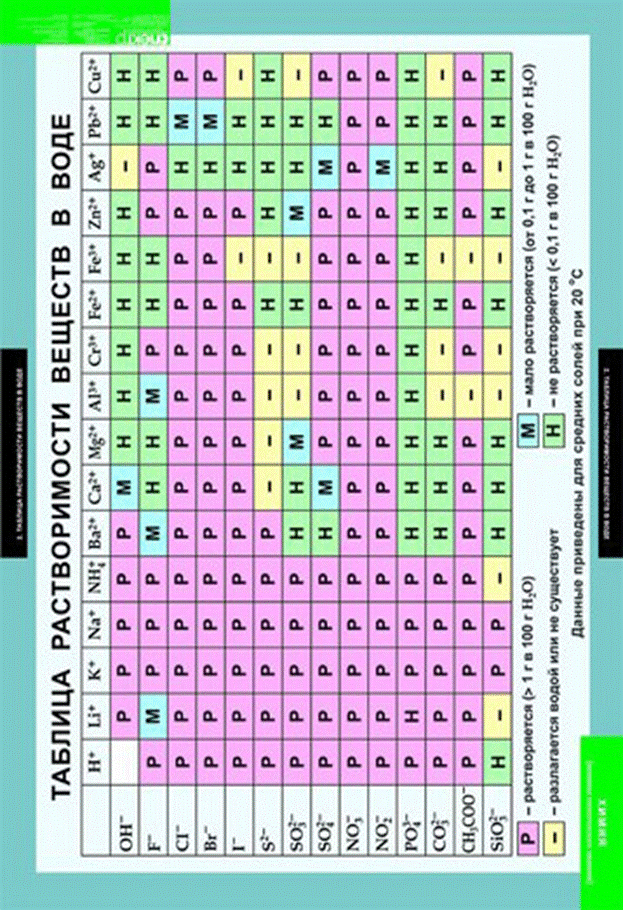
Рекомендуемая литература
Габриелян О.С. Химия: учеб. для студ. проф. учеб. заведений / О.С. Габриелян, И.Г. Остроумов. – М., 2008.
Габриелян О.С. Химия в тестах, задачах, упражнениях: учеб. пособие для студ. сред. проф. учебных заведений / О.С. Габриелян, Г.Г. Лысова – М., 2009.
Габриелян О.С. Практикум по общей, неорганической и органической химии: учеб. пособие для студ. сред. проф. учеб. заведений / Габриелян О.С., Остроумов И.Г., Дорофеева Н.М. – М., 2007.
Габриелян О.С. Химия: орган. химия: учеб. для 10 кл. общеобразоват. учреждений с углубл. изучением химии / О.С. Габриелян, И.Г. Остроумов, А.А. Карцова – М., 2008.
Габриелян О.С. Общая химия: учеб. для 11 кл. общеобразоват. учреждений с углубл. изучением химии / О.С. Габриелян, И.Г. Остроумов, С.Н. Соловьев, Ф.Н. Маскаев – М., 2009.
Браун Т., Лемей Г.Ю. Химия в центре наук: В 2 т. – М., 1987.
Ерохин Ю.М. Химия. – М., 2003.
Кузьменко Н.Е., Еремин В.В., Попков В.А. Краткий курс химии. – М., 2000.
– Конец работы –
Используемые теги: периодическая, система, Строение, атома0.069
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Периодическая система и строение атома
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов