рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Теория химического строения А.М. Бутлерова. Структурные формулы молекул. Предельные углеводороды
Реферат Курсовая Конспект
Теория химического строения А.М. Бутлерова. Структурные формулы молекул. Предельные углеводороды
Теория химического строения А.М. Бутлерова. Структурные формулы молекул. Предельные углеводороды - раздел Химия, Вопрос1.теория Химического Строения А.м.бутлерова.бутлеров Занимался С Исключ...
вопрос1.теория химического строения а.м.бутлерова.Бутлеров занимался с исключительным усердием, но, к своему удивлению, заметил, что самое большое удовольствие доставляют ему лекции по химии. Занимаясь изучением углеводородов, Бутлеров понял, что они представляют собой совершенно особый класс химических веществ. Анализируя их строение и свойства, ученый заметил, что здесь существует строгая закономерность. Она и легла в основу созданной им теории химического строения.Бутлеров высказывает основные положения чел-ка.
понятия «химическое строение», которое Бутлеров формулирует следующим образом«Исходя из мысли, что каждый химический атом, входящий в состав тела, принимает участие в образовании этого последнего и действует здесь определенным количеством принадлежащей ему химической силы (сродства), я называю химическим строением распределение действия этой силы, вследствие которого химические атомы, посредственно или непосредственно влияя друг на друга, соединяются в химическую частицу».В высшей степени важным, особенно для того времени, является также то место доклада, где Бутлеров говорит о возможности судить о строении молекул вещества химическими методами и, прежде всего, методами синтеза органических соединений.В своих исследованиях Бутлеров продолжал развивать структурную теорию. Он задался целью доказать, что разветвленную и прямую углеродные цепи могут иметь все типы органических соединений. Это вытекало непосредственно из теории, но теоретические положения надо было доказать на практике. Разве нельзя получить углеводород — например, бутан, — четыре углеродных атома которого были бы связаны друг с другом не последовательно, а так, как они связаны в триметил-карбиноле? Но чтобы найти правильный метод его синтеза, требовалось множество опытов.И вот, наконец, усилия Бутлерова увенчались успехом. В большой колбе был долгожданный изобутилен. Доказано существование разветвленной цепи углеводородов!Сегодня, между прочим, получение углеводородов и спиртов, которыми занимался Бутлеров, достигло колоссальных промышленных масштабов, их получают в миллионах тонн.
вопрос2.структурные формулы наглядно показывают, из каких атомов состоят молекулы и какими связями они соединены; общие электронные пары или ковалентные связи обозначают черточками. в структурных формулах циклических соединений химические символы часто опускают, изображая только кольцо из связей между атомами углерода. Изомерия – важнейшее понятие в химии и причина многочисленности и разнообразия органических соединений. Такие процессы имеют важное значение в промышленности. Так, например, проводят изомеризацию нормальных алканов в изоалканы для повышения октанового числа моторных топлив; изомеризуют пентан в изопентан для последующего дегидрирования в изопрен. Изомеризацией являются и внутримолекулярные перегруппировки, из которых большое значение имеет, например, перегруппировка Бекмана — превращение циклогексаноноксима в капролактам (сырье для производства капрона).
Явление изомерии в огромной степени способствует росту числа известных (и ещё в большей степени — числа потенциально возможных) соединений. Так, возможное число структурно-изомерных дециловых спиртов — более 500 (известно из них около 70), пространственных изомеров здесь более 1500.
При теоретическом рассмотрении проблем изомерии все большее распространение получают топологические методы; для подсчёта числа изомеров выведены математические формулы.В зависимости от способа разрыва ковалентной связи в реагирующей молекуле органические реакции подразделяются на радикальные и ионные реакции. Ионные реакции в свою очередь делятся по характеру реагента, действующего на молекулу, на электрофильные и нуклеофильные.
Разрыв ковалентной связи может происходить двумя способами,обратными механизмам ее образованияю.1)Разрыв связи, при котором каждый атом получает по одному электрону из общей пары, называется гомолитическим.В результате гомолитического разрыва образуются сходные по электронному строению частицы, каждая из которых имеет неспаренный электрон.Такие частицы называются свободными радикалами.
2)Если при разрыве связи общая электронная пара остается у одного атома, то такой разрыв называется гетеролитическим.В результате образуются разноименно заряженные ионы - катион и анион.Если заряд иона сосредоточен на атоме углерода, то катион называюткарбокатионом, а анион - карбанионом.
ворос3.предельные углеводороды общая формула состояния и свойства.получения алканов.Предельные углеводороды - это углеводороды, в молекулах которых имеются только простые (одинарные) связи (-связи). Предельными углеводородами являются алканы и циклоалканы. Алканы - предельные углеводороды, состав которых выражается общей формулой CnH2n+2. Алканы являются насыщенными углеводородами.Восстановление галогенпроизводных алканов:
При каталитическом гидрировании в присутствии палладия галогеналканы превращаются в алканы.Наиболее характерными реакциями предельных углеводородов являются реакции замещения. Так,например, при освещении метан реагирует с хлором (при сильном освещении может произойти взрыв). Фактически реакции предельных углеводородов с галогенами происходят более сложно.При поглощении световой энергии молекулы хлора распадаются на атомы. Атомы хлора с одним неспаренным электроном химически очень активны. При их столкновении с молекулой метана происходит реакция, в результате которой образуется свободный химически очень активный радикал метил. Его активность тоже объясняется наличием неспаренного электрона.Для получения алканов используют в основном природные источники. Газообразные алканы получают из природного и попутных нефтяных
газов, а твердые алканы — из нефти. Природной смесью твердых высокомолекулярных алканов является горный воск(озокерит) — разновидность твердого природного битума.Реакция Вюрца (взаимодействие галогенпроизводных алканов с Na)
CH3Cl + 2Na + ClCH3 -> 2NaCl + CH3 - CH3
2C2H5Cl + 2Na -> 2 Nacl + C4H10
CH3Cl + 2Na + C2H5Cl -> 2 NaCl + C3H8
В алканах все атомы связаны между собой прочными (s-связями, а валентности углеродных атомов полностью насыщены водородом. Поэтому алканы не вступают в реакции присоединения. При обычных условиях они проявляют высокую химическую устойчивость. По этой причине алканы в свое время получили название парафинов (от лат. parum affinis — мало деятельный, мало сродства).
вопрос4.алкены общая формула получения хим. св-ва получения и применения.
Алке́ны (олефины, этиленовые углеводороды) — ациклические непредельные углеводороды, содержащие одну двойную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n. Атомы углерода при двойной связи находятся в состоянии sp² гибридизации, и имеют валентный угол 120°. Простейшим алкеном является этилен (C2H4). По номенклатуре IUPAC названия алкенов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-ен»; положение двойной связи указывается арабской цифрой.В природе алкены встречаются редко. Поскольку алкены являются ценным сырьем для промышленного органического синтеза, разработаны многие способы их получения.хим.св-ваВсе специфические химические свойства алкенов определяются наличием в их молекуле p-электронного облака (то есть собственно двойной связью). Электроны p-облака находятся вне плоскости молекулы и легко доступны для атаки электрофильными частицами. Поэтому практически все реакции алкенов имеют электрофильный механизм (обычно это электрофильное присоединение, которое обозначается кратко как АЕ).примен.-1. Предельные углеводороды находят широкое применение в самых разнообразных сферах жизни и деятельности человека.
2. Использование в качестве топлива – в котельных установках, бензин, дизельное топливо, авиационное топливо, баллоны с пропан-бутановой смесью для бытовых плит
3. Вазелин используется в медицине, парфюмерии, косметике, высшие алканы входят в состав смазочных масел, соединения алканов применяются в качестве хладагентов в домашних холодильниках
4. Смесь изомерных пентанов и гексанов называется петролейным эфиром и применяется в качестве растворителя. Циклогексан также широко применяется в качестве растворителя и для синтеза полимеров.
5. Метан используется для производства шин и краски
6. Значение алканов в современном мире огромно. В нефтехимической промышленности предельные улеводороды являются базой для получения разнообразных органических соединений, важным сырьем в процессах получения полупродуктов для производства пластмасс, каучуков, синтетических волокон, моющих средств и многих других веществ. Велико значение в медицине, парфюмерии и косметике.
вопрос5.диеновые углеводороды. общая формула хим.св-ва.природные и синтетические каучуки.Диеновые углеводорoды (диены), ненасыщенные углеводороды с двумя двойными связями. Алифатич. диены СnН2n_2 наз. алкадиенами, алициклич. СnН2n_4 - циклоалкадиенами.Общая формула гомологического ряда алкадиенов — СnН2n-2.Химические свойства. Диены, содержащие в молекуле несопряженные (изолированные) двойные связи, ведут себя как обычные алкены. В то же время диены с сопряженными двойными связями обладают высокой реакционной способностью и отличаются рядом особенностей. Однако для тех и других характерны прежде всего реакции присоединения.Значение каучука
В наше время трудно представить, что в конце 20-х гг. XX в. Потребление каучука на одного человека в год в нашей стране составляло около 50г, а один автомобиль приходился на три тысячи жителей. Жизнь современного человека трудно представить без резиновых изделий. Мир резины не только удивительный, но подчас и неожиданный.
Интересна история автомобильной шины. Впервые пневматические шины на автомобиль установил в 1894г. француз А.Мишлен. Это произвело настоящий переворот в автомобилестроении. Вскоре появились цельнолитые толстые шины. Однако настоящим «виновником» широкого использования резиновых шин стал велосипед. Это двухколесное «чудо» впервые изобрел К.Макмиллан из Шотландии в 1839–1844гг. Только в 1865г. француз Тефонон установил на велосипед массивные резиновые шины. Позже, другой его соотечественник – Трюффо – сконструировал для велосипедного колеса трубчатую шину, которая впоследствии стала накачиваться насосом и «оделась» в специальные покрышки – толстые, ребристые, легко преодолевающие все неровности на дороге.
В настоящее время химикам известно более 25 тыс. видов искусственных каучуков. Но промышленность освоила около сотни из них.Благодаря своим свойствам резина завоевала всемирную популярность. Началась настоящая каучуковая лихорадка. Но необходимый для изготовления резины натуральный каучук был достаточно дорогим и дефицитным материалом. Единственными поставщиками этого ценного природного полимера были тропические страны – Бразилия, английские и французские колонии в Юго-Восточной Азии. Для получения 1000 тонн растительного полимера необходимо было обработать 3 млн. каучуконосных деревьев и затратить на это в течение года труд 5,5 тыс. человек. Да и сам натуральный каучук не всегда удовлетворял промышленность: он растворялся в масле, в нефтепродуктах, имел плохую термостойкость и быстро терял свои качества.
Так возникла необходимость в получении каучука синтетическим путем.
Известно, что впервые синтетический изопрен был получен в 1897 году русским химиком В.Н.Ипатьевым. Спустя несколько лет изопрен синтезировали и другие химики. Однако все это было сложно и дорого.
Ближайшим «родственником» изопрена оказался дивинил (бутадиен – 1,3).Состав природного каучука
Состав каучука стал известен уже во второй половине XIX века. Французский химик Гюстав Бушарда в 1875 году выделил изопрен из продуктов термического разложения природного каучука, а также осуществил обратную полимеризацию: получил каучукоподобное вещество нагреванием изопрена и действием на него соляной кислоты (1879 год):
n CH2═C(CH3)─CH═CH2 → (─CH2─C(CH3)═CH─CH2─)n
восрос6.алкины общая формула химические св-ва.получение и применение.
Алки́ны (иначе ацетиленовые углеводороды) — углеводороды, содержащие тройную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n-2.Получение. 1. Общий способ получения алкинов — отщепление двух молекул галогеноводорода от дигалогеналканов, которые содержат два атома галогена либо у соседних, либо у одного атома углерода, под действием спиртового раствора щелочи.2. Гомологи ацетилена можно также получать, действуя галогеналканами на соли ацетиленовых углеводородов (ацетилениды):Эта реакция представляет собой пример нуклеофильного замещения, а нуклеофилом в ней является ацетиленидный карбанион.3. Ацетилен получают в промышленности путем высокотемпературного крекинга метана:или его ближайших гомологов — этана и пропана, причем в этом случае ацетилен образуется при более низких температурах.Химические свойства алкинов обусловлены наличием в их молекулах тройной связи. Типичными реакциями для ацетилена и его гомологов являются реакции электрофильного присоединения АE. Отличие алкинов от алкенов заключается в том, что реакции присоединения могут протекать в две стадии. На первой стадии идет присоединение к тройной связи с образованием двойной связи, а на второй стадии — присоединение к двойной связи. Реакции присоединения для алкинов протекают медленнее, чем для алкенов. Это объясняется тем, что p-электронная плотность тройной связи расположена более компактно, чем в алкенах, и поэтому менее доступна для взаимодействия с различными реагентами.Химические свойства алкинов обусловлены наличием в их молекулах тройной связи. Типичными реакциями для ацетилена и его гомологов являются реакции электрофильного присоединения АE. Отличие алкинов от алкенов заключается в том, что реакции присоединения могут протекать в две стадии. На первой стадии идет присоединение к тройной связи с образованием двойной связи, а на второй стадии — присоединение к двойной связи. Реакции присоединения для алкинов протекают медленнее, чем для алкенов. Это объясняется тем, что p-электронная плотность тройной связи расположена более компактно, чем в алкенах, и поэтому менее доступна для взаимодействия с различными реагентами.
вопрос7.бензол.гомологический ряд бензола.взаимосвязь предельных и непредельных ароматических углеродов.
Бензо́л (C6H6, PhH) — органическое химическое соединение, бесцветная жидкость с приятным сладковатым запахом.Гомологический ряд бензола имеет общую формулу СnН2n-6. Гомологи можно рассматривать как производные бензола, в котором один или несколько атомов водорода замещены различными углеводородными радикалами. Например, С6Н5-СН3 - метилбензол или толуол, С6Н4(СН3)2 - диметилбензол или ксилол, С6Н5—С2Н5 - этилбензол и т.д.
Так как в бензоле все углеродные атомы равноценны, то у первого его гомолога - толуола - изомеры отсутствуют. У второго гомолога - диметилбензола - имеются три изомера, отличающиеся взаимным расположением метильных групп (заместителей). Это орто- (сокращенно о-), или 1,2-изомер, в нем заместители находятся у соседних атомов углерода. Если заместители разделены одним атомом углерода, то это мета- (сокращенно м-) или 1,3-изомер, а если они разделены двумя атомами углерода, то это пара- (сокращенно п-) или 1,4-изомер. В названиях заместители обозначаются буквами (о-, м-, п-) или цифрами.Ациклические (с открытой цепью) Карбоциклические (с замкнутой цепью) предельные непредельные предельные непредельные с одинарной связью с двойной связью с тройной связью с двумя двойными связями с одинарной связью с бензольным кольцом ряд метана (алканы) ряд этилена (алкены) ряд ацетилена (алкины) ряд диеновых углеводородов ряд полиметиленов (нафтены) ряд бензола (ароматические углеводороды, или арены).
вопрос8.св-ва бензола и его гомологов.стирол-важнейшее производное бензола.
Бензол - бесцветная жидкость со своеобразным неприятным запахом. Температура плавления - 5,53 °C, температура кипения - 80,1 °C, плотность - 0.879 г/см³, молекулярная масса - 78,11г/моль. С воздухом образует взрывоопасные смеси. Хорошо смешивается с эфирами, бензином и другими органическими растворителями. С водой бензол образует смесь с температурой кипения 69,25 °C. Растворимость в воде 1.79 г/л, по другим данным 0,08% (при 25°C). Очень токсичен ПДК 5 мг/куб.м, опасен для окружающей среды Огнеопасен, температура самовоспламенения 534 0С., концентрационные пределы взрываемости от 1,4 до 7,1 %.
Бензол по составу относится к ненасыщенным углеводородам (гомологический ряд CnH2n-6). В отличии от углеводородов ряда этилена C2H4, при жёстких условиях проявляет свойства присущие насыщенным углеводородам. Он склонен к реакциям замещения. Свойства бензола объясняются наличием в его структуре сопряжённого π-электронного облака.
Транспортировку бензола осуществляют в железнодорожных цистернах и автоцистернах, на баржах и в металлических бочках. Перекачивание из одного сосуда в другой происходит в закрытой системе, так как бензол ядовит.
В зависимости от технологии производства получают различные марки бензола. Бензол нефтяной получают в процессе каталитического риформинга бензиновых фракций, каталитического гидродеалкилирования толуола и ксилола, а также при пиролизе нефтяного сырья. Получается более чистый продукт. Бензол из угля часто содержит примеси тиофена.Гомологический ряд бензола имеет общую формулу СnН2n-6. Гомологи можно рассматривать как производные бензола, в котором один или несколько атомов водорода замещены различными углеводородными радикалами. Например, С6Н5-СН3 - метилбензол или толуол, С6Н4(СН3)2 - диметилбензол или ксилол, С6Н5—С2Н5 - этилбензол и т.д.Углеродный скелет органических соединений, которые мы рассматривали до сих пор, представлял собой прямые или разветвленные цепи. Немецкий химик Август Кекуле впервые открыл, что молекулы многих других органических соединений построены по типу кольца. Важнейшее кольцо (циклическое соединение углерода) —бензол — содержится в количестве 1—2 % в каменноугольной смоле, из которой его и получают.
вопрос9.природные источники углеводородов.нефть природный и попутный газы продукты коксохимического производства.
Попутный нефтяной газ – это газ, существующий вместе с нефтью, он растворен в нефти и находится над ней, образуя «газовую шапку», под давлением. На выходе из скважины давление падает, и попутный газ отделяется от нефти. Этот газ в прошлые времена не использовался, а просто сжигался. В настоящее время его улавливают и используют как топливо и ценное химическое сырье. Возможности использования попутных газов даже шире, чем природного газа, т.к. состав их богаче. В попутных газах содержится меньше метана, чем в природном газе, но в них значительно больше гомологов метана. Чтобы использовать попутный газ более рационально, его разделяют на смеси более узкого состава. После разделения получают газовый бензин, пропан и бутан, сухой газ. Извлекают и индивидуальные углеводороды – этан, пропан, бутан и другие. Дегидрированием их получают непредельные углеводороды – этилен, пропилен, бутилен и др. Нефть – это маслянистая жидкость с резким запахом. Она встречается во многих местах земного шара, пропитывая пористые горные породы на различной глубине.
По мнению большинства ученых, нефть представляет собой геохимически измененные остатки некогда населявших земной шар растений и животных. Эта теория органического происхождения нефти подкрепляется тем, что в нефти содержатся некоторые азотистые вещества – продукты распада веществ, присутствующих в тканях растений. Есть и теории о неорганическом происхождении нефти: образовании ее в результате действия воды в толщах земного шара на раскаленные карбиды металлов (соединения металлов с углеродом) с последующим изменением получающихся углеводородов под влиянием высокой температуры, высокого давления, воздействия металлов, воздуха, водорода и др.
При добыче из нефтеносных пластов, залегающих в земной коре иногда на глубине нескольких километров, нефть либо выходит на поверхность под давлением находящихся на нем газов, либо выкачивается насосами.Природный газ – источник сырья для химической отрасли промышленности: получение ацетилена, этилена, водорода, сажи, различных пластмасс, уксусной кислоты, красителей, медикаментов и других продуктов.Коксохимическая промышленность — отрасль черной металлургии, занимающаяся переработкой каменного угля методом коксования.
вопрос10.спирты.функциональная группа.классификация .изомерия.
СПИРТЫ(алкоголи),орг. соед., содержащие в молекуле одну или неск. гидроксильных групп ОН у насыщ.атомов углеродаСпирты можно рассматривать как производные воды (H−O−H), в которых один атом водорода замещен на органическую функциональную группу: R−O−H.Спирты являются обширным и очень разнообразным классом органических соединений: они широко распространены в природе, имеют важнейшее промышленное значение и обладают исключительными химическими свойствами.Спирты классифицируются следующим образом:
· По числу гидроксильных групп:
| — одноатомные спирты; — двухатомные спирты; — трехатомные спирты; — четырёхатомные спирты; — многоатомные спирты. | |
· В зависимости от насыщенности углеводородного заместителя:
| — предельные или насыщенные спирты; — непредельные или ненасыщенные спирты; — ароматические спирты. |
· В зависимости от наличия или отсутствия цикла в углеводородном заместителе:
| — алициклические спирты; — алифатические или ациклические спирты. |
В зависимости от того, при каком атоме углерода находится гидроксильная группа: — первичные спирты;
— вторичные спирты;
— третичные спирты.
Структурная изомерия предельных спиртов определяется строением углеродной цепи и положением гидроксильной группы в цепи. Изомерия двух и трехатомных спиртов, кроме того, определяется взаимным расположением гидроксильных групп.
По систематической номенклатуре названия спиртов образуют, добавляя суффикс -ол к названию углеводорода с самой длинной углеродной цепью, включающей гидроксильную группу. Нумерацию цепи начинают с того края, ближе к которому расположена гидроксильная группа.
вопрос11.строение предельных одноатомных спиртов.основные св-ва получения.физ. св-ва.
При замещении в углеводородах ряда метана одного атома водорода на одновалентный радикал гидроксил (водный остаток) ОН получается гомологический ряд одноатомных предельных спиртов, или алкоголей, имеющих следующую общую формулу:CnH2n+1OH, или в общем виде R—OH.
Число изомеров, равно как и характер изомерии, для спиртов совершенно такие же, как и для моногалоидных производных углеводородов.Получение спиртов
I. В промышленности
1. Из водяного газа (получение метанола – древесный спирт)
CO + 2H2 t,p→ CH3OH
2. Брожение глюкозы (получение этанола)
C6H12O6 дрожжи→ 2C2H5OH + 2CO2
Гидратация алкенов
СH3-CH=CH2 + HOH t,kat-H3PO4→ CH3-CH-CH3 (пропанол-2)
│
OH
присоединение по правилу Марковникова
II. В лаборатории
Взаимодействие галогеналканов R-Г с водными растворами щелочей
физ.св-ва Спирты растворимы в большинстве органических растворителей, первые три простейших представителя – метанол, этанол и пропанол, а также… вопрос12.хим.св-ва предельных одноатомных спиртов.метанол и этанол их применение и промышленный синтез.Альдегиды - органические вещества, молекулы которых содержат карбонильную группу ——, связанную с атомом водорода и углеводородным радикалом. Общая формула альдегидов или R—CHO. Функциональная группа альдегидов (—CHO) называется альдегидной группой.Гомологический ряд альдегидов и их номенклатура
Простейший альдегид, называемый муравьиным альдегидом или формальдегидом, содержит альдегидную группу, связанную с атомомHYPERLINK "http://www.xumuk.ru/encyklopedia/633.html"водорода,или сокращенно
Н—СНО. В остальных альдегидах предельного ряда место одного атомаHYPERLINK "http://www.xumuk.ru/encyklopedia/633.html"водорода занимает алкил: СnС2n+1—СНО.Альдегиды можно также рассматривать как вещества, происшедшие от замещения в парафиновых углеводородах атома водорода на альдегидную группу, т. е. как однозамещенные производные углеводородов гомологического ряда метана. Следовательно, здесь гомология и изомерия те же, что и для других однозамещенных производных предельных углеводородов.Названия альдегидов производятся от тривиальных названий кислот с тем же числом атомов углерода в молекуле. Так, альдегид СН3—СНО называется уксусным альдегидом или ацетальдегидом, СН3СН2—СНО — пропионовым альдегидом, СН3СН2СН2—СНО — нормальным масляным альдегидом или бутиральдегидом, (СН3)2СН—СНО — изомасляным альдегидом, альдегиды С4Н9—СНО — валериановыми альдегидамии т. д.По женевской номенклатуре, названия альдегидов производятся от названий углеводородов, имеющих то же число углеродных атомов, с присоединением кокончанию ан слога аль, например метаналь Н—СНО, этаналь СН3—СНО, 2-метилпропаналь СН3СН(СН3)—СНО и т. д.
вопрос16.получение и св-ва альдегидов.
Получение.
1. Гидратация алкинов. Из ацетилена получается альдегид, из его гомологов — кетоны Из-за своей относительной дороговизны, а также из-за того, что получаемые соединения загрязнены токсичными соединениями ртути, в настоящее время этот способ находит ограниченное применение.2. Общий способ получения карбонильных соединений окисление спиртов . В качестве окислителя можно использовать не только дихромат или перманганат калия, но и другие окислители, например, оксид меди (II) при нагревании.3. При щелочном гидролизе дигалогеналканов, содержащих два атома галогена при одном атоме углерода, образуются двухатомные спирты, в которых две группы ОН соединены с одним атомом углерода. Эти вещества неустойчивы и отщепляют воду, превращаясь в карбонильные соединения.4. Дегидрирование спиртов. Одним из промышленных способов получения альдегидов и кетонов является дегидрированиеспиртов в газовой фазе над металлическими медью, серебром, хромом, никелем, оксидом цинка и др.5. Окисление алкенов. Альдегиды и кетоны получают окислением углеводородов ряда этилена кислородом воздуха в присутствии хлоридов палладия (II) и меди (I) Этим экономичным способом в промышленности получают низшие альдегиды и кетоны.6. Простейший кетон — ацетон — получают кумольным методом вместе с фенолом.Химические свойства альдегидов и кетонов определяются тем, что в состав их молекул входит карбонильная группа с полярной двойной связью. Альдегиды и кетоны — химически активные соединения, которые склонны к реакциям присоединения по связи С=О. Эти реакции протекают по механизму нуклеофильного присоединения (обозначается AN от англ, addition nucleophilic). Активность альдегидов и кетонов в реакциях присоединения определяется величиной положительного заряда d+ на атоме углерода в карбонильной группе. Электронодонорные группы, связанные с группой СО, уменьшают величину этого заряда. Карбонильная группа кетонов связана с двумя углеводородными радикалами (которые являются электронодонорными группами), поэтому кетоны менее активны, чем альдегиды (в которых группа СО связана только с одним радикалом). Самым активным из альдегидов является формальдегид H2CO.
вопрос17.карбоновые к-ты функциональная группа общая формула и их гомогологический ряд.изомерия и нумкнклатура.
Карбоновыми кислотами называются производные углеводородов, в молекуле которых содержится одна или несколько карбоксильных групп –COOH.
Общая формула карбоновых кислот:
В зависимости от природы радикала, связанного с карбоксильной группой, кислоты подразделяются на предельные, непредельные и ароматические.
Число карбоксильных групп определяет основность кислот.
Общая формула предельных одноосновных кислот: СnH2n+1COOH (или СnH2nO2).
Номенклатура. Распространены тривиальные названия. По правилам IUPAC к названию углеводорода добавляют "-овая кислота".
Изомерия.1. Для алифатических кислот - изомеризация углеводородного радикала.2. Для ароматических - изомерия положения заместителя при бензольном кольце.3. Межклассовая изомерия со сложными эфирами (например, CH3COOH и HCOOCH3).функциональная группа карбоновых кислот - состоит из карбонильной группы и связанной с ней гидроксильной группы.Гомологический ряд — ряд химических соединений одного структурного типа (например, алканы или алифатические спирты — спирты жирного ряда), отличающихся друг от друга по составу на определенное число повторяющихся структурных единиц — так называемую «гомологическую разность». Чаще всего это метиленовые звенья: …—СН2—… Простейший пример гомологического ряда — низшие гомологи алканов (общая формула СnH2n+2): метан CH4, этан C2H6, пропан С3H8 и т. д.В основе понятия гомологии в органической химии лежит фундаментальное положение о том, что химические и физические свойства вещества определяются структурой его молекул: эти свойства определяются как функциональными группами соединения (гидроксил спиртов, карбоксильная группа карбоновых кислот, арильная группа ароматических соединений и т. п.), так и его углеродным скелетом.
вопрос18.получение и физ.св-ва карбоновых к-т.
физ.св-ва Низшие карбоновые кислоты — жидкости с острым запахом, хорошо растворимые в воде. С повышением относительной молекулярной массы растворимость кислот в воде и их плотность уменьшаются, а температура кипения повышается. Высшие кислоты, начиная с н-нонановой СН3-(СН2)7-СООН, — твердые вещества, без запаха, нерастворимые в воде. Низшие карбоновые кислоты в безводном виде и в виде концентрированных растворов раздражают кожу и вызывают ожоги, особенно муравьиная кислота и уксусная кислота.Способы получения. 1. Окисление альдегидов и первичных спиртов — общий способ получения карбоновых кислот. В качестве окислителей применяются KМnО4 и K2Сr2О7.2 Другой общий способ — гидролиз галогензамещенных углеводородов, содержащих, три атома галогена у одного атома углерода. При этом образуются спирты, содержащие группы ОН у одного атома углерода — такие спирты неустойчивы и отщепляют воду с образованием карбоновой кислоты:2 Другой общий способ — гидролиз галогензамещенных углеводородов, содержащих, три атома галогена у одного атома углерода. При этом образуются спирты, содержащие группы ОН у одного атома углерода — такие спирты неустойчивы и отщепляют воду с образованием карбоновой кислоты:
| ЗNаОН | ||||
| R-CCl3 | → | [R-C(OH)3] | → | R-COOH + Н2О |
| -3NaCl |
3. Получение карбоновых кислот из цианидов (нитрилов) — это важный способ, позволяющий наращивать углеродную цепь при получении исходного цианида. Дополнительный атом углерода вводят в состав молекулы, используя реакцию замещения галогена в молекуле галогенуглеводорода цианидом натрия, например:
СН3-Вr + NaCN → CH3 - CN + NaBr.Образующийся нитрил уксусной кислоты (метилцианид) при нагревании легко гидролизуется с образованием ацетата аммония:CH3CN + 2Н2О → CH3COONH4.При подкислении раствора выделяется кислота:CH3COONH4 + HCl → СН3СООН + NH4Cl.4. Использование реактива Гриньяра по схеме:Н2ОR-MgBr + СО2 → R-COO-MgBr → R-COOH + Mg(OH)Br5. Гидролиз сложных эфиров:R-COOR1 + КОН → R-COOK + R'OH ,R-COOK + HCl → R-COOH + KCl .6. Гидролиз ангидридов кислот:(RCO)2O + Н2О → 2RCOOH.7. Для отдельных кислот существуют специфические способы получения.
Муравьиную кислоту получают нагреванием оксида углерода (II) с порошкообразным гидроксидом натрия под давлением и обработкой полученного формиата натрия сильной кислотой:
Уксусную кислоту получают каталитическим окислением бутана кислородом воздуха:2С4Н10 + 5O2 → 4СН3СООН + 2Н2О.Для получения бензойной кислоты можно использовать окисление монозамешенных гомологов бензола кислым раствором перманганата калия:5С6Н5-СН3 + 6KMnO4 + 9H2SO4 = 5С6Н5СООН + 3K2SO4 + 6MnSO4 + 14H2O.
вопрос19.химические св-ва карбоновых к-т.
Карбоновые кислоты содержат сильно полярную связь между атомами кислорода и водорода в гидроксильной группе, которая еще больше поляризуется под влиянием атома кислорода, входящего в состав карбонильной группы.
1). В водном растворе карбоновые кислоты обратимо диссоциируют:RCOOH ГрафическийобъектRCOO- + Н+
Лакмус в растворе карбоновых кислот приобретает красный цвет.
Карбоновые кислоты — слабые, поэтому сильные минеральные кислоты вытесняют их из соответствующих солей.
2). Реагируют с - активными металлами2RCOOH + Mg → (RCOO)2 Mg+Н2 - основными оксидами2RCOOH + СаО → (RCOO)2 Са+Н2О
- основаниямиRCOOH + NаОH → RCOONа+Н2О- солями слабых кислотRCOOH + NаHCО3 → RCOONа+Н2О+CО23). Взаимодействуют со спиртами:
4).При действии галогенов на свету образуются галогензамещенные кислоты :СH3-CH2-COOH + Br2→ CH3-CHBr-COOH + HBr
вопрос20.важнейшие представительные карбоновые к-ты:муравьиная уксусная пальмитиновая стеариновая олеиновая к-та как представительнепредельных карбоновых к-т.
5. Получение муравьиной кислоты:1 стадия: CO + NaOH t,p → HCOONa формиат натрия – соль2 стадия: HCOONa + H2SO4 → HCOOH + NaHSO4 6. Получение уксусной кислоты:CH3OH + CO t,p → CH3COOHМетанол.Муравьиная кислота – в медицине - муравьиный спирт (1,25% спиртовой раствор муравьиной кислоты), в пчеловодстве, в органическом синтезе, при получении растворителей и консервантов; в качестве сильного восстановителя.Уксусная кислота – в пищевой и химической промышленности (производство ацетилцеллюлозы, из которой получают ацетатное волокно, органическое стекло, киноплёнку; для синтеза красителей,медикаментов и сложных эфиров). В домашнем хозяйстве как вкусовое и консервирующее вещество.Стеариновая C17H35COOH и пальмитиновая кислота C15H31COOH – вкачестве поверхностно-активных веществ, смазочных материалов в металлообработке.Олеиновая кислота C17H33COOH – флотореагент и собиратель при обогащении руд цветных металлов.
вопрос21.мыла как соли высших карбоновых к-т применение карбоновых к-т и их производных.понятие о синтетических моющих средствах.
Калиевые соли образуют жидкие мыла, а натриевые соли – твердые мыла.Основной способ получения мыла – это гидролиз жиров в присутствии щелочей. Реакция омыления – это реакция обратная этерификации. Омыление жиров можно проводить в присутствии серной кислоты (кислотное омыление). В результате чего получаются высшие карбоновые кислоты и глицерин. Первые под действием соды или щелочи переводят в мыла. Растительные масла (хлопковое, подсолнечное), животные жиры, а также кальцинированная сода или гидроксид натрия являются основным сырьем для изготовления мыла. Предварительно растительные масла превращают в твердые жиры. Также используются синтетические карбоновые жирные кислоты с большой молекулярной массой – заменители жиров MDAI. Для производства мыла необходимо большое количество сырья, поэтому в настоящее время существует необходимость производства мыла из непищевых продуктов. Карбоновые кислоты, которые необходимы для производства мыла, получают окислением парафина. Для того, чтобы получить туалетное мыло нейтрализуют кислоты, в молекуле которых от 10 до 16 атомов углерода. Мыло для технических целей, а также хозяйственное мыло получают из кислот, в молекулах которых от 17 до 21 атома углерода. Мыло, которое получают из жиров и синтетическое мыло, плохо моет в жесткой воде. Поэтому для производства моющих средств начали использовать другие виды сырья, например алкилсульфат – это соль сложных эфиров высших спиртов и серной кислоты. В молекуле этих солей содержится от 12 до 14 атомов углерода, и они обладают очень хорошими моющими свойствами. Такие мыла хорошо моют даже в жесткой воде, потому что магниевые и кальциевые соли растворяются в воде. Во многих стиральных веществах содержаться алкисульфаты и 2С-I. Использование синтетических моющих средств позволяет высвобождать огромное количество пищевого сырья - растительных жиров и масел.Карбоновые кислоты проявляют высокую реакционную способность. Они вступают в реакции с различными веществами и образуют разнообразные соединения, среди которых большое значение имеют функциональные производные, т.е. соединения, полученные в результате реакций по карбоксильной группе.Синтетические моющие средства - это натриевые соли кислых сложных эфиров высших спиртов и серной кислоты:
R-CH2-OH + H-O-SO2-OH è R-CH2-O-SO2-OH + H2O;R-CH2-O-SO2-OH + NaOH è R-CH2-O-SO2-ONa + H2O.
вопрос22.строение сложных эфиров.их применение и роль в природе.
Получение и строение сложных эфиров:1) сложные эфиры образуются при взаимодействии кислот со спиртами. В общем виде получение их может быть выражено уравнением:2) реакции кислот со спиртами, ведущие к образованию сложных эфиров, называются реакциями этерификации (лат. aether – эфир);3) они проводятся в присутствии сильных минеральных кислот, при этом ионы водорода оказывают каталитическое действие;4) названия сложных эфиров образуются из названий соответствующих кислот и спиртов, например: а) метиловый эфир уксусной кислоты СН3СООСН3; б) этиловый эфир муравьиной кислоты НСООС2Н5;5) атом водорода функциональной группы в кислотах является подвижным, поэтому в спиртах при реакции этерификации водород должен отщепляться от молекулы кислоты, гидроксильная группа при этом отщепляется от молекулы спирта.Как идет реакция, устанавливается при помощи меченых атомов:а) если на карбоновую кислоту действовать спиртом, который вместо обычного атома кислорода содержит тяжелый изотоп массой 18: RCOOH + HO18R ? RCOO18R + Н2O;б) после проведения реакции тяжелый изотоп кислорода находится в сложном эфире;в) при реакции этерификации от молекулы спирта отделяется не гидроксильная группа, а только атом водорода, гидроксильная же группа отделяется от молекулы кислоты.Применение сложных эфиров.Этилформиат НСООС2Н5 и этилацетат Н3СООС2Н5 используются как растворители целлюлозных лаков (на основе нитроцеллюлозы и ацетилцеллюлозы).Сложные эфиры на основе низших спиртов и кислот (табл. 1) используют в пищевой промышленности при создании фруктовых эссенций, а сложные эфиры на основе ароматических спиртов – в парфюмерной промышленности.Нахождение сложных эфиров в природе.1Синтетические сложные эфиры в виде фруктовых эссенций используются наряду с другими душистыми веществами в производстве фруктовых вод, кондитерских изделий. 2Также сложные эфиры используются при изготовлении духов и одеколонов.3Некоторые из сложных эфиров (например, этиловый эфир уксусной кислоты) служат растворителями.
вопрос23.жиры их физ. и хим. св-ва.
Жиры, или триглицериды — природные органические соединения, полные сложные эфиры глицерина и одноосновных жирных кислот; входят в класс липидов. В живых организмах выполняют структурную, энергетическую и др. функции.Физические свойства. Т-ры плавления индивидуальных триглицеридов, входящих в состав жиров, зависят от длины цепи, степени ненасыщенности жирных к-т и их расположения в триглицеридах. Подобно большинству длинноцепочных соед., Триглицериды могут кристаллизоваться в неск. полиморфных формах. Полиморфизм проявляют не только индивидуальные Триглицериды, но и прир. жиры, состоящие из триглицеридов с близкими длинами кислотных цепей. Жиры, являющиеся смесью разл. триглицеридов, не имеют четкой т-ры плавления Все жиры характеризуются значит. увеличением объема при плавлении.При постепенном охлаждении жидкий жир частично кристаллизуется и приобретает форму твердого тела, обладающегопластичностью. Пластичность характерна для жиров, содержащих 10-30% кристаллич. фазы. В пластичном жире кристаллы твердых триглицеридов образуют решетку, внутри к-рой находится значит. кол-во жидкой фазы.Химические свойства. Гидролиз жиров, конечные продукты к-рого глицерин и жирные к-ты, осуществляют в пром-сти нагреванием их с водой до 200-225 °С при 2-2,5.106 Па (безреактивный способ) или нагреванием при нормальном давлении в присут. сульфокислот (катализатор Твитчела и контакт Петрова). Щелочной катализ применяют в процессах мыловарения (см. Мыла) и при наличии в жирнокислотных цепях гидроксильных групп. Скорости ферментативного гидролиза a- и b-сложноэфирных групп ферментом панкреатич. липазой различны, что используют для установления строения триглицеридов жиров. Алкоголиз жиров, в частности метанолиз, используется как первая ступень непрерывного метода мыловарения. Глицеролиз действием глицерина применяют для получения моно-и диглицеридов, используемых в качестве эмульгаторов. Ацидолиз, напр., ацетолиз кокосового жира с послед. этерификацией избытка уксусной к-ты глицерином, приводит к смеси, состоящей из лауроилдиацетина, миристоилдиацетина и др. смешанных триглицеридов, применяемой в качестве мягчителей нитроцеллюлозы.
вопрос24.понятие и классификация углеводов.моносахариды.понятие о фотосинтезе.глюкоза её строение и св-ва нахождение в природе.фруктоза-изомер глюкозы.
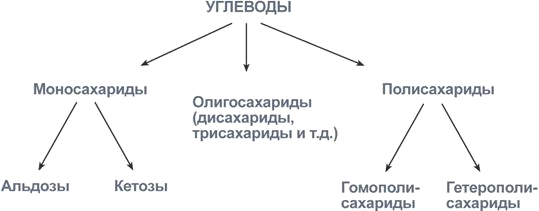
углеводы-это производные спиртов.Моносахариды (от греческого monos: единственный, sacchar: сахар), — органические соединения, одна из основных групп углеводов; самая простая форма сахара; являются обычно бесцветными, растворимыми в воде, прозрачными твердыми веществами.Фотосинтез (от др.-греч. φῶς — свет и σύνθεσις — соединение, складывание, связывание, синтез) — процесс образования органических веществ из углекислого газа и воды на свету при участии фотосинтетических пигментов (хлорофилл у растений, бактериохлорофилл и бактериородопсин у бактерий). В современной физиологии растений под фотосинтезом чаще понимается фотоавтотрофная функция — совокупность процессов поглощения, превращения и использования энергии квантов света в различных эндэргонических реакциях, в том числе превращения углекислого газа в органические вещества.Глюко́за (греч. γλυκόζη, от γλυκύς сладкий) (C6H12O6), или виноградный сахар, или декстроза встречается в соке многих фруктов и ягод, в том числе и винограда, отчего и произошло название этого вида сахара. Является шестиатомным сахаром (гексозой). Глюкозное звено в состав ряда ди- (мальтозы, сахарозы и лактозы) и полисахаридов (целлюлоза, крахмал).строение молекулы-Глюкоза может существовать в виде циклов (α и β глюкозы)./wiki/%D0%A4%D0%B0%D0%B9%D0%BB:Glucose_Fisher_to_Haworth.gifПереход глюкозы из проекции Фишера в проекцию Хоуорса.
Глюкоза — конечный продукт гидролиза большинства дисахаридов и полисахаридов.физ.св-ва-Бесцветное кристаллическое вещество сладкого вкуса, растворимое в воде и органических растворителях, растворимо в реактиве Швейцера: аммиачном растворе гидроксида меди — Cu(NH3)4(OH)2, в концентрированном растворе хлорида цинка и концентрированном растворе серной кислоты.хим.св-ва-Глюкоза может восстанавливаться в шестиатомный спирт (сорбит). глюкоза легко окисляется. Она восстанавливает серебро из аммиачного раствора оксида серебра и медь(II) до меди(I).Проявляет восстановительные свойства. В частности, в реакции растворов сульфата меди с глюкозой и гидроксидом натрия. При нагревании эта смесь реагирует с обесцвечением (сульфат меди сине-голубой) и образованием красного осадка оксида меди(I).Образует оксимы с гидроксиламином, озазоны с производными гидразина.Легко алкилируется и ацилируется.При окислении образует глюконовую кислоту, если воздействовать сильными окислителями на ее гликозиды, и гидролизовать полученный продукт можно получить глюкуроновую кислоту, при дальнейшем окислении образуется глюкаровая кислота.Глюкозаиграет важную роль в организме человека и животных, потому что является универсальным и основным источником энергии, что позволяет обеспечивать нормальное функционирование метаболических процессов. При пищевых отравлениях или возникновении инфекции, глюкозу вводят внутривенно – она выступает в природе как естественное и универсальное антитоксическое средство.
Искусственно в промышленности глюкозу добывают как результат гидролиза крахмала – в природе она образуется растениями при фотосинтезе. Глюкоза в виде кристаллов широко применяется в медицинской отрасли и пищевой промышленности, потому что является полезным природным источником энергии для человека и является незаменимым продуктом питания. Так же этот элемент придает продуктам сладость, стабилизирует их питательную ценность и влажность.
Производство глюкозы широко налажено во всем мире, поэтому, сегодня не возникает проблемы ее купить. Глюкоза используется при изготовлении многих продуктов и товаров, таких как:кондитерские изделия (шоколадки, конфеты, батончики – придает сладость, усиливает вкус); безалкогольные напитки (сохраняет и регулирует вкус); консервы (сохраняет натуральный естественный цвет); мороженое, йогурты, молочные десерты; хлебобулочные изделия (придает аромат и вкус корочке) отрасли настойки, сиропы и таблетки (медицинская отрасль).Фруктоза - С6Н12О6, изомер глюкозы. Она слаще глюкозы и сахарозы. Фруктоза является одним из наиболее часто встречающихся видов натурального сахара. Она присутствует в свободном виде почти во всех сладких ягодах и плодах. Половину сухой части меда составляет фруктоза. Полисахариды, образуемые фруктозой, как, например, инулин и флеин, являются запасами питательных веществ для растений.
Свойства, которые отличают фруктозу от обыкновенного сахара, как например, возможность применения в пищевом рационе больных сахарным диабетом, известны уже десятки лет (см. также Сорбит). Она хорошо усваивается организмом, не оказывая вредного влияния на здоровье и не вызывая побочных явлений.
В зависимости от условий, фруктоза может быть на 90% слаще сахарозы и в два раза слаще сорбита. По вкусу фруктоза не отличается от обыкновенного сахара и не имеет какого-либо привкуса.
вопрос25.дисахариды их состав строение и св-ва.
Дисахариды-это углеводы, которые при нагревании с водой в присутствии минеральных кислот или под влиянием ферментов подвергаются гидролизу, расщепляясь на две молекулы моносахаридов.Молекула дисахарида состоит из двух молекул моносахаридов, соединенных гликозидной связью. В зависимости от того, какие атомы углерода участвуют в образовании гликозидной связи, молекула дисахарида может или не может содержать свободную карбонильную группу.
Дисахариды можно разделить на две группы: невосстанавливающие и восстанавливающие. Невосстанавливающие сахара не имеют ОН-группы ни при одном аномерном центре, восстанавливающие – имеют свободную ОН-группу при аномерном центре. 3. Свойства дисахаридов.Основным представителем дисахаридов является сахароза. Молекула сахарозы состоит из остатков молекулы D-глюкозы и D-фруктозы. Химическая формула — C12H22O11. Сахароза — один из главных углеводов в организме человека, бесцветное кристаллическое вещество. При температуре выше 200є C разлагается с образованием так называемых карамелей. Сахароза не растворима в неполярных органических растворителях, в абсолютном метаноле и этаноле, умеренно растворима в атилацетате, анилине, в водных растворах метанола и этанола. Хорошо растворима в воде. Сахароза не обладает редуцентными свойствами, поэтому она устойчива к действию щелочей, но гидрализуется под влиянием кислот и ферментов сахараз с образованием D — глюкозы и D-фруктозы. Со щелочным металлами образует сахараты. Сахароза является одним из основных дисахаридов. Она гидролизуется HCl желудочного сока и сахаразой слизистой оболочкой тонкой кишки человека.состав.Дисахариды, состоящие из двух моносахаридов.
Сахароза, известная нам как столовый сахар - дисахарид, состоящий из одной молекулы глюкозы и одной молекулы фруктозы. Моно- и дисахариды часто называют простыми углеводами.
вопрос26.полисахариды.крахмал соствав строение хим.св-ва.превращение крахмала пище в организме.
Полисахари́ды — общее название класса сложных высокомолекулярных углеводов, молекулы которых состоят из десятков, сотен или тысяч мономеров — моносахаридов.Полисахариды необходимы для жизнедеятельности животных и растительных организмов.Они являются одним из основных источников энергии, образующейся в результате обмена веществ организма. Они принимают участие в иммунных процессах, обеспечивают сцепление клеток в тканях, являются основной массой органического вещества в биосфере.
Крахма́л (C6H10O5)n — полисахариды амилозы и амилопектина, мономером которых является альфа-глюкоза. Крахмал, синтезируемый разными растениями в хлоропластах, под действием света при фотосинтезе, несколько различается по структуре зёрен, степени полимеризации молекул, строению полимерных цепей и физико-химическим свойствам.Химический состав крахмала
В зависимости от строения и степени полимеризации макромолекул, прочности связей между ними, структуры и величины зерен крахмалы разного происхождения различаются свойствами: Особенно значительны различия между крахмалом картофельным и злаковым - пшеничным, кукурузным и др. Микропористое строение крахмальных зерен обусловливает их высокую сорбционную способность. Благодаря гидрофильным свойствам амилозы и амилопектина крахмальные зерна при тонкопористой структуре очень гигроскопичны, особенно высокая гигроскопичность картофельного крахмала.Строение крахмала.
1. Крахмал (С6H10O5)n – природный полимер.
2. Образуется он в результате фотосинтетической деятельности растений при поглощении энергии солнечного излучения.
3. Сначала из углекислого газа и воды в результате ряда процессов синтезируется глюкоза, что в общем виде может быть выражено уравнением: 6СO2 + 6Н2О = С6Н12O6 + 6O2.
4. Глюкоза далее превращается в крахмал: nС6Н12O6 = (С6H10O5)n + nН2О.
5. Макромолекулы крахмала неодинаковы по размерам: а) в них входит разное число звеньев С6H10O5 – от нескольких сотен до нескольких тысяч, при этом неодинакова и их молекулярная масса; б) различаются они и по строению: наряду с линейными молекулами с молекулярной массой в несколько сотен тысяч имеются молекулы разветвленного строения, молекулярная масса которых достигает нескольких миллионов. Химические свойства крахмала.1. Одно из свойств крахмала – это способность давать синюю окраску при взаимодействии с йодом. Эту окраску легко наблюдать, если поместить каплю раствора йода на срез картофеля или ломтик белого хлеба и нагреть крахмальный клейстер с гидроксидом меди (II), будет видно образование оксида меди (I).2. Если прокипятить крахмальный клейстер с небольшим количеством серной кислоты, нейтрализовать раствор и провести реакцию с гидроксидом меди (II), образуется характерный осадок оксида меди (I). То есть при нагревании с водой в присутствии кислоты крахмал подвергается гидролизу, при этом образуется вещество, восстанавливающее гидроксид меди (II) в оксид меди (I).3. Процесс расщепления макромолекул крахмала водой идет постепенно. Сначала образуются промежуточные продукты с меньшей молекулярной массой, чем у крахмала, – декстрины, затем изомер сахарозы – мальтоза, конечным продуктом гидролиза является глюкоза.4. Реакцию превращения крахмала в глюкозу при каталитическом действии серной кислоты открыл в 1811 г. русский ученый К. Кирхгоф.Разработанный им способ получения глюкозы используется и в настоящее время. 5. Макромолекулы крахмала состоят из остатков молекул циклической L-глюкозы.В организме человека крахмал сырых растений постепенно распадается в пищеварительном тракте, при этом распад начинается еще во рту. Слюна во рту частично превращает его в мальтозу. Вот почему хорошее пережевывание пищи и смачивание ее слюной имеет исключительно важное значение. Старайтесь в своем питании чаще использовать продукты, содержащие естественную глюкозу, фруктозу и сахарозу. Наибольшее количество сахара содержится в овощах, фруктах и сухофруктах, а также проросшем зерне. Крахмал имеет основное пищевое значение. Высоким его содержанием в значительной степени обуславливается пищевая ценность зерновых продуктов. В пищевых рационах человека на долю крахмала приходится около 80% общего количества потребляемых углеводов. Превращение крахмала в организме в основном направлено на удовлетворение потребности в сахаре.
вопрос27.цклюлоза состав и строение св-ва.азотнокислые и уксуснокислые эфиры целюлозы и их применение.
Целлюло́за (фр. cellulose от лат. cellula — «клетка, клетушка») — (C6H10O5)n[1], белое твердое вещество, нерастворимое в воде, молекула имеет линейное (полимерное) строение, структурная единица — остаток β-глюкозы [С6Н7О2(OH)3]n. Полисахарид, главная составная часть клеточных оболочек всех высших растений.Свойства.Целлюлоза- белое волокнистое в-во с длиной волокон более 20 мм (текстильные волокна) и 3 мм (волокна для произ-ва бумаги и картона, хим. переработки). Плота. 1,52-1,54 г/см3;т. разл. 210 °С: степень полимеризации п от неск. сотен до 10-14тыс. Раств. в сравнительно ограниченном числе р-рителей - водных смесях комплексных соед.гидроксидов переходных металлов (Сu, Cd, Ni) с NH3и аминами, нек-рых минер. (H2SO4, Н3РО4)и орг. (трифторуксусная) к-тах, аминоксидах, нек-рых системах (напр., натрийжелезовинный комплекс - аммиак - щелочь, ДМФА - N2O4). Медноаммиачные р-ры целлюлозы используют для формования гидратцеллюлозных волокон и пленок.Строение целлюлозы. Элементарное звено макромолекулы целлюлозы находится в конформации кресла с экваториально расположенными группами ОН и СН2ОН: Теоретически рассчитанная конформация макромолекулы целлюлозы - жесткая спираль (шаг равен 2-3 элементарным звеньям), стабилизированная внутримолекулярными водородными связями.Целлюлоза имеет ряд структурных модификаций, из которых наиболее важны модификации I-IV и X (ЦI-ЦIV и ЦХ). Структура ЦI - модификация природной целлюлозы. Структура ЦII - так называемая гидратцеллюлоза (см. Гидратцеллюлозные волокна), образующаяся при регенерации целлюлозы из ее производных (например, сложных эфиров, щелочной целлюлозы), растворении и последующем осаждении целлюлозы из раствора; ЦIII образуется при обработке ЦI или ЦII жидким NH3 либо безводным этиламином; ЦIV получают обработкой ЦI или ЦII при повышенной температуре глицерином, водой либо водными растворами щелочей; ЦХ - обработкой ЦI 38 - 40,3%-ной НСl при 20°С, нейтрализацией массы с одновременным повышением температуры до 95°С, промывкой, вытеснением воды ацетоном и сушкой.При действии на целлюлозу смеси азотной и серной кислот образуются азотнокислые эфиры целлюлозы.результате взаимодействия целлюлозы со смесью уксусного ангидрида и уксусной кислоты образуются уксуснокислые эфиры целлюлозы — ацетилцеллюлоза. Для получения ацетилцеллюлозы может быть использована облагороженная древесная целлюлоза, однако основным сырьем пока является хлопковая целлюлоза (линтер). Ацетилцеллюлозу употребляют для производства ацетатного шелка, целлона (негорючей пластмассы), лаков, кинопленки и других продуктов. Целлюлоза растворяется в аммиачном растворе окиси меди, образуя медноаммиачное комплексное соединение, которое используется для получения очень тонкого медноаммиачного волокна. При взаимодействии целлюлозы с водой в присутствии катализаторов происходит реакция гидролиза и образуется простейший сахар — глюкоза. В качестве катализаторов обычно используют минеральные кислоты (кислотный гидролиз).Триацетат целлюлозы, или Триацетилцеллюлоза являлись основным веществом при изготовлении подложки фото- и киноплёнок. Обычно называется первичным ацетатом и содержит 62,5 % связанной уксусной кислоты. Растворим в уксусной кислоте, метиленхлориде, хлороформе, дихлорэтане, анилине, пиридине.азотнокислые эфиры-применяются для производства волокон, пленок, пластмасс, лаков, клеев, бездымного пороха и некоторых других продуктов. Сама целлюлоза, не обладая пластичностью, не может быть связующим в производстве пластических масс, тогда как эфирам целлюлозы в определенных условиях свойственна пластичность.
вопрос28.амины классификация изомерия и номенклатура получение.
Ами́ны — органические соединения, являющиеся производными аммиака, в молекуле которого один, два или три атома водорода замещены на углеводородные радикалы.НоменклатураК названию органических остатков, связанных с азотом, добавляют слово «амин», при этом группы упоминают в алфавитном порядке: CHYPERLINK "/wiki/%D0%92%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4"H3NHYPERLINK "/wiki/%D0%A3%D0%B3%D0%BB%D0%B5%D1%80%D0%BE%D0%B4"C3H7 — метилпропиламин, CHYPERLINK "/wiki/%D0%92%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4"H3N(C6H5)2 — метилдифениламин. Для высших аминов название составляется, взяв за основу углеводород, прибавлением приставки «амино», «диамино», «триамино», указывая числовой индекс атома углерода:Для некоторых аминов используются тривиальные названия: C6H5NHYPERLINK "/wiki/%D0%92%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4"H2 — анилин (систематическое название — фениламин).Получение
Восстановление нитросоединений — Реакция Зинина. Эту реакцию впервые осуществил Н. Н. Зинин в 1842 году. Действуя на нитробензол сульфидом аммония, он получил анилин:C6H5NHYPERLINK "/wiki/%D0%9A%D0%B8%D1%81%D0%BB%D0%BE%D1%80%D0%BE%D0%B4"O2 + 3(NHYPERLINK "/wiki/%D0%92%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4"H4)2S → C6H5NHYPERLINK "/wiki/%D0%92%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4"H2 + 6NHYPERLINK "/wiki/%D0%92%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4"H3 + 3S + 2H2O
Восстановление железом:4C6H5NHYPERLINK "/wiki/%D0%9A%D0%B8%D1%81%D0%BB%D0%BE%D1%80%D0%BE%D0%B4"O2 + 9Fe + 4H2O → 4C6H5NHYPERLINK "/wiki/%D0%92%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4"H2 + 3Fe3O4
Восстановление водородом в присутствии катализатора и при высокой температуре:C6H5NHYPERLINK "/wiki/%D0%9A%D0%B8%D1%81%D0%BB%D0%BE%D1%80%D0%BE%D0%B4"O2 + 3H2 → C6H5NHYPERLINK "/wiki/%D0%92%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4"H2 + 2H2OТакже возможно получение путем восстановления нитрилов, оксимов, амидов, путем алкилирования аммиака (реакция Гофмана), путем перегруппировки бензильных четвертичных аммониевых солей (реакция Соммле-Хаузера), путем перегруппировки гидроксамовых кислот (перегруппировка Лоссена).Общая классификация.Обычно гликозиды классифицируют по типу агликона2.Тиольные гликозиды (тиоцианатные, изотиоцианатные, сульфо- и неорганические агликоны) в основном встречаются в растениях семейства крестоцветных (Cruciferae): например, синигрин, выделенный из семян черной горчицы и корней хрена, синальбин из семян белой горчицы и глюкотропеолин из садовой настурции.Цианогенные гликозиды (циангидрин, синильная кислота) обнаружены в сотнях видов растений: амигдалин из горького миндаля, дуррин из сорго и лотузин из Lotus arabicus.Фенольные гликозиды, при гидролизе которых образуются различные типы фенолов: арбутин (образуется гидрохинон), салицин (орто-гидроксибензиловый спирт), хелицин и спиреин (салициловый альдегид), геин (эвгенол) и т.д.Антрагликозиды, которые включают гликозиды гидроксиантрахинонов и антрахинонов, встречаются во многих видах растений, применяемых как слабительное и в качестве сырья для получения красителей. Примерами служат барбалоин из алоэ, франгулин из коры крушины, полигонин из Polygonum sieboldi (горца), реохризин из корней китайского ревеня.Пигментные гликозиды объединяют гликозиды антоксантина, антоциана, флавона, флавонола и других пигментов растений: например, пуницин из плодов граната, мальвин из дикой мальвы (просвирника), генистеин из дрока красильного, идеин из клюквы.Сердечные гликозиды используются при лечении различных сердечных заболеваний. Наиболее важными среди них являются гликозиды из наперстянки (Digitalis) – дигитоксин, гитоксин и гиталин. Строфантины – гликозиды из семян растений рода Strophanthus – задолго до их использования в современной кардиологии применялись в неочищенном виде африканскими племенами как яды для стрел.Сапониновые гликозиды (сапонины) – класс веществ, подобно мылу образующих пену при встряхивании их водных растворов. Отсюда их название: «sapo» по-латыни означает «мыло». Как правило, сапонины – аморфные, растворимые в воде и спирте, нейтральные вещества с раздражающимедким вкусом. При гидролизе они дают агликоны (сапогенины) с довольно большой молекулярной массой и относительно много сахаров. Сапонины широко распространены в растительном мире, особенно среди растений семейств розоцветных и гвоздичных (мыльнянка рода Saponaria).Другие классы гликозидов включают гликозиды галловой кислоты, стеринов, кумаринов, пуринов и пиримидинов (нуклеозиды), меркаптанов, алкалоидов, терпенов, сфингозинов (цереброзиды и ганглиозиды) и некоторых антибиотиков.
вопро29.основные св-ва аминов.сравнение св-в метиламина и диметиламина.
Основные свойства аминов зависят от природы заместителей. В частности, ароматические амины — более слабые основания, чем алифатические, т.к. свободная электронная пара азота вступает в сопряжение с p-системой ароматического ядра, что уменьшает электронную плотность на атоме азота (-М-эффект). Напротив, алкильная группа является хорошим донором электронной плотности (+I-эффект).В молекуле диметиламина атом водорода соединен с двумя метильными радикалами, и к атому азота передается электронная плотность от шести атомов водорода, поэтому электронная плотность на атоме азота больше, чем в молекуле метиламина, и диметиламин является более сильным основанием, чем метиламин. Наконец, в молекуле триметиламина три метильных радикала при атоме азота, и происходит смещение электронов к атому азота от девяти атомов водорода. Поэтому триметиламин является, в свою очередь, более сильным основанием, чем диметиламин. Таким образом, у метиламина основные свойства выражены слабее всего.
вопрос30.анилин физич. и хим. св-ва.значение анилина в органическом синтезе.
Анили́н (фениламин) — органическое соединение с формулой C6H5NHYPERLINK "/wiki/%D0%92%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4"H2, простейший ароматический амин. Представляет собой бесцветную маслянистую жидкость с характерным запахом, немного тяжелее воды и плохо в ней растворим, хорошо растворяется в органических растворителях. На воздухе быстро окисляется и приобретает красно-бурую окраску. Ядовит. Название «анилин» происходит от названия одного из растений, содержащих индиго — Indigofera anil (современное международное название растения — Indigofera suffruticosa).Химические свойства.Для анилина характерны реакции как по аминогруппе, так и по ароматическому кольцу. Особенности этих реакций обусловлены взаимным влиянием атомов. С одной стороны, бензольное кольцо ослабляет основные свойства аминогруппы по сравнению с алифатическими аминами и даже с аммиаком. С другой стороны, под влиянием аминогруппы бензольное кольцо становится более активным в реакциях замещения, чем бензол. Например, анилин энергично реагирует с бромной водой с образованием 2,4,6-триброманилина (белый осадок).Физические свойства аминов.Метиламин, диметиламин и триметиламин — газы, средние члены алифатического ряда - жидкости, высшие — твердые вещества. Низшие амины имеют характерный «рыбный» запах, высшие не имеют запаха.Связь N–H является полярной, поэтому первичные и вторичные амины образуют межмолекулярные водородные связи(несколько более слабые, чем Н-связи с участием группы О–Н).Исключительное значение за несколько последних десятилетий приобрели высокомолекулярные органические соединения. Промышленность производит множество синтетических смол и на их основе разнообразные по своим свойствам и назначению пластические массы (пластмассы]. На современном уровне развития производства синтетические материалы являются важнейшим фактором технического прогресса и роста производительности труда во всех отраслях народного хозяйства. значение.Синтетические материалы играют важнейшую роль в авиационной и автомобильной промышленности, в приборостроении, в химической промышленности, в электро-и радиотехнике; некоторые из них идут для изготовления так называемого органического стекла и синтетических волокон.Производство промышленных товаров также во многом связано с применением различных органических веществ. При этом все большее значение для производства товаров народного потребления приобретают различные синтетические материалы.
вопрос31.понятие об аминокислотах физ. и хим. св-ва.
Аминокисло́ты (аминокарбо́новые кисло́ты) — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы.Физические свойстваАминокислоты — бесцветные кристаллические вещества, хорошо растворимые в воде. хим.св-ва-Многие из них обладают сладким вкусом.Все аминокислоты амфотерные соединения, они могут проявлять как кислотные свойства, обусловленные наличием в их молекулах карбоксильной группы —CHYPERLINK "/wiki/%D0%9A%D0%B8%D1%81%D0%BB%D0%BE%D1%80%D0%BE%D0%B4"OHYPERLINK "/wiki/%D0%9A%D0%B8%D1%81%D0%BB%D0%BE%D1%80%D0%BE%D0%B4"OHYPERLINK "/wiki/%D0%92%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4"H, так и основные свойства, обусловленные аминогруппой —NHYPERLINK "/wiki/%D0%92%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4"H2. Аминокислоты взаимодействуют с кислотами и щелочами:
NHYPERLINK "/wiki/%D0%92%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4"H2 —CHYPERLINK "/wiki/%D0%92%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4"H2 —CHYPERLINK "/wiki/%D0%9A%D0%B8%D1%81%D0%BB%D0%BE%D1%80%D0%BE%D0%B4"OHYPERLINK "/wiki/%D0%9A%D0%B8%D1%81%D0%BB%D0%BE%D1%80%D0%BE%D0%B4"OHYPERLINK "/wiki/%D0%92%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4"H + HHYPERLINK "/wiki/%D0%A5%D0%BB%D0%BE%D1%80"Cl → HHYPERLINK "/wiki/%D0%A5%D0%BB%D0%BE%D1%80"Cl • NHYPERLINK "/wiki/%D0%92%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4"H2 —CHYPERLINK "/wiki/%D0%92%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4"H2 —CHYPERLINK "/wiki/%D0%9A%D0%B8%D1%81%D0%BB%D0%BE%D1%80%D0%BE%D0%B4"OHYPERLINK "/wiki/%D0%9A%D0%B8%D1%81%D0%BB%D0%BE%D1%80%D0%BE%D0%B4"OHYPERLINK "/wiki/%D0%92%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4"H (хлороводородная соль глицина)
NHYPERLINK "/wiki/%D0%92%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4"H2 —CHYPERLINK "/wiki/%D0%92%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4"H2 —CHYPERLINK "/wiki/%D0%9A%D0%B8%D1%81%D0%BB%D0%BE%D1%80%D0%BE%D0%B4"OHYPERLINK "/wiki/%D0%9A%D0%B8%D1%81%D0%BB%D0%BE%D1%80%D0%BE%D0%B4"OHYPERLINK "/wiki/%D0%92%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4"H + NaHYPERLINK "/wiki/%D0%9A%D0%B8%D1%81%D0%BB%D0%BE%D1%80%D0%BE%D0%B4"OHYPERLINK "/wiki/%D0%92%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4"H → H2O + NHYPERLINK "/wiki/%D0%92%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4"H2 —CHYPERLINK "/wiki/%D0%92%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4"H2 —CHYPERLINK "/wiki/%D0%9A%D0%B8%D1%81%D0%BB%D0%BE%D1%80%D0%BE%D0%B4"OHYPERLINK "/wiki/%D0%9A%D0%B8%D1%81%D0%BB%D0%BE%D1%80%D0%BE%D0%B4"OHYPERLINK "/wiki/%D0%9D%D0%B0%D1%82%D1%80%D0%B8%D0%B9"Na (натриевая соль глицина)
Растворы аминокислот в воде благодаря этому обладают свойствами буферных растворов, т.е. находятся в состоянии внутренних солей.
NHYPERLINK "/wiki/%D0%92%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4"H2 —CHYPERLINK "/wiki/%D0%92%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4"H2CHYPERLINK "/wiki/%D0%9A%D0%B8%D1%81%D0%BB%D0%BE%D1%80%D0%BE%D0%B4"OHYPERLINK "/wiki/%D0%9A%D0%B8%D1%81%D0%BB%D0%BE%D1%80%D0%BE%D0%B4"OHYPERLINK "/wiki/%D0%92%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4"H
– Конец работы –
Используемые теги: Теория, химического, строения, Бутлерова, Структурные, формулы, молекул, Предельные, углеводороды0.118
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Теория химического строения А.М. Бутлерова. Структурные формулы молекул. Предельные углеводороды
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов