рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Контрольные задания по дисциплине Химия
Реферат Курсовая Конспект
Контрольные задания по дисциплине Химия
Контрольные задания по дисциплине Химия - раздел Химия, Контрольные Задания По Дисциплине «Химия» Для Студе...
Контрольные задания по дисциплине «Химия»
для студентов 1 курса Политехнического факультета
направления 220700.62 «Автоматизация технологических процессов и производств»
дневной формы обучения
Контрольная работа №1.
Химическая термодинамика. Химическая кинетика и равновесие
Вариант 1
1. Что называется внутренней энергией, энтальпией?
2. Определите количество теплоты, выделяющееся при гашении 100 кг извести водой при 25 °С, если известны стандартные теплоты образования веществ, участвующих в химической реакции:
ΔfH˚298 (CaO кр) = -635,1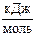 ;
;
ΔfH˚298 (Н2О ж) = -285,84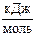 ;
;
ΔfH˚298 (Ca(OН)2 кр) = -982,2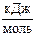 .
.
3. Исходя из ΔfG˚298 соединений, участвующих в реакции, определите, возможна ли реакция:
Al2O3 (кр) + 3SO3 (г) ® Al2(SO4)3 (кр)
4. В какую сторону сместится равновесие реакции:
NiO (кр) « Ni (кр) + 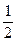 O2 (г) – Q; ΔrH = 262 кДж
O2 (г) – Q; ΔrH = 262 кДж
при понижении температуры, при понижении давления?
5. Во сколько раз изменится константа скорости реакции при увеличении температуры от 500 до 1000 К, если энергия активации равна 95,5 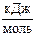 .
.
6. Вычислите константу равновесия химической реакции:
2SO2 (г) + O2 (г) « 2SO3 (г),
протекающей в закрытом сосуде при постоянной температуре. Начальные концентрации веществ равны ( ): С(SO2) = 0,08; C(O2) = 0,06. К моменту наступления равновесия в смеси остаётся 20% первоначального количества SO2.
): С(SO2) = 0,08; C(O2) = 0,06. К моменту наступления равновесия в смеси остаётся 20% первоначального количества SO2.
Вариант 2
1. Вычислите теплоту образования Fe3O4, исходя из реакции, протекающей по уравнению:
8Al + 3Fe3O4 ® 4Al2O3 + 9Fe + 3349,9 кДж
если теплота образования Al2O3 равна –1675 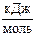 . Сформулируйте закон, на основе которого решаются подобные задачи.
. Сформулируйте закон, на основе которого решаются подобные задачи.
2. Определите ΔrS˚298 системы: H2 (г) + S (ромб) ® H2S (г)
3. Вычислите ΔrG˚298 системы PbO2 + Pb ® 2PbO на основании ΔfH˚298 и S˚298 реагирующих веществ. Определите, возможна ли эта реакция.
4. Укажите факторы, влияющие на скорость химической реакции. Сформулируйте правило Вант-Гоффа.
5. Определите энергию активации реакции, если при увеличении температуры от 500 до 1000 К константа скорости реакции возросла в 100 раз.
6. Константа равновесия химической реакции H2 (г) + I2 (г) ® 2HI (г) при некоторой температуре равна 4. Рассчитайте равновесную концентрацию HI, если исходные концентрации H2 и I2 равны соответственно 0,030 и 0,012  .
.
Вариант 3
1. В каких случаях возможно самопроизвольное протекание химических реакций при стандартных условиях, если принять ½DH°½>>½TDS°½?
2. Восстановление диоксида свинца водородом протекает по уравнению:
PbO2 (кр) + H2 (г) ® PbO (кр) + H2O (ж); ΔrH˚298 = -182,8 кДж
Определите стандартную теплоту образования PbO2.
3. Рассчитайте ΔrS˚298 реакции разложения бертолетовой соли, если:
S˚298(KClO3) = 142,97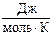 ,
,
S˚298(KCl) = 82,68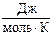 .
.
4. Даны следующие системы:
С (гр) + Н2О (г) « СО (г) + Н2 (г); ΔrH = 131,4 кДж
Н2 (г) + Cl2 (г) « 2HCl (г); ΔrH = -175,7 кДж
РCl5 (г) « PCl3 (г) + Cl2 (г) + Q
CO (г) + Сl2 (г) « СOCl2 (г) – 109,6 кДж
Укажите, какая из систем (1) – (4) является гомогенной? Для каких из реакций (1) – (4) равновесие сместится влево при повышении температуры?
5. Вычислите энергию активации реакции разложения диоксида азота: 2NO2® 2NO + O2,
если константы скорости реакции при 600 и 640 К соответственно равны 83,9 и 407,0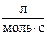 .
.
6. Во сколько раз увеличится скорость реакции, протекающей в газовой фазе, при повышении температуры от 30 до 70 °С, если температурный коэффициент реакции равен 2?
Вариант 4
1. Почему при низких температурах критерием, определяющим направление самопроизвольного процесса реакций, может служить знак DH , а при достаточно высоких температурах таким критерием является знак DS?
2. При растворении 16 г СаО в воде выделяется 19,3 кДж теплоты. Определите стандартную теплоту образования Са(ОН)2.
3. Вычислите изменение энтропии при стандартных условиях в следующей реакции:
СН4 (г) + 4Cl2 (г) ® ССl4 (ж) + 4HCl (г)
S˚298(СCl4 ж) = 216,19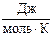 .
.
4. В каких единицах выражается концентрация газообразных и жидких веществ (укажите размерность)?
5. Константа скорости реакции А + 2В ® 3С равна 0,6 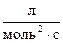 . Начальные концентрации А и В равны соответственно 2,0 и 2,5
. Начальные концентрации А и В равны соответственно 2,0 и 2,5  . В результате реакции концентрация вещества В оказалась равной 0,5
. В результате реакции концентрация вещества В оказалась равной 0,5  . Вычислите, какова концентрация вещества А и начальная скорость реакции.
. Вычислите, какова концентрация вещества А и начальная скорость реакции.
6. Рассчитайте константу равновесия К химической реакции при 1000 К, если стандартная энергия Гиббса реакции равна при этой температуре –19,1 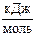 .
.
Вариант 5
1. Вычислите изменение энтропии для реакций, протекающих по уравнениям:
С (гр) + СО2 (г) ® 2СО (г);
N2 (г) + 2О2 (г) ® 2NO2 (г);
N2 (г) + О2 (г) ® 2NO (г).
Почему в этих реакциях ΔrS˚298 имеет значения >0, <0, »0?
2. В каком направлении нижеприведённая реакция будет протекать самопроизвольно:
Fe2O3 (кр) + 3Н2 (г) « 2Fe (кр) + 3Н2О (г)
Необходимые для расчёта ΔrG˚298 реакции значения ΔfH˚298 и S˚298 веществ – участников реакции возьмите из справочника.
3. Тепловой эффект реакции: SO2 (г) + 2Н2S (г) ® 3S (ромб) + 2Н2О (ж)
равен –234,50 кДж. Определите стандартную теплоту образования H2S.
4. Какие вещества называются катализаторами? Что такое положительный и отрицательный катализаторы? Как влияет катализатор на скорость химической реакции, на истинное равновесие?
5. Определите энергию активации реакции, если при изменении температуры от 330 до 400 К константа скорости реакции увеличилась в 105 раз.
6. Вычислите константу равновесия реакции: СО (г) + Н2О (г) « СО2 (г) + Н2 (г)
если начальные концентрации веществ ( ):
):
С(СО) = 0,01; С(Н2О) = 0,02; С(Н2) = 0,01; С(СО2) = 0,01.
Концентрация СО в состоянии равновесия равна 0,007 .
.
Вариант 6
1. Вычислите изменение энтропии для реакций, протекающих по уравнениям:
2SO2 (г) + О2 (г) ® 2SO3 (г);
Ca(OH)2 (кр) ® CaO (кр) + Н2О (г);
Н2 (г) + Cl2 (г) ® 2HCl (г).
Почему в этих реакциях ΔrS˚298 имеет значения >0, <0, »0?
2. В каком направлении будет протекать реакция получения аммиака:
NH4Cl (кр) + NaOH (кр) ® NaCl (кр) + Н2О (г) + NH3 (г),
если реагирующие вещества взяты в стандартных условиях?
3. Вычислите стандартную теплоту образования сахарозы С12Н22О11, если тепловой эффект реакции: С12Н22О11 (кр) + 12О2 (г) ® 12СО2 (г) + 11Н2О (ж) равен –5646,73 кДж.
4. Какие химические процессы называются обратимыми и необратимыми? Приведите примеры практически обратимых и совершенно необратимых процессов.
5. Вычислите во сколько раз возрастает скорость реакции при увеличении температуры на 40°С, если температурный коэффициент этой реакции равен 3.
6. Константа скорости гетерогенной реакции: FeO (кр) + СО (г) « Fe (кр) + СО2 (г) равна 0,5. Чему равны равновесные концентрации СО и СО2, если их начальные концентрации равны ( ): С (СО) = 0,05; С (СО2) = 0,01?
): С (СО) = 0,05; С (СО2) = 0,01?
Вариант 7
1. Сформулируйте закон Гесса и следствия из него. Приведите примеры использования закона Гесса.
2. При образовании 2,69×10-2 кг хлорида меди (II) из простых веществ выделяется 41,17 кДж теплоты. Найдите теплоту образования хлорида меди (II).
3. Исходя из величин ΔfG˚298 соединений, участвующих в реакции, определите, возможна ли реакция: Al2O3 (кр) + 2SO3 (г) ® Al2(SO4)3 (кр).
4. В чём состоит различие в выражениях констант равновесия гомогенных и гетерогенных процессов (приведите примеры)?
5. Во сколько раз изменится константа скорости реакции при увеличении температуры от 500 до 1000 К, если энергия активации равна 95,5 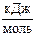 .
.
6. При синтезе фосгена имеет место равновесие реакции: Cl2 (г) + СО (г) « СОCl2 (г). Определите исходные концентрации хлора и оксида углерода, если равновесные концентрации равны ( ): [Cl2] = 2,5; [CO] = 1,8; [COCl2] = 3,2. Рассчитайте константу равновесия.
): [Cl2] = 2,5; [CO] = 1,8; [COCl2] = 3,2. Рассчитайте константу равновесия.
Вариант 8
1. Что называется стандартным изменением энергии Гиббса, единица измерения энергии Гиббса?
2. Сколько теплоты выделится при разложении 54 г глюкозы по реакции:
С6Н12О6 (кр) ® 2С2Н5ОН (ж) + 2СО2 (г), если:
ΔfH˚298 (С6Н12О6 кр) = -1273,00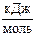 ;
;
ΔfH˚298 (С2Н5ОН ж) = -276,98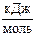 ;
;
ΔfH˚298 (CO2 г) = -393,51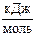 .
.
3. Определите изменение энтропии реакции при стандартных условиях:
4NH3 (г) + 3О2 (г) ® 6Н2О (ж) + 2N2 (г)
4. В какую сторону сместится равновесие реакции:
2СО (г) + О2 (г) « 2СО2 (г); ΔrH° = -566,0 кДж
при повышении температуры, при понижении давления?
5. Температурный коэффициент скорости некоторой реакции равен 2. На сколько градусов надо повысить температуру, чтобы скорость химической реакции увеличилась в 16 раз?
6. При установлении равновесия реакции:
4HCl (г) + O2 (г) « 2Cl2 (г) + 2Н2О (г)
концентрации веществ – участников реакции равны соответственно ( ):
):
[HCl] = 0,1; [O2] = 0,05; [Cl2] = 0,9; [H2O] = 0,9.
Рассчитайте константу равновесия и исходную концентрацию хлороводорода.
Вариант 9
1. В каких случаях возможно самопроизвольное протекание химической реакции, если принять ½DH°½<< ½TDS°½?
2. Тепловой эффект реакции:
SO2 (г) + 2H2S (г) ® 3S (ромб) + 2Н2О (ж)
равен –234,50 кДж. Определите стандартную теплоту образования H2S.
3. Используя значения ΔfG˚298 соединений, участвующих в реакции:
C6H6 (ж) + NH3 (г) ® С6Н5NH2 (ж) + Н2 (г),
определите, возможна ли эта реакция, ΔfG˚298 (С6Н5NH2 ж) = 149,08 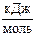 .
.
4. Выведите уравнение константы химического равновесия для реакции:
MgO (кр) + СО2 (г) « MgCO3 (кр); DrH° < 0.
Какими способами можно сместить химическое равновесие этой системы влево?
5. При 398 К реакция заканчивается за 18 мин. Через сколько времени эта реакция закончится при 453 К, если температурный коэффициент скорости реакции равен 3?
6. Равновесие реакции: H2 (г) + Cl2 (г) « 2НCl (г) установилось при следующих концентрациях участвующих в ней веществ: ( ): [Н2] = 0,25; [Cl2] = 0,05; [HCl] = 0,9. Определите исходные концентрации хлора и водорода.
): [Н2] = 0,25; [Cl2] = 0,05; [HCl] = 0,9. Определите исходные концентрации хлора и водорода.
Вариант 10
1. Уменьшится или увеличится энтропия при переходе водяного пара в жидкость, кристаллического йода в парообразное состояние? Почему? Вычислите DS° для каждого превращения.
2. Определите ΔfH˚298 (Fe2O3 кр), если при реакции:
2Fe (кр) + Al2O3 (кр) ® Fe2O3 (кр) + 2Al (кр)
на каждые 80 г Fe2O3 поглощается 426,5 кДж теплоты.
3. Рассчитайте ΔrG˚298 реакции: N2 (г) + 2H2O (г) ® NH4NO2 (г) и сделайте вывод о возможности её протекания. ΔfG˚298 (NH4NO2 г) = 115,94 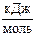 .
.
4. Выведите уравнение константы химического равновесия для реакции:
MgO (кр) + СО2 (г) « MgCO3 (кр); DrH° < 0.
Какими способами можно сместить химическое равновесие этой системы влево?
5. Вычислите температурный коэффициент некоторой реакции, если константа скорости этой реакции при 120°С равна 5,88×10-4, а при 170°С – 6,7×10-2.
6. Равновесные концентрации веществ – участников реакции:
СН3СООН (ж) + С2Н5ОН (ж) ® СН3СООС2Н5 (ж) + Н2О (ж)
равны соответственно ( ): [СН3СООН ж] = 0,02; [С2Н5ОН ж] = 0,32; [СН3СООС2Н5 ж] = 0,08; [Н2О ж] = 0,08. Какими стали равновесные концентрации после смещения равновесия вследствие увеличения концентрации С2Н5ОН в 4 раза?
): [СН3СООН ж] = 0,02; [С2Н5ОН ж] = 0,32; [СН3СООС2Н5 ж] = 0,08; [Н2О ж] = 0,08. Какими стали равновесные концентрации после смещения равновесия вследствие увеличения концентрации С2Н5ОН в 4 раза?
Вариант 11
1. Как должна изменится энтропия при эндотермическом процессе, чтобы он мог протекать самопроизвольно?
2. Определите стандартную теплоту образования сероуглерода CS2, используя тепловой эффект следующей реакции:
CS2 (ж) + 3О2 (г) ® СО2 (г) + 2SO2 (г); ΔrН˚298 = -1075 кДж.
3. Определите ΔrG˚298 реакции, протекающей по уравнению:
4NH3 (г) + 5О2 (г) ® 4NO (г) + 6Н2О (г).
Вычисления сделайте на основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ. Возможна ли эта реакция в стандартных условиях?
4. При определённых условиях реакция хлороводорода с кислородом является обратимой:
4HCl (г) + О2 (г) « 2Cl2 (г) + 2Н2О (г); ΔrН = -116,4 кДж.
Какое влияние на равновесие системы окажут:
– увеличение давления,
– повышение температуры,
– введение катализатора?
5. При температуре 30°С реакция протекает за 25 мин, при 50°С – за 4 мин. Рассчитайте температурный коэффициент скорости реакции.
6. При состоянии равновесия системы: СО (г) + Сl2 (г) « COCl2 (г) концентрация оксида углерода (II) равна 3 ; хлора – 0,3
; хлора – 0,3 ; фосгена – 2
; фосгена – 2 . Вычислите исходную концентрацию хлора и константу равновесия.
. Вычислите исходную концентрацию хлора и константу равновесия.
Вариант 12
1. Сформулируйте закон Гесса и следствия из него. Приведите примеры использования закона Гесса.
2. Определите тепловой эффект реакции: CaO (кр) + СО2 (г) ® СаСО3 (кр), если при взаимодействии 140 г оксида кальция с углекислым газом выделяется 444 кДж теплоты.
3. Укажите, будет ли процесс 2Al (кр) + Fe2O3 (кр) ® 2Fe (кр) + Al2O3 (кр) протекать самопроизвольно. Значения ΔfH˚298 и S˚298, необходимые для расчёта ΔrG˚298 найдите в справочнике.
4. Каким из указанных ниже способов можно увеличить выход водяного пара в реакции:
СО2 (г) + Н2 (г) « СО (г) + Н2О (г); ΔrН = -0,8 кДж
а) увеличить давление,
б) уменьшить давление,
в) увеличить концентрацию водорода,
г) уменьшить концентрацию углекислого газа.
5. Энергия активации реакции: 2HI (г) ® Н2 (г) + I2 (г) равна 186,4 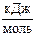 . Рассчитайте константу скорости этой реакции при 700 К, если при 456 К константа скорости равна 0,942×10-6
. Рассчитайте константу скорости этой реакции при 700 К, если при 456 К константа скорости равна 0,942×10-6 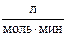 .
.
6. При нагревании диоксида азота в закрытом сосуде до некоторой температуры равновесие реакции: 2NO2 « 2NO + O2 установилось при концентрации диоксида азота, равной 0,8 ; оксида азота – 2,2
; оксида азота – 2,2 ; кислорода – 1,1
; кислорода – 1,1 . Вычислите константу равновесия реакции для этой температуры и исходную концентрацию диоксида азота.
. Вычислите константу равновесия реакции для этой температуры и исходную концентрацию диоксида азота.
Вариант 13
1. Уменьшится или увеличится энтропия при переходе кислорода в озон, воды в лёд? Почему? Определите DS° для каждого превращения.
2. Найдите теплоту образования оксида серы (IV), если известно, что при сжигании серы выделилось 74,225 кДж теплоты, и образовалось 0,016 кг оксида серы (IV).
3. Восстановление Fe3O4 оксидом углерода (II) идёт по уравнению:
Fe3O4 (кр) + СО (г) ® 3FeO (кр) + CО2 (г)
Вычислите ΔrG˚298 и сделайте вывод о возможности самопроизвольного протекания этой реакции при стандартных условиях. Чему ΔrS˚298 равно в этом процессе?
4. При определённых условиях реакция хлороводорода с кислородом является обратимой:
4HCl (г) + О2 (г) « 2Cl2 (г) + 2Н2О (г); ΔrН = -116,4 кДж.
Какое влияние на равновесие системы окажут:
– увеличение давления,
– повышение температуры,
– введение катализатора?
5. Во сколько раз увеличится скорость реакции, протекающей в газовой фазе, при повышении температуры от 30 до 70°С, если температурный коэффициент реакции равен 2?
6. При синтезе аммиака при некоторых условиях в равновесии находятся 0,1 N2; 0,2
N2; 0,2 Н2; 0,8
Н2; 0,8 NH3. Вычислите константу равновесия и рассчитайте исходные концентрации азота и водорода.
NH3. Вычислите константу равновесия и рассчитайте исходные концентрации азота и водорода.
Вариант 14
1. Что такое внутренняя энергия, энтальпия? Сформулируйте первый закон термодинамики.
2. Определите, какое количество теплоты выделится при сжигании 3 кг сероуглерода CS2 (ж), если продуктами реакции сгорания сероуглерода являются CO2 (г) и SO2 (г). Расчёт сделайте с использованием стандартных теплот образования веществ – участников реакции.
3. Определите изменение энтропии в следующей реакции:
2Al (кр) + Cr2O3 (кр) ® 2Сr (кр) + Al2O3 (кр)
4. В какую сторону сместится равновесие в системе:
NiO (кр) « Ni (кр) + 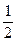 О2 (г); ΔrН° = 262
О2 (г); ΔrН° = 262 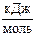
при понижении температуры, при понижении давления?
5. Вычислите энергию активации реакции разложения диоксида азота:
2NO2 ® 2NO + O2,
если константы скорости этой реакции при 600 К и при 640 К раны соответственно: 83,9 и 407,0 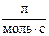 .
.
6. Константа скорости реакции: СО2 (г) + Н2 (г) « СО (г) + Н2О (г) при 1100 К равна 1. Исходная концентрация оксида углерода (IV) составляет 0,2 ; водорода – 0,8
; водорода – 0,8 . При каких концентрациях всех четырёх веществ установится равновесие.
. При каких концентрациях всех четырёх веществ установится равновесие.
Вариант 15
1. Какое из двух неравенств ΔS˚298 > 0 или ΔS˚298 < 0 отвечает изменению энтропии в процессах:
а) плавления льда;
б) кипения воды;
в) синтеза аммиака.
Ответ поясните.
2. Возможно ли самопроизвольное протекание следующей реакции:
2Hg2Cl2 ® 2HgCl2 + 2Hg
Ответ подтвердите, рассчитав ΔrG˚298 этой системы.
3. Какое количество теплоты выделяется при превращении 1 кг красного фосфора в чёрный, если ΔfН˚298 (Р красный) = -17,45 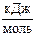 , а ΔfН˚298 (Р чёрный) = -43,20
, а ΔfН˚298 (Р чёрный) = -43,20 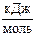 .
.
4. В какую сторону сместится равновесие процесса:
2СО (г) « СО2 (г) + С (гр); ΔrН˚298 = -172,4 кДж
при повышении температуры, при повышении давления?
5. Разложение NO2 на поверхности золота при высоких температурах протекает по уравнению: 2N2O ® 2N2 + O2. Константа скорости данной реакции равна 5,1×10-4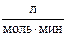 при 1173 К. Начальная концентрация N2O равна 3,2
при 1173 К. Начальная концентрация N2O равна 3,2 . Определите скорость реакции при заданной температуре в начальный момент времени и в тот момент, когда разложится 25% N2O.
. Определите скорость реакции при заданной температуре в начальный момент времени и в тот момент, когда разложится 25% N2O.
6. Определите равновесную концентрацию водорода в реакции: 2HI « H2 + I2, если исходная концентрация HI составляет 0,55  , а константа равновесия Кс = 0,12.
, а константа равновесия Кс = 0,12.
Вариант 16
1. Что такое энтропия? Сформулируйте второй закон термодинамики для изолированных систем.
2. Исходя из теплового эффекта реакции:
3СаО (кр) + Р2О5 (кр) ® Са3(РО4)2 (кр); ΔrН˚298 = -739 кДж,
определите ΔfН˚298 ортофосфата кальция.
3. Рассчитайте ΔrG˚298 следующей реакции: Pb (кр) + CuO (кр) ® PbO (кр) + Cu (кр). При расчёте используйте значения ΔfH˚298 и S˚298 веществ – участников реакции. Укажите, будет ли данная реакция идти самопроизвольно?
4. Не проводя вычислений, установите знак ΔrS˚ следующих процессов:
2NH3 (г) ® N2 (г) + 3Н2 (г);
2NO (г) + О2 (г) ® 2NO2 (г);
2СН3ОН (г) + 3О2 (г) ® 4Н2О (г) + 2СО2 (г);
2НCl (г) ® Н2 (г) + Сl2 (г).
5. Каково значение энергии активации реакции, скорость которой при 300 К в 10 раз больше, чем при 280 К.
6. Найдите константу равновесия реакции: N2O4 « 2NO2, если начальная концентрация N2O4 составляла 0,08 , а к моменту наступления равновесия диссоциировало 50% N2O4.
, а к моменту наступления равновесия диссоциировало 50% N2O4.
Вариант 17
1. Исходя из уравнения реакции:
СН3ОН (ж) + 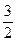 О2 (г) ® СО2 (г) + Н2О (ж); ΔrН˚298 = -726,6
О2 (г) ® СО2 (г) + Н2О (ж); ΔrН˚298 = -726,6 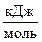 ,
,
определите стандартную теплоту образования метилового спирта.
2. Рассчитайте ΔrG˚298 следующей реакции:
8Al (кр) + 3Fe3O4 (кр) ® 9Fe (кр) + 4Al2O3 (кр)
При расчёте используйте значения ΔfH˚298 и S˚298 веществ – участников реакции.
3. От каких факторов зависят скорость химической реакции и константа скорости химической реакции? Сформулируйте закон действующих масс.
4. При 150°С некоторая реакция заканчивается за 16 мин. Принимая температурный коэффициент скорости реакции равным 2,5, рассчитайте, через какое время закончится эта реакция, если проводить её при 200°С.
5. Чему равна энергия активации реакции, если при повышении температуры от 290 до 300 К скорость её увеличится в 2 раза?
6. В замкнутом сосуде протекает реакция АВ (г) « А (г) + В (г). Константа равновесия реакции равна 0,04, а равновесная концентрация вещества В составляет 0,02  . Найдите начальную концентрацию вещества АВ. Сколько процентов вещества АВ разложилось?
. Найдите начальную концентрацию вещества АВ. Сколько процентов вещества АВ разложилось?
Вариант 18
1. Определите ΔrH˚298 реакции синтеза акриловой кислоты:
СНºСН (г) + СО (г) + Н2О (ж) ® СН2=СНСООН (ж),
если известны теплоты сгорания веществ – участников реакции:
| Вещество | СНºСН (г) | СО (г) | Н2О (ж) | СН2=СНСООН (ж) |
ΔсH˚298, 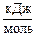
| -1299,63 | -282,92 | -1368,03 |
2. Вычислите ΔfH˚298 MgCO3 (кр), пользуясь следующими данными:
С (гр) + О2 (г) ® СО2 (г); ΔrH˚298 = -393,5 кДж
2Mg (кр) + О2 (г) ® 2MgO (кр); ΔrH˚298 = -1203,6 кДж
MgО (кр) + СО2 (г) ® MgCO3 (кр); ΔrH˚298 = -117,7 кДж
3. Можно ли восстановить Fe2O3 алюминием до свободного металла при температуре 500 К. Ответ аргументируйте расчётом.
4. Сформулируйте принцип Ле-Шателье. В какую сторону смещается равновесие в системе при повышении давления, при понижении температуры?
5. Энергия активации реакции разложения йодида водорода при использовании катализатора (Pt) уменьшится с 168 до 59 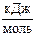 . Во сколько раз возрастёт скорость реакции при 500 К?
. Во сколько раз возрастёт скорость реакции при 500 К?
6. Для реакции Н2 (г) + Br2 (г) « 2HBr (г) при некоторой температуре К = 1. Определите состав (в процентах по объёму) равновесной реакционной смеси, если 1 л исходной смеси содержал 3 моля Н2 и 2 моля Br2.
Вариант 19
1. Тепловой эффект реакции: СО (г) + 2Н2 (г) ® СН3ОН (ж) ΔrН˚298 = -128,1 кДж. Рассчитайте массу образовавшегося метанола, если в результате реакции выделяется 5000 кДж.
2. Определите теплоту образования ΔfH˚298 жидкого анилина. Для решения используйте значение теплоты сгорания:
С6Н7N (ж.) + 7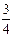 O2 (г.) = 6CO2 (г.) + 3
O2 (г.) = 6CO2 (г.) + 3 H2O (ж.) +
H2O (ж.) + 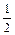 N2 (г.), ΔсH˚298 = -3396,2
N2 (г.), ΔсH˚298 = -3396,2 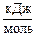
3. Какой знак имеет изменение энтропии процессов: сублимации йода; перехода ромбической серы в моноклинную; превращения кислорода в озон?
4. Сформулируйте правило Вант-Гоффа. Чему равен температурный коэффициент скорости реакции, если при увеличении температуры на 30°С скорость реакции возрастает в 15,6 раз?
5. Скорость реакции окисления SO2 при 710 К под действием катализатора возрастает в 500 раз. Насколько уменьшается энергия активации?
6. После смешивания газов А и В в системе А (г) + В (г) « С (г) + D (г) устанавливается равновесие при следующих концентрациях: [B] = 0,05 ; [C] = 0,02
; [C] = 0,02 . Константа равновесия реакции К = 4×10-2. Найдите исходные концентрации веществ А и В.
. Константа равновесия реакции К = 4×10-2. Найдите исходные концентрации веществ А и В.
Вариант 20
1. Что такое стандартная теплота образования вещества? Определите стандартную теплоту образования ΔfH˚298 С2Н5ОН (ж), если теплоты сгорания С (гр), Н2 (г), О2 (г), С2Н5ОН (ж) равны соответственно, 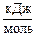 : -393,51; -285,83; 0; -1370,68.
: -393,51; -285,83; 0; -1370,68.
2. Определите изменение энтропии ΔrS˚298 реакции сгорания метана:
СН4 (г) + 2О2 (г) ® СО2 (г) + 2Н2О (г)
3. Пользуясь справочными данными, покажите, что в стандартных условиях при 25°С приведённая ниже реакция невозможна.
Cu (кр) + ZnO (кр) ® CuO (кр) + Zn (кр)
При расчёте используйте значения ΔfH˚298 и S˚298 веществ – участников реакции.
4. Учитывая, что NO2 (г) окрашен, а N2O4 (г) бесцветен, и исходя из знака изменения энтальпии реакции: 2NO2 (г) « N2O4 (г), предскажите, как изменится окраска в системе при увеличении температуры: а) усилится, б) ослабеет.
5. Во сколько раз изменится скорость реакции 2А + В ® А2В, если концентрацию вещества А увеличить в 2 раза, а концентрацию вещества В уменьшить в 2 раза?
6. В закрытом сосуде установилось равновесие: СО2 (г) + Н2 (г) « СО (г) + Н2О (г). Константа равновесия К = 1. Определите, сколько процентов СО2 подвергнется превращению в СО при данной температуре, если смешать 1 моль СО2 и 5 молей Н2?
Контрольная работа №2.
Растворы
Вариант 1
1. Определите молярную концентрацию раствора, полученного при смешивании 200 мл 8М и 300 мл 2М растворов серной кислоты.
2. К водному раствору слабого электролита ЭCl2 добавили сильного электролита BaCl2. Как это влияет на значение константы и степени электролитической диссоциации ЭCl2. Дайте аргументированные ответы.
3. Определите значение рОН и рН водного раствора электролита, если концентрация ионов гидроксида 10-2  .
.
4. В каком из растворов концентрация ионов Pb2+ наименьшая: Pb(OH)2, PbCl2 или PbI2? Почему?
5. Закончите составление уравнений реакций:
SnSO4 + K2CO3 + H2O ®
FeCl3 + CH3COOK + H2O ®
6. Какова реакция водного раствора нитрата меди (II): слабокислая, нейтральная, слабощелочная, сильнощелочная? Составьте ионно-молекулярное и молекулярное уравнения гидролиза Cu(NO3)2.
Вариант 2
1. В растворе объёмом 250 мл содержится сульфат алюминия массой 7,5 г. Чему равна молярная концентрация и молярная концентрация эквивалента этого раствора?
2. Можно ли осуществить следующие реакции:
BaCO3¯ + CaCl2 ® CaCO3¯ + BaCl2
AgI¯ + KBr ® AgBr¯ + KI
3. Раствор циановодорода HCN имеет рН < 7. Постепенно в него добавляют цианид калия и констатируют, что среда становится менее кислой, затем нейтральной и, наконец, щелочной (рН < 7). Объясните результаты опыта.
4. Раствор, содержащий 2,1 г КОН в 250 мл воды, замерзает при –0,519°С. Найдите для этого раствора изотонический коэффициент. Криоскопическая постоянная воды К=1,86.
5. Какая из солей в большей степени подвергается гидролизу (при одинаковой концентрации растворов): NH4Cl; СH3COONa; K2S; Rb2CO3? Почему? Напишите молекулярное и ионные уравнения гидролиза Rb2CO3 по первой ступени.
6. Вычислите рН раствора 0,1М уксусной кислоты, если степень диссоциации составляет 1%.
Вариант 3
1. Какой объём 10% – ного раствора гидроксида калия (r = 1,08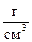 ) можно приготовить из 15 г КОН?
) можно приготовить из 15 г КОН?
2. Определите рОН и рН раствора, в котором концентрация гидроксид-ионов равна 1,5×10-9 .
.
3. К насыщенному раствору AgBr, находящемуся в равновесии с осадком, добавили раствор NaCl. Какие явления будут наблюдаться? Почему?
4. При какой концентрации раствора степень диссоциации азотистой кислоты HNO2 будет равна 0,2?
5. В растворе каких солей краснеет лакмусовая бумажка: KCl; ZnSO4; Cu(NO3)2; K2CO3? Напишете молекулярное и ионно-молекулярное уравнения гидролиза соли Cu(NO3)2.
6. Температура кристаллизации одномолярных растворов циановодорода HCN и глюкозы C6H12O6 близки. Какой вывод можно сделать относительно степени диссоциации HCN: а) a близка к 1; б) a близка к 0? Почему?
Вариант 4
1. Какой объём 30% - ного раствора гидроксида калия (r = 1,286 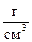 ) нужно взять, чтобы приготовить 2 л 10% - ного раствора КОН (r = 1,082
) нужно взять, чтобы приготовить 2 л 10% - ного раствора КОН (r = 1,082 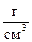 ).
).
2. В 0,05 кг воды растворено 0,006 кг неэлектролита. Определите молярную массу (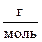 ) неэлектролита, если раствор замерзает при – 3,72°С. Криоскопическая постоянная воды К = 1,86.
) неэлектролита, если раствор замерзает при – 3,72°С. Криоскопическая постоянная воды К = 1,86.
3. Определите концентрацию катионов водорода ( ), если рН раствора 10.
), если рН раствора 10.
4. Не проводя вычислений, расположите вещества в порядке увеличения их растворимости в воде: Ag2CO3; Ag2SO4; Ag2CrO4. Ответ аргументируйте справочными данными.
5. Вычислите константу диссоциации циановодородной кислоты HCN, если степень диссоциации её в 0,01М растворе равна 2,83×10-4.
6. При гидролизе каких солей образуется H2S и HCN? Приведите уравнения гидролиза этих солей.
Вариант 5
1. Какой объём 30% – ного раствора серной кислоты (r = 1,22 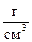 ) нужно взять для приготовления 600 мл 0,1Н раствора H2SO4? Какова молярная концентрация приготовленного раствора?
) нужно взять для приготовления 600 мл 0,1Н раствора H2SO4? Какова молярная концентрация приготовленного раствора?
2. Определите рН и рОН 0,1М раствора синильной кислоты, если a = 0,0001.
3. Опытным путём установлено, что при нагревании раствора HI степень диссоциации его увеличивается. Какой является реакция диссоциации HI: экзотермической или эндотермической?
4. Раствор, содержащий 33,2 г нитрата бария в 300 г воды, кипит при 100,47°С. Вычислите степень диссоциации соли в растворе. Эбулиоскопическая постоянная воды Э=0,52.
5. Какие пары ионов могут быть использованы при составлении молекулярного уравнения, которому отвечает ионно-молекулярное уравнение: 2Ag+ + SO42-® Ag2SO4:
а) Cl- и Ba2+;
б) NO3- и Ca2+;
в) I- и H+;
г) NO3- и H+?
6. При гидролизе какой соли в водном растворе рН < 7: BeSO4; KClO4; Li2CO3; FeBr3? Составьте молекулярное и ионное уравнения процесса гидролиза соли Li2CO3.
Вариант 6
1. Какой объём воды необходимо прибавить к 0,300 дм3 20% - ного раствора серной кислоты (r = 1,143 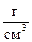 ), чтобы получить её 5% - ный раствор?
), чтобы получить её 5% - ный раствор?
2. При каком значении рН начинает выпадать в осадок гидроксид алюминия из 0,1М раствора AlCl3? ПР [Al(OH)3] = 5×10-33.
3. Определите рОН и рН водного раствора, если концентрация ионов гидроксида равна 10-11 .
.
4. Раствор, содержащий глицерин массой 13,8 г в воде объёмом 1 л, замерзает при температуре -0,279°С. Найдите молярную массу глицерина.
5. Какая из солей в большей степени подвергается гидролизу (при одинаковом разбавлении растворов): (СН3СОО)2Са; КСlO; K2CrO4; Na2SiO3? Напишите ионно-молекулярное уравнение гидролиза соли (СН3СОО)2Са.
6. Какова реакция водного раствора гидрофосфата натрия:
1) слабокислая;
2) нейтральная;
3) слабощелочная;
4) сильнощелочная.
Почему?
Вариант 7
1. До какого объёма нужно разбавить 400 мл 20% - ного раствора соляной кислоты (r = 1,1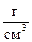 ), чтобы получить 8% - ный раствор (r = 1,05
), чтобы получить 8% - ный раствор (r = 1,05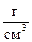 ).
).
2. Рассчитайте концентрации ионов Н+ и ОН- в растворе рН которого 8.
3. Чему равна молярная концентрация раствора неэлектролита, если при 17°С его осмотическое давление составляет 1204,5 Па?
4. Возможно ли осуществить следующие реакции:
BaCrO4¯ + K2SO4 ® BaSO4¯ + K2CrO4;
CuS¯ + CdSO4 ® CdS¯ + CuSO4?
5. Определите рН и рОН раствора синильной кислоты, если a = 0,0001.
6. Какая из солей в большей степени подвергается гидролизу (при одинаковом разбавлении растворов): FeCl3; MgCl2; ZnCl2; AlCl3. Напишите уравнения гидролиза соли MgCl2.
Вариант 8
1. К 100 мл 80% - ного раствора HNO3 (r = 1,16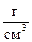 ) прибавили 400 мл воды. Получился раствор с r = 1,128
) прибавили 400 мл воды. Получился раствор с r = 1,128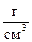 . Какова массовая доля и молярная концентрация полученного раствора?
. Какова массовая доля и молярная концентрация полученного раствора?
2. При добавлении какого из нижеперечисленных веществ к насыщенному раствору ZnS будет выпадать осадок: NaCl; ZnCl2; K2SO4?
3. Вычислите степень диссоциации 0,05М и 0,5М растворов NH4OH. Как влияет концентрация раствора на степень диссоциации?
4. Какие пары ионов могут быть использованы при составлении молекулярного уравнения, которому отвечает ионно-молекулярное: СО32- + 2Н+ ® Н2О + СО2:
а) Сa2+ и Cl-;
б) K+ и F-;
в) K+ и S2-;
г) Na+ и NO3-?
5. При смешивании водных растворов FeCl3 и Na2CO3 выделяется СО2 и образуется Fe(OH)3. Объясните образование Fe(OH)3 и СО2, выразив реакцию ионным уравнением.
6. Какое вещество можно добавить, чтобы увеличить степень гидролиза NH4Cl:
а) HCl;
б) NH4NO3;
в) Na2S;
г) HNO3.
Составьте ионное и молекулярное уравнения гидролиза Na2S.
Вариант 9
1. К 500 мл 32% - ной азотной кислоты (r = 1,2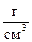 ) прибавили 1 л воды. Рассчитайте массовую долю и молярную концентрацию полученного раствора.
) прибавили 1 л воды. Рассчитайте массовую долю и молярную концентрацию полученного раствора.
2. Укажите, осадок какого вещества появится раньше при добавлении по каплям раствора NaOH к смеси растворов CuCl2 и FeCl2.
3. Во сколько раз нужно увеличить концентрацию катионов водорода, чтобы рН раствора уменьшился на 1?
4. Гидролиз какой соли протекает полнее (при одинаковом разбавлении растворов): СН3СООК; KF; (NH4)2SO4; Na2S? Составьте ионное и молекулярное уравнение гидролиза соли СН3СООК.
5. Одинаково ли осмотическое давление одно-молярных растворов глюкозы С6Н12О6; селитры KNO3; этилового спирта C2H5OH; уксусной кислоты CН3СООН? Ответ обоснуйте.
6. Что такое константа электролитической диссоциации и от каких факторов она зависит?
Вариант 10
1. Определите количество вещества мочевины СО(NH2)2, которое следует взять, чтобы приготовить раствор массой 1 кг с массовой долей мочевины 10%.
2. Концентрация катионов Ag+ в растворе составляет 10-3 . Какую молярную концентрацию хлорида калия следует создать в растворе, чтобы обнаружить ионы серебра, если ПР (AgCl) = 1,8×10-10.
. Какую молярную концентрацию хлорида калия следует создать в растворе, чтобы обнаружить ионы серебра, если ПР (AgCl) = 1,8×10-10.
3. Рассчитайте рН и рОН 0,05М раствора гидроксида аммония.
4. В чём заключается сущность ступенчатой диссоциации? Напишите уравнение ступенчатой диссоциации мышьяковой кислоты H3AsO4. Как изменяется значение константы диссоциации по ступеням? Почему?
5. При растворении 13,0 г неэлектролита в 400 г диэтилового эфира (С2Н5)2О температура кипения повысилась на 0,453°С. Определите молекулярную массу растворённого вещества. Эбулиоскопическая константа диэтилового эфира Э = 2,02.
6. Какая из солей подвергается полному гидролизу: MgSO4; AlCl3; (NH4)2S; BaCl2? Напишите ионно-молекулярные уравнения гидролиза соли MgSO4.
Вариант 11
1. Молярность какого из 1Н растворов кислот наименьшая: СН3СООН; Н3РО4; H2SO4; HNO3? Ответ обоснуйте.
2. Найдите концентрацию ионов Н+ в растворах, в которых концентрация гидроксид-ионов составляет ( ): а) 10-4; б) 3,2×10-6; в) 7,4×10-11.
): а) 10-4; б) 3,2×10-6; в) 7,4×10-11.
3. Можно ли осуществить следующие реакции:
AgCl¯ + KBr ® AgBr¯ + KCl;
CdS¯ + FeCl2 ® CdCl2 + FeS¯?
Ответ обоснуйте.
4. Вычислите константу диссоциации слабого однокислотного основания, если рН его 0,001М раствора равен 9.
5. При какой температуре кипит раствор, если в 1500 г воды растворено 3 моль глюкозы С6Н12О6? Эбулиоскопическая постоянная воды Э = 0,516.
6. В растворе какой соли рН = 7: NH4I; KF; NH4CN; BeSO4.
Вариант 12
1. Какой объём 30% - ного раствора H2SO4 (r = 1,22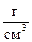 ) нужно взять для приготовления 600 мл 0,2М H2SO4? Какова молярная концентрация эквивалентов полученного раствора?
) нужно взять для приготовления 600 мл 0,2М H2SO4? Какова молярная концентрация эквивалентов полученного раствора?
2. Вычислите рН и рОН 0,1Н раствора гидроксида калия.
3. Какая из солей обладает лучшей растворимостью в воде: CuS, CdS, MnS? Ответ обоснуйте.
4. Какие вещества называют электролитами? Какие бывают электролиты? Укажите вещество, являющееся электролитом: С6Н6; СН3СООН; AlOHSO4; C2Н5ОН.
5. Какие пары ионов можно использовать при составлении молекулярного уравнения, отвечающего ионно-молекулрному: Cu2+ + 2OH- ® Cu(OH)2:
а) Cl- и Zn2+;
б) СО32- и Na+;
в) S2- и Na+;
г) Cl- и Ва2+?
6. В растворах каких солей метилоранж приобретает розовую окраску:
MgCl2; CH3COONH4; K2S; Ca(NO3)2?
Составьте ионно-молекулярные уравнения гидролиза соли MgCl2.
Вариант 13
1. В 450 мл воды растворили 50 г гидроксида натрия. Плотность раствора r = 1,05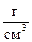 . Рассчитайте массовую долю и молярную концентрацию полученного раствора.
. Рассчитайте массовую долю и молярную концентрацию полученного раствора.
2. В водном растворе концентрация катионов водорода равна 10-3 . Каково значение рОН в этом растворе?
. Каково значение рОН в этом растворе?
3. Какое соединение выпадет в осадок раньше при добавлении раствора Pb(NO3)2 в раствор смеси NaF и NaCl?
4. При растворении вещества массой 1 г в воде массой 50 г получается непроводящий тока раствор, замерзающий при –0,81°С. Найдите молярную массу растворённого вещества.
5. Вычислите константу диссоциации гидроксида аммония, если степень диссоциации в 2×10-3М растворе NH4OH равна 10%.
6. Какие из солей: AlCl3; KCl; K2CO3; NH4NO3 подвергаются гидролизу? Составьте ионно-молекулярные уравнения гидролиза AlCl3.
Вариант 14
1. Какова будет массовая доля (%) HNO3 в растворе, если к 0,200 дм3 32% - ного раствора азотной кислоты (r = 1,198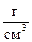 ) прибавить 1 дм3 воды?
) прибавить 1 дм3 воды?
2. При какой температуре (°С) замерзает раствор, содержащий 21,6 г глюкозы (С6Н12О6) в 100 г воды? Криоскопическая постоянная воды К = 1,86.
3. Определите концентрацию ( ) катионов натрия в растворе гидроксида натрия, если рН раствора 11.
) катионов натрия в растворе гидроксида натрия, если рН раствора 11.
4. Укажите слабодиссоциирующий электролит: Ba(OH)2; NH4OH; Al(OH)3; LiOH. От чего зависит степень диссоциации?
5. В каком из указанных случаев раствор электролита МХ ненасыщен:
а) [Mz+]×[Xz-] < ПР;
б) [Mz+]×[Xz-] > ПР;
в) [Mz+]×[Xz-] =ПР.
6. Какая из солей подвергается полному гидролизу: FeSO4; (NH4)2S; MgBr2; Bi2(SO4)3? Напишите ионно-молекулярные уравнения гидролиза FeSO4.
Вариант 15
1. Сколько граммов SO3 надо растворить в воде, чтобы получить 400 мл 15% - ного раствор H2SO4 (r = 1,100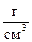 )?
)?
2. Чему равна концентрация раствора уксусной кислоты, рН которой равен 5,2?
3. К раствору H2SO4 медленно добавляют раствор, содержащий CaCl2 и SrCl2. Какой осадок начнёт выпадать раньше: SrSO4 или CaSO4? Почему?
4. Рассчитайте константу диссоциации гидроксида аммония, если степень диссоциации в 2×10-3М растворе NH4OH равна 10%.
5. Какое значение рН (<, > или » 7) имеют растворы солей: K3PO4; ZnCl2; K2SO3; NiCl2; FeCl3? Напишите ионно-молекулярные уравнения гидролиза соли NiCl2.
6. Какие пары ионов можно использовать при составлении молекулярного уравнения, которому соответствует ионно-молекулярное уравнение: Н+ + ОН- ® Н2О:
а) Br- и K+;
б) SO42- и Mg2+;
в) CN- и K+;
г) NO3- и Ba2+?
Вариант 16
1. Сколько граммов 30% - ного (по массе) раствора NaCl нужно добавить к 300 г воды, чтобы получить 10% - ный раствор соли?
2. 55,16 г сахарозы (С12Н22О11) растворено в 316,3 г воды. Рассчитайте температуру кипения и температуру замерзания этого раствора. Для воды криоскопическая постоянная К = 1,86, эбулиоскопическая постоянная Э = 0,52.
3. Определите рН раствора, в 1 л которого содержится 0,1 г NaOH. Диссоциацию щёлочи считайте полной.
4. Константа диссоциации масляной кислоты C3Н7СООН Кд = 1,5×10-5. Вычислите степень её диссоциации в 0,005М растворе.
5. В 500 мл воды при 18°С растворяется 0,0166 г Ag2CrO4. Чему равно произведение растворимости этой соли?
6. Укажите, какие из перечисленных ниже солей подвергаются гидролизу: ZnBr2; K2S; Fe2(SO4)3; MgSO4; Na2SO4; Na3PO4. Напишите в молекулярной и ионно-молекулярной форме уравнения гидролиза ZnBr2.
Вариант 17
1. Плотность 40% - ного (по массе) раствора HNO3 равна 1,25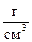 . Рассчитайте молярность и моляльность этого раствора.
. Рассчитайте молярность и моляльность этого раствора.
2. 10 мг органического вещества растворено в 1 г камфоры. Понижение температуры замерзания камфоры составило 1,33 К. Криоскопическая постоянная камфоры К = 40. Рассчитайте молярную массу растворённого вещества.
3. Определите концентрации Н+ и ОН- в растворе, рН которого равен 6,2.
4. Степень диссоциации угольной кислоты Н2СО3 по первой ступени в 0,1М растворе равна 2,11×10-3. Вычислите константу диссоциации К1.
5. Произведение растворимости ацетата серебра ПР (СН3СООAg) = 2,0×10-3. 4,1 г ацетата натрия СН3СООNa добавили к 100 см3 насыщенного раствора ацетата серебра в воде. Вычислите массу образовавшегося осадка ацетата серебра.
6. Напишите в ионно-молекулярной форме уравнения реакций взаимодействия между водными растворами:
а) NaHCO3 и HCl.;
б) Pb(CH3COO)2 и Na2S.
Вариант 18
1. Определите массовую долю вещества в растворе, полученном смешением 300 г 25% - ного и 400 г 40% - ного (по массе) растворов этого вещества.
2. 20 мг белка растворено в 10 г раствора. При температуре 25 °С осмотическое давление раствора составляет 40 Па. Определите молярную массу белка, считая раствор идеальным.
3. Вычислите рН растворов, в которых:
а) концентрация ионов Н+ равна 2×10-7 ;
;
б) концентрация ионов Н+ равна 5×10-4 ;
;
в) концентрация ионов ОН- равна 5×10-6 .
.
4. При какой концентрации раствора степень диссоциации азотистой кислоты HNO2 будет равна 0,2?
5. К 50 мл 0,001Н раствора HCl добавили 450 мл 0,0001Н раствора AgNO3. Выпадет ли осадок хлорида серебра?
6. Составьте в молекулярной форме уравнения реакций, которые выражаются следующими ионно-молекулярными уравнениями:
а) NO2- + H+ ® HNO2;
б) Cu2+ + 2OH- ® Cu(OH)2¯;
в) Pb2+ + 2I- ® PbI2¯.
Вариант 19
1. К 500 мл 32% - ной (по массе) HNO3 (r = 1,20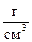 ) прибавили 1 л воды. Чему равна массовая доля HNO3 в полученном растворе?
) прибавили 1 л воды. Чему равна массовая доля HNO3 в полученном растворе?
2. В 0,0106 кг раствора содержится 0,4×10-3 кг салициловой кислоты, растворённой в этиловом спирте. Этот раствор кипит при температуре на 0,337 К выше температуры кипения чистого спирта. Определите молярную массу салициловой кислоты, учитывая, что эбулиоскопическая постоянная этилового спирта 1,19.
3. Во сколько раз концентрация ионов водорода в крови (рН = 7,36) больше, чем в спинномозговой жидкости (рН = 7,53)?
4. Чему равна концентрация ионов водорода в водном растворе муравьиной кислоты, если a = 0,03?
5. Произведение растворимости BaSO4 в воде при 25°С равно 1,1×10-10. Какого объёма воды достаточно для полного растворения 2,33×10-2 г BaSO4 при 25°С?
6. Какие из перечисленных ниже солей подвергаются гидролизу: NaCN; KNO2; KNO3; CH3COONH4; CaCl2; NaCl; KBr? Напишите молекулярное и ионно-молекулярное уравнения гидролиза CH3COONH4.
Вариант 20
1. Какую массу 20% - ного (по массе) раствора КОН надо добавить к 1 кг 50% - ного (по массе) раствора, чтобы получить 25% - ный раствор?
2. Понижение температуры замерзания водного раствора уксусной кислоты (Смл = 0,01 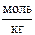 ) равно 0,0193 К. Рассчитайте степень диссоциации уксусной кислоты. Криоскопическая постоянная воды К = 1,86.
) равно 0,0193 К. Рассчитайте степень диссоциации уксусной кислоты. Криоскопическая постоянная воды К = 1,86.
3. Вычислите рН 0,02М раствора NH4OH.
4. Степень диссоциации муравьиной кислоты НСООН в 0,2Н растворе равна 3%. Определите константу диссоциации кислоты.
5. Образуется ли осадок сульфата серебра, если к 450 мл 0,02М раствора AgNO3 добавить 600 мл 1Н раствора H2SO4?
6. Что такое степень гидролиза и константа гидролиза? Вычислите константу гидролиза фторида калия, определите степень гидролиза этой соли в 0,01М растворе и рН раствора. Напишите ионно-молекулярные уравнения гидролиза KF.
Контрольная работа №3.
Окислительно-восстановительные реакции. Электрохимия
Вариант 1
1. Расставьте коэффициенты в уравнении реакций (ионно-электронный метод), протекающих по схемам:
P + HClO3 + H2O ® H3PO4 + HCl
H3AsO3 + KMnO4 + H2SO4 ® H3AsO4 + K2SO4 + H2O + MnSO4
Укажите для каждой реакции окислитель и восстановитель, какое вещество окисляется, какое восстанавливается.
2. Составьте схему элемента при а(Zn2+) = 10-2 у одного электрода и а(Zn2+) = 10-6
у одного электрода и а(Zn2+) = 10-6  у другого электрода. Укажите, какой из электродов будет анодом, какой – катодом. Рассчитайте ЭДС гальванического элемента.
у другого электрода. Укажите, какой из электродов будет анодом, какой – катодом. Рассчитайте ЭДС гальванического элемента.
3. Электролиз раствора сульфата цинка проводили с нерастворимыми анодами в течение 6,7 ч, в результате чего выделился кислород объёмом 5,6 л (измерен при нормальных условиях). Вычислите ток и массу осаждённого цинка при выходе его по току 70%.
4. Какие катодные процессы возможны при коррозии железа в растворе хлорида натрия? Какие методы защиты железа от коррозии можно рекомендовать в этом случае?
Вариант 2
1. Расставьте коэффициенты в уравнениях реакций (ионно-электронным методом), протекающих по схемам:
FeCl2 + KClO3 + HCl ® FeCl3 + KCl + H2O
As + HNO3 (конц.) ® H3AsO4 + NO2
Укажите для каждой реакции окислитель и восстановитель, какое вещество окисляется, какое восстанавливается.
2. Составьте схему элемента при а(Ag+) = 10-1 у одного электрода и а(Ag+) = 10-4
у одного электрода и а(Ag+) = 10-4  у другого электрода. Укажите, какой из электродов будет анодом, какой – катодом. Рассчитайте ЭДС гальванического элемента.
у другого электрода. Укажите, какой из электродов будет анодом, какой – катодом. Рассчитайте ЭДС гальванического элемента.
3. Напишите уравнения реакций, протекающих на графитовых электродах при электролизе хлорида кальция. Сколько времени необходимо вести электролиз при токе 1А, чтобы на катоде выделилось вещество массой 4 г?
4. Как происходит атмосферная коррозия лужёного и оцинкованного железа при нарушении сплошности покрытия? Составьте уравнения анодного и катодного процессов.
Вариант 3
1. Расставьте коэффициенты в уравнениях реакций (ионно-электронным методом), протекающих по схемам:
PbS + HNO3 ® S + Pb(NO3)2 + NO + H2O
KMnO4 + H2SO4 + KI ® I2 + K2SO4 + MnSO4 + H2O
Укажите для каждой реакции окислитель и восстановитель, какое вещество окисляется, какое восстанавливается.
2. Определите равновесный потенциал электрода, на котором протекает реакция:
Cr2O72- + 14H+ + 6e- « 2Cr3+ + 7H2O
Стандартный потенциал равен +1,33 В, активности ионов Cr2O72- и Cr3+ равны 1 ;
;
рН = 5; Т = 298К.
3. Электролиз раствора CuSO4 проводили в течение 15 мин при силе тока 2,5А. Выделилось 0,72 г меди. Составьте электронные уравнения процессов, происходящих на электродах в случае медного и угольного анода. Вычислите выход по току (отношение массы выделившегося вещества к теоретически возможной).
4. Какое покрытие металла называется катодным и какое анодным? Назовите металлы, которые можно использовать для катодного и анодного покрытия железа во влажном воздухе и в сильнокислой среде.
Вариант 4
1. Расставьте коэффициенты в уравнениях реакций (ионно-электронным методом), протекающих по схемам:
Cl2 + H2S + H2O ® HCl + H2SO4
Cr2O3 + NaNO3 + NaOH ® Na2CrO4 + NaNO2 + H2O
Укажите для каждой реакции окислитель и восстановитель, какое вещество окисляется, какое восстанавливается.
2. Вычислите ЭДС гальванического элемента, составленного из металлического магния в 0,02М растворе сульфата магния и металлического никеля в 0,2М растворе сульфата никеля (II).
3. Электролиз раствора сульфата цинка проводили в течение 5 ч, в результате чего выделилось 6 л кислорода (н.у.). Составьте уравнения электродных процессов и вычислите силу тока.
4. Как происходит атмосферная коррозия лужёного железа и лужёной меди при нарушении покрытия? Составьте уравнения анодного и катодного процессов.
Вариант 5
1. Расставьте коэффициенты в уравнениях реакций (ионно-электронным методом), протекающих по схемам:
H2SO3 + HClO3 ® H2SO4 + HCl
FeSO4 + K2Cr2O7 + H2SO4 ® Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O
Укажите для каждой реакции окислитель и восстановитель, какое вещество окисляется, какое восстанавливается.
2. Рассчитайте стандартную ЭДС гальванического элемента, в котором установилось равновесие:
H2 + Cl2 « 2HCl (г)
ΔG˚298 (HCl) = - 94,86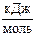 .
.
3. Напишите уравнения реакций, протекающих на нерастворимых электродах при электролизе водного раствора КОН. Какие вещества и в каком объёме можно получить при н.у., если пропускать ток силой 13,4А в течение 2 ч?
4. Железное изделие покрыли свинцом. Какое это покрытие – анодное или катодное? Почему? Составьте уравнения анодного и катодного процессов коррозии этого изделия при нарушении цельности покрытия во влажном воздухе. Какие продукты коррозии при этом образуются?
Вариант 6
1. Расставьте коэффициенты в уравнениях реакций (ионно-электронным методом), протекающих по схемам:
K2Cr2O7 + HBr ® Br2 + CrBr3 + KBr + H2O
Au + HNO3 + HCl ® AuCl3 + NO + H2O
Укажите для каждой реакции окислитель и восстановитель, какое вещество окисляется, какое восстанавливается.
2. Рассчитайте ЭДС элемента, в котором при 298 К установилось равновесие:
Zn + Sn2+ « Zn2+ + Sn
при а(Zn2+) = 10-4 , а(Sn2+) = 10-2
, а(Sn2+) = 10-2 .
.
Напишите уравнения электродных реакций.
3. При электролизе соли трёхвалентного металла при силе тока 1,5А в течение 30 мин на катоде выделилось 1,071 г металла. Вычислите атомную массу металла.
4. Железное изделие покрыто никелем. Какое это покрытие – анодное или катодное? Составьте уравнения катодных и анодных процессов во влажном воздухе и в растворе соляной кислоты при нарушении цельности покрытия.
Вариант 7
1. Расставьте коэффициенты в уравнениях реакций (ионно-электронным методом), протекающих по схемам:
NaCrO2 + Br2 + NaOH ® Na2CrO4 + NaBr + H2O
FeS + HNO3 ® Fe(NO3)2 + S + NO + H2O
Укажите для каждой реакции окислитель и восстановитель, какое вещество окисляется, какое восстанавливается.
2. Рассчитайте ЭДС гальванического элемента, в котором при 298К установилось равновесие:
Fe + 2Ag+ « Fe2+ + 2Ag
при а(Ag+) = 10-3 , а(Fe2+) = 10-2
, а(Fe2+) = 10-2 .
.
Напишите уравнения электродных реакций.
3. Электролиз раствора NaI проводили при силе тока 6А в течение 2,5 ч. составьте электродные уравнения процессов, проходящих на угольных электродах, и вычислите массу вещества, выделившегося на катоде и аноде?
4. Какой металл целесообразнее выбрать для протекторной защиты от коррозии свинцовой оболочки кабеля: цинк, магний или хром? Почему? Составьте электронные уравнения анодного и катодного процессов атмосферной коррозии. Какой состав продуктов коррозии?
Вариант 8
1. Расставьте коэффициенты в уравнениях реакций (ионно-электронным методом), протекающих по схемам:
AgNO3 + Na2SO3 + NaOH ® Ag + Na2SO4 + NaNO3 + H2O
Cu + H2SO4 ® CuSO4 + SO2 + H2O
Укажите для каждой реакции окислитель и восстановитель, какое вещество окисляется, какое восстанавливается.
2. Составьте схему и напишите уравнения электродных процессов гальванического элемента, состоящего из медной и кадмиевой пластин, опущенных в раствор, содержащий собственные ионы кадмия с активностью а(Cd2+) = 10-1 . Рассчитайте ЭДС этого элемента.
. Рассчитайте ЭДС этого элемента.
3. За 10 мин из раствора платиновой соли ток силой 5А выделил 1,517 г Pt. Определите эквивалентную массу платины.
4. В чём сущность протекторной защиты металлов от коррозии? Приведите пример протекторной защиты железа в электролите, содержащем растворённый кислород. Составьте уравнения анодного и катодного процессов.
Вариант 9
1. Расставьте коэффициенты в уравнениях реакций (ионно-электронным методом), протекающих по схемам:
KClO3 + Na2SO3 ® KCl + Na2SO4
KMnO4 + HBr ® Br2 + KBr + MnBr2 + H2O
Укажите для каждой реакции окислитель и восстановитель, какое вещество окисляется, какое восстанавливается.
2. Рассчитайте равновесный потенциал электрода, на котором протекает реакция:
ClO3- + 6H+ + 6e- « Cl- + 3H2O
Стандартный потенциал электрода равен +1,45В, активности ионов равны:
а(ClO3-)= 10-1 , а(Cl-) = 10-1
, а(Cl-) = 10-1 ; рН = 5; Т = 298К.
; рН = 5; Т = 298К.
3. Электролиз раствора сульфата некоторого металла проводили при силе тока 6А в течение 45 мин, в результате чего выделилось 5,49 г металла. Вычислите эквивалентную массу металла.
4. Приведите пример анодных и катодных покрытий для кобальта. Составьте уравнения катодных и анодных процессов во влажном воздухе и в растворе соляной кислоты при нарушении целостности покрытия.
Вариант 10
1. Расставьте коэффициенты в уравнениях реакций (ионно-электронным методом), протекающих по схемам:
MnO2 + H2SO4 ® MnSO4 + O2 + H2O
KI + KBrO3 + HCl ® I2 + KBr + KCl + H2O
Укажите для каждой реакции окислитель и восстановитель, какое вещество окисляется, какое восстанавливается.
2. Составьте схемы двух гальванических элементов, в одном из которых кадмий является анодом, а в другом – катодом. Напишите уравнения электродных процессов и вычислите ЭДС каждого элемента.
3. Напишите уравнения реакций, протекающих на графитовых электродах при электролизе расплава хлорида кальция. Сколько времени необходимо вести электролиз при силе тока 1А, чтобы на катоде выделилось вещество массой 4 г?
4. Если пластинку из чистого цинка опустить в разбавленную кислоту, то начавшееся выделение водорода вскоре прекратится. Однако, при прикосновении к цинку медной палочкой на последней начинается бурное выделение водорода. Объясните это явление, составив уравнения анодного и катодного процессов. Напишите уравнение протекающей химической реакции.
Вариант 11
1. Расставьте коэффициенты в уравнениях реакций (ионно-электронным методом), протекающих по схемам:
HNO3 + Zn ® N2O + Zn(NO3)2 + H2O
FeSO4 + KClO3 + H2SO4 ® Fe2(SO4)3 + KCl + H2O
Укажите для каждой реакции окислитель и восстановитель, какое вещество окисляется, какое восстанавливается.
2. Рассчитайте ЭДС элемента, в котором при 298К установилось равновесие:
Cd + Cu2+ « Cd2+ + Cu
при а(Cd2+)= 10-2 , а(Cu2+) = 10-3
, а(Cu2+) = 10-3 .
.
Составьте схему гальванического элемента.
3. Напишите уравнения реакций, протекающих на электродах при электролизе водного раствора сульфата никеля:
а) электроды никелевые;
б) электроды растворимые.
Каким должен быть ток, чтобы за 10 ч на катоде выделился никель массой 47 г?
4. Объясните, почему в атмосферных условиях цинк корродирует, а золото нет. Объяснения подтвердите расчётом.
Вариант 12
1. Расставьте коэффициенты в уравнениях реакций (ионно-электронным методом), протекающих по схемам:
KMnO4 + Na2SO3 + KOH ® K2MnO4 + Na2SO4 + H2O
PbS + HNO3 ® S + Pb(NO3)2 + NO + H2O
Укажите для каждой реакции окислитель и восстановитель, какое вещество окисляется, какое восстанавливается.
2. Вычислите ЭДС и составьте схему гальванического элемента, составленного из следующих электродов: металлического цинка, помещённого в 0,1М раствор нитрата цинка, и металлического серебра, помещённого в 0,005М раствор нитрата серебра, при 298К.
3. При электролизе водного раствора Cr2(SO4)3 током силой 2А масса катода увеличилась на 8 г. В течение какого времени проводили электролиз? Составьте схему электролиза с угольными электродами.
4. Как проходит коррозия цинка, находящегося в контакте с кадмием в нейтральном и кислом растворах? Составьте электронные уравнения анодного и катодного процессов. Каков состав продуктов коррозии?
Вариант 13
1. Расставьте коэффициенты в уравнениях реакций (ионно-электронным методом), протекающих по схемам:
KMnO4 + K2SO3 + H2SO4 ® MnSO4 + K2SO4 + H2O
Cl2 + H2S + H2O ® HCl + H2SO4
Укажите для каждой реакции окислитель и восстановитель, какое вещество окисляется, какое восстанавливается.
2. Потенциал водородного электрода в некотором водном растворе равен – 118 мВ. Вычислите активность ионов Н+ в этом растворе.
3. Составьте схемы электролиза водных растворов H2SO4 и CuCl2 с платиновыми электродами.
4. К какому типу покрытий относятся:
а) олово на стали;
б) олово на меди?
Какие процессы будут протекать при атмосферной коррозии лужёных стали и меди при нейтральной реакции среды при Т = 298К? Напишите уравнения катодных и анодных реакций.
Вариант 14
1. Расставьте коэффициенты в уравнениях реакций (ионно-электронным методом), протекающих по схемам:
FeCl2 + KMnO4 + HCl ® FeCl3 + MnCl2 + KCl + H2O
Mg + H2SO4 ® MgSO4 + S + H2O
Укажите для каждой реакции окислитель и восстановитель, какое вещество окисляется, какое восстанавливается.
2. Суммарная реакция, протекающая на электродах свинцового аккумулятора, описывается уравнением:
Pb (тв) + PbO2 (тв) + 4H+ + 2SO42- « 2PbSO4 (тв) + 2H2O (ж)
Рассчитайте ЭДС свинцового аккумулятора при Т = 298К и активностях:
а(Н+) = 5 , а(SO42-) = 5
, а(SO42-) = 5 , а(Н2О)= 1
, а(Н2О)= 1 .
.
3. Напишите схему электролитического разложения воды. Сколько времени потребуется для полного разложения 2 молей воды током силой 2 А?
4. Какой металл может служить протектором при защите железа от коррозии в водном растворе с рН 10 в контакте с воздухом? Напишите уравнения реакций протекающих процессов.
Вариант 15
1. Расставьте коэффициенты в уравнениях реакций (ионно-электронным методом), протекающих по схемам:
K2SO3 + KMnO4 + H2O ® K2SO4 + MnO2 + KOH
Cu + H2SO4 ® CuSO4 + SO2 + H2O
Укажите для каждой реакции окислитель и восстановитель, какое вещество окисляется, какое восстанавливается.
2. Гальванический элемент составлен из стандартного цинкового электрода и хромового электрода, погружённого в раствор, содержащий ионы Cr3+. При какой концентрации ионов Cr3+ ЭДС этого элемента при Т = 298К будет равна 0? Напишите уравнения электродных процессов.
3. Напишите схему электролитического разложения воды. Какое количество электричества потребуется для выделения из раствора:
а) 2 г водорода;
б) 2 г кислорода?
4. Возможна ли коррозия олова в водном растворе с рН 6 при контакте с воздухом? При каких значениях рН возможна коррозия с выделением водорода? Ответ подтвердите расчётом.
Вариант 16
1. Расставьте коэффициенты в уравнениях реакций (ионно-электронным методом), протекающих по схемам:
NaNO2 + NaI + H2SO4 ® NO + I2 + Na2SO4 + H2O
Cl2 + NaOH ® NaClO3 + NaCl + H2O
Укажите для каждой реакции окислитель и восстановитель, какое вещество окисляется, какое восстанавливается.
2. Рассчитайте ЭДС гальванического элемента, состоящего из стандартного водородного электрода и свинцового электрода, погружённого в раствор ацетата свинца с активностью а(Pb2+) = 1 при Т = 298К. Составьте схему элемента. Напишите уравнения процессов, протекающих на электродах.
при Т = 298К. Составьте схему элемента. Напишите уравнения процессов, протекающих на электродах.
3. Составьте схему процессов, происходящих при электролизе водного раствора KNO3 на медных электродах. Какая масса газа выделится на катоде при пропускании через раствор тока силой 12 А в течение 30 мин?
4. Приведите примеры катодных и анодных покрытий для кобальта. Составьте уравнения катодных и анодных процессов во влажном воздухе и в растворе соляной кислоты при нарушении целостности покрытия.
Вариант 17
1. Расставьте коэффициенты в уравнениях реакций (ионно-электронным методом), протекающих по схемам:
K2SO3 + KMnO4 + KOH ® K2SO4 + K2MnO4 + H2O
HBr + H2SO4 ® Br2 + SO2 + H2O
Укажите для каждой реакции окислитель и восстановитель, какое вещество окисляется, какое восстанавливается.
2. Рассчитайте равновесный потенциал электрода, на котором протекает реакция по уравнению:
PbO2 + 4H+ + 2e- « Pb2+ + 2H2O
Активность иона Pb2+ равна 0,1 , рН 10, Т = 310К.
, рН 10, Т = 310К.
3. Составьте схему процессов, происходящих на угольных электродах при электролизе раствора CuCl2. Найдите массу меди, выделившейся на катоде, если на аноде выделилось 560 мл газа.
4. В чём заключается сущность протекторной защиты металлов от коррозии? Приведите пример протекторной защиты железа в электролите с рН > 7, содержащем растворённый кислород. Составьте уравнения анодного и катодного процессов.
Вариант 18
1. Расставьте коэффициенты в уравнениях реакций (ионно-электронным методом), протекающих по схемам:
C (гр) + H2SO4 ® CO2 + SO2 + H2O
CrCl3 + H2O2 + NaOH ® Na2CrO4 + H2O + NaCl
Укажите для каждой реакции окислитель и восстановитель, какое вещество окисляется, какое восстанавливается.
2. Рассчитайте равновесный потенциал электрода, на котором протекает реакция по уравнению:
MnO4- + 8H+ + 5e- « Mn2+ + 4H2O
Активность ионов равны: а(MnO4-) = 1 , а(Mn2+) = 10-1
, а(Mn2+) = 10-1 . рН 10, Т = 310К.
. рН 10, Т = 310К.
3. Составьте схему процессов, протекающих на инертных электродах при электролизе раствора хлорида натрия. Рассчитайте объём выделившегося на аноде газа за 10 ч при токе 30 А и выходе газа по току 90%.
4. Медь не вытесняет водород из разбавленных кислот. Почему? Однако, если к медной пластинке, опущенной в кислоту, прикоснуться цинковой, то на меди начинается бурное выделение водорода. Объясните это явление, составив уравнения анодного и катодного процессов. Напишите уравнение протекающей химической реакции.
Вариант 19
1. Расставьте коэффициенты в уравнениях реакций (ионно-электронным методом), протекающих по схемам:
P + HNO3 ® H3PO4 + NO2 + H2O
KBrO + MnCl2 + KOH ® KBr + MnO2 + KCl + H2O
Укажите для каждой реакции окислитель и восстановитель, какое вещество окисляется, какое восстанавливается.
2. Составьте схемы двух гальванических элементов, в одном из которых медь служила бы катодом, а в другом – анодом. Напишите уравнения реакций, происходящих при работе этих элементов, и вычислите значения стандартных ЭДС.
3. Составьте схемы электролиза водного раствора сульфата меди, если:
а) анод медный;
б) анод угольный.
4. Приведите примеры катодных и анодных покрытий для железа. Составьте уравнения катодных и анодных процессов во влажном воздухе и в растворе соляной кислоты при нарушении цельности покрытия.
Вариант 20
1. Расставьте коэффициенты в уравнениях реакций (ионно-электронным методом), протекающих по схемам:
KBr + KBrO3 + H2SO4 ® Br2 + K2SO4 + H2O
H2O2 + KMnO4 + H2SO4 ® O2 + MnSO4 + K2SO4 + H2O
Укажите для каждой реакции окислитель и восстановитель, какое вещество окисляется, какое восстанавливается.
2. ЭДС гальванического элемента, составленного из двух водородных электродов, равна 272 мВ. Чему равен рН раствора, в который погружён анод, если катод погружён в раствор с рН 3?
3. Составьте схему электролиза водного раствора гидроксида калия на инертных электродах. Какой объём кислорода (н.у.) выделится при пропускании тока силой 6 А в течение 30 мин через водный раствор КОН?
4. В чём заключается катодная защита? Напишите уравнения электродных реакций, протекающих при катодной защиты стальных труб, находящихся в щелочной среде.
ЛИТЕРАТУРА
Основная
1. Глинка, Н. Л. Задачи и упражнения по общей химии: Учебное пособие для вузов / Н. Л. Глинка; под ред. В. А. Рабиновича и Х. М. Рубиной. – М. : Интеграл-Пресс, 2005. – 240 с.
2. Коровин, Н. В. Общая химия: Учебник для технических направлений и специальностей вузов / Н. В. Коровин. – М. : Высшая школа, 1998. – 559 с.
Дополнительная
4. Глинка, Н. Л. Общая химия / Н. Л. Глинка; под ред. А. И. Ермакова. – 28-е изд., перераб. и доп. – М. : Интеграл-Пресс, 2000. – 728 с. 5. Карапетьянц, М. Х. Общая и неорганическая химия / М. Х. Карапетьянц, С. И.… 6. Краткий справочник физико-химических величин / под ред. А. А. Равделя, А. М. Пономарёвой. – 2-е изд. – СПб. :…– Конец работы –
Используемые теги: Контрольные, задания, дисциплине, Химия0.069
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Контрольные задания по дисциплине Химия
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов