рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Тонкой химической технологии им. М.В. Ломоносова
Реферат Курсовая Конспект
Тонкой химической технологии им. М.В. Ломоносова
Тонкой химической технологии им. М.В. Ломоносова - раздел Химия, Федеральное Агентство По Образованию ...
Федеральное агентство по образованию
Московская государственная академия
тонкой химической технологии им. М.В. Ломоносова
Кафедра физической химии
Курс лекций по физической химии
Учебно–методическое пособие
Москва, 2006
Лекция № 1
Предмет, структура и методы физической химии.
1.1.1. Термин физическая химия введен М. В. Ломоносовым. «Физическая химия - наука, которая должна на основе положений и опытов физических объяснить… 1.1.2. Физическая химия – это теоретическая химия, которая рассматривает общие… 1.1.3. Физическая химия – основа химической технологии, она позволяет оптимизировать протекание химических реакций,…Основные разделы физической химии
1.2.1. Химическая термодинамика – как часть научной дисциплины общей термодинамики – исследует условия равновесия в физико-химических процессах и химических реакциях..
1.2.2. Строение вещества – теории химической связи и расчетные и экспериментальные методы изучения строения.
1.2.3. Химическая кинетика – протекание во времени и механизмы химических реакций
Электрохимия
1.2.5. Промежуточные, объединяющие разделы:
Статистическая термодинамика
Теория реакционной способности
Термодинамика необратимых процессов
Электрохимическая кинетика
Основные понятия химической термодинамики
Термодинамические системы .
Классификация термодинамических систем
По составу
2.1.2.1.1. Однокомпонентные. 2.1.2.1.2. Двухкомпонентные, или бинарные. 2.1.2.1.3. Трехкомпонентные – тройные.Состояние ТДС
Определение.
Равновесие
2.2.3. Уравнение соcтояния связывает параметры состояния и относится к фазе. Общий вид его f (p,V, T) = 0. Простейший вид уравнения состояния имеет… где R = 8.314 Дж/(моль.К) = 1,987 кал/(моль.К) = 0,082 л.атм/(моль.К) . [p] = Па, 1атм = 1,013*105 Па = 760 мм рт.ст.,Классификация параметров и функций состояния
2.2.5.1. Интенсивные свойства при контакте двух систем выравниваются
(температура, давление, поверхностное натяжение, электрический потен-циал) Y’1 < Y’’1
Y2 = Y’2 = Y’’2, Y’1 < Y2 < Y’’1. (1.4)
2.2.5.2. Экстенсивные свойства при объединении (контакте) двух систем складываются ( Объем, число молей, энергия, теплоемкость и т. д.)
X = X’ + X’’(1.5)
Экстенсивные свойства зависят от массы. Чтобы описать экстенсивные свойства, их относят к определенному количеству вещества, например,
к одному молю X/n = X – мольные величины,
к единице массы X/m = Xуд. – удельные величины,
к единице объема X/V = r – плотности.
Мольные величины не зависят от массы, поэтому их иногда относят к интенсивным свойствам, он они не обладают главной особенностью интенсивных величин – они не выравниваются при контакте.
2.3. Термодинамический процесс - изменение состояния системы при взаимодействии с окружающей средой.
Классификация термодинамических процессов
2.3.1.1. Циклические и нециклические
2.3.1.2. Обратимые и необратимые
2.3.1.2.1. Необратимые – это реальные процессы в термодинамических системах.
2.3.1.2.2. Обратимые – это идеализированные процессы, которые проходят в прямом и обратном направлении через одни и те же промежуточные состояния, и после завершения цикла ни в системе, ни в окружающей среде не наблюдается никаких изменений. Обратимые процессы называют часто равновесными, так как в каждый момент промежуточного состояния внешние и внутренние силы должны быть почти скомпенсированы (последнее характерно для состояния равновесия), т.е. они должны отличаться на бесконечно малую величину. Такой процесс происходит бесконечно медленно, поэтому время не учитывается в термодинамике обратимых процессов, и их также называют квазистатическими. Пример – обратимое изотермическое расширение идеального газа. В обратимом процессе работа, полученная в прямом направлении должна быть численно равна работе, затраченной в обратном процессе. По сравнению с необратимыми процессами обратимый процесс дает возможность получить максимальную работу.
2.3.2.Теплота и работа – способы обмена энергией между ТДС и окружа-ющей средой. Теплота и работа характеристики процесса, они не являются функциями состояния
2.3.2.1. Теплота– форма обмена энергией на микроскопическом уровне, т.е. в форме изменения хаотического движения молекул. Теплота считается положительной, если она подводится к системе.
2.3.2.2. Работа - форма обмена энергией на макроскопическом уровне, когда происходят направленное перемещение объекта. Работа считается положительной, если ее совершает система против внешних сил.
В зависимости от характера объекта различают разные виды работы:
2.3.2.2.1. Механическая- перемещение тела
dWмех = - F ехdl.(1.6)
Работа – скалярное произведение 2-х векторов силы и перемещения, т.е.
|dWмех| = F dl cosα.Если направление внешней силы противоположно перемещению, совершаемому внутренними силами, то cos α < 0.
2.3.2.2.2. Работа расширения (чаще всего рассматривается расширение газа)
dW = - рех dV
В обратимом процессе peх ~ - pin,поэтому обычно пишут, что
dW = р dV,(1.7)
Однако нужно иметь в виду, что это выражение справедливо только для обратимого протекания процесса, а в случае необратимого характера последнего pin > - peх, а работа dWнеобр. < р dV
2.3.2.2.3. Электрическая – перемещение электрических зарядов
dWэл = -jdq,(1.8)
где j -электрический потенциал.
2.3.2.2.4. Поверхностная – изменение поверхности,
dWповерхн. = -sdS,(1.9)
где s -поверхностное натяжение.
2.3.2.2.5. Общее выражение для работы
dW = - Ydx,(1.10)
Y– обобщенная сила, dx - обобщенная координата, таким образом работа может рассматриваться как произведение интенсивного фактора на изменение экстенсивного.
2.3.2.2.6. Все виды работы, кроме работы расширения, называются полезной работой (dW’).
dW = рdV + dW’
2.3.2.2.7. По аналогии можно ввести понятие химической работы, когда направленно перемещается k-ое химическое вещество, nk – экстенсивное свойство, при этом интенсивный параметр mk называется химическим потенциалом k-ого вещества
dWхим = -Smkdnk. (1.11)
2.3.3. Нулевой закон термодинамики. Сформулирован позже первого и вто-рого, но по логике построения постулатов термодинамики он должен предшествовать им. Если две системы находятся в тепловом равновесии с третьей, то они находятся и в тепловом равновесии между собой.
ТА = ТВ; ТА = ТС Þ ТВ = ТС.
Таким образом, ответственным за тепловое равновесие является интенсивный параметр - температура. Поэтому можно процессы теплообмена также представить в виде аналогичной по структуре формулой
dQ = TdS, (1.12)
где экстенсивное свойство называется энтропией, а знак + соответствует передаче энергии системе в обратимом тепловом процессе.
Лекция №2
Первый закон термодинамики
Содержание первого закона термодинамики
3.1.1. Первый закон термодинамики является частным случаем закона сохранения энергии. Эмпирический закон Майер (1842), Джоуль (1842), Гесс (1840), Гельмгольц (1847). Энергия не создается и не уничтожается, а только переходит из одной формы в другую. Невозможен вечный двигатель 1-го рода, который работал бы без подвода энергии. Эквивалентность теплоты и работы.
Внутренняя энергия как функция состояния системы
p1 V1, T1 p1 V1, T1 ∙ ∙ ∙ ∙Математическое выражение и формулировка 1-го закона
Q = DU + W(2.1)
| Тепло, подведенное к системе, идет на изменение внутренней энергии системы и совершение системой работы против внешних сил. |
dQ = dU + dW = dU + pdV + dW’(2.2)
Классическая термодинамика не дает способов расчета и измерения внутренней энергии, а только ее изменение.
Применение 1-го закона к простейшим системам
3.2.1. Изолированная система
Q = 0, W = 0, DU = 0.
Внутренняя энергия изолированной системы постоянна.
3.2.2. Изохорный процесс V = const.
Теплота изохорного процесса
Если dW’ = 0, pdV = dWрасширения = 0. Wрасширения = 0.
Þ dQv = dU; Qv = DU(2.3)
В отсутствие полезной работы изменение внутренней энергии равно теплоте изохорного процесса. Это утверждение дает способ экспериментального измерения для изменения внутренней энергии.
Изохорное нагревание
гдеCv – мольная теплоемкость системы при постоянном объеме. dQ = m cуд dT 3.2.3. Изобарный процесс p = constИзобарическое нагревание
dQp = n Cp dT = dH, Cp dT = dH Þ Cp =  ,(2.8)
,(2.8)
где Cр – мольная теплоемкость системы при постоянном давлении.
3.2.4. Изотермический процесс Т =const
Изотермическое расширение идеального газа
dQ = dWрасшир. = pdV; Q = W = = = nRT ln= nRT ln (2.9) 3.2.5. АдиабатическийпроцессТермохимия
Предмет термохимии
Термохимия занимается тепловыми эффектами, сопровождающими химические и физико-химические процессы, т.е. измерениями теплоты, которая выделяется или поглощается в химических реакциях, фазовых переходах или образовании и разбавлении растворов.
Понятие теплоты химической реакции
Стехиометрическое уравнение химической реакции и химическая переменная.
ênA ê A + ênB êB = nC C + nD D, или в общем виде, 0 = ,Теплоты химических реакций и их связь с изменением термодина-мических функций.
Теплотой химической реакции называют количество тепла, которое выделяется(–) или поглощается(+) за один пробег химической реакции (т.е. при полном… Если W’ = 0, то U = f (T, V, ξ); Qv = DU Þ= . (2.12) 4.2.2.2. Теплота при постоянном давлении.Закон Гесса (1836)
Формулировка
Расчет изменеия термодинамических функций в химических реакциях
== (2.14) Оператор Drозначаетдействие над любой функцией состояния, сводя-щееся к суммированию мольных значений этой функции для…Классификация реакции по знаку теплового эффекта
DrU = Qv > 0
DrН = Qр > 0реакция эндотермическая
DrU = Qv < 0
DrН = Qр < 0 реакция экзотермическая
4.3.4. Связь Qр и Qv в химических реакциях
DrН = DrU + p DrV
В химических реакциях объем изменяется, если изменяется число молей газообразных веществ
pDrV = Drnгаз RT.
При расчете на один пробег изменение числа молей газообразных ве-ществ равно алгебраической сумме стехиометрических коэффициентов этих веществ
Drnгаз =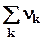 газ =(
газ =( )газ = D ên k êгаз
)газ = D ên k êгаз
DrН = DrU + Dr ên k êгаз ∙ RT(2.17)
Пример: 1/2N2 + 3/2 H2 = NH3 DrH = -46, 19 кДж/моль = Qp
nk -1/2 -3/2 1 Dn = -1
QV = Qp + RT = -46190 + 8,314 298 = -43710 Дж/моль = - 43, 71 кДж.моль
Лекция № 3
4.3.5. Применение закона Гесса. Закон Гесса позволяет комбинировать стехиометрические уравнения, вкладывая в них термохимический смысл. Любые линейные комбинации с одинаковыми общими уравнениями имеют один и тот же тепловой эффект. Это позволяет легко определять теплоты реакций, которые трудно экспериментально провести до конца в соответствие с требованиями
H2 + O2 = H2O2 DrH-?
+1ç H2 + 1/2 O2 = H2O DrH1 = -285.8 кДж/моль
–1 ç H2O2 = H2O + 1/2O2 DrH2 = -98,7 кДж/моль
H2 + O2 = H2O2
Подбираем коэффициенты линейной комбинации уравнений реакций, теп-лоты которых известны, чтобы в сумме получалось заданное уравнение. С такими же коэффициенты данные теплоты войдут в искомую теплоту.
DrH = DrH1 - DrH2 = -285,8 – (-98,7) = -187,1 Кж/моль
Энергетическая диаграмма –графическое изображениеуровней реаги-рующих веществ – позволяет наглядно представить эти процессы и нахо-
________________ H2 + O2 дить любые неизвестные теплоты по

 имеющимся данным путем составле-
имеющимся данным путем составле-
-187.1 ния циклов, суммарная теплота кото-
рых равна 0.

 -285.8 H2 O2
-285.8 H2 O2
-98.7
 H2O + 1/2 O2
H2O + 1/2 O2
Следствия из закона Гесса
Первое следствие.
Согласно 1-ому закону термодинамики невозможно измерить абсолютное значение энергии, а только ее изменение. Поэтому нужно выбрать для различных… Стандартная теплота образования – это тепловой эффект реакции образования… Пример,Экспериментальное определение теплот реакций.
0 = DrH + DtH = DrH Dx + CpDT DrH = - CpDT/x = - CpDTνk/ Dnk (3.2) 4.4.2.2 .Теплота сгорания.Теплота реакция равна сумме теплот сгорания реагентов минус сумма теплот сгорания продуктов с учетом модулей стехио-метрических коэффициентов.
3 Сграф. + 3 Н2 + 1/2О2 = Н3С-СО-СН3 DfH˚ -? -1 C3H6O + 4 O2 = 3 CO2 + 3 H2O DсН˚= -1785.3 кДж/моль 3 Н2 + 1/2О 2 = Н2 О DсН˚ = -285,8 кДж/мольТеплота образования вешества равна сумме теплот сгорания простых веществ, образующих его, минус теплота сгорания самого вещества
Приближенный расчет теплот химических реакций по знергиям связи
HClгаз = H + Сl; DrН = εHCl H2Oгаз = 2 Н + О; DrН = 2 εHCl H2Oгаз = Н + ОН DrH = 497 кДж/мольТеплота растворения
4.7.1 Интегральная теплота растворения (DHm) – количество теплоты, выделяемое или поглощаемое при растворении 1 моля вещества в таком количестве… DHmЗависимость теплоты реакции от температуры
Σ׀νi׀Срi Σ׀νj׀Срj Реагенты Т2 Продукты Т2; DrHт2 Из изображенного цикла видно, что зависимость теплоты реакции от температуры связана с разностью теплот нагревания…Зависимость теплоемкости от температуры для идеального газа
Сv = Сp = Связь Ср и Сvлегко определяется для идеального газа: dH= dU + pdV = dU + p R/p *dT = dU + RdTЭнергия молекул как сумма энергий различного вида движения
e = eэлектр. + eкол. + eвращ. + eпост. = eе + ev + er + et. (4.2) Известно, что энергия микрочастиц квантована, т.е. может принимать только… Поступательная энергия молекул практически не квантуется, т.е. может изменяться непрерывно. Когда системе сообщается…Теплоемкость твердых тел
Сv = 3R (q/T)2 e q/T ,где(4.6) (e q/T –1)2 где q = hn/kназывается характеристической температурой.Анализ уравнения Кирхгоффа
4.8.5.1. DrСр = 0 DrНT1= DrНT2 . Теплота реакции не зависит от температуры. 4.8.5.2. DСр>0, T DrН Для эндотермической реакции DrН2 > DrН1. Для экзотермической реакции ½DrН2½ <½DrН1½.Интегрирование уравнения Кирхгоффа
Þ (4.14) DНТ = DН298 + = DН298 + DrСр (T-298) В небольшом интервале температур DrСр= const.В противном случае нужно представить DrСр в виде температурного ряда и…Второй закон термодинамики
Классификация процессов с точки зрения 2 закона термодинамики.
5.1.1. Самопроизвольные процессы выравнивания, протекающие в системе без внешних воздействий, они идут до установления равновесия. Самопроизвольные процессы всегда протекают в одном направлении.
За счет самопроизвольных процессов может быть получена работа: например, за счет разности давлений можно получить механическую работу или работу электрическую - пьезоэлектричество; за счет разности температур может работать тепловой двигатель или термопара, в процессе установления химического равновесия можно получить электрическую работу – в гальваническом элементе.
5.1.2. Несамопроизвольные не могут протекать в системе в отсутствие внешних сил
5.1.3. Обратимые, равновесные, квазистатические, или регулируемые процессы, после циклического их завершения не остается никаких изменений ни в системе, ни в окружающей среде. Это идеализированные процессы, которые характеризуются следующими особенностями:
1) внешние и внутренние силы почти скомпенсированы и различаются на бесконечно малую величину, например ре » -рi;
2) могут изменять направление при бесконечно малом изменении внешних сил;
3) в прямом и обратном направлении процесс протекает через одни и те же промежуточные состояния – по одному и тому же пути;
4) бесконечно медленно;
5) могут быть изотермическими или адиабатическими;
6) |dW| полученная = |dW|затраченная;
7) dWобр = dWmax. > dWнеобр..
8) Необратимых путей множество, а обратимый только один. Для проведения обратимого процесса нужно искусственно тормозить его, прилагая внешнюю силу, преодоление которой позволяет извлекать из системы максимальную работу. Для получения такого результата необходимо иметь некоторое усторойство (тепловой двигатель, галь-ванический элемент и т.п.). Обратимый – идеализированный полностью регулируемый процесс.
5.2. Формулировки второго закона термодинамики. Закон прошел длительный путь эволюции и сначала был сформулирован как основной закон действия тепловых машин
5.2.1. Теорема Карно (1824) “Размышление о движущей силе огня” – коэффициент полезного действия обратимого цикла, состоящего из 2 изотерм и 2 адиабат, зависит только от разности температур тепловых резервуаров и не зависит от природы рабочего тела
h = (Q1 – Q2 )/Q1 = (T1 –T2)/T1 = 1 – Т2/Т1 . (5.1)
5.2.2. Томсон (лорд Кельвин) (1848) ввел понятие абсолютной температуры и (1851) сформулировал 2 закон ТД – невозможно построить периодически действующую тепловую машину, которая только бы черпала тепло из одного резервуара и производила механическую работу, т.е. невозможен вечный двигатель 2-го рода
5.2.3. Клаузиус (1850) дал первую формулировку 2 закона ТД – невозможен самопроизвольный переход теплоты от тела менее нагретого к телу более нагретому. Обе формулировки эквивалентны, одна невозможна без другой. (1854) Ввел понятие энтропии.
5.2.4. Математическое выражение 2 –го закона ТД
Для каждой фазы a, содержащей k компонентов, существует аддитивная функция состояния, называемая энтропией
изменение которой следующим образом связано с теплотой и температурой процессар dS = для обратимых процессов; (5.1) p1 V1 T1 S1 dS > для необратимых процессов. (5.2) p2V2 T2 S2Изменение температуры в закрытой сиситеме
, (5.7) если СV = const, т.е. интервал температур небольшой, в противном случае нужно… 5.3.1.2. p = const. ÞИзотермическое расширение-сжатие идеального газа
5.3.3. Смешение газов.Модельсмешения припостоянных давлении и температуре…P,T p,T p,T
nk/ Snk = Nk мольная доля DS = DSa + DSb = na R ln + nb R ln =Фазовые переходы
dS =  Þ DS =
Þ DS =  , (5.11)
, (5.11)
так как фазовые переходы чистых веществ произходят при постоянной температуре, если зафиксировано давление.
Химические реакции
DrS = SnjSj - S½ni½Si = SnkSk.(5.12) 5.4. Энтропия – критерий направления самопроизвольных процессов в… dSU,V > 0 самопроизвольный процесс; (5.13)Статистический смысл энтропии
5.5.1. Макро- и микросостояния термодинамической системы. Макро- состояние системы задается набором термодинамических параметров, которые имеют… Микросостояние – это состояние отдельных частиц системы, которые можно… N очень велико, и это приводит к новым, статистическим закономерностям, которые нельзя свести к механическим.…Термодинамическая вероятность.
5.5.3.2. Принципы расчета термодинамической вероятности. 5.5.3.2.1. Микросостояния отличаются друг от друга перестановкой частиц. 5.5.3.2.2. Перестановки внутри одной ячейки не ведут к новому микросостоянию, так как состояния внутри ячейки…Процессы , ведущие к увеличению энтропии
5.5.5.2. Увеличение объема фазового пространства, т.е. увеличение числа ячеек, или возможных состояний. а) увеличение объема, расширение; смешение, свертывание полимера в клубок; б) увеличение числа доступных уровней энергии, густота энергетического спектра, уменьшение расстояния между уровнями.…Третий закон термодинамики
Формулировки
При температуре, близкой к абсолютному нулю, многие свойства системы становятся независимыми от температуры, т.е. становятся постоянными, например… . (6.8) Теплоемкости всех веществ становятся одинаковыми и стремятся к 0. Изменение энтропии при всех процессах при абсолютном…Остаточная энтропия
где g0 – кратность вырождения низшего уровня. Аналогично можно рассчитать остаточную конфигурационную энтропию, возникающую,… 6.3. Абсолютная энтропия – это изменение энтропии, отсчитанное от абсолютного нуля до данного состояния. Для ее…Применение 2-го закона термодинамики к изотермическим процессам
Фундаментальное уравнение Гиббса
dS =1/Т ∙dU + p/Т∙dV + dW’, (7.1) для закрытой системы dW’=0 dS = 1/T dU + p/T dV Þ (7.2)Критерии направления самопроизвольных процессах в изотермических условиях. Термодинамические потенциалы.
7.2.1. Энергия Гельмгольца. 7.2.1.1. Физический смысл Преобразуем выражение (7.6) таким образом, чтобы функции состояния попали в одну сторону неравенства – влево:Физический смысл
dU - TdS + pdV £ - dW’ d(U –TS +PV) £ - dW’ D(U –TS +PV) £ - W’p,TУбыль энергии Гиббса равнa максимальной полезной работе изобарно-изотермического процесса.
7.2.2.2. Критерии направления самопроизвольного процесса при T,p = const.
dG p,T £ 0, DG p,T £ 0.(7.17)
Процессы при T,p = const идут в сторону убыли энергии Гиббса.
Стабильное равновесие достигается при минимуме энергии Гиббса
dG p,T = 0 ; (d 2G/d Х2) p,T ³ 0.(7.18)
Полный дифференциал энергии Гиббса в закрытой системе
dG = dU + pdV + Vdp – TdS – SdT из определения функции.
Подставим фундаментальное уравнение Гиббса (7.4)
dG = TdS - pdV + pdV + Vdp – TdS – SdT = Vdp –SdT.
Определяющими параметрами для энергии Гиббса будут – р и Т,
dG = Vdp –SdT(7.19)
 (7.20)
(7.20)
Характеристические функции
S T U H A GТаблица характеристических функций (F)
| F | Естествен- ные параметры | Условия самопро- извольных процессов | Условия равновесия | Производные функций | Физиче-ский смысл |
| U | S,V | DUS,V<0 | DUS,V=0

| 
| DU= QV |
| H | S,р | DHS,p<0 | DHS,p=0 d2H>0 | 
| DH = Qp |
| A | T,V | DAT,V<0 | DAT,V=0 d2A>0 | 
| -DA = (WT)max |
| G | T,p | DG p,T<0 | DG p,T=0 d2G>0 | 
| -DG = (W’pT)max |
Полные дифференциалы и частные производные характеристиче-ских функций в закрытых системах (урпанения Массье)
dН = TdS – Vdp фундаментального уравнения Гиббса к другим dA = –SdT – pdV переменным, но содержат эквивалентную ему dG = Vdp –SdT информацию.Зависимость энергии Гиббса от температуры и давления
DG pT º D H -TDS, D rG pT º D rH -TDrS(7.22) DH характеризует общее изменение энергии системы в ходе процесса, а изменение… а); б) (7.20)P T
Рис. 7.1. Зависимость энергии Гиббса от давления и температуры.
С ростом температуры энергия Гиббса убывает, так как энтропия всегда положительна, причем падение энергии Гиббса будет ускоряться из-за роста энтропии при повышении температуры.
7.3.5. Уравнение Гиббса – Гельмгольца.Эта зависимость позволяет заменить недоступную для непосредственных измерений функцию – энтропию на измеряемую величину - температурную зависимость энергии Гиббса. В результате подстановки этого выражения в уравнение (7.21) получаем
G º H +T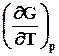 (7.23)
(7.23)
Аналогично можно представить энергию Гельмгольца
А º U +T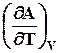 (7.24)
(7.24)
Уравнения (7.24) и (7.25) называется уравнениями Гиббса-Гельмгольца. Можно произвести с ними дальнейшие преобразования: из уравнения (7.24) следует
 =
= 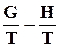 . (7.25)
. (7.25)
Далее рассмотрим производную от дроби G/Tи подставим в нее выраже-ние (7.26):
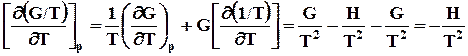 . (7.26)
. (7.26)
Таким образом зависимость приведенной энергии Гиббса G/Tот температуры определяется энтальпией системы. Уравнение (7.27) также называют урав-нением Гиббса –Гельмгольца. Аналогично для энергии Гельмгольца можно написать
 . (7.27)
. (7.27)
Уравнения Гиббса-Гельмгольца находят применение для физических и химических процессов. Для этого требуется заменить в них термодина-мические потенциалы на их изменение в указанных процессах, например
ΔrG = ΔrH +T ,или(7.28)
,или(7.28)
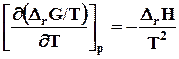 и (7.29)
и (7.29)
 . (7.30)
. (7.30)
Лекция № 8
Фундаментальное уравнение Гиббса для открытых систем
dU = TdS – pdV - dW’ Гиббс ввел в качестве переменной массу, а точнее количество молей компонентов,… dWхим. = - .Понятие химического потенциала.
Химический потенциал k –компонента в фазе a показывает изменение любой характеристической функции при введении в систему (фазу) 1 моля k-вещества… mk = = ==.(8.5) Наиболее часто используется именно последнее выражение химического потенциала через энергию Гиббса.Уравнение Гиббса-Дюгема
dU = TdS + SdT – pdV – Vdp + + . Подставим в него фундаментальное уравнение Гиббса (8.1): TdS – pdV + = TdS + SdT – pdV – Vdp + + ÞВыражение химического потенциала компонента идеального газа
m = G/n = G. dG = - SdT + Vdp, при постоянной температуре dGT = Vdp.(8.16) Проинтегрируем последнее выражение от некоторого стандартного состояния до заданного с учетом уравнения Менделеева -…Смесь газов
DG A = ; DGB = nBRT ln pB/pB0. DG = DG A + DGB = RT(nA ln pA/pA0 + nB ln pB/pB0)(8.18)Коэффициент летучести. Стандартные состояния.
1 m0 2 m*Химические реакции и химическое равновесие
Общее условие химического равновесия в закрытой системе
При p,T = const dGр,Т = Smk dnk. (9.1) Так же будут выглядеть дифференциалы других характеристических функций при… dnk/nk = dx и dnk = nk dxУравнение изотермы химической реакции
Гомогенные газовые реакции
m = m0 + RT ln p (идеальный газ), m = m0 + RT ln f/f˚(реальный газ) Þ DrGpT = S(m0k + RT ln pk) nk = Smоknk + RT ln= DrGpT = DrGT0+ RT ln= DrGT0+ RT ln kp. = DrGT0 + RT ln.(9.6)Гетерогенные реакции
FeOтв. + H2газ = Feтв. + H2Oж. n -1 -1 1 1 DrGpT = mFe + m H2O - m FeO - mH2 = m˚Fe + m˚H2O - m˚FeO - m˚H2 – RT ln pH2 ÞВлияние давления на направление реакции
3/2 H2 + 1/2N2 = NH3 T = 500 K DrG˚500 = 9.26 кДж. Стандартное изменение энергии Гиббса положительно, т.е. при стандартных…Закон действующих масс
Константа равновесия
В состоянии равновесия при p,T = const DGpT = 0.Так как стандартное изменение энергии Гиббса зависит только от температуры, то и второе слагаемое в… - DGT0 = RT lnP p*knk = f (T) (9. 10) Отношение равновесных парциальных давлений продуктов к давлению реагентов в степенях, соответствующих модулю…Способы выражения константы равновесия и взаимосвязь между ними
Идеальный газ при постоянном давлении и температуре
Kp = P p*knk = f(T) = = KxpобщDrnгаз, (9.14) где Кх = P х*knk = f (T,pобщ.) Константа Кх,по сути своей уже не является истинной константой, так как зависит и от температуры, и от давления, но…Реальный газ
В выражении константы равновесия реальных газов отношение равновесных парциальных давлений заменяется отношением их летучестей
Kf = 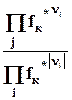 = P f*knk = f(T) = Kp P gknk.(9.15)
= P f*knk = f(T) = Kp P gknk.(9.15)
Идеальный газ при постоянном объеме и температуре
Kp = = P C*knk (RT)Δrnk= Кс(RT) Δrnk= f(T),(9.16) где Δrвключает только газообразные вещества. Константу Кс удобно…Влияние температуры на химическое равновесие
Вывод уравнения Вант-Гоффа
ln Kp = - . и (10.1) . (10.2)Анализ уравнения Вант-Гоффа
Так как RT2 > 0. Изменение константы равновесия с ростом температуры определяется стандартной теплотой реакции.
Если DrHº > 0 реакция эндотермическая, то при T Kp;
Если DrHº < 0 реакция экзотермическая, то при T Kp ¯.
Такие изменения соответствуют принципу Ле-Шателье
Использование уравнения Вант-Гоффа
а) две точки в небольшом интервале температур, DrHº= сonst = ln = ÞПо измерению полезной работы
-DrGºT,p = (W’)max(7.16), например, в электрохимии можно измерить ЭДС гальванического элемента в обратимом процессе
DrGºT,p = -Eº F z, где
гдеEº – стандартная ЭДС элемента, F – число Фарадея, z – количество электронов в уравнении окислительно-восстановительной реакции.
Экспериментальное определение констант равновесия.
NO2 = NO + 1/2O2 .Если nk0 = 1, то x = a nk -1 1 1/2 nk0 1 0 0Статистические расчеты констант равновесия
Q = Si gi exp(-ei/kT) mk = Gk = -RT ln Q/NA + U0.(10.13) Kc = exp(-DrU00/RT)(10.14)– Конец работы –
Используемые теги: тонкой, химической, технологии, Ломоносова0.069
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Тонкой химической технологии им. М.В. Ломоносова
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов