рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Образование
- /
- Номенклатура алкенов. Простейшим соединением ряда алкенов является этен С2Н4
Реферат Курсовая Конспект
Номенклатура алкенов. Простейшим соединением ряда алкенов является этен С2Н4
Номенклатура алкенов. Простейшим соединением ряда алкенов является этен С2Н4 - раздел Образование, Алкены ...
АЛКЕНЫ
Алкенами называются ненасыщенные линейные углеводороды, содержащие одну двойную связь и отвечают общей формуле – СnН2n. Простейшим алкеном является этилен С2Н4, остальные углеводороды этого ряда рассматривают как его производные. Исторически первое название алифатических углеводородов с двойной связью – олефины (маслообразующие, т. к. при взаимодействии с хлором и бромом образовы-вали маслянистые жидкости).
Номенклатура алкенов. Простейшим соединением ряда алкенов является этен С2Н4.
Для названия алкенов используют следующие номенклатуры:
· тривиальную;
· рациональную;
· систематическую.
Тривиальная. Как и в ряду алканов, для первых членов гомологического ряда широко используются тривиальные названия этилен СН2=СН2, пропилен СН2=СН–СН3, бутилен СН2=СН–СН2–СН3, псевдобутилен СН3–СН=СН–СН3.
Рациональная. В рациональной номенклатуре олефины рассматривают как алкилзамещенный этилен, обозначая положения заместителей словами симметричный или несимметричный, либо символами α или β.
Систематическая (заместительная, международная, ИЮПАК). Систематическое название строят, принимая за главную цепь самую длинную углеродную цепь, содержащую двойную связь, которую обозначают суффиксом -ен. Нумерация цепи начинается со стороны, к которой ближе расположена двойная связь.
Изомерия. Для алкенов характерны следующие виды изомерии:
Структурная:
· скелетная;
· изомерия положения;
· метамерия.
Пространственная:
· геометрическая.
Способы получения. Низшие алкены в небольших количествах могут входить в состав нефтяного газа, высшие – в состав некоторых нефтей. Непредельный характер имеет целый ряд феромонов. Так, половой аттрактант самки домашней мухи представляет собой алкен С23Н46-(Z)-трикозен-9 (мускулар):
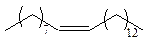
Е-изомер этого соединения не активен и не является феромоном.
Промышленные способы:
1. Получение из нефти. Низшие алкены С2 – С4 можно получить при переработке нефти. Среди газообразных продуктов пиролиза и крекинга нефти, содержание алкенов может достигать 50%. Алкены С5 – С10, которые нельзя выделить из сложной смеси после крекинга, входят в состав бензина. Образование алкенов в процессе крекинга и пиролиза основано на реакциях свободных радикалов (см. термические превращения алканов).
1.1. Каталитическая дегидрогенизация (дегидрирование) алканов. (450 – 460оС, катализатор – смеси оксидов металлов (алюминия, хрома, железа и др.):
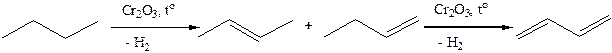
Лабораторные методы:
2. Дегидрогалогенирование галогенпроизводных алканов. Для элиминирования галогеноводорода требуется сильное основание – спиртовой раствор щелочи. Атом водорода преимущественно отщепляется от наименее гидрогенизированного атома (правило Зайцева):
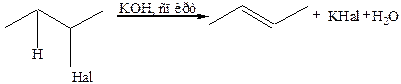
3. Дегалогенирование вициальных дигалогеналканов:
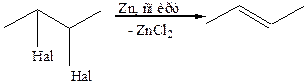
4. Дегидратациая спиртов (водоотнимающий агент, 150–200оС; оксид алюминия при 350–400оС):
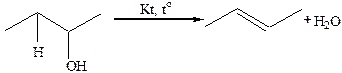
5. Восстановление алкадиенов и алкинов:
5.1
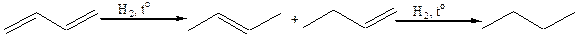
5.2
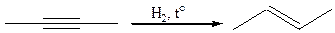
6. Реакция конденсации. Алкены и их производные получают при взаимодействии двух соединений с активными группами (например, карбонильной, метиленовой и др.). Общая схема реакции:
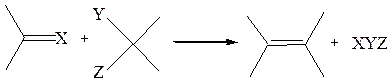
6.1. Реакция фосфонийилидов с сильными нуклеофильным реагентами (реакция Виттига):
(С6Н5)3Р=СН2 + О=С(R)2  (С6Н5)3Р=О + СН2= С(R)2
(С6Н5)3Р=О + СН2= С(R)2
6.2. Взаимодействие малоновой кислоты с карбонильными соединениями (Э. Кневенагель, 1896 г.):
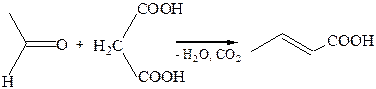
7. Деалкоголиз простых эфиров. Отщепление спирта в простых эфирах осуществляется действием сильных кислот, связывающих спирт:
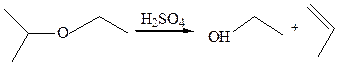
8. Из сложных эфиров. Образование алкенов идет по типу ЕN1:
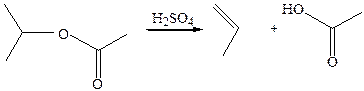
9. Деаммонолиз. Связь в аминах С–N менее полярна по сравнению C–O в спиртах, гомолитический разрыв возможен в результате пиролиза при высоких температурах:
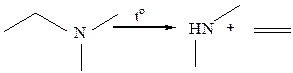
Физические свойства и строение алкенов. Первые представители гомологического ряда алкенов (С2 – С4) при обычных температурах – газы, следующие члены ряда – бесцветные жидкости или кристаллические вещества. Этилен и пропен имеют слабый запах. При увеличении числа углеродных атомов и разветвлении цепи запах становится едким.
Алкены имеют более низкие температуры плавления и кипения по сравнению, например, со спиртами с аналогичной молекулярной массой, т. к. единственными силами притяжения между неполярными углеводородными фрагментами молекул алкенов являются слабые ван-дер-ваальсовы силы. В гомологическом ряду алкенов температуры кипения закономерно возрастают. Алкены с разветвленной углеродной цепью имеют более низкие температуры кипения, чем изомеры с нормальной цепью. Низшие гомологи этилена образуют более плотно упакованные молекулярные кристаллические решетки из-за плоского строения участка ионной связи, что объясняет их более высокую относительную плотность по сравнению с соответствующими алканами. Чем выше молекулярная масса, тем меньше это различие.
Таблица 20 – Физические свойства некоторых алкенов
| Соединение | 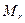
| Формула | Температура, °С | Плотность, 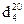
| |
| плавления | кипения | ||||
| этен | СН2=СН2 | –169 | 0,5699* | ||
| пропен | СН3СН=СН2 | –185 | –47,4 | 0,5193* | |
| бутен-1 | СН3СН2СН=СН2 | –130 | –6,3 | 0,5951* | |
| цис-бутен-2 | СН3СН=СНСН3 | –139 | 3,7 | 0,6213 | |
| транс-бутен-2 | СН3СН=СНСН3 | –105 | 0,9 | 0,6042 | |
| 2-метилпропен-1 | СН3С(СН3)=СН2 | –140 | –6,9 | 0,5942* | |
| пентен-1 | СН3(СН2)2СН=СН2 | –138 | 30,0 | 0,6405 | |
| цис-пентен-2 | СН3СН2СН=СНСН3 | –151 | 36,9 | 0,6556 | |
| транс-пентен-2 | СН3СН2СН=СНСН3 | –136 | 36,4 | 0,6482 | |
| 2-метилбутен-2 | СН3С(СН3)=СНСН3 | –123 | 38,6 | 0,6623 | |
| октадецен-1 | СН3(СН2)15СН=СН2 | +17,6 | +314,8 | 0,7890 |
Примечание: * значения измерены при температуре кипения
Алкены хорошо растворяются в бензоле, тетрахлорметане, петролейном и диэтиловом эфирах, но практически не растворяются в воде.
Наличие π-связи объясняет такие свойства алкенов, как повышенная рефракция, пониженная энергия одной связи, легкая поляризуемость. Электроны π-орбитали находятся дальше от атомных ядер, поэтому они более подвижны, энергия π-орбиталей меньше, чем энергия σ-орбиталей. Отрыв электрона от π-орбитали требует затраты меньшего количества энергии, чем отрыв электрона от σ-орбитали. Плотность, коэффициент преломления и молекулярная рефракция алкенов выше по сравнению с алканами с тем же числом углеродных атомов, что свидетельствует о большей поляризуемости двойной связи (табл. 20). Физические параметры двойной связи приведены в таблице 21.
Таблица 21 – Сравнительные физические параметры связей углеводородов
| Связь | Длина, нм | Средняя энергия, кДж/моль | Рефракция связи, RD, см3 | Тип атома углерода | Дипольный момент, μ, D |
| С=С | 0,133 | 4,170 | sp2 | 0,68 | |
| С–С | 0,154 | 1,296 | sp3 | 0,40 | |
| С≡С | 0,120 | 6,240 | sp | 1,0 |
Особого внимания заслуживает сравнение термодинамической устойчивости изомерных алкенов. Введение алкильных групп у двойной связи термодинамически стабилизирует молекулу алкена. Это следует из значений стандартной энтальпии (теплот) сгорания алкенов и теплот гидрирования. Чем меньше теплота сгорания соединений одинакового состава, тем стабильнее соединение. Аналогично уменьшаются теплоты гидрирования.
Химические свойства. Характеристика реакционной способности. Реакции непредельных углеводородов обусловлены наличием в их составе кратной связи.
· π-cвязь менее прочная, чем σ, по месту ее разрыва возможно присоединение к углеродным атомам. Поскольку π-электроны обладают большей подвижностью, то для π-связи предпочтителен гетеролитический разрыв.
· π-электроны находятся на периферии молекулы, более доступны, чем ядро атома углерода, поэтому в реакции присоединения алкены выступают как доноры электронов или основания Льюиса. Следовательно, алкены могут взаимодействовать с электрофильными и нейтральными частицами, оставаясь инертными к нуклеофильным реагентам. Таким образом, для алкенов более характерны реакции электрофильного присоединения (АЕ);
· поскольку в молекулах алкенов связи неполярны или малополярны возможен их гомолиз, и соответственно, могут протекать реакции АR и SR по углеводородному радикалу. Связь С=С может стабилизировать соседний радикальный центр за счет делокализации электронов и таким образом способствовать SR реакции по этому центру молекулы;
· за счет разрыва π-связей непредельные углеводороды склонны к реакциям полимеризации, которые можно отнести к особому типу присоединения;
· благодаря наличию π-связей алкены легко вступают в реакции окисления.
Реакции присоединения.
В общем виде механизм реакции АЕ можно показать на следующей схеме:

1. Стадия электрофильной атаки. Электрофил образует с кратной связью молекулярный комплекс (π-комплекс), в котором осуществляется пространственная ориентация реагирующих веществ. Затем происходит гетеролитический разрыв π-связи, т. е. электрофил образует новую σ-связь с атомом углерода, а соседний С–атом приобретает «+» заряд и возникает карбокатион.
2. Стадия нуклеофильной атаки. Образовавшийся карбкатион активен и взаимодействует с любым нуклеофилом, имеющимся в реакционной зоне.
Для несимметричных алкенов в реакциях, протекающих по механизму АЕ присоединение происходит по правилу В.В. Марковникова: при присоединении протонных кислот и воды водород присоединяется к наиболее гидрогенизированному атому углерода при двойной связи. Или в современной трактовке: присоединение протона к алкену осуществляется в направлении образования наиболее стабильного карбокатиона.
Устойчивость карбокатиона зависит от строения и падает в ряду:
третичный > вторичный > первичный
Алкильные группы обладают большими электронодонорными свойствами, чем водород, и могут принимать участие в частичной компенсации положительного заряда на атоме углерода карбкатиона вследствие действия положительного индукционного и мезомерного эффектов (σ, р). Следовательно, чем больше алкильных групп связано с С+, тем больше они будут компенсировать заряд и тем более устойчивым окажется комплекс.
Известно много исключений из правила В.В. Марковникова в его классической интерпретации. Но, хотя формально, эти реакции протекают против правила, они соответствуют его обобщенной форме: присоединение осуществляется с образованием наиболее устойчивой промежуточной частицы. Причиной протекания реакции против правила В.В. Марковникова может служить механизм реакции. Так, реакции протекающие по АR, образуют аномальный продукт (реакция Караша):
2H–Br + •O–O•  H2O2 + 2Br•
H2O2 + 2Br•
CH3–CH=CH2 + Br•  CH3–C•H–CH2–Br
CH3–C•H–CH2–Br
CH3–C•H–CH2–Br + H–Br  CH3–CH2–CH2–Br + Br•
CH3–CH2–CH2–Br + Br•
Следует отметить, что из всех галогеноводородов только бромоводород обнаруживает перекисный эффект. Атом хлора более богат энергией и не получается таким путем, а атом йода, как малореакционноспособный, не может подержать цепь реакции.
1. Гидрирование (катализаторы: Ni, Pt, Pd и др. при комнатной температуре):
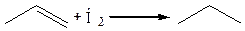
2. Галогенирование (в присутствии полярных растворителей: вода, спирт, уксусная кислота и др.). Реакция является качественной на двойную связь:
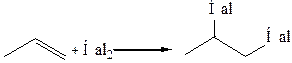
Галогенирование в среде полярного растворителя протекает по электрофильному двухстадийному механизму, с позиций которого можно рассмотреть стереохимию галогенирования. На стадии электрофильной атаки неполярная молекула галогена поляризуется под влиянием полярного растворителя либо под влиянием электрического поля кратной связи, после чего образуется с молекулой углеводорода π-аддукт:
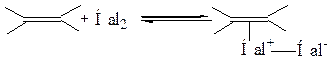
Затем связи С=С и Hal–Hal гетеролитически разрываются, электрофил Hal+ вытягивает пару π-электронов и образует за ее счет σ-связь с атомом углерода. Возникает карбокатион, который может образовать циклический галогеоний-катион.

Таким образом, реакция галогенирования протекает как транс–присоединение, подтверждая стереоселективность реакции.
3. Реакции с Н–электрофилами (Н–Х, где Х – анион кислоты):
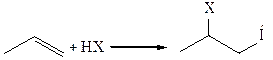
При взаимодействии с серной кислотой в реакции образуются алкилсульфаты, которые при нагревании с водой подвергаются гидролизу с образованием спирта (Х – SO4H -):
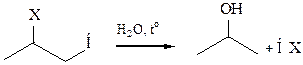
4. Присоединение гипогалоидных кислот, образуются галогенгидрины:
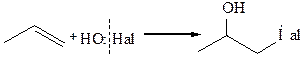
Такие же продукты можно получить при хлорировании алкена в водном растворе (сопряженное присоедиение).
5. Присоединение С-электрофилов к алкенам:
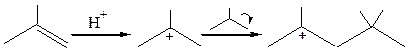
Если в реакционной смеси присутствуют какие-либо другие вещества, димерный катион может отдать протон, превращаясь при этом в два алкена:
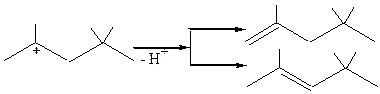
Такой процесс называют димеризацией алкенов.
6. Карбонилирование (гидроформилирование или оксосинтез, катализатор – НСо(СО)4):
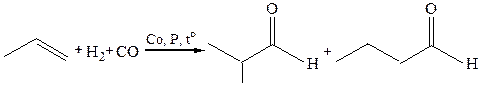
Если реакцию проводить с последующей обработкой продуктов реакции нуклеофильными реагентами продуктом будут карбоновые кислоты и их производные:
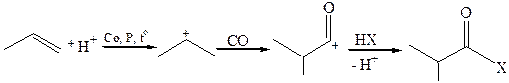
7. Радикальные реакции. Реакции такого типа у непредельных углеводородов могут протекать с участием кратных связей (AR) и С–Н связей (SR).
7.1 Реакции радикального присоединения. В качестве примера АR – реакции можно рассмотреть реакцию Караша. Подобные реакции не характерны для алкенов, но могут протекать при особых условиях (температура, УФ-свет, пероксиды).
Алкены присоединяют свободные радикалы по π-связи с образованием нового свободного алкильного радикала, при этом могут происходить рекомбинаци радикалов, отрыв водородного атома от других молекул. При этом начинается процесс олигомеризации и полимеризации, возможно диспропорционирование алкильного радикала:
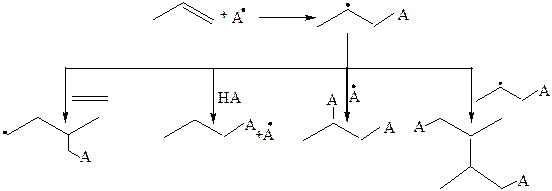
7.2 Реакции радикального замещения. Замещение осуществляется у атома углерода, который находится рядом с двойной связью (аллильное положение):
7.2.1 Аутоокисление:
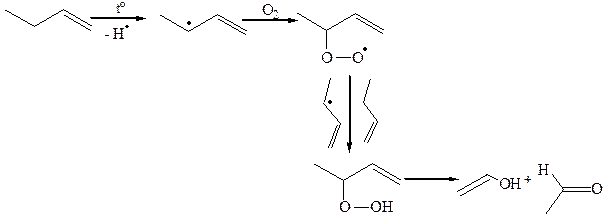
Процесс образования аллильных радикалов может быть конкурирующим присоединению по двойной связи.
7.2.2 Изомеризация (выше 500оС):

7.2.3 Аллильное галогенирование:
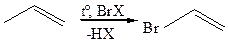
Аллильные радикалы являются более стабильными, чем обычные алкильные радикалы, что обусловлено сопряжением неспаренного электрона с двойной связью.
7.2.4 Реакция Хека:
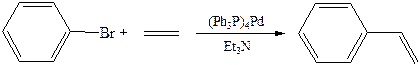
8. Реакции окисления.
8.1 Эпоксидирование.(кислородом или воздухом, в присутствии серебряного катализатора, гидропероксидами в присутствии молибден-, вольфрам-, ванадийсодержащих катализаторов, пероксикислотами), образуется эпоксид (оксиран):
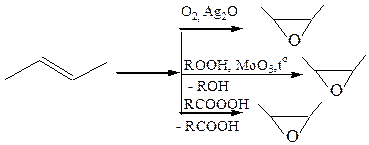
В последней реакции (Прилежаев, 1909 г.) эпоксиды могут выступать в качестве промежуточных веществ, если в реакционной среде присутствует вода:
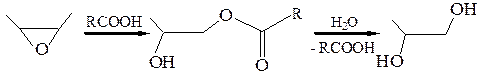
Таким образом, суммарный результат этой реакции – транс-гидроксилирование алкена, следовательно, реакция протекает стереоселективно (О.А. Реутов).
Асимметричное эпоксидирование по Шарплессу:
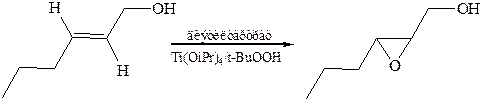
8.2 Гидроксилирование(реактив Е. Вагнера, 1888 г.).
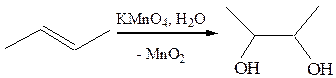
Цис-присоединение объясняется с помощью механизма, предполагающего первоначальное присоединение аниона MnO4- c последующим гидролизом образующегося циклического эфира:
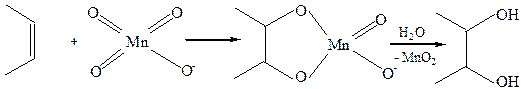
Реакция Вагнера широко используется как тест на непредельный характер соединения.
Для цис-гидроксилирования алкенов можно использовать тетраоксиды осмия (реакция Криге, 1936 г.) и рутения.
8.3 Озонирование (озонолиз, реакция К. Гариеса, 1904 г.):
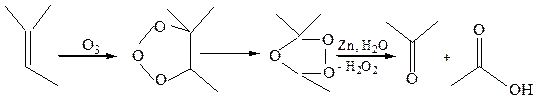
Из-за простоты идентификации продуктов озонолиза эта реакция широко используется для установления строения непредельных соединений.
8.4 Жесткое окисление. Сильные окислители (перманганат или дихромат калия в кислой среде, хромовый ангидрид в уксусной кислоте) расщепляют непредельные углеводороды по кратной связи, образуя смеси кислот и кетонов. Хромовый ангидрид пригоден для селективного окисления двойной связи в присутствии тройной:
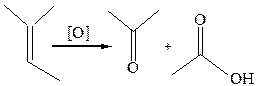
8.5 Окисление в присутствии солей палладия (Вакер-процесс):
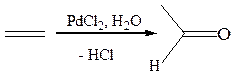
Этилен образует с PdCl2, содержащим незаполненные орбитали, π-комплекс, в котором двойная связь активирована к нуклеофильным реагентам и может подвергнуться атаке молекулами воды. В результате образуется палладийорганическое соединение, отщепляющее затем палладий и хлороводород:
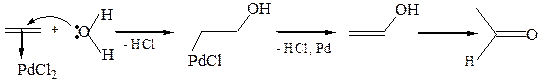
9. Реакции циклоприсоединения.Реакциями циклоприсоединения называются реакции, в которых несколько ненасыщенных молекул присоединяются друг к другу с образованием циклического аддукта.
9.1 Циклоприсоединение [2+1]. Взаимодействие алкенов с карбенами. Карбены реакционноспособные частицы, не существующие в свободном виде, но образующиеся из ряда соединений в качестве интермедиатов:
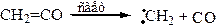
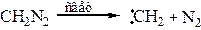

Карбены легко присоединяются по месту разрыва π-связи, образуя трехчленный цикл:
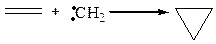
9.2 Циклоприсоединение [2+2]. Димеризация алкенов с образованием производных циклобутана происходит только под действием УФ-света:
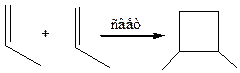
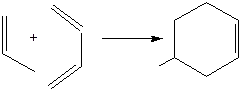
9.3 Циклоприсоединение [2+4]. Алкены способны взаимодействовать с сопряженными диенами и давать производные циклогексена (диеновый синтез, синтез Дильса – Адлера):
10. Олигомеризация и полимеризация алкенов. Реакции (димеризации, тримеризации, тетрамеризации и т. д.) и полимеризации осуществляются только в присутствии других веществ, инициирующих образование (карбкатионов, карбанионов, свободных радикалов) и в особых условиях. Полимер – высокомолекулярное соединение, состоящее из повторяющихся простых единиц – мономеров. Полимеры, получаемые из алкенов называют полиолефинами.
Полимеризация – это процесс образования полимера путем последовательного присоединения целого числа простых молекул (мономеров) без выделения побочных продуктов.
Олигомер – вещество, состоящее из повторяющихся молекул, физические свойства которого изменяются при добавлении или удалении одного или нескольких составных звеньев.
Сополимер – полимер, образованный мономерами нескольких типов. Степень полимеризации – число повторяющихся звеньев полимерной цепи. В зависимости от механизма реакции полимеризации различают радикальную и ионную полимеризацию.
Полимеризация в присутствии кислот.
10.1 Катионная полимеризация:
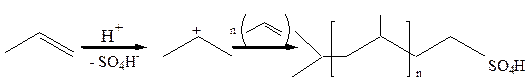
10.2 Анионная полимеризация:
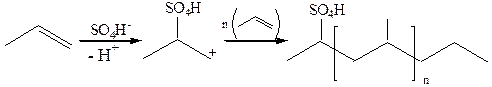
10.3 Радикальная полимеризация:
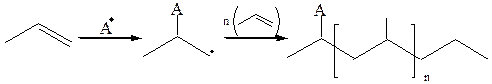
Цепь полимеризации обрывается, если происходит димеризация или диспропорционирование свободных радикалов.
10.4 Координационная полимеризация (в присутствии металлоорганических соединений, например алюминий, титан, смешанных металлоорганических катализаторов (Циглера – Натта, 1953-1955 г.):
R2Al–R + nCH2=CH2  R2Al(–CH2–CH2–)nR
R2Al(–CH2–CH2–)nR
R–TiCl3 + nCH2=CH2  R(–CH2–CH2–)nTiCl3
R(–CH2–CH2–)nTiCl3
В зависимости от условий, возможно три варианта образования полимерной цепи:
· изотактический полимер, группы заместителей расположены стереорегулярно по одну сторону цепи полимера:
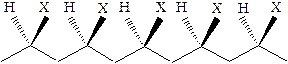
· атактический полимер, группы заместителей расположены беспорядочно относительно главной цепи полимера:
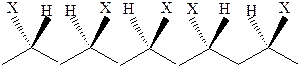
· синдиотактический полимер, группы заместителей расположены то по одну, то по другую сторону главной полимерной цепи:

Применение алкенов. Практическое значение алкенов связано с тремя основными обстоятельствами.
· Повышенная реакционная способность позволяет их использовать качестве исходных соединений для получения разнообразных и необходимых продуктов жизнедеятельности человека: галогеналканов, спиртов, альдегидов, кетонов, карбоновых кислот и их производных, моторных топлив и т. д.
· Алкенами являются многие природные соединения растительного и животного происхождения. Например, в состав растительных жиров входят ненасыщенные и полиненасыщенные кислоты. Некоторые алкены обладают свойствами, характерными для феромонов и имеют большое практическое значение как экологически безвредные средства борьбы с вредными насекомыми. Среди первых ферромонов, известен телергон или транс-9-кетодецен-2-овая кислота (Батлер, 1959 г.), выделяемая пчелиной маткой, регулирующая состав пчелиной семьи:
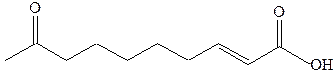
Феромонами являются, например, половой аттрактант шелкопряда бомбикол:

Гераниол, содержащийся в розах, привлекающий рабочих пчел, транс-форма изопропенила и изопропилидена:
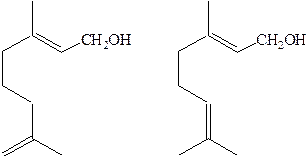
Цис-7-додеценилацетат – половой аттрактант капустной улитки:
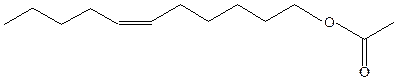
· Алкены являются исходным сырьем для получения полиолефинов, одной из важнейших сфер применения алкенов.
Экологическое послесловие. Загрязнение атмосферы, почв, водоемов и подземных вод алкенами и способы борьбы аналогичны описанным для алканов. Отдельного внимания заслуживает производство высокомолекулярных соединении (ВМС), которое имеет два аспекта: собственно производство и утилизация использованных изделий:
· Производство ВМС связанно с выбросом в атмосферу легколетучих неорганических и органических соединений (HCl, HF, Cl2, F2, NH3, HCN, C2H4, C3H6, C4H8, C2H3Cl и др.), которые являясь ядовитыми, губительно сказываются на человеке, растительном и животном мире на значительных территориях вокруг такого производства.
· Вторая проблема, связанная с утилизацией использованных изделий из ВМС, становится все более актуальной в связи с резким расширением применения пластических масс и синтетических волокон, являющихся долговечными и слабо подвергающимися разрушению кислородом и биодеградации.
В настоящее время используют два варианта утилизации изделий из ВМС:
1) часть изделий подвергают вторичной переработке;
2) твердые отходы cжигают.
Оба метода имеют свои ограничения – массовый сбор использованных изделий достаточно трудно организовать как по экономическим причинам; сжигание ВМС также имеет свои отрицательные моменты, связанные с выделением диоксида углерода и деполимеризацией с образованием токсичных продуктов. По этим причинам актуальной становится проблема получения ВМС и изделий из них нового поколения с заданным сроком эксплуатации, подверженных биодеградации.
АЛКАДИЕНЫ
В зависимости от взаимного расположения двойных связей различают три типа алкадиенов: · кумулированные, двойные связи располагаются у одного углеродного атома –… · сопряженные, двойные связи разделены одной σ-связью;Способы получения.
Получение алкадиенов-1,2 (аллены)
Химические свойства.
2. Алкадиены-1,3, присоединение происходит в двух направлениях: 1,2- и 1,4-присоединение, соотношение определяется…КАУЧУК
Натуральный каучук представляет собой эластичную при низких температурах, пластичную при более высоких температурах массу, которую получают из молочного сока латекса бразильской гевеи (Hеvea brasiliensis). Первым европейцем, ознакомившимся с каучуком, был X. Колумб. Подробно свойства каучука описывал французский исследователь Ш. Кондамин в 1735 г. Первое практическое использование каучука нашел К. Макинтош (1823 г.) – при пропитывании ткани раствором каучука он получил водонепроницаемый материал. Наибольшее значение имело открытие Ч. Гудьира (1839 г.). Он обнаружил, что при обработке каучука серой или серусодержащими соединениями получается материал с отличными механическими свойствами – резина. Этот процесс был назван вулканизацией.
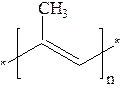 В 1826 г. М. Фарадей установил, что каучук состоит только из углерода и водорода, а Г. Вильямс в I860 г. при сухой перегонке каучука получил изопрен. Строение каучука окончательно установил немецкий химик Г. Штаудингер (1924 г.). Оказалось, что каучук является полимером изопрена:
В 1826 г. М. Фарадей установил, что каучук состоит только из углерода и водорода, а Г. Вильямс в I860 г. при сухой перегонке каучука получил изопрен. Строение каучука окончательно установил немецкий химик Г. Штаудингер (1924 г.). Оказалось, что каучук является полимером изопрена:
Натуральный каучук состоит из смеси молекул цис-полиизопрена. В природе встречается также транс-полиизопрен, называемый гуттаперчей, который имеет худшие механические свойства.
Уже начиная с 1878 г. изучалась полимеризация алкадиенов-1,3 с целью получения синтетического каучука. До 1916 г. были разработаны различные способы полимеризации в присутствии как Na или К, так и свободных радикалов для неразбавленных алкадиенов-1,3 и для водных эмульсий. В 1916 г. в Германии был впервые разработан промышленный метод получения синтетического каучука полимеризацией 2,3-диметилбутадиена.
Первый промышленный метод производства бутадиенового каучука был разработан советским химиком С.В. Лебедевым в 1927 г. Бутадиен он получал из этилового спирта, а полимеризация велась в присутствии Na. В 1931 г. была выпущена экспериментальная партия, а в 1932 г. началось промышленное производство.
Впервые стереорегулярную полимеризацию изопрена в присутствии лития наблюдал советский химик А. Коротков, при использовании комплексных катализаторов Циглера – Натта было разработано промышленное производство стереорегулярного полиизопрена. В СССР промышленная партия этого каучука была выпущена в 1963 г. (каучук СКИ-3). В 1956 г. под руководством советского химика В. Долгоплоска была разработана методика стереорегулярной полимеризации бутадиена и получения цис-бутадиенового каучука (дивинилкаучук, СКД).
ПРИРОДНЫЕ ИЗОПРЕНОИДЫ. ТЕРПЕНЫ
Однако, следует отметить, что эти соединения выделены в одну группу терпенов и терпеноидов по фитохимическому признаку. Большой вклад в развитие… При всем разнообразии технологий и приемов получают две большие группы… Классификация терпенов.Изопренами называются широко распространенные в природе органические соединения, молекулы…Алифатические монотерпены и терпеноиды
Мирцен:АЛКИНЫ
Алкины, углеводороды ряда ацетилена, содержащие тройную связь. Простейшим алкином является этин С2Н2, открытый в 1836 году Э. Дэви в светильном газе, остальные углеводороды этого ряда рассматривают как его производные. Общая формула СnН2n–2.
Номенклатура алкинов. Для названия алкинов используют следующие номенклатуры:
· тривиальную;
· рациональную;
· систематическую.
Тривиальная. Алкины имеют в названиях те же корни, что и алканы, исключение составляет ацетилен, название которого связано с ацетатом, (лат. acetum – уксус, это же происхождение имеют ацеталь и ацетон, последний раньше получали прокаливанием ацетата кальция).
Рациональная. В рациональной номенклатуре алкины рассматривают как алкилзамещенный ацетилен.
Систематическая (заместительная, международная, ИЮПАК). Систематическое название строят, принимая за главную цепь самую длинную углеродную цепь, содержащую тройную связь, которую обозначают суффиксом -ин. Нумерация цепи начинается со стороны, к которой ближе расположена тройная связь, которая может быть концевой(терминальной) или внутренней.
Изомерия. Для алкинов характерны следующие виды изомерии:
Структурная:
· скелетная;
· изомерия положения;
· метамерия.
Способы получения.
СаС2 + 2Н2О НС≡СН + Са(ОН)24.1.1
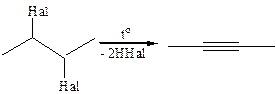
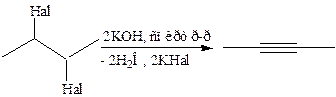 4.1.2
4.1.2
4.1.3
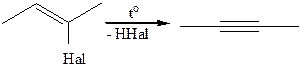
4.1.4
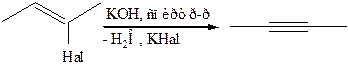
4.1.5
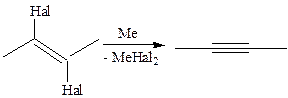
5. Алкилирование алкинов(Ж.И. Иоцич, 1902 г.):

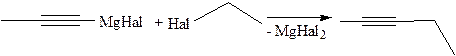
6. Получение из природных источников. Соединения с сопряженными тройными связями выделены из сложноцветных, зонтичных растений. Например, из подсолнечника выделен углеводород желтого цвета – тридецен-1-пентаин-3,5,7,9,11:

Физические свойства алкинов. Низшие алкены – газы, не обладающие ни цветом ни запахом. Начиная с С17 алкины кристаллические вещества. Они имеют более высокие температуры кипения, чем алкены. Алкины с терминальной связью кипят ниже, чем соответствующие изомеры с внутренней связью. Плотности, температуры кипения, плавления у алкинов выше, чем у соответствующих алканов. Чем выше молекулярная масса алкинов, тем эта разница меньше. Строение алкинов позволяет низшим гомологам ацетилена образовывать плотно упакованные молекулярные кристаллические решетки по сравнению с алкенами и алканами. Это отражается на их физических свойствах (табл. 24).
Для алкинов характерна большая молекулярная рефракция, чем у алкенов, что свидетельствует о большей поляризуемости тройной связи.
Наличие sp-гибридных орбиталей для образования σ-связей приводит к их укорочению по сравнению с C–C и С–Н связями этилена и этана в соответствии с величиной ковалентных радиусов (табл. 21).
π-МО более компактны, чем у этилена, что несколько затрудняет реакции присоединения.
Таблица 24 – Физические свойства некоторых алкинов
| Соединение | 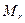
| Формула | Температура, °С | Плотность, 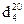
| |
| плавления | кипения | ||||
| этин | СН≡СН | –81,8 | –81,0 | 0,656* | |
| пропин | СН3С≡СН | –102,7 | –23,2 | 0,670* | |
| бутин-1 | СН3СН2С≡СН | –125,7 | +8,5 | 0,678* | |
| бутин-2 | СН3С≡ССН3 | –32,7 | +27,0 | 0,691 | |
| пентин-1 | СН3(СН2)2СН≡СН | –105,7 | +40,2 | 0,691 | |
| гексин-1 | СН3(СН2)3С≡СН | –131,9 | +71,3 | 0,716 | |
| гептин-1 | СН3(СН2)4С≡СН | –80,9 | +99,7 | 0,733 | |
| децин-1 | СН3(СН2)7С≡СН3 | –44,0 | +174,0 | 0,766 | |
| октадецин-1 | СН3(СН2)15С≡СН | +27,0 | +313,0 | 0,802 |
Примечание: * значения измерены при температуре кипения
Алкины с терминальной тройной связью обладают дипольным моментом большим, чем алкены с тем же числом атомов углерода, что свидетельствует о большей поляризации тройной связи под влиянием электронодонорных алкильных групп.
Алкины, подобно алканам и алкенам, нерастворимы в воде, но хорошо растворимы в органических растворителях – тетрахлорметане, бензоле, эфире.
Химические свойства. Характеристика реакционной способности. Алкины проявляют ряд особых свойств, возникновение которых связано с особенностями их электронного строения:
· Следствием sp гибридизации является повышенная электроотрица-тельность атомов углерода, что значительно уменьшает способность π-электронного облака к поляризации под действием внешних агентов.
· Длина С–С связи в алкина меньше, чем в алкенах и алканах приводит к более эффективному боковому перекрыванию. π-Электроны находятся ближе к межъядерной оси, внешние области С-атомов обеднены электронами, поэтому становится возможной атака ядра нуклеофилами, т. е. осуществление реакций нуклеофильного присоединения (АN).
· За счет разрыва π-связей непредельные углеводороды склонны к реакциям полимеризации, которые можно отнести к особому типу присоединения.
· Алкины, в отличие от других углеводородов обладают заметной С–Н кислотностью благодаря повышенной полярности терминальной С–Н связи.
Реакции присоединения.
Реакции электрофильного присоединения.
3.1.1
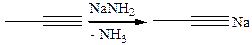
3.1.2
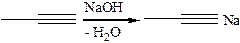
3.1.3
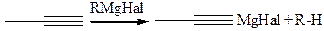
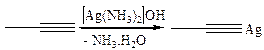 3.1.4
3.1.4
3.1.5
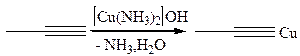
Ацетилениды являются активными нуклеофильными реагентами, их широко используют для введения тройной связи в молекулу:
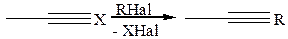
3.1.6 Реакции конденсации. Синтез Репе (1949 г.):
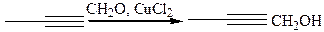
3.1.7 Реакция конденсации. Реакция Фаворского (1905 г.):
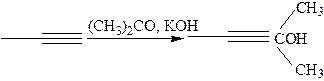
3.1.8 Реакция Саногашира:

4. Реакции полимеризации.
4.1 Линейная полимеризация. В присутствии металлорганических соединений происходит полимеризация алкинов с образованием сопряженных полиенов:
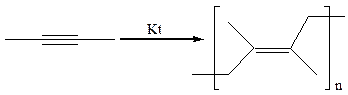
4.2 Линейная полимеризация ацетилена.В присутствии одновалентной меди и окислителя ацетилен образует полимер, состоящий только из атомов С (карбин, полиацетилен):
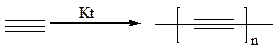
4.3 Линейная ди- и тримеризация ацетилена, проходит в присутствии одновалентной меди в кислой среде (реакция Ньюленда):
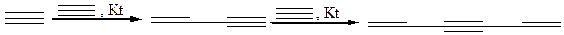
4.4 Циклическая олигомеризация(400–500оС, катализатор – активированный уголь, соединения Cr, Ni, Co, Н.Д. Зелинский, В.А. Казанский):
4.4.1
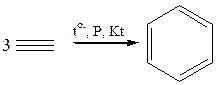
4.4.2
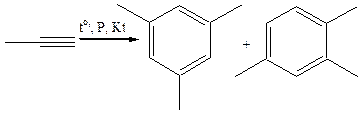
4.4.3 В растворе тетрагидрофурана, катализатор цианида никеля (В. Реппе, 1948 г.):

Применение алкинов.Ацетилен – соединение, дающее начало промышленному производству уксусного альдегида, а на его основе спирта и уксусной кислоты. Ацетилен важен в качестве исходного вещества для получения разнообразных мономеров:
НС≡СН 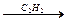 СН2=СН–С≡СН
СН2=СН–С≡СН 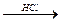 хлоропрен, каучуки
хлоропрен, каучуки
НС≡СН 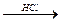 СН2=СНCl
СН2=СНCl  поливинилхлорид, перхлорвинил
поливинилхлорид, перхлорвинил
НС≡СН 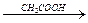 СН2=СН–ОСОСН3
СН2=СН–ОСОСН3  поливинилацетат
поливинилацетат
НС≡СН 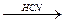 СН2=СН–CN
СН2=СН–CN  полиакрилонитрил, волокно (орлон, нитрон)
полиакрилонитрил, волокно (орлон, нитрон)
Экологические аспекты. Антропогенными источниками поступления в окружающую среду являются как предприятия, принимающие алкины, например, при производстве синтетического каучука, уксусного альдегида, тетрахлорэтана, акрилонитрила, так и предприятия, их производящие.
В организм алкины поступают через легкие и оказывают наркотическое действие, которое нарастает с увеличением молекулярной массы соединения. Длительные контакты с ацетиленом в производственных условиях вызывают функциональные нарушения нервной системы. Его высокие концентрации при небольшом содержании кислорода приводят к потере сознания и отеку легких.
Экологические проблемы производства и использования углеводородов.В окружающей среде медленно, но непрерывно происходит увеличение концентрации летучих углеводородов, главным образом метана. Кроме того, как основной вид моторного топлива, а также как источник тепловой энергии углеводородное сырье при сжигании образует огромное количество углекислого газа, который выбрасывается в атмосферу. Нарушение теплового баланса («парниковый эффект») может привести к глобальным экологическим последствиям, одно из которых затопление низменных участков суши вследствие интенсивного таяния льда в Антарктиде, на Северном полюсе и ледников горных массивов.
Кроме непосредственного экологического загрязнения окружающей среды углеводородами, еще более серьезную опасность представляют токсические продукты, получаемые из углеводородов (галогено-производные, нитросоединения, органические цианиды).
– Конец работы –
Используемые теги: Номенклатура, алкенов, простейшим, соединением, ряда, алкенов, является, этен, С2Н40.126
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Номенклатура алкенов. Простейшим соединением ряда алкенов является этен С2Н4
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов