рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- механизмы химических процессов, т.е. промежуточные стадии, через которые система переходит из начального в конечное состояние
Реферат Курсовая Конспект
механизмы химических процессов, т.е. промежуточные стадии, через которые система переходит из начального в конечное состояние
механизмы химических процессов, т.е. промежуточные стадии, через которые система переходит из начального в конечное состояние - раздел Химия, ...

Химическая кинетика - изучает:
:: ► механизмы химических процессов, т.е. промежуточные стадии, через которые система переходит из начального в конечное состояние,
:: ► скорости этих стадий,
Факторы, влияющие на их скорость.
Кол-во в-ва меняется
непрерывно Þ
► истинная скорость есть
Производная функции
по времени:
Для гомогенных для гетерогенных
Процессов процессов
! .! ! ……… ……………… ……………… ю … .Скорость определяют по приращению продукта.
Если V = const во время реакции: 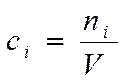
… …………………………..…….
тогда: ! 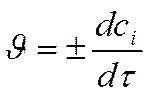
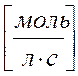
…… …………………………
Для исходных веществ для продуктов
ß ß
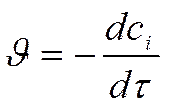 !
! 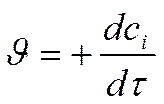
…………… ………………… ! …….. ……………………….
В этом случае: Скорость химической реакции - . изменение концентрации вещества во времени .
Пример. За время 10 сек в объеме 2 л в результате 3х разных реакций образовалось:
Г Н2SО4 ; 340 г NH3 ; 80 г H2.
Скорость этих реакций: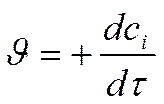
или v = m в-ва /( Mв-ва . V . t ).
молярные массы веществ:
МН2SO4 = 98 г/моль, МNH3 =17 г/моль, МH2 = 2 г/моль.
VH2SO4 = 980 / 98 . 2 . 10 = 0,5 моль/л.c
v NH3 = 340 / 17 . 2 . 10 = 1 моль/л.c
V H2 = 80 / 2 . 2 . 10 = 2 моль/л.c - max !
Cкорость химической реакции зависит от:
Igrave; * природы реагирующих веществ
ì * ихконцентраций или
v== f í парциальных давлений (газы)
n îî* температуры
Icirc;* площади поверхности раздела фаз
î (гетерогенные процессы)
Icirc; * наличия катализатора
Влияние концентрации на скорость
реакции v = ¦ (C в-ва )
· Химическая реакция протекает при столкновении частиц.
· Чем больше концентрация частиц Þ тем больше число их соударений.
· Согласно теории вероятности – вероятность столкновения частиц пропорциональна произведению концентраций каждой из частиц.
Для реакции: aA + bB → mM + lL
►кинетическое уравнение реакции – математическое выражение основного закона кинетики:
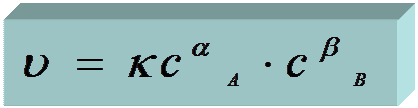 |

Основной закон химической кинетики:
Скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, возведенных в некоторые степени. !
K - константа скорости химической реакции
Þ при сА = сВ = 1моль/лÞ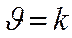
Igrave; * природы реагирующих веществ
► k = f í* температуры
Icirc; * наличия катализатора
► k ¹ f ( концентраций реагирующих веществ )
И β – частные порядки реакции по веществам А и В
В общем случае не совпадают со стехиометрическими коэффициентами, определяются экспериментально.
N = (α+ β) – общий порядок реакции
N .- формальная величина, не имеет физического смысла !
Для простых реакций, идущих в одну стадию, выполняется Þ
.. Закон действия масс :
Скорость химической реакции пропорциональна произведению концентраций реагирующих веществ в степенях их стехиометрических коэффициентов .: :
кинетическое уравнение: υ = k.cAa.cBb
Общий порядок реакции n
ß ß
В простых реакциях в сложных реакциях
N = 1, 2, 3 n = 0, 1, 2, 3, дробный
Опыт:
Na2SO3 + 2HJO3 J2 ¯ + 5Na2SO4 + H2O
; ;Таким образом, общий порядок реакции равен 2.
Целое положительное число, имеет реальный физический смысл, бывают:ПРИМЕР
А) H2 + I2 ® 2HI – простая (элементарная) реакция
N(Н2) = 1, n(I2) =1 , т.е. равны стехиометрическим коэффициентам
THORN; общий порядок реакции n = 1+1 = 2
Þ кинетическое уравнение: 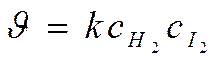
б) 2N2O5 ® O2 + 2N2 O4 - сложная реакция,
протекает по стадиям:
N2O5 ® O2 + N2O3 - молекулярность и порядок = 1
N2O3 ® NO + NO2 - молекулярность и порядок = 1
NO + N2O5 ® 3 NO2 - молекулярность и порядок = 2
NO2 ↔ N2O4 - молекулярность и порядок = 2
Самая медленная стадия – (1)
THORN; она определяет oбщий порядок реакции n = 1
Þ кинетическое уравнение:
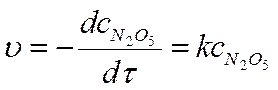
Реакции 1-ого порядка n = 1
А ® продукты
Кинетическое уравнение реакции первого порядка:
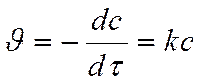
Разделяем переменные и интегрируем:
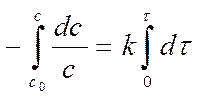
Lnс – lnс0 = - kt Þ lnс = lnс0 - kt
С0 – исходная концентрация вещества А, моль/л.
…………………………………………………… ► !… …………………………………………… …… …..T, с
► 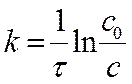 размерность [ k ] = [с-1]
размерность [ k ] = [с-1]
Период полупревращения τ1/2 :
|
Ю с = 0,5 с0 ю
Период полупревращения t ½ для реакций 1- порядка
Þ 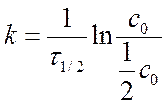
Þ►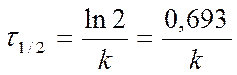
Вывод: для реакций 1 порядка τ1/2 ¹ ¦ (Со )
Реакции 2-ого порядка n = 2
A + B → продукты или 2А ® продукты
Кинетическое уравнение реакции второго порядка:
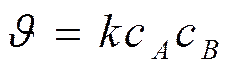
При с0A = с0 B = с0 Þв момент времени τ сA = сB = с
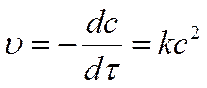
разделяем переменные и интегрируем:
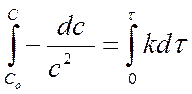
…………………………………………… …… …..
► !. .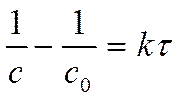 . .!
. .!
……………………………………………………
С0 – исходная концентрация вещества, моль/л.
► ► размерность [ k ] = [л×моль-1×с-1]T
Период полупревращения t ½ для реакций 2- порядка
с = ½ с0
Þ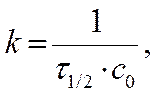 Þ ►
Þ ►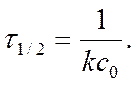
Вывод: для реакций 2 порядка
τ1/2 = ¦ (Со ) Þ обратнопропорционален Со…
Реакции нулевого порядка n = 0
А(избыток) ® продукты
Кинетическое уравнение реакции нулевого порядка:
DcA/dτ = k1cA0 = k
После интегрирования (аналогично выше) имеем
► с = с0 - kt ► t1/2 = с0 /2k
размерность [ k ] = [ моль ×л-1×с-1]
Реакции 3-ого порядка n = 3
A + B +D → продукты или 3А ® продукты
υ = -dcA/dτ = -dc/dτ = kcAcBcD при с0A = с0 B = с0D = с0 Þ в момент времени τ Þ сA = сB = сD = сМетоды определения порядка реакции
Эксперимент: измеряют cреаг.в-в в разные моменты времени.
Полученные данные:
Подставляют в выражение для константы скорости реакций 1, 2 и т.д. порядков.
Критерий - k = Const
2)► строят графики зависимости с = ¦ (t) :
а) если реакция 1-ого порядка Þ график в координатах ( lnс, t ) - прямая линия,
Б) если реакция 2-ого порядка Þ график в координатах ( 1/с , t) - прямая линия и т.д.
для определения порядка реакции по конкретному реагенту:
Эксперимент: измеряют скорость v химической реакции при различных концентрациях вещества c .
v1 = k . c1 x v2 = k . c2 x Þ v2 / v1 = (c2 / c1) x Þ ln(v2 / v1 )= ln(c2 / c1) xTHORN; ln(v2 / v1 ) = x . ln(c2 / c1) Þ /..x..
Влияние температуры на скорость
реакции v = ¦ ( Т )
Правило Вант-Гоффа
|
…………………………… …………………….
!! !!
…………………………… …… ……………….
Выполняется в небольшом интервале температур
THORN; для приблизительных расчётов
γ = (1,8 - 5) - температурный коэффициент (табл.)
всегда:
 gэкзотерм.< gэндотерм. υ
gэкзотерм.< gэндотерм. υ
DrН>0
DrН<0
Т
Уравнение Аррениуса
К реакции приводит столкновение лишь тех молекул, энергия которых больше (равна) определённой величины энергии активации E ≥ Ea

На 1018 молекул - только 4 молекулы активные
При ТÞ доля активных молекул
► Ea = f ( природы реагирующих веществ )
► Ea ¹ f ( температуры )
|
Уравнение
Аррениуса
K0 – предэкспоненциальный множитель
► k0 = f ( природы реагирующих веществ ) ► k0 ¹ f ( температуры )При ТÞ k Þ v скорость химической реакции
Чем > Еа, тем сильнее влияние Т на k реакции
Активированный комплекс – переходное состояние системы с максимальной энергией на пути реакции
АВ + DС ® АВСD* ® АD + ВС
Исходные ® активированный ® продукты
Молекулы комплекс реакции
Еа - минимальная избыточная энергия по сравнению со средней энергией всех частиц, необходимая для перехода системы в состояние…Связь энергии активации Еа с Dr H
Пусть протекает равновесная реакция:
АВ + ДС ÛАД + ВС
● для прямой реакции:
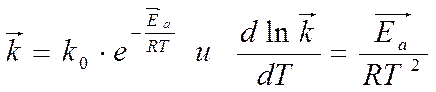
● для обратной реакции:
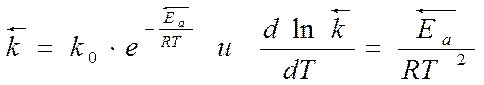
Вычитая из первого уравнения второе, получим:
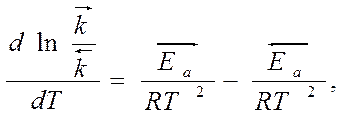
Выражение закона действия масс
К – константа равновесия
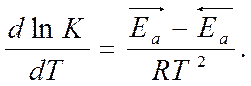
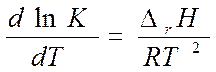 - изобара Вант-Гоффа
- изобара Вант-Гоффа
► 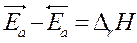 Þ связь термодинамических и
Þ связь термодинамических и
Кинетических параметров


· Катализатор Kt – входит в состав активированного комплекса Þ уменьшает энергию активированного комплекса Þ
снижает Еа
Небольшие количества Kt – резко ускоряют процесс
А+ В + Kt →[ А…В…Kt]→АВ + Kt
Без с
Катализатора катализатором
Еа > Еа, Kt
[ А…В] [ А…В…Kt]
k < kKt
v < vKt
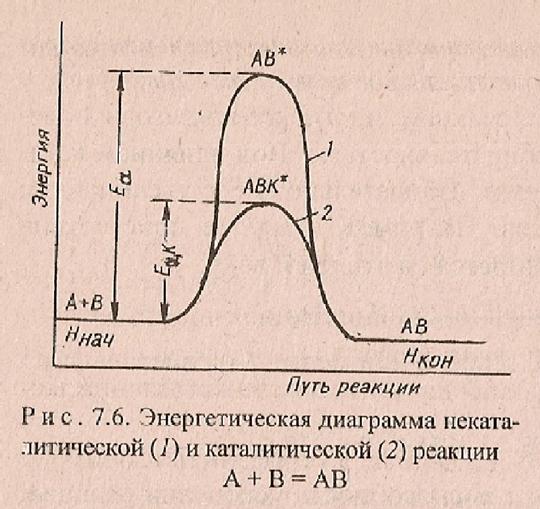
Энергетическая диаграмма некаталитической (1) и каталитической (2) реакции
Пример: H2O2 HI-kt H2O + 1/2O2Более 90% химических промышленных процессов проводят с применением катализаторов → экономия энергии, тепла, ресурсов, направленное получение продуктов.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Задача. Во сколько раз изменится скорость реакции
2СО (г) + О2 (г) ® 2СО2 (г)
При увеличении давления в системе в 10 раз?
Температура системы поддерживается постоянной.
Решение. Предположим, что рассматриваемая реакция является элементарной, т. е. для нее
справедлив закон действующих масс:
υ = k×с2СО×сО2.
Концентрация и парциальное давление связаны прямо пропорциональной зависимостью:
рi = сi×RT,
Поэтому
υ1= k×р2СО×рО2
При увеличении давления в системе в 10 раз парциальное давление каждого из реагентов возрастет тоже в 10 раз, т. е.
υ2 = k×(10рСО)2×10рО2= k×1000р2СО×рО2= 1000 υ1
скорость реакции увеличится в 1000 раз.
Задача. Для реакции А ® В + С
Константа скорости k = 5 . 10 -5 с - 1 .
THORN; n = 1 (по размерности). Определите концентрацию веществ А и В и скорость реакции через 1 час и через 5 часов, если начальная концентрация А составляла с0 (А) = 0,2 моль/л.
Решение. Для реакции 1-го порядка:
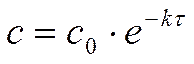
Где с – текущая концентрация вещества А в момент времени τ, с0 – начальная концентрация вещества А, k – константа скорости, τ – время.
через τ = 1 час: с (А) = 0,2 . e - 0,00005 . 3600 =
Моль/л
через τ = 5 час: с (А) = 0,2 . e - 0,00005 . 18000 =
Моль/л
Концентрация вещества В находится по стехиометрическому соотношению веществ А и В. Из уравнения реакции следует, что концентрация вещества В возрастает на ту же величину, на какую убывает концентрация А, т. к. из 1 моль (А) получается 1 моль (В). Поэтому: с (В) = с 0(А) – с(А)
Через τ = 1 час: с (В) = 0,2 – 0,17 = 0,03 моль/л
Через τ = 5 час: с (В) = 0,2 – 0,08 = 0,12 моль/л
Рассчитаем скорость реакции по уравнению:
v = k . c (A)
Через τ = 1 час: v = 5.10 – 5 . 0,17 = 8,5 . 10 – 6 моль/л .с
Через τ = 5 час: v = 5.10 – 5 . 0,08 = 4 . 10 – 6 моль/л .с
Задача. Для реакции 2А ® продукт
константа скорости k = 8,83×10-16 л/(моль×с)
THORN; n = 2 (по размерности). Определите время полупревращения вещества А , если начальная концентрация его составляла с0 = 1 моль/л. Определите время, за которое прореагирует 90% вещества. Определите, как при этом изменится скорость реакции по сравнению с начальной.
Решение. Для реакции 2-го порядка
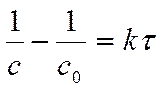
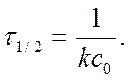
Где с – текущая концентрация вещества А в момент времени τ, с0 – начальная концентрация вещества А, k – константа скорости, τ – время.
Times;10-16. 1) = 1,1×1015 сек
После превращения 90 % вещества А его концентрация составит 10% от начальной концентрации, т. е. с = 0,1с 0 = 0,1 моль/л.
Время 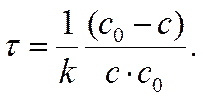
τю = ( с0 – с )/( k . с0 . с) =
Times;10-16. 1. 0,1) = 1×1018 сек.
Для реакции 2-го порядка
v = k . c 2
В нач. момент: v0 = 8,83.10 – 16 . 12 = 8,83. 10 –1 6 моль/л .с
через τ = 1×1018 сек: v = 8,83.10 –16 . 0,12 =
Моль/л .с
Скорость реакции уменьшилась в 100 раз.
▼Задача. Рассчитайте изменение константы скорости реакции, имеющей энергию активации Еа = 131 кДж/моль, при увеличении температуры от
Т1= 330 до Т2= 400 К.
Решение. Зависимость константы скорости реакции от температуры определяется уравнением Аррениуса:
.. 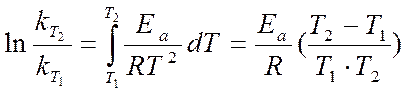
где R = 8,31 Дж/(моль×К) – универсальная газовая постоянная.
Ln ( k2 / k1 ) = 131. 103 . (400 - 330 ) / (8,31. 400 . 330 )@ 8,3
K2 / k1 ) = е 8,3 @ 4000
Константа скорости реакции увеличится в 4000 раз.
– Конец работы –
Используемые теги: Механизмы, химических, процессов, промежуточные, стадии, через, которые, система, переходит, начального, конечное, состояние0.143
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: механизмы химических процессов, т.е. промежуточные стадии, через которые система переходит из начального в конечное состояние
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?


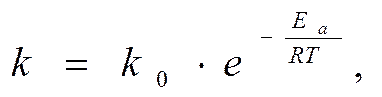





Новости и инфо для студентов