ХИМИЯ
ХИМИЯ - раздел Химия, Министерство Образования И Науки Российской Федерации ...
Министерство образования и науки Российской Федерации
НОВОСИБИРСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
54 № 3635
Х 465
ХИМИЯ
Сборник индивидуальных домашних заданий
для студентов технических специальностей и направлений
дневной формы обучения
НОВОСИБИРСК
2009
УДК 54(07)
Х 465
Составители: В.К. Варенцов, д-р техн. наук, профессор
А.И. Апарнев, канд. хим. наук, доцент
Г.К. Лупенко, канд. хим. наук, доцент
Рецензент Т.П. Александрова, канд. хим. наук, доцент
Работа подготовлена на кафедре химии
ХИМИЯ
Сборник заданий
Редактор Л.Н. Ветчакова Выпускающий редактор И.П. Брованова Компьютерная верстка В.Н. ЗенинаТЕМА 2
Строение вещества ............................................................................................ 7
ТЕМА 3
Основные закономерности протекания химических процессов............ 8
ТЕМА 4
Кинетика химических процессов и химическое равновесие ................. 9
ТЕМА 5
Растворы электролитов .................................................................................... 13
ТЕМА 6
Общие свойства растворов ............................................................................. 16
ТЕМА 7
Комплексные соединения................................................................................. 18
ТЕМА 8
Электрохимические процессы ....................................................................... 20
ЛИТЕРАТУРА ............................................................................................................ 26
ПРИЛОЖЕНИЕ.......................................................................................................... 27
ПРЕДИСЛОВИЕ
Выполнение индивидуальных заданий дает возможность проверить уровень усвоения основных разделов курса химии. Индивидуальная работа осуществляется в основном по учебникам: Коровин Н. В. Общая химия: учебник для вузов / В. Н. Коровин. – М.: Высшая школа, 2005; Глинка Н. Л. Общая химия: [учебное пособие для вузов] / Н. Л. Глинка; под ред. А. И. Ермакова. – М.: Интеграл-Пресс, 2005 и конспектам лекций. Необходимые справочные данные приведены в приложении. Студенту выдается определенное число заданий по темам, номер варианта соответствует номеру в журнале группы. Задания выполняются в письменной форме в отдельной тетради и сдаются преподавателю в сроки, указанные в учебном плане.

Тема 1
Химический эквивалент.
Закон эквивалентов.
Окислительно-восстановительные реакции
Задание 1. Даны массы металла (mМе), его оксида (mо) и сульфида (mс) (см. ваш вариант в табл. 1).
Рассчитайте молярные массы эквивалентов металла, серы, оксида и сульфида металла.
Задание 2. Даны масса двухвалентного металла (mМе) и объем кислорода (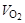 ), затраченного на его окисление при н.у.
), затраченного на его окисление при н.у.
Рассчитайте молярную массу эквивалентов металла, молярную массу металла и назовите металл.
Задание 3. Дана схема реакции (см. табл. 1):
1) определите степень окисления атомов элементов, меняющих ее в процессе реакции;
2) составьте электронный баланс с учетом принципа равенства числа отдаваемых и принимаемых электронов, укажите процессы окисления и восстановления;
3) запишите множители в уравнение окислительно-восстанови-тельной реакции как основные стехиометрические коэффициенты;
4) подберите стехиометрические коэффициенты остальных участников реакции;
5) выпишите формулы вещества – окислителя и восстановителя и рассчитайте их молярные массы эквивалентов.
Таблица 1
| Номер варианта | Задания | |||||
| mМе, г | mо, г | mс, г | mМе, г | 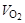 ,
л ,
л
| Схема реакции | |
| 3,24 | 3,44 | 3,67 | 9,93 | 0,81 | KMnO4 + HCl ® MnCl2 + Cl2 + KCl + H2O | |
| 2,0 | 2,15 | 2,30 | 11,9 | 2,04 | HI + H2SO4 ® I2 + SO2 + H2O | |
| 2,5 | 2,68 | 2,87 | 6,91 | CuS + HNO3 ® Cu(NO3)2 + NO2 + H2SO4 + H2O | ||
| 3,0 | 3,22 | 3,44 | 20,2 | 2,58 | K2Cr2O7 + HBr ® CrBr3 + Br2 + KBr + H2O | |
| 3,5 | 3,76 | 4,02 | 3,2 | Mn(NO3)2+PbO2+HNO3 ®HMnO4 + Pb(NO3)2 +H2O | ||
| 4,0 | 4,30 | 4,59 | 5,29 | K2Cr2O7+KI+H2SO4®Cr2(SO4)3 + I2 + K2SO4 + H2O | ||
| 4,5 | 4,83 | 5,17 | 16,12 | KBrO3 + HI ® KBr + I2 + H2O | ||
| 5,0 | 5,37 | 5,74 | 11,18 | HI + H2SO4 ® I2 + H2S + H2O | ||
| 5,5 | 5,91 | 6,31 | 3,67 | MnO2 + HBr ® MnBr2 + Br2 + H2O | ||
| 6,0 | 6,44 | 6,89 | 8,56 | HClO + HCl ® Cl2 + H2O | ||
| 6,5 | 6,98 | 7,46 | 5,48 | KClO3 + HBr ® KCl + Br2 + H2O | ||
| 7,0 | 7,52 | 8,04 | 7,67 | KMnO4 ® K2MnO4 + MnO2 + O2 | ||
| 7,5 | 8,06 | 8,61 | 5,30 | H2SO3 + HNO3 ® H2SO4 + NO + H2O | ||
| 8,0 | 8,59 | 9,18 | 32,26 | CuSO4 + HI ® CuI + H2SO4 +I2 | ||
| 8,5 | 9,13 | 9,76 | 13,22 | HCl + K2Cr2O7 ® Cl2 + CrCl3 + H2O + KCl | ||
| 9,0 | 9,67 | 10,33 | 22,36 | Cr2O3 + KClO3 + KOH ® K2CrO4 + KCl + H2O | ||
| 9,5 | 10,20 | 10,91 | 8,47 | H2SO3 + HClO3 ® H2SO4 + HCl | ||
| 10,0 | 10,74 | 11,49 | 8,97 | FeS + HNO3 ® Fe(NO3)2 + S + NO + H2O | ||
| 10,5 | 11,28 | 12,05 | 43,79 | H2S + Cl2 + H2O ® H2SO4 + HCl | ||
| 11,0 | 11,81 | 12,68 | 27,92 | HNO3 + Zn ® Zn(NO3)2 + N2O + H2O | ||
| 2,7 | 2,85 | 3,07 | 13,42 | K2Cr2O7 + SO2 + HCl ®CrCl3 + KCl + H2SO4 + H2O | ||
| 3,0 | 3,22 | 3,44 | 6,14 | NaIO3 + CO + H2SO4 ® I2 + CO2 + Na2SO4 + H2O | ||
| 4,0 | 4,30 | 4,59 | 5,95 | Ca(NO2)2 + (NH4)2SO4 ® N2 + CaSO4 + H2O | ||
| 5,0 | 5,37 | 5,74 | 55,31 | FeCl2 + HNO3 + HCl ® FeCl3 + NO + H2O | ||
| 6,0 | 6,44 | 6,89 | 15,98 | P2O3 + Cu(NO3)2 ® CuO + NO + P2O5 |
Тема 2
Строение вещества
Задание 1. Для элементов, атомы которых образуют молекулу (см. вариант в табл. 2):
1) напишите электронные формулы, подчеркните валентные электроны и определите семейство;
2) укажите значения квантовых чисел для валентных электронов;
3) распределите валентные электроны по энергетическим ячейкам и определите валентность в основном (невозбужденном) и возбужденном состояниях;
4) объясните связь электронного строения атома элементов с их положением в периодической системе (период, группа, подгруппа);
5) определите степени окисления элементов в молекуле;
6) составьте электронные формулы для атомов элементов с данной степенью окисления и охарактеризуйте их окислительно-восстановительные свойства;
7) охарактеризуйте химические свойства элементов, заполнив следующую таблицу:
| Элемент | Формула оксида | Формула гидроксида | Формула водородного соединения |
| Химический характер |
Тема 3
Основные закономерности протекания
химических процессов
Задание. Дано уравнение реакции (см. ваш вариант в табл. 3).
1. Для всех веществ, участвующих в реакции, выпишите из приложения 1 значения стандартных термодинамических величин 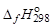 и
и 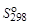 .
.
2. Вычислите изменение энтальпии реакции 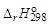 и определите, является ли данная реакция экзо– или эндотермической. Запишите термохимическое уравнение реакции.
и определите, является ли данная реакция экзо– или эндотермической. Запишите термохимическое уравнение реакции.
3. По виду уравнения реакции, не прибегая к расчетам, определите знак изменения энтропии реакции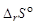 . Вычислив изменение энтропии реакции в стандартных условиях, объясните знак
. Вычислив изменение энтропии реакции в стандартных условиях, объясните знак 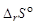 .
.
4. Вычислите энергию Гиббса прямой реакции в стандартных условиях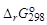 и установите возможность самопроизвольного протекания реакции.
и установите возможность самопроизвольного протекания реакции.
5. Определите температуру, при которой реакция находится в равновесии (Тр).
6. Рассчитайте 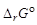 при Т = Тр – 100, Т = Тр + 100.
при Т = Тр – 100, Т = Тр + 100.
7. Постройте график зависимости 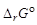 от Т и обозначьте на графике область температур самопроизвольного протекания реакции.
от Т и обозначьте на графике область температур самопроизвольного протекания реакции.
8. Вычислите значения константы равновесия Кc для температур:
Т = Тр, Т = Тр–100, Т = Тр + 100. Cделайте вывод о влиянии температуры на величину Кc и на смещение химического равновесия.
Таблица 2
| Номер варианта | Формула вещества | Номер варианта | Формула вещества | Номер варианта | Формула вещества |
| BF3 | AlCl3 | PH3 | |||
| PbCl4 | GaCl3 | BeCl2 | |||
| H2Se | SnCl4 | СО2 | |||
| SiCl4 | CaH2 | SnCl2 | |||
| PI3 | SbBr3 | PI3 | |||
| AsCl3 | HgCl2 | AsF5 | |||
| SbH3 | H2O | CdF2 | |||
| BeF2 | BI3 | ||||
| PbCl2 | CH4 |
Тема 4
Кинетика химических процессов
и химическое равновесие
Задание 1. Дано уравнение реакции (см. ваш вариант в табл. 3).
1. Запишите кинетические уравнения скоростей прямой 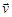 и обратной
и обратной 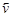 реакций. Гомо– или гетерогенной является данная реакция?
реакций. Гомо– или гетерогенной является данная реакция?
2. Рассчитайте скорость прямой реакции 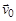 в начальный момент времени (при С0). Как изменится скорость прямой реакции к моменту времени
в начальный момент времени (при С0). Как изменится скорость прямой реакции к моменту времени 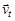 , когда прореагирует 20 % вещества В?
, когда прореагирует 20 % вещества В?
3. Рассчитайте увеличение скорости прямой реакции 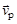 при одновременном повышении давления в системе в 2 раза и температуры
при одновременном повышении давления в системе в 2 раза и температуры 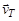 на 20 °С при g = 2.
на 20 °С при g = 2.
Задание 2. Даны уравнение реакции и исходные концентрации веществ (см. вариант табл. 3).
1. Запишите выражение для константы равновесия химической реакции через концентрации Кс.
2. Рассчитайте равновесные концентрации всех веществ к моменту времени, когда прореагирует 30% вещества В и вычислите константу равновесия.
3. Укажите направление смещения равновесия при изменении каждого из факторов (С, Р, V или Т).
Задание 3. Используя вещество с молярной массой М =
= 100 г/моль, было приготовлено пять растворов с различной концентрацией С0 (см. вариант в табл. 4).
1. Рассчитайте массу вещества, адсорбированного из 100 мл каждого раствора адсорбентом (m, г), если равновесные концентрации [C1] =
= 0,002, [C2] = 0,01, [C3] = 0,04, [C4] = 0,16, [C1] = 0,63 моль/л. Вычислите величину адсорбции (Г).
2. Постройте график зависимости величины адсорбции (Г) от равновесной концентрации в натуральной и логарифмической системе координат и вычислите константы уравнения Фрейндлиха.
 Таблица 3
Таблица 3
| Номер вари- анта | 1, 2, 3 | Изменение внешних условий | |||||
| аА + bВ ó cC + dD | C0(А), моль/л | C0(В), моль/л | Сисх | Р | V | Т | |
| CН4(г) + 2 Н2О(г) ó CO2(г) + 4 Н2(г) | ↑ | ↓ | ↓ | ↓ | |||
| СS2(г) + 4 Н2(г) ó CH4(г) + 2 Н2S(г) | ↑ | ↑ | ↑ | ↓ | |||
| SO2(г) + 3 F2(г) ó SF6(г) + О2(г) | ↓ | ↓ | ↑ | ↑ | |||
| 2 BCl3(г) + 3 Н2(г) ó 2 В(т) + 6 HCl(г) | ↑ | ↑ | ↓ | ↓ | |||
| 2 AsCl3(г) + 3 Н2(г) ó 2 As(г) + 6 HCl(г) | ↑ | ↑ | ↓ | ↓ | |||
| 2 Н2S(г) + 3 O2(г) ó2 SO2(г) + 2 Н2О(ж) | ↓ | ↓ | ↑ | ↑ | |||
| 2 NO(г) + 2 H2S(г) ó N2(г) + 2 H2O(г) + 2S(т) | ↑ | ↑ | ↓ | ↓ | |||
| СО(г) + 3 Н2(г) ó СН4(г) + Н2О(г) | ↓ | ↓ | ↑ | ↑ | |||
| 2 NO2(г) + F2(г) ó 2 (NO2)F(г) | ↓ | ↓ | ↑ | ↑ | |||
| 4 HCl(г) + O2(г) ó 2 Н2О(г) + 2 Сl2(г) | ↑ | ↑ | ↓ | ↓ | |||
| 2 CО(г) + SО2(г) ó 2 CО2(г) + S(т) | ↓ | ↓ | ↑ | ↑ |
Окончание табл. 3
 Номер вари- анта Номер вари- анта
| 1, 2, 3 | Изменение внешних условий | |||||
| аА + bВ ó cC + dD | C0(А), моль/л | C0(В), моль/л | Сисх | Р | V | Т | |
| 2 NO(г) + 2 Н2(г) = N2(г) + Н2О(ж) | ↑ | ↑ | ↓ | ↓ | |||
| 2 NO(г) + 2 SO2(г) ó N2(г) + 2 SO3(г) | ↑ | ↑ | ↑ | ↑ | |||
| 2 PF3(г) + О2(г) ó 2 POF3(г) | ↓ | ↓ | ↑ | ↑ | |||
| 2 H2S(г) + SO2(г) ó 3 S(т) + 2 H2O(ж) | ↓ | ↓ | ↓ | ↓ | |||
| 2 PCl3(г) + O2(г) ó 2 PCl3O(г) | ↑ | ↑ | ↑ | ↑ | |||
| SiCl4(г) + 2 Н2(г) ó Si(т) + 4 HCl(г) | 0,5 | ↓ | ↓ | ↓ | ↓ | ||
| 2 NO(г) + Cl2(г) ó 2 NOCl(г) | ↑ | ↑ | ↑ | ↓ | |||
| 2 СО(г) + 2 Н2(г) ó СН4(г) + СО2(г) | ↓ | ↑ | ↑ | ↓ | |||
| CCl4(г) + 2 Н2(г) ó CН4(г) + 2 Cl2(г) | ↑ | ↓ | ↑ | ↑ | |||
| СO2(г) + 2 NH3(г) ó СО(NH2)2(т) + H2O(г) | 1,5 | ↑ | ↓ | ↓ | ↑ | ||
| 2 NO2(г) + O3(г) ó N2O5(г) + O2(г) | ↓ | ↑ | ↓ | ↑ | |||
| CS2(г) + 2 Сl2(г) = CCl4(г) + 2 S(т) | 1,5 | ↑ | ↓ | ↑ | ↑ | ||
| SiH4(г) + 2 O2(г) = 2 H2O(г) + SiO2(т) | 0,5 | ↑ | ↑ | ↓ | ↑ | ||
| 2 СН4(г) = С2Н2(г) + 3 H2(г) | – | ↓ | ↑ | ↑ | ↓ |


Таблица 4
| Номер варианта | m, г | C0, моль/л | ||||
| 0,9 | 0,010 | 0,023 | 0,065 | 0,200 | 0,698 | |
| 0,6 | 0,005 | 0,015 | 0,050 | 0,180 | 0,670 | |
| 2,0 | 0,030 | 0,045 | 0,084 | 0,212 | 0,695 | |
| 0,9 | 0,012 | 0,024 | 0,060 | 0,186 | 0,665 | |
| 0,4 | 0,004 | 0,014 | 0,047 | 0,173 | 0,662 | |
| 0,18 | 0,008 | 0,018 | 0,050 | 0,172 | 0,645 | |
| 0,4 | 0,003 | 0,013 | 0,046 | 0,173 | 0,654 | |
| 0,7 | 0,005 | 0,014 | 0,045 | 0,168 | 0,637 | |
| 0,6 | 0,010 | 0,021 | 0,054 | 0,180 | 0,655 | |
| 0,5 | 0,005 | 0,015 | 0,047 | 0,167 | 0,645 | |
| 0,6 | 0,007 | 0,016 | 0,047 | 0,168 | 0,639 | |
| 0,5 | 0,008 | 0,017 | 0,048 | 0,169 | 0,642 | |
| 0,7 | 0,005 | 0,014 | 0,045 | 0,167 | 0,639 | |
| 0,95 | 0,011 | 0,025 | 0,067 | 0,204 | 0,705 | |
| 0,65 | 0,005 | 0,016 | 0,052 | 0,182 | 0,674 | |
| 2,8 | 0,033 | 0,048 | 0,088 | 0,217 | 0,702 | |
| 0,95 | 0,013 | 0,026 | 0,062 | 0,189 | 0,678 | |
| 0,75 | 0,011 | 0,030 | 0,079 | 0,242 | 0,806 | |
| 0,85 | 0,009 | 0,019 | 0,051 | 0,173 | 0,646 | |
| 0,6 | 0,008 | 0,018 | 0,055 | 0,190 | 0,695 | |
| 0,18 | 0,008 | 0,018 | 0,050 | 0,172 | 0,645 | |
| 0,9 | 0,012 | 0,024 | 0,060 | 0,186 | 0,665 | |
| 0,4 | 0,004 | 0,014 | 0,047 | 0,173 | 0,662 | |
| 0,5 | 0,005 | 0,015 | 0,047 | 0,167 | 0,645 | |
| 0,6 | 0,007 | 0,016 | 0,047 | 0,168 | 0,639 |
Тема 5
РАСТВОРЫ ЭЛЕКТРОЛИТОВ
Задание 1. Имеется раствор вещества данной концентрации и плотности (см. вариант в табл. 5).
Определите молярную концентрацию вещества (С), молярную концентрацию эквивалентов вещества (Сэк) и массовую долю растворенного вещества (ω, %) в растворе.
Таблица 5
| Номер варианта | Вещество | ρ, г/мл | Концентрация | ||
| Сэк, моль/л | ω, % | С, моль/л | |||
| AlCl3 | 1,016 | ||||
| AgNO3 | 1,194 | 1,4 | |||
| CaСl2 | 1,032 | ||||
| Cu(NO3)2 | 1,036 | 0,22 | |||
| Fe2(SO4)3 | 1,181 | ||||
| MnCl2 | 1,068 | ||||
| Zn(NO3)2 | 1,067 | 0,9 | |||
| NiSO4 | 1,21 | 2,8 | |||
| ZnSO4 | 1,084 | 1,3 | |||
| Na2Cr2O7 | 1,041 | ||||
| (NH4)2SO4 | 1,115 | ||||
| Al2(SO4)3 | 1,105 | 1,3 | |||
| Na2CO3 | 1,05 | ||||
| K2SO4 | 1,056 | ||||
| H3PO4 | 1,150 | 3,0 | |||
| Co(NO3)2 | 1,015 | 0,11 | |||
| Mg(NO3)2 | 1,044 | ||||
| Na2CrO4 | 1,216 | ||||
| Ba(NO3)2 | 1,015 | 0,5 | |||
| FeCl3 | 1,032 |
Окончание табл. 5
| Номер варианта | Вещество | ρ, г/мл | Концентрация | ||
| Сэк, моль/л | ω, % | С, моль/л | |||
| MnSO4 | 1,059 | ||||
| NaHCO3 | 1,013 | ||||
| ZnCl2 | 1,035 | 0,6 | |||
| MgSO4 | 1,27 | 2,54 | |||
| CoSO4 | 1,08 |
Задание 2. Имеется раствор слабого электролита (см. вариант в табл. 6).
1. Запишите уравнения диссоциации и выражения для констант диссоциации (Кд) по всем возможным ступеням, укажите величины Кд (см. приложение 3).
2. Рассчитайте степень диссоциации слабого электролита, концентрацию ионов H+ в растворе и рН данного раствора с заданной концентрацией электролита.
Задание 3. Определите рН насыщенного раствора гидроксида (см. вариант в табл. 6), используя значение произведения растворимости (см. приложение 4). Рассчитайте растворимость (в моль/л и г/л) данного гидроксида в одном литре воды.
Задание 4. Имеется раствор соли (см. вариант в табл. 6).
1. Напишите ионно-молекулярное и молекулярное уравнения реакции гидролиза и выражение для константы гидролиза по 1-й ступени (Кг1).
2. Рассчитайте степень гидролиза (aг) и рН раствора соли с заданной концентрацией, учитывая только 1-ю ступень гидролиза.
3. Какой цвет будет иметь индикатор метиловый оранжевый или фенолфталеин в растворе данной соли?
4. Как изменятся рН раствора соли и окраска индикатора при нагревании и почему?
Таблица 6
| Номер варианта | Задание 2 | Задание 3 | Задание 4 | ||
| Вещество | С, моль/л | Вещество | Вещество | С, моль/л | |
| HCN | 0,01 | Mg(OH)2 | Са3(VO4)2 | 0,01 | |
| НNO2 | 0,05 | Fe(OH)2 | Al(NO3)3 | 0,02 | |
| HOCl | 0,01 | Be(OH)2 | CrCl3 | 0,03 | |
| H2GeO3 | 0,02 | Ba(OH)2 | Ba(NO2)2 | 0,04 | |
| HF | 0,1 | Ca(OH)2 | CoCl2 | 0,05 | |
| HOBr | 0,05 | Cd(OH)2 | K2TeO4 | 0,02 | |
| HOI | 0,1 | Co(OH)2 | K2CO3 | 0,1 | |
| Н2ТеО3 | 0,5 | Cr(OH)2 | Na2C2O4 | 0,02 | |
| H2С2O4 | 0,05 | Cu(OH)2 | FeCl2 | 0,04 | |
| H2SeO3 | 0,02 | Ni(OH)2 | Na2TeO4 | 0,01 | |
| Н2ТеО3 | 0,01 | Pb(OH)2 | NiSO4 | 0,05 | |
| HOCl | 0,05 | Sc(OH)3 | Na2Te | 0,01 | |
| H3BO3 | 0,01 | Mn(OH)2 | K2SiO3 | 0,01 | |
| H2S | 0,05 | Sr(OH)2 | Li2TeO4 | 0,02 | |
| H2Se | 0,02 | La(OH)3 | Na3AsO4 | 0,05 | |
| H2SO3 | 0,01 | Sn(OH)2 | K2GeO3 | 0,01 | |
| НNO2 | 0,02 | Fe(OH)2 | Cr(NO3)3 | 0,02 | |
| H2TeO4 | 0,01 | Mg(OH)2 | FeSO4 | 0,1 | |
| HCN | 0,02 | Be(OH)2 | SnCl2 | 0,02 | |
| НNO2 | 0,1 | Ba(OH)2 | Na3PO3 | 0,01 | |
| H2SiO3 | 0,05 | Ca(OH)2 | K2TeO3 | 0,1 | |
| H2S | 0,02 | Sc(OH)3 | Na2SeO3 | 0,05 | |
| H2Se | 0,05 | Zn(OH)2 | CrCl2 | 0,02 | |
| H3AsO4 | 0,02 | Nd(OH)3 | MnSO4 | 0,05 | |
| HCOOH | 0,01 | Y(OH)3 | Na3AsO4 | 0,02 |
Тема 6
ОБЩИЕ СВОЙСТВА РАСТВОРОВ
Задание. Рассчитайте температуру кипения и замерзания раствора, состав которого представлен в табл. 7.
Температуры кипения, замерзания, криоскопическая и эбуллиоскопическая постоянные чистых растворителей приведены в приложении 4.
Таблица 7
| Номер вари-анта | Растворитель | Растворенное вещество | ||
| Вещество | Масса, г | Вещество | Масса, г | |
| Этанол С2Н5ОН | Сахароза С12Н22О11 | |||
| Вода Н2О | Мочевина (NH2)2СО | |||
| Уксусная кислота СН3СООН | Антрацен С14Н10 | 4,25 | ||
| Хлороформ СНCl3 | Пропеновая кислота С3Н4О2 | 7,2 | ||
| Этанол С2Н5ОН | Антраниловая кислота NH2C6H4COOH | 3,0 | ||
| Бензол С6Н6 | Камфора С10Н16О | 7,55 | ||
| Хлороформ СНCl3 | Нафталин С10Н8 | 2,1 | ||
| Вода Н2О | Глицерин С3Н5(ОН)3 | |||
| Этанол С2Н5ОН | Салициловая кислота С7Н6О3 | 11,4 | ||
| Сероуглерод СS2 | Бензойная кислота С6Н5СООН | 6,5 | ||
| Вода Н2О | Этиленгликоль (СН2)2(ОН)2 | |||
| Циклогексан С6Н12 | Пиррол С4Н5N | 2,5 |
Окончание табл. 7
| Номер вари-анта | Растворитель | Растворенное вещество | ||
| Вещество | Масса, г | Вещество | Масса, г | |
| Бензол С6Н6 | Cера S | 11,6 | ||
| Диэтиловый эфир (С2Н5)2О | Анилин C6H5NH2 | 3,5 | ||
| Вода Н2О | Глюкоза С6Н12О6 | |||
| Бензол С6Н6 | Фенол С6Н6О | 1,75 | ||
| Вода Н2О | Метанол СН3ОН | |||
| Вода Н2О | Сахароза С12Н22О11 | |||
| Бензол С6Н6 | Трихлоруксусная кислота ССl3СООН | 3,27 | ||
| Уксусная кислота СН3СООН | Ацетон (СН3)2СО | 1,05 | ||
| Ацетон (СН3)2СО | Глицерин С3Н5(ОН)3 | 9,2 | ||
| Вода Н2О | Глюкоза С6Н12О6 | 4,84 | ||
| Четыреххлористый углерод CCl4 | Аспирин С9Н8О4 | 1,0 | ||
| Уксусная кислота СН3СООН | Антрацен С14Н10 | 2,5 | ||
| Вода Н2О | Мочевина (NH2)2СО |
Тема 7
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Задание 1. Дано комплексное соединение (см. вариант в табл. 8).
1. Укажите: а) внутреннюю и внешнюю сферы, их заряды;
б) комплексообразователь, его координационное число и заряд; в) лиганды и их заряд.
2. Для иона комплексообразователя напишите электронную формулу.
3. Напишите уравнения диссоциации комплексного соединения в водном растворе и выражение константы нестойкости комплексного иона.
Таблица 8
| Номер варианта | Вещество | Номер варианта | Вещество |
| [Cr(NH3)2(H2O)4]Cl3 | [Co(NH3)5Br]SO4 | ||
| K2[Pt(NH3)2(NO2)4] | [Pt(NH3)3Cl]Cl | ||
| Na[Co(NO2)4(NH3)2] | Mg[Be(OH)F3] | ||
| K2[Pt(OH)3Cl] | [Fe(NH3)5Cl]SO4 | ||
| Na[Pt(NH3)Cl3] | Na2[Sb(H2O)Cl5] | ||
| [Ni(NH3)6]Br2 | [Zn(NH3)3H2O](NO3)2 | ||
| [Hg(NH3)4](NO3)2 | K4[Ni(CN)4Cl2] | ||
| Na[Co(NH3)2(CN)4] | Na[Co(CN)4(H2O)2] | ||
| (NH4)2[Ni(CN)4] | Ba[Cu(CN)2Cl2] | ||
| Ва[Fe(CN)5(H2O)] | [Sn(OH)2(H2O)4]Cl2 | ||
| [Co(NH3)4SO4]NO3 | K2[Cd(CN)2SO4] | ||
| (NH4)2[Pt(OH)2Cl4] | Ca2[Fe(CN)4(OH)2] | ||
| Ba[Cr(NH3)2Cl4] |
Задание 2. Дано комплексное соединение (см. вариант в табл. 9).
1. Запишите первичную и вторичную диссоциацию комплексного соединения в водном растворе, выражение константы нестойкости комплексного иона и ее численное значение (см. приложение 5).
2. Вычислите концентрации ионов комплексообразователя, лигандов и ионов внешней сферы в растворе комплексной соли с заданной концентрацией (С).
Численные значения констант нестойкости комплексных ионов приведены в приложении 5.
Таблица 9
| Номер варианта | Вещество | С, моль/л | Номер варианта | Вещество | С, моль/л |
| K2[HgI4] | 0,03 | (NH4)2[Ni(CN)4] | 0,02 | ||
| [Cd(NH3)4]SO4 | 0,02 | K2[Zn(CN)4] | 0,2 | ||
| K2[Cu(OH)4] | 0,05 | [Zn(NH3)4]SO4 | 0,01 | ||
| K3[AgI4] | 0,01 | K2[Cu(CN)4] | 0,1 | ||
| K2[Be(OH)4] | 0,1 | Na[AuCl4] | 0,01 | ||
| Na2[HgBr4] | 0,01 | [Hg(NH3)4](NO3)2 | 0,5 | ||
| Na2[PtCl4] | 0,01 | [Cu(NH3)2]Cl | 0,02 | ||
| K[Sb(OH)4] | 0,1 | Na[Ag(NO2)2] | 0,01 | ||
| K2[Cu(CNS)4] | 0,5 | K2[CdI4] | 0,3 | ||
| Na2[Hg(NO2)4] | 0,02 | K2[BeF4] | 0,1 | ||
| Na[In(OH)4] | 0,01 | (NH4)3[Ag(SCN)4] | 0,03 | ||
| K2[PtBr4] | 0,1 | (NH4)2[PdBr4] | 0,05 | ||
| Na2[Cd(CN)4] | 0,05 |
Тема 8
ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
Гальванический элемент
Задание 1. Дан электрод (см. вариант в табл. 10).
1. Запишите схему двух гальванических элементов, в которых заданный электрод будет: в одном случае – анодом, в другом – катодом. В одном из случаев в качестве второго электрода используйте газовый водородный электрод.
2. Для каждого гальванического элемента запишите электрохимическую систему (гальванический элемент), уравнения электродных реакций, суммарной реакции, определяющих работу этого элемента.
3. Рассчитайте равновесное напряжение гальванического элемента, составленного из заданного электрода и водородного электрода с заданным рН раствора и парциальным давлением водорода.
Задание 2. Гальванический элемент составлен из электродов (см. вариант в табл. 11).
1. Подберите электролиты и запишите электрохимическую систему (гальванический элемент).
2. Запишите уравнения электродных реакций и суммарной реакции, определяющие работу гальванического элемента.
3. Рассчитайте равновесное напряжение гальванического элемента, составленного из указанных электродов с учетом активности потенциалопределяющих ионов (а).
4. Рассчитайте энергию Гиббса, используя равновесное напряжение гальванического элемента.
Стандартные электродные потенциалы электродов приведены в приложении 6.
П р и м е р 3. Составьте схему гальванического элемента, в котором электродами являются магниевая и цинковая
пластинки, опущенные в растворы их ионов с активной концентрацией 1 моль / л. Какой металл является анодом, какой
катодом? Напишите уравнение окислительно-восстановительной реакции, протекающей в этом гальваническом элементе,
и вычислите его ЭДС.
Р е ш е н и е. Схема данного гальванического элемента
(–)Mg | Mg2+ || Zn2+ | Zn(+).
Вертикальная линия обозначает поверхность раздела между металлом и раствором, а две линии – границу раздела
двух жидких фаз – пористую перегородку (или соединительную трубку, заполненную раствором электролита). Магний
имеет меньший потенциал (– 2,37 В) и является анодом, на котором протекает окислительный процесс:
Мg° – 2e = Mg2+.
¯ (1)
Цинк, потенциал которого – 0,763 В, – катод, т.е. электрод, на котором протекает восстановительный процесс:
Zn2+ + 2e = Zn°.
¯ (2)
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента,
можно получить, сложив электронные уравнения анодного (1) и катодного (2) процессов:
Мg + Zn2+ = Mg2+ + Zn.
Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода. Так как
концентрация ионов в растворе равна 1 моль / л, то ЭДС элемента равна разности стандартных потенциалов двух его элек-
тродов:
Е = ϕ°(Zn2+ / Zn) – ϕ°(Mg2+ / Mg) = – 0,763 – (– 2,37) = 1,607 B.
Таблица 10
| Номер вари-анта | Электрод | рН раствора | 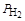 ,
мм рт. cт. ,
мм рт. cт.
|
| W|W3+ | 0,1 | ||
| Ag|Ag+ | 0,4 | ||
| Cu|Cu2+ | 0,5 | ||
| Pd|Pd2+ | 0,3 | ||
| Ni|Ni2+ | 0,7 | ||
| Co|Co2+ | 0,4 | ||
| Ag|AgCl,KCl | 0,8 | ||
| Fe|Fe2+ | 1,5 | ||
| Bi|Bi3+ | 0,2 | ||
| Pb|Pb2+ | 0,5 | ||
| Sn|Sn2+ | 1,2 | ||
| Ti|Ti3+ | 0,9 | ||
| Cr|Cr3+ | 0,4 | ||
| In|In3+ | 0,2 | ||
| Mn|Mn2+ | 1,3 | ||
| Tl|Tl+ | 0,5 | ||
| Pt|Pt2+ | 0,6 | ||
| Cu|Cu+ | 0,7 | ||
| Mo|Mo3+ | 0,4 | ||
| (Pt)Cl2|Cl- | 0,8 | ||
| Ti|Ti2+ | 1,1 | ||
| Zn|Zn2+ | 0,7 | ||
| Cd|Cd2+ | 0,5 | ||
| Mg|Mg2+ | 1,2 | ||
| Sb|Sb3+ | 0,8 |
Таблица 11
| Номер варианта | Электрод I | Электрод II | Активность потенциалопределяющих ионов а, моль/л | |
| электрода I | электрода II | |||
| Ag|AgCl,KCl | Ag|Ag+ | 0,1 | 0,02 | |
| Mo|Mo3+ | Zn|Zn2+ | 0,2 | 0,8 | |
| (Pt)F2|F- | Cd|Cd2+ | 0,3 | 0,5 | |
| Mo|Mo3+ | (Pt)Cl2|Cl- | 0,4 | 2,0 | |
| Au| Au+ | Sn|Sn2+ | 0,05 | 1,5 | |
| Ag|Ag+ | Zn|Zn2+ | 0,1 | 1,7 | |
| Cu|Cu+ | Ti|Ti3+ | 0,6 | 0,3 | |
| Pt|Pt2+ | Sn|Sn2+ | 0,03 | 1,2 | |
| Bi|Bi3+ | Bi|Bi3+ | 0,05 | 1,3 | |
| Mg|Mg2+ | In|In3+ | 1,6 | 0,2 | |
| Pb|Pb2+ | Ti|Ti2+ | 0,3 | 0,5 | |
| Cu|Cu2+ | Cr|Cr3+ | 0,8 | 0,2 | |
| Au|Au3+ | Sb|Sb3+ | 0,03 | 0,4 | |
| Pd|Pd2+ | Ag|AgCl,KCl | 0,01 | 1,0 | |
| Fe|Fe2+ | Sb|Sb3+ | 0,8 | 0,2 | |
| In|In3+ | (Pt)Cl2|Cl- | 0,2 | 1,7 | |
| Ti|Ti3+ | (Pt)F2|F- | 0,5 | 0,8 | |
| Mn|Mn2+ | Zn|Zn2+ | 0,8 | 0,5 | |
| Cr|Cr3+ | Ag|AgCl,KCl | 0,7 | 0,1 | |
| Cd|Cd2+ | Pd|Pd2+ | 0,5 | 0,04 | |
| Cu|Cu2+ | Cu|Cu2+ | 2,1 | 0,1 | |
| V|V2+ | Sn|Sn2+ | 1,4 | 0,3 | |
| (Pt)Cl2|Cl- | Cu|Cu2+ | 1,5 | 0,5 | |
| (Pt)O2|OH- | (Pt)H2|H+ | 0,5 | 1,3 | |
| Pd|Pd2+ | Co|Co2+ | 0,03 | 0,9 |
Электролиз водных растворов электролитов
Задание3. Дан водный раствор электролита (см. вариант в табл. 12), для его электролиза используйте приведенный в таблице анод.
1. Запишите электрохимическую систему, уравнения электродных реакций.
2. Укажите рН раствора до электролиза (больше, меньше или равно 7). Если в процессе электролиза меняется рН раствора у электродов, укажите, в какую сторону.
3. Рассчитайте массу или объем (для газа) веществ, выделившихся на электродах при электролизе. Катодный выход металла по току равен 80 %, если на электроде протекает две реакции. Если на катоде выделяется только один металл или один газ, выход по току процесса равен 100 %. Анодный выход по току равен 100 % во всех случаях.
Таблица 12
| Номер варианта | Раствор электролита | Ток, А | Время, ч | Количество прошедшего электричества, А·ч | Материал анода |
| AuCl3 | Au | ||||
| AgNO3 | Ag | ||||
| NiSO4 | Ni | ||||
| Zn(NO3)2 | Zn | ||||
| Cr(NO3)3 | C | ||||
| CuSO4 | Cu | ||||
| Bi(NO3)3 | 0,5 | Bi | |||
| Pb(NO3)3 | Pb | ||||
| FeCl3 | Fe | ||||
| CoSO4 | 0,8 | Co | |||
| Pd(NO3)2 | 0,5 | Pt | |||
| NaCl | C | ||||
| K2SO4 | Pt | ||||
| AuCl | C |
Окончание табл. 12
| Номер варианта | Раствор электролита | Ток, А | Время, ч | Количество прошедшего электричества, А·ч | Материал анода |
| AgNO3 | Pt | ||||
| BaCl2 | C | ||||
| SbCl3 | Sb | ||||
| Li2SO4 | C | ||||
| MnCl2 | C | ||||
| Al2(SO4)3 | Pt | ||||
| SnCl2 | Sn | ||||
| CuCl | C | ||||
| NiSO4 | C | ||||
| Hg(NO3)2 | Hg | ||||
| FeSO4 | C |
Коррозия металлов
Задание 4. Даны пара металлов и значения рН водной среды (см. вариант в табл. 13).
1. Оцените возможность коррозии металла в данной электрохимической системе на основании сравнения рассчитанных равновесных потенциалов электродов: водородного, кислородного и данных металлов (равновесные потенциалы металлических электродов принимаем равными их стандартному значению). Запишите коррозионную электрохимическую систему, уравнения электродных реакций при коррозии.
2. Предложите для данной пары металлов при заданном значении рН катодное и анодное металлическое покрытие.
3. Запишите электрохимическую схему элементов, образующихся при нарушении целостности покрытия, уравнения электродных реакций при коррозии для этих элементов.
4. Предложите протекторную защиту для данной пары металлов. Запишите электрохимическую систему, уравнения электродных реакций при протекторной защите.
5. Запишите электрохимическую систему электрозащиты (катодной) данной пары металлов, уравнения электродных реакций при работе электрозащиты.
Таблица 13
| Номер варианта | Металлы | рН | |
| Cu-Cr | |||
| Cu-Fe | |||
| Cu-Ni | |||
| Fe-Ni | |||
| Fe-Cr | |||
| Fe-Cd | |||
| Fe-Co | |||
| Cu-Ag | |||
| Cu-Sn | |||
| Cu-Pd | |||
| Ni-Cr | |||
| Fe-Zn | |||
| Fe-Pb | |||
| Cu-Pb | |||
| Fe-In | |||
| Ag-Ni | |||
| Ti-Cu | |||
| Ti-Ni | |||
| Ni-Au | |||
| Al-Zn | |||
| Al-Cd | |||
| Al-Ni | |||
| Al-Ag | |||
| Mg-Cu | |||
| Mg-Ni |
СПИСОК ЛитературЫ
1. Коровин Н. В. Общая химия: учебник для вузов по техническим направлениям и специальностям / Н. В. Коровин.– Изд. 10-е, доп.– М.: Высшая школа, 2008.
2. Химия: [учебник для вузов по техническим направлениям и специальностям] / А. А. Гуров [и др.].– Изд. 3-е, испр.– М.: Изд-во МГТУ им. Н. Э. Баумана, 2007.
3. Н. Л. Глинка. Химия / под ред. А. И. Ермакова. – М.: Интеграл-Пресс, 2005.
4. Глинка Н. Л. Задачи и упражнения по общей химии: [учебное пособие для нехимических специальностей вузов] / Н. Л. Глинка; под ред. В. А. Рабиновича, Х. М. Рубиной.– Изд. стереотип.– М.: Интеграл-Пресс, 2008.
5. Задачи и упражнения по общей химии: учеб. пособие; под ред. Н.В. Коровина. – М.: Высшая школа, 2004.
6. Зайцев О.С. Химия. Современный краткий курс. – М.: Изд-во НЦ ЭНАС, 2001.
7. Суворов А.В., Никольский А.Б. Вопросы и упражнения по общей химии. – СПб: Химиздат, 2002.

приложения
П р и л о ж е н и е 1
Термодинамические характеристики некоторых веществ при 298 К
П р о д о л ж е н и е т а б л. П1 Вещество Df H°, кДж/моль S°, …О к о н ч а н и е т а б л. П1
П р и л о ж е н и е 2
Кислота Название и формула Кд Название и формула Кд Азотистая HNO2 …Окончание табл. П2
| Основание | |||||
| Название и формула | Кд | Название и формула | Кд | ||
| Иодноватистая HOI | 2,3×10–11 | Фосфористая H3PO3 | К1 К2 | 1,6×10–2 2×10–7 | |
| Кремневая-мета H2SiO3 | К1 К2 | 2,2×10–10 1,6×10–12 | Фосфорная H3PO4 | К1 К2 К3 | 7,1×10–3 6,2×10–8 4,2×10–13 |
| Мышьяковая H3AsO4 | К1 К2 К3 | 5,6×10–3 1,7×10–7 3×10–12 | Хлорноватистая HClO | 5×10–8 | |
| Муравьиная НСООН | 1,8×10–4 | Хромовая H2CrO4 | К1 К2 | 1,1×10–1 3,2×10–7 | |
| Аммония гидроксид NH4ОН | 1,8×10–5 | Меди (II) гидроксид Cu(OH)2 | К2 | 3,4×10–7 | |
| Бария гидроксид Ва(ОН)2 | К2 | 2,3×10–1 | Никеля (II) гидроксид Ni(OH)2 | К2 | 8,32×10–4 |
| Железа (II) гидроксид Fe(OH)2 | К1 К2 | 1,2×10–2 1,3×10–4 | Олова (II) гидроксид Sn(ОН)2 | К2 | 10–12 |
| Железа (III) гидроксид Fe(OH)3 | К2 К3 | 1,82×10–11 1,35×10–12 | Ртути (II) гидроксид Hg(OH)2 | К1 К2 | 4×10–12 5×10–11 |
| Кадмия гидроксид Cd(OH)2 | К1 К2 | 8,1×10–4 4,2×10–7 | Свинца (II) гидроксид Pb(OH)2 | К1 К2 | 5×10–4 1,4×10–8 |
| Кобальта (II) гидроксид Со(ОН)2 | К1 К2 | 7,9×10–5 8,9×10–6 | Хрома (II) гидроксид Cr(OH)2 | К2 | 4×10–8 |
| Кальция гидроксид Са(ОН)2 | К2 | 5,8×10–2 | Хрома (III) гидроксид Cr(OH)3 | К3 | ~10–10 |
| Магния гидроксид Mg(OH)2 | К2 | 2,63×10–3 | Цинка гидроксид Zn(OH)2 | К1 К2 | 1,32×10–5 2,0×10–9 |
П р и л о ж е н и е 3
Произведение растворимости ПР некоторых малорастворимых электролитов при 298 К Вещество ПР Вещество ПР …П р и л о ж е н и е 4
Температуры кипения Ткип, замерзания Тзам, криоскопическая Ккр и эбуллиоскопическая Кэб постоянные некоторых чистых растворителей …П р и л о ж е н и е 5
Формула иона Кнест Формула иона Кнест Формула иона Кнест Аммиакаты Цианидные…П р и л о ж е н и е 6
Стандартные электродные потенциалы
Электродов Е 0 при 298 К
Окончание табл.П6
| Электрод | Электродная реакция | Е0, В |
| Sn2+|Sn | Sn2+ + 2e ó Sn | –0,136 |
| Pb2+|Pb | Pb2+ + 2e ó Pb | –0,126 |
| W3+|W | W3+ + 3e ó W | –0,05 |
| Fe3+|Fe | Fe3+ + 3e ó Fe | –0,036 |
| Sn4+|Sn | Sn4+ + 4e ó Sn | +0,007 |
| Ge2+|Ge | Ge2+ + 2e ó Ge | +0,01 |
| Sb3+|Sb | Sb3+ + 3e ó Sb | +0,2 |
| Bi3+|Bi | Bi3+ + 3e ó Bi | +0,215 |
| Cu2+|Cu | Cu2+ + 2e ó Cu | +0,337 |
| Cu+|Cu | Cu+ + e ó Cu | +0,521 |
| Ag+|Ag | Ag+ + e ó Ag | +0,8 |
| Os2+|Os | Os2+ + 2e ó Os | +0,85 |
| Hg2+|Hg | Hg2+ + 2e ó Hg | +0,854 |
| Pd2+|Pd | Pd2+ + 2e ó Pd | +0,987 |
| Pt2+|Pt | Pt2+ + 2e ó Pt | +1,200 |
| Au3+|Au | Au3+ + 3 e ó Au | +1,498 |
| Au+|Au | Au+ + e ó Au | +1,691 |
| Газовые электроды | ||
| Pt|H2|H+ | 2H+ + 2e ó H2 | 0,00 |
| Pt|H2|OH–, H2O | 2H2O + 2e ó H2 + 2 OH– | –0,828 |
| Pt|Cl2|Cl– | Cl2 + 2e ó 2Cl– | +1,36 |
| Pt|F2|F– | F2 + 2e ó 2F– | +2,87 |
| Pt|O2|OH–, H2O | O2 + 2H2O + 4e ó 4OH– | +0,401 |
| Pt|O2|H+, H2O | O2 + 4H+ + 4e ó 2H2O | +1,229 |
| Электроды второго рода | ||
| Ag | AgCl, Cl– | AgCl + e ó Ag + Cl– | +0,222 |
| Hg | Hg2Cl2, Cl– | Hg2Cl2 + 2e ó 2Hg + 2Cl– | +0,268 |
Растворимость веществ в воде
Ионы Li+ Na+ K+ Be2+ Mg2+ …– Конец работы –
Используемые теги: Химия0.033
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: ХИМИЯ
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов