рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Биотехнологии
- /
- ОСНОВЫ БИОТЕХНОЛОГИИ
Реферат Курсовая Конспект
ОСНОВЫ БИОТЕХНОЛОГИИ
ОСНОВЫ БИОТЕХНОЛОГИИ - раздел Биотехнологии, А.а.чиркин ...
А.А.ЧИРКИН
ОСНОВЫ БИОТЕХНОЛОГИИ
Витебск 2009
Министерство образования Республики Беларусь
Учреждение образования «Витебский государственный университет им. П.М.Машерова»
ОСНОВЫ БИОТЕХНОЛОГИИ
Учебно-методический комплекс для студентов биологического факультета
Чиркин А.А.
Учебно-методический комплекс для студентов биологического факультета / А.А.Чиркин. – Витебск: Издательство УО «ВГУ им. П.М.Машерова», 2009. – 146… ISBNОглавление
| Раздел | Стр. |
| Оглавление | |
| Введение | |
| Основы биотехнологии (Программы) | |
| Содержание курса | |
| Литература | |
| История развития молекулярной биотехнологии | |
| Промышленная биотехнология | |
| Понятие о метаболизме | |
| Продуценты и селекция | |
| Биотехнологическое сырье | |
| Объекты молекулярной биотехнологии | |
| Технология рекомбинантных ДНК | |
| Полимеразная цепная реакция | |
| Ферменты | |
| Биотехнологические основы культивирования микроорганизмов | |
| Экологически чистая энергия. Биогаз. | |
| Деградация ксенобиотиков с помощью микроорганизмов | |
| Утилизация целлюлозы | |
| Питание сельскохозяйственных животных | |
| Получение ферментативных препаратов | |
| Молекулярная биотехнология и питание | |
| Бродильное производство | |
| Химия пищевых веществ в питании человека | |
| Продукты из молока | |
| Хлебные продукты | |
| Молекулярная биотехнология и производство коммерческих продуктов | |
| Биотехнология и растениеводство | |
| Трансгенные животные, птицы, рыбы | |
| Контроль применения методов молекулярной биотехнологии | |
| Геномная инженерия | |
| Практикум | |
| Вопросы итогового контроля |
ВВЕДЕНИЕ
Учебно-методический комплекс дисциплины «Основы биотехнологии» составлен с ориентацией на конечный результат обучения студентов на биологическом факультете с целью формирования знаний о современных биотехнологических процессах, основанных на методах рекомбинантных ДНК, а также на использовании иммобилизованных ферментов, клеток или клеточных органелл. В основе программы лежат представления о молекулярной биотехнологии, которая служит для создания нового продукта или получение уже известного продукта в промышленных масштабах с помощью биологических систем in vitro и in vivo. Рассмотрены вопросы практического применения молекулярной биотехнологии на примерах производства продуктов питания (выращивание водорослей, дрожжей и бактерий для получения веществ, повышающих биологическую и энергетическую ценность пищи), повышения продуктивности сельскохозяйственных растений и животных, производства фармацевтических субстанций, биологической очистки объектов окружающей среды, совершенствования лабораторных методов обследования биологических объектов экосистем. Программа основана на учебно-исследовательском принципе изучения предмета.
Весь материал разбит на 4 раздела. В первом разделе излагаются основы молекулярной биологии, во втором – основной упор сделан на молекулярную биотехнологию микроорганизмов, в третьем – рассмотрены вопросы биотехнологии эукариотических систем, в том числе и человека и в четвертом разделе приведена законодательная база использования генноинженерных продуктов в пищевой и фармацевтической промышленности, применения рекомбинантных организмов в сельском хозяйстве, понятия о правилах GMP и GLP (требования производства генноинженерных продуктов и их добротного испытания).
При изложении теоретических основ спецкурса автор широко использовал шесть учебных пособий: Б.Глик, Дж.Пастернак «Молекулярная биотехнология. Принципы и применение». М.: Мир, 2002. – 589 с.; Т.А.Егорова, С.М.Клунова, Е.А.Живухина «Основы биотехнологии». М.: ACADEMA, 2003. – 208 с.; О.В. Кислухина «Ферменты в производстве пищи и кормов». М.: ДеЛи принт, 2002 – 336 с.; В.Н.Голубев, И.Н.Жиганов «Пищевая биотехнология». М.: ДеЛи принт, 2001. – 123 с.; А.Н.Евтушенков, Ю.К.Фомичев «Введение в биотехнологию». Мн: БГУ, 2004. – 93 с.; И.В.Семак «Инженерная энзимология». Мн.: БГУ, 2006. – 126 с.
Все замечания и предложения будут с благодарностью приняты и учтены в дальнейшей работе по совершенствованию спецкурса
ОСНОВЫ БИОТЕХНОЛОГИИ
ЗАДАЧИ ПРЕПОДАВАНИЯ КУРСА В результате изучения основ биотехнологии студент должен:ТЕОРЕТИЧЕСКОЕ СОДЕРЖАНИЕ КУРСА
История развития молекулярной биотехнологии представлена в таблице 1.
Таблица 1 - Историческая справка о становлении молекулярной биологии (по Б.Глик, Дж.Пастернак, 2002)
| Дата | Событие |
| Карл Эреки ввел термин «биотехнология» на основе промышленного выращивания свиней с использованием сахарной свеклы | |
| Промышленное производство пенициллина | |
| Генетический материал – ДНК (Эвери, МакЛеод, МакКарти) | |
| Двойная спираль ДНК (Уотсон и Крик) | |
| Расшифрован генетический код | |
| Выделена первая рестриктаза (эндонуклеаза) | |
| Синтез полноразмерного гена тРНК (Корана) | |
| Создание технологии рекомбинантных ДНК (Бойер и Коэн) | |
| Описание технологии получения моноклональных антител (Колер, Мильштейн) | |
| Первые руководства для работы с рекомбинантными ДНК | |
| Методы определения нуклеотидной последовательности ДНК | |
| Произведен человеческий инсулин, полученный с помощью E. сoli | |
| Описано применение Ti-плазмиды для трансформации растений | |
| Генноинженерным путем получена высокоопухолевая линия мышей | |
| Создан метод полимеразной цепной реакции (ПЦР) | |
| Начало проекта «Геном человека» | |
| Определение нуклеотидной последовательности всех хромосом эукариотического микроорганизма (Saccharomyces cerevisiae) | |
| Клонировано млекопитающее из дифференцированной соматической клетки | |
| Завершение проекта «Геном человека» |
Термин «биотехнология» был предложен в 1917 году венгерским инженером Карлом Эреки для описания процесса крупномасштабного выращивания свиней с использованием в качестве корма сахарной свеклы. По определению Эреки, биотехнология – это «все виды работ, при которых из сырьевых материалов с помощью живых организмов производятся те или иные продукты». В 1961 году по инициативе шведского микробиолога Карла Герена Хеден было предложено название журналу «Биотехнология и биоинженерия», что определило официальное признание термина – биотехнология, т.е. наука в области «промышленного производства товаров и услуг при участии живых организмов, биологических систем и процессов». Фундаментом для этой науки явились микробиология, биохимия и химическая инженерия.
Промышленная биотехнология. Промышленный биотехнологический процесс, в котором для производства коммерческих продуктов используются микроорганизмы, обычно состоит из трех ключевых этапов.
1. Исходная обработка: обработка сырья таким образом, чтобы его можно было использовать как источник питательных веществ для микроорганизма-мишени.
2. Ферментация и биотрансформация: рост микроорганизма-мишени в большом (обычно более 100 л) биореакторе (ферментация) с последующим образованием нужного метаболита, например антибиотика, аминокислоты или белка (биотрансформация).
3. Конечная обработка: очистка нужного вещества от компонентов культуральной среды или от клеточной массы.
По Т.А.Егоровой и соавт. (2003) достижения биотехнологии перспективны в следующих отраслях:
1) в промышленности (пищевая, фармацевтическая, химическая, нефтегазовая) – использование биосинтеза и биотрансформации новых веществ на основе сконструированных методами генной инженерии штаммов бактерий и дрожжей с заданными свойствами на основе микробиологического синтеза;
2) в экологии – повышение эффективности экологизированной защиты растений, разработка экологически безопасных технологий очистки сточных вод, утилизация отходов агропромышленного комплекса, конструирование экосистем;
3) в энергетике – применение новых источников биоэнергии, полученных на основе микробиологического синтеза и моделированных фотосинтетических процессов, биоконверсия биомассы в биогаз;
4) в сельском хозяйстве – разработка в области растениеводства трансгенных агрокультур, биологических средств защиты растений, бактериальных удобрений, микробиологических методов рекультивации почв; в области животноводства – создание эффективных кормовых препаратов из растительной, микробной биомассы и отходов сельского хозяйства, репродукция животных на основе эмбриогенетических методов;
5) в медицине – разработка медицинских биопрепаратов, моноклональных антител, диагностикумов, вакцин, развитие иммунобиотехнологии в направлении повышения чувствительности и специфичности иммуноанализа заболеваний инфекционной и неинфекционной природы.
В качестве примера на рис. 1 представлены современные направления биотехнологии, предназначенные для создания продовольствия.
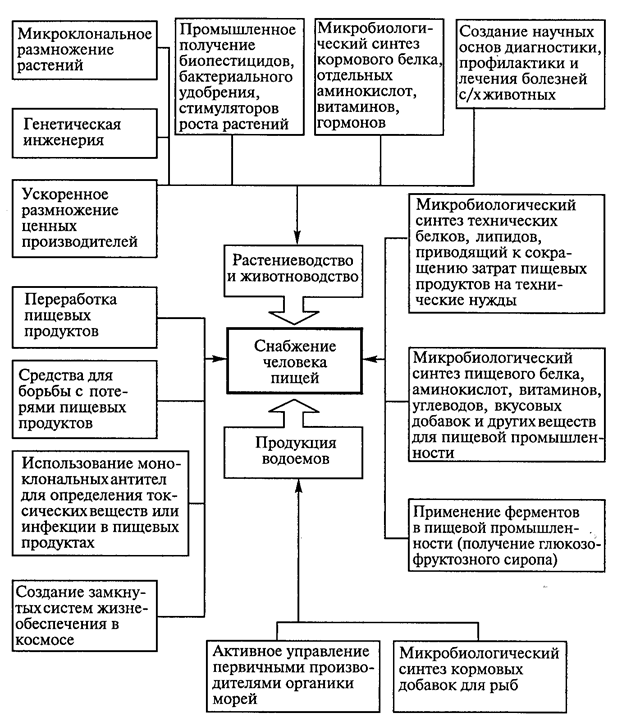
Рис. 1. Перспективные направления биотехнологии в снабжении человечества продовольствием (Т.А.Егорова и соавт., 2003).
Будущее биотехнологии некоторые исследователи связывают с протоинженерией – технологией изменения свойств природных белков на генетическом уровне, получения новых белков (инсектицидов, биостимуляторов, биосенсоров, качественных продуктов питания, лекарств и др.). Так, например, использование биосенсоров лежит в основе биоэлектроники, призванной обеспечивать революционные изменения в методах измерений и контроля в различных областях науки и техники. Основная доля успехов биотехнологии в последние годы связана с развитием методов генной инженерии – технологии рекомбинантных ДНК. Согласно определению Национальных институтов здоровья США, рекомбинантными ДНК называют молекулы ДНК, полученные вне живой клетки, в пробирке, путем соединения природных или синтетических фрагментов ДНК с векторами, способными самореплицироваться в клетке.
Современные методы биотехнологических процессов:методы промышленной микробиологии, генная инженерия, использование иммобилизованных ферментов, клеточных органелл, клеток, тканей растений, насекомых и животных.
Промышленная микробиология базируется на фундаментальных науках микробиология, иммунология и биохимия. В течение последнего столетия промышленная микробиология постепенно занимала передовые позиции в получении пищевых добавок и чистых биологически значимых веществ по сравнению с производствами, основанными на химическом синтезе. Существенным прорывом в развитии промышленной микробиологии явился синтез пенициллина и других антибиотиков. На одной из последних технологических схем синтеза пенициллина представлены типичные этапы биотехнологического процесса синтеза и выделения антибиотика (рис. 2). В промышленной микробиологии важную роль играют знания по энзимологии и генетике микроорганизмов, а также сведения по таксономии микроорганизмов.
Основу генной инженерии составляет встраивание природной или чужеродной ДНК в вектор, который представляет собой бактериальную плазмиду или геном вируса; затем рекомбинантную молекулу ДНК вводят в клетку, где она реплицируется. Клетка, содержащая такую ДНК, размножается, образуя клон трансформированных клеток, способных к экспрессии чужеродных генов и образованию специфических белков в больших количествах.
Технология иммобилизованных ферментов получила свое развитие в последние 30-40 лет. Иммобилизованные ферменты на гелевых или пористых носителях оказались высокотехнологичными при промышленном ферментативном выделении или синтезе различных химических веществ, включая пищевые продукты (получение концентрата фруктозы из крахмала, этанола и др.).
В молекулярной биотехнологии определенное место занимает использование клеток животных, например, для культивирования вирусов при производстве вакцин, интерферона, при синтезе моноклональных антител клетками гибридом, получении сложных белков.
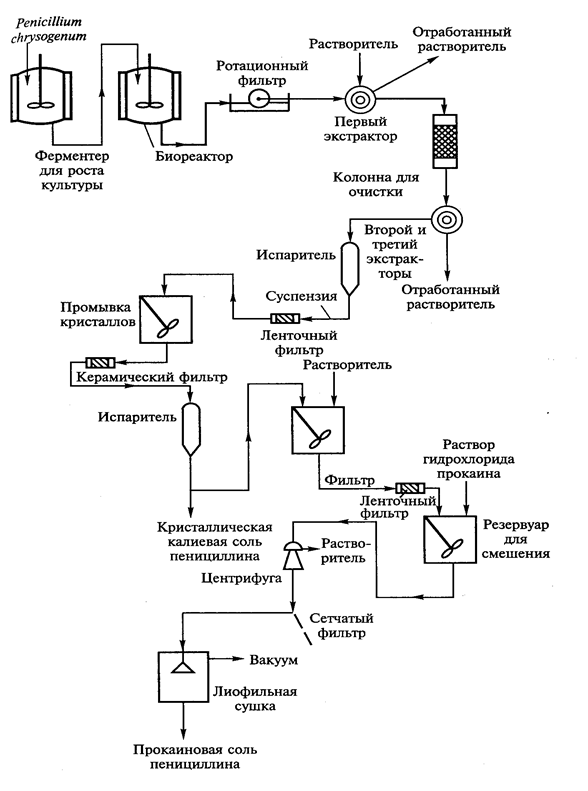
Рис. 2. Технологическая схема производства пенициллина (Т.А.Егорова и соавт., 2003).
Для широкомасштабного производства клонов растений используют меристемы. Культуры растительных клеток применяют для синтеза различных веществ, чаще всего алкалоидов и других вторичных метаболитов. Начиная с 1970 г. исследователи нередко наблюдали, что клетки, растущие в культуре, синтезируют вещества, которые не обнаруживаются в целом растении.
Весьма перспективным является использование тканей и органов животных, насекомых и растений как биореакторов. Наибольший интерес представляет использование молочных желез крупного рогатого скота с целью получения обогащенного специальными добавками молока или лишенного лактозы молока для лиц с дефицитом кишечной лактазы.
Понятие о метаболизме, метаболических путях, карте метаболизма. Совокупность химических превращений веществ в организме называют метаболизмом. Подавляющее большинство химических реакций в живых клетках катализируется ферментами. Вещества, участвующие в метаболизме, называются метаболитами. Метаболизм выполняет 4 функции: 1) Снабжение организма химической энергией, полученной при расщеплении богатых энергией пищевых веществ или путем преобразования энергии солнца. 2) Превращение пищевых веществ в строительные блоки, которые используются в клетке для биосинтеза макромолекул. 3) Сборка макромолекулярных (биополимеры) и надмолекулярных структур живого организма, пластическое и энергетическое поддержание его структуры. 4) Синтез и разрушение тех биомолекул, которые необходимы для выполнения специфических функций клетки и организма.
По форме усвояемого углерода все живые организмы делятся на 2 группы: 1) Автотрофные клетки ("сами себя питающие") усваивают СО2 воздуха в процессе фотосинтеза, и из него строят все свои углеродсодержащие биомолекулы (фотосинтезирующие бактерии, зеленые растения). 2) Гетеротрофные клетки ("питающиеся за счет других") получают углерод из сложных органических молекул, например, глюкозы (клетки высших животных и большинства микроорганизмов), т.е. они питаются продуктами жизнедеятельности других клеток. В биосфере автотрофы и гетеротрофы являются участниками кругооборота углерода и кислорода между животным и растительным мирами (рис. 3). По отношению к кислороду гетеротрофов делят: 1) Аэробы - требуют наличия кислорода для окисления питательных веществ. 2) Анаэробы - для окисления питательных веществ кислород не требуется. 3) Факультативные анаэробы - существуют в кислородной и бескислородной средах; 4) Облигатные анаэробы - живут только в бескислородной среде. Большинство гетеротрофов - факультативные анаэробы, которые при наличии кислорода используют аэробные метаболические пути.
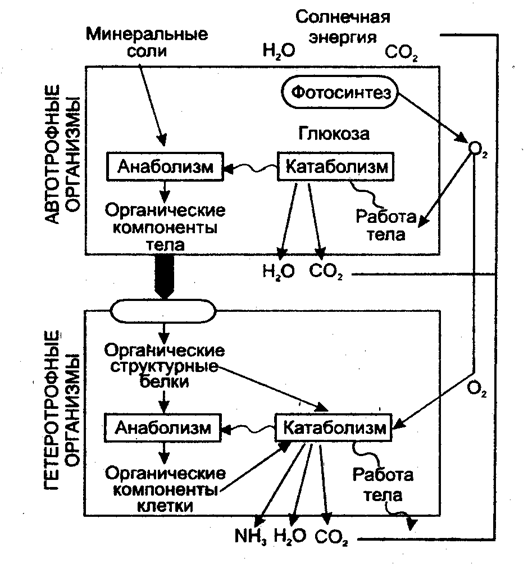
Рис. 3. Катаболизм и анаболизм у автотрофных и гетеротрофных организмов (Голубев В.Н., Жиганов И.Н., 2001).
Метаболические пути. В живой клетке многие тысячи метаболитов вступают в химические реакции. Реакционная способность метаболитов зависит от ряда условий и прежде всего, наличия соответствующих ферментов. Так, например, в мышечных клетках вся глюкоза реагирует только с АТФ и превращается в глюкозо-6-фосфат. Другие реакции не идут, т.к. нет ферментов, а некатализируемые реакции крайне медленны. Образовавшийся глюкозо-6-фосфат является заряженным веществом и поэтому не может покинуть клетку. Дальнейшие превращения глюкозо-6-фосфата определяются набором ферментов, катализирующих последовательные реакции. Т.о. получается ферментативная цепь реакций. Это и есть метаболический путь. Метаболические пути всех веществ связаны друг с другом общими метаболитами и образуют единую сетку реакций - карту метаболизма.
Ферменты и метаболизм. Понятие о регуляции метаболизма. Метаболизм регулируется за счет ферментов. Регуляция активности и количества ферментов лежит в основе метаболических процессов в норме и при патологии. Еще в прошлом веке Клодом Бернаром было установлено, что внутриклеточные константы сохраняются, невзирая на изменение окружающей среды. Это концепция гомеостаза в своей основе содержит координированную деятельность многих ферментативных реакций. Для идеализированной клетки используют камерную модель метаболизма. Исследователь судит о метаболизме, изучая входные и выходные параметры. Изучение самих метаболических путей затруднено. Здесь необходимы специальные приемы, например, изотопная техника. Регуляция метаболических путей осуществляется по Ленинджеру на трех уровнях: 1) Быстрое реагирование, связанное с действием аллостерических ферментов, каталитическая активность которых может меняться под влиянием особых веществ, оказывающих стимулирующее или тормозящее действие (эффекторы, модуляторы). 2) У высших организмов - гормональная регуляция, точнее - нейрогормональная регуляция. Это регуляция посредством дистантных гуморальных сигналов, действующих через мембраны, химическую модификацию или геном клетки. 3) Регуляция метаболизма (долговременная) связана с изменением концентрации данного фермента в клетке. Концентрация всякого фермента в любой данный момент определяется соотношением скоростей его синтеза и распада (индукция синтеза, например, диетой).
Катаболизм и анаболизм. Основные конечные продукты метаболизма. В наиболее употребительном значении термин "метаболизм" равнозначен "обмену веществ". В точном смысле "метаболизм" означает промежуточный обмен, т.е. превращение веществ внутри клеток с момента их поступления до образования конечных продуктов. Метаболизм складывается из двух фаз - катаболизма и анаболизма.
Катаболизм- это ферментативное расщепление крупных пищевых или депонированных молекул до более мелких с выделением энергии и запасанием ее в виде макроэргических соединений. Катаболизм идет в 3 стадии. Первая стадия - полимеры превращаются в мономеры (крахмал и гликоген - в глюкозу, белки - в аминокислоты, триацилглицерины - в жирные кислоты и др.). Вторая стадия (специфические пути катаболизма) - мономеры превращаются в общие продукты, чаще всего, ацетил-КоА. Третья стадия (общий путь катаболизма) - окисление ацетильной группы ацетил-КоА до СО2 и Н2О в реакциях цикла трикарбоновых кислот. Окислительные реакции общего пути катаболизма (ЦТК) сопряжены с цепями переноса электронов (рис. 4). При этом энергия (~ 40%) запасается в макроэргических связях АТФ.
Анаболизм - ферментативный синтез крупных полимерных молекул из простых предшественников с затратой энергии. Идет в 3 стадии, причем третья стадия катаболизма является первой стадией анаболизма.

Рис. 4. Схема катаболизма.
Анаболизм и катаболизм не являются простым обращением реакций. Анаболические пути должны отличаться от путей катаболизма хотя бы одной из ферментативных реакций, чтобы регулироваться независимо. Например, специфический путь распада глюкозы до лактата (гликолиз) включает 11 реакций; синтез глюкозы из лактата включает 8 обратимых реакций распада глюкозы и 3 дополнительных реакции с новым набором ферментов. Именно на этих стадиях за счет регуляции активности ферментов регулируются суммарные скорости распада и синтеза глюкозы. Кроме того реакции катаболизма и анаболизма часто разделены мембранами и протекают в разных отсеках (компартментах) клеток. Например, распад жирных кислот идет в митохондриях, а их синтез в цитозоле. Конечные продукты метаболизма: Н2О, СО2, NН3.
Особенности метаболизма микроорганизмов представлены на рис.5.
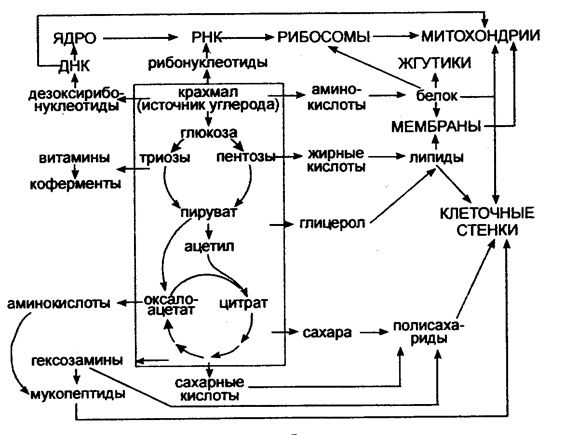
Рис. 5. Основные этапы метаболизма микроорганизмов (Голубев В.Н., Жиганов И.Н., 2001).
Большинство микроорганизмов и зеленые растения способны синтезировать все протеиногенные аминокислоты. Клетки животных не могут синтезировать все аминокислоты, в связи с чем для жизнедеятельности необходимо поступление незаменимых (не синтезируемых) аминокислот с пищей.
Исходным материалом для синтеза аминокислот микроорганизмами служат простые метаболиты (пируват, 2-оксоглутарат, оксалоацетат, фумарат, эритрозо-4-фосфат, рибозо-5-фосфат, АТФ). При синтезе большинства аминокислот аминогруппа вводится только на последнем этапе путем трансаминирования. Другие аминокислоты образуются в результате превращений других аминокислот (рис. 6). Синтезированные аминокислоты используются в процессе трансляции, т.е. синтеза белков на рибосомах с использованием генетического кода иРНК. Эти процессы лежат в основе первых успехов технологии рекомбинантных ДНК: синтез рекомбинантного инсулина клетками E.coli после введения в них гена человеческого инсулина. Синтез белков микроорганизмами, растениями, клетками насекомых, животными клетками является наиболее перспективным и разработанным методом молекулярной биотехнологии.
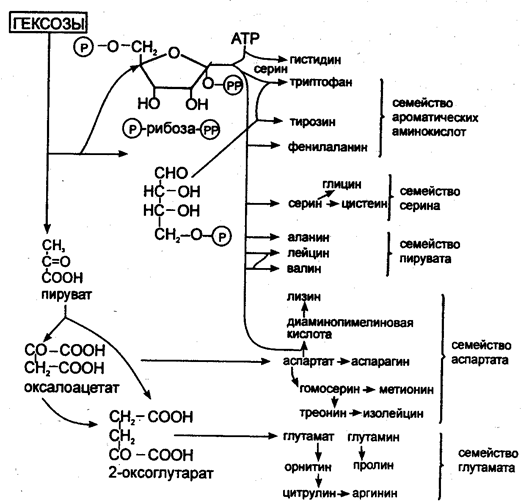
Рис. 6. Биосинтез аминокислот из молекул-предшественников (Голубев В.Н., Жиганов И.Н., 2001)
Продуценты и их селекция.Микроорганизмы, применяемые в микробиологической промышленности, принадлежат разным таксономическим группам (бактерии, фикомицеты, актиномицеты и др.). Из более чем 100000 известных видов микроорганизмов в промышленности используется около 100 видов, к которым принадлежат несколько тысяч штаммов. Промышленный штамм должен удовлетворять следующим требованиям (по Л.И.Воробьевой, 1987):
- расти на дешевых и доступных субстратах;
- обладать высокой скоростью роста биомассы и иметь высокую продуктивность целевого продукта при экономном потреблении питательного субстрата;
- проявлять направленную биосинтетическую активность при минимальном образовании побочных продуктов;
- быть генетически однородным, стабильным в отношении продуктивности и требований к питательному субстрату и условиям культивирования;
- быть устойчивым к фагам и другой посторонней микрофлоре;
- быть безвредным (не обладать патогенными свойствами) для людей и окружающей среды;
- желательно, чтобы продуценты были термофильными и ацидофильными (или алкалофильными), так как в этом случае легче предохранить ферментируемый субстрат от инвазии посторонней микрофлорой;
- целевой продукт биосинтеза должен иметь экономическую и народнохозяйственную ценность и должен легко выделяться из субстрата.
Большой интерес для производства представляют анаэробные микроорганизмы, поскольку при их культивировании не требуются энергоемкие аэрирующие устройства.
В промышленности применяют три вида штаммов микроорганизмов:
1) природные штаммы, улучшенные естественным и искусственным отбором (производство микробной массы микробного белка, использование в качестве бактериальных азотистых удобрений, биопестицидов, в производстве пищевых продуктов);
2) штаммы, измененные в результате индуцированных мутаций;
3) штаммы, полученные методами генетической или клеточной инженерии.
Принципы селекции микроорганизмов.Микроорганизмы, как объект селекции, имеют ряд особенностей (по В.Н.Голубеву, И.Н.Жиганову, 2001):
1. Выращивание микробной культуры из одной клетки – обычный для микробной селекции прием – приводит к тому, что в руках селекционера в качестве исходного материала селекции всегда оказывается особь клона (имеющего генетическую однородность). С другой стороны, клон микроорганизмов быстро достигает такой численности, что за счет естественных мутаций превращается в популяцию клеток с разными генотипами.
2. Большинство микроорганизмов гаплоидны, с одним набором хромосом, поэтому у них нет скрытой изменчивости, являющейся основой селекции высших организмов.
3. У большинства микроорганизмов, имеющих промышленное значение, до сих пор не известна способность к гибридизации (половому размножению). Это означает, что селекцию клеток можно вести только вегетативным путем.
4. Микроорганизмы характеризуются исключительно быстрой сменой поколений, поэтому возможностей для отбора положительных экземпляров у селекционера-микробиолога значительно больше. Оценку выбранного микроорганизма можно провести за считанные дни выращивания (в отличие от макроорганизмов, где результаты селекционной работы видны лишь через несколько лет).
5. Селекционер микроорганизмов имеет огромное число индивидуумов для отбора, что принципиально расширяет его возможности. Но оценка продуктивности каждого клона из сотен и тысяч образцов требуется такой трудоемкой работы, часто с применением ряда химических и биохимических исследований, которая вполне соизмерима с масштабами работы селекционера высших организмов.
Общая схема селекции микроорганизмов включает этапы:
1. Выбор объекта селекции.
2. Мутагенез или рекомбинация генов.
3. Отбор (естественный или искусственный).
4. Стабилизация свойств штаммов, полученных в результате селекции.
5. Консервирование различными способами.
Биотехнологическое сырье.В микробиологической промышленности использование сырья распределяется следующим образом:
- более 90% идет на производство этанола;
- 5% используется при производстве хлебопекарской продукции;
- 1,7% используется при производстве антибиотиков;
- 1,65% идет на производство аминокислот и других органических кислот.
В биотехнологических процессах 40-65% расходов приходится на сырье.
В принципе, микроорганизмы способны ассимилировать любое органическое соединение. Поэтому потенциальными ресурсами для микробиологической биотехнологии могут служить все мировые запасы органических веществ, включая первичные и вторичные продукты фотосинтеза, а также запасы органических веществ в недрах земли. Каждый конкретный вид микроорганизмов, используемый в биотехнологии, весьма избирателен к питательным веществам. В связи с этим органическое сырье (кроме лактозы, сахарозы и крахмала) без предварительной химической обработки практически не пригодно для микробного синтеза. Целлюлозосодержащее сырье после химического или ферментативного гидролиза и очистки от ингибирующих или балластных примесей (фенол, фурфурол, оксифурфурол и др.) может быть использовано в биотехнологическом производстве. Каменный уголь, природный газ и древесина могут служить сырьем для химического синтеза технических спиртов или уксусной кислоты. Последние, в свою очередь, являются отличным сырьем для микробиологической промышленности.
Традиционные источники углерода–кристаллическая глюкоза, техническая сахароза, техническая лактоза, гидрол (сиропообразная жидкость, содержащая глюкозу), крахмал, уксусная кислота, спирт этиловый синтетический, узкая фракция жидкого парафина. Низкомолекулярные спирты (метанол, этанол) можно отнести к числу перспективных видов микробиологического сырья, так как их ресурсы существенно увеличиваются благодаря успешному развитию технологии химического синтеза. Дрожжи родов Pichia, Candida, Torulopsis и др., некоторые виды бактерий (род Protaminobacter, Flavobacterium и др.) используют в качестве единственного источника углерода метанол и образуют биомассу с высоким содержанием белков (60-70%). В 1939 году В.О.Тоусоном была установлена способность разных видов микроорганизмов использовать в качестве единственного источника углерода и энергии н-алканы и некоторые фракции нефти.
Побочные продукты производства– высокомолекулярные парафины (ранее сжигались), вода после замачивания кукурузных зерен при выделении крахмала (раннее спускалась в канализацию, теперь упаривают), отходы химического производства (смеси карбоновых кислот, сульфитный щелок, зерновая и картофельная барда, меласса, соапсток, гидрол и др.) нашли применение в микробиологической промышленности как источники углерода. Так, для производства кормовых дрожжей используют сульфитный щелок, картофельную барду, зерновую барду, гидрол, солодовое сусло, молочную сыворотку, депротеинизированный сок растений, гидролизат древесных отходов и торфа. Побочные продукты производства являются сырьевым резервом для микробиологической промышленности. В нашей стране ежегодно остается неиспользованной около 1 млн. т лактозы, содержащейся в сыворотке и пахте. В США из 15 млн. т молочной сыворотки, ежегодно расходуемой на производство сыра, половина теряется со сточными водами, хотя известно, что из одной тонны сыворотки можно получить около 20 кг воздушно-сухой биомассы дрожжей. В микробиологической промышленности нашли широкое применение побочные продукты производства глюкозы из крахмала – меласса и гидрол. В мелассе содержится до 45% сахарозы, все незаменимые аминокислоты кроме триптофана, витамины и витаминоподобные вещества (биотин, пантотеновая кислота, инозит).
Источники минерального питания– неорганические и органические соли. При выращивании биомассы в концентрации 30-40 г/л потребность в добавках азотсодержащих солей обычно не превышает 0,3-0,4% от объема среды. Большинство дрожжей хорошо усваивает аммиачные соли; некоторые виды дрожжей испытывают потребность в нитратах. Часто источником азота в состав сред включают мочевину. При направленном биосинтезе, например, целлюлозолитических ферментов грибом Peniopora gigantea наивысшая биохимическая активность клеток наблюдается на средах с органическим азотом (аспарагин, пептон и др.). Микроорганизмы для построения своих компонентов и обеспечения энергетики требуют поступления фосфора, магния, кальция, железа и других элементов (10-3-10-4 М. Повышенная потребность микроорганизмов в микроэлементах возникает, если целевой метаболит содержит микроэлемент. Например, при биосинтезе витамина В12 в питательную среду включают кобальт. Избыточное введение некоторый ионов может изменить потенциал клеток (отрицательный в норме, 16-20 мВ), что нарушит их биологические и продуцентные свойства.
Комплексные обогатители сред необходимы для оптимизации роста и функционирования микроорганизмов: кукурузный экстракт, дрожжевой автолизат, экстракт, гидролизат, клеточный сок картофельных клубней, молочная сыворотка, экстракт пшеничных отрубей, экстракт солодовых проростков и др. Иногда добавляют мясной и рыбный пептоны. Для культивирования животных клеток используют экстракт плаценты, плазму крови животных. Для выращивания клеток растений или мицелия высших грибов применяют экстракты тыквы, листьев хлопчатника, отвар слив и др. Все эти добавки приносят витамины, аминокислоты, цитокинины и другие необходимые для роста биологически активные вещества.
Пеногасители и флокулянты. Процессы пенообразования и пеногашения необходимо регулировать при аэробном глубинном культивировании микроорганизмов. Для создания устойчивых режимов пенообразования применяют механические и химические пеногасители и их комбинации. Химические пеногасители (поверхностно-активные вещества – ПАВ) делятся на жировые и синтетические. Жиры проявляют пеногасящие свойства в относительно высоких концентрациях 0,2-1,0% от объема среды. Но их концентрация может изменяться из-за потребления микроорганизмами, а продукты их распада – жирные кислоты – могут закислять среду (нагрузка на буферную систему среды инкубации). Для пищевой промышленности выпускаются эффективные синтетические пеногасители: силиконы, пропинолы, контрамин, полиформаль и др. Для флокуляции (конгломеризации) клеток применяют химические флокулянты (хлорид кальция, соли фосфорной кислоты) или синтетические полиэлектролиты – катион-, анионактивные, неионогенные. Эффективность применения флокулянтов зависит от температуры культивирования, рН среды и физиологического состояния клеток.
Вода и кислород.Для биосинтеза 1 кг дрожжевой биомассы необходимо 1,0-2,5 кг кислорода. При интенсивном потреблении субстрата продуцент ассимилирует независимо от источника углерода 1,0-4,0 мг кислорода на 1 л среды в минуту. Растворимость кислорода относительно низкая и зависит от условий культивирования клеток. При давлении 0,1 МПа и температуре 30 ˚С в 1 л дистиллированной воды растворяется 7,5 мг кислорода. В реальной питательной среде растворимость кислорода составляет 2-5 мг/л. Запасов кислорода в среде культивирования хватает для обеспечения жизнедеятельности аэробных продуцентов в течение всего лишь 0,5-2 минут. При интенсивном перемешивании и во время интенсивного роста биомассы увеличивается потребление кислорода. Введено понятие о критической концентрации кислорода, при которой лимитируется дыхание клеток: при росте на сахаросодержащих средах критическая концентрация кислорода 0,05-0,1 мг/мл (3-8% от полного насыщения среды кислородом). Оптимальной для роста биомассы считается концентрация кислорода 50-60% от полного насыщения, для биосинтеза целевых метаболитов – 10-20%.
Вода составляет 80-90% биомассы микроорганизмов. Для приготовления питательных сред требуется чистая вода: не более 50 мг/л хлоридов и не более 60 мг/л сульфитов. Концентрации ионов металлов (мг/л) не должны превышать следующих значений: цинк – 5,0, медь – 3,0, фтор – 1,5, свинец – 0,2, мышьяк – 0,05.
Объектами молекулярной биотехнологии являются разнообразные биологические системы:
- микроорганизмы;
- клеточные линии насекомых;
- клеточные линии растений;
- клеточные линии животных;
- многоклеточные организмы (растения, домашние и лабораторные животные).
Во многих случаях генетически модифицированная самовоспроизводящая биологическая единица – микроорганизм, вирус, растение или животное – является конечным коммерческим продуктом. Среди множества биологических объектов, используемых в молекулярной биотехнологии, чаще применяются Escherichia coli, одноклеточные дрожжи Saccharomyces cerevisiae и различные клеточные линии животного происхождения. Все они играют важную роль в получении белков, кодируемых клонированными генами. Рассмотрим наиболее значимые молекулярно-биотехнологические системы.
Прокариоты и эукариоты.Все живые организмы делят на две группы: прокариоты и эукариоты. Прокариотические клетки (например, бактериальные): 1) хромосомная ДНК находится в цитоплазме, 2) клетка окружена ригидной клеточной стенкой, в состав которой часто входит пептидогликан (но не хитин или целлюлоза), 3) в клетке нет субклеточных цитоплазматических органелл. Эукариотическая клетка имеет: 1) ядро, отделенное от цитоплазмы ядерной мембраной, хромосомная ДНК находится в ядре, 2) клеточная стенка, если она есть, может содержать хитин или целлюлозу, но не пептидогликан, 3) в цитоплазме содержатся различные субклеточные органеллы (митохондрии, лизосомы, хлоропласты и др.).
Кишечная палочка(Escherichia coli) – один из наиболее хорошо изученных биотехнологических объектов (генетика, молекулярная биология, биохимия, физиология, общая биология). Это грамотрицательная непатогенная подвижная палочка длиной менее 1 мкм. Ее средой обитания является кишечник человека, но она также может высеваться из почвы и воды. Благодаря способности размножаться простым делением на средах, содержащих ионы натрия, калия, магния, кальция, аммония, хлора, фосфата, сульфата, микроэлементы и источник углерода (например, глюкозу), E.coli стала излюбленным объектом научных исследований. При культивировании E.coli на обогащенных жидких питательных средах, содержащих аминокислоты, витамины, соли, микроэлементы и источник углерода, время генерации (т.е. время между образованием бактерии и ее делением) в логарифмической фазе роста при температуре 37 ˚С составляет примерно 22 мин.
Для каждого живого организма существует определенный температурный интервал, оптимальный для его роста и размножения. При слишком высоких температурах происходит денатурация белков и разрушение важных клеточных компонентов, что ведет к гибели клетки. При низких температурах биологические процессы существенно замедляются или останавливаются совсем вследствие структурных изменений, которые претерпевают белковые молекулы. Исходя из температурного режима, который предпочитают те или иные микроорганизмы, их можно подразделить на термофилы (от 45 ˚С до 90 ˚С и выше), мезофиллы (от 10 ˚С до 47 ˚С) и психрофилы, или психротрофы (от -5 ˚С до 35 ˚С). Микроорганизмы, активно размножающиеся лишь в определенном диапазоне температур, могут быть полезным инструментом для решения различных биотехнологических задач. Например, термофилы часто служат источником генов, кодирующих термостабильные ферменты, которые применяются в промышленных или лабораторных процессах, а генетически видоизмененные психротрофы используют для биодеградации токсических отходов, содержащихся в почве и воде, при пониженных температурах.
E. coli можно культивировать как в аэробных (в присутствии кислорода), так и в анаэробных (без кислорода) условиях. Однако для оптимальной продукции рекомбинантных белков E.coli и другие микроорганизмы обычно выращивают в аэробных условиях. Если целью культивирования бактерий в лаборатории является синтез и выявление определенного белка, то культуры выращивают на сложных жидких питательных средах в колбах. Для поддержания нужной температуры и обеспечения достаточной аэрации культуральной среды колбы помещают в водяную баню или термостатируемую комнату и непрерывно встряхивают. Такой аэрации достаточно для размножения клеток, но не всегда – для синтеза белка. Рост клеточной массы и продукция белка лимитируются не содержанием в питательной среде источников углерода или азота, а содержанием растворенного кислорода: при 20 ˚С оно равно примерно девяти миллионным долям. Это становится особенно важно при промышленном получении рекомбинантных белков с помощью микроорганизмов. Для обеспечения условий, оптимальных для максимальной продукции белков, конструируют специальные ферментеры и создают системы аэрации.
Широкое применение клеток E.coli связано со следующим:
1. Эффект Лурия-Дельбрюка – устойчивость E.coli к бактериальным вирусам (бактериофагам) обусловлено именно произошедшими в них мутациями, а не реакцией бактерий на воздействие со стороны бактериофага.
2. Эффект Ледерберга-Татума – между членами генетически неоднородной популяции E.coli может происходить обмен генетической информацией (т.е. как и двуполых организмов, в результате физического обмена между хромосомами могут возникать новые генетические комбинации (генетическая рекомбинация). Ледерберг и Татум создали различные штаммы E.coli, индуцируя те или иные мутации и отбирая клетки с разнообразными наследуемыми дефектами метаболизма. Например, одна чистая культура могла синтезировать вещества А,В,С, но не D или Е (ее обозначили АВСde). Параллельно создали другую чистую культуру, abcDE. Смешав эти культуры, получили бактерии ABCDE. Ни в одной из чистых культур тип ABCDE не возникал спонтанно. Экспериментально исключив остальные возможные причины образования комбинации ABCDE, было доказано, что она возникает в результате физического обмена генетическим материалом между двумя хромосомами.
Микроорганизмы, используемые в молекулярной биотехнологии, делят на две группы:
1. Микроорганизмы как источники специфических генов (например, ген термостабильной ДНК-полимеразы, используемой в полимеразной цепной реакции).
2. Микроорганизмы, созданные генноинженерными методами для решения определенных задач (например, различные штаммы Corynebacterium glutamicum, которые были генетически модифицированы с целью повышения продукции промышленно важных аминокислот.
Дрожжи(Saccharomyces cerevisiae) – это непатогенные одноклеточные микроорганизмы с диаметром клетки около 5 мкм, которые во многих отношениях представляют собой эукариотический аналог E.coli. Их генетика, молекулярная биология и метаболизм детально изучены. S. cerevisiae размножаются почкованием и хорошо растут на такой же простой среде, как и E.coli. Их способность к превращению сахара в этанол и углекислый газ издавна использовалась для изготовления алкогольных напитков и хлеба. В настоящее время ежегодно во всем мире расходуется более 1 млн. тонн S. cerevisiae. Эти клетки являются наиболее удобной моделью для исследования других эукариот (например, многие гены, ответственные за регуляцию клеточного деления S. cerevisiae аналогичны таковым у человека). Это открытие способствовало идентификации и характеристике генов человека, отвечающих за развитие новообразований. В 1996 г. была определена полная нуклеотидная последовательность всего набора хромосом S. cerevisiae.
Синтезированный бактериальной клеткой эукариотический белок часто приходится подвергать ферментативной модификации, присоединяя к белковой молекуле низкомолекулярные соединения – во многих случаях это необходимо для правильного функционирования белка. К сожалению, E. coli и другие прокариоты не способны осуществлять эти модификации, поэтому для получения полноценных эукариотических белков используют S. cerevisiae и другие виды дрожжей.
Культуры эукариотических клеток.При всех различиях между типами эукариот методические подходы к культивированию клеток насекомых, растений и млекопитающих имеют много общего. Сначала берут небольшой кусочек ткани данного организма и обрабатывают его протеолитическими ферментами, расщепляющими белки межклеточного материала (при работе с растительными клетками добавляют специальные ферменты, разрушающие клеточную стенку). Высвободившиеся клетки помещают в сложную питательную среду, содержащую аминокислоты, антибиотики, витамины, соли, глюкозу и факторы роста. В этих условиях клетки делятся до тех пор, пока на стенках емкости с культурой не образуется клеточный монослой. Если после этого не перенести клетки в емкости со свежей питательной средой, то рост прекратится. Обычно удается переносить (перевивать, субкультивировать) и поддерживать до 50-100 клеточных генераций исходной (первичной) клеточной культуры, затем клетки начинают терять способность к делению и гибнут. Культивируемые клетки сохраняют некоторые свойства исходного клеточного материала, поэтому их можно использовать для изучения биохимических свойств различных тканей.
Часто некоторые клетки перевиваемых первичных клеточных культур претерпевают генетические изменения, в результате которых ускоряется их рост. Культуры клеток, которые при этом приобретают селективные преимущества, оказываются способными к неограниченному росту in vitro и называются устойчивыми клеточными линиями. Одни клеточные линии сохраняют основные биохимические свойства исходных клеток, другие нет. У большинства клеток, способных к неограниченному росту, имеются значительные хромосомные изменения, в частности отмечается увеличение числа одних хромосом и потеря других. В молекулярной биотехнологии устойчивые клеточные линии иногда используют для размножения вирусов и для выявления белков, которые кодируются клонированными последовательностями ДНК. Кроме того, они применяются для крупномасштабного производства вакцин и рекомбинантных белков.
Растительные клетки.Большой интерес представляет культура одиночных клеток. Согласно Т.А.Егоровой и соавт. (2003), ее применяют в клеточной селекции для отбора гибридных клеток и их клонирования, а также для генетических и физиологических исследований. Особенно это важно для культивирования растительных клеток. Известно, что одиночная клетка живет, но не делится в тех условиях, которые разработаны для нормального роста и размножения клеток каллусной ткани.
Напомним, что культура изолированных тканей обычно представлена каллусными и гораздо реже опухолевыми тканями. Каллусная ткань образуется в результате повреждения на целых растениях, а также в стерильной культуре на эксплантатах – фрагментах ткани или органа, используемых для получения первичного каллуса. Возникновение каллуса связано с неорганизованным делением (пролиферацией) дедифференцированных клеток. Дедифференцировка – основа создания каллусной ткани.
Культивирование одиночных клеток основано на использовании так называемого «кондиционирующего фактора» - метаболитов, выделяемых в среду культивирования делящимися клетками. Действительно, когда в питательную среду вводится одна клетка или небольшое их количество, они не делятся, так как выделяемого «кондиционирующего фактора» не хватает для индукции деления. Следовательно, необходимо повысить концентрацию этого фактора в питательной среде. Это достигается с помощью следующих методов:
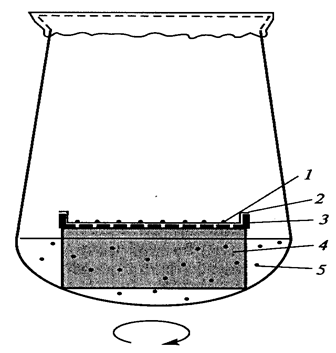
Рис. 7. Использование культуры суспензионных клеток в качестве «кормящего слоя» для выращивания изолированных протопластов и одиночных клеток кукурузы (Егорова Т.А. и соавт., 2003): 1 – колонии клеток; 2 – фильтровальная бумага; 3 – алюминиевая сетка; 4 – пенополиуретан; 5 – суспензия клеток.
1. Метод ткани-«няньки» - кондиционирующий фактор выделяется находящимися рядом с одиночной клеткой кусочками ткани-«няньки».
2. Метод «кормящего слоя» - кондиционирующий фактор выделяют активно делящиеся клетки суспензионной культуры того же вида растений, что и одиночная клетка (рисунок 7).
3. Кондиционирование среды – осуществляется путем добавления в нее питательной среды, отфильтрованной от интенсивно делящихся клеток.
4. Метод культивирования одиночных клеток - осуществляется в микрокапле (объем около 20 мкл) богатой питательной среды.
Кондиционирующий фактор водорастворим, термостабилен, не заменяется фитогормонами, включает низкомолекулярные вещества. Химическая природа кондиционирующего фактора видна из следующего эксперимента. Если разделить одиночные клетки и ткань-«няньку» стеклянной пластиной, то деление клеток не наступает. Если вместо пластин поместить целлофан, то хотя и с опозданием начинается деление одиночных клеток (рисунок 8).
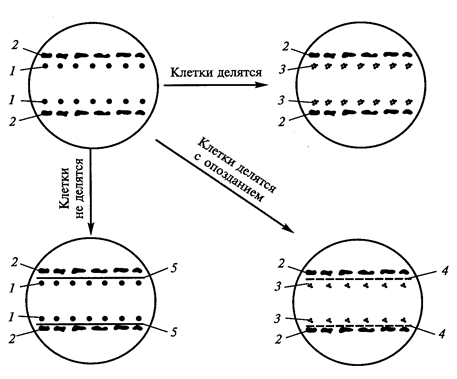
Рис. 8. Доказательство химической природы фактора кондиционирования (Егорова Т.А. и сотр., 2003): 1 – одиночные клетки; 2 – ткань-«нянька»; 3 – делящиеся клетки; 4 – целлофан; 5 – стеклянные пластинки.
Культуры клеток и тканей растений нашли широкое применение в биотехнологии: массовое клональное микроразмножение плодовоовощных и декоративных растений, их оздоровление от вирусных и других инфекций, синтез вторичных метаболитов. Известно около 20000 синтезируемых растениями вторичных метаболитов, используемых человеком: компоненты пищи, лекарства, красители, эфирные масла и др. Способность интактных растений синтезировать различные соединения обосновала предположение о возможности получение таких веществ с помощью культур клеток, тканей и органов. Это направление оказалось весьма перспективным. Синтез вторичных метаболитов происходит главным образом в суспензионной культуре клеток, в регулируемых условиях. Поэтому он не зависит от климатических факторов, от повреждения насекомыми. Культуры выращивают на малых площадях. Культуры клеток растений могут синтезировать практически все классы соединений вторичного обмена, причем довольно часто в количествах, в несколько раз превышающих их синтез в целых растениях. В культурах клеток может начаться синтез веществ, не характерных для исходного растения, либо расширяется набор синтезируемых соединений. Важная особенность культивируемой популяции клеток – ее стабильность в отношении синтеза и накопления продуктов вторичного синтеза. Синтез вторичных метаболитов в культивируемых клетках связан с внутриклеточными органеллами (тблица 2).
Таблица 2 - Внутриклеточная локализация синтеза и накопления вторичных метаболитов (Бутенко Р.Г., 1999)
| Внутриклеточные метаболиты | Синтез | Накопление |
| Алкалоиды | Пластиды, цитоплазма | Вакуоль, хлоропласты, СП |
| Монотерпены Тритерпены | Лейкопласты Хлоропласты, лейкопласты | СП Вакуоль, СП, цитозоль |
| Флавоноиды Танины Кумарины Оксикоричные кислоты | Хлоропласты Вакуоль, пластиды Вакуоль, хлоропласты ЭПР, хлоропласты, МХ | Вакуоль, хлоропласты Вакуоль, СП, ЭПР Вакуоль Вакуоль, хлоропласты |
| Цианогенные гликозиды | ЭПР | Вакуоль |
| Глюкозинолаты | ЭПР | Вакуоль |
| Бетаины | Цитозоль | Вакуоль |
Примечание: СП – свободное пространство клетки, ЭПР – эндоплазматический ретикулум, МХ – митохондрии.
Технология рекомбинантных ДНК (молекулярное клонирование или генетическая инженерия) – это совокупность экспериментальных процедур, позволяющая осуществлять перенос генетического материала (ДНК) из одного организма в другой. Рассмотрим типичную процедуру.
1. Из организма – донора нужных генов – экстрагируют нативную ДНК (клонируемая ДНК, встраиваемая ДНК, ДНК-мишень, чужеродная ДНК). Эту ДНК подвергают ферментативному гидролизу и соединяют с другой ДНК (вектор для клонирования, клонирующий вектор) с образованием новой, рекомбинантной молекулы. Образуется новая рекомбинантная молекула: конструкция «клонирующий вектор – встроенная ДНК».
2. Эту конструкцию вводят в клетку-хозяина (реципиент), где она реплицируется и передается по наследству при каждом делении. Этот процесс называется трансформацией.
3. Отбирают клетки, несущие рекомбинантную ДНК (трансформированные клетки).
4. Получают специфический белковый продукт, синтезированный клетками-хозяевами, что служит подтверждением клонирования искомого гена.
Успех молекулярного клонирования зависит:
1) от возможности воспроизводимо разрезать молекулу ДНК на фрагменты определенного размера;
2) способа их целенаправленного транспорта;
3) высокоспецифичного отбора клеток с клонированным геном и возможности индукции его экспрессии.
Для точного разрезания молекул ДНК используют высокоспецифичные ферменты рестриктазы -бактериальные рестрицирующие эндонуклеазы типа II. Например, одна из первых рестрицирующих эндонуклеаз II типа была выделена из бактерии E. coli и получила название EcoRI. Этот фермент узнает участок ДНК, содержащий специфическую палиндромную последовательность (перевертыш типа «кок», «шалаш») G-A-A-T-T-C, и катализирует разрыв между остатками гуанина (G) и аденина (А) в каждой цепи.
↓
Р-цепь-Г-А-А-Т-Т-Ц-цепь-ОН
НОцепь-Ц-Т-Т-А-А-Г-цепь-Р →
↑
Р-цепь-Г-ОН + Р-цепь-А-А-Т-Т-Ц-цепь-ОН
НОцепь-Ц-Т-Т-А-А-цепь-Р НО-Г-цепь-Р
Происходит расщепление связи между атомом кислорода при 3′-атоме углерода дезоксирибозного остатка одного нуклеотида и фосфатной группой, присоединенной к 5′-углеродному атому дезоксирибозы соседнего нуклеотида. Разрывы в цепи ДНК располагаются наискось друг от друга, в результате чего образуются одноцепочечные комплементарные концы с «хвостами» из четырех нуклеотидов в каждом (липкие концы). Каждый одноцепочечный «хвост» заканчивается 5′-фосфатной группой, а 3′-гидроксильная группа противоположной цепи как бы утоплена. К настоящему времени получены тысячи рестриктаз; их номенклатура: род микроорганизма обозначается прописной буквой, а вид – двумя строчными, штамм обычно не указыается; римские цифры – порядковый номер данной эндонуклеазы в ряду прочих рестриктаз, выделенных из данного микроорганизма (см. выше EcoRI). Палиндромные последовательности, которые атакуют рестриктазы называют сайтами узнавания. Рестриктазы существуют двух типов: 1) катализируют косое расщепление двойной спирали ДНК с образованием «липких концов» и 2) катализируют перпендикулярный разрыв с образованием «тупых концов».
Приведем примеры наиболее часто используемых ферментов рестрикции (таблица 3).
Таблица 3 - Нуклеотидные последовательности, распознаваемые типичными ферментами рестрикции (по Б.Глик и Дж. Пастернак 2002)
| Фермент | Сайт узнавания | Место разрыва | Характер концов |
| EcoRI | ГААТТЦ | Г-А | Выступающие концы |
| BamHI | ГГАТЦЦ | Г-Г | Выступающие концы |
| Pstl | ЦТГЦАГ | А-Г | Выступающие концы |
| Sau3AI | ГАТЦ | Х-Г | Выступающие концы |
| PvuII | ЦАГЦТГ | Г-Ц | Тупые концы |
| HpaI | ГТТААЦ | Т-А | Тупые концы |
| HaeIII | ГГЦЦ | Г-Ц | Тупые концы |
| NotI | ГЦГГЦЦГЦ | Г-Ц | Выступающие концы |
Рестриктазы используют для 1) изучения последовательности нуклеотидов в ДНК и 2) в генетической инженерии. В последнем случае рекомбинантные ДНК получают, когда два разных образца ДНК обрабатывают одной и той же рестриктазой с образованием фрагментов с липкими концами, а затем смешивают эти образцы. Благодаря комплементарному спариванию липких концов фрагментов разных образцов ДНК могут образовываться новые комбинации генов.
Этот ключевой механизм молекулярного клонирования поддерживается тремя способами:
1. Фрагменты ДНК, образующие комплементарные дуплексы в области липких концов удерживаются водородными связями недостаточно прочно, чтобы молекулы в растворе оставались стабильными длительное время. Для стабилизации используют фермент ДНК-лигаза бактериофага Т4, который катализирует образование фосфодиэфирных связей между концами полинуклеотидных цепей, которые уже удерживаются вместе благодаря спариванию липких концов. Этот же фермент способен «сшивать» тупые концы, которые сближаются друг с другом после связывания с ферментом.
2. Объединение разных молекул ДНК (образование рекомбинантных ДНК) требует их реплицирования в клетке-хозяине. Следовательно, одна часть рекомбинантной молекулы ДНК должна нести нужный ген, который предполагается клонировать, а другая – должна содержать информацию, необходимую для репликации в клетке рекомбинантной ДНК (клонирующие векторы).
3. При рестрикции ДНК образуется смесь разнообразных фрагментов, а затем после их лигирования с векторной ДНК образуется множество различных комбинаций. Поэтому существуют специальные системы скрининга для распознавания реципиентных клеток, содержащих ДНК с нужной для клонирования нуклеотидной последовательностью.
Для целенаправленного транспорта выделенного гена в клетку используют плазмидные векторы.Плазмиды – это внехромосомные автономно реплицирующиеся двухцепочечные кольцевые молекулы ДНК, содержащие от 1 до 200 т.п.н. и более. Плазмиды встречаются практически у всех бактерий. Их делят на высококопийные (в клетке 10-100 копий) и низкокопийные (в клетке 1-4 копии). На долю плазмидной ДНК приходится 0,1-5,0% суммарной клеточной ДНК. Классификация плазмид по типу содержащейся информации:
- F-плазмиды содержат информацию для собственного переноса из одной клетки в другую;
- R-плазмиды несут гены устойчивости к антибиотикам;
- плазмиды деградации содержат гены, ответственные за утилизацию необычных метаболитов;
- криптические плазмиды несут гены, выполняющие скрытые (латентные) функции;
- плазмиды с узким спектром хозяев несут специфический сайт начала (инициации) репликации и могут реплицироваться только в клетках одного вида;
- плазмиды с широким спектром хозяев – содержат неспецифичный сайт инициации репликации, что позволяет им реплицироваться в разных бактериальных клетках.
Для целей генетической инженерии требуются плазмиды, обладающие тремя важными свойствами:
1) небольшой размер (менее 15 т.п.н.) необходимый для эффективного переноса;
2) наличие уникального сайта рестрикции, в который может быть осуществлена вставка;
3) наличие одного или более селективных генетических маркеров для идентификации реципиентных клеток, несущих рекомбинантную ДНК.
Природные (не модифицированные) плазмиды обычно лишены одного или нескольких свойств, необходимых для эффективного переноса, поэтому качественные плазмидные векторы приходится также создавать методами генетической инженерии.
В технологии рекомбинантных ДНК классическим является плазмидный вектор рВR322. Номенклатура: р – от английского plasmid, следующие буквы имеют отношение к описанию вектора или истории его создания (для данного вектора буквы BR указывают на авторство Ф. Боливара и Р. Родригеса); цифра 322 номер из исследовательского протокола. Размер плазмиды рВR322 4361 п.н. Эта плазмида имеет:
- два гена устойчивости к антибиотикам ампициллину (AmpR) и тетрациклину (TetR);
- уникальные сайты узнавания ферментами рестрикции для BamH1, HindIII, SalI в гене TetR, один PstI-сайт в гене AmpR (разрыв генов TetR и AmpR и встраивание в это место клонируемого гена лишит трансформированную плазмидой клетку устойчивости к соответствующему поврежденному гену антибиотику – тетрациклину или ампицициллину);
- один сайт для EcoRI, находящийся за пределами кодирующих последовательностей;
- сигнал начала репликации, обеспечивающий репликацию исключительно в бактериальных клетках кишечной палочки.
Принцип работы плазмидного вектора рВR322:
1. Плазмиду рВR322 обрабатывают рестриктазой, которая катализирует ее разрыв в единственном сайте, расположенном в одном из генов устойчивости к тому или иному антибиотику. Образуется линейная молекула с липкими концами.
2. Донорную ДНК, содержащую нужный ген, обрабатывают той же рестриктазой, что приводит к образованию фрагментов ДНК с липкими концами.
3. Линейные молекулы плазмиды рВR322 смешивают с обработанной донорной ДНК. Поскольку липкие концы этих двух ДНК взаимно комплементарны, они спариваются с образованием гибридных молекул.
4. Для стабилизации гибридных молекул ДНК производят обработку ДНК-лигазой фага Т4 в присутствии АТФ. В результате этого образуется множество разных комбинаций фрагментов. Кроме того, образуются нежелательные продукты, объединяющие между собой фрагменты донорной ДНК и исходные плазмидные ДНК. Для их уменьшения обрабатывают рестрицированную плазмидную ДНК щелочной фосфатазой, отщепляющей от линейной молекулы 5′-фосфатные группы. В результате ДНК-лигаза не сможет сшить концы дефосфорилированной линейной плазмидной ДНК. Что касается собственно рекомбинантных молекул ДНК, то два из четырех одноцепочечных разрыва при действии ДНК-лигазы устраняются, и конструкция оказывается стабильной благодаря образовавшимся фосфодиэфирным связям.
5. После введения гибридной ДНК в клетку хозяина происходит ее репликация и образуются новые кольцевые молекулы уже без разрывов.
Трансформация и отбор.Введение рекомбинантной ДНК в клетку-хозяина называется трансформацией. Для ее осуществления используют специально разработанные приемы, например, подвергают клетки высокотемпературному воздействию и обрабатывают их хлоридом кальция. Однако эффективность трансформации остается низкой. Положительный результат получается примерно в одной клетке из тысячи (введение в клетку плазмиды со встроенным фрагментом чужеродной ДНК – гибридная плазмида). Проникновение в клетку экзогенной ДНК еще не означает, что она будет поддерживаться в клетке-хозяине. Для сохранения рекомбинантной ДНК в клетке-хозяине в первоначальном виде необходимо отсутствие генов, кодирующих синтез эндогенных рестриктаз, разрушающих ДНК. Необходимо также, чтобы клетка имела фенотип RecA- (такие клетки неспособны к общей рекомбинации).
Следующий этап – это идентификация клеток, содержащих рекомбинантную ДНК. При использовании плазмиды рВR322, в которой чужеродная ДНК встраивается в сайт BamHI, специфическая идентификация состоит из двух этапов:
1. Клетки после трансформации высевают на питательную среду, содержащую ампицилин. Вырастают только клетки с наличием интактного гена AmpR (или в составе интактной плазмиды рВR322, или в составе гибридной плазмиды). Нетрансформированные клетки чувствительны к ампициллину. Сайт BamHI расположен в гене TetR плазмиды рВR322; встраивание в этот ген фрагмента ДНК прерывает кодирующую последовательность, в результате чего устойчивость к тетрациклину утрачивается. Следовательно, клетки, которые несут гибридную плазмиду, устойчивы к ампициллину, но чувствительны к тетрациклину, а клетки, получившие интактную плазмиду рВR322, несут ген TetR и устойчивы как к ампициллину, так и к тетрациклину.
2. Клетки, выросшие на среде с ампициллином, переносят на среду с тетрациклином. Клетки, образующие колонии на чашках с тетрациклином, содержат интактную плазмиду рВR322 (они устойчивы к обоим антибиотикам). Клетки, не выросшие на среде с тетрациклином, чувствительны к этому антибиотику, а значит они содержат гибридную плазмиду рВR322. Среди колоний, выросших на среде с ампициллином, выделяют те, которые оказались чувствительны к тетрациклину, и из каждой колонии получают индивидуальные клеточные клоны. Чаще объединяют все колонии, устойчивые к ампициллину и чувствительные к тетрациклину, культивируют их вместе. Далее проводят дополнительный скрининг и идентифицируют те клетки, которые несут гибридную плазмиду рВR322 со специфической вставкой.
В настоящее время известно много плазмидных векторов. Например, на основе плазмиды pUC создан вектор, содержащий ген, который кодирует убивающий клетку белок. Этот остроумный подход позволяет облегчить сортировку и выделение трансформированных клеток.
Итак, системы клонирования должны включать 1) несколько сайтов для специфической рестрикции; 2) удачную структуру вектора, транспортирующего клонируемый ген; 3) достаточно простую идентификацию клеток с рекомбинантными ДНК. Уникальные сайты рестрикции выполняют в опытах с рекомбинантной ДНК двойную функцию: 1) обеспечивают встраивание чужеродной ДНК в вектор; 2) обеспечивают вырезание клонированной последовательности из вектора. Для рутинных процедур молекулярного клонирования используют E.coli, Bacillus subtilis, Agrobacterium tumefaciens. Во многих случаях в векторы, которые функционируют в E.coli, можно встроить второй сайт инициации репликации, обеспечивающий их репликацию в других клетках. Это так называемые челночные векторы позволяют сначала проводить клонирование в E.coli, а затем внедрять готовую конструкцию в другие клетки.
Геномная библиотека. Процесс разделения геномной ДНК на клонируемые элементы и введение этих элементов в клетки-хозяева называется созданием геномной библиотеки (банка клонов, банка генов).
Для молекулярной биотехнологии важна идентификация структурных генов, кодирующих определенные белки. У прокариот структурные гены непрерывны, а у эукариот кодирующие участки генов – экзоны разделены некодирующими – интронами. Поэтому технологии клонирования генов у прокариот и эукариот имеют различия.
У прокариот нужная последовательность для клонирования (ДНК-мишень) часто не превышает 0,02% от суммарной хромосомной ДНК. Технология клонирования и отбора ДНК-мишени включает: 1) гидролиз суммарной ДНК рестриктазой; 2) каждый из получившихся фрагментов встраивают в вектор; 3) обнаружение специфической клеточной линии (клон), которая несет нужную последовательность; 4) выделение и характеристика этой клеточной линии. У эукариот (прерывистые гены) вначале выделяют иРНК, затем с помощью обратной транскриптазы синтезируют кДНК (ДНК, комплементарная иРНК) и уже ее используют для молекулярного клонирования и создания геномной библиотеки.
Следующий после создания геномной библиотеки этап – это поиск клона (клонов), несущего искомую последовательность ДНК. Для этого используют три метода.
1. Гибридизация с меченым ДНК-зондом с последующим радиоавтографическим анализом. После трансформации высевают клетки на чашки с питательной средой и переносят выросшие колонии на твердую подложку (нитроцеллюлозный или нейлоновый фильтр). Лизируют клетки. Производят депротеинизацию и денатурацию ДНК. Фиксируют ДНК на подложке. Наносят на фильтр меченый зонд и производят отжиг, а затем радиоавтографию. Колонии на исходной чашке, которые содержат гибридизовавшуюся ДНК, выделяют и культивируют.
2. Иммунологический скрининг. В результате экспрессии клонированного гена образуется белок, который можно обнаружить иммунологическими методами. Для этого все клеточные линии (клоны) библиотеки высевают на чашки с питательной средой. Выросшие колонии переносят на фильтр, клетки лизируют, а высвободившиеся белки фиксируют на фильтре. Затем на фильтр наносят первые антитела, которые специфически связываются с данным белком (антигеном). Все несвязавшиеся антитела удаляют, а фильтр помещают в раствор вторых антител, специфичных в отношении первых антител. Во многих тест-системах используют конъюгаты вторых антител с ферментом (например, щелочной фосфатазой). После отмывания фильтра добавляют бесцветный субстрат. Если вторые антитела связываются с первыми, то под действием фермента происходит гидролиз субстрата с образованием окрашенного вещества в том месте, где идет реакция.
3. Скрининг по активности белка. Если искомый ген кодирует фермент, не синтезируемый клеткой-хозяином, то для обнаружения клонов используют цветную реакцию, катализируемую данным ферментом.
Клонирование крупных фрагментов ДНК. Чтобы иметь возможность клонировать целый ген, донорную ДНК расщепляют лишь частично. При этом получаются фрагменты разной длины, из которых затем создают геномную библиотеку. Для клонирования крупных фрагментов ДНК были сконструированы векторы на основе бактериофагов лямбда и Р1, а также плазмиды F.
В заключение этого раздела пособия следует отметить, что конечный результат молекулярного клонирования ДНК лишь тогда положителен, если будет доказано получение нативного структурного гена.
Для целей молекулярного клонирования используются химический синтез, определение нуклеотидной последовательности и амплификация ДНК.
Химический синтез ДНКиспользуют для получения 1) одноцепочечных цепей дезоксирибонуклеотидов (олигонуклеотиды) и 2) двухцепочечных цепей ДНК (синтез генов).
Синтез олигонуклеотидов длиной около 50 нуклеотидов осуществляется с помощью ДНК-синтезаторов с использованием фосфорамидитного метода. В отличие от биологического синтеза ДНК (присоединение каждого последующего нуклеотида по 3′-ОН группе дезоксирибозы, в химическом синтезе каждый новый нуклеотид присоединяется к 5′-ОН группе, т.е. 5′-концу олигонуклеотида). Синтезированные олигонуклеотиды используются:
- для конструирования фрагментов или целых генов;
- для амплификации (усиление синтеза) специфических фрагментов ДНК;
- для направленных мутаций изолированных ДНК;
- в качестве зондов при гибридизации (нуклеотидную последовательность зондов длиной 20-40 звеньев находят из данных об аминокислотной последовательности соответствующих белков);
- в качестве линкеров, облегчающих клонирование (линкер – синтетический олигонуклеотид, содержащий сайт рестрикции; используется для соединения векторной и клонируемой ДНК, к концам которой по методу сшивания тупых концов присоединены линкеры);
- олигонуклеотиды длиной 17-24 звеньев служат праймерами при секвенировании ДНК и проведения полимеразной цепной реакции (ПЦР).
Синтез генов из химически синтезированных отдельных комплементарных цепей олигонуклеотидов. Как правило, синтетические двухцепочечные гены собирают из модулей – одноцепочечных фрагментов длиной от 20 до 60 нуклеотидов с перекрывающимися концами. Нуклеотидные последовательности цепей задают так, чтобы после отжига (образование комплементарных двухцепочечных фрагментов) концевые сегменты гена имели тупые концы. Каждый внутренний сегмент имеет выступающие 3′- и 5′-концы, комплементарные таковым соседнего сегмента. После сборки гена остается сшить одноцепочечные разрывы с помощью ДНК-лигазы Т4. Синтетические гены могут быть сконструированы так, чтобы помимо белок-кодирующих последовательностей они содержали концевые участки, обеспечивающие:
- встраивание в клонирующий вектор (сайты для рестриктаз);
- сигнальные последовательности для правильной инициации и терминации транскрипции и трансляции..
Секвенирование ДНК– это определение нуклеотидной последовательности полинуклеотидных цепей. Без знания нуклеотидной последовательности генов невозможно осуществлять молекулярное клонирование. Для секвенирования используют несколько методов.
1. Дидезоксинуклеотидный метод. Дидезоксинуклеотид – это полученный искусственным путем нуклеотид, лишенный 2′- и 3′-гидроксильных групп при углеродных атомах сахара. У дезоксирибонуклеотидов, входящих в ДНК, отсутствует только 2′-гидроксильная группа. Как указано выше, удлинение цепи во время репликации ДНК происходит в результате присоединения очередного нуклеозидтрифосфата к 3′-гидроксильной группе последнего нуклеотида растущей цепи. Если же присоединяемым нуклеотидом является дидезоксинуклеотид, то синтез ДНК останавливается, поскольку следующий нуклеотид не может образовать фосфодиэфирную связь. Остановка синтеза ДНК – ключевой этап дидезокси-метода. Для секвенирования в разных пробирках одновременно проводят четыре реакции синтеза ДНК, каждая – в присутствии одного из четырех дидезоксинуклеотидов (ддАТФ, ддГТФ, ддЦТФ и ддТТФ). Продукты реакций разделяют с помощью гель-электрофореза, проводят радиоавтографию и «считывают» с радиоавтографа нуклеотидную последовательность синтезированного фрагмента ДНК.
2. Для секвенирования более длинных генов используют систему на основе фага М13. В ДНК фага встраивают фрагмент ДНК длиной до 500 нуклеотидов, который хотят секвенировать. Эту рекомбинантную ДНК легко получить в одноцепочечной форме и использовать ее в качестве матрицы для секвенирования вставки. Можно использовать также двухцепочечные плазмиды, содержащие клонированную ДНК.
3. Для определения нуклеотидной последовательности протяженных клонированных сегментов сначала подбирают синтетический олигонуклеотидный праймер, комплементарный участку, соседствующему со вставкой. Затем с помощью дидезокси-метода секвенируют первые 250-300 нуклеотидов. Затем по результатам секвенирования синтезируют второй праймер и определяют последовательность следующих 250-350 нуклеотидов клонированного участка и т.д. Этот метод, называемый «праймер-опосредованной прогулкой» (или «блуждающей затравкой»), позволяет секвенировать протяженные фрагменты ДНК без их субклонирования, как в случае системы на основе фага М13.
В таблице 4 представлен прогресс в секвенировании генов.
Таблица 4 - Историческая справка о секвенировании ДНК генов (Primrose S.B., Twyman R.M., 2003)
| Секвенированный ген | Год | Размер гена | Комментарий |
| Бактериофаг фх174 | 5,38 kb | Первый ген | |
| Плазмида рBR322 | 4,30 kb | Первая плазмида | |
| Бактериофаг А | 48,5 kb | ||
| Вирус Эпштейн-Барра | 172 kb | ||
| Дрожжевая хромосома III | 315 kb | Первая хромосома | |
| Haemophylus influence | 1,8 Мb | Первый геном организма-клетки | |
| Saccharomyces cerevisiae | 12 Mb | Первый геном клетки-эукариота | |
| Ceanorhabditis elegans | 97 Mb | Первый геном мультиклеточного организма | |
| Drosophila melanogaster | 165 Mb | ||
| Arabidopsis thaliana | 125 Mb | Первый геном растения | |
| Homo sapiens | 3000 Mb | Первый геном млекопитающего | |
| Pufferfish (Fugu rubripes) | 400 Mb | Наименьший геном позвоночных | |
| Мышь (Mus musculis) | 2002/3 | 2700 Mb | Генетическая модель человека |
Полимеразная цепная реакция (ПЦР)– это эффективный способ получения in vitro большого числа копий специфических нуклеотидных последовательностей (Kary Mullis; США, патент 4,683,202). Их амплификация (иногда в миллионы раз) осуществляется в ходе трехэтапного циклического процесса. Для ПЦР необходимы:
- два синтетических олигонуклеотидных праймера (длиной примерно по 20 нуклеотидов), комплементарные участкам ДНК из противоположных цепей, фланкирующим последовательность-мишень; 3′-гидроксильные группы праймеров после отжига с ДНК должны быть ориентированы навстречу друг другу (таким образом отмечаются начальный и конечный участки нужного фрагмента на ДНК-матрице);
- ДНК-мишень длиной от 100 до 35000 п.н.;
- термостабильная ДНК-полимераза Taq, выделенная из бактерий Thermus aquaticus, которая не теряет своей активности при температуре 95 ˚С и выше;
- четыре дезоксирибонуклеотида;
- буфер, содержащий ионы магния.
Этапы ПЦР:
1. Денатурация (плавление). Для денатурации ДНК (расхождение цепей) ее выдерживают до 1 мин. При 95 ˚С. Помимо ДНК, в реакционной смеси содержатся в избытке два праймера, термостабильная ДНК-полимераза и четыре дезоксирибонуклеотида.
2. Ренатурация (отжиг). Температуру смеси медленно понижают до 55 ˚С, при этом праймеры спариваются с комплементарными последовательностями ДНК.
3. Синтез (элонгация). Температуру повышают до 75 ˚С, т.е. температурного оптимума для ДНК-полимеразы Taq. Начинается синтез комплементарной цепи ДНК, инициируемой 3′-гидроксильной группой праймера.
Все реакции проводятся в регулируемом термостате с повторением циклов, продолжительностью 3-5 мин. Эти циклы повторяют до 30 раз.
Применение метода ПЦР:
- Идентификация патогенных микроорганизмов, возбудителей заболеваний человека, животных и растений. Для синтеза праймеров, специфичных в отношении исключительно ДНК-мишени, необходимо знать нуклеотидную последовательность ДНК предполагаемого патогенного микроорганизма. В этом случае в ходе ПЦР будет амплифицироваться только фрагмент ДНК, длина которого равна суммарной длине двух праймеров и фрагмента ДНК между ними.
- Получение кДНК (ДНК, комплементарные информационной РНК, иРНК). Метод называют RACE (rapid amplification of cDNA ends). Обычно получают кДНК, комплементарные 3′- и 5′- концам мРНК (3′RACE и 5′RACE). В случае 3′RACE праймером для синтеза первой цепи кДНК является олиго(дТ) с присоединенным к нему вторым праймером (Р). Олиго(дТ) спаривается с поли(А)-хвостом иРНК (3′-конец молекулы). С помощью обратной транскриптазы на матрице иРНК синтезируется цепь кДНК. На матрице синтезированной цепи кДНК синтезируется вторая цепь и затем в последовательных циклах ПЦР с введением «внутренних праймеров» накапливаются значимые количества кДНК, комплементарной 3′концу иРНК.
- Синтез генов с помощью ПЦР.
- Выделение делеций или вставок в генах, ответственных за то или иное наследственное заболевание. Например, определение мутаций с помощью аллельспецифических проб производится следующим образом. Синтезируются 2 коротких 32Р-олигодезоксирибонуклеотида, один из которых содержит ДНК-последовательность, включающую мутацию, а другой не изменен. С помощью этих аллельспецифичных проб ДНК пациентов проверяют на носительство исследуемой мутации. Для этого область гена, содержащую интересующий участок, амплифицируют с помощью ПЦР. Образцы наносят на узкие полоски нитрата целлюлозы и обрабатывают мечеными олигонуклеотидами, содержащими нормальную или мутантную последовательность. Радиоавтографически оценивают, с какой из проб преимущественно связывается ДНК пациента.
Ферменты (энзимы) - биологические катализаторы белковой природы. Происхождение терминов: fermentatio (лат.) - брожение; enzyme (греч.) - в дрожжах. Открытие ферментов было связано с процессами, идущими с выделением газов (тесто, вино), а следовательно, это явление человек наблюдал и использовал тысячелетия. В настоящее время при помощи ферментов получают фруктозный сироп, L-аминокислоты, лекарства и многие пищевые продукты.
Ферментативный катализ отличается от неорганического:
1) Ферменты действуют в мягких условиях организма (Р, t°, pH).
2) Белки-ферменты чувствительны к денатурирующим агентам.
3) Для действия ферментов характерна высокая эффективность.
4) Активность ферментов контролируется (генетически на уровне строения и различными биорегуляторами).
5) В организме, как правило, действуют полиферментные (т.е. поликаталитические) системы, в результате чего достигается многоэтапное направленное превращение вещества с допустимыми для организма уровнями перепада энергии. Например: в пробирке Н2 + О2 ® Н2О + взрыв (гремучий газ); в организме та же реакция, но за счет разбивания ее на фазы протекает без взрыва, а с запасанием энергии в виде АТФ.
6) Для действия ферментов характерна специфичность (четыре вида). а) Абсолютная - фермент катализирует превращение строго определенного вещества (уреаза расщепляет только мочевину на СО2 и NH3). б) Относительная - фермент катализирует превращения одного типа связей в ряду близких по химическому строению веществ. Например: липаза катализирует разрыв сложноэфирных связей, независимо от типа радикала. в) Групповая относительная, то же, но для разрыва связи важны образующие ее атомные группировки. Все протеолитические ферменты расщепляют пептидные связи, но пепсин, трипсин, химотрипсин расщепляют пептидные связи, образованные определенными аминокислотами. г) Стереохимическая - фермент катализирует превращение только одного стереоизомера при наличии рацемата (L-оксидазы превращают L-аминокислоты, но не D-аминокислоты).
Строение ферментов.По строению ферменты бывают простыми и сложными белками. Для сложных белков-ферментов используют следующие обозначения: 1) апофермент - полипептидная часть молекулы фермента; 2) холофермент, прочный природный комплекс апофермента и небелковой части; 3) кофактор - небелковая часть сложного белка-фермента; 4) простетическая группа - прочно связанный с апоферментом кофактор (металлы, гем и др.); 4) кофермент - легко отделяемый кофактор от апофермента (например, диализом) (витамины, нуклеотиды и др.) Апофермент всегда синтезируется в организме, кофакторы (витамины, металлы и др.) должны поступать с пищей. Ферментативный катализ идет на поверхности фермента. Превращаемые вещества называются субстратами. Превращение субстрата происходит в области активного центра, который сформирован в третичной структуре большинства ферментов. У простых белков-ферментов активный центр образован сближенными в пространстве радикалами аминокислот первичной структуры. У сложных белков-ферментов здесь находятся кофакторы. В активном центре выделяют 2 части: якорная (радикалы аминокислот обеспечивают фиксацию субстрата) и каталитическая (радикалы аминокислот и (или) кофакторы обеспечивают катализ). Коферменты определяют природу катализируемой реакции. По выполняемым функциям коферменты можно разделить на три группы:
- переносящие ионы водорода или электроны; связаны с окислительно-восстановительными ферментами (НАД, НАДФ, ФАД);
- участвующие в переносе групп атомов (АТФ, КоА, тетрагидрофолат, пиридоксальфосфат);
- катализирующие реакции синтеза, распада и изомеризацию углеродных связей (тиаминпирофосфат, биотин, производные витамина В12).
У ряда регуляторных ферментов имеется еще один центр - аллостерический. Присоединение к этому центру низкомолекулярных веществ (эффекторов) индуцирует изменение третичной структуры фермента, в том числе и в области активного центра. Это и ведет к изменению каталитической активности фермента.
Белки-ферменты с четвертичной структурой могут катализировать одну и ту же реакцию, но несколько отличаться по строению (т.е. первичной структуре) субъединиц. Если это закреплено генетически - мы говорим об изоферментах. Например, фермент лактатдегидрогеназа состоит из 4-х субъединиц 2-х типов Н и М и возможно 5 вариантов, т.е. изоферментов.
В настоящее время описано более 2000 ферментов. Молекулярная масса ферментов составляет от 150000 до миллиона Да и выше.
| k+1 k2 Ферментативный катализ идет в 3 стадии: E + S ¬® ES ® (EZ - EP) —®E + P k-1 |
Механизмы действия ферментов.1) По Фишеру: субстрат подходит к ферменту (т.е. активному центру) как ключ к замку. 2) По Кошланду: субстрат изменяет конформацию активного центра фермента, делая ее комплементарной (индуцируемая адаптация фермента к субстрату; рука - перчатка).
1) Образование фермент-субстратного комплекса: E + S « ES быстрая стадия, соответствующая фиксации субстрата на якорном участке активного центра. Ускорение реакции достигается за счет сближения и правильной ориентации субстратов относительно друг друга и увеличения их эффективной концентрации (поскольку в растворе их столкновения случайны). 2) ES ® EZ ® EP На стадии фермент-субстратного комплекса происходит химическая реакция через переходное состояние с образованием продукта реакции на поверхности фермента. Как правило, субстрат вступает во временные промежуточные реакции (взаимодействия) с определенными функциональными группами активного центра, в результате чего реакция требует более низкой энергии активации. 3) EP ® E + P. Продукт отделяется, а фермент в неизменном виде может вновь вступать в катализ.
Факторы, влияющие на скорость ферментативных реакций.1) Влияние концентрации субстрата. При увеличении концентрации субстрата и при постоянной концентрации фермента скорость реакции вначале увеличивается линейно (реакция первого порядка), затем переходит в реакцию смешенного порядка и, достигнув Vmax, превращается в реакцию нулевого порядка.
По Михаэлису-Ментен скорость реакции описывается уравнением:
| Vmax × [S] разделить на [S] Vmax k-1 V= ¾¾¾¾¾ ¾¾—¾¾¾® ¾¾¾ , где Ks = ¾— Ks + [S] 1 + Ks k+1 [S] |
(константа диссоциации комплекса ES равна отношению констант скоростей обратной и прямой реакции).
| Vmax V = ¾¾¾¾ , 1 + Km [S] |
Это уравнение описывает участок реакции первого порядка. Для описания всей кривой Бриггс и Холдейн модифицировали уравнение:
где Km - константа Михаэлиса: это такая концентрация субстрата, при которой V = 1/2 Vmax. Величина Кm определяется графически по кривой зависимости V от [S]: по оси ординат откладывают Vmax/2, опускают перпендикуляр на кривую и от точки пересечения опускают перпендикуляр на ось абсцисс. Отмеченный отрезок и есть Кm. Если Кm велика, то это означает, что потребуется много субстрата для достижения Vmax/2 (сродство фермента к субстрату низкое, медленная скорость реакции). Низкая величина Кm указывает, что для достижения половинной скорости требуется мало субстрата (высокое сродство, высокая скорость реакции). Для точного измерения величин Vmax и Km используют график прямой, построенный на основании модифицированного уравнения Михаэлиса-Ментен (график Лайнуивера и Берка):
| 1 Km 1 1 ¾ = ¾¾— × ¾¾ + ¾—¾ V Vmax [S] Vmax |
2) Влияние концентрации фермента. При условии избытка субстрата скорость ферментативной реакции зависит от концентрации фермента. Эта зависимость подчиняется уравнению прямой V = k × [E], где [E] - концентрация фермента.
3) Влияние температуры. Скорость химической реакции повышается в 2-4 раза при повышении температуры на 10°С. Однако из-за белковой природы фермента повышение температуры приведет к тепловой денатурации молекул фермента. Поэтому оптимум температуры для ферментов растений при 45-50 °С, а для ферментов теплокровных ~37 °C. Есть исключения: миокиназа мышц выдерживает температуру 100 °C.
4) Влияние рН среды. Ферменты, подобно всем белковым молекулам несут заряженные группы. Общий заряд белковой молекулы зависит от рН среды. Зависимость скорости ферментативной реакции от величины рН носит колоколообразный характер. Большинство ферментов проявляют максимальную активность в узком диапазоне рН - оптимум рН. Для большинства ферментов оптимум рН ~ 7.4; однако для пепсина 1-1.5; для трипсина 8.6.
Классификация ферментов.Ранее ферменты назывались по наименованию субстрата с добавлением суффикса - аза (amylon - амилаза, lipоs - липаза, protein - протеиназа). Позже, ферменты, катализирующие сходные реакции, получили название по типу реакции: дегидрогеназы, оксидазы, декарбоксилазы и др. Международный Совет Биохимиков (IUB) предложил положить в основу наименования и классификации ферментов тип химической реакции и ее механизм:
1) Реакции и ферменты их катализирующие делят на 6 классов, каждый из которых состоит из 4-13 подклассов: оксидоредуктазы, трансферазы, гидролазы, лиазы, изомеразы, лигазы (синтетазы).
1.1. Оксидоредуктазы. К классу оксидоредуктаз относятся ферменты, катализирующие окислительно-восстановительные реакции с участием двух субстратов А и В: А восстан. + В окислен « А окислен. + В восстан. Систематические названия их составляют по форме "донор: акцептор оксидоредуктазы". Например: ЛГД - лактат: НАД+ оксидоредуктаза (тривиальное название лактатдегидрогеназы). Различают следующие основные оксидоредуктазы: оксидазы (аэробные дегидрогеназы), которые катализируют перенос протонов (электронов) на кислород (на атом кислорода); анаэробные дегидрогеназы, катализирующие перенос протонов (электронов) на промежуточный субстрат, но не на кислород; цитохромы, обеспечивающие перенос только электронов; каталаза и пероксидаза, катализирующие реакции с участием перекиси водорода (перенос протонов и электронов на молекулу кислорода).
1.2. Трансферазы. К классу трансфераз относятся ферменты, катализирующие реакции межмолекулярного переноса групп Х (отличной от атома водорода) с субстрата А на субстрат В: А-Х + В « А + В-Х. Катализируют перенос одноуглеродных остатков, ацильных, гликозильных, альдегидных или кетонных, нуклеотидных остатков, азотистых групп, остатков фосфорной и серной кислот и др. Наименование этих ферментов составляется по форме: “донор: транспортируемая группа - трансфераза". Например, Ацетил-КоА + Холин « КоА + Ацетил-холин. Эту реакцию катализирует фермент ацетил-КоА: холин-О-ацетилтрансфераза (короче - холин-ацетилтрансфераза).
1.3. Гидролазы катализируют гидролиз эфирных, сложноэфирных, пептидных и гликозидных связей, кислородных ангидридов, связей С-С, С-галоген и Р-N, т.е. расщепление внутримолекулярных связей с участием воды. Наименование их составляется по форме: "субстрат - гидролаза". Например, Ацетилхолин + Н2О « Холин + Уксусная кислота. Фермент называется ацетилхолин-ацилгидролаза. К этому классу относят эстеразы (гидролиз и синтез сложных эфиров); гликозидазы (разрыв гликозидных связей); фосфатазы и пептидгидролазы (разрыв фосфоангидридных и пептидных связей) и др.
1.4. Лиазы - это ферменты, отщепляющие группы от субстратов по негидролитическому (без участия воды) механизму, с образованием двойных связей.
Ферменты действуют на связи С-С, С-О, С-N, С-S и С-галоген. Название ферментов: "субстрат-лиаза". Например, L-малат « фумарат + Н2О. Этот фермент называется L-малат-гидролиаза (тривиальное название - фумараза).
К этому классу относят декарбоксилазы (карбокси-лиазы, амилазы-лиазы и др.).
1.5. Изомеразы катализируют различные типы оптических, геометрических и позиционных изомеров). Название этих ферментов составляется с учетом типа реакции: "Субстрат-цис-транс-изомераза (например транс-ретиналь - 11 цис-транс изомераза катализирует превращения транс-ретиналя в 11-цис-ретиналь при восприятии света); "альдегид-кетон-изомераза" (D-глицеральдегид-3-фосфаткетон-изомераза катализирует превращение D-глицеральдегид-3-фосфата в дигидроксиацетонфосфат); если изомеризация включает внутримолекулярный перенос группы, то фермент получает название мутазы. К классу изомераз относят так же рацемазы и эпимеразы.
1.6. Лигазы катализируют соединения двух молекул, сопряженное с разрывом пирофосфатной связи АТФ или другого макроэргического соединения. Систематическое название этих ферментов составляют по форме "А: В лигазы", где через А и В обозначают исходные вещества. В этот класс включены ферменты, катализирующие реакции образования связей С-О, С-S, С-N, С-С. Например, образование С-N связи при синтезе глутамина катализирует фермент L-глутамат: аммиак лигаза, тривиальное название глутаминсинтетаза: АТФ + L-глутамат + NH4+ « АДФ + ортофосфат + L-глутамин.
2) Наименование фермента имеет 2 части. Первая - наименование субстрата или субстратов. Вторая, оканчивающаяся на -аза, показывает тип катализируемой реакции.
3) Дополнительная информация, например, малатдегидрогеназа (декарбоксилирующая): L-малат +НАД+ ® пируват + СО2 + НАДН + Н+.
4) Каждый фермент по классификации ферментов (КФ, ЕС) обозначается четырьмя цифрами: 1-класс, 2-подкласс, 3-подподкласс, 4-номер фермента в списке. Так, КФ 2.7.1.1. означает: класс 2 - трансферазы, подкласс 7 (перенос фосфата), подподкласс 1 (алкогольная группа - акцептор фосфата). Конечное название - гексокиназа, или АТФ:D-гексоза-6-фосфотрансфераза, фермент, катализирующий перенос фосфата с АТФ на гидроксильную группу у 6 углеродного атома глюкозы.
Единицы измерения активности и количества ферментов.Для выражения концентрации фермента рекомендуется стандартная единица (Е). 1) За единицу любого фермента принимается то количество его, которое в оптимальных условиях катализирует превращение 1 мкмоль субстрата в минуту (мкмоль/мин). Для выражения активности фермента пользуются удельной и молекулярной активностями. 2) Удельную активность фермента принято выражать числом единиц ферментативной активности на 1 мг белка. 3) Число молекул субстрата, подвергающихся, превращению одной молекулой фермента в минуту, принято называть числом оборотов, или молекулярной активностью. 4) Предложено новое определение международной единицы фермента, катал (кат), соответствующее количеству фермента, способному вызывать превращение 1 моль субстрата в продукт в 1 сек. (1 моль/с). 1 Е = 16,67 нкат. Удельная активность кат/кг активного белка. Рекомендуется проведение измерений единиц фермента при 25 °С, оптимуме рН и концентрации субстрата, превышающей концентрацию насыщения. В этом случае скорость соответствует нулевому порядку реакции в отношении субстрата и будет зависеть только от концентрации фермента.
В клетках микроорганизмов обнаружено более 1000 видов ферментов. В одной клетке содержится около 100000 молекул ферментов. Каждую реакцию в клетке могут катализировать 50-100 молекул соответствующего фермента. Содержание каждого фермента в клетке составляет 0,1-5,0% общего количества белка.
Источники ферментов.Ферменты животного происхождения преимущественно выделяют из органов, в которых протекают интенсивные биохимические процессы. Из слизистой желудка свиней и крупного рогатого скота получают препарат пепсин. Из поджелудочной железы свиней получают смеси трипсина, химитрипсина, липаз и амилаз (гликозидаз). Из желудка телят выделяют сычужный фермент, широко используемый в сыроделии. Из ферментов растительного происхождения наиболее широко в народном хозяйстве используют амилазы и папаин. Условно ферментным препаратом можно назвать и ячменный солод, в котором содержится до 1% амилаз. Растительный протеолитический фермент – папаин – содержится в плодах дынного дерева. В США ежегодно расходуют около 100 т папаина для обработки (тендеризации, т.е. размягчения) мяса. Папаин при комнатной температуре за 2 часа расщепляет белки соединительной ткани (коллаген, эластин); аналогично действуют протеиназы фицин (из фигового дерева) и бромелин (из ананаса). Из растительного сырья получают также фосфатазы (картофель), пероксидазы (хрен), уреазы (Канавалия мечевидная), амилазы (ячмень).
Содержание ферментов в растениях низкое и получение ферментов из растений носит сезонный характер. Органы животных получают на мясокомбинатах, но при этом возникают проблемы с консервированием и хранением этого вида сырья. Перспективно получение ферментов микробиологическим путем. Технологии генетической инженерии позволяют целенаправленно увеличивать выход необходимого фермента. Кроме того, среди микроорганизмов находят формы, живущие в экстремальных условиях (термофилы, галлофилы и др.). Из них выделяют ферменты с улучшенными свойствами – термостабильные, осмоустойчивые, кислото- и щелочеустойчивые. Для биотехнологии важно, что микроорганизмы могут выделять ряд ферментов из клеток в окружающую среду; это делает этапы выделения и очистки ферментов более технологичными.
Абзимы и рибозимы. Идея W.Jencks (1969) о способности белков-антител катализировать химические реакции была подтверждена в конце 80-х годов прошлого века. Были введены термины «каталитические антитела» или «абзимы» (от antibody enzyme). В настоящее время известны несколько классов химических реакций, катализируемых антителами: ацилтрансферазные, изомеразные, бимолекулярной ассоциации и окислительно-восстановительные.
Абзимы могут быть выработаны для катализа почти всехтхимических реакций. Эта уникальная особенность выгодно отличает абзимы от других биологических катализаторов. Потенциальное число таких химических превращений больше, чем количество реакций, имеющих место в живых системах и катализируемых соответствующими ферментами. По мнению И.В.Семак (2006) , абзимы могут найти самое широкое применение:
1. В органическом синтезе за счет увеличения специфичности катализа, возможности разделения энантиомеров и катализа трудно идущих химических превращений.
2. В медицине для «совершенствования» системы иммунитета, когда антитела, способны не только связывать, но и катализировать разрушение токсинов, бактерий, раковых клеток и др. При этом в организм вводятся либо готовые абзимы, либо безвредные гаптены, обеспечивающие выработку абзимов с нужной каталитической активностью.
Каталитические РНК (рибозимы) были описаны в 80-х годах прошлого века (T.R.Chech et al., 1981; C.Guerrier-Takada et al., 1983). Рибозимы достаточно широко представлены в природе и играют важную роль в эволюции живых организмов, поскольку они могут обеспечивать репродукцию и процессинг РНК без участия белков-ферментов. В частности, рибозимы участвуют в удалении неинформативных интронов из пре-и-РНК, на этапе синтеза белков путем созревания тРНК с помощью рибонуклеазы Р РНК, а также в процессе саморепликации вирусного РНК генома (патогенные вирусы для растений и человека). Ранее неоднократно сообщалось, что синтез белка в рибосомах зависит от уровня рРНК. Активность рибозимов может контролироваться антибиотиками, что открывает новую страницу в профилактике и лечении вирусных заболеваний, включая вакцинацию.
Иммобилизованные ферменты – это ферменты, сохраняющие свою активность при связывании с нерастворимыми носителями (1971 г., Первая конференция по инженерной энзимологии). Преимущества иммобилизованных ферментов:
- являются гетерогенными катализаторами, легко отделяющимися от реакционной среды;
- возможны направленные изменения свойств фермента;
- долговечность и стабильность ферментативного препарата;
- технологичность применения и экономическая выгода.
Ферменты иммобилизуются двумя способами – без возникновения ковалентных связей между ферментом и носителем (физические методы – адсорбция ферментов на нерастворимых носителях; иммобилизация фермента путем включения в гель, иммобилизация ферментов в полупроницаемые структуры) или с образованием ковалентной связи между ними (иммобилизация на носителях, обладающих гидроксогруппами – бромциановый метод; обладающих аминогруппами; обладающих активированными производными карбоксильной группы; иммобилизация на носителях со свободными сульфгидрильными группами (через образование дисульфидных связей).
Методы иммобилизации универсальны для всех видов иммобилизованных биокатализаторов – индивидуальных ферментов, клеток, субклеточных культур, комбинированных препаратов. Использование иммобилизированных клеток удобно, поскольку отпадает необходимость выделения, очистки и хранения изолированного фермента.
Согласно Егоровой Т.А. и соавт. (2003), иммобилизованные клетки микроорганизмов применяют для биотрансформации органических соединений, разделения рацемических смесей, гидролиза ряда сложных эфиров, инверсии сахарозы, восстановления и гидроксилирования стероидов. Иммобилизованные хроматофоры используют в лабораторных установках для синтеза АТФ, а пурпурные мембраны – для создания искусственных фотоэлектрических преобразователей – аналогов солнечных батарей. Разрабатывается реактор на основе иммобилизованных клеток дрожжей для получения этанола из мелассы, в котором дрожжи сохраняли бы способность к спиртовому брожению в течение 1800 ч. Из более чем 2000 известных в настоящее время ферментов иммобилизована и используется для целей инженерной энзимологии примерно десятая часть (преимущественно оксидоредуктазы, гидролазы и трансферазы).
Для осуществления химических процессов с помощью иммобилизованных ферментов применяют колоночные, трубчатые, пластинчатые и танкерные реакторы разного объема и производительности. Иммобилизованные ферментные системы функционируют в биореакторе в виде неподвижной фазы, через которую протекает среда с субстратом, подлежащим химическому превращению (гетерогенный катализ).
В настоящее время в мире разработаны следующие крупномасштабные производства с использованием иммобилизованных ферментов и клеток:
- получение глюкозофруктозных сиропов;
- получение оптически активных L-аминокислот из их рацемических смесей;
- синтез L-аспарагиновой кислоты из фумарата аммония;
- синтез L-аланина из L-аспарагиновой кислоты;
- синтез L-яблочной кислоты из фумаровой кислоты;
- получение безлактозного молока;
- получение сахаров из молочной сыворотки;
- получение 6-аминопенициллиновой кислоты.
Высокая эффективность биологических катализаторов и специфичность их действия делают ферменты идеальными реагентами для аналитической химии. Сейчас созданы искусственные аналитические системы различных конструкций (биосенсоры, датчики, ферментные электроды, проточные анализаторы), содержащие иммобилизованные ферменты и клетки и предназначенные для автоматического детектирования продуктов энзиматического превращения. Точность определения достигается за счет специфичности ферментативного определения вещества. Начаты разработки новых поколений биодатчиков на базе аффинных взаимодействий (биосродства) типа фермент-ингибитор, антиген-антитело, агонист (антагонист)-клеточный рецептор, а также на основе полупроводниковых структур и мезоэлектрического эффекта. Последние два биодатчика дают возможность создавать сенсоры, чувствительные к газам. Это имеет существенное значение для создания роботов, реагирующих на изменение внешних воздействий.
Биосенсоры на основе иммобилизованных ферментов помогают выполнять десятки быстрых и точных анализов при диагностике заболеваний, контролировать содержание вредных веществ (инсектицидов, пестицидов, удобрений) в пищевых продуктах и в воздухе. Биосенсоры нашли применение в решении аналитических задач в химической и микробиологической промышленности, а также в научных исследованиях.
Важную роль в медицине играют исследования по направленному транспорту лекарственных веществ. Чаще используют инкапсулированные ферменты – протеолипосомы. Протеолипосомы, заполненные ферментом аспарагиназой, переносятся кровотоком к зонам скопления аспарагина и поэтому применяются для лечения аспарагинзависимых опухолей. Колонки, заполненные микрокапсулами с ферментом, используют для диализа в аппарате «искусственная почка», которая работает в десятки раз эффективнее обычного аппарата.
Стабилизация ферментов в биотехнологических системах (по И.В.Семак, 2006). В биотехнологических процессах ферменты, как правило, функционируют при повышенных температурах, экстремальных значениях рН, в присутствии высоких концентраций органических растворителей или поверхностно-активных веществ. В связи с этим возникает проблема стабилизации фермента.
Для стабилизации ферментов используют три основных подхода:
1) в среду, в которой хранится фермент или проводится ферментативная реакция, добавляют стабилизирующие вещества (субстраты или их аналоги, органические растворители и соли);
2) фермент химически модифицируют (часто используют бифункциональные реагенты типа глутарового альдегида, которые способны образовывать поперечные связи между аминогруппами и тем самым сохранять активную конформацию фермента в денатурирующих условиях);
3) фермент иммобилизируют на носителе.
Направленная эволюция ферментов как способ оптимизации биотехнологических свойств ферментов. Направленная эволюция фермента включает этапы:
1) создание библиотеки мутированных генов фермента;
2) экспрессия гена в подходящем микробном хозяине;
3) скрининг или селекция продуктов экспрессии, для которых зафиксировано улучшение желаемого параметра;
4) гены, кодирующие ферменты с улучшенными свойствами, снова подвергают мутагенезу с целью накопления полезных мутаций.
Получение полусинтетических ферментов осуществляют при использовании других ферментов или белков, изначально не обладающих ферментативной активностью. Для этого используют три основных подхода:
1. Ковалентная модификация функциональных групп в активном центре путем присоединения аналогов коэнзима.
2. Удаление кофактора и использование образовавшейся полости в качестве активного центра.
3. Конформационная модификация путем изменения нативной конформации белка под воздействием различных физико-химических факторов с последующей фиксацией индуцированных изменений путем образования внутри- и межмолекулярных сшивок.
Биотехнологические основы культивирования микроорганизмов.
Исходная культура (5-10 мл) ↓ Встряхиваемая колба (200-1000 мл)Практикум
Основные компоненты питательных сред: - макроэлементы (азот, фосфор, калий, кальций, сера, магний, железо); - микроэлементы (бор, цинк, медь, марганец, кобальт, йод, молибден);Работа 3. Разделение аминокислот методом тонкослойной ионообменной хроматографии (УИРС).
Принцип метода. Разделение аминокислот из их смеси производят на катионообменной синтетической смоле типа дауэкс 50х8. Удобно пользоваться готовыми пластинками типа «Фиксион 50х8», на которых нанесен сильный катионит в натриевой форме. При нанесении образца на пластинку все аминокислоты должны сорбироваться в стартовой позиции путем их обмена с катионом натрия. Следовательно, все аминокислоты в исходной пробе должны быть в форме катионов, что достигается доведением наносимого раствора до рН ниже 2,2. Удержание аминокислот смолой зависит от степени диссоциации основных и кислотных групп аминокислоты (т.е. от величины их рК), от числа этих групп в молекуле, от способности к гидрофобным взаимодействиям со смолой и некоторых других условий. Ароматические и основные аминокислоты (арг, гис, лиз, фен, тир), а также лейцин прочно удерживаются на катионите. Для их разделения применяют пропускание через слой смолы цитратного буфера рН 5,25 с концентрацией Na+ 0,35 М. В этих условиях все остальные аминокислоты (кислые и нейтральные) приобретают высокую подвижность и идут с фронтом растворителя. Для выявления отдельных аминокислот пластинку опрыскивают раствором нингидрина. Появляются фиолетовые пятна аминокислот, располагающиеся по длине пластинки в последовательности по степени возрастания подвижности аминокислот. Полуколичественная оценка содержания аминокислоты в смеси достигается путем сравнения величины пятна из анализируемого образца с пятном соответствующей стандартной аминокислоты.
Реактивы, исследуемый материал, оборудование
1. Растворы аминокислот. Сначала готовят маточные растворы с концентрацией аминокислоты 40 мкмоль/мл. Для этого в 5 мл 0,01 н раствора HCI растворяют арг – 42 мг, гис – 42 мг, лиз – 36 мг, фен – 33 мг, тир – 36 мг, лей – 26 мг. Из них готовят рабочие растворы каждой аминокислоты, смешивая 0,1 мл маточного раствора и 0,9 мл 0,01 н раствора HCI. В полученных рабочих растворах содержится по 4 мкмоль/мл аминокислоты. 2. Стандартная смесь аминокислот готовится из полученных шести маточных растворов аминокислот, смешивая по 1 мл каждой и доводя общий объем до 10 мл 0,01 н раствором HCI. В полученной стандартной смеси содержатся аминокислоты, каждая из которых с концентрацией 4 мкмоль/мл. 3. Цитратный буфер, рН 5,28 (на 1 л буфера 24,6 г лимонной кислоты, 14,4 г NaOH, 6,8 мл 35% раствора HCI, 0,1 г фенола). 4. Нингидриновый реактив (раствор 1 – 1 г нингидрина в 100 мл ацетона; раствор 2 – 1 г ацетата кадмия в смеси 50 мл ледяной уксусной кислоты и 100 мл воды; рабочий раствор – 100 мл раствора 1 + 20 мл раствора 2).
Ход работы
На пластинке мягким карандашом наносят линию старта на расстоянии 1,5-2,0 см от нижнего края. На этой линии через равные промежутки отмечают 7 точек для нанесения растворов аминокислот. С помощью капилляров в точки наносят по 1,5 мкл (3 касания) рабочих растворов каждой из шести аминокислот и смеси аминокислот (одно касание – 0,5 мкл, что соответствует 2×10-3 мкмоля каждой аминокислоты). Между касаниями пятно подсушивать феном. Нельзя царапать слой катионита капилляром! Таким образом в первые шесть точек внесены последовательно арг, гис, лиз, фен, тир, лей, а в седьмую точку – смесь аминокислот.
В сосуд для хроматографии налить цитратный буфер рН 5,28 на высоту 1 см и поместить пластинку с нанесенными образцами, Стартовая позиция смеси аминокислот должна быть выше уровня налитого буферного раствора, Для разделения аминокислот буфер должен подняться по пластинке ровным фронтом на высоту 15 см. Для этого требуется около двух часов. Процесс разделения можно значительно ускорить, предварительно пропитав пластинки в 10 раз разбавленным буфером и высушив их.
По окончании разделения пластинки вынуть из сосуда с буфером, нижние кромки промокнуть фильтровальной бумагой и пластинки высушить феном. Высушенные пластинки установить в наклонном положении в вытяжном шкафу и опрыснуть из пульверизатора нингидрином до равномерного пропитывания. Пластинки высушить и прогреть в термостате при 40-50 °С 20 мин. Выявляются фиолетовые пятна аминокислот в последовательности снизу вверх: арг, гис, лиз, фен, тир, лей. Сравнить положение пятен стандартных растворов аминокислот с положением их при хроматографировании смеси аминокислот. Хроматограмму зарисовать в тетради.
Работа 4. Определение концентрации общего белка в сыворотке (плазме) крови биуретовым методом (набор НТК «Анализ-Х») - УИРС
Состав набора 1. Биуретовый реактив (3 флакона по 3,5 г). Приготовление раствора… 2. Стандарт белка (раствор или лиофилизат).Работа 5. Колоночная гель-фильтрация.
Принцип метода. Разделительный гель состоит из гранул с определенным размером пор и межгранульного пространства. Молекулы, размер которых превышает… Реактивы, исследуемый материал 1. Раствор хлористого натрия, 8.5 г/л. 2. Гель сефадекса G-200 или 100 (или акрилексы соответствующих марок). 3. Смесь…Работа 6. Определение термолабильности амилазы слюны.
Вариант 2
| Реагенты | Опыт 1 | Опыт 2 | Опыт 3 | Опыт 4 |
| Крахмал, 1%, мл | 0,5 | 0,5 | 0,5 | 0,5 |
| Слюна, 1:10, мл | 0,5 | 0,5 | 0,5 | 0,5 |
| Температура, °С | ||||
| Инкубировать 10 мин и затем добавить по 1-2 капли J2 в KJ | ||||
| Зарегистрировать окрашивание |
Сделать выводы о влиянии температуры на скорость ферментативной реакции.
Работа 7. Определение оптимума рН для действия амилазы.
Работа 8. Влияние активаторов и ингибиторов на активность амилазы.
Работа 9. Специфичность действия ферментов
Работа 10. Исследование свойств тирозиназы из картофеля. Тирозиназа - фермент, окисляющий аминокислоту тирозин в темный пигмент за счет кислорода. Этот фермент может окислить…Работа 11. Ингибирующее действие хлорид-ионов на дегидрогеназный комплекс картофеля.
Реактивы, исследуемый материал 1. NaCl, крист. 2. NaI, крист. 3. KClO3, крист. 4. Сырой картофель. …Работа 12. Определение активности амилазы крови с помощью метода «сухой химии» в сочетании с рефлометрией.
Тест-полоски имеют довольно сложное строение. В верхней части полоски находится многослойная структура, причем наружный слой состоит из… Принцип: a-амилаза Индолил-a,D-мальтогептаозид индоксил + глюкозаРабота 13. Определение активности щелочной и кислой фосфатаз в сыворотке крови по гидролизу b-глицерофосфата (метод Боданского), УИРС.
Реактивы и исследуемый материал 1. Щелочной раствор b-глицерофосфата, 5 г/л, рН 8,6. 2. Кислый раствор… Ход работыРабота 14. Качественные реакции на витамин А.
Реактивы, исследуемый материал 1. Масляный раствор ретинола ацетата, 34,4 г/л. 2. Серная кислота… Ход работыРабота 15. Количественное определение витамина А в рыбьем жире.
Реактивы и исследуемый материал 1. Хлороформ. 2. Уксусный ангидрид. 3. Треххлористая сурьма, 23% раствор. Ход работыРабота 16. Качественные реакции на витамин Д.
Реактивы, исследуемый материал 1. Анилиновый реактив (15 частей и 1 часть концентрированной соляной кислоты).… Ход работыРабота 17. Обнаружение эргостерола в дрожжах.
Реактивы, исследуемый материал 1. Дрожжи. 2. Хлороформ. 3. Уксусный ангидрид. 4. Серная кислота… Ход работыРабота 18. Качественная реакция на викасол.
Викасол в присутствии цистеина в щелочной среде окрашивается в лимонно-желтый цвет.
Реактивы, исследуемый материал
1. Раствор цистеина, 0,25 г/л. 2. Раствор едкого натра, 100 г/л. 3. Раствор викасола, 0,5 г/л.
Ход работы
К 5 каплям раствора викасола добавить равное количество раствора цистеина и 1 каплю раствора едкого натра. Отметить результат реакции.
Работа 107. Качественная реакция на витамин Е с азотной кислотой.
Реактивы и материал 1. Витамин Е, 0,1 % спиртовой раствор. 2. Азотная кислота, концентрированная.… Ход работыРабота 19. Количественное определение витамина Е.
В две пробирки наливают по 2,5 мл 0,1% спиртового раствора витамина Е; добавляют по 0,5 мл 70% раствора азотной кислоты и выдерживают в кипящей…Работа 20. Количественное определение витамина С в хвое, шиповнике, картофеле, луке, молоке, капусте по методу Тильманса.
или где 0,088 (0,0005) – количество мг (ммоль) аскорбиновой кислоты,… Реактивы, исследуемый материалРабота 21. Разделение модельной смеси водорастворимых витаминов методом тонкослойной хроматографии.
Принцип метода. Метод основан на способности жидкой фазы, продвигающейся по слою адсорбента (силикагель) перемещать компоненты разделяемой смеси с разными скоростями. Положение пятен разделяемых витаминов на хроматограмме характеризуют значением Rf.
Реактивы и исследуемый материал
1. Подвижная фаза 1 (бензол-этанол-уксусная кислота-ацетон, 70:20:5:5). 2. Подвижная фаза 2 (бензол-этанол-уксусная кислота-ацетон 55:35:5:5). 3. Пластинки силуфол. 4. Смесь витаминов (тиамин, пиридоксол, аскорбиновая кислота, рибофлавин, никотиновая кислота) в 50% этаноле.
Ход работы
В угол пластинки силуфол на расстоянии 2 см от каждой стороны наносят раствор смеси витаминов по 5 мкл (3 мкг/мкл) растворов тиамина, аскорбиновой кислоты, никотиновой кислоты, 10 мкл (3 мкг/мкл) раствора пиридоксола. Проводят двумерную хроматографию. Для первого направления используют подвижную фазу 1, затем подсушивают и проводят разделение в перпендикулярном направлении подвижной фазой 2. (Замена этанола метанолом существенно улучшает качество разделения). Затем пластины высушивают и выявляют пятна витаминов в ультрафиолетовом свете, используя следующие значения Rf для тиамина, пиридоксола, витамина С, рибофлавина, никотиновой кислоты с подвижной фазой 1 - 0,00, 0,17, 0,48, 0,53, 0,68, а с подвижной фазой 2 – 0,00, 0,60, 0,16, 0,22, 0,44, соответственно.
Работа 22. Выделение фолиевой кислоты из дрожжей и ее обнаружение.
Реактивы, исследуемый материал 1. Едкий натр, 0,1 н и 0,005 н растворы. 2. Ледяная уксусная кислота. 3.… Ход работы– Конец работы –
Используемые теги: основы, биотехнологии0.06
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: ОСНОВЫ БИОТЕХНОЛОГИИ
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов