рефераты конспекты курсовые дипломные лекции шпоры
Реферат Курсовая Конспект
Газовые законы. Основные газовые процессы
Газовые законы. Основные газовые процессы - Лекция, раздел Право, № П/п Тема Лекции № Стр. ...
| № п/п | Тема лекции | № стр. |
| Основные классы химических соединений, номенклатура. | 3 | |
| Основные законы общей химии. Стехиометрия. Химический эквивалент. | 5 | |
| Газовые законы. Основные газовые процессы. | 7 | |
| Строение атома. | 9 | |
| Строение атома (заключение). Химическая связь. Основные типы химической связи. | 12 | |
| Периодический закон и периодическая система элементов Д.И. Менделеева. | 16 | |
| Основы термодинамики. I,II и III начало термодинамики. | 18 | |
| Основы термодинамических расчетов. | 21 | |
| Химическая кинетика и химическое равновесие. | 23 | |
| Теория электролитической диссоциации. Электролиты. | 26 | |
| Водородный показатель кислотности и щелочности водных растворов. Растворимость. | 28 | |
| Гидролиз солей. | 32 | |
| Окислительно-восстановительные реакции. | 34 | |
| Растворы. Способы выражения их концентрации. | 37 | |
| Классификация растворов. Коллигативные свойства растворов. | 40 | |
| Основы химии промышленных взрывчатых веществ. | 42 | |
| Расчеты кислородных балансов ВВ и тепловых эффектов реакций взрыва. | 45 |
Лекция №1: Основные классы неорганических соединений, номенклатура.
Основными классами неорганических соединений являются оксиды, кислоты, соли и основания.
Оксиды представляют собой соединения элементов с кислородом. Оксиды подразделяют на солеобразующие и несолеобразующие. Солеобразующие оксиды делят на основные (образуют соли с кислотами), кислотные (образуют соли с основаниями) и амфотерные (образуют соли как с кислотами, так и с основаниями). Основным оксидам отвечают основания, кислотным – кислоты, а амфотерным – гидраты, которые проявляют как кислотные, так и амфотерные свойства. Кислотные оксиды представляют собой ангидриды кислот (SO2 – серный ангидрид, N2O5 – азотный ангидрид).
Примеры: N2O, NO - несолеобразующие оксиды; SO3, SiO2 - кислотные оксиды; СаО, МgО – основные оксиды и т.д.
В настоящее время общепринятой является международная номенклатура оксидов. Согласно международной номенклатуре в названии оксида указывается валентность элемента: СuO и Cu2O – оксиды меди [II] и [III] соответственно. Существует также русская номенклатура, согласно которой окисью называется единственно возможный оксид элемента, в остальных случаях название дается в соответствии с числом атомов кислорода. Оксиды, в которых элемент проявляет низшую валентность, называются закисями.
Примеры: MgO – окись магния; NiO – одноокись никеля; Ni2O3 – полутораокись никеля; Сu2О – полуокись меди.
Пероксиды (перекиси) металлов являются солями перекиси водорода Н2О2 и лишь формально относятся к оксидам. Приставка пер в названии соединений обычно указывает на принадлежность соединения к перекисным, но существуют исключения: соли кислот НMnO4 (перманганаты) и НСlO4 (перхлораты) перекисными не являются, а приставка пер в названии этих соединений указывает на максимальную насыщенность соединений кислородом.
Гидроксиды (основания) классифицируют по их силе (сильные – все щелочи кроме NH4OH и слабые), а также по растворимости в воде (растворимые – щелочи и нерастворимые). Важнейшими щелочами являются КОН (едкое кали) и NaOH (едкий натр).
В состав кислот входит водород, способный замещаться металлом, а также кислотный остаток. Коэффициент х, отвечающий количеству атомов водорода, а, следовательно, равный валентности кислотного остатка, называют основностью кислоты. Кислоты классифицируют по их силе (H2SO4, HNO3 – сильные кислоты; HCN – слабая кислота), на кислородсодержащие (H2SO4, HNO3) и бескислородные (HCN, HI); а также по основности (х) -
HCN – одноосновная кислота, H2SO3 – двухосновная кислота, H3РO4 – трехосновная кислота. Важнейшим свойством кислот является их способность образовывать соли с основаниями. Названия кислот образуют от того элемента, которым образована кислота, при этом названия бескислородных кислот оканчивается словом водород (HCN –циановодород или синильная кислота). Названия кислородсодержащих кислот образуют от того элемента, которым образована кислота, с добавлением слова кислота (H3AsO4 – мышьяковая кислота, H2CrO4 – хромовая кислота). В случаях, когда один элемент образует несколько кислот различие между кислотами проявляют в окончаниях названий (на ная или овая оканчиваются названия тех кислот, в которых элемент проявляет наивысшую валентность; на истая или овистая оканчиваются названия тех кислот, в которых элемент проявляет валентность ниже максимальной).
Примеры:HNO3 – азотная кислота, а HNO2 - азотистая кислота; H3AsO4 – мышьяковая кислота, а H3AsO3 – мышьяковистая кислота.
Одному и тому же оксиду могут соответствовать несколько кислот, при этом наиболее богатая водой форма имеет в названии приставку орто, а наименее богатая – мета (ортофосфорная кислота H3РO4 – на одну молекулу ангидрида Р2О5 приходится три молекулы воды; метафосфорная кислота HРO3 – на одну молекулу ангидрида Р2О5 приходится одна молекула воды). Следует также учитывать и то, что ряд кислот имеют исторически сложившиеся названия.
Соли являются продуктом замещения водорода в кислоте на металл или гидроксогрупп в основании на кислотный остаток. Нормальные (средние) соли получаются при полном замещении; кислые – при неполном замещении водорода кислоты на металл; основные – при неполном замещении гидроксогрупп основания на кислотный остаток. Кислая соль может быть образована только кислотой, основность которой 2 и более, а основная – металлом, заряд которого 2 и более.
Примеры:NaHS, KHCO3 – кислые соли (гидросульфид натрия и гидрокарбонат натрия); MgOHCl, CaOHCl – основные соли (хлориды гидроксо магния и кальция); NaCl, CuS – нормальные соли (хлорид натрия и сульфид меди).
| Название кислоты | Формула | Пример соли | Название соли |
| Серная | H2SO4 | K2SO4 | сульфат К |
| сернистая | H2SO3 | Na2SO3 | сульфит Na |
| соляная | HCl | Ca(Cl)2 | хлорид Са |
| иодоводородная | HI | KI | иодид К |
| сероводородная | H2S | Na2S | cульфид Na |
| азотная | HNO3 | KNO3 | нитрат К |
| азотистая | HNO2 | NaNO2 | нитрит Na |
| ортофосфорная | H3РO4 | K3РO4 | ортофосфат К |
| хлорная | НСlO4 | NaСlO4 | перхлорат Na |
| хлорноватая | НClO3 | NaСlO3 | хлорат Na |
| хлористая | НClO2 | NaСlO2 | хлорит Na |
| хлорноватистая | НСlO | NaСlO | гипохлорит Na |
| кремниевая | H2SiO3 | CaSiO3 | силикат Сa |
Продолжение табл.
| Название кислоты | Формула | Пример соли | Название соли |
| алюминиевая | H3AlO3 | K3AlO3 | алюминат К |
| ортоборная | H3BO3 | K3BO3 | ортоборат К |
| мышьяковая | H3AsO4 | K3AsO4 | арсенат К |
| мышьяковистая | H3AsO3 | K3AsO3 | арсенит К |
| двуфосфорная | H4P2O7 | K4P2O7 | дифосфат К |
| угольная | H2CO3 | K2CO3 | карбонат К |
| фосфористая | H3PO3 | K3PO3 | фосфит К |
| фтороводород | HF | KF | фторид К |
| хромовая | Н2СrO4 | K2СrO4 | хромат К |
| синильная | НCN | KCN | цианид К |
Лекция №2: Основные законы общей химии. Стехиометрия. Химический эквивалент.
1. Закон постоянства состава. Соотношение масс элементов, формирующих данное соединение, постоянно и не зависит от способа получения этого… 2. Закон кратных отношений. Установлен Дальтоном в 1803г. В случае, когда два… Законы постоянства состава и кратных отношений не носят всеобщего характера, в отличии, например, от закона…Газовые законы
Для описания состояния идеального газа пользуются уравнением Менделеева-Клапейрона: РV=, где: P – давление газа, Па; V – объём газа, м3; T – температура газа, К;… Уравнением, объединяющим газовые законы Бойля-Мариотта и Гей-Люссака, является:Основные газовые процессы
1. Изохорный процесс. Объём системы остаётся постоянным (dV=0). Поэтому элементарная работа расширения системы dАр=PdV=0, а вся теплота, сообщенная… 2. Изобарный процесс. Давление Р=соnst. Таким образом dQp=d(U+PV), а работа… Ар=Р(V2-V1).Введение
Большую роль в установлении сложной природы атома и расшифровке его структуры сыграло открытие и изучение радиоактивности (явление испускания некоторыми элементами излучения, способного проникать через вещества, ионизировать воздух, вызывать засвечивание фотографических пластинок). Впервые в 1896г. радиоактивность обнаружена А. Беккерелем у соединений урана. Мария и Пьер Склодовские-Кюри обнаружили радиоактивность и у соединений тория, а в 1898 г. они открыли в составе урановых руд присутствие двух новых радиоактивных элементов – полония и радия. Опыты супругов Кюри показали, что атомы радия в процессе радиоактивного излучения распадаются, превращаясь в атомы других элементов, в частности, в атомы гелия. Впоследствии было установлено, что другим продуктом распада радия является инертный газ радон.
В 1903 г. Дж. Томсон предложил модель строения атома, согласно которой атом состоит из положительного ядра и электронов. Развивая эти представления, Э. Резерфорд в 1911г. предложил ядерную модель строения атома. Существенным шагом в развитии представлений о строении атома стала предложенная в 1913г. Н. Бором теория, объединившая, по сути, ядерную модель атома с квантовой теорией света. Основные положения своей теории Бор сформулировал в виде следующих постулатов: 1) электрон может вращаться вокруг ядра только по некоторым определенным круговым орбитам (стационарным орбитам); 2) Двигаясь по стационарной орбите, электрон не излучает электромагнитной энергии; 3) Излучение происходит при скачкообразном переходе электрона с одной стационарной орбиты на другую.
В 1900г. М. Планк предположил, что лучистая энергия испускается и поглощается телами не непрерывно, а дискретно. При этом, он определил энергию каждой такой порции как Е=h*n (уравнение Планка), где n – частота излучения; h=6,626*10-34 Дж*с – постоянная Планка. Т.о. согласно определению Планка квант – это минимальная порция электромагнитного излучения с определенной частотой. В 1905г. А. Эйнштейн при изучении явления фотоэлектрического эффекта пришел к выводу, что электромагнитная энергия существует только в форме квантов, а излучение представляет собой поток неделимых материальных «частиц» - фотонов, энергия которых определяется уравнением Планка. Фотон не является ни частицей, ни волной – ему свойственна корпускулярно-волновая двойственность.
Атом и его строение
Согласно современным представлениям, электрон обладает одновременно свойствами волны и частицы, поэтому для описания его поведения нельзя… Состояние электрона в атоме характеризуется волновой функцией, являющейся… Каждой АО соответствует область пространства определённого размера, формы и ориентации, равноценная понятию…Закон Гесса. Тепловые эффекты химических реакций
Для расчета тепловых эффектов различных процессов, (в том числе и состоящих из нескольких этапов) в термодинамике применяют закона Гесса (установлен… DrH0298=ånкон(DfH0298)кон-ånнач(DfH0298 )нач Для различных веществ при нормальных условиях (Р0=101,3 кПа; Т0=298К) энтальпии образования обозначаются как DfН0298,…ЧАСТЬ 2.
II закон термодинамики. Теорема Карно-Клаузиуса
Коэффициент полезного действия (кпд) тепловой машины, работающей по квазистатическому циклу Карно, не зависит от природы рабочего тела, а… , где: Q1 – теплота, сообщенная рабочему телу при температуре Т1 от источника… Основной формулировкой второго закона является формулировка Больцмана: «Все процессы в природе переводят систему из…III закон термодинамики. Теорема Нернста. Постулат Планка
при Т®0 S=0 и dS=0. Важнейшим следствием этой гипотезы является то, что энтропия правильно сформированного (бездефектного) идеального кристалла при… На основе этого закона разработаны современные методы вычислений изменения…Определение термодинамической вероятности осуществления процесса
-D(TS), DHх.р.=ånкон(DfH0298)кон-ånнач(DfH0298 )нач; DSх.р=å(nS0298)кон-å(nS0298)нач. Если значение DG>0, то процесс термодинамически мало вероятен, причем, чем… Если значение DG=0, то система находится в равновесии.Энергия Гельмгольца
Величина F=U-TS является функцией состояния системы и носит название изохорно-изотермического потенциала или энергии Гельмгольца (размерность энергии (Дж)). При Т,Р=const энергия Гельмгольца может служить признаком наличия равновесия или самопроизвольности процессов. При равновесии она постоянна и минимальна по величине. Самопроизвольно могут протекать только процессы, которые приводят к ее убыли.
Расчет энергетических величин и выражения первого закона термодинамики для предельных процессов идеального газа
Химическая кинетика – это раздел химии, изучающий скорости химических реакций. Химические реакции могут протекать с различными скоростями (от малых… Скорость гомогенной реакции – это количество вещества, вступающего в реакцию… vгомог=; vгетерог=. Т.е. скорость гомогенной реакции можно определить как изменение концентрации какого-либо из…Лекция №11: Водородный показатель кислотности и щелочности водных растворов. Ионное произведение воды. Растворимость.
рН=-lg[H+], где [H+]=[моль/л]. Таким образом, по характеру среду растворы можно подразделить на кислые… Характер среды (раствора) Величина рН Концентрация [Н+], моль/л …Н+]·[ОН-]=const=KH2O, где KH2O – ионное произведение воды.
При Т=298К (25°С) для чистой воды [Н+]=[ОН-]=10-7 моль/л, поэтому:
KH2O=10-7·10-7=10-14 или р[Н+]+р[ОН-]=14, т.е. р[Н+]=14-р[ОН-].
Т.о. сумма водородного и гидроксильного показателей в водных растворах при 25°С равна 14.
При увеличении температуры значение ионного произведения воды возрастает (например, при 100°С оно достигает величины 5,5·10-13).
Однако следует учитывать, что каковой бы ни была величина реакции раствора (рН), произведение концентраций [Н+]·[ОН-] остаётся неизменным. Величина ионного произведения воды может измениться только при изменении температуры, но не при увеличении [Н+] или [ОН-].
Расчет растворимости солей и минералов
Насыщенным называют раствор, находящийся в равновесии с избытком растворяемого вещества. При заданных условиях концентрация насыщенного раствора не изменяется во времени. Её называют растворимостью и обозначают заглавной буквой английского термина «Solubility» S. Растворимость зависит от температуры и состава раствора. Обычно её рассчитывают на основе термодинамических констант. Рассмотрим равновесие между солью, состоящей из катионов металла Mz+ и анионов кислотного остатка Az-, и её насыщенным раствором. При этом учтем, что все соли - сильные электролиты, полностью диссоциирующие в растворе.
Мn+Аn-(т)=n+Мz+(р-р)+n-Аz-(р-р). (1)
Константу данного равновесия называют произведением растворимости соли и обозначают L. Запишем её выражение согласно закону действующих масс учитывая, что активность чистого растворенного вещества равна 1 (стандартное состояние).
L = a+n+×a-n- = [Mz+]n+×[Az-]n-×g±n, (2)
где n = n+ + n- , а среднеионный коэффициент активности g± = (g+n+×g-n-)1/n. Выражение (2) используют для расчета концентрации ионов в насыщенных растворах. Значения произведений растворимости берут в справочнике или вычисляют по величине энергии Гиббса растворения соли:
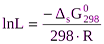 (3)
(3)
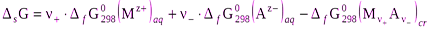 (4)
(4)
Растворимость в бинарной системе соль - вода
В этом случае, согласно уравнению (1), [Mz+]=n+S и [Az-]=n-S.
Подставим эти соотношения в (2). L=(n+S)n+(n-S)n-×g±n. После преобразования получим: L=(n±g±S)n, где среднеионный стехиометрический коэффициент равен: n±=(n+n+×n-n-)1/n, а n++n-=n.
Отсюда получаем формулу для расчета растворимости соли в воде:
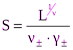 (5)
(5)
Если растворимость соли ниже 10-4 моль/л, то среднеионный коэффициент активности можно принять равным 1.
Растворимость в многокомпонентной системе в отсутствие
Одноименного иона
Следует подчеркнуть, что с ростом ионной силы g± при не высоких концентрациях электролита понижается, а растворимость увеличивается. Растворимость в многокомпонентной системе с одноименными ионами Рассмотрим расчет растворимости соли Мn+Аn- в системе, содержащей хорошо растворимую соль M¢Аn¢с одноименным…Лекция №14: Растворы. Способы выражения их концентрации.
Систематическое изучение свойств растворов в зависимости от их составов началось лишь во второй половине XIX-го века. Так своё исследование,… Полярно противоположная точка зрения на растворы, получившая название… Якоб Вант-Гофф пришел к выводу о полной аналогии свойств разбавленных растворов свойствам газов, о применимости к ним…Расчет кислородного баланса ВВ
Кислородным балансом (КБ) называется выраженное в процентах отношение массы свободного кислорода, остающегося после окисления всего углерода,… Вещества с положительным КБ (селитра, нитроглицерин), т.е. окислители, для… При отрицательном кислородном балансе в результате взрыва могут образоваться ядовитые газы (СО), сажа (С), а при…Расчет тепловых эффектов реакций взрыва
Расчет теплового эффекта реакций взрыва производят на основе первого начала (закона) термодинамики и закона Гесса. Согласно первому началу… Q=DU+А или dQ=dU+dА Где U – внутренняя энергия; А – работа.– Конец работы –
Используемые теги: Газовые, законы, основные, Газовые, процессы0.084
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Газовые законы. Основные газовые процессы
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов