рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Тесты по химии
Реферат Курсовая Конспект
Тесты по химии
Тесты по химии - раздел Химия, Тесты По Химии ...
Тесты по химии
Тесты по разделу «Электрохимия» 1. Электролиз расплава хлорида натрия описывается суммарным уравнением:Хлор
5)гидроксид калия
3. Количественно процессы электролиза подчиняются законам
1)Ньютона
2)Ампера
3)Фарадея
4)Ома
5)Кулона
4. Процесс, протекающий при электролизе раствора сульфата натрия на платиновом аноде, описывается уравнением:
1)Na+ + 1ē →Na0
2)2H2O + 2ē → H2 + 2OH-
3)Pt - 2ē → Pt2+
4)2H2O - 4ē → 4H+ + O2
5)Na - 1ē → Na+
5. Процесс, протекающий при электролизе раствора сульфата никеля на никелевом аноде описывается уравнением:
1)2SO42- - 2 ē→ S4O82-
2)2H2O - 4 ē → O2 +4H+
3)Ni - 2 ē → Ni2+
4)2H2O +2 ē → H2 + 2OH-
5)Ni2+ + 2 ē → Ni0
6. Процесс, протекающий при электролизе раствора хлорида меди(II) на платиновом аноде, описывается уравнением
1)2Cl- -2 ē→ Cl2
2)2H2O - 4 ē → O2 + 4H+
3)Pt - 2 ē →Pt2+
4)Cu2+ + 2 ē → Cu0
5)Cu - 2 ē →Cu2+
7. При электролизе водного раствора смеси солей CuCl2, KCl, AlCl3 на катоде протекает процесс:
1)Cu2+ + 2 ē → Cu0
2)K+ + 1 ē → K
3)Al3+ + 3 ē →Al
4)2Cl- - 2 ē →Cl2
5)2H2O - 4 ē → 4H+ + O2
8. На электродах гальванического элемента Якоби-Даниэля, состоящего из цинковой и медной пластин, протекают следующие процессы:
1)A: Cu - 2 ē → Cu2+ K: Zn2+ + 2 ē → Zn
2)A: Zn - 2 ē → Zn2+ K: Cu2+ + 2 ē → Cu
3)A: Cu - 2 ē → Cu2+ K: 2H+ + 2 ē → H2
4)A: Zn - 2 ē → Zn2+ K: 2H2O - 4 ē → O2 + 4H+
5)A: Zn - 2 ē → Zn2+ K: 2H+ + 2 ē → H2
9. На электродах гальванического элемента Якоби-Даниэля, состоящего из серебряной и свинцовой пластин, протекают следующие процессы:
1)A: Pb - 2 ē → Pb2+ K: Ag+ + 1 ē →Ag
2)A: Ag - 1 ē → Ag+ K: Pb2+ + 2 ē → Pb
3)A: Pb - 2 ē → Pb2+ K: 2H+ + 2 ē → H2
4)A: Pb - 2 ē → Pb2+ K: 2H2O - 4 ē →O2 + 4H+
5)A: Sn - 2 ē → Sn2+ K: Ag+ + 1 ē →Ag0
10. Гальванический элемент Вольта состоит из цинковой и медной пластин, опущенных в раствор серной кислоты. На электродах этого гальванического элемента протекают следующие процессы:
1)А: Zn – 2 ē → Zn2+ K: 2H+ + 2 ē → H2
2)А: Cu – 2 ē → Cu2+ K: 2H+ + 2 ē → H2
3)А: Zn – 2 ē → Zn2+ K: Cu2+ + 2 ē → Cu
4)А: Zn – 2 ē → Zn2+ K: 2H2O - 4 ē → O2 + 4H+
5)А: Cu – 2 ē → Cu2+ K: Zn2+ + 2 ē → Zn0
11. На электродах гальванического элемента Якоби-Даниэля., состоящего из цинковой и железной пластин, протекают следующие процессы:
1)А: Zn – 2 ē → Zn2+ K: Fe2+ + 2 ē → Fe
2)А: Zn – 2 ē → Zn2+ K: 2H+ + 2 ē → H2
3)А: Fe – 2 ē → Fe2+ K: 2H+ + 2 ē → H2
4)А: Fe – 2 e → Fe2+ K: Zn2+ + 2e → Zn
5)А: Fe – 2e → Fe2+ K 2H2O + O2 +4e → 4OH-
12. Наибольшую э.д.с. имеет гальванический элемент:
1)Zn / ZnCl2, 1M // CdCl2, 1M /Cd
2)Cd / CdNO3, 1M // AgNO3, 1M / Cd
3)Zn / ZnSO4, 1M // NiSO4, 1M / Ni
4)Mg / Mg(NO3)2, 1M // AgNO3, 1M / Ag
5)Mg / MgSO4, 1M // FeSO4, 1M / Fe
13. В гальваническом элементе Якоби-Даниэля при 298 К установилось равновесие:
Zn + 2Ag+ ←→ Zn2+ + 2Ag
Концентрация ионов Zn2+ составляет 0,01моль/л, концентрация ионов Ag+ составляет 0,001 моль/л. Э.д.с. данного гальванического элемента равна:
1)1,0 В
2)-1,44 В
3)1,44 В
4)1,56 В
5)0,04 В
14. Э.д.с. гальванического элемента
Zn / ZnSO4, 0,000001 M // ZnSO4, 0,01 M /Zn равна:
1)0,76 В
2)0,06 В
В
4)0,24 В
5)0,18 В
15. Краткая схема гальванического элемента Якоби-Даниэля имеет вид:
Zn / ZnSO4, 1M // CuSO4, 1M / Cu
Э.д.с. данного гальванического элемента равна:
1)0,32 В
В
3)-1,1 В
4)-0,32 В
5)0,5 В
16. Процессы, протекающие при контактной коррозии магния и железа в нейтральной водной среде, описываются уравнениями
1)А: Mg – 2e → Mg2+ K: 2H2O + O2 – 4e → 4OH-
2)А: Mg – 2e → Mg2+ K: 2H+ + 2e → H2
3)А: Mg – 2e → Mg2+ K: Fe2+ + 2e → Fe
4)А: Fe – 2e → Fe2+ K: 2H+ + 2e → H2
5)А: Fe – 2e → Fe2+ K: 2H2O + O2 –4e → 4OH-
17.Для протекторной защиты железа от коррозии в нейтральной водной среде применяется:
1)серебро
Цинк
3)медь
4)олово
5)свинец
18. Металлом, наиболее подверженным электрохимической коррозии при контакте с оловом, является:
Магний
2)свинец
3)кобальт
4)железо
5)медь
19. Электрохимическая коррозия железа в нейтральной водной среде описывается уравнением:
1)4Fe + 3O2 + 6H2O = 4Fe(OH)3
2)4Fe + 3O2 = 2Fe2O3
3)Fe + 3Cl2 = 2FeCl3
4)3Fe + C = Fe3C
5)3Fe + Si + Fe3Si
20. Процессы, протекающие при коррозии оцинкованного железа во влажном воздухе, описываются уравнениями:
1)А: Zn – 2e → Zn2+
K: Fe2+ + 2e → Fe
2)А: Zn – 2e → Zn2+
K: 2H+ + 2e → H2
3)А: Zn – 2e → Zn2+
K: 2H2O + O2 – 4e → 4OH-
4)А: Fe – 2e → Fe2+
K: 2H2O + O2 –4e → 4OH-
5)А:Fe – 2e → Fe2+
K: 2H+ + 2e → H2
21. Уравнение, отвечающее электрохимической коррозии металла:
1) 2Mg + O2 = 2MgO
2) Sn + O2 = SnO2
3)2Zn + O2 + 2H2O = 2Zn(OH)2
4) 2Pb + O2 = 2PbO
5) 4Fe + 3O2 = 2Fe2O3
22. Процесс отвода электронов с катодных участков при электрохимической коррозии называется:
Деполяризацией
2)ионизацией
3)диссоциацией
4)аэрацией
5)катодной защитой
23. Металлом, который может служить анодным покрытием на железе, является:
1)свинец
2)олово
3)медь
4)серебро
Магний
24. Процесс коррозии лужёного железа в кислой среде при нарушении целостности покрытия описывается уравнениями:
1)А: Fe – 2ē → Fe2+ K: 2H2O + O2 +4ē → 4OH-
2)А: Fe – 2ē→ Fe2+ K: 2H+ + 2ē → H2
3)А: Sn – 2ē → Sn2+ K: 2H+ + 2ē → H2
4)А: Fe – 2ē → Fe2+ K: Sn2+ + 2ē → Sn
5)А: Sn – 2ē → Sn2+ K: 2H2O + O2 +4ē → 4OH-
25. Атмосферная коррозия лужёного железа (покрытого тонким слоем олова) описывается уравнениями:
1)А: Fe – 2ē → Fe2+ K: 2H2O + O2 +4ē → 4OH-
2)А: Fe – 2ē → Fe2+ K: 2H+ + 2ē → H2
3)А: Sn – 2ē → Sn2+ K: 2H2O + O2 +4ē → 4OH-
4)А: Sn – 2ē → Sn2+ K: 2H+ + 2ē → H2
5)А: Fe – 2ē → Fe2+ K: Sn2+ + 2ē → Sn
Тесты по разделу «Химическая связь»
1. Между атомами элементов с порядковыми номерами 3 и 9 образуется химическая связь
1) ионная
2) металлическая
3) ковалентная неполярная
4) ковалентная полярная
5) донорно-акцепторная
2. Наименее прочная химическая связь
1) ионная
2) водородная
3) металлическая
4) ковалентная полярная
5) ковалентная неполярная
3. При образовании молекулы хлороводорода перекрываются орбитали
1) р и d
2) р и р
3) s и р
4) s и s
5) s и d
4. При гибридизации одной одной s- и одной р-орбиталей образуются
1) две гибридные sр2-орбитали
2) одна гибридная sр-орбиталь
3) две гибридные sр-орбитали
4) одна гибридная sр2-орбитали
5) три гибридные sр-орбитали
5. Между молекулами воды образуется вид связи
1) ионный
2) водородный
3) металлический
4) донорно-акцепторный
5) ковалентная неполярный
6.Между молекулами этилового спирта образуется вид связи
1) ионный
2) водородный
3) металлический
4) донорно-акцепторный
5) ковалентная неполярный
7. Последовательность заполнения молекулярных орбиталей в порядке возрастания их энергии σs<σs*<σz<πх=πу<πх*=πу*<σz* характерна для молекулы
1) Н2O
2) НCl
3) O2
4) CO
5) ВN
8. Последовательность заполнения молекулярных орбиталей в порядке возрастания их энергии σs<σs*<πх=πу<σz <πх*=πу*<σz* характерна для молекулы
1) Н2
2) Cl2
3) O2
4) CO
5) N2
9. Кратность связи в молекуле О2 равна
1) 1
2) 2
3) 3
4) 5
5) 0
10. Кратность связи в молекуле N2 равна
1) 1
2) 2
3) 3
4) 5
5) 0
11. Кратность связи в молекуле Н2 равна
1) 1
2) 2
3) 3
4) 5
5) 0
12. В хлориде аммония отсутствуют связи
1) ионные
2) донорно-акцепторные
3) ковалентные полярные
4) ковалентные неполярные
5) водородные
13. Ковалентную неполярную связь имеет
1) Н2О
2) СО
3) Н2
4) КОН
5) Сu
14. Ковалентную полярную связь имеет
1) Cl2
2) O2
3) Н2
4) НСl
5) N2
15. Наибольшую склонность к образованию ионных связей проявляет элемент
1) N
2) Si
3) C
4) S
5) F
16. Геометрическая форма молекулы метана СН4
1) пирамидальная
2) тетраэдрическая
3) треугольная
4) угловая
5) линейная
17. Угол 109028/ образуется между гибридными
1) sр-орбиталями
2) sр2-орбиталями
3) sр3-орбиталями
4) sр3d2-орбиталями
5) sd-орбиталями
18. Угол 1200 характерен для
1) пирамидальной молекулы
2)тетраэдрической молекулы
3) треугольной молекулы
4) угловой молекулы
5) линейной молекулы
19. Угол 109028/ характерен для
1) пирамидальной молекулы
2)тетраэдрической молекулы
3) треугольной молекулы
4) угловой молекулы
5) линейной молекулы
20. Геометрическая форма молекулы аммиака NH3
1) тетраэдрическая
2) пирамидальная
3) треугольная
4) угловая
5) линейная
21. Прочность и полярность связи в ряду молекул HF→HCl→НВr→HJ изменяются:
1) как прочность, так и полярность связи увеличивается
2) прочность уменьшается, полярность увеличивается
3) как прочность, так и полярность связи уменьшаются
4) прочность увеличивается, полярность уменьшается
5) прочность и полярность связи сначала увеличивается, затем уменьшается
22. π-связь образуется при перекрывании
1) вдоль оси s-орбиталей
2) вдоль оси р-орбиталей
3) вдоль оси s-и р-орбиталей
4) р-орбиталей, оси которых параллельны
5) d-орбиталей, находящихся в двух параллельных плоскостях
23. Две π-связи имеет молекула
1) Н2О
2) СО2
3) NH3
4) O2
5) HCl
24. Двойную связь имеет молекула
1) Н2О
2) С2Н6
3) NH3
4) O2
5) HCl
25. Тройную связь имеет молекула
1) Н2О
2) СО2
3) NH3
4) C2Н2
5) HCl
26. Трехцентровую связь имеет молекула
1) Н2О
2) НNО3
3) NH3
4) O2
5) HCl
27. Линейную форму имеет молекула
1) OF2
2) ВeCl2
3) H2O
4) AlCl3
5) CH4
28. Пирамидальную форму имеет молекула
1) NH3
2) ВeCl2
3) H2O
4) AlCl3
5) CH4
29. Число σ-связей в три раза больше числа π-связей
1) хлороводородной кислоты
2) сернистой кислоты
3) ортофосфорной кислоты
4) хлористой кислоты
5) бромистоводородной кислоты
30 Все связи ковалентные неполярные в молекуле
1) СО2
2) С2Н6
3) С2Н2
4) Н2О2
5) О2
31. Парамагнитной является молекула
1) F2
2) O2
3) Cl2
4) N2
5) H2
32. В молекуле аммиака NH3 число связывающих электронных пар равно
1) 2
2) 3
3) 1
4) 0
5) 4
33. В молекуле аммиака NH3 число несвязывающих электронных пар равно
1) 2
2) 3
3) 1
4) 0
5) 4
34. Формулы соединений только с ковалентной связью представлены в ряду
1) N2, КNO3
2) КСl, CuSO4
3) H2O, СН3СООН
4) ВаСl2, КF
5) КВr, О2
Тесты по разделу «Полимеры»
1.Карбоцепным является полимер:
1) (-СF2-)n -тефлон
2) (-CH2O-)n-полифоральдегид
3) (-MeO-)n-оксиды металлов
4) (-ЅιO2-)n-двуокись кремния
5) (-S-)n-сера
2.Гетероцепным полимером является:
1) (-СН2-)n-полиэтилен
2) (-СН2-СClH-)n-поливинилхлорид
3) (СН2-С(СН3)2-)-полиизобутилен
4) (-СН2-СН-F-)n –поливинилфторид
5) (-СН2-СН2О-)n-полиэтиленоксид
3.Полимерами не являются:
1) Вещества, получаемые методами поликонденсации
2) Вещества, получаемые методами полимеризации
3) Вещества, получаемые методами полимераналогичных превращений
4) Продукты взаимодействия щелочей с минеральными кислотами
5) Вещества, получаемые реакциями полиприсоединения
4 Наиболее устойчивым полимером является:
Тефлон ( Фторпласт-4)
3)Полиэтилен 4)Каучук 5)КрахмалНа рис. приведена диаграмма состояния системы компонентов M и N. Укажите на диаграмме точки, отвечающие равновесию жидкого сплава и кристаллов химического соединения MN.
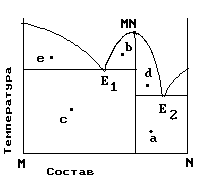
| 1) только c 2) b и d 3) a и b 4) e и a 5) c и d |
На рис. приведена диаграмма состояния системы А-В. Укажите на диаграмме область однородного расплава.
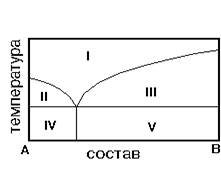
1) IV 2) I 3) II 4) V 5) III
4. На рисунке приведена диаграмма состояния системы компонентов M и N. Укажите на диаграмме точку, отвечающую температуре плавления химического соединения MN.
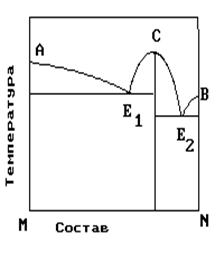
| 1) E2 2) B 3) C 4) E1 5) A |
На рисунке представлена диаграмма состояния компонентов M и N. Укажите на диаграмме точку эвтектики интерметаллического соединения и компанента-M
6. На рис. приведена диаграмма состояния системы А-В. Укажите область…На рис. приведена диаграмма состояния системы А-В. Укажите область кристаллов В и эвтектики.
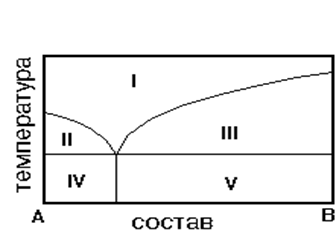
1) IV2) I3) II4) V5) III
8. На рис. приведена диаграмма состояния системы А-В. Укажите область равновесия кристаллов В и расплава
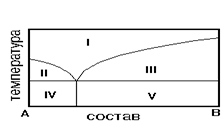
1) IV 2) I3) II4) V 5) III
На рис. приведена диаграмма состояния системы А-В. Укажите область кристаллов А и расплава.
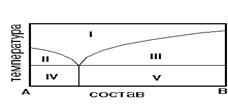
1) IV2) I3) II4) V5) III
На рисунке представлена диаграмма состояния компонентов M и N. Укажите на диаграмме точку эвтектики интерметаллического соединения и компанента-N
11. На рисунке показана фазовая диаграмма воды. Укажите на диаграмме кривую кипения воды. 1) A 2) В и С 3) Е 4) С 5) О и Е …На рисунке показана фазовая диаграмма воды. Укажите на диаграмме тройную точку воды.
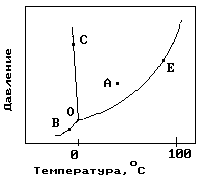
| 1) A 2) В и С 3) Е 4) С 5) О |
На рисунке показана фазовая диаграмма воды. Укажите на диаграмме кривую плавления льда.
14. На рисунке показана фазовая диаграмма воды. Укажите на диаграмме кривую… 1) A 2) В и С 3) Е 4)О-В 5) ОЛегкоплавким сплавам
3) Сплавам с неограниченной растворимостью металлов в жидком и твердом виде
4) Сплавам металлов, образующих интерметаллические соединения
5) Всем сплавам
18. Для сплава, диаграмма которого приведена на рисунке, характерно:
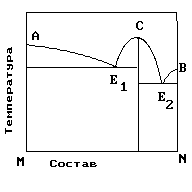
Образование интерметаллического соединения
3) Механическая смесь 4) Ограниченная растворимость компонентов в твердом и жидком состояниях 5) Одинаковая химическая природа металловНа рисунке показана фазовая диаграмма воды. Укажите на диаграмме точку жидкой фазы.
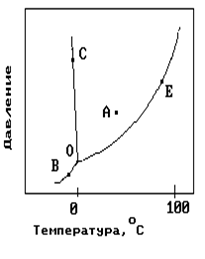
| 1) A 2) В и С 3) Е 4) С 5) О и Е |
При нейтрализации соляной кислоты (НСL)
раствором едкого натра РН –среды:
1) Становится равной 0
Становится равной 7
3) Становится меньше 7
4) Становится больше 8
5) Становится меньше 0
24. При взаимодействии: N2 + 3 H2 = 2NH3 аналитическим сигналом будет:
Уменьшении давления реакционной смеси
2) Скорость химической реакции
3) Положение равновесия
4) Концентрация катализатора
5) Теплота образования аммиака
25. При реакции разложения перекиси водорода аналитическим сигналом является:
2Н2О2 =Н2О + О2
1) Концентрация катализатора
2) Объем раствора
3) Молекулярный вес перекиси водорода
Парциальное давление образующегося кислорода
5) Теплоемкость воды
26. Все аналитические методы основаны на получении и измерении аналитического сигнала, т.е. любого проявления химических или физических свойств вещества. Аналитическим сигналом в кислотно-основном титровании является:
Окраска индикатора
2) Показатель преломления
3) Масса
4) Pадиоактивность
5) Цвет раствора.
Тесты к разделу “ Металлы“
1. С водой при комнатной температуре взаимодействует:
1) Золото
2) Платина
Калий
4) Медь
5) Свинец
2. С соляной кислотой ( НСl ) реагирует с выделением водорода:
1) Серебро
2) Платина
3) Золото
Железо
5) Медь
3. Старательским способом добывают:
1) Калий
2) Натрий
Золото
4) Магний
5) Кальций
Металл не реагирует с азотной кислотoй ( HNO3 )
Золото
2) Железо
3) Натрий
4) Цинк
5) Литий
Металл из руды получают карботермией ( восстановление углеродом )
Железо
2) Литий
2) Калий
3) Натрий
4) Франций
5) Цезий
6. Золото устойчиво на воздухе ввиду того, что:
Имеет большой стандартный электродный потенциал
2) Находится в первой группе элементов таблицы Д.И.Менделеева
3) На нем отсутствует оксидная пленка
4) Образует амальгаму
5) В природе встречается в самородном виде
7. Оксид хрома (VI ) проявляет:
1) Амфотерные свойства
Кислотные свойства
3) Основные свойства
4) Восстановительные свойства
5) Безразличный оксид
8. При взаимодействии медного купороса (CuSO4 ) c цинком образуется:
Медь и сульфат цинка
3) Гидроксид меди и сульфат цинка 4) Сульфит меди (II ) 5) Оксид цинка и сульфид медиK
3) Au
4) Fe
5) Pt
11. Разбавленная серная кислота не реагирует с:
Медью
2) Кальцием
3) Железом
4) Магнием
5) Хромом
12. Алюминий устойчив на воздухе ввиду того , что:
1) Имеет отрицательный стандартный электродный потенциал
Покрыт с поверхности устойчивой оксидной пленкой
3) Пассивируется в концентрированной азотной кислоте
4) Реагирует с водными растворами щелочей
5) Пластичен
13. Алюминий получают в промышленности:
Электролизом глинозема в расплаве криолита
2) Карботермией
3) Электролизом водных растворов
4) Пирометаллургическим способом
5) Восстановлением водородом
14. Медь реагирует с концентрированной азотной кислотой с образованием:
Нитрата меди ( II ) , воды и двуокиси азота
2) Нитрата меди ( I ) , воды и двуокиси азота
3) Нитрата меди ( II ) и воды
4) Нитрата меди (II ) и двуокиси азота
5) Нитрата меди ( II ) , воды и оксида азота (1)
15. Желез реагирует с азотнокислым серебром с образованием:
Серебра и нитрата железа (II)
2) Оксида серебра и нитрита железа
3) Серебра и нитрида железа
4) Нитрида серебра и оксида железа (II)
5) Серебра и оксида железа (II)
16. При взаимодействии железа с кислородом:
1) Железо восстанавливается с образованием оксида
Железо окисляется с образованием оксида
3) Кислород окисляется при образовании оксида железа
4) Железо не реагирует с кислородом
5) Железо проявляет амфотерные свойства
17. Бериллий в отличии от элементов второй группы элементов таблицы Д.И. Менделеева проявляет:
Амфотерные свойства
2) Основные свойства
3) Кислотные свойства
4) Окислительные свойства
5) Окислительно-восстановительную двойственность
18. При взаимодействии перманганата калия (марганцовка) с перекисью водорода в присутствии серной кслоты образуются:
Сульфат марганца, сульфат калия, вода и кислород
2) Сульфид марганца, сульфат калия, вода и кислород
3) Сульфат марганца, сульфат калия и вода
4) Сульфат калия, вода и кислород
5) Сульфат марганца, вода и кислород
19. При взаимодействии бромистоводородной кислоы (НВr) с двуокисью марганца образуются:
Бром, вода, бромид марганца
2) Бром, вода, бромат марганца
3) Бром и бромид марганца
4) Бромистый водород, вода и бромид марганца
5) Бром и бромат марганца
20. CrO3 проявляет:
1) Окислительно-восстановительную двойственность
Окислительые и кислотные свойства
4) Основные свойства 5) Амфотерные свойства 21. Металлы реагируют с неокисляющими кислотами с выделением водорода если:Na, Fe, Pb, Au, Pt
2) Au, Na, Fe, Pb, Pt
3) Pt, Au, Na, Fe, Pb
4) Pt, Au, Na, Pb, Fe
5) Na, Fe, Pt, Au, Pb
23. Металл может быть получен электролизом водных растворов солей этого металла:
1) Натрий
2) Калий
Медь
4) Кальций
5) Литий
24. Латунь это сплав:
1) Меди и цинка
2) Меди и олова
3) Лантана и цинка
4) Меди и золота
5) Меди и серебра
25. Реакция : Me + nHCl = MeCln + H2 xaрактерна для :
Li
2) Cu
3) Ag
4) Pt
5) Au
Тесты по разделу «Металлы и электрохимический ряд напряжений металлов»
1. Координационное число в кристаллической решетке металлов может быть равным
1) 6 и 8
2) 8 и 10
И 12
4) 6 и 10
2. В узлах кристаллической решетки металлов находятся
1) нейтральные атомы металла
Положительно заряженные ионы металла
3) отрицательно заряженные ионы металла
5) отрицательно и положительно заряженные ионы металла.
3. Наибольшей электропроводностью среди металлов обладают
1) Fe, Co , Ni
2) Zn, Cu, Fe
3) Al, Cr, Mn
Au, Ag, Cu
4. В химических реакциях металлы выступают в роли
1) окислителей
2) восстановителей
3) окислителей и восстановителей
4) акцепторов электронов
5. Электродные потенциалы не зависят от
1) природы металла
2) концентрации соли
3) атомной массы металла
4) температуры
6. Промышленная очистка титана от примесей осуществляется
Иодидным способым
3) отгонкой летучих соединений 4) зонным методом. 7. Промышленная очистка меди от примесей осуществляетсяNa и Mg
2) Pb и Zn
3) Cu и Ag
4) Fe и Ni
10. При электрохимическом рафинировании меди, содержащей марганец, цинк, золото и серебро в анодный шлам перейдут
1) Zn и Ag
2) Mn и Au
Au и Ag
Zn и Mn
11. При электрохимическом рафинировании меди, содержащей марганец, цинк, железо и серебро в раствор перейдут
1) Mn u Zn
2) Mn u Ag
3) Mn, Ag u Fe
Mn, Zn u Fe
1) 0,001 моль/л 2) 0,01 моль/л 3) 0,1 моль/лAg u Pt
3) Zn u Mg
4) Sn u Al
20.Амфотерными свойствами обладают металлы
1) Fe u Ni
Be u Al
3) Na u Mg
4) Co u K
21.Не взаимодействуют с водой
1) Mg u K
2) Mn u Na
3) Ca u Ba
Zn u Sn
22.Относятся к легким конструкционным следующие металлы
Mg u Al
2) Co u Ni
3) Ti u Pt
4) Cu u Zn
23. Из четырех металлов Li , Na , K , Rb наименьший потенциал ионизации имеет
1) Li
2) Na
3) K
Rb
24. Из четырех металлов Mg , Ca , Sr , Ba наименьшую электроотрицательность имеет
1) Mg
2) Ca
3) Sr
Ba
25.Разбавленная серная кислота не взаимодействует со следующими металлами
Сu u Hg
3) Zn u Cr 4) Mg u Pb Тесты по разделу «Строение атома и периодическая система Д.И.Менделеева»КДж
2) +2,8 кДж
3) –790,4 кДж
4) +790,4 кДж
5) +44,5 кДж
22. Для реакции, протекающей в стандартных условиях, известны стандартные энтальпии образования исходных веществ и продуктов реакции:
СО(г) + 3Н2(г) = СН4(г) + Н2О(г)
Н0обр. –110,6 -74,8 -241,2 кДж/моль
Изменение энтальпии в указанной реакции составляет:
1) +205,4 кДж
2) –205,4 кДж
3) –426,6 кДж
4) +426,6 кДж
5) –25,4 кДж
23. Для реакции, протекающей в стандартных условиях, известны значения энтальпии образования исходных веществ и продуктов реакции:
4НСl + О2 = 2Н2О + 2Сl2
ΔН0обр. –92,5 -242,0 кДж/моль
Изменение энтальпии в ходе данной реакции составляет:
1) +114,0 кДж
2) –114,0 кДж
3) –854,0 кДж
4) +300 кДж
5) +432,0 кДж
24. Процессом, который характеризуется наибольшим возрастанием энтропии,является:
1) конденсация
2) испарение
3) кристаллизация
4) охлаждение
5) изменение кристаллической модификации
25. Внутренняя энергия системы в экзотермических реакциях изменяется следующим образом:
1) увеличивается
2) уменьшается
3) не изменяется
4) знак ΔU зависит от агрегатного состояния вещества
5) знак ΔU зависит от давления в объёме
Тесты по разделу «Растворы»
1.Зависимость осмотического давления раствора от концентрации растворённого вещества описывается законом:
1)Менделеева
Вант-Гоффа
3)Фарадея
4)Авогадро
5)Генри
2 «Понижение давления насыщенного пара растворителя над раствором пропорционально мольной доле растворённого вещества».
Приведённое выражение представляет собой
1)закон Гесса
Закон Рауля
3)закон Фарадея
4)закон Ома
5)первый закон термодинамики
3.Раствор, в котором не происходят химические реакции между компонентами, а силы межмолекулярного взаимодействия между компонентами одинаковы, называется
1)насыщенным
2)концентрированным
Идеальным
4)реальным
5)пересыщенным
4.Отношение числа молекул электролита, распавшихся на ионы, к общему числу его молекул в растворе, называется:
1)степенью гидролиза
Степенью диссоциации
3)произведением растворимости
4)константой диссоциации
5)константой гидролиза
5. Выражение «раствор с массовой долей соли 3%» означает:
1)в 100 г воды растворено 3 г соли
2)в 1 л воды растворено 3 г соли
В 100 г раствора содержится 3 г соли
4)в 103 г раствора содержится 3 г соли
5)в 97 г раствора содержится 3 г соли
6.Число молей гидроксида калия, содержащихся в 500 мл 0,2 М раствора КОН, равно
1) 0,2
2) 0,25
3) 0,3
4)0,1
5)0,125
6. Масса гидроксида натрия, содержащаяся в 500 мл его 1М водного раствора, равна:
1) 10 г
2) 40 г
Г
4) 60 г
5) 50 г
7. Масса хлорида калия, содержащаяся в двух литрах 1М раствора, равна:
1) 74,5 г
Г
3) 35,5 г
4) 39 г
5) 37,2 г
8. Чему равна молярная концентрация раствора, полученного разбавлением 250 мл 2М раствора до объёма 1 л?
1) 0,1 М
М
3) 1 М
4) 1,2 М
5)1,5 М
9. В 250 миллилитрах раствора серной кислоты, имеющего концентрацию 1 моль/л. содержится
1) 98 г кислоты
Г кислоты
3) 49г кислоты
4) 125 г кислоты
5) 9,8 г кислоты
10.Водородный показатель (рН) 0,01 М раствора азотной кислоты равен:
1) 1
2) 0,01
3) 2
4) 10
5)12
11.Водородный показатель (рН) раствора гидроксида калия, имеющего концентрацию 0,01 моль/л, равен:
1) 0,01
2) 2
3) 12
4) 1
5) 10
13. Для уравнения реакции: CuSO4 + NaOH = …………
сокращённое ионное уравнение запишется в виде:
1)Cu2+ + 2OH- = Cu(OH)2
2)CuSO4 + 2OH- = Cu(OH)2 + SO42-
3)SO42- + 2Na+ = Na2SO4
4)2NaOH + Cu2+ = Cu(OH)2 + 2OH-
5)CuSO4 + 2Na+ = Na2SO4 + Cu2+
14. Для уравнения реакции FeCl2 + H2S = …………….
сокращённое ионное уравнение запишется в виде:
1)Fe2+ + S2- = FeS
2)Fe2+ + H2S = Fe2+ + S2- + 2H+
3)Fe2+ + H2S = FeS + 2H+
4)2Cl- + H2S = 2HCl + S2-
5)FeCl2 + S2- = FeS + 2Cl-
15. Сокращённому ионному уравнению : Н+ + ОН- = Н2О
соответствует следующая реакция в молекулярном виде:
1)BaCl2 + H2SO4 = BaSO4 + 2HCl
2)NaOH + HNO3 = NaNO3 + H2O
3)CuCl2 + 2NaOH = Cu(OH)2 + 2NaCl
4)AgNO3 + KI = KNO3 + AgI
5)FeCl3 + 3H2O = Fe(OH)3 + 3HCl
16. Ионы Cl- образуются при диссоциации соли:
1)гидросульфид калия
Хлорид калия
3)бертолетова соль KClO3
4)гипохлорит калия KClО,
5)перхлорат калия КClO4
17. Из приведённых ниже солей по катиону гидролизуются:
1) KNO3
2) NaCl
3) ZnCl2
4) K2SO4
5) BaCl2
18. Из приведённых ниже солей по аниону гидролизуются:
1)сульфат меди (II)
2)хлорид алюминия
3)нитрат железа(III)
Сульфид натрия
19. Из приведённых ниже солей гидролизуется одновременно по катиону и аниону: 1)нитрат меди (II) 2)хлорид барияДополнение
1. Соединение, в котором углерод имеет степень окисления - 4: 1. CO2; 2. CCl4;– Конец работы –
Используемые теги: тесты, химии0.046
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Тесты по химии
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов