рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Образование
- /
- Изохорный процесс
Реферат Курсовая Конспект
Изохорный процесс
Изохорный процесс - раздел Образование, 77.изохорный Процесс. (V=Const) Диаграмма Этого ...
77.Изохорный процесс. (V=const)
Диаграмма этого процесса (изохора) в координатах p,V изобр-ся прямой, параллельной оси ординат
δQ=dU δA=pdV=>δA=0
Удельная теплоемкость равна кол-ву теплоты, которое небход. Затратить для нагрев. 1кг вещ-ва на 1К.
С=δQ/mdT [Дж/кг*К]
Молярная теплоемкость при V=const
Сv=δQ/νdT Cv=δQ/νdT=(ν=1; δQ=dU)=dU/dT
U=i/2kT*Na=i/2RT
Cv=i/2R-не зависит от Т, опр-ся только числом степеней свободы i
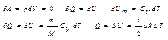

78.Изобарный процесс (p=const)
Диаграмма этого процесса в координатах p,V изобр-ся прямой параллельной оси  V. При изобарном процессе работа газа при увеличении объема от V1 до V2 равна
V. При изобарном процессе работа газа при увеличении объема от V1 до V2 равна
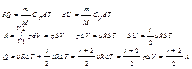
79.Изотермический процесс (T=const)
Описывается законом Бойля-Мариотта
Диаграмма этого процесса (изотерма) в координатах p,V представляет собой гиперболу, расположенную на диаграмме тем выше, чем выше температура, при которой происходит процесс.

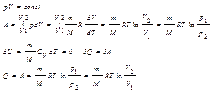 Следовательно, для того чтобы при расширении газа температура на понижалась, к газу в течение изотермич. процесса необходимо подводить кол-во теплоты, эквивалентное внешней работе расширения.
Следовательно, для того чтобы при расширении газа температура на понижалась, к газу в течение изотермич. процесса необходимо подводить кол-во теплоты, эквивалентное внешней работе расширения.
Неполноценность I начала термодинамики. Различные формулировки второго начала. Круговые процессы. Тепловые машины.
Феноменологич. формулировка II начала терм-ки: вечный двигатель II рода невозможен. Вечный двигатель II рода - периодически действующий двигатель, совершающий… Его КПД = 1, т.е. это двигатель, работающий только за счёт получения тепла из вне.Адиабатный процесс. Уравнение адиабаты. Политропный процесс.
продифференцировав уравнение состояния для идеального газа, получим: разделив переменные и учитывая, что Ср/Сv= g найдем интегрируя это выражение в пределах от р1 до р2 и соответственно от V1 до V2,… - уравнение адиабатического процесса.(уравнение Пуассона) g- показатель адиабатыПрименение 1 начала терм-ки к изопроцессам в идеальном газе
Уравнение политропы: Здесь и- показатель политропы С помощью этого показателя можно легко описать любой изопроцесс:Цикл Карно с идеальным газом
Карно проанализировал обратимый цикл, состоящий из двух изотерм и двух адиабат. Его называют циклом Карно. Рассмотрим прямой цикл Карно, в котором в… Изотермические расширение и сжатие заданы соответственно кривыми 1—2 и 3—4, а…Взаимодействие молекул и агрегатные состояния
В модели идеального газа, используемой в МКТ газов, пренебрегаются размерами молекул и их взаимодействием друг с другом. Следовательно, МКТ позволяют отследить поведение разряженных реальных газов при достаточно высоких температурах и низких давлениях.
С ростом давления среднее расстояние между
Закон возрастания энтропии. Гипотеза о тепловой смерти Вселенной
2.Если система не замкнутая, то dS≥dQ/T. Уравнения 1 и 2 это аналитическая запись 2-го начала термодинамики. Примеры возрастания энтропии: Теплопроводность: ∆Q1=∆Q2=∆Q ∆QГипотеза о тепловой смерти Вселенной.
Статистический смысл 2-го начал термодинамики.
Формула Стерлинга: ln N!=NlnN-N, ln WT2=lnN!-ln(N!/2)-ln(N!/2)=NlnN-N-(N/2)∙lnN/2+N/2=NlnN-NlnN/2=Nln2 => WT2=2N, P2/P1=WT2, P2/P1=2N. При…Общие сведения о явлениях переноса. Средн длина свободн пробега молекул.
Считаем, что все молекулы кроме одной неподвижны. Взаимодействие молекул происходит в рез-те удара. След-но, центр «подвижной» молекулы будет двигаться по ломаной линии. От удара до удара будет прямая линия, длина которой будет наз-ся длиной свободного пробега λi . λср=Σλi/z-средняя длина свободн пробега (z-число столкновений). Молекула на своем пути будет сталкиваться со всеми молекулами, расстояние м/у центрами которых и центром движущейся молекулы ≤d. D=R1+R2=R
R1-радиус движущейся молекулы, R2-радиус покоящейся молекулы. Если R1=R2, то 2R=d-диаметр молекулы, т.е, столкновение м/у двумя молекулами будет происходить если центры неподвижных молекул окажутся внутри объема с площадью сечения S=σ=πd2 длиной l=λi σ=полное поперечное сечение рассеяния. Выпрямим ломаную траекторию движения молекул. В этом случае z-число молекул в объеме с длиной l равной пути пройденному движущейся молекулой за время t.
Z=N=nV=nσυt=nπd2υt n-концентрация молекул.
λi=υiti; Σλi=υt; λср=(Σλi/z)=υ/nπd2υ
Более точный расчет дает формулу: λср=1/√2πd2n
P=nkT=>n=p/kT
λср=kT/√2πd2p=kT/√2σp при T=сonst λ~1/p
Газ при нормальных условиях:
T=300K, p≈106дин/см2, 1дин=г*см/с2, d~2*10-8cм, σ~12*10-16cм2 => λср=2*10-5м
l>>d газ достаточно разряжен. Общие сведения о явлениях переноса: диффузия, внутреннее трение, теплопроводность.
Диффузия.
Где Jm - плотность потока массы — величина, определяемая массой вещества, диффундирующего в единицу времени через единичную площадку,… D=⅓<υ><l>. 84.Термодинамическая вероятность макроскопического состояния. Распределение молекул по объёму.Основные положения классической статистики
1. Молекулы представляют собой частицы которые подчиняются классическим законам механики. Энергия и другие характ. частиц изменяются непрерывно и могут принимать значения от 0 до сколь угодно больших значений.
2. Принцип различимости тождественных частиц: молекулы обладают индивидуальностью позволяющей их отличать друг от друга.
3. Все микросостояния системы равно вероятны.
Распределения молекул по объему
Залетело две молекулы P1*P2=1/2*1/2=1/4. Из таблицы следует WT1/WT2=P1/P2. Равномерное распределение молекул по V является не единственно возможным,… Молекулы системы совершают беспорядочное движение. Сл-но, число микросостояний…Энтропия. Формула Больцмана.
Для кругового обратимого процесса SВ=SA сл-но, , dQ/T-полный дифференциал некоторой ф-ии S, которая определяется т-ко состоянием системы и не… Энтропия идеального газа для изохоры: V=const, ΔS=Cv *ln(T2/T1). Для изобары: P=const, ΔS=Cv *ln(T2/T1 )+ R*ln(V2/V1).Закон возрастания энтропии.
2.Если система не замкнутая, то dS≥dQ/T. Уравнения 1 и 2 это аналитическая запись 2-го начала термодинамики. Примеры возрастания энтропии: Теплопроводность: ∆Q1=∆Q2=∆Q ∆QГипотеза о тепловой смерти Вселенной.
Статистический смысл 2-го начал термодинамики.
Формула Стерлинга: ln N!=NlnN-N, ln WT2=lnN!-ln(N!/2)-ln(N!/2)=NlnN-N-(N/2)∙lnN/2+N/2=NlnN-NlnN/2=Nln2 => WT2=2N, P2/P1=WT2, P2/P1=2N. При… 88. Свободная энергия.Общие сведения о явлениях переноса. Средн длина свободн пробега молекул.
Считаем, что все молекулы кроме одной неподвижны. Взаимодействие молекул происходит в рез-те удара. След-но, центр «подвижной» молекулы будет двигаться по ломаной линии. От удара до удара будет прямая линия, длина которой будет наз-ся длиной свободного пробега λi . λср=Σλi/z-средняя длина свободн пробега (z-число столкновений). Молекула на своем пути будет сталкиваться со всеми молекулами, расстояние м/у центрами которых и центром движущейся молекулы ≤d. D=R1+R2=R
R1-радиус движущейся молекулы, R2-радиус покоящейся молекулы. Если R1=R2, то 2R=d-диаметр молекулы, т.е, столкновение м/у двумя молекулами будет происходить если центры неподвижных молекул окажутся внутри объема с площадью сечения S=σ=πd2 длиной l=λi σ=полное поперечное сечение рассеяния. Выпрямим ломаную траекторию движения молекул. В этом случае z-число молекул в объеме с длиной l равной пути пройденному движущейся молекулой за время t.
Z=N=nV=nσυt=nπd2υt n-концентрация молекул.
λi=υiti; Σλi=υt; λср=(Σλi/z)=υ/nπd2υ
Более точный расчет дает формулу: λср=1/√2πd2n
P=nkT=>n=p/kT
λср=kT/√2πd2p=kT/√2σp при T=сonst λ~1/p
Газ при нормальных условиях:
T=300K, p≈106дин/см2, 1дин=г*см/с2, d~2*10-8cм, σ~12*10-16cм2 => λср=2*10-5м
l>>d газ достаточно разряжен. Общие сведения о явлениях переноса: диффузия, внутреннее трение, теплопроводность.
Диффузия.
Где Jm - плотность потока массы — величина, определяемая массой вещества, диффундирующего в единицу времени через единичную площадку,… D=⅓<υ><l>.Взаимодействие молекул и агрегатные состояния
В модели идеального газа, используемой в МКТ газов, пренебрегаются размерами молекул и их взаимодействием друг с другом. Следовательно, МКТ позволяют отследить поведение разряженных реальных газов при достаточно высоких температурах и низких давлениях.
С ростом давления среднее расстояние между
– Конец работы –
Используемые теги: Изохорный, процесс0.051
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Изохорный процесс
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов