рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Энергетика
- /
- Особенности процесса коррозии
Реферат Курсовая Конспект
Особенности процесса коррозии
Особенности процесса коррозии - раздел Энергетика, ...
 | |||
 |
особенности процесса коррозии:
► самопроизвольный
nMе + mOx → MеnRedm 
► гетерогенный
► нежелательный
►возможность протекания процесса коррозии
G КОР < 0 , не дает реальных представлений
О скорости коррозии.
Пример
Al + 3O2 + 6H2О = 4Al(OH)3 , кДж < 0.
THORN; Al - интенсивно корродирует под действием О2.
THORN; Al - конструкционный материал.
Причина – продукты коррозии - оксидные, гидроксидные, солевые и др. пленки тормозят дальнейший процесс коррозии - пассивация металла.

Скорость:
V ХИМ.КОР << v ЭЛ.ХИМ.КОР ≈ в 100 раз

Газовая, высокотемпературная коррозия:
nMе + mOx → MеnRedm
Fe + O2 → 2FeO
Fe + H2O( Г ) → FeO + Н2
Fe + Cl2 → FeCl2
Fe + SO2 → FeS+ 2FeO
И т.д.
►ΔG КОР , Т < 0 Þ процесс идет самопроизвольно
THORN; образование продуктов коррозии MеnRedm на
Поверхности металла Mе Þ ↓ доступ Ox к Mе
THORN; постепенно ↓v ХИМ.КОР .

Механизм:
Т ПОВ.МЕТ. < Т ОКР.СРЕДЫ
THORN; конденсация влаги на поверхности Ме
(слой Н2О 2 ÷ 3 молекулы)
THORN; растворение газов из окружающей среды в
Поверхностном слое влаги
THORN; Ме погружен в раствор электролита
THORN; на поверхности Ме образуется множество
короткозамкнутых коррозионных микро ГЭ:
А : Ме → Меn+ + nе
K : Ox + nе → Red
Поверхность Ме энергетически неоднородна:
► на участках, имеющих более отрицательное
значение Е
THORN; окисление Ме Þ анодные участки
Коррозионных гальванических элементов.
► на участках, имеющих более положительное
значение Е
THORN; восстановление Ox из окружающей среды
THORN; катодные участки коррозионных ГЭ.
Например:
Сталь углеродистая Fe – Fe3C
/
Анодный участок катодный участок
Латунь Cu – Zn
/
Катодный участок анодный участок
Сталь с продуктами Fe + {FeO
коррозии: / {Fe2O3
/ {Fe(OH)2
/
Анодный участок катодный участок
Разные механические нагрузки
Разная аэрация отдельных участков конструкции.
Самые распространенные окислители:
► О2 воздуха, растворенный в электролите
► ионы Н+ - деполяризаторы
- кислородная деполяризация:
O2 + 2H2O + 4е→ 4OH- pH ³ 7
O2 + 4H+ + 4е → 2H2O pH < 7
- водородная деполяризация:
H+ + 2е → H2 pH < 7
H2O + 2е → H2 + 2OH– pH ³ 7
ПРАВИЛА:
►Энергия Гиббса коррозии: 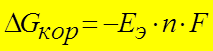
G КОР < 0
► ЭДС коррозионного ГЭ:

ЕЭ > 0
►При контакте металлов М1 - М2 - М3
Корродирует 1 – с самым отрицательным значением
потенциала Е Меn+/Ме
Пусть Е Ме1n+/Ме1 < Е Ме2n+/Ме2 < Е Ме3n+/Ме3

ß ß
Самый отрицательный выполняют роль
Szlig; катодной подложки
Анод коррозионного ГЭ
ß
эл.-хим. коррозия М1,
если Е Ме1n+/Ме1 < Е Ox/Red
► Для оценочных расчетов:
Е0 Меn+/Ме определяем по таблице СЭП
Е р Ox / Red рассчитываем по уравнению Нернста
Потери массы металла
N - число электронов, участвующих в
Электрохимической реакции
I - ток коррозии, τ - время коррозии, F =26,8 А. час
►по закону эквивалентов:
Количество эквивалентов Ox , вступивших в
Реакцию, = количеству эквивалентов
прокорродировавшего Ме
► nЭ, Ме = nЭ, Н2 + nЭ, О2
масса металла m Ме = nЭ, Ме . МЭ, Ме
тогда при Н.У. (р =101 кПа, Т =273 К):
- потери массы металла:

где VН2 – объем выделившегося водорода, л,
VО2 – объем поглощенного кислорода, л,
В результате электрохимической коррозии
При н.у. V 0Э,Н2 = 11,2 л/моль; V 0 Э,О2 = 5,6 л/моль


Задача
Имеется спай Sn - Ag. Определить
Возможность коррозии при эксплуатации изделия в
Щелочной среде (рН = 9) при контакте с кислородом.
Написать уравнения коррозионных процессов.
Решение.
 B,
B,  B,
B,
Т.к. Þ анод - Sn, катод – Ag.
 B,
B,
 B.
B.
Lt; Þ водородная деполяризация
НЕ идет
Gt; Þ кислородная деполяризация
Идет
A : Sn → Sn2+ + 2е
K : O2 + 2H2O + 4е → 4OH–
Задача
При коррозии железного изделия Fe с поглощением
Кислорода О2 за 3 мин образовалось 0,125г Fe(OH)2.
Вычислите объем кислорода VО2 , израсходованного на
коррозию железа, силу коррозионного тока IКОР
И массу металла m Ме , разрушенного коррозией.
Решение.
 моль-экв.
моль-экв.
Вещества взаимодействуют в эквивалентных количествах:
Моль-экв
Мл
По закону Фарадея :
А
масса прокорродировавшего железа: 
Г.

Коррозия Fe-Fe3C (углеродистая сталь)
Среда: кислая в отсутствии воздуха (нет О2),
Окислитель - Н +

 <
< 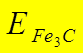 Þ Fe - участок -коррозия
Þ Fe - участок -коррозия

Fe3C - участок –катодная подложка

Fe – 2e ® Fe2+ , Коррозионная диаграмма:
Е ,В


 2H+ + 2e ® H2
2H+ + 2e ® H2

 Екор
Екор
I,мА
Iкор

Основные характеристики .
Электрохимической коррозии: .
► Iкор - ток коррозии или плотность тока коррозии iкор (показывают скорость коррозионного процесса в электрических единицах). ► v КОР - скорость коррозии - потери металла в единицу времени ( m ) или величина тока ( Iкор ) или плотности тока ( iкор ) коррозии:Скорость коррозии лимитируется скоростью
Самой медленной стадии Þ чаще катодная реакция
Коррозионная диаграмма
Е,В с лимитирующим
 катодным контролем:
катодным контролем:
ЕА
Екорр
iкорр
ЕК
iкорр
i А/м2
Коррозия с водородной деполяризацией
Þ коррозия в выделением Н2
А: Ме → Меn+ + nе
К: 2H+ + 2е → H2 pH < 7
H2O + 2е → H2 + 2OH– pH ³ 7
Условие коррозии: ЕрМеn+/Ме < ЕрН+/Н2 ► Характерна для кислых сред с рН< 7 или для нейтральной среды с рН = 7 –Присутствие в составе металла примесей (Hg, Pb, Cd, Zn) – на этих металлах плохо выделяется водород - с большой поляризацией: ↓ v КОР в целом.
↑S К-фазы Þ ↑iКОР Þ ↑vКОР ► v КОР = ƒ (рН среды): ↓рН Þ ↑vКОР ► v КОР = ƒ (температуры): ↑Т Þ ↑vКОРА: Ме → Меn+ + nе
К: O2 + 2H2O + 4е→ 4OH- pH ³ 7
O2 + 4H+ + 4е → 2H2O pH < 7
►Ox - О2, растворенный в электролите
► Условие коррозии: Ер Меn+/Ме < Ер О2/ОН –
► Характерна для любой среды с 7 ≤ рН ≤ 7
Самая распространенная коррозия – в атмосфере,
В воде, в грунте.
► Лимитирующая стадия - диффузия молекул О2
Через диффузионный слой.
Скорость определяется предельной плотностью тока iпр:
iпр = 4F .DO2 .cO2 .δ-1 ,
где DO2 - коэффициент диффузии кислорода;
cO2 - концентрация кислорода в растворе;
Толщина диффузионного слоя.
► v КОР ≠ ƒ (природы металла) ► v КОР ≠ ƒ (количество К – фазы) ► v КОР = ƒ (рН среды): ↓рН Þ ↑vКОРПри перемешивании коррозионной среды Þ ↑↑ vКОР.
● . Коррозия со смешанной деполяризацией
Þ коррозия с поглощением О2 и выделением Н2
А: Ме → Меn+ + nе
К: O2 + 2H2O + 4е→ 4OH- pH ³ 7
2H2O + 2е → H2 + 2OH–
или ----------------------------------------------------
К: O2 + 4H+ + 4е → 2H2O pH < 7
►Ox - ион H+ и О2, растворенный в электролите ► Условие коррозии: Ер Меn+/Ме < Ер Н+/Н2 , Ер О2/ОН-Образование на поверхности металла
Плотной труднорастворимой защитной пленки
Из продуктов коррозии, которая тормозит
Анодный процесс и Þ скорость
Электрохимической коррозии в целом .
Скорость коррозии лимитируется скоростью
THORN; анодной реакции для металлов, способных
к пассивации ( Cr, Ti, Ni, Co, Pt, Pd, Os, Ru, Al )
Коррозионная диаграмма
Е,В с лимитирующим
ЕА Екорр ЕКМеханизм действия – адсорбция ингибиторов на корродирующей поверхности Þ торможение процесса коррозии.
Анодные ингибиторы: - NaNO2, NaNO3, K2SeO4, NaF, Na2SiO3, Na3PO4, H2O2, хромпик K2Cr2O7. - вызывают пассивацию металла. С инг = 10-4 – 10-3 моль/л – строгий контроль.
Катодные ингибиторы: - соли тяжелых металлов AsCl3, Bi2(SO4)3, Sb2(SO4)3, уротропин N4(CH2)4, пиридин C6H5N, диэтиламин (CH3CH2)2NH.
►– легирование - обычно компонентами,
повышающими пассивацию металла -
Cr, Ni, Al, Mn, Mo, Cu.
Пример: способность металлов к пассивации в растворе NaCl при 250С:
Min
Пасс.
Cu-Pb-Sn-Cd-Zn-Mn-Fe-Co-Ni-Mo-Be-Cr-Al-Nb-Ta-Zr-Ti
Max
Пассивация
►– защитные неметаллические покрытия
Лаки, краски, цемент, резина, органика – при низких
Температурах (до 2000 С).
…Me + Mt
/
Основной покрытие
Металл
► катодное покрытие: Е0 Ме < Е0 Мt
при повреждении покрытия: /
Анод катодная
Подложка
При Е0Ме < Ер Ox Þ коррозия
А : Ме → Меn+ + nе
K : Ox + nе → Red
► анодное покрытие: Е0 Мt < Е0 Ме
при повреждении покрытия: /
Анод катодная
Подложка
При Е Мt < Е Ox Þ коррозия
А : Мt → Мtn+ + nе
K : Ox + nе → Red
THORN; нет коррозии Ме.
Источника тока Þ Ме становится катодом Þ нет
Коррозии Ме
► анодная защита – подключение защищаемого Ме к положительному полюсу внешнего источника тока Þ перевод Ме в пассивное… ►протекторная защита - присоединение к защищаемому изделию Ме протектора Пр – металлаА : Пр → Прn+ + nе
K : Ox + nе → Red
THORN; нет коррозии Ме.
Задача
Предложите анодное покрытие для защиты железного
Fe -изделия от электрохимической коррозии в
Кислородсодержащей среде при рН = 7, ргаз =1.
Напишите уравнения коррозионных процессов при
Нарушении целостности покрытия.
Решение.
В качестве анодного покрытия для Fe Þ металлы с
более отрицательным значением потенциала,
Е0 Мtn+/Mt < Е0 Fe2+/Fe (например, Zn, Cr, Al и др.).
Выберем хром:  В <
В <  В.
В.
По уравнению Нернста определим равновесные потенциалы вероятных окислителей ( Н+ и О2):
 В,
В,
В.
Т.к. <Þ при нарушении целостности хромового покрытия на железном изделии
THORN; хром – анод Þ коррозия.
т.к.  <
<  ,
,  Þ в данной среде термодинамически возможна коррозия хрома с кислородной и водородной деполяризацией:
Þ в данной среде термодинамически возможна коррозия хрома с кислородной и водородной деполяризацией:
A- : Cr → Cr3+ + 3е
K+ : O2 + 2H2O + 4е → 4OH-
2H2O + 2е → H2 + 2OH-
В нейтральной среде:
Хром Cr Þ склонен к пассивации Þ отличается высокой коррозионной стойкостью. Продукты коррозии хрома (Cr2O3 , Cr(OH)3 и др.) образуют на поверхности металла плотные труднорастворимые оксидно-солевые защитные пленки Þ затрудняется контакт Me - Ox
Þ тормозится дальнейший процесс коррозии. Þ
THORN; Поэтому, хотя термодинамически коррозия возможна, железное изделие c хромовым покрытием реально не разрушается под действием коррозии.
Задача.
Предложите катодное покрытие для защиты железного Fe - изделия от электрохимической коррозии в кислородсодержащей среде при рН = 8 и ргаз =1. Напишите уравнения коррозионных процессов при нарушении целостности покрытия.
Решение.
В качестве катодного покрытия для Fe Þ металлы с
более положительным значением потенциала,
Е0 Мtn+/Mt > Е0 Fe2+/Fe (например, Ni, Cu, Ag и др.).
Выберем медь:  В >
В >  В.
В.
Т. к. < Þ при нарушении целостности медного покрытия на железном изделии
THORN; железо – анод Þ коррозия.
По уравнению Нернста определим равновесные потенциалы вероятных окислителей ( Н+ и О2):
 В,
В,
В.
Т. к. < < Þ в данной среде термодинамически возможна коррозия железа с кислородной деполяризацией и невозможна коррозия с выделением водорода.
A- : Fe → Fe2+ + 2е
K+ : O2 + 2H2O + 4е → 4OH--
Железное изделие при этом будет разрушаться.
Задача.
Напишите уравнения электрохимической коррозии пары Sn-Zn при рН=5 и 298 К.
Сколько и какого металла прокорродировало, если в процессе коррозии поглотилось VО2 = 56 мл кислорода и выделилось VН2 = 22,4 мл водорода?
Определите коррозионный ток I КОР , если продолжительность коррозии τ = 20 мин.
Решение. Стандартные потенциалы металлов:
 B,
B,  B,
B,
Т.к. < Þ в заданной
Гальванической паре Þ Zn – анод , Sn- катод.
В, В. т.к. <, Þ в данной среде термодинамически возможна электрохимическая коррозия цинка с кислородной и…K+ : O2 + 4H+ + 4е → 2H2O
2H+ + 2е → H2
Определим количество моль-эквивалентов nЭ поглотившегося кислорода и выделившегося водорода (н.у. ,  л/моль,
л/моль,  л/моль):
л/моль):
 моль-экв,
моль-экв,
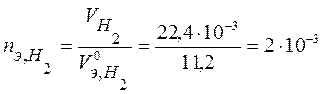 моль-экв.
моль-экв.
Таким образом, на катоде претерпело изменение
NЭ, К =1,2.10-2 моль-экв. окислителя.
По закону эквивалентов: nЭ, К = nЭ, А = 1,2.10-2 моль-экв.
THORN; на аноде: моль-экв.
Масса прокорродировавшего цинка ( г/моль):
г/моль):
Г.
M Zn = 0,39 г
Величина коррозионного тока определяется
по закону Фарадея:
А.
I КОР = 0,96 A
Задача.
Выберите протектор для защиты стальной конструкции (Fe ) в кислой среде ( рН=4) на воздухе. Напишите уравнения процессов коррозии.
Рассчитайте, как изменится масса протектора mПР, если за некоторое время в процессе коррозии поглотилось VО2 =112 мл кислорода и выделилось VН2 = 112 мл водорода.
Решение.
При протекторной защите к металлическому изделию подсоединяются металл с более отрицательным значением потенциала, чем потенциал защищаемого изделия: Е0 ПР < Е0 Ме .
Для железа (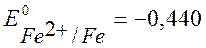 В) Þ
В) Þ
В качестве протектора можно использовать:
Þ магний ( В),
В),
Þ цинк (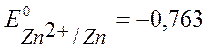 В),
В),
THORN; алюминий (В).
При контакте с окислителем металл протектора растворяется, а защищаемое изделие не разрушается. Выберем магний. Так как  <
< 
THORN; в паре с железом магний Þ анод Þ коррозия.
В, В. т.к. <, Þ в данной среде термодинамически возможна электрохимическая коррозия магниевого протектора с…A- : Мg → Мg2+ + 2е
K+ : O2 + 4H+ + 4е → 2H2О
H+ + 2е → H2 .
Стальное изделие при этом не разрушается.
Определим количество моль-эквивалентов nЭ поглотившегося кислорода и выделившегося водорода (н.у.,  л/моль,
л/моль,  л/моль):
л/моль):
 моль-экв,
моль-экв,
Моль-экв.
Таким образом, на катоде претерпело изменение
NЭ, К =3.10-2 моль-экв. окислителя.
По закону эквивалентов: nЭ, К = nЭ, А = 3.10-2 моль-экв.
THORN; на аноде:моль-экв.
Масса прокорродировавшего протектора
( г/моль):
г/моль):
 г.
г.
M Mg = 0,36 г
– Конец работы –
Используемые теги: особенности, процесса, коррозии0.06
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Особенности процесса коррозии
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов