рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Изобретательство
- /
- МЕТОДИЧЕСКАЯ РАЗРАБОТКА ПРАКТИКУМ ПО ОБЩЕЙ ХИМИИ
Реферат Курсовая Конспект
МЕТОДИЧЕСКАЯ РАЗРАБОТКА ПРАКТИКУМ ПО ОБЩЕЙ ХИМИИ
МЕТОДИЧЕСКАЯ РАЗРАБОТКА ПРАКТИКУМ ПО ОБЩЕЙ ХИМИИ - раздел Изобретательство, ...

| Негосударственное Образовательное Учреждение Высшего Профессионального Образования Московский Медицинский Институт «Реавиз» |
МЕТОДИЧЕСКАЯ РАЗРАБОТКА
ПРАКТИКУМ ПО ОБЩЕЙ ХИМИИ
В.Е. Трегубова, А.В. Сафонов, К.Э. Герман
129301, г. Москва, ул. Касаткина, д. 3, стр. 2
Тел: 8 (495) 642-30-66; 8 (499) 187-14-51
В.Е. Трегубова, А.В. Сафонов, К.Э. Герман. ПРАКТИКУМ ПО ОБЩЕЙ ХИМИИ (МЕТОДИЧЕСКАЯ РАЗРАБОТКА), Изд. 2-ое, переработанное и дополненное: ММИ РЕАВИЗ. 2013. 57 с.
Утверждено на заседании кафедры естественных и медико-биологических наук ММИ РЕАВИЗ 7-го октября 2013 года.
Содержание
Как оформить работу.................................................................................................................3
О некоторых тонкостях использования химической посуды................................................4
Раздел 1. Химические методы анализа....................................................................................6
Теоретическое введение............................................................................................................6
Работа № 1. Определение содержания витамина С в различных продуктах.......................11
Работа № 2. Определение содержания редуцирующих веществ в различных продуктах..14
Работа № 3.Определение содержания антиоксидантов в различных видах чая.................20
Раздел 2. Физико-химические методы анализа......................................................................24
Теоретическое введение...........................................................................................................24
Работа № 1. Определение концентрации нитрата в пищевой продукции..........................26
Работа № 2. Определение содержания нитритов в пищевой продукции...........................33
Работа № 3.Разделение липидов различных масел естественного происхождения.........43
Список литературы..................................................................................................................52
Как оформить работу:
- Титульный лист.

- Название работы - переписать
- Цель работы. - переписать
- Теоретическое введение – требуется краткий конспект теории из общего раздела и раздела, относящегося к вашей конкретной работе.
- Приборы и реактивы – переписать.
- Ход работы – переписать.
- Результаты – представление результатов см. отдельно в каждой работе.
- Выводы – требуется объяснить, о чем говорит полученный вами результат, например о пользе продукта или ее отсутствии для организма человека.
О некоторых тонкостях использования химической посуды.
В химической лаборатории как правило используют различную стеклянную посуду и приборы – пробирки, колбы, пипетки, стаканчики и т.д. Что же нужно с ними делать?
1. Пробирки.
Пробирки – это, как правило, вытянутые узкие цилиндрические сосуды с круглым дном, диаметром ~1-1,5 см. Используются для проведения собственно химических реакций, в частности в физико-химических методах анализа или для проведения качественных реакций в аналитике вообще (когда используются небольшие объемы реагентов).
2. Колбы
Колбы бывают разные – по форме их можно разделить на конические/сферические, плоскодонные/круглодонные. Отдельной строкой идут мерные колбы – колбы с вытянутым узким горлышком, на котором нанесена метка – риска. Также колбы бывают разные по объемам. Все колбы выпускаются на стандартные объемы 25-50-100-200-250-500-1000-2000 мл. Объем указан собственно на колбе. Используются они по-разному. Обычные колбы используются так же как и пробирки – для проведения химических реакций, в случае если используется объем реактивов суммарно превышающий 10 мл. Мерные колбы используются для получения заданного объема раствора вещества с конкретной концентрацией. Их использование выглядит следующим образом: берется мерная колба необходимого объема. В нее вносится навеска вещества, которое нужно растворить или некий объем раствора, который нужно разбавить. После этого в колбу наливается, допустим, вода, вплоть до риски на горлышке колбы. После этого колбу нужно закрыть крышкой и аккуратно(!) встряхнуть. Раствор готов к употреблению!
3. Стаканчики, в случае необходимости используются точно так же как и обычные колбы.
4. Пипетки.
Пипетки – узкие стеклянные трубочки, сильно зауженные с одного конца с градуировкой на них. Выпускаются стандартных объемов – 1-2-5-10 мл. Также бывают мерные пипетки, которые позволяют вам отмерить один конкретный объем жидкости.
Как уже было сказано, на пипетках указываются их объем и некая градуировка. Градуировка соответствует объему. Часть делений подписано – это 1/10 от объема пипетки. Между каждыми из подписанных делений есть еще 10 делений, которые позволяют более точно определить, какой объем жидкости у вас в пипетке. Самое мелкое деление называется «шагом», равно 1/100 от объема пипетки и тоже указывается на пипетке.
Используются они так: пипетку зауженным концом опускают в емкость, откуда хотят набрать раствор. Затем при помощи груши (если реактив неядовит – можно ртом) засасывают в пипетку некий объем жидкости, выше отметки «0». Затем быстро зажимают свободный конец пипетки пальцем. Осторожно двигая пальцем, доводят уровень жидкости до нулевой отметки. Переносят пипетку, устанавливая ее зауженный конец над исследуемым раствором. Сливают жидкость вплоть до отметки, которая обозначает требуемый объем. Оставшуюся в пипетке жидкость переносят в слив или в исходную колбу.
4. Фотометрические кюветы.
Маленькие емкости квадратной или прямоугольной формы. Некоторые стороны могут быть матовыми – за них можно браться руками.
Используются для работы со специальными приборами – фото-электро-колориметрами (ФЭК) или спектро-фотометрами (СФ). В них вносится окрашенный раствор, интенсивность окраски которого измеряет прибор. Перед каждым использованием (т.е. внесением окрашенного раствора) необходимо промывать кювету дистиллированной водой. Нельзя хвататься за те части кюветы, которые будут стоять на пути светового луча. Также на этих частях не должно быть капель, грязи и т.д. – поэтому перед установкой в прибор их необходимо аккуратно протереть фильтровальной бумагой.
5. Электроды.
Используются для электрохимических измерений. Электрод извлекается из раствора, торец ополаскивается дистиллятом, вытирается фильтровальной бумагой, погружается в следующий раствор. Необходимое условие – чтобы электрод минимум времени проводил вне раствора – иначе он портится.
Раздел 1. Химические методы анализа.
Теоретическое введение.


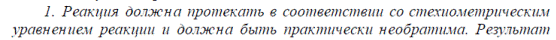







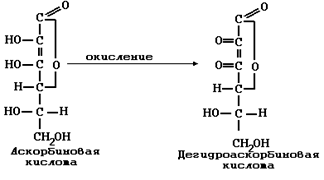
Лабораторная работа №1.
Определение содержания витамина С в различных продуктах.
Цель работы – определение содержания витамина С в пищевых продуктах – яблоке, лимоне, и др.
Теоретическое введение.


Метод относится к окислительно-восстановительному обратному титрованию. Общее название – йодометрия. Суть метода заключается взаимодействии вещества с избытком раствора йода и дальнейшем определении оставшегося количества йода. Схема реакции выглядит следующим образом:
 при этом, I2→2I-
при этом, I2→2I-
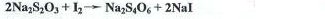
Приборы и реактивы:
- Фрукты/овощи
- Раствор I2, 0,1Н
- Раствор Na2S2O3, 0,1Н
- Раствор HCl, 0,1Н
- Раствор крахмала, 0,1%.
- Пробирки.
- Пипетки.
- Ступка.
- Пестик.
Ход работы:
- Кусочек продукта взвесить, растереть в пюре в ступке при помощи пестика; получившееся пюре перенести в колбу и залить 100 мл дистиллированной воды. Добавить несколько капель 0,1Н НCl, хорошенько взболтать.
- Отобрать в пробирку 1 мл получившегося раствора. Добавить 5 мл. 0,1Н р-ра I2. Перемешать, убрать в темное место на 5 мин.
- Через 5 мин. добавлять в пробирку ПО КАПЛЯМ (!) 0,1Н р-р Na2S2O3 до получения ярко-желтой окраски. Затем добавить каплю раствора крахмала и продолжать прибавление раствора Na2S2O3 по каплям до исчезновения синей окраски. Зафиксировать объем раствора, который был добавлен.
- Повторить п. 1-3 для всех продуктов.
Результаты:
Результаты следует представить в виде таблицы:
| № | Продукт | V 0,1H Na2S2O3, мл. | m продукта, г. | С вит.С, мг/г |
Расчет концентрации витамина С ведется на 1 г продукта по следующей формуле:
C=[(V0-Vx)*CNa2S2O3*Vразв.*М вит.С*1000]/[Vал.*fэкв.*m прод.], где
ü V0 – объем добавленного раствора йода (0,1Н I2, равен 5 мл. (см. ход работы))
ü Vх – объем добавленного раствора тиосульфата натрия (0,1H Na2S2O3, из таблицы)
ü C Na2S2O3 – концентрация раствора тиосульфата натрия (0,1 моль-экв./л)
ü Vразв. – объем воды, который был добавлен к размятому продукту (100 мл=0,1 л, см. ход работы)
ü М – молярная масса витамина С, 176 г/моль.
ü 1000 – коэффициент пересчета из г в мг
ü Vал. – объем раствора взятый на анализ (1 мл, см. ход работы)
ü fэкв. – фактор эквивалентности для Na2S2O3, (равен 1)
ü mпрод. – масса продукта, взятая на анализ, г.
Подставляя имеющиеся цифры в формулу получаем:
С=(5-Vx)*1760/mпрод., мг/г.
Лабораторная работа № 2.
Определение содержания восстанавливающих сахаров в пищевых продуктах.
Цель работы: определить содержание восстанавливающих углеводов в пищевых продуктах в пересчете на глюкозу.
Теоретическое введение:
УГЛЕВОДЫ (сахара), обширная группа полигидроксикарбо-нильных соед., входящих в состав всех живых организмов; к углеводам относят также мн. производные, получаемые при хим. Mодификации этих соед. путем окисления, восстановления или введения разл. заместителей.
Термин "углеводы" возник потому, что первые известные представители углеводов по составу отвечали ф-ле CmH2nOn (угле-род+вода); впоследствии были обнаружены природные углеводы с др. элементным составом.
Классификация и распространение.Углеводы принято делить на моносахариды, олигосахариды и полисахариды.
Моносахариды обычно представляют собой полигид-роксиальдегиды (альдозы) или полигидроксикетоны (кетозы) с линейной цепью из 3-9 атомов С, каждый из к-рых (кроме карбонильного) связан с группой ОН. Простейший моноса-харид, глицериновый альдегид, содержит один асим. атом С и известен в виде двух оптич. антиподов (D и L). Прочие моносахариды имеют неск. асим. атомов С; их рассматривают как производные D- или L-глицеринового альдегида и относят к D- или L-ряду в соответствии с абс. конфигурацией асим. атома С, наиб. удаленного от карбонильной группы. Различия между изомерными моносахаридами в каждом ряду обусловлены относит, конфигурацией остальных асим. центров.
Характерное св-во моносахаридов в р-рах - мутаротация, т. е. установление таугомерного равновесия между ациклич. альдегидо- или кетоформой, двумя пятичленными (фураноз-ными) и двумя шестичленными (пиранозными) полуацеталь-ными формами. Две пиранозы (как и две фуранозы) отличаются друг от друга конфигурацией (a или b) нового асим. (аномерного) центра, возникающего из карбонильного атома С при циклизации.
Полуацетальный (гликозидный) гидроксил циклич. форм моносахаридов резко отличается от прочих групп ОН моно-сахарида значительно большей склонностью к р-циям нукле-оф. замещения. Такие р-ции приводят к образованию глико-зидов (остаток нуклеофила в гликозиде - напр. спирта. меркаптана - носит назв. агликон). В тех случаях, когда агликоном служит др. молекула моносахарида, образуются олиго- и полисахариды. При этом каждый остаток моносахарида может в принципе иметь пиранозную или фуранозную форму, a- или b-конфигурацию гликозидного центра и быть связанным с любой из гидроксильных групп соседнего моносахарида. Поэтому число разл. по строению полимерных молекул, к-рые теоретически можно построить даже из остатков только одного моносахарида, представляет собой аст-рономич. величину.
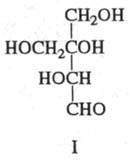
К наиб, обычным и распространенным в природе моноса-харидам относят D-глюкозу, D-галактозу, D-маннозу, D-фрук-тозу, D-ксилозу, L-арабинозу и D-рибозу. Из представителей др. классов моносахаридов часто встречаются: 1) дезоксиса-хара, в молекулах к-рых одна или неск. групп ОН заменены атомами H (напр., L-рамноза, L-фукоза, 2-дезокси-D-рибоза); 2) аминосахара, где одна или неск. групп ОН заменены на аминогруппы (напр., 2-амино-2-дезокси-D-глюкоза, или D-глюкозамин); 3) многоатомные спирты (полиолы, альди-ты), образующиеся при восстановлении карбонильной группы моносахаридов (D-сорбит из D-глюкозы, D-маннит из D-маннозы, и др.); 4) уроно-вые кислоты - альдозы, у к-рых группа CH2OH окислена в карбоксильную (напр., D-глюкуроновая к-та); 5) разветвленные сахара, содержащие нелинейную цепь углеродных атомов (напр., апиоза, или 3-С- гидроксиметил-D-глицеро-тетроза; ф-ла I); 6) высшие сахара с длиной цепи более шести атомов С (напр., D-седогеп-тулоза и сиаловые к-ты; ф-лы см. соотв. в статьях Пентозо-фосфатный цикл иМоносахариды}.
За исключением D-глюкозы и D-фруктозы своб. моносахариды встречаются в природе редко. Обычно они входят в состав разнообразныхгликозидов, олиго- и полисахаридов и м. б. получены из них после кислотного гидролиза. Разработаны многочисл. методы хим. синтеза редких моносахаридов исходя из более доступных.
Олигосахариды содержат в своем составе от 2 до 10-20 моносахаридных остатков, связанных гликозидными связями. Наиб, распространены дисахариды, выполняющие ф-цию запасных B-B: сахароза в растениях, трегалоза в насекомых и грибах, лактоза вмолоке млекопитающих.
Известны многочисл. гликозиды олигосахаридов, к к-рым относят разл. физиологически активные в-ва, напр,гликозиды сердечные, нек-рые сапонины (в растениях), мн. антибиотики (в грибах и бактериях), гликолипиды.
Полисахариды- высокомол. соед., линейные или разветвленные молекулы к-рых построены из остатков моносахаридов, связанных гликозидными связями. В состав полисахаридов могут входить также заместители неуглеводной природы (остатки алифатич. к-т,фосфат, сульфат). В свою очередь цепи высших олигосахаридов и полисахаридов могут присоединяться к полипептидным цепям с образованием гликопротеинов.
Особую группу составляют биополимеры, в молекулах к-рых остатки полиолов, гликозилполиолов, нуклеозидов или моно- иолигосахаридов соединены не гликозидными, а фос-фодиэфирными связями. К этой группе относят тейхоевые кислоты бактерий, компоненты клеточных стенок нек-рых дрожжей, а также нуклеиновые кислоты, в основе к-рых лежит поли-D-рибозофосфатная (РНК) или поли-2-дезок-си-D-рибозофосфатная (ДНК) цепь.
Физико-химические свойства.Обилие полярных функц. групп в молекулах моносахаридов приводит к тому, что эти в-ва легко раств. вводе и не раств. в малополярных орг. р-рителях. Способность к таутомерным превращениям обычно затрудняет кристаллизацию моно- и олигосахаридов, однако если такие превращения невозможны (напр., как в гликозидах и невосстанавливающих олигосахаридах типасахарозы), то в-ва кристаллизуются легко. Mн. гликозиды с малополярными агликонами (напр., сапонины) проявляют св-ва ПАВ.
Полисахариды - гидрофильные полимеры, мн. из них образуют высоковязкие водные р-ры (растит, слизи, гиалуроно-вая к-та; ф-лу последней см. в ст. Мукополисахариды), а в ряде случаев (в результате своеобразной межмол. ассоциации) - прочные гели (агар, алъгиновые кислоты, каррагинаны, пектины). Нек-рые полисахариды образуют высокоупорядоченные надмолекулярные структуры, препятствующие гидратации отдельных молекул; такие полисахариды (напр., хитин, целлюлоза)не раств. в воде.
Биологическая роль.Ф-ции углеводов в живых организмах чрезвычайно многообразны. В растениях моносахариды являются первичными продуктами фотосинтеза и служат исходными соед. для биосинтеза гликозидов и полисахаридов, а также др. классов B-B (аминокислот, жирных K-T, фенолов и др.). Эти превращения осуществляются ферментами, субстратами для к-рых служат, как правило, богатые энергией фос-форилир. производные Сахаров, гл. обр. нуклеозиддифосфат-сахара.
Углеводы запасаются в растениях (в виде крахмала), животных, бактериях и грибах (в виде гликогена), где служат энергетич. резервом. Источником энергии являются р-ции расщепления глюкозы, образующейся из этих полисахаридов, по гликоли-тич. или окислит. пути (см. Гликолиз). В виде гликозидов в растениях и животных осуществляется транспорт разл. метаболитов. Полисахариды и более сложные углеводсодержащие полимеры выполняют в живых организмах опорные ф-ции. Жесткая клеточная стенка у высших растений представляет собой сложный комплекс из целлюлозы, гемицеллюлоз и пектинов. Армирующим полимером в клеточной стенке бактерий служат пептидогликаны (муреины), а в клеточной стенке грибов и наружных покровах членистоногих - хитин. В организме животных опорные ф-ции выполняют протео-гликаны соединит, ткани, углеводная часть молекул к-рых представлена сульфатир.мукополисахаридами. Эти в-ва участвуют в обеспечении специфич. физ.-хим. CB-B таких тканей, как кости, хрящи, сухожилия, кожа. Будучи гидрофильными полианионами, эти полисахариды способствуют также поддержанию водного баланса и избират. ионной проницаемости клеток. Аналогичные ф-ции в морских многоклеточных водорослях выполняют сульфатир. галактаны (красные водоросли) или более сложные сульфатир. гетерополисахари-ды (бурые и зеленые водоросли); в растущих и сочных тканях высших растений эту ф-цию выполняют пектины.
Особенно ответственна роль сложных углеводов в образовании клеточных пов-стей и мембран и придании им специфич. св-в. Так, гликолипиды - важнейшие компоненты мембран нервных клеток и оболочек эритроцитов, а липополисахариды -наружной оболочки грамотрицат. бактерий. Углеводы клеточной пов-сти часто определяют специфичность иммунологич. р-ций (групповые в-ва крови, бактериальные антигены) и взаимод. клеток с вирусами. Углеводные структуры принимают участие и в др. высокоспецифич. явлениях клеточного взаимод., таких, как оплодотворение, узнавание клеток при тканевой дифференциации, отторжение чужеродных тканей и т. д.
Практическое использование.Углеводы составляют главную часть пищ. рациона человека, в связи с чем широко используются в пищ. и кондитерской пром-сти (крахмал, сахароза и др.). Кроме того, в пищ. технологии применяют структурир. в-ва полисахаридной природы, не имеющие сами по себе пищ. ценности,- гелеобразователи, загустители, стабилизаторы суспензий и эмульсий (альгинаты,агар, пектины, растит. галактоманнаны и др.).
Превращения моносахаридов при спиртовом брожении лежат в основе процессов получения этанола, пивоварения, хлебопечения; др. виды брожения позволяют получать из Сахаров биотехнол. методами глицерин, молочную, лимонную, глюконовую к-ты и мн. др. в-ва.
Глюкозу, аскорбиновую к-ту, углеводсодержащие антибиотики, гепарин широко применяют в медицине. Целлюлоза служит основой для получения вискозного волокна, бумаги, нек-рых пластмасс, BB и др. Сахарозу и растит, полисахари-ды рассматривают как перспективное возобновляемое сырье, способное в будущем заменить нефть в пром. орг. синтезе. Моносахариды используют в качестве доступных хиральных исходных соед. для синтеза сложных прир. B-B неуглеводной природы.
Как было указано выше, углеводы можно разделить на альдозы (содержащие в своем составе альдегидную группу, напр. глюкоза) и кетозы (содержат кетонную группу, напр. фруктоза). Важное отличие в химических свойтвах этих двух классов сахаров заключается в том, что альдозы способны восстанавливать серебро или медь до металла из их солей, а кетозы – нет. Поэтому альдозы называют также восстанавливающими сахарами, а кетозы – невосстанавливающими.
Метод представляет собой реверсионное титрование: к известному количеству раствора с известной концентрацией прибавляется раствор с неизвестной концентрацией. В ходе определения происходят следующая реакция:
CH2OH–(CHOH)4–CH=O + 2Cu(OH)2 →
→ CH2OH–(CHOH)4–COOH + Cu2O↓ + 2H2O,
Оксид меди (I) представляет собой ярко-красный кристаллический осадок, выпадение которого сильно мешает определению. Поэтому в раствор добавляется желтая кровяная соль (К4[Fe(CN)6]*4H20), которая связывает образующуюся медь в растворимый комплекс, который имеет желтую окраску.
Приборы и реактивы:
- Фрукты/овощи
- Раствор Фелинга 1: CuSO4*5H2O – 4,32г/л
- Раствор Фелинга 2: сегнетовая соль – 12,5 г/л; К4[Fe(CN)6]*4H20 – 2,5 г/л; NaOH –18,75 г/л.
- Плитка
- Колбы термостойкие
- Пипетки
- Пробирки
Ход работы:
- Кусочек продукта взвесить, растереть в пюре в ступке при помощи пестика; получившееся пюре перенести в колбу и залить 100 мл дистиллированной воды. Добавить несколько капель 0,1Н НCl, хорошенько взболтать.
- Отобрать в колбу 5 мл р-ра Фелинга 1 и 5 мл р-ра Фелинга 2. Взболтать до получения равномерно окрашенного раствора. Поставить колбу на плитку, нагреть до кипения.
- В кипящий раствор добавлять ПО КАПЛЯМ (!) раствор, полученный в п.1, до тех пор, пока раствор не сменит окраску на зеленовато-желтую. Зафиксировать объем добавленного раствора.
- Повторить п. 1-3 для всех продуктов.
Результаты:
Результаты следует представить в виде таблицы:
| № | Продукт | Vр-ра продукта, мл. | m продукта, г. | С РВ в пересчете на глюкозу, мг/г |
Концентрация раствора Фелинга (по глюкозе)=… г/л
Расчет концентрации глюкозы ведется на 1 г продукта по следующей формуле:
C=[Vфел.*Cфел.*Vразв.*1000]/[Vх*m прод.], где
ü Vфел. – суммарный объер рствора Фелинга (5+5=10 мл (см. ход работы))
ü Vх – объем добавленного раствора продукта (из таблицы)
ü Cфел.– концентрация раствора Фелинга (определяется преподавателем по глюкозе;)
ü Vразв. – объем воды, который был добавлен к размятому продукту (100 мл=0,1 л, см. ход работы)
ü 1000 – коэффициент пересчета из г в мг
ü mпрод. – масса продукта, взятая на анализ, г.
Подставляя имеющиеся цифры в формулу, получаем:
C=[Cфел..*1000]/[Vх*m прод.], мг/г.
Лабораторная работа № 3.
Определение содержания антиоксидантов в чае.
Цель работы: определить содержание антиоксидантов в чае в пересчете на рутин.
Теоретическое введение:
Кислород, необходимый организму для функционирования ЦПЭ и многих других реакций, является одновременно и токсическим веществом, если из него образуются так называемые активные формы.
· К активным формам кислорода относят:
· ОН• - гидроксильный радикал;
· 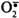 - супероксидный анион;
- супероксидный анион;
· Н2О2 - пероксид водорода.
Активные формы кислорода образуются во многих клетках в результате последовательного одноэлектронного присоединения 4 электронов к 1 молекуле кислорода. Конечный продукт этих реакций - вода, но по ходу реакций образуются химически активные формы кислорода. Наиболее активен гидроксильный радикал, взаимодействующий с большинством органических молекул. Он отнимает от них электрон и инициирует таким образом цепные реакции окисления. Эти свободнорадикальные реакции окисления могут выполнять полезные функции, например, когда клетки белой крови с участием активных форм кислорода разрушают фагоцитированные клетки бактерий.
Активные формы кислорода повреждают структуру ДНК, белков и различные мембранные структуры клеток. В результате появления в гидрофобном слое мембран гидрофильных зон за счёт образования гидропероксидов жирных кислот в клетки могут проникать вода, ионы натрия, кальция, что приводит к набуханию клеток, органелл и их разрушению. Активация перекисного окисления характерна для многих заболеваний: дистрофии мышц (болезнь Дюшенна), болезни Паркинсона, при которых ПОЛ разрушает нервные клетки в стволовой части мозга, при атеросклерозе, развитии опухолей. Перекисное окисление активируется также в тканях, подвергшихся сначала ишемии, а затем реоксигенации, что происходит, например, при спазме коронарных артерий и последующем их расширении.
Поэтому в организме функционирует эффективная система ингибирования перекисного окисления липидов (ПОЛ). Одним из компонентов этой системы являются антиоксиданты, точнее витамины и витаминоподбные вещества, обладающие антиоксидантым действием. Рассмотрим некоторые из них.
ВитаминЕ (α-токоферол) - наиболее распространённый антиоксидант в природе - является липофильной молекулой, способной инактивировать свободные радикалы непосредственно в гидрофобном слое мембран и таким образом предотвращать развитие цепи перекисного окисления. Различают 8 типов токоферолов, но α-токоферол наиболее активен.
Витамин Е отдаёт атом водорода свободному радикалу пероксида липида (ROO•), восстанавливая его до гидропероксида (ROOH) и таким образом останавливает развитие ПОЛ (рис. 8-56).
Свободный радикал витамина Е, образовавшийся в результате реакции, стабилен и не способен участвовать в развитии цепи. Наоборот, радикал витамина Е непосредственно взаимодействует с радикалами липидных перекисей, восстанавливая их, а сам превращается в стабильную окисленную форму -- токоферолхинон.
Витамин С(аскорбиновая кислота) также является антиоксидантом и участвует с помощью двух различных механизмов в ингибировании ПОЛ. Во-первых, витамин С восстанавливает окисленную форму витамина Е и таким образом поддерживает необходимую концентрацию этого антиоксиданта непосредственно в мембранах клеток. Во-вторых, витамин С, будучи водорастворимым витамином и сильным восстановителем, взаимодействует с водорастворимыми активными формами кислорода - 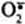 , Н2О2, ОН• и инактивирует их.
, Н2О2, ОН• и инактивирует их.
β-Каротин,предшественник витамина А, также обладает антиоксидантаьш действием и ингибирует ПОЛ. Показано, что растительная диета, обогащённая витаминами Е, С, кароти-ноидами, существенно уменьшает риск развития атеросклероза и заболеваний ССС, подавляет развитие катаракты - помутнения хрусталика глаза, обладает антиканцерогенным действием. Имеется много доказательств в пользу того, что положительное действие этих компонентов пищи связано с ингибированием ПОЛ и других молекул и, следовательно, с поддержанием нормальной структуры компонентов клеток. Также к антиоксидантам относятся витамины Р и Q.

Суть перманганатометрии заключается в определении концентрации веществ-восстановителей путем добавления перманганата калия в кислой среде.

Приборы и реактивы:
- Разл. виды чая
- KMnO4 0,005 моль/л.
- H2SO4 разв.
- Плитка
- Колбы термостойкие
- Пипетки
- Пробирки
Ход работы:
- Положить в колбу пакетик или всыпать 1 ч.л. чая. Залить 100 мл горячей дистиллированной воды. Подождать 5 мин.
- Отобрать в колбу 1 мл р-ра, полученного в п.1. Добавить 5 мл. H2SO4 разв. Поставить на плитку, нагреть до кипения.
- В кипящий раствор добавлять ПО КАПЛЯМ (!) раствор KMnO4, до тех пор, пока раствор в колбе не сохранит розовую окраску в течении 30 сек. Зафиксировать объем добавленного раствора.
- Повторить п. 1-3 для всех продуктов.
Результаты:
Результаты следует представить в виде таблицы:
| № | Продукт | V КmnO4, мл. | С рутина, мкг/л |
Известно, что 1 мл 0,1Н KMnO4 cоответсвует 6,4 мкг рутина.Поэтому, расчет концентрации антиоксидантов проводится по следующей формуле:
C=[6,4*VKMnO4 ]/[Vал.*Vр-ра.*10], где
ü VKMnO4. – объем раствора KMnO4, ушедший на титрование.
ü Vал. – объем раствора, взятый на анализ (1 мл, см. ход работы)
ü Vр-ра. – объем воды, который был добавлен к размятому продукту (100 мл=0,1 л, см. ход работы)
ü 10 – коэффициент разведения р-ра КMnO4
Подставляя имеющиеся цифры в формулу получаем:
C=6,4*VKMnO4 , мг/л.
Раздел 2. Физико-химические методы анализа.
Теоретическое введение




Лабораторная работа №4
Определение содержания нитрита в пищевых продуктах.
Цель работы – определение содержания нитрита в пищевых продуктах фотометрическим методом.
Теоретическое введение:
1. Введение в оптический анализ.

Классификация оптических методов анализа:
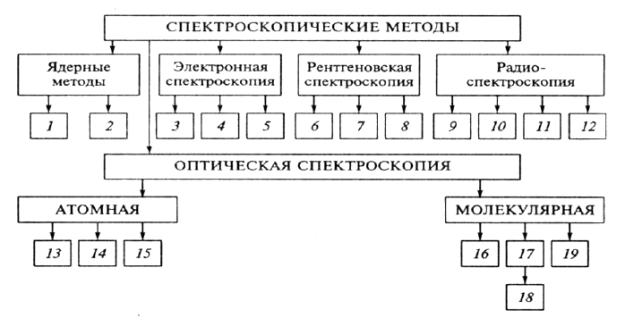

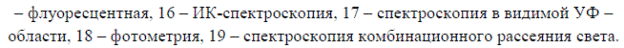



2. Нитриты.
Азот — это один из самых важнейших химических элементов в жизни растений, т. к. он необходим для синтеза аминокислот, из которых образуются белки. Растение получает азот из почвы в виде минеральных азотных солей (нитратных и аммиачных).
В растениях азот подвергается сложным превращениям. Метаболизм азота в растениях — это сложный процесс, и нитраты занимают в нём промежуточное положение:
HNO3 – HNO2 – (HNO)2 – NH2OH + NH3 |
(нитрат) (нитрит) (гипонитрит) (гидроксиламин) (аммиак)
Нитраты в растениях восстанавливаются до нитритов. В этом процессе участвуют различные металлы (молибден, железо, медь, марганец), и при этом происходит интенсивная трата углеводов, т. к. на восстановление требуется энергия, источником которой являются углеводы. Нитриты могут накапливаться в растениях и этим подавлять их рост. Но основная часть нитритов, подвергаясь дальнейшим превращениям, даёт аммиак (NH3). Аммиак русский учёный Д.М. Прянишников назвал альфой и омегой в питании растений.
В организме человека нитрат также способен восстанавливаться до нитрита за счет деятельности микроорганизмов в кишечнике человека. Однако нитрит может поступать в организм напрямую с пищей, так как используется в виде пищевой добавки. Нитрит натрия (Е 250), так же, как и гуаровая камедь и модифицированный крахмал , указаны на упаковке практически любого товара, который мы покупаем ежедневно.
«Все есть яд, и все есть лекарство. Одна только доза делает вещество или ядом, или лекарством», - это утверждение Парацельса более чем актуально для всех искусственных добавок Е . Нитрит натрия обладает рядом полезных свойств, которые делает это вещество незаменимым в пищевой и фармацевтической промышленности. В то же время нитрит натрия – опасный яд, передозировка которого грозит непоправимыми последствиями для организма.
Пищевой нитрит натрия – добавка Е 250, которая используется в качестве фиксатора окраски и консерванта в изделиях из мяса и рыбы.
Нитрит натрия связывает молекулы гемоглобина. Это свойство Е 250 обеспечивает колбасе и другим мясным изделиям приятный розовый цвет, который ассоциируется у нас со свежим качественным мясом. Мясные изделия, изготовленные без нитрита натрия, не будут выглядеть столь привлекательно.
Нитрит натрия – консервант, антибактериальный агент. Е 250 предотвращает рост возбудителей ботулизма. Использование нитрита натрия при производстве продуктов питания предотвращает одну из самых тяжелых пищевых интоксикаций. Е 250 способствует формированию специфического вкуса и аромата мясных и рыбных изделий.
Нитрит натрия – токсичное вещество для млекопитающих. Норма содержания нитрита натрия в готовой продукции – не больше 50 мг на 1000г, для детского питания – не более 30мг на 1кг.
Тем не менее, в медицине нитрит натрия используется для следующих целей:
1. Нитрит натрия обладает сосудорасширяющими, бронхолитическими свойствами, снимает спазмы.
2. Препараты нитрита натрия применяются при стенокардии, при спазмах сосудов головного мозга.
3. Нитрит натрия используется в качестве антидота при отравлении цианидами.
Главная опасность использования нитрита натрия в пищевых продуктах – возможность образования нитрозаминов, вызывающих онкологические заболевания. Нитрозамины образуются в продуктах с содержанием Е 250 при их нагревании, например, в жареном беконе. По мнению некоторых ученых, употребление подобных продуктов вызывает рак кишечника и другие формы онкологических заболеваний. Предотвратить канцерогенный эффект помогает витамин С. Продукты, в которых сочетаются Е 250 и аскорбиновая кислота, по мнению специалистов, являются безопасными. Кроме того, употребление мясных и рыбных изделий вместе с большим количеством овощей, содержащих витамин С, также предотвращает канцерогенный эффект нитрозаминов.
Передозировка нитрита натрия настолько опасна для здоровья, что может привести к летальному исходу. Высокая концентрация нитритов приводит к кислородному голоданию организма. Признаки отравления нитритом натрия: посинение кожных покровов, одышка, учащенное сердцебиение, потеря сознания. Для предотвращения передозировки нитрита натрия нужно покупать колбасные изделия, мясные и рыбные копчености, изготовленные по нормативным документам. Не стоит рисковать, приобретая продукцию подпольных производителей в сомнительных местах продажи.
Наибольшая доза нитритов поступает в организм не с продуктами питания, при производстве которых использовалась Е 250, а с овощами и фруктами. Формирование нитрозаминов в мясных и рыбных изделиях нейтрализуется витамином С. Продукция, в составе которой есть нитрит натрия, изготовленная в соответствии с санитарными нормами, безопасна для взрослого здорового человека. Но для детского и диетического питания отдавать предпочтение следует все-таки натуральному мясу и рыбе.
Приборы и реактивы:
- Фрукты/овощи.
- Реактив Грисса 1: 0,6% раствор сульфаниловой кислоты в 25% уксусной кислоте.
- Реактив Грисса 2: 0,6% раствор N-нафтиламина в 25% уксусной кислоте.
- Пробирки
- Пипетки
- Фотоколориметрметр «Экотест-2020»
Ход работы:
- Кусочек продукта взвесить, растереть в пюре в ступке при помощи пестика; получившееся пюре перенести в колбу и залить 100 мл дистиллированной воды. Добавить несколько капель 0,1Н НCl, хорошенько взболтать.
- Отобрать в пробирку 1 мл р-ра, полученного в п.1. Добавить 1 мл. реактива Грисса 1. Подождать 5 мин.Добавить в ту же пробирку 1 мл реактива Грисса 2.
- Перелить раствор из пробирки в кювету, установить ее в прибор и измерить оптическую плотность раствора на длине волны 525 нм. Зафиксировать значение.
- Повторить п. 1-3 для всех продуктов.
Результаты:
Результаты следует представить в виде таблицы:
| № | Продукт | D | m продукта, г. | С нитрита, мг/г |
Уравнение калибровочной прямой: (выясн. у преподавателя)
Калибровочная прямая имеет вид D=kC, где D – оптическая плотность, С – концентрация нитрита в растворе, мг/л. Для того, чтобы пересчитать на концентацию нитрита в продукте, требуется значение концентрации умножить на 0,1 (объем раствора из п.1) и разделить на массу продукта. Конечная формула имеет вид:
С=[D*0,1]/[k*mпрод.], мг/г.
Лабораторная работа №5.
Определение содержания нитрата в пищевых продуктах.
Цель работы – определить содержание нитрата в пщевых продуктах методом потенциометрии.
Теоретическое введение:
1. Введение в электрохимию.
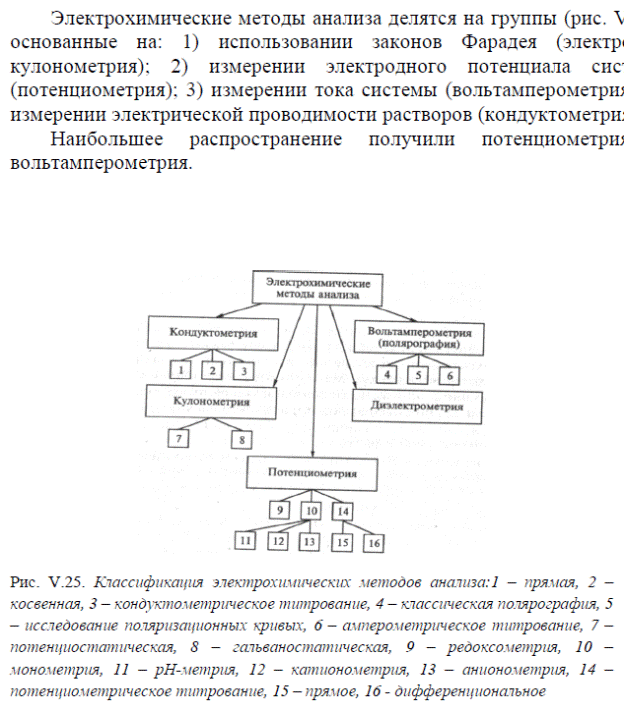

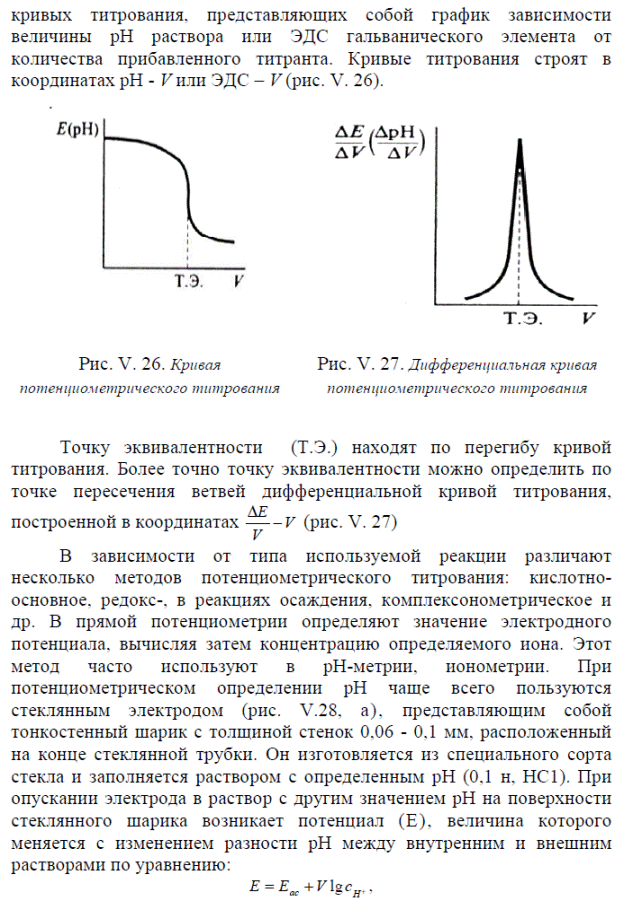


2. Нитраты.
Впервые заговорили о нитратах в нашей стране в 70-х годах, когда в Узбекистане случилось несколько массовых желудочно-кишечных отравлений арбузами из-за их чрезмерной подкормки аммиачной селитрой (1).
В мировой науке о нитратах знали уже гораздо раньше. Сейчас общеизвестно, что нитраты обладают высокой токсичностью для человека и домашних животных:
Нитраты под воздействием фермента нитратредуктазы восстанавли-ваются до нитратов, которые взаимодействуют с гемоглобином крови и окисляют в нём двухвалентное железо в трехвалентное. В результате образуется вещество метгемоглобин, который уже не способен переносить кислород. Поэтому нарушается нормальное дыхание клеток и тканей организма (тканевая гипоксия), в результате чего накапливаются молочная кислота, холестерин, резко падает количество белка.
Особенно опасны нитраты для грудных детей, т. к. их ферментная основа несовершенна, а восстановление метгемоглобина в гемоглобин идёт медленно.
Нитраты способствуют развитию патогенной (вредной) кишечной микрофлоры, которая выделяет в организм человека ядовитые вещества — токсины, в результате чего идёт токсикация, т. е. отравление организма. Основными признаками нитратных отравлений у человека являются:
· синюшность ногтей, лица, губ и видимых слизистых оболочек;
· тошнота, рвота, боли в животе;
· понос, часто с кровью, увеличение печени, желтизна белков глаз;
· головные боли, повышенная усталость, сонливость, снижение работоспособности;
· одышка, усиленное сердцебиение, вплоть до потери сознания;
· при выраженном отравлении — смерть.
Нитраты снижают содержание витаминов в пище, которые входят в состав многих ферментов, стимулируют действие гормонов, а через них влияют на все виды обмена веществ.
У беременных женщин возникают выкидыши, у здоровых мужчин — снижение потенции.
При длительном поступлении нитратов в организм человека (пусть даже в незначительных дозах) уменьшается количество йода, что приводит к увеличению щитовидной железы.
Установлено, что нитраты сильно влияют на возникновение раковых опухолей в желудочно-кишечном тракте у человека.
Нитраты способны вызывать резкое расширение сосудов, в результате чего понижается кровяное давление.
При всём вышеизложенном следует помнить, что вред наносят организму человека не сами нитраты, а нитриты, в которые они превращаются при определённых условиях.
Допустимые нормы нитратов для человека
Для взрослого человека предельно допустимая норма нитратов — 5 мг на 1 кг массы тела человека, т. е. 0,25 г на человека весом в 60 кг. Для ребёнка допустимая норма составляет не более 50 мг.
Сравнительно легко человек переносит дневную дозу нитратов в 15 – 200 мг; 500 мг — это предельно допустимая доза (600 мг — уже токсичная доза для взрослого человека). Для отравления грудного малыша достаточно и 10 мг нитратов.
В Российской Федерации допустимая среднесуточная доза нитратов — 312 мг, но в весенний период реально она может достигать 500 – 800 мг/сутки.
Пути попадания нитратов в организм человека
Нитраты попадают в организм человека различными путями.
· растительного происхождения; · животного происхождения. · Через питьевую воду.Содержание и накопление нитратов в растениях
Само по себе присутствие нитратов в растениях — нормальное явление, т. к. они являются источниками азота в этих организмах, но излишнее увеличение их крайне нежелательно, т. к. они (как мы уже знаем) обладают высокой токсичностью для человека и домашних животных.
Нитраты в основном скапливаются в корнях, корнеплодах, стеблях, черешках и крупных жилках листьев, значительно меньше их в плодах.
Нитратов также больше в зеленых плодах, чем в спелых. Больше всего нитратов содержится в салате (особенно в тепличном), в редьке, петрушке, редисе, столовой свёкле, капусте, моркови, укропе:
в свекле и моркови больше нитратов в верхней части корнеплода, а в моркови также и в его сердцевине;
в капусте — в кочерыжке, в толстых черешках и в верхних листьях.
Выяснено также, что у всех овощей и плодов больше всего нитратов содержится в их кожице.
По способности накапливать нитраты овощи, плоды и фрукты делятся на 3 группы (2):
· с высоким содержанием (до 5000 мг/кг сырой массы): салат, шпинат, свекла, укроп, листовая капуста, редис, зелёный лук, дыни, арбузы;
· со средним содержанием (300 – 600 мг): цветная капуста, кабачки, тыквы, репа, редька, белокочанная капуста, хрен, морковь, огурцы;
· с низким содержанием (10 – 80 мг): брюссельская капуста, горох, щавель, фасоль, картофель, томаты, репчатый лук, фрукты и ягоды.
С физиологической точки зрения количество нитратного азота в растениях определяется соотношением:
· процессов поглощения;
· транспорта;
· ассимиляции;
· распределения его в разных органах и частях растения.
И все эти процессы обусловлены совокупностью почвенно-экологических условий, агротехнических и генетических факторов.
Таким образом, накопление нитратов в растениях зависит от комплекса причин:
от биологических особенностей самих растений и их сортов. Выяснено, что больше всего нитратов содержится в редисе сорта “Красный великан” по сравнению с другими её сортами (“розовый с белым кончиком”, “жара” и др.).
от возраста растений: в молодых органах их больше (кроме шпината и овса). Меньше накапливается нитратов в гибридных растениях. Нитратов больше в ранних овощах, чем в поздних.
от режима минерального питания растений. Так, микроэлементы (особенно молибден) снижают содержание нитратов в редисе, редьке и цветной капусте; цинк и литий — в картофеле, огурцах и кукурузе. Уменьшается содержание нитратов в растениях и в результате замены минеральных удобрений на органические (навоз, торф и др.), которые постепенно разлагаются и усваиваются растениями. Органические удобрения положительно влияют на капусту, морковь, свеклу, петрушку, картофель, шпинат. Нерациональное, халатное использование химических удобрений, чрезмерные дозы их приводят к сильному накоплению нитратов, особенно в столовых корнеплодах.
Содержание нитратов возрастает сильнее при использовании нитратных удобрений (KNO3, NaNO3, Ca(NO3)2), чем при употреблении аммонийных. За последние годы (по словам руководителя лаборатории пищевой токсикологии института питания Т. С. Хотимченко) произошло существенное снижение нитратов в продуктах отечественного растениеводства по причине меньшего использования химических удобрений в виду их дороговизны. Если в 1988 – 89 годах ПДК по нитратам превышал 15% у овощей, то теперь — не более 3%.
от факторов окружающей среды (температуры, влажности воздуха, почвы, интенсивности и продолжительности светового освещения):
чем длиннее световой день, тем меньше нитратов в растениях;
при влажном и холодном лете количество нитратов увеличилось в 2,5 раза.
при повышении температуры до 20 °С количество нитратов снизилось в столовой свекле в 3 раза. Нормальная освещённость растений снижает содержание нитратов, поэтому в тепличных растениях нитратов больше.
При употреблении фруктов в пищу мы должны внимательно следить за их качеством. Чтобы яблоки дольше хранились, их покрывают эмульсионным налётом и насыщают консервантами. Такие яблоки внешне очень привлекательны, но порой в них нет ни вкуса, ни запаха, ни живой сочности, а консерванты в них убивают в кишечнике человека полезную микрофлору. Такие же консерванты используются и для хранения других продуктов (растительного масла, сосисок, колбас). Поэтому надо внимательно следить за сертификатами импортных продуктов.
Вопрос накопления нитратов в растениях нашей области стал изучаться СахНИИ с/х с 1989 года, сотрудники которого выяснили, что на Сахалине в связи с особыми агрометеорологическими условиями содержание нитратов в растениях увеличивается:
· большое количество дней, частые туманы;
· заниженная солнечная радиация;
· более низкие температуры воздуха и почвы;
· сильные ветра.
Способы снижения вреда нитратов в растениях на организм человека
Снижается количество нитратов при термической обработке овощей (13) (мойке, варке, жарке, тушении и бланшировке). Так, при вымачивании — на 20 –… · в капусте — на 58%; · в столовой свекле — на 20%;Б. Биологические функции липидов
2. Структурные блоки.Ряд липидов принимает участие в образовании клеточных мембран (см. рис. 217). Типичными мембранными липидами являются… 3. Изолирующий материал.Жировые отложения в подкожной ткани и вокруг различных… 4. Прочие функции липидов.Некоторые липиды выполняют в организме специальные функции Стероиды, эйкозаноиды и некоторые…– Конец работы –
Используемые теги: Методическая, Разработка, Практикум, общей, химии0.082
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: МЕТОДИЧЕСКАЯ РАЗРАБОТКА ПРАКТИКУМ ПО ОБЩЕЙ ХИМИИ
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов