рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Медицина
- /
- БИОХИМИЯ И ЕЁ ЗАДАЧИ
Реферат Курсовая Конспект
БИОХИМИЯ И ЕЁ ЗАДАЧИ
БИОХИМИЯ И ЕЁ ЗАДАЧИ - раздел Медицина, Биохимия И Ее Задачи Биохимия – Это Наука О Структуре Веще...
Биохимия и ее задачи
Биохимия – это наука о структуре веществ, входящих в состав живого организма, их превращениях и физико-химических процессах, лежащих в основе жизнедеятельности.
Биохимия является одной из фундаментальных дисциплин медицины и биологии. Она занимается познанием живого на уровне макромолекул. Биохимия – это результат интеграции биологии и химии.
Разделы биохимии:
1. статическая (биоорганическая химия);
2. динамическая (изучает превращение веществ);
3. функциональная (изучает физико-химические процессы).
Выделяют разделы биохимии в зависимости от объекта изучения: биохимия животных, микроорганизмов, растений, человека, клиническая биохимия и т.д.
Основные задачи биохимии:
1. изучение процессов биокатализа;
2. изучение строения и функций нуклеиновых кислот;
3. изучение молекулярных механизмов наследственности;
4. изучение строения, обмена белков;
5. изучение превращения углеводов;
6. изучение процессов обмена липидов;
7. изучение роли биорегуляторов (гормоны, нейромедиаторы);
8. изучение роли витаминов и минеральных веществ.
Значение БХ для медицины:
1. необходима для понимания сущности заболевания (патогенеза), его механизма. Пр.: сахарный диабет в результате недостатка инсулина, атеросклероз – нарушение обмена липопротеинов, опухолевый рост – функционирование онкогенов;
2. необходима для диагностики заболеваний. Пр.: биохимический анализ крови, мочи. Определяется:
а) количество субстрата (уровень метаболита);
б) активность фермента;
в) количество биорегуляторов (гормонов и нейропептидов);
В диагностике заболеваний используются различные методы: радио-иммуный анализ, иммуно-ферментный анализ, введение ДНК-зондов для выявления чужеродной ДНК, дефектов ДНК, онкогенов. Также позволяет выявить предрасположенность к заболеваниям;
3. разработка новых лекарственных препаратов;
4. необходима для профилактики заболеваний. Пр.: рахит – в результате недостатка витамина D, цинга – витамина С.
Белки и их биологическая роль
Белки – это высокомолекулярные азотсодержащие органические вещества, состоящие из аминокислот, соединённых в цепи с помощью пептидных связей и… Основные отличительные признаки белков: 1. содержат азота больше, чем другие вещества (16%). Так, 1г азота содержится в 6,25г белка;Характеристика простых белков
I. гистоныипротамины, растворимые в солевых растворах. Они относятся к низкомолекулярным белкам (M<5 000 дальтон, Да). В своем составе эти белки… Основные функции протаминов и гистонов: 1. структурная, т.е. они поддерживают пространственную организацию ДНК и входят в состав ДНП.Методы разделения (фракционирования) белков
1. Высаливание – разделение на основе различной растворимости альбуминов и глобулинов. Осаждение белков обычно производят сульфатом аммония (NH4)2SO4. В насыщенном растворе этого реактива осаждаются альбумины, а в полунасыщенном – глобулины.
2. Электрофорез – разделение белков при движении в электрическом поле за счет разности их заряда.
Основные белки сыворотки крови делятся на несколько фракций. Быстрее всех движутся к аноду альбумины – это гомогенная фракция. Глобулины делятся на 4 фракции: a1, a2, b, g [рис. альбуминов и 4-х глобулинов и как они движутся к аноду].
В крови определяется общий белок. Нормальное общее содержание белка, но изменено соотношение его фракций – диспротенемия. При инфекционных заболеваниях увеличивается содержание g-глобулиновой фракции. При заболеваниях почек снижается содержание альбуминовой фракции, но увеличивается содержание a2 и b глобулинов. Также наблюдается парапротеинемия – появление патологических белков, например при некоторых онкологических заболеваниях.
III. Проламины и глютелины. Это основные растительные белки. Они не растворяются ни в водных растворах, ни в свободном этаноле, но растворяются в 65% растворе этанола. По АК-составу присутствует глутамин (до 25%), пролин (до 15%). В кукурузе содержится зеин, в ячмене – гордеин, в пшенице – глиадин.
IV. Протеиноиды (склеропротеины). Они не растворяются ни в воде, ни в солевых растворах. Это фибриллярные белки опорных тканей. Входят в состав сухожилий, костной, хрящевой тканей и др. К ним относятся: кератины – белки волос, ногтей; коллагены – белки соединительной ткани; эластины – белки, входящие в состав связок. Особенностью АК-состава является повышенное содержание аланина, глицина, пролина. Имеется оксипролин. Эти белки составляют 25-33% от всех белков в организме.
Характеристика сложных белков
Они имеют белковую и небелковую (простетическую) части. Белковую часть составляет полипептид, построенный из АК-остатков. В состав небелковой части может входить: гем, металл, остаток фосфорной кислоты, углеводы, липиды и т.д.
Хромопротеины
Гемоглобин. Его белковая часть представлена глобином, небелковая – гемом. Это олигомерный белок, т.е. имеет четвертичную структуру, состоящую из 4… a цепи построены из 141 АК-остатка. b цепи из 146 АК-остатков [рис. 4-х субъединиц, в каждой нарисована точка - гем].Липид-белковые комплексы
1. предельные и непредельные ВЖК. К предельным относятся стеариновая С17Н35СООН и пальмитиновая С15Н31СООН; к непредельным – олеиновая С17Н33СООН,… 2. простые и смешанные триацилглицериды. К простым относится трипальмитин, а к…Нуклеопротеины
НП состоят из 2-х частей: белковой (содержит гистоны и протамины, которые являясь основными белками, придают основные свойства) и простетической,… Все НП по составу НК можно разделить на 2 группы: рибонуклеопротеины (РНП) и…Углевод-белковые комплексы
Гликопротеины (ГП)– комплекс белков с углеводными комплексами, где на долю углеводов приходится 2-20%. Углеводы представлены гетерополисахаридами,…Хондроитинсульфаты (ХС). Это полимеры, структурной единицей которых является димер, состоящий из глюкуроновой кислоты и N-ацетилгалактозамина (сульфатирован по 4 или 6 положению).

ХС-ты входят в состав опорной, костной ткани, хрящей, сухожилий. Наличие сульфатной группировки и ОН-группы глюкуроновой кислоты придаёт этим соединениям дополнительные отрицательные заряды в растворе, и эти полимеры являются полианионами. Поэтому они легко притягивают Са2+ и таким образом в процессах минерализации играют определённую роль в связывании Са. В межклеточном матриксе протеогликаны организованы в своеобразные комплексы («ерш из ершиков»). Такой комплекс содержит до 160 протеогликанных единиц.
Гепарин. Полимер, структурной единицей является димер, состоящий из глюкуроновой кислоты, связанной с N-ацетилглюкозамином, сульфатированым 4 или по 6 положению серной кислотой.
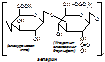
Гепарин не является структурным компонентом межклеточного матрикса. Он вырабатывается тучными клетками соединительной ткани и после их цитолиза выделяется в межклеточное пространство и кровеносное русло. В крови может соединяться с неспецифическими белками. Гепарин – естественный природный коагулянт, препятствует свёртыванию крови.
ПГ выполняют следующую роль:
1. роль «рессор» – смягчают нагрузки на суставные поверхности (в хрящах, суставных поверхностях);
2. ограничивают диффузию и проницаемость межклеточного вещества для различных молекул и крупных частиц. Гиалуроновая кислота подвергается гидролизу под действием фермента – гиалуронидазы. В норме, в здоровой ткани, фермент и субстрат находятся в равновесии. при патологических процессах количество фермента может увеличится, что приводит к гидролизу гиалуроновой кислоты и нарушению проницаемости. При этом разрываются b-1,4-гликозидные связи;
3. являются поливалентными анионами. Способны связывать большие количества ионов Na+ и др. катионов и участвуют в регуляции водно-солевого обмена;
4. Гиалуроновая кислота может присутствовать в свободном виде, например в хрусталике глаза, суставной жидкости. Она имеет консистенцию геля и выполняет различные функции.
Фосфопротеины
Типичными фосфопротеинами являются: казеин молока (1% фосфорной кислоты),…Строение коферментов
- ковалентными связями; - ионными связями; - гидрофобными взаимодействиями и т.д.Изоферменты
- аминокислотному составу; - электрофоретической подвижности; - молекулярной массе;Свойства ферментов
1) и те, и другие катализируют только энергетически возможные реакции; 2) увеличивают скорость реакции; 3) не меняют направления реакции;Классификация и номенклатура ферментов
Согласно международной классификации, принятой в 1961 году, все ферменты делятся на 6 классов по типу катализируемой реакции. Каждый класс делится на несколько подклассов. Классы:
1. оксидоредуктазы;
2. трансферазы;
3. гидралазы;
4. лиазы;
5. изомеразы;
6. лигазы (синтетазы).
1. Оксидредуктазы – ферменты, катализирующие окислительно-восстановительные реакции. Известно 480 этих ферментов, которые делятся на 17 подклассов.
а) аэробные дегидрогеназы (оксидазы). Отщепляют водород от субстрата и переносят его на молекулу кислорода. Пр.: НАДФН2+О2= Н2О2+НАДФ.
Если кислород непосредственно внедряется в субстрат, то ферменты – оксигеназы. Наибольшее значение имеют оксидазы аминокислот.
б) анаэробные дегидрогеназы – катализируют перенос водорода от субстрата на любой другой акцептор, кроме кислорода.
CH3CH2OH → СН3СН=О
[над стрелочкой алкоголь-ДГ; под стрелочкой НАД → НАДН2 ; этанол превращается в этаналь]
в) цитохромы – это ферменты, переносящие электроны.
г) пероксидазы – гемсодержащие оксидоредуктазы. Они отщепляют водород от субстрата и переносят его на Н2О2.
Пр.: каталазная реакция
2Н2О2 → 2Н2О+О2 [над стрелочкой - каталаза].
2. Трансферазы – ферменты, переносящие группы атомов от одного субстрата к другому. При этом один субстрат донор, а другой – акцептор. В зависимости от природы переносимых групп трансферазы делят на 8 подклассов:
- аминотрансферазы, переносят NH2;
- метилтрансферазы, переносят CH3;
- фосфотрансферазы, переносят PO3H2;
- ацилтрнсферазы.
Пр. переаминирование. [рис. Аланин + альфакетоглутаровая кислота под действием АлАТ и перидоксальфосфата получается ПВК и глутаминовая к-та].


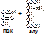
3. Гидролазы – ферменты, катализирующие разрыв одинарных связей с участием воды, присоединяемой по месту разрыва связи. Т.е. они принимают участие в реакциях гидролиза. Все ферменты пищеварительного тракта относятся к гидролазам. Всего выделяют 460 гидролаз. В зависимости от типа разрываемых связей выделяют 11 подклассов:
- эстеразы – разрывают сложно-эфирную связь. Пр.: триацилглицерид+ 3H2O=(липаза) глицерин+ 3С17H35COOH [рис. этого. Стрелочкой показать сложноэфирные связи]
- пептидазы – разрывают пептидную связь. Пр.: АЛА-ГЛИ+ H2O = (дипептидаза) АЛА+ГЛИ [рис. этого. Стрелочкой показать пептидную связь]
- гликозидазы – разрывают гликозидные связи. Пр.: мальтоза+ H2O=(мальтаза) 2глюкозы [рис. этого. Стрелочкой показать гликозидную связь]
4) Лиазы. Эти ферменты осуществляют разрыв углеродных связей без участия воды. Выделяют:
- декарбоксилазы – катализируют отщепление CO2. Пр.:

- альдолазы – катализируют расщепление связи между атомами углерода. Пр.: фруктозо-1,6-дифосфат (6 атомов С)= (альдолаза) фосфоглицериновый альдегид (3 атома С)+ дигидроксиацетонфосфат (3 атома С).
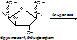

- гидратазы – разрыв двойной связи с присоединением воды по месту разрыва двойной связи.
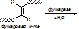

- ферменты, отщепляющие воду – реакция дегидратации. При этом образуется двойная связь.
5) Изомеразы – ферменты, катализирующие реакции изомеризации и обеспечивающие внутримолекулярную перестройку.
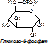
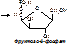
6) Лигазы (синтетазы) – катализируют образование более сложных веществ из более простых. При этом требуется энергия из вне. Обязательно участие АТФ или других трифосфатов (УТФ, ЦТФ и т.д.). [Пр. Аспарагиновая к-та + аммиак + АТФ под действием аспарагинсинтетазы превращается в аспарагин + АМФ + неорганический фосфат +энергия].


Номенклатура ферментов
2) Рабочая номенклатура – название фермента составляется из названия субстрата или продукта реакции, типа катализируемой реакции и окончание –аза,… 3) Систематическая, научная - L-лактат-НАД-оксидредуктаза. 4) Все ферменты имеют цифровой шифр, например ЛДГ - 1.1.1.27.Современные представления о ферментативном катализе
В основу современной теории положена теория Михаэлеса и Ментена. Ведущую роль в механизме ферментативного катализа играет образование… [рис. E+S«ES®ES*®ES**®EP®E+P] 1 этап: образование фермент-субстратного комплекса (на рис. до ES включительно). Происходит диффузия субстрата к…Молекулярные эффекты действия ферментов
2) Эффект ориентации – это специфическое связывание субстрата с контактными участками активного центра фермента, которое обеспечивает взаимную… 3) Эффект натяжения (теория «дыбы»). Субстрат до присоединения к ферменту… 4) Эффект вынужденного соответствия (прилегания). Не только субстрат претерпевает изменение конформации, но и фермент,…Теория кислотно-основного катализа
При закреплении субстрата в активном центре на его молекулу влияют электрофильные и нуклеофильные группы каталитического участка, что вызывает… Пр.: Реакция превращения ацетилхолина в холин. На первом этапе между СОО-… После образования фермент-субстратного комплекса в действие вступают остальные аминокислоты, остатки активного центра.…Регуляция активности ферментов
- активаторы – вещества, увеличивающие скорость реакции; - ингибиторы – вещества, уменьшающие скорость реакции.Переваривание и всасывание белков
Среди всех веществ, поступающих в организм, при недостатке какого-либо из них, например, углеводов, их могут в некоторой степени заменить белки и… Взрослый мужчина нуждается в ежедневном употреблении 80-100 г белка. В 100 г… Для характеристики белкового (азотного) обмена веществ используется понятие «азотистый баланс» – это разность между…Превращение белков в органах пищеварения
► Ротовая полость. Гидролиза нет. ► Желудок. Действуют ферменты: 1) Пепсин (вырабатывается в виде пепсиногена, который активируется соляной кислотой и своей активной формой –…Переваривание сложных белков и их катаболизм
2. Липопротеины – с помощью липолитических ферментов. 3. Гемсодержащие хромопротеины: порфириновое кольцо не расщепляется, а… 4. Нуклеопротеины. В кишечнике полинуклеотиды гидролизуются с помощью специфических нуклеаз до мононуклеотидов,…Гниение белков и обезвреживание его продуктов
Образуются такие продукты: а) токсичные: сероводород H2S, углекислота CO2, аммиак NH3, метан CH4,… б) нетоксичные: спирты (в т.ч. этиловый), амины, жирные к-ты, кетокислоты, витамины (напр., витамин B6).Метаболизм аминокислот
1) гидролиза белков пищи, 2) гидролиза тканевых белков (под действием катепсинов лизосом). Расходуется АК-фонд на процессы:Общие пути обмена веществ
Роль: синтез заменимых АК, участие в непрямом дезаминировании АК. Определение АлАТ и АсАТ в крови имеет большое…Образование конечных азотистых продуктов
В сутки распадается около 1-2% всех белков организма, что составляет в среднем 500 г. Из них 80% (400 г) идут на ресинтез организм-специфичных белков, а 20% (100 г) подвергаются непрямому дезаминированию с образованием конечных продуктов – кетокислот и аммиака (они содержат 10-16 г азота).
Временное обезвреживание аммиака
1) в основном – образованием амидов дикарбоновых кислот. Напр., ГЛУ + NH3 → ГЛН (над стрелочкой "глутаминсинтетаза", под стрелочкой… → → 2) восстановительное аминирование кетокислот. Этот путь и дает токсичность аммиака (из-за уменьшения кол-ва…Орнитиновый цикл мочевинообразования
1. NH3 + CO2 + 2АТФ + Н2О → H2N-CO-OPO3H2 + 2АДФ + Н3РО4 (над стрелочкой карбамоилфосфатсинтетаза). Образуется карамоилфосфат. 2. NH2-(CH2)3-CH(NH2)-COOH (это орнитин) + H2N-CO-OPO3H2 (это карбамоилфосфат)… Далее: NH2-CO-NH-(CH2)3-CH(NH2)-COOH (это цитруллин) +COOH-CH(NH2)-CH2-COOH (это АСП)® аргининосукцинатсинтетаза,…Синтез и распад нуклеотидов
1. Ни сами нуклеотиды, ни азотистые основания, поступающие с пищей, не включаются в синтез нуклеиновых кислот и нуклеотидов организма. Т.е.,… 2. Нуклеотиды синтезируются клетками организма заново, при этом не… Биосинтез пуриновых оснований – из аминокислот: ГЛИ, АСП, ГЛН, два атома углерода – из производного фолиевой к-ты,…А. Окисление пуриновых нуклеозидов
Мочевая к-та – конечный продукт распада пуриновых оснований. Б. Распад пиримидиновых нуклеозидов Они распадаются до бета-аланина, который окисляется до СО2 и NH3. А также до бета-амилоизобутирата. Аммиак,…Функционирование ДЦ
[До KoQ включительно переносятся 2 протона и 2 электрона, а по цепи цитохромов – только 2 электрона] Существует и укороченная ДЦ, в которой субстрат окисляется ФАД-зависимой ДГ,… Необходимо отметить, что АТФ выделяется на этапах: НАД→ФМН (в укороченной ДЦ эта молекула АТФ не выделяется!),…Альтернативные варианты биологического окисления
К ним относят оксигеназный путь окисления. Он не относится к энергоснабжающим клетку процессам, а используется для деградации (разрушения) метаболитов. Ферменты оксигеназного пути катализируют включение кислорода в субстрат.
Различают ди- и монооксигеназный пути.
Диоксигеназный путь содержит ферменты, которые включают в молекулу субстрата оба атома кислорода. Этот вариант встречается очень редко.
S + O2 → S·O2
Монооксигеназный путь – в молекулу субстрата включается один из атомов кислорода, а другой восстанавливается до воды. Для этого необходим еще косубстрат (донор электронов).
A-H + O2 + ZH2 → A-OH + Z + H2O
Для примера рассмотрим систему микросомального окисления. Она содержит цитохромы Р-450 и b5. Эта система играет большую роль в обезвреживании многих токсинов и лекарств путем их гидроксилирования.
R-H → R-OH
При этом часто образуется пероксид водорода, который разрушается каталазой.
Матричный биосинтез
Генетический код
Понятие о генетическом коде было введено в середине 50-х гг. Гамовым. Генетически код - это информация об аминокислотах (АК), записанная в виде последовательности нуклеотидов. Посредством 4-х нуклеотидов кодируется 20 основных АК.
Свойства генетического кода:
1. генетический код триплетный, т.е. одна последовательность состоит из 3-х нуклеотидов. Имеется 43 (64) варианта, а необходимо 20, поэтому генетический код имеет квазидуплетность – смысловую нагрузку для большинства АК несут первые 2 нуклеотида, а третий нуклеотид для некоторых АК не важен вообще, а для других имеет значение пуриновый он или пиримидиновый. И только для ТРИ и МЕТ важен 3 нуклеотид;
2. однозначность - один код (триплет) несет информацию только об одной АК;
3. вырожденность - одной АК соответствует несколько кодонов. Это происходит вследствие того, что кодонов 64, а АК - 20. Так, СЕР соответствует 6 кодонов, ГЛИ и АЛА - по 4 кодона. Большей части АК соответствует по 2 кода, только ТРИ и МЕТ кодируются 1 кодоном;
Также имеются кодоны, которые не несут смысловой нагрузки - нонсенс (бессмысленные) кодоны – терминирующие кодоны;
4. неперекрещиваемость - считывание информации идет от одного триплета к другому триплету последовательно;
5. универсальность - для всего живого генетический код един.
Т.о., в виде генетического кода записана информация об одной АК, а последовательность нуклеотидов (в виде триплетов) несет информацию о последовательности АК в полипептидной цепи.
Отрезок ДНК, несущий информацию о последовательности АК в одной полипептидной цепи, называется геном.
Функции гена:
1. хранение информации об одной полипептидной цепи;
2. передача информации из поколения в поколение клеток;
3. передача информации с ДНК на РНК - транскрипция (синтез РНК);
4. передача информации с РНК на последовательность АК в последовательность полипептидной цепи - трансляция (декодирование информации РНК в последовательность АК) - биосинтез белка.
Репликация (самоудвоение, биосинтез) ДНК
Условия, необходимые для репликации: 1. строительный материал - дезоксинуклеозидтрифосфаты (дАТФ, дГТФ, дЦТФ ТТФ);Транскрипция (передача информации с ДНК на РНК) или биосинтез РНК
В опероне выделяют информативные участки - экзоны и неинформативные участки - интроны. В начале оперона выделяют промотор (P) - это начальный… Необходимые условия для трансляции:Регуляция биосинтеза белка
Прокариоты. Теория регуляции биосинтеза у прокариот была разработана в 1961 г. Ф. Жакобом и Ж. Моно. Основные положения теории: …Механизмы развития раковой опухоли
Виды повреждений генов: 1) потеря гена, 2) собственно повреждение гена,Переваривание липидов
Все эти условия у взрослого человека создаются в кишечнике. У детей первого года жизни слизистая оболочка желудка вырабатывает липазы. рН лежит в… Переваривание жиров пищи начинается в тонком отделе кишечника, где создаются… - желчные кислоты, которые образуются в печени;Механизм ресинтеза жира
1. сначала продукты гидролиза (глицерин, ВЖК) активируются с использованием АТФ. Далее происходит последовательное ацилирование глицерина с… 2. [рис. присоединения к a-глицерофосфату активированного остатка ВЖК: a-глицерофосфат+ R1-COSKoA®(ацилтрансфераза)…Транспортные формы липидов в организме
Мицеллы ЛП имеют наружный слой и ядро. Наружный слой состоит из белка, ФЛ и свободного ХС, которые имеют гидрофильные полярные группы и проявляют… ЛП транспортируют: ФЛ, ТГ, холестерин. Могут транспортировать некоторые… ХМ – хиломикроны. Они образуются в стенке тонкого отдела кишечника;Превращение липидов в тканях
Окисление глицерина в тканях тесно связано с гликолизом и гексодифосфатным путём путем превращения глюкозы, в который вовлекаются метаболиты… киназа ↓АТФ ® АДФБиосинтез глицерина и ВЖК в тканях
Биосинтез ВЖК в тканях происходит в эндоплазматической сети. Исходным материалом синтеза ВЖК в тканях является ацетил-КоА, который в цитозоль… Условием для биосинтеза ВЖК в тканях: - наличие ацетил-КоА;Патология липидного обмена
На этапе пищеварения. При поражении печени, желчных путей, желчного пузыря, когда в результате воспалительных процессов нарушается синтез или… Поражение поджелудочной железы, слизистой тонкой кишки ведёт к нарушению… Липидный обмен нарушается при сахарном диабете. Накопление недоокисленных веществ ведёт к развитию кетоза. В случае…Ионы Са2+.
Гормоны центральных желез - гипоталамуса и гипофиза Раздражитель действует на ЦНС, импульсы передаются в гипоталамус, который выделяет регулирующие факторы – либерины и…Гормоны паращитовидных желез
Гормоны поджелудочной железы (ПЖ) ПЖ обладает и экзокринной и эндокринной функцией. В островках Лангерганса находятся клетки А, B, D, F. Инсулин - 70% -…Классификация витаминов
Принята классификация по растворимости:
1) жирорастворимые (A, D, E, K);
2) водорастворимые (все остальные: В_, С, Р, Н);
3) витаминоподобные вещества – синтезируются в организме, но в недостаточном количестве (парааминобензойная к-та, коэнзим Q, холин, инозит, пангамовая к-та).
Номенклатура витаминов представлена химическим названием и буквенным обозначением.
Напр., витамин А – ретинол, витамин РР – никотинамид или никотиновая кислота, витамин В6 – пиридоксин, пиридоксаль или пиридоксамин.
Также существует клиническое название витамина, которое состоит из названия патологического проявления недостатка витамина с приставкой анти- .
(напр., витамин А – антиксерофтальмический витамин, витамин D – антирахитический витамин).
Жирорастворимые витамины могут откладываться в печени в виде резервов (A, D, K), витамин Е может накапливаться в жировой ткани. Так как эти витамины нерастворимы в воде, то они не могут свободно проникать в кровь и выводиться с мочой. При избыточном поступлении этих витаминов могут развиваться токсические эффекты (в основном, витамина А и D).
Водорастворимые витамины выводятся с мочой, поэтому их избытка не наблюдается. Возможен небольшой резерв фолиевой к-ты и витамина В12 в печени. Токсические эффекты не наблюдаются.
Роль витаминов в обмене веществ
Напр., В1 – тиамин – входит в состав кофермента декарбоксилаз кетокислот в виде ТПФ (ТДФ), В2 – рибофлавин – входит в состав коферментов… 2. витамины – предшественники гормонов (витамин D3 – предшественник… 3. витамины могут использоваться для синтеза медиаторов (витамин С – для синтеза норадреналина и серотонина);Понятие о гиповитаминозах, авитаминозах и гипервитаминозах
Авитаминоз – патологическое состояние, вызванное отсутствием витамина в организме. Полигиповитаминоз – патологическое состояние, связанное с недостатком… Гипервитаминоз – патологическое состояние, связанное с избытком каких-либо витаминов в организме (обычно витаминов А…Причины гиповитаминозов
2. Вторичные: а) снижение аппетита; б) повышенный расход витаминов;Витамин А
Клиническое название: антиксерофтальмический витамин. По химической природе: циклический непредельный одноатомный спирт на основе…Витамин D
D2 – эргокальциферол и D3 – холекальциферол. Витамин D2 содержится в грибах. Витамин D3 синтезируется в организме под… 7-дегидрохолестерол → холекальциферол (D3)Витамин Е
В химическом плане это альфа-, бета-, гамма- и дельта-токоферолы, но преобладающим является альфа-токоферол. Витамин Е устойчив к нагреванию. Роль витамина Е в обмене веществВитамин К
Витамеры: К1 – филлохинон и К2 – менахинон. Роль витамина К в обмене веществ Это кофактор карбоксилирования глутаминовой кислоты (ГЛУ) в белке крови протромбине для его превращения в тромбин.Водорастворимые витамины
Витамин С
Является лактоном. Легко окисляется: О=С─┐ О=С─┐ | │ | │Витамин Р
Витамин проницаемости.
Витамеры: рутин, катехины, цитрин.
Это витамин-спутник витамина С.
Гиповитаминоз Р: поражение сосудов, нарушение их проницаемости.
Роль в обмене веществ
Витамин Р тормозит активность гиалуронидазы, чем сохраняет соединительную ткань. А также участвует в окислительно-восстановительных реакциях.
Потребность в витамине Р не установлена.
Витамин В1
Тиамин устойчив в кислой среде (до 140ºС), а в щелочной среде быстро… Роль витамина В1 в обмене веществВитамин В2
Устойчив в кислой среде, но разрушается в нейтральной и щелочной. Легко… - окисляет восстановленную форму НАД·Н (компонент НАД·Н-дегидрогеназы в дыхательной цепи),Витамин РР
Витамеры: никотиновая к-та, никотинамид, ниацин. Устойчив при кипячении.Витамин В6
Пиридоксин → пиридоксаль → пиридоксамин [нарисовать формулы] (все три эти соединения обладают витаминным действием)Витамин В12
Имеет красный цвет. На свету разлагается. Роль кобаламина в обмене веществ - транспорт метильных групп;Витамин В3
Состоит из масляной кислоты с b-аланином. Роль в обмене веществ Участвует в образовании КоА, который в свою очередь участвует:Витаминоподобные вещества
Парааминобензойная кислота
Роль: входит в состав фолиевой кислоты, участвует в пигментации. При авитаминозах нарушение пигментации.
Холин
Относится к витаминоподобным веществам.
НО-СН2-СН2-N(CH3)3
Роль в обмене веществ
1. холин входит в состав сложных липидов (фосфатидилхолин);
2. источник метильных групп при синтезе различных соединений.
В организме синтезируется из серина и метионина в необходимых количествах. Но метионин – незаменимая АК!
АНТИВИТАМИНЫ
Это вещества, которые нарушают использование витаминов.
Их 2 группы:
1. антивитамины, прямо воздействующие на снижение активности витаминов, например авидин на витамин А, аскорбатоксидаза на витамин С;
2. структурные аналоги витаминов, похожие на витамины, но оказывающие противоположное действие, например сульфаниламиды похожи по структуре на ПАБК. Такие вещества используют для гибели микроорганизмов, которые их не различают.
Биохимия печени
Роль печени в обмене веществ
Печень занимает центральное место в обмене веществ организма. Особенность анатомического расположения и связи с другими органами, позволяет печени участвовать во всех видах обмена веществ. Печень кровоснабжается печеночной артерией и воротной веной, которые в ней образуют обширную капиллярную сеть, следовательно, все вещества поступающие в организм вместе с пищей, после их всасывания в кровь распределяются печенью по всему организму. Через печень протекает около 1,2 литра крови в минуту. Площадь капиллярных синусоидов в печени взрослого человека 400-450 м2.
Важнейшие функции печени:
1. синтетическая - происходит превращение питательных веществ в такие формы, которые могут быть использованы другими тканями:
- белки плазмы крови (альбумины, глобулины, фибриноген, протромбины);
- группа белков участвующих в транспорте липидов (ЛПОНП, ЛПНП, ЛПВП);
- гормонов (транскортины);
- витаминов;
- микроэлементы (трансферины, церрулоплазмины – переносчики ионов меди)
В печени синтезируется глюкоза, гликоген, нейтральные жиры, ХС, ФЛ, ВЖК (заменимые), кетоновые тела.
В печени активно синтезируются из АК небелковые азотистые соединения: коферменты (HS-KoA), креатин, глутатион, никотиновая кислота, пуриновые и пиримидиновые основания, порфирины.
В печени происходит биосинтез мочевины, мочевой кислоты, активно протекают реакции обмена АК (переаминирование, окислительное дезаминирование, декарбоксилирование), что обеспечивает поддержание в организме баланса заменимых АК, биогенных аминов.
2. депонирующая. В печени может депонироваться гликоген, ТГ, жирорастворимые витамины (А, D, Е, К), некоторые водо-растворимые витамины (В1, В2, В12), микроэлементы.
3. пищеварительная - связана с образованием и секретированием желчи и желчных кислот.
4. выделительная (экскреторная) – связана с образованием специально жидкого экскрета - желчи. Вместе с желчью из клеток удаляются избытки ХС, желчные кислоты, продукты распада гема (желчные пигменты), инактивированные витамины и гормоны, обезвреженные токсические вещества, вода.
5. обезвреживающая функция. В печени обезвреживаются токсические метаболиты обмена веществ (аммиак, крезол, фенол, скатол, индол, билирубин). В печени обезвреживаются, поступающие из вне через ЖКТ, вдыхаемый воздух, кожу - спирты, карболовые кислоты, альдегиды.
Поступающие в организм извне чужеродные вещества, а так же соединения, образующиеся в организме в процессе метаболических реакций, которые не могут быть использованы для пластических целей или как источники энергии, называются ксенобиотиками. Эти соединения в подавляющем большинстве случаев должны подвергаться обезвреживанию, т.е. детоксикации. Главным органом, где происходят эти процессы, является печень.
Кроме ксенобиотиков, инактивации в печени и выведению из организма подвергаются и некоторые собственные метаболиты обмена (продукты распада гема, стероидные гормоны, катехоламины). Все эти соединения из организма выводятся в виде метаболитов, химического комплекса с биомолекулами (с глутатионом), выводятся металлы. Некоторые из них выводятся в неизмененном виде (ацетон), некоторые соединяются с макромолекулами и могут, накапливаясь в организме, оказывать токсическое действие, медленно выделяясь из организма. Так взаимодействуют с белками соли тяжелых металлов.
В большинстве случаев ксенобиотики выводятся из организма в виде парных безвредных соединений – конъюгатов. Если в молекулах, поступающих с током крови веществ в печень, имеются свободные функциональные группы –OH, –SH,–NH2, то эти вещества могут сразу же вступать в фазу конъюгации.
Если у ксенобиотиков таких функциональных групп нет, то они должны предварительно пройти стадию химической модификации. В процессе этих реакций, соединение может подвергаться окислению или восстановлению, циклизации, дециклизации, гидролизу и т.д. При этом, в структуре вещества происходит разрыв внутренних связей, либо вводят дополнительные функциональные группы или происходит высвобождение заблокированной функциональной группы. Таким образом, появление дополнительной функциональной группы делает ксенобиотики более гидрофильными и следовательно способны вступить в фазу конъюгации.
Важным этапом детоксикации поступивших в печень с током крови веществ является их окисление в микросомах ЭПС. Здесь в липидном слое биомембран локализуется система гидроксилированных ферментов, требующих наличие молекул кислорода, НАДФН2 (восстановленый), поступающих из пентозного цикла, флавопротеида (ФП) и цитохрома.
Гидроксилазы способствуют включению кислорода в молекулу субстрата. НАДФН2 является источником электронов и протонов. Введение ОН-группы в структуру ксенобиотика делает его более полярным и, следовательно, облегчает его последующее конъюгирование.
НАДФН2 – зависимая моноксигеназная цепь микросом состоит из:
1. ФП, коферментом которого является ФАД;
2. цитохрома Р-450.
ФП обладает НАДН2–дегидрогеназной активностью, причем ФАД акцентирует протоны и электроны. С ФП электроны транспортируются на цитохром Р-450, а протоны в окружающую среду.
Цитохром Р-450 является последним самоокисляющим звеном этой цепи. Он выполняет двойную роль:
1. активирует кислород путем переноса электронов;
2. использует активированный кислород для окисления вещества и образование воды.
В этом процессе 1 атом кислорода включается в окисляемое вещество, а другой связывает два протона из среды и входит в состав воды.
Гидроксилирование ксенобиотиков с участием микросомальной монооксигеназной системы
[рис. бензол+ О2 +НАДФН2®(гидроксилаза, цитохром Р450) фенол + НАДФ+ Н2О] 2. индола: [рис. индол+ О2 +НАДФН2®(гидроксилаза, цитохром Р450) индоксил + НАДФ+ Н2О]Роль печени в пигментном обмене
К пигментам относятся 4 группы веществ: 1. гем-содержащие пигменты, входят в состав ФАВ, т.н. дыхательных пигментов… 2. представлены предшественниками гема – порфиринами;Биосинтез гема
Для активации глицина необходим витамин В6. В процессе первой метаболической реакции синтеза гема образуется d-аминолевулиновая кислота (АЛК).… [рисуется в столбик. Первая реакция идет в митохондриях: глицин +… После образования АЛК в митохондриях, в цитозоле происходит конденсация двух молекул АЛК с образованием…Распад гема
Первая реакция распада гемоглобина – это гидролиз его белковой части. Катаболизм гема, освобождение от белковой части происходит в микросомальной… гем (Fe2+)® (над: оксигеназа) гемин(Fe3+) (это ферри форма) ® (над: редуктаза; под: НАДФH2®НАДФ) гемин (Fe2+) (ферро…Патология пигментного обмена
Выделяют следующие желтухи: 1. Механическая (обтурационная), которая связана с нарушением оттока желчи в… КБ поступает в кровь, развивается гипербилирубиннемия, за счет КБ.Типы изменения биохимического состава крови
Абсолютные обусловлены нарушением синтеза, распада, выведения того или иного соединения. Относительные обусловлены изменением объема циркулирующей крови (ОЦК). Когда… II. Качественные и количественные.Белковый состав крови
1. поддерживают онкотическое давление (в основном за счет альбуминов); 2. определяют вязкость плазмы крови (в основном за счет альбуминов); 3. определяют устойчивость форменных элементов в кровотоке (предупреждают склеивание клеток крови между собой);Общий белок
Общий белок – это сумма всех белковых веществ крови. ► Гипопротеинемия – снижение альбуминов. Причины: 1. дефицит аминокислот в организме (из-за нарушения поступления, низкобелковой диете, нарушении переваривания и…Альбумины
В норме 35-50 г/л.
Гипоальбуминемия – причины см. выше (гипопротеинемия). При снижении альбуминов ниже 30 г/л возникают отеки.
Гиперальбуминемия – при переливании альбуминов с лечебной целью и при сгущении крови (относительная гиперальбуминемия). Истинной не встречается.
Глобулины в норме 20-30 г/л
α-антитрипсин – ингибирует трипсин, пепсин, эластазу, некоторые другие протеазы крови. Выполняет антивоспалительную функцию крови. Повышенный… α1-серомукоиды – гликопротеины сыворотки крови. Являются компонентами… α1-фетопротеин – фетальный белок. В норме в больших количествах во внутриутробном периоде. Концентрация у…Небелковые азотсодержащие вещества
Остаточный азот
1. Метаболиты: 1.1. аминокислоты (25%); 1.2. креатин (5%);Углеводный обмен
1. Гипергликемия (повышение глюкозы): 1.1. панкреатическая гипергликемия – при отсутствии инсулина, нарушении… 1.2. внепанкреатическая гипергликемия – при гиперпродукции контринсулярных гормонов, нарушении инсулиновых рецепторов…Липидный обмен
К=(ЛПНП +ЛПОНП) /ЛПВП. В норме у взрослого коэффициент атерогенности не более 3,0. У новорожденного –… Гиперхолестеринемия может свидетельствовать об:Минеральный обмен
Снижается уровень натрия при длительной рвоте (потеря бикарбонатов), длительных поносах (например, при холере) и при увеличении содержания воды в… Калий – это главный внутриклеточный ион. Увеличивается его концентрация при… Снижается уровень калия при его недостатке в продуктах питания и при синдроме гемоделлюции. Снижение уровня калия…Ферменты плазмы крови
1. Функционирующие ферменты (собственно плазменные). Напр., ренин (повышает АД через ангиотензин II), холинестераза (расщепляет ацетилхолин). Их… 2. Нефункционирующие ферменты (плазмонеспецифические). Появляются в плазме… Причины гиперферментемии:Физические свойства мочи здорового человека, их изменения при патологии
► Полиурия – увеличение количества мочи из-за: 1) увеличения фильтрации (под действием адреналина увеличивается… 2) увеличения онкотического давления при снижении концентрации белков в плазме;Показатели химического состава мочи
ü увеличиваться – гиперазотурия – из-за распада белков в организме или употребления большого количества мясной пищи; ü уменьшатся – гипоазотурия – при нарушении функции почек.Особенности обмена веществ в нервной ткани
В ткани головного мозга увеличено клеточное дыхание (преобладают аэробные процессы). Мозг потребляет большее количество кислорода, чем постоянно… Ткань головного мозга использует весь кислород, находящийся в ней, за 10… Дыхательный коэффициент (отношение объема СО2 к объему О2) в тканях головного мозга приблизительно равно 1,…Химическая передача нервного возбуждения
- нейропептидов; - АК; - ацетилхолина;– Конец работы –
Используемые теги: Биохимия, задачи0.083
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: БИОХИМИЯ И ЕЁ ЗАДАЧИ
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов