рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Философия
- /
- Харчова хімія Конспект лекцій
Реферат Курсовая Конспект
Харчова хімія Конспект лекцій
Харчова хімія Конспект лекцій - раздел Философия, Міністерство Освіти І Науки України ...
Міністерство освіти і науки україни
Національний університет
Харчових технологій
В.Ф. Доценко
Харчова хімія
Конспект лекцій
Для студентів спеціальності 6.140101
«Готельно-ресторанна справа»
Денної форми навчання
СХВАЛЕНО
на засіданні кафедри
технології харчування і
готельно-ресторанної справи
Протокол № 16
від 23 лютого 2010р.
Київ НУХТ 2010
Доценко В.Ф. Харчова хімія: Конспект лекцій для студентів спеціальності 6.140101 «Готельно-ресторанна справа» денної форми навчання. – К.: НУХТ, 2010. - 146 с.
Рецензент Л.Ю.Арсеньєва, д.т.н., професор
В.Ф. Доценко, д.т.н., професор
Видання подається в авторській редакції
Atilde;В.Ф. Доценко, 2010
 ãНУХТ, 2010
ãНУХТ, 2010
Вступна лекція.
Предмет, мета і завдання дисципліни
План
1. Об’єм дисципліни, характеристика навчальної програми, форми контролю знань
2. Що вивчає харчова хімія
3. Зв'язок з фундаментальними та інженерними дисциплінами
4. Значення харчових продуктів в життєдіяльності людини
5. Терміни та визначення
6. Рекомендована література
Дисципліна « Харчова хімія» розрахована на 32 години лекційного матеріалу, 32 годин практичних занять на яких студенти виконують реферативно- розрахункові роботи, 32 години лабораторних занять.
Робоча програма включає такі розділи: предмет і мета і завдання дисципліни. Зв'язок з іншими дисциплінами. Значення харчової хімії. Білки. Вуглеводи. Ліпіди. Мінеральні речовини. Вітаміни. Харчові кислоти. Ферменти та ферментні препарати. Вода. Харчові і біологічно активні добавки. Основи раціонального харчування.
Робочою програмою передбачено 2 модульних контролі знань студентів.
Дисципліна «Харчова хімія» відноситься до дисциплін циклу «Природничо-наукової та професійно-практичної підготовки» і є базовою у підготовці бакалаврів напряму 6.140101 «Готельно-ресторанна справа»
Харчова хімія – розділ хімічної науки. Це наука про хімічний склад харчових систем (сировина, напівфабрикати, готові харчові продукти), його зміни в ході технологічного потоку під впливом різних факторів (фізичних, хімічних, біохімічних і т.д.), що включають ліпід-білкові, ліпід-вуглеводні, білок-білкові, білок-вуглеводні взаємодії, загальні закономірності цих перетворень.
Вона включає вивчення взаємозв’язку структури і властивостей харчових речовин і його впливу на властивості і харчову цінність продуктів харчування.
Харчова хімія приділяє увагу методам виділення (вилучення), фракціонування, очистки харчових речовин (білків, вуглеводів, ліпідів і т.д.), їх каталітичній модифікації.
Невід’ємною частиною харчової хімії є розділи, присвячені харчовим і біологічно-активним добавкам, забруднювачам харчової сировини і продуктів.
На базі знань одержаних при вивченні «Харчової хімії» вивчаються такі дисципліни: «Основи фізіології та гігієни харчування», «Гігієна і санітарія», «Товарознавство», «Основи виробництва продукції ресторанного господарства», «Методи контролю якості продукції у галузі», «Безпека харчових продуктів» та інші.
Програма дисципліни підкреслює єдність закономірностей взаємозв’язку хімічного складу сировини, фізико-хімічних та технологічних властивостей складових сировини, у поєднанні із впливом на організм людини.
Предмет дисципліни – хімічний склад харчових систем, їх взаємозв’язок зі структурою і властивостями харчових речовин, їх зміни в ході технологічного процесу у поєднанні з харчовою цінністю продуктів харчування, вплив на організм людини.
Мета викладання дисципліни – дати цілісне уявлення про властивості основних складових харчової сировини які забезпечують задані властивості різних харчових продуктів, сформувати у студентів науковий підхід до питань удосконалення технологічних процесів, забезпечити набуття студентами певної ерудиції з технології продуктів ресторанного господарства, показників якості харчових продуктів та методів їх контролю, розкрити значення складових сировини в життєдіяльності людини.
Основні терміни та визначення
Список Рекомендованої літератури
Основна
1. Пищевая химия/Нечаев А.П., Траубенберг С.Г., Кочеткова А.А. и др.. Под ред. А.П.Нечаева. Издание 2-е, перераб. И испр. – СП.:ГИОРД, 2003. – 640 с.
2. Рогов И.А., Антипова Л.В., Дунченко Н.И. Химия пищи. – М.: Колос С, 2007. – 853 с.
3. Капрельянц Л.В., Іоргачова К.Г. Функціональні продукти. – Одеса: Друк, 2003. – 312 с.
4. Технология пищевых производств/Под ред. Л.П.Ковальской. – М.: Колос, 1997. – 752 с.
Додаткова
1. Смоляр В.І. Фізіологія та гігієна харчування. – К.: Здоровя, 2000.-336 с.
2. Позняковський В.М. Гигиенические основы питания, качество и безопасность пищевых продуктов. – Новосибирск: Сиб. Унив. Изд-во, 2005.- 522 с.
3. Тутельян В.А., Спириче В.Б., Суханов Б.П., Кудашева В.А. Микронутриенты в питании здорового и больного человека (справочное руководство по витаминам и минеральным веществам). – М.: Колос, 2002. – 424 с.
5. Основи фізіології харчування/Н.В. Дуденко, Л.Ф. Павлоцька, В.С. Артеменко, М.В. Кривоносов, І.С. Кратенко: Підручник. – Х.: Торнадо, 2003. – 407 с.
Тема 1
Білки. Будова, властивості, перетворення
У харчових процесах
План
1. Будова білків, властивості, класифікація
2. Функціональні властивості білків
3. Перетворення білків у харчових технологіях
4. Значення білків у життєдіяльності людини
5. Методи визначення білків
Будова білків, властивості, класифікація
Білки – найважливіша складова продуктів харчування. Без білка немає життя – це істина згадується при кожному описанні живої матерії. Існує нескінченний цикл – перетворення азоту для біосинтезу амінокислот і білків.
Тварини використовують у їжу рослини, асимілюють амінокислоти і перетворюють їх у власні білки.
Людина використовує у їжу тваринні і рослинні продукти, перетворюючи амінокислоти їжі у власні тканинні білки.
Після смерті живих організмів органічні молекули розкладаються мікроорганізмами, азот поступає у грунт, який асимілюється фіксуючими бактеріями і перетворюються у органічні речовини і цикл повторюється.
Білками або протеїнами (від грецького слова protos – перший, первісний) називають високомолекулярні природні азотовмісні сполуки, молекули яких побудовані із залишків амінокислот.
Білки – найскладніші речовини із усіх сполук живої тканини.
До складу білків входять п’ять елементів: азот, вуглець, кисень, водень, сірка приблизно у таких кількостях(%):
вуглець -50-54, азот – 15-18, кисень -20-23, водень -6-8, сірка -0,3-2,5.
Амінокислоти являються будівельними блоками білків. Білки синтезуються із амінокислот і перетворюються в амінокислоти при перетравлюванні (гідролізі) у шлунково-кишковому тракті.
Природних амінокислот нараховується біля 200, а до складу білків входять лише 20 індивідуальних амінокислот.
Молекули амінокислот містять декілька функціональних груп, які визначають їх властивості: аміногрупа – NH2; карбоксильна група – СООН і амінокислотний радикал - R, що має різну будову: від 1 до 7 атомів вуглецю.

Загальна формула амінокислот
Яким же чином вони зв’язані у молекулі білка?
При вивченні властивостей білків і їх будови вченими було установлено, що між молекулами амінокислот існує так званий пептидний зв’язок або його ще називають кислотно-амідним зв’язком, завдяки якому утворюються ди -, три -, тетра -, пентапептиди).

Схема пептидного зв’язку
У білковій молекулі крім поліпептидних є ще дисульфідні зв’язки – S – S -, які з’єднують між собою окремі пептидні ділянки одного і того ж поліпептидного ланцюга, утворюючи спіраль.
Розглянемо деякі властивості амінокислот.
1. У продуктах харчування містяться лише 20 амінокислот. Ці амінокислоти поділяються на замінні і незамінні
Класифікація амінокислот
Замінні амінокислоти можуть синтезуватися в організмі людини, а незамінні повинні надходити у готовому вигляді з білками їжі. Залежно від вмісту незамінних амінокислот білки поділяються на повноцінні і… Повноцінні білки є у багатьох продуктах тваринного походження. Більшість же білків рослинного походження, крім білків…У розчині з рН між 4 і 9 (водні розчини) АК існують у вигляді цвіттер-іонів.
Стан амінокислоти, коли її сумарний електричний заряд дорівнює нулю, називається ізоелектричним, значення рН, що обумовлює цей стан, називається ізоелектричною точкою амінокислоти (рІ).
В ізоелектричні точці ІЕТ АК мають мінімум розчинності, мінімальну буферну ємність.
З якими хімічними речовинами можуть взаємодіяти АК?
Завдяки наявності карбоксильних і аміногруп АК можуть брати участь у специфічних хімічних реакціях, які використовуються при розділенні, ідентифікації і кількісному визначенні АК.
АК легко утворюють солі, складні ефіри і інші сполуки, гідразиди, азиди, тіоефіри, галогенангідриди: АК можуть взаємодіяти (вступати в реакцію) зі спиртами, утворюючи складні ефіри, з азотистою кислотою (НNO2), утворюючи оксикислоту і газоподібний азот, з формальдегідом, для ідентифікації і кількісного аналізу АК використовують реакцію з нінгідрином – кольорова реакція.
Але основною реакцією, яка має суттєве значення у технологіях харчових продуктів, є реакція амінокислот з редукуючими речовинами. Ці речовини взаємодіють при нагріванні до температури 100-1050C, а її реакція одержала назву Майяра (1912 р). Її ще називають реакцією меланоідиноутворення.
Реакція Майяра остаточно не вивчена, вона складна, протікає через ряд проміжних стадій.
Меланоідини – важливі компоненти харчових продуктів. Однак, слід наголосити, що реакція Майяра є причиною зменшення цінних компонентів їжі (амінокислот і цукрів) із-за того що меланоідини практично не засвоюються організмом людини.
Але при кулінарній обробці харчових продуктів меланоідини беруть участь у формуванні смаку, запаху і кольору харчових продуктів.
Так, колір, аромат свіжовипеченого хліба, колір квасу, пива, кип’яченого молока, м’ясних виробів, що піддані кулінарній обробці, особливо смаженню, колір сушених плодів і овочів – у більшості визначається реакцією меланоідиноутворення.
Навпаки, у виробництві цукру, меланоідини не бажані так як вони обумовлюють високу в’язкість уварюваних сиропів і загальмують процес кристалізації у них цукрози.
Особливості будови молекул деяких амінокислот
До складу сірковмісних амінокислот - цистеіна, цистина і метіоніна входить атом сірки. Деякі АК мають у боковому ланцюгу другий атом азоту (лізин, аргінін,… АК, боковий ланцюг яких розгалужений, називаються амінокислотами з розгалуженим боковим ланцюгом (лейцин, ізолейцин,…Білки класифікують за фізико-хімічними властивостями та хімічним складом. За цими ознаками білки поділяють на дві групи – прості (протеїни) і складні (протеїди).
Протеїни – це білки, до складу яких входять лише залишки амінокислот.
Протеїди – складні білки, молекули яких крім залишків АК містять ще і інші компоненти – простетичні групи.
Прості білки(протеїни) поділяються на такі класи: - альбуміни, глобуліни, протаміни, гістони, проламіни, глутеліни і протеіноїди. Із названих білків детально зупинимося на чотирьох, які мають важливе значення у технологіях продуктів харчування: альбуміни, глобуліни, глутеліни і проламіни.
Альбуміни – входять до складу продуктів харчування: молока, яєць, зерна злакових і бобових культур.
Молекулярна маса альбумінів 35-70 тис. Молекули їх мають еліпсовидну форму, яка більш компактна і симетрична, ніж у глобулінів. Альбуміни належать до гідрофільних білків, вони добре розчиняються у воді. За хімічним складом альбуміни характеризуються високим вмістом лейцину (15%), а також значним вмістом сірковмісних амінокислот, лізину, аспарагінової і глутамінової кислот і незначним вмістом гліцину.
Глобуліни – входять до складу зерна злаків, насіння соняшника, льону, бавовника та бобових рослин. Широко відомі такі глобуліни, як фазеолін квасолі, легумін гороху, гліцидин сої. У тваринних тканинах найбільш розповсюдженими є лактоглобулін молока, фібриноген крові тощо.
Молекулярна маса глобулінів 0,9-1,5 млн. Вони більш грубодисперсні і менш гідрофільні, ніж альбуміни, що пояснюється меншою стійкістю їх колоїдних розчинів.
Добре розчиняються 10% розчинами солей. За хімічним складом глобуліни дещо відрізняються від альбумінів – містять більше гліцину (5%) і меншу кількість сірковмісних амінокислот.
Проламіни – ця група білків досить розповсюджена у рослинному світі. Вони входять до складу насіння злакових культур. Представниками їх є гліадин пшениці, орозеїн рису, гордеїн ячменю, зеїн кукурудзи, авенін вівса тощо. Назва «проламіни» була запропонована в зв’язку з тим, що до їх складу входить значна кількість проліну. Крім проліну проламіни містять також глутамінову кислоту і незначну кількість інших АК. Для проламінів характерним є те, що вони зовсім не містять лізину. Розчиняються у 70% водному розчині спирту.
Глутеліни як і проламіни, містяться у зелених частинах рослин і насінні. Характерною особливістю білків є те, що до їх складу входять велика кількість глутамінової кислоти і лізину. Добре розчиняються у лугах.
Складні білки (протеїди) складаються з простого білка і сполуки небілкової природи-простетичної групи (від грецького слова prosteto-приєдную, додаю). Залежно від хімічної природи простетичної групи складні білки поділяються на нуклеопротеїди, хромопротеїди, металопротеїди, глюкопротеїди, фосфопротеїди і ліпопротеїди.
Нуклеопротеїди – це складні білки, простетичною групою яких є нуклеїнові кислоти. Залежно від природи нуклеїнової кислоти нуклеопротеїди поділяються на рибонуклеопротеїди (РНП), якщо до їх складу входить рибонуклеїнова кислота – РНК, а якщо дезоксирибонуклеїнова кислота – ДНК.
Хромопротеїди – побудовані з простого білка і забарвленої простетичної групи якою можуть бути похідні каротину, порфірину (гемоглобін, міоглобін, ферменти). Гемоглобін крові – хромопротеїд, міоглобін міститься у м’язах тварин.
Глюкопротеїди – у складі простетичної групи містять залишки вуглеводів та їх похідні. Входять до складу крові, білків молока, яєць, ферментів, гормонів.
Металопротеїди – до складу простетичної групи входять залізо, мідь, кобальт, цинк та інші елементи. До металопротеїдів належить велика група ферментів.
Фосфопротеїди – містять у вигляді простетичної групи залишки ортофосфорної кислоти. Ці білки входять до складу білків яєць ( овальбумін), молока (казеїн).
Ліпопротеїди – у складі простетичної групи містять ліпіди і їх похідні (тригліцериди, фосфоліпіди, холестерин тощо). Найчастіше простетичною групою є нейтральні жири – тригліцериди. Входять до складу біологічних мембран, крові, лімфи, нервових тканин та інше.
В комплексі з білками ліпіди набувають нових властивостей: вони здатні розчинятися у воді і втрачають здатність розчинятися у органічних розчинниках. Ліпіди ж не розчиняються у воді і розчиняються у органічних розчинниках.
Функціональні властивості білків
Під функціональними властивостями мають на увазі властивості, які визначають їх зміни при переробленні у харчові продукти та забезпечують певну структуру, технологічні і споживні властивості. До найбільш важливих функціональних властивостей білків належать:
- водозвязувальна;
- жирозвязувальна;
- структуроутворювальна (піноутворювальна та драглеутворювальна) здатність.
Здатність білків зв’язувати на своїй контактній поверхні воду – одна із характерних фізико-хімічних властивостей що відіграє важливу роль у технології харчових продуктів.
З гідрофільністю пов’язані такі процеси, як набухання і розчинність білків, їх осадження і денатурація при дії жорстких фізико-хімічних факторів середовища.
Гідрофільність являє собою наслідок дії електростатичних сил протягування, що розвиваються між іоногенними і полярними групами білкової глобули і диполями води.
Набухання. Внаслідок великої різниці у швидкості дифузії молекул білків і низькомолекулярного (вода) розчинника на першій стадії процесу розчинення білка молекули розчинника проникають у простір між полімерними ланцюгами білка. Відбувається збільшення об’єму молекули. Це явище називають набуханням, яке переходить у розчинення (необмежене набухання) у тому випадку, коли між поліпептидними ланцюгами відсутні поперечні хімічні зв’язки. Це явище характерне для глобулярних білків. У поліпептидах, що утворюють сітчасту структуру, розчинення неможливе, і процес закінчується набуханням (обмежене набухання). Такі перетворення характерні для деяких фібрілярних білків.
Кількісною характеристикою обмеженого набухання є ступінь набухання αm, яку визначають гравіметричним способом: зважують зразок до і після набухання і розраховують за формулою:
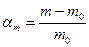
m – маса набухлого зразка;
m0 – наважка вихідного зразка.
Ступінь набухання також визначають об’ємним методом, вимірюючи об’єм зразка до і після набухання:
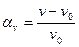
V – об’єм набухлого зразка;
V0 – об’єм вихідного зразка.
Ступінь набухання залежить від різних факторів, у тому числі від природи розчинника.
Розчинення білків – спонтанний процес.
Таким чином, при постійному тиску і температурі він супроводжується зменшенням вільної енергії (енергії Гіббса):
DG = DH - TDS, де
DG – ентальпія; DS – ентропія; Т – температура.
При обводненні системи на стадії набухання і розчинення білків зміни вільної енергії перевищують зміни вмісту тепла і ентропія системи починає зростати.
Під дією електростатичних сил поверхня білкової глобули покривається гідратною оболонкою. Перший шар молекул води (мономолекулярний шар) досить міцно адсорбований на поверхні, наступні шари гідратної оболонки, по мірі того як електростатичні сили слабкішають, стають менш упорядкованими.
Виникає ситуація коли характерною ознакою якої є повільний перехід від твердої фази (білкової глобули) до дисперсійного середовища (вода); білкова глобула як би закріплена на "якорях", роль яких виконують диполі води. Оскільки диелектрична проникність води висока, взаємозв’язок між білковою глобулою і водним середовищем досить стабільний.
При контакті з водою сухий білок набухає, молекули води проникають у білкову масу і в результаті гідратації молекули білка роз’єднуються.
Важливу роль тут відіграють не тільки електростатичні сили, але і сили осмосу.
Набухлий білок можна вважати розчином води у білку; енергія набухання велика. Подальше поглинання води призводить до розчинення білка.
Розчинення пов’язано з хімічною структурою білка. Оскільки амінокислотний склад білків різний, розчинність білків коливається у широких межах і буде визначатись співвідношенням гідрофільних (іоногенних і полярних) і гідрофобних (неполярних) R – груп, специфікою укладання їх у трьохвимірну структуру; чим більше гідрофільних R – груп на поверхні білкової молекули, тим вища її гідрофільність і тим вища розчинність білка; поверхневі гідрофобні R – групи зменшують розчинність.
Глобулярні білки краще розчинні, ніж фібрілярні. Кількість зв’язаної води для різних білків складає біля 0,15-0,35 г на 1 г білка.
Явище набухання широко розповсюджено у харчових технологіях; воно, наприклад, відіграє важливу роль в утворенні пшеничного тіста.
Набухлі білки борошна гліадин і глютенін відомі під назвою клейковина, яка обумовлює пружність, розтяжність і еластичність тіста.
Обмежено набухає колаген – основний компонент сировини і напівфабрикатів м’ясної промисловості.
Частково деструктурований колаген називають желатином, який легко набухає у теплій воді.
При набуханні об’єм і маса зразків збільшується у 10-15 разів.
Якщо набухання переходить у розчинення (необмежене набухання) система переходить у стан геля (студня).
На процес набухання впливає ряд факторів:
1. Додавання електролітів, які гальмують набухання;
2. Швидкість набухання зростає з підвищенням температури;
3. Швидкість і ступінь набухання зростають із збільшенням ступеня подрібненості полімеру, оскільки зростає поверхня контакту полімеру з розчинником і інтенсивність дифузії молекул. Ці фактори мають важливе значення у харчових технологіях.
Вплив електростатичних сил на розчинність білків залежить від рН середовища. Білки є амфотерними електролітами, оскільки вони містять карбоксильні і амінні групи та можуть дисоціювати і як кислоти, і як луги. Але при рН, близьким до ізоелектричної точки, розчинність білків найменша. В ізоелектричній точці спостерігається також найменша в’язкість розчинів білків та найлегше білки осідають з розчинів.
Але сам по собі білок не виділяється у вигляді осаду. Це можна зробити за допомогою нейтральних солей у високих концентраціях (сульфат амонію, фосфат натрію або калію) або органічних розчинників (спирту, ацетону). Процес вилучення білка з розчину під дією солей називається висолюванням. Насичення водного розчину спиртом або ацетоном призводить до зневоднення білків, оскільки спирт та ацетон є більш гідрофільними, порівняно з білками. Внаслідок цього білкові глобули злипаються у крупніші частинки і випадають в осад.
Ця властивість використовується у технологіях виготовлення ізолятів та концентратів білків. Суть технології полягає у переведенні білків сировини (соєвих білків, соняшникових та інших) у розчин за допомогою кислот чи лугів, а потім – виділення цих білків з розчинів осадженням. Осадження білків краще відбувається при низьких температурах.
Висолювання є зворотнім процесом. Після видалення осаду білки знову можна розчинити. Розчини білків є колоїдними розчинами.
Денатурація білків
Денатурація – це наслідок руйнування нативної структури білків, який супроводжується втратою біологічної активності (ферментативної,… З фізичної точки зору – це деструкція білкової молекули без зміни первинної… Типовим прикладом денатурації є згортання (зкручування) яєчного альбуміну при варінні яєць.Перетворення білків у харчових технологіях
Основні перетворення білків полягають у їх денатурації, гідролізі, утворенні токсичних елементів тощо. Процес денатурації білків викладено у попередньому розділі. Термічна обробка білків при температурах 40-1000С призводить не лише до денатурації, а й прискорює небажані термічні…Значення білків у життєдіяльності людини
Строга специфічність біологічних функцій білків – основа обміну речовин у живій клітині. Ні один клас біологічно-активних речовин не наділений… Постільки обмін речовин в організмі людини являє собою сукупність великого… 1. Ферментативна (каталітична) функція. Без неї не протікає ні одна біохімічна реакція у живій клітині. Ферменти –…Методи визначення білків
Якісні реакції на білки
Дуже важливою властивістю білків є забарвлюючі їх реакції, які зумовлені наявністю в білковій молекулі певних хімічних груп. До них відносяться ксантопротеїнова, біуретова, Міллонова реакція, реакція Адамкевича.
Ксантопротеїнова реакція полягає в тому, що при обробленні білка міцною азотною кислотою з’являється жовте забарвлення, зумовлене наявністю в білку бензольних кілець.
Міллонова реакція полягає в обробленні білка міллоновим реактивом (розведеним водою розчином металевої ртуті в азотній кислоті), який реагує з фенольними групами, утворюючи сполуки, що надають білку вишневого-червоного забарвлення.
Біуретова реакція – поява фіолетового чи червоно-фіолетового забарвлення під дією розчину CuSO4 у лужному середовищі.
Реакція Адамкевича – поява фіолетового забарвлення при додаванні до розчину білка декількох крапель гліоксилевої кислоти та міцної сірчаної кислоти. Ця реакція залежить від наявності індолевої групи.
Кількісне визначення білків
2. Колориметричні методи. Біуретовий метод оснований на специфічній реакції пептидних зв’язків з іонами… Метод Лоурі. В основі метода лежить реакція відновлення реактиву Фоліна мідним похідним білка з утворенням забарвлених…Питання для самоперевірки
2. Охарактеризуйте елементний склад білків. 3. Що таке пептидний зв'язок? 4. Які функціональні групи входять до складу амінокислот? Що таке амфотерність амінокислот?Рекомендована література
Основна:
1. с. 17 – 112
2. с. 14 – 88; с. 181 – 201; с. 349 – 399.
3. с.51 - 53
4. с. 8-12
Додаткова:
1. с. 55 – 67
4.с. 88 - 100
Тема 2
Вуглеводи. Будова, властивості, перетворення в
Харчових технологіях
План
1. Будова вуглеводів, класифікація, властивості
2. Перетворення вуглеводів при виробництві харчових продуктів
3. Функціональні властивості вуглеводів
4. Роль вуглеводів в організмі людини
Будова вуглеводів, класифікація, властивості
В організмі людини і тварин вуглеводи виконують енергетичну, структурну і захисну функцію. Термін "вуглеводи" вперше був запропонований у 1844р. К.Ш.Шмідтом,… Вуглеводи ще часто називають цукрами.Схема класифікації вуглеводів
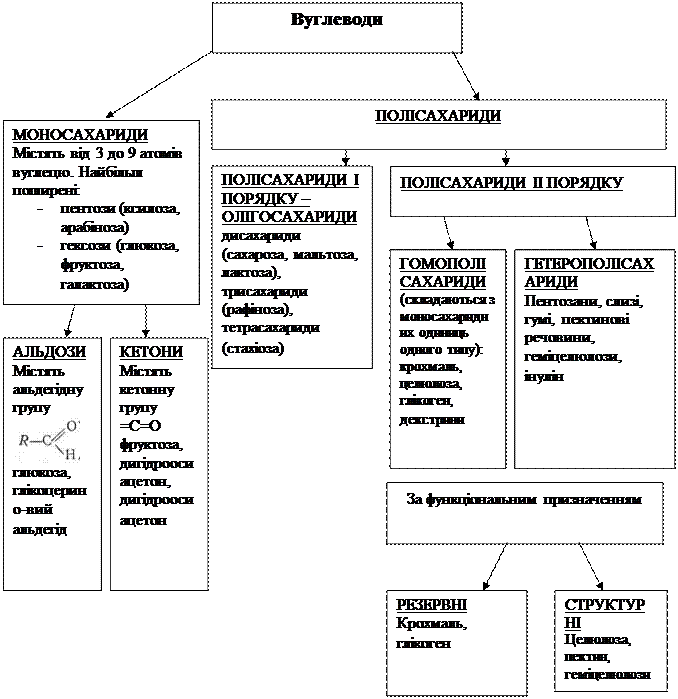
1. Моносахариди. Їм відповідає загальна формула CnH2nOn, де n = 4,5,6,7,8 і т.д.
Залежно від числа атомів вуглецю у ланцюгу моносахариди розрізняють:
триози, сполуки, що містять 3 вуглецевих атома;
тетрози, сполуки що містять 4 вуглецевих атома;
пентози, сполуки, що містять 5 вуглецевих атома;
гексози, сполуки, що містять 6 вуглецевих атома;
гептози, сполуки, що містять 7 вуглецевих атомів.
і т. д.
|
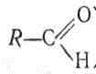
За наявності альдегідних або кетонних груп моносахариди поділяють на альдози і кетози
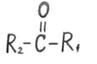
|
альдегідна кетонна
Звідси і назви:
триози – альдози (альдотриози) або кетози (кетотрози)
тетрози – альдози (альдотетрози) або кетози (кетотетрози)
пентози – альдози (альдопентози) або кетози (кетопентози)
гексози – альдози ( альдогексози) або кетози ( кетогексози)
Більшість моносахаридів мають прямий вуглецевий ланцюг. Але є моносахариди з розгалуженим ланцюгом (апіоза – міститься у петрушці, стрептоза – міститься у стрептоміцині).
Крім гідроксильних, альдегідних і кетонних груп моносахариди містять амінні, карбоксильні і сульфігідрильні групи.
Число гідроксильних груп інколи не відповідає кількості вуглецевих атомів. Такі моносахариди називають дезоксисахарами.
Будова альдоз.
Молекула глюкози містить шість вуглецевих атомів. Її елементарна формула С6Н12О6. Глюкоза в структурі молекули має альдегідну групу і веде себе як альдегід. Нумерація вуглецевих атомів у ланцюгу починається від кінцевого карбонільного вуглецю.Класифікація полісахаридів
Крохмаль – резервний полісахарид формули (С6Н10О5)n. У великих кількостях міститься у ендоспермі зерна пшениці 58-78%, кукурудзи -65-72%, рису… Це біла аморфна речовина, що набухає у гарячій воді з утворенням колоїдного… Розмір крохмального зерна коливається від 2 до 150 мкм.Перетворення вуглеводів при виробництві харчових продуктів
У багатьох харчових технологіях має місце гідроліз олігосахаридів та полісахаридів. Гідроліз дисахаридів має місце при виробництві цукру. При цьому… У харчових технологіях застосовують кислотний та ферментативний гідроліз… Гідроліз крохмалю під дією кислот спричиняє спочатку послаблення зв'язків між макромолекулами амілози і амілопектину.…Ферментативний гідроліз крохмалю, не крохмальних полісахаридів і сахарози детально викладено у темі 7.
1) каталізуються кислотами, і лугами; 2)потребують температури. Реакції з розривом – С – С – зв'язків спричиняють утворення летких кислот, фуранів, спиртів, ароматичних речовин,…Глюкозооксидаза Д-глюкоза Д-глюконова кислота
4) Хімічний спосіб інгібування реакції Майяра полягає у використанні сульфітів. В одних випадках сульфіти сповільнюють реакцію меланоідиноутворення,… Деякі інші інгібітори також неприйнятні із-за токсичності (ціаніди,… Процес меланоідиноутворення має як позитивний, так і негативний вплив на якість харчових продуктів, що необхідно…Зброджування вуглеводів
Спиртове бродіння здійснюється завдяки життєдіяльності дріжджів роду Saccharomyces . Сумарно спиртове бродіння описується рівнянням
С6Н1206= 2С02 + 2С2Н5ОН
Проте при спиртовому бродінні завжди в невеликих кількостях утворюються інші речовини: бурштинова, лимонна кислота, суміш амілового , ізоамілового, бутилового та інших спиртів, а також оцтова кислота, оцтовий альдегід, дикетони, гліцерин. Ці домішки негативно впливають на аромат вина, пива, горілки.
Різні цукри по-різному зброджуються дріжджами. Найлегше зброджується дріжджами глюкоза і фруктоза, повільніше - маноза, найповільніше - галактоза, пентози (ксилоза і арабіноза) дріжджами не зброджуються. Серед дисахаридів сахароза і мальтоза легко зброджуються після гідролізу відповідно b-фруктофуранозидазою і a- глюкозидазою, які містяться у дріжджах. Лактоза дріжджами не зброджується, але у разі застосування ферменту b-галактозидаза утворюється глюкоза і галактоза, які з різною швидкістю зброджуються дріжджами.
Другим видом бродіння, яке має важливе значення у харчових технологіях, є молочнокисле бродіння, що здійснюється під дією молочнокислих бактерій:
С6Н1206 = 2СН3-СНОН-СООН
Молочна кислота
Функціональні властивості вуглеводів
- гідрофільність (гігроскопічність); - солодкість; - здатність зв'язувати ароматичні речовини;Роль вуглеводів в організмі
Найважливішими серед них слідуючі: 1. Енергетична. При змішаному типі харчування вуглеводи забезпечують понад 60%… 2. Пластична. Використовуються для синтезу багатьох життєво необхідних для організму людини речовин: глікогену,…ПИТАННЯ ДО САМОПЕРЕВІРКИ
2. Які моноцукри мають найбільше значення в харчових технологіях? 3. Назвіть полісахариди першого порядку. 4. Яка будова полісахаридів другого порядку?Рекомендована література
Основна:
1. с.122 – 184
2. с.501 – 594
3. с.41 – 51
4. с.16 – 21
Додаткова:
1. с.76 – 86
4. с.118 - 128
Тема 3
Ліпіди. Будова, властивості, їх перетворення в харчових технологіях
План
1. Будова та класифікація ліпідів, склад сирого жиру
2. Основні реакції ліпідів
3. Перетворення ліпідів у технологіях харчових продуктів
4. Біологічна цінність харчових ліпідів
5. Роль ліпідів в організмі людини
Будова та класифікація ліпідів
Ліпіди об’єднують велику групу різних за хімічною природою органічних речовин, які мають деякі спільні фізико-хімічні властивості.
Однією з таких спільних властивостей ліпідів є нерозчинність їх у воді і здатність добре розчинятися в органічних розчинниках – спирті, ефірі, хлороформі, ацетоні, бензолі і інших розчинниках.
За хімічним складом та фізико-хімічними властивостями ліпіди поділяють на дві групи: - прості і складні.
До простих ліпідів відносять ліпіди, які побудовані із залишків спиртів і вищих жирних кислот. Найпоширенішими з цієї групи ліпідів є нейтральні жири (гліцериди), стериди і воски.
Класифікація ліпідів
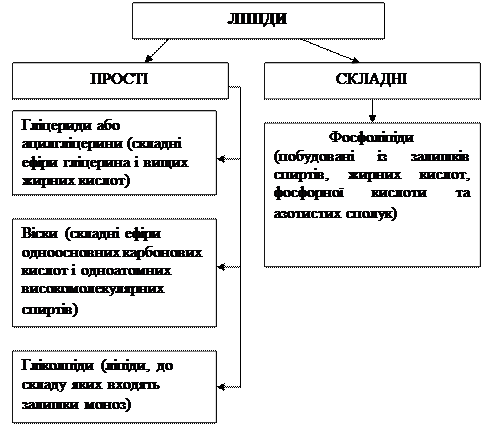
Група складних ліпідів характеризується наявністю в їхній молекулі крім спиртів і вищих жирних кислот фосфорної або сірчаної кислоти, азотистих речовин, вуглеводів та деяких інших компонентів. Основними представниками цієї групи ліпідів є фосфоліпіди, гліколіпіди.
Прості ліпіди
Утворення жирів з гліцерину та жирних кислот відбувається за слідуючою схемою: Якщо в гліцерині всі три спиртові групи етерифіковані жирними кислотами, то…Насичені жирні кислоти
Капронова – СН3(СН2)4 – СООН () Каприлова – СН3(СН2)6 – СООН () Капринова – СН3(СН2)8 – СООН ()Ненасичені жині кислоти
Пальмітоолеїнова – СН3 – (СН2)5 – СН=СН – (СН2)7 – СООН () Олеїнова – СН3 – (СН2)7 – СН=СН – (СН2)7 – СООН () Ерукова – СН3 – (СН2)7 – СН=СН – (СН2)11 – СООН ()Склад сирого жиру
Розрізняють воски тваринного і рослинного походження. До першої групи восків відносять ланолін, спермацет і бджолиний віск. Представником рослинних… Ланолін – віск, виділений із овечої вовни. Він є сумішшю ефірів жирних кислот… Спермацет добувають із спермацетового масла, яке є в мозку кашалота. Складний ефір цетилового спирту і пальмітинової…Складні ліпіди
Фосфоліпіди (фосфатиди) – обов’язкові компоненти рослин. Їх вміст у різних культурах слідуючий (в %): соя – 1,8, соняшник – 0,3, льон – 0,6, пшениця… В молекулі фосфоліпідів є замісники двох типів: гідрофільні і гідрофобні. В… Побудовані таким чином амфіфільні (такі, що мають подвійну спорідненість) молекули ліпідів легко орієнтуються.…Основні реакції ліпідів
- гідроліз триацилгліцеринів; - переетерефікація; - гідрогенізація;Окислення ацилгліцеринів
Жири і олії, які містять радикали ненасичених жирних кислот, окиснюються киснем повітря. Реакція окиснення може відбуватися під дією фермента ліпоксгенази. Під час окиснення ненасичених жирних кислот
Загальна схема ферментативного прогоркання жирів
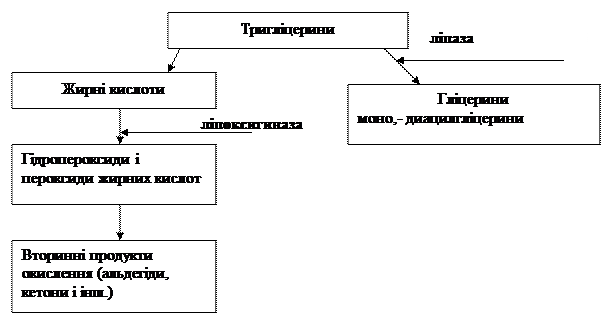
спочатку утворюються перекиси, які прискорюють реакцію окиснення жирів.
При цьому перекиси розпадаються з утворенням окисів, альдегідів та інших речовин, які надають жирам прогірклий смак і запах. Реакція окиснення є вільнорадикальною ланцюговою реакцією, тому вона прискорюється в присутності активних радикалів. Висока активність ферменту ліпази прискорює реакцію, оскільки вільні жирні кислоти окиснюються швидше, ніж ті, що входять до складу ацилгліцеринів.
Швидкість реакції окиснення залежить від низки факторів:
• від жирнокислого складу - зі збільшенням ступеня ненасиченості швидкість окиснення зростає;
• від вологості - зі збільшення вологості прискорюється окиснення;
• від температури та вмісту кисню - зі зростанням їх окиснення прискорюється;
• у присутності іонів металів - заліза, марганцю, міді та інш.окиснення прискорюється;
• надзвичайно великий вплив на швидкість окиснення має присутність антиоксидантів - речовин, що утворюють з вільними радикалами стабільні сполуки.
До природних антиоксидантів відноситься токофероли, сполуки фенольної природи - кварцетин, (b-каротин) та ін. Активність антиоксидантів зростає в присутності їх синергістів, зокрема, лимонної, аскорбінової кислот, фосфоліпідів, наприклад лецитину.
Отже, рослинні олії, які містять значну кількість ненасичених жирних кислот, схильні до автоокиснення. Проте, завдяки низькій вологості (W олії = 1 %) піддаються мікробіологічному псуванню і без доступу світла можуть зберігатись досить довго. Найкращі умови для зберігання олій: температура - 4 - 6°С, відносна вологість - 75 %, в закритій тарі, без доступу світла. Тваринні жири за своїм хімічним складом (невеликий вміст ненасичених жирних кислот) повинні мати високу стійкість при зберіганні, але вони не містять антиоксидантів, тому зберігаються погано. Найгірше зберігається маргарин, вершкове масло, комбіновані жири, тому що вони мають високу вологість - 16 - 35 %, містять білки і мінеральні речовини. Це сприяє розвитку мікроорганізмів та інтенсивному розвитку процесів біохімічного згіркнення.
Перетворення ліпідів у технологіях
Харчових продуктів
При приготуванні продуктів харчування, як у промисловості, так і ресторанному господарстві, в ході технологічного потоку ліпіди вихідної сировини (зерно, крупи, м'ясо і молоко, жири і масла, плоди і овочі і інш.) зазнають різних перетворень.
Значні зміни відбуваються і в ліпідному комплексі продуктів що зберігається. Все це впливає на їх склад, на харчову і біологічну ефективність готових продуктів.
З головними напрямами цих перетворень ми ознайомились у попередньому розділі: гідроліз ліпідів, окисне і біохімічне прогорання. Але у харчовій сировині, напівфабрикатах і готовій продукції вони можуть протікати одночасно, у вигляді зв’язаних між собою перетворень. У спрощеній формі це показано на схемі.
Перетворення ліпідів в технологічному процесі
Глибина і інтенсивність цих процесів залежать від хімічного складу ліпідів,… Завдяки низькій вологості, відсутності мінеральних речовин ліпіди не вражаються мікроорганізмами і можуть тривалий час…Біологічна цінність харчових ліпідів
Важливим показником біологічної цінності жирів є їхнє перетравлення, яке визначається кількістю тригліцеридів, що всмокталися в лімфу та кров.… Усмоктуваність жиру залежить від складу жирних кислот. Засвоюваність жирів з… При змішаному харчуванні засвоюється 96—98% свинячого жиру, 94—98% маргарину, 93—98% вершкового масла, 86—90%…Роль ліпідів в організмі людини
Ліпіди виконують структурно-пластичну роль, тому що входять до складу клітинних мембран усіх тканини. Мембранні структури клітин, утворені двома… Жири є жиророзчинниками вітамінів А, Д, Є, К та сприяють їх засвоєнню. З… Ліпіди, які входять до складу нервових клітин та їх відростків, забезпечують скерованість потоків нервових сигналів. …Питання до самоперевірки
2. Назвіть основні принципи класифікації ліпідів за їхніми фізико-хімічними та біологічними властивостями. 3. Дайте коротку характеристику гліцеридам. 4. Яка залежність між жирнокислотним складом і властивостями тригліцеридів?Рекомендована література
Основна:
1. с. 187 – 220
2. с. 404 – 496
3. с.39 - 41
4. с. 12 – 15
Додаткова:
1. с. 68 – 75
4 .с. 105 - 117
Тема 4
Мінеральні речовини (МР)
План
1. Роль мінеральних речовин в організмі людини
2. Класифікація та характеристика окремих макро - і мікроелементів
3. Вплив технологічної обробки харчових продуктів на їх мінеральний склад
4. Методи визначення мінеральних речовин
Роль мінеральних речовин в організмі людини.
МР відносяться до життєво необхідних компонентів харчування зі значними фізіологічними функціями.
Вони входять до складу живої матерії – містяться в протоплазмі і біологічних рідинах, забезпечують постійність осмотичного тиску, що є необхідною умовою нормальної життєдіяльності клітин і тканин. Вони входять до складу гемоглобіну, гормонів, ферментів, являються пластичним матеріалом для побудови костної та зубної тканини. У вигляді іонів МР беруть участь в передачі нервових імпульсів, забезпечують звертання крові та ін.
Підтримка кислотно-лужної рівноваги
Кислотоутворюючі елементи переважають у складі харчів багатих білками: м'ясі, рибі, птиці, яйцях і продуктах із зерна. Лужні елементи – кальцій, калій натрій, магній переважають у фруктах, овочах і… Незважаючи на кислий смак в деяких фруктах (наприклад, цитрусових – лимонах, грейпфрутах) переважають лужні мінеральні…Регуляція біохімічних реакцій
Мінеральні речовини входять до складу ферментів, що каталізують багато біохімічних реакцій, в тому числі реакцій метаболізму харчових речовин. Відомо, наприклад, що цинк каталізує біля 100 реакцій. Всмоктування і перетравлювання їжі протікає за участі мікроелементів. Окислення вуглеводів, жирів і білків і одержання із макронутрієнтів енергії відбувається в реакціях які каталізуються мінеральними елементами.
МР входять до складу гормонів, ферментів та інших біологічно-активних речовин, як обов'язкові компоненти, без яких утворення цих речовин неможливе. Гормон щитовидної залози тироксин утворюється при достатньому надходженні в організм йоду.
Ферменти, які містять в якості активної групи мінеральні елементи, метали, називаються металоферментами. При відсутності мінералів ці ферменти або втрачають активність, або зовсім не утворюються.
Мінерали як складові частини тіла
Мінеральні елементи, такі як кальцій і фосфор, є основними компонентами кісток і зубів, тобто слугують матеріалом для утворення цих тканин. Від наявності цих елементів залежить ріст кісток і зубів. Другі МР також відіграють велику роль в процесах росту дитячого організму, являючись активними компонентами металоферментів, які беруть участь в одержанні енергії із основних харчових речовин.
Водяний обмін
Накопичення і рух рідини із однієї частини в іншу залежить від концентрації розчинених у воді мінеральних солей, які складаються із протилежно… В нормальних умовах концентрація електролітів і рідини регулюється таким… Але при підвищеному вживанні солі (NaCl) спостерігається накопичення іонів натрію і хлору в позаклітинній рідині, яке…Інші функції мінеральних елементів
Мінеральні елементи беруть участь у передачі нервового імпульсу по нервовому волокну і між клітинами. В цьому процесі беруть участь калій, натрій, зміна концентрації яких генерує нервовий імпульс. В переносі нервового імпульсу між нервовими клітинами бере участь нейромедіатор ацетилхолін, звільнення якого в нервовому закінченні регулюється кальцієм.
Для нормального функціонування м'язів необхідним є кальцій, який бере участь в процесі скорочення, а також калій, натрій і магній, які необхідні для процесу розслаблення і скорочення м'язів.
Класифікація та характеристика окремих
Макро – і мікроелементів
До макроелементів відносять калій, натрій, кальцій, магній, фосфор, хлор, сірка. Їх вміст складає сотні і десятки міліграмів на 100 г харчового… Мікроелементи входять до складу продукту в кількостях виражених десятими,… Мікроелементи умовно поділяють на дві групи: абсолютно чи життєвонеобхідні (кобальт, залізо, мідь, марганець, цинк,…Симптоми при дефіциті різних мінеральних елементів
Найбільш розповсюдженим наслідком невідповідності у раціоні кількості Са і Р є карієс зубів, розрідження кісткової тканини. При нестачі фтору у питній воді руйнується зубна емаль; дефіцит йоду… Перерахуємо деякі причини порушення обміну мінеральних речовин, які можуть мати місце навіть при їх достатній…Основні мінеральні елементи, їх добова потреба, фізіологічні зміни при нестачі, харчові носії
Вплив технологічної обробки харчових продуктів на їх мінеральний склад
При цьому частина МР втрачається з відходами. Наприклад, при одержанні круп і борошна після обробки зерна вміст МР зменшується так як у видалених… Порівняльний вміст МР в пшеничному борошні в/сорту і борошна із цільнозмеленого зерна (мг/100 г продукту) …Методи визначення мінеральних речовин
Для аналізу МР в основному використовують фізико-хімічні методи – оптичні і електрохімічні.
Для цього слід підготувати правильно зразок шляхом його мінералізації.
Є "суха" мінералізація – це спалювання і прокалювання зразка; "мокра" мінералізація – передбачає обробку зразка концентрованими кислотами сірчаною (H2SO4) i азотною (HNO3).
І Спектральні методи аналізу
1.Фотометричний аналіз
2.Емісійний.
3.Атомно-абсорбційна спектроскопія
ІІ Електрохімічні методи аналізу
1.Іонометрія
2.Полярографія
І Спектральні методи аналізу
Метод оснований на поглинанні молекулами речовини променів в ультрафіолетовій, видимій і інфрачервоних областях електромагнітного спектра. Для цього можна проводити дослідження за допомогою фотоелектроколориметра. При… Спектрофотометрія – основана на вимірюванні поглинання монохроматичного випромінювання в ультрафіолетовій, видимій і…ІІ Електрохімічні методи аналізу
1. Іонометрія служить для визначення іонів K+, Na+, Ca2+, Mn2+, F-, J-, Cl- і ін.
Метод оснований на використанні іон селективних електролітів, мембрана яких прониклива для визначеного типу іонів.
2. Полярографія - метод змінно-струмної полярографії використовують для визначення токсичних елементів (ртуть, кадмій, свинець, мідь, залізо).
Метод базується на вивченні вольтамперних кривих, які одержані при електролізі електроокисних чи електровідновних речовин.
В якості індикаторного електрода в полярографії найчастіше використовують ртутний крапельний електрод.
Питання до самоперевірки
1. Які хімічні елементи відносяться до макроелементів?
2. Яка роль мінеральних речовин в організмі?
3. Які нутрієнти є джерелами кислих та лужних груп у внутрішньому середовищі?
4. Яка роль кальцію, фосфору в організмі людини?
5. Навіщо організму потрібен натрій і калій? Які продукти багаті на ці макроелементи?
6. Які хімічні елементи відносять до мікроелементів і які їх функції в організмі людини?
7. Яку роль відіграє залізо та мідь в організмі людини і в яких харчових продуктах вони містяться?
8. Приведіть приклади взаємодії деяких мікроелементів і вітамінів.
9. Яка роль йоду в організмі людини?
10. Які види технологічної обробки сировини і харчових продуктів призводять до втрат мінеральних речовин?
11. Які методи визначення макро-і мікроелементів Вам відомі?
12. В чому суть методів визначення МР?
Рекомендована література
Основна:
1. с.223 – 244
2. с.663 – 733
3. с.32 - 37
4. с.29 – 34
Додаткова:
1. с.29 – 34
2. с.167 – 197
3. с.150 - 162
Тема 5
Вітаміни
План
1. Терміни, поняття та класифікація вітамінів
2. Фізіологічна роль, потреби та джерела вітамінів
3. Вітаміноподібні сполуки
4. Вплив технологічної обробки на збереженість вітамінів
5. Вітамінізація продуктів харчування
Терміни, поняття та класифікація вітамінів
- забезпечення ферментативного каталізу; - забезпечення нормального обміну речовин, підтримання гомеостазу; - забезпечення біохімічних функцій організму.Фізіологічна роль, потреби та джерела вітамінів
Вітаміноподібні сполуки
Група вітаміноподібних сполук Представники Незамінні харчові речовини з переважно пластичними функціями … Холін – входить до складу фосфоліпідів (фосфотидхоліни).Вплив технологічної обробки на збереження вітамінів
Дотримання правил приготування їжі допомагає краще зберегти в ній вітаміни. В природі вітамін С зустрічається у вигляді a - аскорбінової,… З основами лужних і лужноземельних металів a - аскорбінова кислота утворює добре кристалізовані і розчинні у воді…Вітамінізація продуктів харчування
Результати медичних обстежень свідчать про дефіцит вітамінів у більшої частини населення України. Найбільш ефективний спосіб вітамінної профілактики – збагачення вітамінами… Вітамінізація (іноді в комплексі зі збагаченням мікроелементами) дозволяє підвищити якість харчових продуктів,…Питання до самоперевірки
2. Приведіть класифікацію вітамінів. 3. Яку фізіологічну роль виконують вітаміни в організмі людини? 4. Що таке гіповітаміноз, авітаміноз, гіпервітаміноз?Рекомендована література
Основна:
1. с.246 - 263
2. с.598 – 660
3. с.28 - 32
4. с.22 - 28
Додаткова:
1. с.86 - 106
2. с.13 - 146
3. с.131 - 148
Тема 6
Харчові кислоти
План
1. Загальна характеристика харчових кислот
2. Харчові кислоти та кислотність продуктів
3. Вплив харчових кислот на якість продуктів
4. Регулятори кислотності харчових систем
5. Функції харчових кислот у харчуванні
6. Методи визначення кислот у харчових продуктах
Харчові кислоти (ХК) – це різноманітна за своїми властивостями група речовин органічної і неорганічної природи.
Склад і особливості хімічної будови ХК залежать від специфіки харчової сировини.
Наприклад, кислотність молока і молочних продуктів формується за рахунок молочної кислоти, що утворюється в результаті біохімічних перетворень лактози молока.
До групи органічних харчових кислот відносяться амінокислоти, вищі жирні кислоти.
Загальна характеристика харчових кислот
Рослинна сировина і продукти її переробки є основним джерелом ХК.
Разом з цукрами, ароматичними сполуками вони формують смак і аромат плодів, ягід і продуктів їх переробка.
Харчові кислоти фруктів, ягід і овочів
Найбільш розповсюдженими в складі плодів і ягід є лимона і яблучна кислоти. Цитрусові плоди містять переважно лимонну і невелику кількість яблучної. Вміст останньої в апельсинах складає 10-25%, в мандаринах – до 20%, в грейпфрутах і лимонах – до 5% по відношенню до…С12Н22О11 + Н2О → 4СН3 – СН(ОН) – СООН
Лактоза молочна кислота
Харчові кислоти та кислотність продуктів
Іони водню обумовлюють кислий смак продукту. Активність іонів водню (активна кислотність) характеризується показником рН (від'ємний логарифм концентрації іонів водню).
Значення рН для деяких рідких харчових продуктів
Практично всі харчові кислоти є слабкі і у водних розчинах незначно дисоціюють. До того ж, в харчовій системі можуть знаходитись буферні речовини, в… Прикладом такої системи є молоко.Властивості харчових кислот
Вплив харчових кислот на якість продуктів
У складі комплексу смакоароматичних речовин вони беруть участь у формуванні смаку і аромату, які є основними показниками якості продукту. Саме смак, поряд із запахом і зовнішнім виглядом проявляють більш суттєвий… Зміни смаку і аромату проявляють ознаки початкового псування харчового продукту, або наявності в його складі сторонніх…Регулятори кислотності харчових систем
У цьому випадку ХК використовуються у якості харчових добавок. Узагальнено можна виділити три основні цілі додавання кислот у харчову… - надання необхідних органолептичних властивостей (смаку, кольору, аромату), характерних для конкретного продукту; …Функції харчових кислот у харчуванні
Так, молочна кислота, яблучна та лимонна кислоти мають коефіцієнти енергетичної цінності: 3,6, 2,4, та 2,5 ккал/г відповідно. Але основна функція – участь у процесах травлення. До них відносяться:Методи визначення кислот у харчових
Продуктах
Визначення потенційної кислотності основане на титруванні цих речовин лугом. Для різних харчових продуктів характерні свої особливі умови титрування… Аналіз кислотного складу харчового продукту дає можливість виявити фальсифікацію чи підтвердити натуральність.Питання для самоперевірки
1. Дайте загальну характеристику кислот, що входять до складу харчових продуктів.
2. Наведіть приклади речовин, що використовуються у харчовій промисловості для регулювання рН харчових систем.
3. В яких технологічних функціях проявляється дія органічних кислот у харчових системах?
4. Які особливості органічних кислот, що використовуються у харчових цілях?
5. Приведіть приклади біохімічних змін кислотності харчової системи.
6. Дайте коротку характеристику методів, які дозволяють визначити кислоти у складі продуктів.
7. На які технологічні параметри впливає величина рН?
Рекомендована література
Основна:
1. с.263 – 275
Тема 7
Роль Ферментів та ферментних препаратів у
Харчових технологіях
План
1. Класифікація ферментів, їх властивості
2. Фактори, що впливають на кінетику ферментативних реакцій
3. Основні біохімічні перетворення у харчових технологіях
4. Ферментні препарати, їх характеристика
5. Застосування ферментних препаратів у харчових технологіях
Класифікація ферментів, їх властивості
Ферменти – це біологічні каталізатори білкової природи. Вони значно перевищують швидкість хімічних реакцій. Вступаючи в біохімічні реакції, ферменти не витрачаються і не зазнають незворотних змін.
Ферментативну реакцію можна представити таким рівнянням:
Е + S ÛES → P + E,
де Е – фермент, S – субстрат, ЕS – фермент-субстратний комплекс, Р – продукт реакції.
Ферменти як білкові речовини часто зв’язані з небілковим компонентом – коферментом, який бере участь у дії ферменту. Коферментом можуть бути вітаміни, їх похідні та інші речовини.
Класифікація ферментів
Харчові технології є, по-суті, біотехнологіями, оскільки одними з найбільш важливих процесів є мікробіологічні та біохімічні. Біохімічні процеси, що… Особливіості ферментів порівняно з неорганічними каталізаторами: 1. Вони значно, в 108– 1020, підвищують швидкість реакцій, що каталізуються;Фактори, що впливають на кінетику
Ферментативних реакцій
1. Концентрації субстрату. Максимальна швидкість ферментативної реакції спостерігається при такій концентрації субстрату, коли всі активні центри… 2. Концентрації ферменту. Вона має суттєвий вплив на швидкість ферментативних… 3. Природи субстрату та його атакованості. Атакованістю називають піддатливість субстрату до дії ферменту. Вона…Параметри зони оптимуму дії основних ферментів зернових культур
5.Швидкість ферментативних реакцій залежить від присутності активаторів. Цистеїн, глютатіон, які містять сульфгідрильні групи, є активаторами… Інгібіторами ферментів можуть бути солі важких металів (Pb, Hg та ін.),…Основні біохімічні перетворення у харчових технологіях
У харчових технологіях основну роль відіграють гідролази та оксидоредуктази:
§ гідролази (гідролітичні ферменти) – ліпази, пектинестераза, амілази, b- галактозидаза, b- фруктофуранозидаза, протеїнази, целюлолітичні ферменти;
§ оксидоредуктази: поліфенолоксидаза, ліпоксигеназа, каталаза, пероксидаза.
.
Під час зберігання сировини ферменти беруть участь у:
§ гідролітичних процесах;
§ процесах дихання;
§ автолізі.
Значення гідролітичних процесів у харчових технологіях
Протеолітичні ферменти (протеази) Білки підлягають хімічному (під дією кислот та лугів) та біохімічному… Ферментативний гідроліз білків здійснюється під дією протеаз, ферментів, які каталізують розрив пептидних зв’язків.…Амілази
Ферментативний гідролізкрохмалювідбувається під дією амілолітичних ферментів a- і b-амілази, глюкоамілази та деяких інших.
a-амілаза є ендоамілазою, тобто вона може розривати внутрішньо-молекулярні зв’язки в будь-якому місці. Діючі на крохмалеві зерна, a-амілаза ніби розщеплює зерно, утворює на поверхні канали і бороздки. Клейстеризований крохмаль гідролізується з утворенням низькомолекулярних незабарвлюваних йодом декстринів, які дуже повільно гідролізуються a-амілазою до мальтози і глюкози.
Крохмаль ® a -декстрини + мальтоза + глюкоза
b-амілаза є екзоамілазою, яка відщеплює від амілози і амілопектину мальтозу з нередукуючого кінця, діє лише на a-Д – 1,4 зв’язок. Нативні крохмальні зерна b-амілазою не гідролізуються. Клейстеризований крохмаль гідролізується на 54-58% до мальтози і 42-46% утворює b-декстринів.
Крохмаль ® мальтоза + b декстрини
Глюкоамілаза a–1,4 глюканглюкогідролаза є екзоферментом, який каталізує послідовне відщеплення a-Д –глюкози від нередукеруючого кінця крохмального ланцюга. Особливістю цього ферменту є здатність швидко гідролізувати полімери, але дуже повільно ди-та олігосахара. Останніми роками у технології виробництва патоки поєднують кислотний і ферментативний гідроліз. Ферментативний гідроліз крохмалю має місце під час виготовлення пива та спирту.
Целюлази, пектинази
Пектинестераза гідролізує складноефірні зв’язки в молекулі розчинного пектину, в результаті чого утворюється галактуронова кислота і метиловий… Це призводить до зниження драглеутворюючої здатності пектину і супроводжується… Інвертаза (сахараза, b-фруктофуранозидаза)Ферментативний гідроліз сахарози під дією фермента b-фруктофуранозидази (сахарази) має місце під час приготування тіста, під час виробництва вин: (сахароза гідролізується з утворенням зброджуваних цукрів глюкози і фруктози. Інвертний сироп, який використовується при виробництві безалкогольних напоїв, готують ферментативним способом.
Ліпаза
Гідроліз триацилгліцеринів відбувається під дією ферменту ліпази, при цьому утвоюються гліцерин і жирні кислоти. Реакція гідролізу широко застосовується в техніці для отримання жирних кислот, гліцерину, моно- і диацилгліцеринів. З іншого боку, негативне значення полягає у псуванні та зниженні якості продуктів, що містять ліпіди (жирів, зерна, круп, борошна ).
Глибина та інтенсивність процесу залежить від:
- хімічного складу ліпідів;
- супутніх речовин, що додаються чи утворюються, наприклад, антиоксиданти;
- вологості;
- активності ферментів ліпази;
- присутності мікроорганізмів;
- від контакту з повітрям;
- способу пакування.
На швидкість гідролізу впливає будова і положення ацилів. Зі збільшенням довжини вуглеводневого ланцюга та зі збільшенням ступеня ненасиченості жирних кислот швидкість гідролізу знижується. Швидкість гідролізу моноацилгліцеринів вища, ніж триацилгліцеринів. В присутності кислотних каталізаторів (H 2SO4, сульфокислоти) процес гідролізу протікає при 100оС в надлишку води. У фазі відсутності каталізатора розщеплення відбувається при температурі 220-225оС під тиском 2-2,5 мПа.
Швидкість реакції зростає при збільшенні вологості.
Швидкість і глибина гідролізу олій характеризується кислотним числом.
Оксидоредуктази у харчових технологіях
Фермент поліфенолоксидаза (тирозиназа, фенолаза, катехолаза, О-дифенолоксидаза) каталізує окиснення моно- ди- та поліфенолів. З дією цього ферменту… § бланшування - теплова інактивація ферменту, § додавання інгібіторів (гідросульфіту натрію, сірчистого ангідриду, хлориду натрію,Ферментні препарати, їх характеристика
Ферменти викликають перетворення під час зберігання сировини та під час перебігу технологічних процесів. Ферменти мікроорганізмів мають позитивне… Мікроорганізми також використовуються для отримання ферментних препаратів.… Назва ферментного препарату включає назву основного ферменту та назву продуцента. Так, амілолітичні ферментні…Застосування ферментних препаратів у
Харчових технологіях
Застосування ферментних препаратів у харчових технологіях дає змогу інтенсифікувати технологічні процеси, поліпшувати якість продукції, економити цінну харчову сировину.
Ферментні препарати підбираються у відповідності до мети їх використання, за типом реакції, що каталізується, з урахуванням умов, в яких вони застосовуються, а саме : рН, температури середовища, присутності активаторів та інгібіторів. Крім цього, важливим є оцінка безпечності ферментних препаратів, ступінь очистки, наповнювачі, вартість.
Використання ферментних препаратів у хлібопеченні. Найбільш важливе значення у хлібопекарському виробництві при приготуванні хлібопекарського тіста мають амілолітичні та протеолітичні ферменти. Ферментативний гідроліз вуглеводів і білків забезпечує досягнення реологічних характеристик тіста, накопичення зароджуваних цукрів. Цей процес протікає під дією власних амілолітичних та протеолітичних ферментів борошна, або ферментних препаратів. Ефективність використання ферментних препаратів залежить від якості борошна. Ферментні препарати також використовуються для оцукрення заварок під час приготування рідких дріжджів, активованих дріжджів, заварних сортів хліба.
Як ферментні препарати використовують солод, ферментні препарати амілоризин П10х та амілосубтілін Г10х. Крім амілолітичної активності ці ферментні препарати мають певну протеолітичну активність. Наприклад, амілоризин має АА не< 2000 од./г, ОА не< 150 од./г, протеолітична здатність не> 70 од./г. Протосубтілін – ПЗ не< 70 од./г, АЗ не< 150 од./г. Амілосубтілін має вищу амілолітичну активність (АА не < 3000 од./г), а ПЗ не>2 од./г, але для цього ферментного препарату характерним є більш висока термостабільність a- амілази та обсемінення спорами B.subtilis та B.mesentericus, що може викликати картопляну хворобу хліба.
Використання ферментних препаратів у виробництві крохмалю та крохмалепродуктів.Крохмалево-патокова промисловість випускає широкий асортимент продукції: сухий крохмаль, модифіковані крохмалі (окислені, набухаючі, заміщені), декстрини, різні види крохмальної патоки, глюкозу, глюкозо-фруктозні сиропи. Більшість цих продуктів є продуктами гідролізу крохмалю. Застосовують кислотний, кислотно-ферментативний та ферментативний гідроліз.
Кислотний спосіб дешевший і швидкий, але гідролізати мають невисоку якість, оскільки містять продукти деградації білків, вуглеводів.
При кислотно-ферментативному способі розрідження крохмалю здійснюють за допомогою НCl при рН 1,5 – 2,5 , температурі 146 ° С протягом 5 хв. Потім нейтралізують розчин СаСО3 до рН 6,0 – 6,5 та охолоджують до температури 85° С . Після цього гідроліз проводять з допомогою ФП Амілосубтілін Г10х протягом 30 хв. Осахарювання здійснюють ФП Глюковамарином Г20х , рНопт.= 4,0 –5,5; Tопт = 56 –58 ° С.
При ферментативному способі розрідження крохмалю здійснюють з допомогою ФП Амілосубтілін Г10х при Т = 85 – 90 ° С, рН = 6,3 – 6,5 протягом 1 год.
У разі виробництва глюкозо-фруктозних сиропів використовують ФП глю-коізомеразу, яка каталізує реакцію ізомеризації глюкози до фруктози при рН опт = 7,0 – 8,5, Т опт. = 60 ° С протягом 24 год до утворення 42 % фруктози і 52 % глюкози.
Кондитерське виробництво.Під час приготування кондитерського тіста як правило процес бродіння відсутній, тому використання амілаз не є необхідним. Але для приготування тіста для печива, пряників, необхідно використовувати слабке борошно зі слабкою клейковиною. Для цього доцільно використовувати бактеріальні протеолітичні ферментні препарати. Наприклад, протосубтілін Г10х, який містить супутні амілази. Такі комплексні ферментні препарати не тільки розріджують тісто, але й завдяки накопиченню декстринів сприяють збереженню свіжості виробів.
Під час виготовлення помадних цукерок використовують препарат інвертазу для отримання м’якої консистенції при високих концентраціях цукру. Під час приготування деяких цукеркових мас, які містять молочні інгредієнти, для підсилення смаку, аромату. Використовують фермент ліпазу. Вільні жирні кислоти, які утворюються при цьому, підсилюють аромат виробів.
Застосування ферментних препаратів у технологіях соків, вин, пива, спирту.Використання ФП здійснюється з метою підвищення виходу соків, освітлення і стабілізації вин, соків попередження окислення в соках.
Для підвищення виходу соку, його освітлення застосовують пектолітичні препарати, які гідролізують пектинові речовини. Проте для повногшо освітлення вин необхідний гідроліз і інших колоїдних сполук, тому пектолітичні препарати є комплексними і містять ферменти, що гідролізують білок, целюлозу, геміцелюлозу та інші компоненти. Деякі плодово-ягідні соки і вина важко освітлюються і часто мутніють, тому що містять багато білкових сполук. Білкового помутніння можна уникнути шляхом термічної обробки і обробки адсорбентами. Але в цьому випадку видаляються і деякі інші речовини, які зумовлюють смак і аромат. Тому доцільним є використання протеолітичних ферментних препаратів.
Питання для самоперевірки
2. Які особливості мають ферменти як каталізатори? 3. Як впливають технологічні фактори на кінетику ферментативних реакцій? 4. Які гідролітичні ферменти Ви знаєте? Наведіть приклади.Рекомендована література
Основна
1. с.278 – 344
2. с.305 – 336
3. с.53 - 56
4. с. 141 - 157
Тема 8
Вода
План
1. Вода як складова сировини і харчових продуктів
2. Значення води для життєдіяльності людини
3. Фізичні і хімічні властивості води
4. Методи визначення вологи
Вода як складова сировини і харчових продуктів
Завдяки фізичній взаємодії з білками, полісахаридами, ліпідами і солями вода суттєво впливає на текстуру продуктів. Вміст вологи в харчових продуктах (в%) змінюється в широких межах: М'ясо – 65-75; молоко – 87; фрукти і овочі – 70-95; хліб 35-40; мед – 20; масло, маргарин – 16-18; борошно – 12-14;…Значення води для життєдіяльності людини
Тіло людини на 50-70% складається з води. Кількість води в організмі людини залежить від віку і складу тіла, особливо від співвідношення м’язової та… В молодому віці переважає м’язова тканина, що і обумовлює більший вміст води в… Вода потрібна людині як середовище – розчинник для виконання різних функцій:Фізичні і хімічні властивості води
Температура замерзання (плавлення) води - 0°С, кипіння - 100°С. При замерзанні вода розширюється, внаслідок чого щільність льоду нижча, ніж води… Теплопровідність води вища, ніж інших рідин, а льоду більша, ніж інших… У зв’язку з цим доречно розглянути діаграму стану води.Діаграма стану води в області невисокого тиску
Крива ОА – характеризує залежність насиченої водяної пари від температури: точки кривої показують ті пари значень Т і Р, при яких рідка вода і… Крива ОА називається кривою рівноваги рідина – пара або кривою кипіння. Крива ОС – крива рівноваги твердий стан – рідина, або крива плавлення, показує ті пари значень при яких лід і рідка…Активність води (aw) у харчових продуктах
Роль льоду у зберіганні харчових продуктів
При цьому необхідний ефект досягається не за рахунок утворення льоду, а за рахунок впливу низьких температур. Утворення льоду у клітинних структурах харчових продуктів і гелях має два… Під час заморожування вода переходить у кристали льоду. Тому всі неводні компоненти концентруються у зменшеній…Методи визначення вологи
Визначення загального вмісту вологи
Висушування до постійної маси. Вміст вологи розраховують за різницею маси зразка до і після висушування у сушильній шафі при температурі 100-105°С. Це стандартний метод визначення вологи. Цей метод точний, але потребує багато часу для проведення аналізу.
Визначення вільної і зв’язаної вологи
Термогравіметричний метод оснований на визначенні швидкості висушування. В контролюємих умовах межа між областю постійної швидкості висушування і областю, де ця швидкість знижується, характеризує зв’язану вологу.
Диференційна скануюча калориметрія.
Якщо зразок охолодити до 0°С, то вільна волога замерзає, зв’язана – ні. При нагріванні замороженого зразка в калориметрі можна виміряти тепло, що витрачається при таненні льоду. Незамерзаюча вода визначається як різниця між загальною і замерзаючою водою.
Ядерно-магнітний резонанс (ЯМР). Суть методу полягає у вивченні рухомості води в нерухомій матриці. При наявності вільної і зв’язаної вологи одержують дві лінії в спектрі ЯМР замість одної для об'ємної води.
Питання для самоперевірки
1. Наведіть приклади взаємозв’язку вологовмісту у сировині і її текстури.
2. Яку роль виконує вода в організмі людини?
3. Яке значення має діаграма стану води? Як нею користуватися?
4. Які функції виконує вода у харчових продуктах?
5. Що таке вільна і зв’язана волога?
6. Які форми зв'язку вологи з сировиною Вам відомі? Охарактеризуйте їх.
7. Що таке активність води?
8. Як поділяють харчові продукти в залежності від велечини активності води?
9. Яка роль льоду у стабільності якості харчових продуктів?
10. Завдяки використанню яких технологічних прийомів можна впливати на величину активності води?
11. Яке значення має активність води для стабільності харчових продуктів?
12. Як впливає активність води на мікробіологічне псування?
13. Які методи визначення загальної вологи, вільної і зв’язаної вологи в харчових продуктах Вам відомі? Охарактеризуйте їх.
Рекомендована література
Основна:
1. с.461 - 470
Тема 9
Харчові добавки
План
1. Терміни і визначення
2. Класифікація харчових добавок (ХД)
3. Характеристика основних груп ХД:
- харчові барвники;
- замінники цукру;
- підсолоджувачі;
ХД – використовуються людством на протязі тисячоріч. Як тільки людина почала займатися землеробством і тваринництвом, виникла необхідність здійснювати запаси їжі і турбуватися про її збереженість. Так було відкрито консервуючу дію солі, диму, холоду, оцту. Останній, як передбачають, одержано випадково із промислового вина.
У ХІV віці у Європі почали використовувати селітру для соління м’яса, риби та іншої сировини.
З часом проблеми збереження харчових продуктів загострювались. Для їх вирішення в продукти харчування стали додавати різні речовини хімічної і біологічної природи, які перешкоджали розвитку мікроорганізмів.
ХХ сторіччя характеризується бурним розвитком цієї галузі.
Використання ХД стало виходити за межі домашньої кухні в область промислового виготовлення продуктів. При цьому виділяються слідуючі основні напрями:
- подовження термінів зберігання продукту;
- покращення технологічних властивостей;
- забезпечення високих технологічних якостей продуктів.
Тому виробництво ХД перетворюється в окрему велику групу товарної продукції. На сьогодні світова індустрія ХД характеризується фундаментальним рівнем наукових розробок. Активно розвивається вітчизняний ринок ХД.
Все це свідчить про необхідність аналізу і узагальнення нових відомостей і матеріалів по ХД.
Терміни і визначення
У нас прийнято слідуюче визначення, яке не протирічить визначенню ВООЗ. ХД– природні чи штучні речовини і їх сполуки, спеціально додані у харчові… До ХД не відносяться сполуки які підвищують харчову цінність чи фармокологічну спрямованість продуктів харчування,…Класифікація харчових добавок
Згідно до запропонованої цифрової кодифікації ХД, їх класифікація виглядає так: Е 100 – 182 – барвники, Е 200 і далі – консерванти,Загальні підходи до підбору харчових добавок
З метою ефективного використання ХД пропонується схема її підбору яка враховує особливості хімічної будови, функціональних властивостей і характеру дії ХД, виду продукту, особливостей сировини, складу харчової системи, технології одержання готового продукту, типу устаткування специфіки упаковки і зберігання.
Схема розробки технології підбору і використання ХД
| Перший рівень | 
| Характеристика харчових добавок | Склад основної речовини. Основні якісні показники. Розчинність, толерантність, термостабільність. | |
| ||||
| Другий рівень | 
| Характеристика функціональних властивостей | Основні функціональні властивості. Технологічні властивості. Побічні властивості. Стійкість (t, рН середовища, ферменти). | |
| ||||
| Третій рівень | 
| Визначення напрямів використання | Вид продуктів. Особливості застосування сировини. Технологія отримання. | |
| ||||
| Четвертий рівень | 
| Особливості складу і властивостей харчових систем | Склад, фізико-хімічні властивості. Принцип дії добавки. Можливі види взаємозв'язку з іншими компонентами, роль добавки в харчовій системі. | |
| ||||
| П'ятий рівень | 
| Розробка технології застосування харчових добавок | Вибір етапу внесення. Визначення оптимальної концентрації. Найменший рівень концентрації. Технологічні параметри. | |
| ||||
| Шостий рівень | 
| Оцінка ефективності додавання | Характеристика харчових продуктів. Порівняльна оцінка технологічного рішення (без добавки; з добавкою). Економічна оцінка. | |

| ||||
| Сьомий рівень | 
| Аналіз медико-біологічної безпеки | Склад добавки в готовому продукті. Продукти . Допустимий рівень добового надходження. Можливість фактичного надходження. Система контролю. | |
| ||||
 Восьмий рівень Восьмий рівень
| Сертифікація харчових добавок і продукту з її вмістом | Нормативно-технологічні документи. Особливості сертифікації харчової добавки, продукту з її вмістом |
Схема враховує всі етапи розробки технології підбору і використання ХД. Вона може бути спрощена при використанні відомих, добре вивчених ХД. Але у кожному випадку слід враховувати особливості харчових систем в які добавка вноситься, правильно визначити етап і спосіб її внесення оцінити ефективність її використання.
ХД повинні вноситись у харчові продукти у мінімально необхідній для досягнення технологічного ефекту кількості, але не більше установлених санітарних правил.
Є ХД які заборонені до використання у технологіях харчових продуктів:
барвники:
Цитрусовий червоний Е 121,
Амарант Е123і,
Еритрозин Е127,
Коричневий Е154,
Консервант: Формальдегід Е 240а
Поліпшувач борошна і хліба: Бромат калію Е 940а, бромат кальцію Е 940б
Характеристика основних груп ХД
Барвники можуть бути жиро-і водорозчинними, а також пігментами – нерозчинними ні у воді, ні у жирі. Найбільш широко харчові барвники використовують… Харчові барвники (ХБ) Натуральні (природні) барвники (НБ)Склад деяких сумішей барвників
Суміші барвників використовують для одержання кольорів і відтінків які можна приготувати за допомогою індивідуальних барвників. Як індивідуальні, так і суміші барвників можуть виготовлятись з наповнювачами…Замінники цукру
Цукрозамінники надають харчовим продуктам солодкого смаку та виконують інші технологічні функції цукру. За силою солодкості цукрозамінники не дуже… За останні десятиріччя відбувається інтенсивне зростання виробництва… В світі виробляється 130 млн т цукру, а загальне виробництво замінників цукру складає 15-20 млн т до цукрового…Класифікація солодких речовин
Якщо у сиропі 42 % фруктози це звичайний ГФС, при підвищеному вмісту фруктози до 55- 60% - збагачений ГФС (сироп 2-го покоління), а високофруктозний… У зв’язку з тим, що такий сироп солодший за цукор, за кордоном він поступово… ГФС можна замінити біля 20% цукру в кондитерській промисловості, у виробництві морозива біля 50%, при виробництві…Ксиліт Е967
Білий кристалічний порошок, без запаху, з солодким смаком, визиває відчуття холоду на язику. Т°пл. 93-94, t°кіп. - 2150С, стійкий до кислот і… Природнє джерело ксиліта: міститься в овочах і фруктах до 1% СР, в ксилані… Березову деревину розкладають кислотою до Д-ксилози. Після очистки останню відновлюють до ксиліта. Ксиліт тому і…Сорбіт Е420
Емпірична формула С6Н14О6, м.м. 182,17. Це білий кристалічний порошок, без запаху, гігроскопічний, солодкий на смак, холодить язик, солодкість… Т°пл – 960С, наслідком від’ємної теплоти розчинення є "холодящий"… Природнім джерелом для одержання сорбіту є ягоди горобини та плоди сімейства розовоквіткових.D – маніт Е421
Це білі негідроскопічні кристали без запаху, солодкі на смак, в 2 рази менша солодкість, ніж сахарози. D –маніт має незначну оптичну активність, добре розчинний в гарячій воді,… Джерело (природнє) – основний компонент-манани застиглого ексудата ясеня і платана (30-50) і 80-90% відповідно),…Мальтіт і мальтітний сироп Е965
Синоніми: гідрирувана мальтоза, мальтітол
Емпірична формула: С12Н24О11 м.м. 344.31
Це білий кристалічний порошок без запаху, з солодким смаком; 0,8 солодкості цукрози.
Температура плавлення 148-1510С, стійкий до гідролізу, добре розчиняється у воді, середньо – у спирті, не розчиняється в жирі.
Одержують каталітичним гідрирувуванням мальтози або високомальтозних сиропів.
Мальтіт не повністю гідролізується в тонкому кишечнику до глюкози, сорбіта та маніта. Мікрофлора товстої кишки розкладає залишок на коротколанцюгові жирні кислоти які всмоктуються і засвоюються.
Мальтіт не визиває карієсу і має незначні обмеження для хворих діабетом. Добове вживання більше 90 г може визвати пронос.
Ізомальтіт Е953
Це білі кристали без запаху з солодким смаком Т°пл 145-1500С, відносно стійкий до гідролізу, гігроскопічний, добре… Одержують ферментативною ізомеризацією цукрози в ізомальтозу (палатінозу) яку потім піддають каталітичному…Моносахариди
Калорійність така як цукрози. Може вживатись діабетиками в дозах 0.5 – 1г на 1 кг маси тіла. Популярна серед спортсменів, водіїв авто. Втрати… Світове виробництво фруктози складає біля 150 тис. т на рік. Використовується… Фруктоза дуже гігроскопічна, тому до пакувального матеріалу підвищені вимоги (як для зберігання самої фруктози так і…Дісахариди
Одержують лактозу із молочної сировини, коефіцієнт солодкості 0.16. Використовують при виробництві продуктів дитячого харчування, діабетичних… Гідролізовані розчини лактози використовують в кондитерській промисловості, при виробництві морозива можна замінити до…Підсолоджувачі
Переваги при використанні.Інтенсивні підсолоджувачі вважаються достойною альтернативою традиційним цукровим речовинам у виробництві харчових… - здешевлюється і спрощується технологія виробництва (… - в десятки разів знижується калорійність продуктів;Натуральні підсолоджувачі
Стевіозид Е960
Емпірична формула: С38Н60О18, м.м. 804.9
Це білий кристалічний порошок, гігроскопічний, без запаху, з сильним солодким смаком, приблизно в 100-350 разів солодший за цукор.
Т°пл 196-1980С, розчинний в холодній воді, не розчинний в гарячій.
Джерело одержання: листя рослин Sevia rebaudiana Bertoni. Батьківщина: Південна Америка. Культивується в Японії, Китаї, Кореї, Вьєтнамі, Італії, Росії, Україні.
Одержують стевіозид із очищеного соку рослини стевії, зокрема вільний стевіол і ребаудіозид теж є підсолоджувачами.
Заключної оцінки з досліджень нешкідливості стевіозида поки що немає.
ДДП – відсутні.
Використовують як чистий стевіозид, так і листя стевії (зелений чай).
Стевіозид використовують у хлібопекарській та кондитерській промисловості.
Монелін
Одержують із ягід тропічної рослини, що росте у Західній Африці і за зовнішнім виглядом нагадує виноградну лозу.
Складається з 2х зв’язаних між собою нековалентним зв’язком структурних одиниць по 44 і 50 амінокислотних залишків.
Монелін не схожий на тауматін. М.м. 10700, коефіцієнт солодкості 1500-3000
Монелін легко розкладається, як білок. ДДП – відсутні.
Стабільний у середовищах з рН 2,0-9,0, нетоксичний, але його термічна нестійкість (при 55-650С солодкість втрачається) і труднощі виділення призводять до маловірогідного промислового використання.
Гліциризин Е958
Синоніми: гліциризинова кислота, глікозид гліциризинової кислоти, екстракт солодкового (лакричного) кореня.
Емпірична формула: С42Н62О16, м.м. 823
Це кристали без кольору з добре вираженим смаком лакриці, в 50 разів солодший за цукрозу. Екстракт солодкового кореня – це густа однорідна маса темно-коричневого кольору зі слабким приторно-солодкого запахом.
Добре розчиняється у гарячій воді, спиртах, середня розчинність в холодній воді.
Гліциризин є у соку лакричних рослин: солодки голої, солодки уральської.
Некарієсогенний, рекомендований для діабетиків; сильний присмак лакриці обмежує використання. Посилює смак і аромат. Як піноутворювач використовується при виробництві халви, карамелі, для виробництва табаку (аромат), для ліків.
Неогесперидин дігідрохалкон Е959
Емпірична формула: С28Н36О15, м.м. 612.58 Це білий порошок, без запаху з дуже сильним солодким смаком, приблизно в… Одержують із нарінгіна, гіркої речовини кожури грейфрутів.Міракулін
Глікопротеїд ягід тропічного чагарника, що росте в Західній Африці. Екстракт цих ягід (червоний колір) сприяє тому, що язик через декілька хвилин після вживання сприймає кислоти (чи кислі харчові продукти), як "солодкі". Ця дія триває декілька годин.
Міракулін таким чином ближче до модифікатора смаку, ніж до підсолоджувача. Сам екстракт смаку не має.
Нестійкий до нагрівання, м.м. біля 40.000
В організмі повністю розкладається як білок, ДДП відсутня; стійкий до рН 3-12.
В США заборонено використання в харчовій промисловості концентратів міракуліна і продуктів на його основі.
Тауматіт Е 957
Посилювач смаку і аромату.
Тауматіт - це поліпептид що складається з 207 залишків амінокислот.
Це кремовий порошок без запаху, з сильним солодким смаком в декілька сотень разів солодший за цукор, який з’являється не зразу, але зберігається досить довго. Присутній лакричний присмак; в 1600 разів солодший за цукрозу; 0,9г тауматіна замінює 1,5 кг цукру.
Добре розчиняється у воді, не розчиняється в жирі.
Одержують із зрілих плодів африканського чагарника катемфе шляхом екстрагуванням водою.
Розкладається як білок, побічної дії не виявлено.
ДДП не встановлена. Використовується в США, Росії, Австралії, Японії, Канаді, в країнах ЄС для підсолоджування кондитерських виробів, сухофруктів, морозива, жувальної гумки.
Синтетичні підсолоджувачі
Сахарин Е954
Це білий кристалічний порошок без запаху, з інтенсивним солодким смаком (приблизно в 550-350 разів солодший за цукрозу) з гірко-металевим… Т°пл – 229-229,70С. Термостійкий, та стійкий до гідролізу; при тривалому… Сахарин швидко всмоктується та виводиться із організму людини через нирки в незмінному вигляді.Аспартам Е951
Емпірична формула: С14Н18N2O5, м.м. 294,3 Це білий, слабо гігроскопічний кристалічний порошок без запаху з інтенсивним… Не зовсім стабільний до гідролізу, особливо при нагріванні; Тпл 246-2470С, розкладається при 1960С. Легко розчиняється…Цикламати Е952
Еміпрична формула: 1)C6H13NO3S цикламова кислота; 2)C6H12NO3SNa∙2H2O цикламат натрію;Ацесульфам калія Е950
Емпірична формула: С4Н4KNO4S, м.м. 201,24 Це білий кристалічний порошок без запаху з інтенсивним солодким смаком,… Т°пл – 2250С з розкладанням. Легко розчиняється у воді, середня розчинність у спирті.Сукралоза Е955
Емпірична формула: С12H19O8Cl3, м.м. 397.64 Це білі кристали без запаху з інтенсивним солодким смаком, приблизно в 600… Т°пл 1300С, стійка до нагрівання і гідролізу; добре розчинна у воді, спиртах; не розчиняється в жирних розчинниках. …Алітам Е 956
Емпірична формула: С14Н25N3О4S∙2,5Н2О, м.м. 376,52 Це білий кристалічний порошок без запаху з дуже солодким смаком приблизно в… Достатньо розчиний у воді і спирті, помірно в жирах. Може піддаватися гідролізу з втратою солодкого смаку під дією…Питання до самоперевірки
2. На які групи поділяються харчові добавки? 3. Розкрийте поняття "технологічні добавки". 4. Охарактеризуйте схему підбору і використання харчової добавки?Рекомендована література
Основна:
1. с. 349 – 456
3. с.83 - 89
Тема 10
Основи раціонального харчування
План
1. Фізіологічні аспекти хімії харчових речовин
2. Схеми процесів перетравлювання макронутрієнтів
3. Теорії і концепції харчування
4. Принципи раціонального харчування
Нормальне функціонування організму людини визначається трьома основними факторами до яких відносять вживання їжі, води і наявність кисню.
Сукупність процесів, пов’язаних із вживанням і засвоюванням в організмі речовин, що входять до складу їжі, називається харчуванням.
Харчування включає послідовні процеси поступання, перетравлення, всмоктування і засвоювання в організмі харчових речовин, необхідних для покриття його енерговитрат, побудові і поновлення клітин і тканин тіла і регуляції функцій організму.
Фізіологічні аспекти хімії харчових речовин
а) продовольча сировина; б) харчові добавки; в) біологічно-активні добавки.Схеми процесів переварювання макронутрієнтів
1.Перетравлювання вуглеводів. Людина перетравлює полісахариди: крохмаль, що міститься в рослинній їжі і глікоген, що міститься в їжі тваринного… Обидва полісахариди повністю розкладаються ферментами ШКТ до глюкози. Процес починається у роті під дією амілази слюни…Теорії і концепції харчування
1. При ідеальному харчуванні надходження речовин точно відповідає їх втратам. 2. Надходження харчових речовин забезпечується шляхом руйнації харчових… 3. Енергетичні витрати організму повинні бути збалансовані з поступанням енергії.Принципи раціонального харчування
Перший принцип раціонального харчування
Частка енергії, яка може вивільнитися із макронутрієнтів у ході біологічного окислення, характеризує енергетичну цінність (калорійність) продукту. … Кількість тепла, що виділяється, розраховують виходячи з того, що для нагріву… Енергетична цінність 100г продукту виходячи із його складу і теплоти спалювання окремих компонентів, може бути…Коефіцієнти енергетичної цінності макронутрієнтів
За енергетичною цінністю (калорійністю) харчові продукти діляться на 4… 1. Особливо високо енергетичні: шоколад, жири, халва – 400-900Основні групи інтенсивності праці
Отже, для забезпечення нормальної життєдіяльності людини необхідно створити умови відносної рівноваги між енергією, яку людина витрачає, і енергією,… Розрахунки показують, що при тривалому щоденному перевищенні калорійності їжі…Другий принцип раціонального харчування
4/5 населення земної кулі харчується в основному рослинною їжею, в якій на долю вуглеводів приходиться 70, а іноді 90% сумарної калорійності. У розвинутих країнах, де населення споживає у порівняно великих кількостях… У відповідності з основами раціонального харчування, добова потреба організму людини у вуглеводах складає 400-500г, що…Добова потреба у білках 85-90г. Показник якості харчового білка, що відображає ступінь відповідності його амінокислотного складу потребам організму в амінокислотах для синтезу білка, має назву біологічна цінність.
Самими повноцінними є білки тваринного походження, поскільки вони містять незамінні амінокислоти у кількості, наближеній до ідеального білка.
Для нормального харчування кількість незамінних амінокислот повинна складати 36-40%, що забезпечується при співвідношенні білків рослинних і тваринних, як 45:55%.
4.3. Третій принцип раціонального харчування.
Згідно до третього принципу раціонального харчування, принциповим для нормального функціонування організму є не тільки які продукти харчування і в якій кількості вживає людина, але і те як і коли відбувається це вживання.
В основу третього принципу раціонального харчуванн6я закладено чотири основних правила:
- регулярність харчування;
- дробність харчування на протязі доби, яка повинна складати не менше 3-4 разів на день;
- раціональний підбір продуктів при кожному прийомі;
- оптимальне розподілення їжі на протязі дня, при якому вечеря не повинна перевищувати третини денного раціону.
Рекомендований режим харчування наведено нижче.
Добовий розподіл харчового раціону (в%)
| Режим харчування | 1-й сніданок | 2-й сніданок | Обід | Вечеря |
| 4-и разове харчування | 20-30 | 15-20 | 15-20 | 15-20 |
| З-и разове харчування | - | 45-50 | 20-25 | |
| Харчування при малій обідній перерві і в літні місяці в жаркому кліматі | - | |||
| Харчування при роботі у нічну зміну | - | 40-45 | 25-35 |
Регулярність харчування пов’язана з дотриманням часу приймання їжі, при якому у людини формується рефлекс виділення харчотравних соків, що забезпечує нормальне харчотравлення і засвоєння їжі.
Дробність харчування забезпечує рівномірне навантаження на харчотравильний апарат і створює умови для своєчасного забезпечення організму необхідною енергією і поживними речовинами.
Продукти, що містять білки тваринного походження, раціональніше вживати у першій половині дня, а молочну і рослинну їжу – у другій.
Оптимальний розподіл їжі на протязі дня диференціюється в залежності від віку, характеру фізичної активності, розпорядку дня.
Для людей середнього віку найбільш раціональним прийнято чотириразове харчування; для похилих людей – п’ятиразове з проміжками між прийомами в 4-5 год. Менш раціональним вважається триразове харчування, при якому збільшується об’єм спожитої їжі і навантаження на харчотравильний апарат.
Офіційна статистика свідчить про тенденцію до збільшення числа прийомів їжі на протязі дня. Наприклад, у французів кількість денних прийомів їжі виросло сьогодні до 6, а у деяких американців до 20.
Ці тенденції спричинили зміни в упаковці продуктів: збільшилась чисельність мілкої упаковки, з’явилась продукція придатна до вживання, що дає можливості «переїсти» в любий час в любому місці.
Питання для самоперевірки
2. Що таке макро-і мікронутрієнти? 3. Як перетравлюються вуглеводи, білки та жири? 4. В чому полягає суть теорії збалансованого харчування?Рекомендована література
Основна
1. с.560 – 597
Додаткова
1. с. 119 – 139
4. с. 200 – 217; с.244 – 248
ЗМІСТ
| Вступ………………………………………………………………………… | |
| Список рекомендованої літератури | |
| Тема 1. Білки. Будова, властивості, перетворення у харчових процесах…………………………………………………………. | |
| Будова білків, властивості, класифікація…………………………………… | |
| Функціональні властивості білків…………………………………………… | |
| Перетворення білків у харчових технологіях………………………………. | |
| Значення білків у життєдіяльності людини………………………………… | |
| Методи визначення білків…………………………………………………… | |
| Тема 2. Вуглеводи. Будова, властивості, перетворення в харчових технологіях…………………………………………….. | |
| Будова вуглеводів, класифікація, властивості……………………………… | |
| Перетворення вуглеводів при виробництві харчових продуктів………….. | |
| Функціональні властивості вуглеводів……………………………………… | |
| Роль вуглеводів в організмі людини………………………………………… | |
| Тема 3. Ліпіди. Будова, властивості, їх перетворення в харчових технологіях……………………………………………….. | |
| Будова та класифікація ліпідів, склад сирого жиру………………………... | |
| Основні реакції ліпідів……………………………………………………….. | |
| Перетворення ліпідів у технологіях харчових продуктів………………….. | |
| Біологічна цінність харчових ліпідів………………………………………... | |
| Роль ліпідів в організмі людини……………………………………………... | |
| Тема 4. Мінеральні речовини (МР)………………………………… | |
| Роль мінеральних речовин в організмі людини……………………………. | |
| Класифікація та характеристика окремих макро - і мікроелементів……… | |
| Вплив технологічної обробки харчових продуктів на їх мінеральний склад…………………………………………………………………………… | |
| Методи визначення мінеральних речовин………………………………….. | |
| Тема 5. Вітаміни…………………………………………………………. | |
| Терміни, поняття та класифікація вітамінів………………………………… | |
| Фізіологічна роль, потреби та джерела вітамінів…………………………... | |
| Вітаміноподібні сполуки…………………………………………………….. | |
| Вплив технологічної обробки на збереженість вітамінів………………….. | |
| Вітамінізація продуктів харчування………………………………………… | |
| Тема 6. Харчові кислоти……………………………………………... | |
| Загальна характеристика харчових кислот…………………………………. | |
| Харчові кислоти та кислотність продуктів…………………………………. | |
| Вплив харчових кислот на якість продуктів………………………………... | |
| Регулятори кислотності харчових систем…………………………………... | |
| Функції харчових кислот у харчуванні……………………………………... | |
| Методи визначення кислот в харчових продуктах………………………… | |
| Теми 7. роль Ферментів та ферментних препаратів у харчових технологіях………………………………………………. | |
| Класифікація ферментів, їх властивості …………………………………… | |
| Фактори, що впливають на кінетику ферментативних реакцій…………… | |
| Основні біохімічні перетворення у харчових технологіях………………… | |
| Ферментні препарати, їх характеристика. Продуценти……………………. | |
| Застосування ферментних препаратів у технології хліба……………………. | |
| Тема 8. Вода……………………………………………………………….. | |
| Вода як складова сировини і харчових продуктів………………………….. | |
| Значення води для життєдіяльності людини……………………………….. | |
| Фізичні і хімічні властивості води…………………………………………... | |
| Методи визначення вологи………………………………………………….. | |
| Тема 9. Харчові добавки……………………………………………... | |
| Терміни і визначення………………………………………………………… | |
| Класифікація харчових добавок (ХД)………………………………………. | |
| Характеристика основних груп ХД…………………………………………. | |
| Тема 10. Основи раціонального харчування……………….. | |
| Фізіологічні аспекти хімії харчових речовин………………………………. | |
| Схеми процесів перетравлювання макронутрієнтів……………………….. | |
| Теорії і концепції харчування……………………………………………….. | |
| Принципи раціонального харчування………………………………………. |
Навчальне видання
В.Ф. Доценко
Харчова хімія
Конспект лекцій
Для студентів спеціальності 6.140101
«готельно-ресторанна справа»
Денної форми навчання
Видання подається в авторській редакції
– Конец работы –
Используемые теги: харчова, ХІМІЯ, Конспект, лекцій0.074
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Харчова хімія Конспект лекцій
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов