рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Ядерная техника
- /
- Мета і завдання дисципліни, її місце у навчальному процесі
Реферат Курсовая Конспект
Мета і завдання дисципліни, її місце у навчальному процесі
Мета і завдання дисципліни, її місце у навчальному процесі - раздел Ядерная техника, Передмова Вивчення Дисципліни «Фізика» Для Спеціальн...
ПЕРЕДМОВА
Вивчення дисципліни «Фізика» для спеціальності “Обладнання харчових та переробних виробництв” в університеті економіки і торгівлі відбувається протягом трьох семестрів на денному, та двох семестрів на заочному відділенні. При цьому аудиторні заняття передбачають лекційні та лабораторні заняття. Практичні ж заняття не передбачені взагалі. Впровадження кредитно-модульної системи організації навчального процесу приводить до змін у навчальних робочих планах вивчення дисципліни. За останні роки аудиторне навчальне навантаження на студентів невпинно зменшується, що веде до зростання ролі їхньої самостійної роботи. Тому видання цього методичного посібника допоможе самостійно опановувати курс загальної фізики як студентам інженерних спеціальностей денної, так і заочної форми навчання. Цей посібник може бути застосований як при тестуванні студентів при проведенні модульного або ректорського контролю знань, так і для підготовки до виконання лабораторних робіт та їх захисту, а також для контролю та самоконтролю знань у вигляді контрольних робіт.
Мета і завдання дисципліни, її місце у навчальному процесі
Дисципліна «фізика» разом із курсами вищої математики, хімії та інформатики складають основу теоретичної підготовки фахівців інженерного профілю… Внаслідок вивчення дисципліни «Фізика» студенти повинні знати: · основні фізичні величини, одиниці їх вимірювань, основи теорії похибок та правила оброблення результатів…Моделі будови атома Томсона і Резерфорда. Досліди Резерфорда. Лінійчатий характер спектру випромінювання атома водню. Серіальні закономірності спектральних ліній: серії Лаймана, Бальмера, Пашена, Брекета, Пфунда. Узагальнена формула Бальмера. Постулати Бора. Досліди Франка та Герца. Будова атома водню та воднеподібних атомів за Бором: квантування радіусів електронних орбіт та енергії атома. Пояснення серіальних закономірностей спектрів воднеподібних атомів. Загальна кількість можливих спектральних ліній у спектрі. Потенціали збудження та іонізації.
Розділ 6.2. Елементи квантової механіки.
Хвильові властивості речовини. Гіпотеза і формула де Бройля. Співвідно-шення невизначеностей Гейзенберга. Хвильова функція та її статистичний зміст. Загальне хвильове рівняння Шредінгера. Рівняння Шредінгера для стаціонарних станів. Частинка у одновимірній потенціальній ямі. Власні хвильові функції та власні значення енергії. Тунельний ефект. Квантовий гармонічний осцилятор.
Атом водню у квантовій механіці. Квантування енергії, моменту імпульсу електрона та його проекції. Квантові числа: головне, орбітальне, магнітне. Орбітальне гіромагнітне відношення електрона. Магнетон Бора. Досліди Штерна і Герлаха. Спін електрона. Спінове квантове число. Квантування спінового магнітного моменту електрона та його проекції. Спінове гіромагнітне відношення електрона. Кратність виродження енергетичних рівнів електрона в атомі без урахування спіна і з урахуванням його.
Принцип нерозрізненості тотожних частинок. Ферміони та бозони. Статистики Фермі-Дірака та Бозе-Ейнштейна. Принцип Паулі. Розподіл електронів за станами у атомі.Систематика заповнення електронних станів (оболонок та шарів) у атомах. Періодична система елементів Менделєєва.
Розділ 6.3. Ядерна фізика.
Розміри, склад і заряд атомних ядер. Нуклони. Масове і зарядове число. Ізотопи хімічних елементів. Особливості ядерних сил. Дефект маси та енергія зв’язку ядра. Питома енергія зв’язку ядра. Явище природної радіоактивності. Види радіоактивного випромінювання та їхні закономірності. Закон радіоактивного розпаду. Стала розпаду, період піврозпаду ізотопу. Активність радіоактивного ізотопу та середній час його життя. Правила зміщення для a-, b- та g-випроміню-вання. Нейтрино і антинейтрино. Людина і радіація. Методи спостереження та реєстрації радіоактивних випромінювань і частинок.
Ядерні реакції та їхні основні типи. Екзотермічні і ендотермічні ядерні реакції. Ядерні реакції під дією нейтронів. Коефіцієнт розмноження нейтронів. Ланцюгова реакція поділу. Реакції синтезу легких атомних ядер. Проблеми керованих термоядерних реакцій. Ядерні реактори. Класифікація і властивості елементарних частинок. Основні типи фундаментальних взаємодій.
ЗАГАЛЬНІ ВКАЗІВКИ ДО ВИВЧЕННЯ ДИСЦИПЛІНИ
Курс «Фізика» складається із курсу лекцій, курсу лабораторних робіт, засобів модульного контролю, консультативних занять та іспиту.
Курс лекцій, у якому розглядаються основні теоретичні положення, передбачає допомогу студентам для засвоєння теоретичного матеріалу з усіх розділів фізики, що винесені на вивчення програмою.
Лабораторний практикум передбачає засвоєння та практичне виконання лабораторних робіт за окремими темами курсу, навчання студентів користуватись приладами та лабораторним обладнанням, робити вимірювання, спостерігати процеси, що відбуваються під час проведення дослідів, аналізувати та узагальнювати одержані результати, робити висновки щодо виконаних дослідів. Кожна лабораторна робота вимагає попередньої підготовки, яка складається з конспектування теоретичного матеріалу за темою роботи, а також методичної частини її виконання. Під час виконання лабораторних робіт експериментальні результати вимірювань та спостережень потрібно занести у зошит. Результати виконання лабораторної роботи підлягають обробці, оцінюванню похибки вимірів, а на наступному занятті кожний студент, зробивши висновки щодо результатів роботи, здає її викладачу, отримуючи при цьому залікові бали.
Модульний контроль є важливою складовою частиною самостійної роботи студентів денної форми навчання, оскільки допомагають засвоєнню основ теорії, практичного використання цих знань при розв'язанні задач із даного розділу. На проведення модульного контролю виділена певна кількість навчального часу при завершенні вивчення окремого розділу. Студенти-заочники отримують індивідуальне завдання для семестрової письмової контрольної роботи, яка повинна бути ретельно виконана і оформлена у окремому зошиті. Зарахування цієї контрольної роботи є необхідною умовою допуску до семестрового іспиту або заліку. Варіанти завдань наведені в таблиці для кожної контрольної роботи окремо. Вони визначаються за останніми цифрами шифру у заліковій книжці студента.
Консультаційні заняття проводяться потижнево і призначені для додаткового спілкування студентів з викладачем, де студенти можуть отримати консультацію з теоретичних питань або методу вирішення задачі, виконати пропущену лабораторну роботу або захистити її результати, підвищити результати свого модульного контролю.
Вказівки до самостійної роботи
Вивчати курс фізики потрібно систематично протягом усього навчального року. Вивчення фізики в стислий термін перед іспитом не дає змоги отримати глибокі та тверді знання. За своєчасного захисту лабораторних робіт та успішного написання модульного контролю, студент має змогу протягом навчального семестру заробити до 40% своєї екзаменаційної оцінки.
1. При вивченні курсу фізики доцільно користуватись конспектом лекцій та рекомендованими підручниками. При розв'язуванні задач - Міжнародною системою одиниць (СІ).
2. Студентам заочної форми навчання необхідно прослухати курс лекцій з фізики та користуватися очними консультаціями викладачів.
Вказівки щодо розв'язування задач
1. При оформленні розв'язаної задачі вказувати основні закони та формули, на яких базується розв'язок та давати письмове обґрунтування цих законів. Потрібно пояснювати буквені позначення у формулах. Якщо при розв'язку задачі використовується формула, яка отримана для окремого випадку, що не висловлює будь-який нефізичний закон або не є визначенням будь-якої фізичної величини, то її необхідно отримати.
2. Навести рисунок, який пояснює зміст задачі (у тих випадках, коли це можливо). Виконати його треба ретельно (за допомогою олівця, лінійки, циркуля).
3. Супроводжувати розв'язок задач короткими, але вичерпними поясненнями.
4. Всі початкові значення величин в умові задачі потрібно перевести у одиниці системи СІ. Наприклад, потрібно переводити км/год - у м/с, градуси - у радіани, градуси 0С - у градуси Кельвіна (К).
5. Отримати розв'язок задачі у загальному вигляді, тобто виразити величину, яку потрібно знайти, у буквених позначеннях величин, що задані в умові задачі. При такому способі розв'язку не проводяться обчислення проміжних величин.
6. Підставити у праву частину отриманої робочої формули замість символів величин позначення одиниць вимірювань, провести з ними відповідні дії і переконатись у тому, що результат відповідає тій, яку знаходимо.
7. Підставляти у робочу формулу числові значення величин потрібно, тільки якщо вони виражені у системі СІ. Недотримання цього правила приводить до невірного результату.
8. При підстановці у робочу формулу, а також при запису відповіді, числові значення величин потрібно записувати у вигляді добутку десяткового дробу з однією значущою цифрою перед комою на відповідну ступінь десяти. Наприклад, радіус Землі 6400 км потрібно записати у вигляді 6,4×106 м, а замість 0,00123 потрібно записати 1,23×10-3 і таке інше.
9. Оцінити, де це можливо, правдоподібність чисельної відповіді. У ряді випадків така оцінка допоможе знайти хибність отриманого результату. Наприклад, коефіцієнт корисної дії теплової машини не може бути більшим за одиницю, електричний заряд не може бути меншим за елементарний заряд, швидкість тіла не може бути більшою за швидкість світла у вакуумі і таке інше.
Вимоги до оформлення контрольних робіт
1. Семестрові контрольні роботи виконуються чорними або синіми чорнилами чи кульковою ручкою в звичайному шкільному зошиті, на обкладинці якого… 2. У кінці контрольної роботи вказується, яким підручником чи посібником… 3. Якщо контрольна робота при рецензуванні не зарахована, то студент повинен подати її на повторну рецензію, у яку…Модель воднеподібного атома по Бору
23. Яке із наведених тверджень несправедливе ? А) У основному стані атом може знаходитись скільки завгодно.Хвильові властивості речовини
У 1923 році французький фізик-теоретик Луї де Бройль виказав гіпотезу про те, що частинки речовини разом із корпускулярними володіють також і… то хвильові явища. У 1927 році американські фізики Девіссон і Джермер вивчали… Ідеї де Бройля і виявлені на досліді хвильові властивості частинок речовини послужили поштовхом до створення…Рівняння Шредінгера
Оскільки із рухом мікрочастинки зіставляється якийсь хвильовий процес, то й стан частинки у квантовій механіці описується хвильовою функцією,… ходиться будь-де у просторі. Це є вірогідність достовірної події, яку в теорії… однозначною) і безперервною (вірогідність не може змінюватись стрибками).Атом водню у квантовій механіці
У квантовій механіці задача про атом водню (крім його простої структури) є однією із основних ще і тому, що задача про рух електрона у полі… вколо ядра воднеподібного атома має вигляд: Оскільки… ділення змінних. Це досить складна задача, але якісні її результати такі.Співвідношення невизначеностей
115. Атом випромінює фотони протягом Dt=10-9 c. Визначте величину невизначеності його координати у просторі Dх ? (Швидкість поширення світла… А) Dх=3 см. Б) Dх=30 см. В) Dх=3 м. Г) Dх=1 см. Д) Dх=10 м.А) j=600. Б) j=450. В) j=660. Г) j=540. Д) j=720.
161. Який кут j із напрямком зовнішнього магнітного поля складає момент імпульсу електрона L у атомі водню, якщо орбітальне квантове число l=3, а магнітне квантове число m=2 ?
А) j=350. Б) j=450. В) j=650. Г) j=550. Д) j=750.
162. Який кут j із напрямком зовнішнього магнітного поля складає момент імпульсу електрона L у атомі водню, якщо орбітальне квантове число l=3, а магнітне квантове число m=1 ?
А) j=390. Б) j=480. В) j=640. Г) j=560. Д) j=730.
163. Визначте максимальне значення орбітального квантового числа l для електрона у збудженому стані атому водню, якщо енергія збудження DE дорівнює 12,09 еВ.
А) l=2. Б) l=3. В) l=4. Г) l=5. Д) l=6.
Квантування орбітального магнітного моменту електрона
164. Укажіть вірний вираз для магнетону Бора mВ.
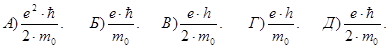
165. Укажіть вірну розмірність магнетона Бора mВ.
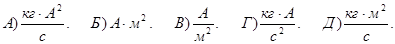
166. Як визначається гіромагнітне відношення для орбітальних магнітного та механічного моментів електрона pm/L.
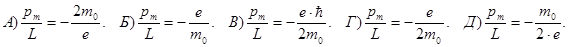
167. Визначте гіромагнітне відношення для орбітальних магнітного та механічного моментів електрона pm/L.
А)–1,2×1010 Кл/кг. Б)–0,3×1010 Кл/кг. В)–8,8×1010 Кл/кг. Г)–6,4×1010 Кл/кг. Д)–3,1×1010 Кл/кг.
168. Скільки значень може приймати магнітне квантове число, якщо орбітальне квантове число l дорівнює 2 ?
А) Два. Б) Чотири. В) Три. Г) Вісім. Д) П’ять.
169. Укажіть вірний вираз для квантування проекції орбітального магнітного моменту електрона в атомі pmz на заданий напрямок
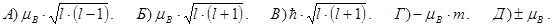
170. На скільки компонентів N розщеплюється у магнітному полі потік атомів водню, які знаходяться у основному 1S-стані ?
А) N=1. Б) N=4. В) N=3. Г) N=2. Д) N=5.
171. Яке із наведених чисел відповідає одному із можливих значень орбітального магнітного квантового числа m у електронному 2p-стані ?
А) +2. Б) +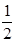 . В) -1. Г) -
. В) -1. Г) -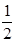 . Д) –2.
. Д) –2.
172. Укажіть кількість можливих значень магнітного квантового числа m електрона, який знаходиться у електронній f-оболонці.
А) m=7. Б) m=10. В) m=8. Г) m=6. Д) m=12.
173. Скільки всього значень може приймати магнітне квантове число m у 2p-стані ?
А) Шість. Б) П’ять. В) Сім. Г) Три. Д) Вісім.
174. Скільки всього значень може приймати магнітне квантове число m у 3d-стані ?
А) Шість. Б) П’ять. В) Сім. Г) Чотири. Д) Вісім.
175. Скільки всього значень може приймати магнітне квантове число m у 4f-стані ?
А) Шість. Б) П’ять. В) Сім. Г) Три. Д) Вісім.
176. Скільки всього значень може приймати магнітне квантове число m у 5g-стані ?
А) Шість. Б) П’ять. В) Сім. Г) Три. Д) Вісім.
177. Чому дорівнює орбітальний магнітний момент pm валентного електрона незбу-дженого атома натрію (z=11) ?
А) pm=mВ. Б) pm=2×mВ. В) 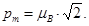 Г)
Г) 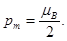 Д) pm=0.
Д) pm=0.
178. Орбітальний магнітний момент електрона в атомі 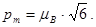 Якого із наведених значень не може набувати проекція орбітального моменту імпульсу на заданий напрямок Lz ?
Якого із наведених значень не може набувати проекція орбітального моменту імпульсу на заданий напрямок Lz ?
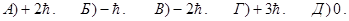
179. Якого максимального значення може набувати проекція орбітального магнітного моменту електрона pmz на напрямок зовнішнього магнітного поля, якщо значення головного квантового числа n дорівнює 3 ?
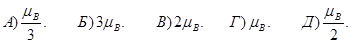
Спін електрона. Заповнення електронних оболонок і шарів.
180. Як визначається власний механічний момент (спін) електрона Ls ?
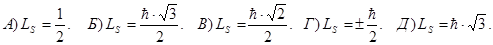
181. Як можна визначити власний (спіновий) магнітний момент електрона pms ?
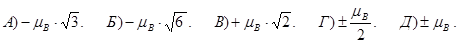
182. Яких значень може набувати проекція спінового магнітного моменту pmsz електрона на напрямок зовнішнього магнітного поля ?

183. Як визначається гіромагнітне відношення для власних (спінових) магнітного та механічного моментів електрона pms/Ls.

184. Визначте гіромагнітне відношення для власних (спінових) магнітного та механічного моментів електрона pms/Ls.
А)–2,83×1012 Кл/кг. Б)–4,12×1010 Кл/кг. В)–1,76×1011 Кл/кг. Г)–3,82×109 Кл/кг. Д)–9,31×1011 Кл/кг.
185. Проекції власного (спінового) магнітного моменту електрона в атомі pmsz на заданий напрямок можуть набувати значення:

186. До яких мікрочастинок застосовний принцип Паулі ?
А) Тільки до протонів. Б) До частинок із цілим спіном. В) Тільки до електронів.
Г) До частинок із напівцілим спіном. Д) Тільки до нейтронів.
187. Яка найбільшакількість електронів N може знаходитись у атомі, якщо для них збігаються значення квантових чисел n, l та m ?
А) N=2×(2×l+1). Б)N=2. В) N=(2×l+1). Г) N=(n+1). Д) N=2×n2.
188. Яка найбільша кількість електронів може знаходитись у атомі, якщо для них збігаються значення квантових чисел n, l та m ?
А) Шість. Б) Чотири. В) Вісім. Г) Два. Д) Десять.
189. Укажіть максимально можливу кількість електронів N у станах, що визначаються двома квантовими числами - n та l.
А) N=2×(2l+1). Б) N=(2l+1). В) N=n2. Г) N=(n-1). Д) N=2×n2.
190. На скільки частин N розділяється у досліді Штерна і Герлаха пучок атомів водню, які знаходяться у 1S-стані ?
А) N=0. Б) N=1. В) N=2. Г) N=3. Д) N=4.
191. Якого значення може набувати спінове квантове число електрона S ?
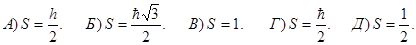
192. Укажіть максимальну кількість електронів N у атомі, які мають однакове значення головного квантового числа n без урахування спіна електрона.
А) N=2×n2. Б) N=2×(2l+1). В) N=(n-1). Г) N=n2. Д) N=(2l+1).
193. Укажіть кратність виродження енергетичного рівня N воднеподібного іону у стані, головне квантове число якого n=3 без урахування спіна електрона.
А) N=3. Б) N=9. В) N=12. Г) N=18. Д) N=24.
194. Укажіть максимальну кількість електронів N у атомі, які мають однакове значення головного квантового числа n з урахуванням спіна електрона.
А) N=2×n2. Б) N=2×(2l+1). В) N=2. Г)N=n2. Д)N= (2l+1).
195. Визначте кількість електронів N у воднеподібному атомі у енергетичному стані, головне квантове число якого n=4 (кратність виродження) без урахування спіна.
А) N=8. Б) N=16. В) N=24. Г) N=32. Д) N=4.
196. Визначте кількість електронів N у воднеподібному атомі у енергетичному стані, головне квантове число якого n=4 (кратність виродження) із урахуванням спіна.
А) N=8. Б) N=24. В) N=16. Г) N=32. Д) N=4.
197. Який із наборів квантових чисел n, l, m та ms відповідає електрону у 1S-стані ?
А) 1,0,-1,+ . Б) 1,0,0,-
. Б) 1,0,0,- . В) 1,1,-1,+
. В) 1,1,-1,+ . Г) 2,0,0,+
. Г) 2,0,0,+ . Д) 1,1,0,
. Д) 1,1,0,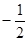 .
.
198. Який із наборів квантових чисел n, l, m та ms відповідає електрону у 2p-стані ?
А) 2,1,-2,- . Б) 2,0,1,-
. Б) 2,0,1,- . В) 2,0,-1,+
. В) 2,0,-1,+ . Г) 2,0,0,+
. Г) 2,0,0,+ . Д) 2,1,-1,
. Д) 2,1,-1, .
.
199. Який із наборів квантових чисел n, l, m та ms відповідає електрону у 3d-стані ?
А) 3,2,-1,+ . Б) 3,1,0,-
. Б) 3,1,0,- . В) 3,0,-2,+
. В) 3,0,-2,+ . Г) 3,1,1,+
. Г) 3,1,1,+ . Д) 2,2,-2,
. Д) 2,2,-2,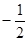 .
.
200. Який із наборів квантових чисел n, l, m та ms відповідає електрону у 4f-стані ?
А) 4,2,-1,+ . Б) 4,3,0,-
. Б) 4,3,0,- . В) 2,4,-1,+
. В) 2,4,-1,+ . Г) 4,3,4,+
. Г) 4,3,4,+ . Д) 3,3,-2,
. Д) 3,3,-2,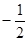 .
.
201. Укажіть вірну електронну конфігурацію для атома азоту (z=7) у основному стані.
А) 1S22S22p2. Б) 1S22S22p6. В) 1S22S22p3. Г) 1S22S22p5. Д) 1S22S22p4.
202. Укажіть вірну електронну конфігурацію для атома фтору (z=9) у основному стані.
А) 1S22S22p2. Б) 1S22S22p63S1. В) 1S22S22p6. Г) 1S22S22p5. Д) 1S22S22p4.
203. Укажіть вірну електронну конфігурацію для атома натрію (z=11) у основному стані.
А) 1S22S22p63S1. Б) 1S22S22p6. В) 1S22S22p63S2. Г) 1S22S22p5. Д) 1S22S22p4.
204. Укажіть вірну електронну конфігурацію для атома алюмінію (z=13) у основному стані.
А) 1S22S22p6. Б) 1S22S22p63S23р1. В) 1S22S22p63S2. Г) 1S22S22p63S23p2. Д) 1S22S22p63S1.
205. Скільки вільних квантових станів існує у електронному L-шарі, що заповнений шістьма електронами ?
А) Три. Б) Чотири. В) П¢ять. Г) Один. Д) Два.
206. Скільки вільних квантових станів мають місце у електронному М-шарі, який заповнений одинадцятьма електронами ?
А) Тринадцять. Б) Чотири. В) Вісім. Г) Сім. Д) Три.
207. Скільки вільних квантових станів мають місце у електронному N-шарі, який заповнений чотирнадцятьма електронами ?
А) Десять. Б) Сім. В) Вісімнадцять. Г) Чотирнадцять. Д) Чотири.
208. Із яких електронних оболонок складається електронний М-шар ?
А) S, p, d. Б) S, p, d, f, g. В) S, p. Г) S, p, d, f. Д) S.
209. Із яких електронних оболонок складається електронний N-шар ?
А) S, p, d. Б) S, p, d, f. В) S, p. Г) S, p, d, f, g. Д) S.
210. Укажіть головне квантове число n для електронного шару, в якому не може знаходитись понад 18 електронів.
А) П’ять. Б) Чотири. В) Два. Г) Три. Д) Шість.
211. Укажіть головне квантове число n для електронного шару, в якому не може знаходитись понад 32 електронів.
А) П’ять. Б) Шість. В) Два. Г) Три. Д) Чотири.
212. Укажіть головне квантове число n для електронного шару, в якому не може знаходитись понад 50 електронів.
А) П’ять. Б) Чотири. В) Два. Г) Три. Д) Шість.
213. Укажіть кількість електронів у атомі, у якого заповнені К- та L-шари, а також 3S- оболонка.
А) Одинадцять. Б) П’ятнадцять. В) Десять. Г) Дванадцять. Д) Чотирнадцять.
214. Укажіть кількість електронів у атомі, у якого заповнені К- та L-шари, а також 3S- та наполовину 3р-оболонка.
А) Вісімнадцять. Б) П’ятнадцять. В) Десять. Г) Дванадцять. Д) Чотирнадцять.
215. Укажіть кількість електронів у атомі, у якого повністю заповнені К- та L-шари, а також 3S- та 3р-оболонки.
А) Вісімнадцять. Б) П’ятнадцять. В) Чотирнадцять. Г) Дев’ятнадцять. Д) Шістнадцять.
216. Укажіть кількість електронів у атомі, у якого повністю заповнені К- та L-шари, 3S- та 3р-оболонки, а у 3d-оболонці – 2 електрони.
А) Чотирнадцять. Б) П’ятнадцять. В) Двадцять. Г) Дев’ятнадцять. Д) Вісімнадцять.
217. У атомі деякого хімічного елемента повністю заповнені К- та L- електронні шари, а у М-шарі знаходяться 4 електрони ?
А) Mg (z=12). Б) Si (z=14). В) Al (z=13). Г) P (z=15). Д) Nе (z=10).
218. У атомі якого хімічного елемента повністю заповнені К- та L- електронні шари ?
А) Mg (z=12). Б) Na (z=11). В) Al (z=13). Г) P (z=15). Д) Nе (z=10).
219. У зовнішній електронній 3р-оболонці незбудженого атома деякого хімічного елемента містяться два електрони. Який це атом ?
А) Al (z=13). Б) P (z=15). В) Na (z=11). Г) Si (z=14). Д) Mg (z=12).
220. У атомі деякого хімічного елемента повністю заповнені К-, L- та M- електронні шари, а у 4S-оболонці – один електрон. Який це атом ?
А) Cu (z=29). Б) Zn (z=30). В) Ni (z=28). Г) Cr (z=24). Д) Fе (z=26).
221. У атомі деякого хімічного елемента повністю заповнені К-, L- та M- електронні шари, а також 4S-оболонка і наполовину 4р-оболонка. Який це атом ?
А) Mn (z=25). Б) As (z=33). В) Br (z=35). Г) Zn (z=30). Д) Ni (z=28).
222. Визначте загальну кількість електронів у атомі N, у якого повністю заповнені К-, L- та M- електронні шари, а також 4S-оболонка.
А) N=26. Б) N=24. В) N=30. Г) N=32. Д) N=28.
Частинка у потенціальній ямі
223. Яким співвідношенням визначається енергія Еn частинки у нескінченно глибокій одновимірній потенціальній ямі, розміром 0£х£l.
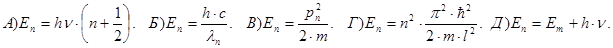
224. Частинка знаходиться у одновимірній нескінченно глибокій потенціальній ямі, розміром 0£х£l. У якій точці цієї ями із координатою х імовірність виявлення частинки у основному стані (n=1) максимальна ?
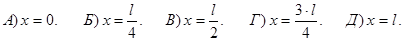
225. Частинка знаходиться у одновимірній нескінченно глибокій потенціальній ямі, розміром 0£х£l. У якій точці цієї ями із координатою х імовірність виявлення частинки у збудженому стані (n=2) максимальна ?

226. Частинка знаходиться у одновимірній нескінченно глибокій потенціальній ямі, розміром 0£х£l. У якій точці цієї ями із координатою х імовірність виявлення частинки у збудженому стані (n=3) максимальна ?

227. Частинка знаходиться у одновимірній нескінченно глибокій потенціальній ямі, розміром 0£х£l. У якій точці цієї ями із координатою х імовірність виявлення частинки у збудженому стані (n=4) максимальна ?
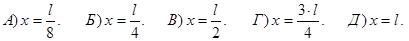
228. Частинка знаходиться у одновимірній нескінченно глибокій потенціальній ямі, розміром 0£х£l. У якій точці цієї ями із координатою х імовірність виявлення частинки у збудженому стані (n=4) мінімальна ?
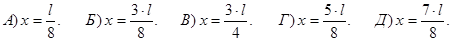
229. Визначте мінімальну енергію електрона у нескінченно глибокій потенціальній ямі, розміром l=10-10 м.
А) 76,2 еВ. Б) 37,6 еВ. В) 13,5 еВ. Г) 24,1 еВ. Д) 47,8 еВ.
230. Визначте енергію електрона у нескінченно глибокій потенціальній ямі, розміром l=10-10 м при значенні головного квантового числа n=2.
А) 15,1 еВ. Б) 14,2 еВ. В) 46,8 еВ. Г) 132,0 еВ. Д) 150,4 еВ.
231. Визначте енергію електрона у нескінченно глибокій потенціальній ямі, розміром l=2×10-10 м при значенні головного квантового числа n=2.
А) 89,3 еВ. Б) 13,6 еВ. В) 64,8 еВ. Г) 37,6 еВ. Д) 76,3 еВ.
232. Визначте енергію нейтрона у нескінченно глибокій одновимірній потенціальній ямі розміром l=10-14 м при n=2. (mn=1,67×10-27 кг).
А) 2,21 МеВ. Б) 8,14 МеВ. В) 6,32 МеВ. Г) 4,27 МеВ. Д) 10,06 МеВ.
233. Визначте енергію електрона у нескінченно глибокій потенціальній ямі, розміром l=10-9 м при значенні головного квантового числа n=3.
А) 4,57 еВ. Б) 5,62 еВ. В) 3,38 еВ. Г) 1,27 еВ. Д) 2,44 еВ.
234. Визначте енергію нейтрона у нескінченно глибокій потенціальній ямі, розміром l=10-11 м при значенні головного квантового числа n=3. (mn=1,67×10-27 кг).
А) 24,8 еВ. Б) 12,2 еВ. В) 9,4 еВ. Г) 18,3 еВ. Д) 32,6 еВ.
235. Визначте енергію електрона у нескінченно глибокій потенціальній ямі, розміром l=2×10-10 м при значенні головного квантового числа n=3.
А) 168 еВ. Б) 136 еВ. В) 75 еВ. Г) 284 еВ. Д) 112 еВ.
236. Визначте енергію протона у нескінченно глибокій одновимірній потенціальній ямі розміром l=3×10-11 м при n=4. (mр=1,67×10-27 кг).
А) 8,26 еВ. Б) 11,46 еВ. В) 5,94 еВ. Г) 16,57 еВ. Д) 3,62 еВ.
237. Визначте енергію електрона у нескінченно глибокій потенціальній ямі, розміром l=4×10-10 м при значенні головного квантового числа n=5.
А) 99,3 еВ. Б) 45,7 еВ. В) 58,5 еВ. Г) 74,6 еВ. Д) 21,9 еВ.
238. Визначте мінімальну різницю між двома сусідніми енергетичними рівнями DЕmin для електрона у нескінченно глибокій потенціальній ямі, розміром l=10-9 м.
А) 0,8 еВ. Б) 2,6 еВ. В) 8,4 еВ. Г) 1,1 еВ. Д) 4,2 еВ.
239. Електрон у нескінченно глибокій потенціальній ямі при переході із другого енергетичного рівня на перший випромінює фотон з енергією 1 еВ. Визначте ширину цієї потенціальної ями l.
А) l=0,76 еВ. Б) l=1,06 еВ. В) l=2,31 еВ. Г) l=3,74 еВ. Д) l=4,12 еВ.
240. Електрон у нескінченно глибокій потенціальній ямі при переході із третього енергетичного рівня на другий випромінює фотон з енергією 0,25 еВ. Визначте ширину цієї потенціальної ями l.
А) l=0,78 еВ. Б) l=1,06 еВ. В) l=2,73 еВ. Г) l=3,54 еВ. Д) l=4,12 еВ.
ОСНОВИ ТЕОРІЇ З РОЗДІЛУ “ЯДЕРНА ФІЗИКА”
У 1911 році на підставі результатів своїх експериментальних досліджень англійський фізик Е.Резерфорд запропонував ядерну(планетарну) модель атома. Згідно цієї моделі, навколо позитивного ядра, розмірами ~10-15¸10-14 м, що має заряд Ze і масу, практично рівну масі атома, у області із лінійними розмірами ~10-10 м по замкнутих орбітах під дією сил електростатичного притягання рухаються електрони, утворюючи електронну оболонку атома. Оскільки атоми електрично нейтральні, то навколо ядра рухаються Z-електронів, сумарний заряд яких компенсує позитивний заряд ядра (Z – порядковий номер елементу в системі Менделєєва). Електрон був відкритий у 1897 році англійським фізиком Дж. Томсоном. Точні вимірювання електричного заряду атомного ядра були виконані у 1913 році англійським фізиком Г. Мозлі, який визначав заряди ядер по спектрах рентгенівського випромінювання, яке випромінюється при опроміненні атомів електронами високих енергій. Саме Мозлі встановив, що заряд ядра q=Z×e. Припустивши, що носії позитивного заряду у ядрах однакові, Мозлі назвав ядро найлегшого елементу – водню (Z=1) – протоном, заряд якого складає q=e=+1,6×10-19 Кл і має масу mp=1,67×10-27 кг. У 1919 році Резерфорд серед частинок, вибитих із атомних ядер, експериментально знайшов і протони, які входять до складу ядер.
Дослідження мас ядер показали, що вони складаються не тільки із протонів. Інша частинка, яка входить до складу ядра, була відкрита у 1932 році англійським фізиком Д. Чедвіком. Ця частинка, маса якої приблизно дорівнює масі протона, є електрично нейтральною, тому вона названа нейтроном. У 1932 році Д.Іваненко і В.Гейзенберг майже одночасно запропонували протонно-нейтронну модель ядра. Протон і нейтрон є двома зарядовими станами ядерної частинки, названої нуклоном (від англійського слова nucleus – ядро). Протон і нейтрон відносяться до класу ферміонів – частинок із напівцілим спіном. Нуклони володіють власними магнітними моментами, взаємодія яких із магнітним полем приводить до розщеплювання пучків ядер і виникнення надтонкої структури спектральних ліній. Кількість протонів у ядрі визначає його позитивний заряд, позначається Z (оскільки співпадає із порядковим номером елементу в системі Менделєєва) і називається зарядовим числом. Кількість нейтронів в ядрі позначається N, а загальну кількість нуклонів у ядрі називають масовим числом ядра А. Очевидно, що А=Z+N.
Для позначення атомних ядер застосовують символи. Якщо Х – позначення атома хімічного елементу у періодичній системі Менделєєва, то символ ядра цього атома має вигляд 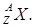 Для всіх ядер А³Z. Ядра, що мають однаковий заряд Z, але відмінні масовим числом А, називаються ізотопами (вони мають різну кількість нейтронів у складі ядра). Всі хімічні елементи є природними сумішами ізотопів. Наприклад, водень має три ізотопи: легкий ізотоп протій з ядром
Для всіх ядер А³Z. Ядра, що мають однаковий заряд Z, але відмінні масовим числом А, називаються ізотопами (вони мають різну кількість нейтронів у складі ядра). Всі хімічні елементи є природними сумішами ізотопів. Наприклад, водень має три ізотопи: легкий ізотоп протій з ядром 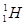 , важкий ізотоп дейтерій з ядром
, важкий ізотоп дейтерій з ядром 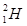 і штучний ізотоп тритій з ядром
і штучний ізотоп тритій з ядром 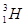 . Уран (Z=92) має 12 ізотопів з масовими числами від А=228 до А=239. Ізотопи володіють однаковими хімічними властивостями, але різними фізичними: густиною, здібністю до радіоактивного розпаду і таке інше. Оскільки нуклони, які входять до складу ядер, володіють хвильовими властивостями, атомні ядра не мають різко виражених меж. Експериментальні дані по розсіюванню a-частинок речовиною дозволили встановити емпіричну формулу для обчислення радіусу ядра:
. Уран (Z=92) має 12 ізотопів з масовими числами від А=228 до А=239. Ізотопи володіють однаковими хімічними властивостями, але різними фізичними: густиною, здібністю до радіоактивного розпаду і таке інше. Оскільки нуклони, які входять до складу ядер, володіють хвильовими властивостями, атомні ядра не мають різко виражених меж. Експериментальні дані по розсіюванню a-частинок речовиною дозволили встановити емпіричну формулу для обчислення радіусу ядра:

| де R0=(1,2¸1,5)×10-15 м, А – масове число ядра. Об'єм ядра пропорційний кількості нуклонів А, які входять у нього, тому нуклони у всіх ядрах упаковані приблизно із рівною густиною, яка за поряд- |
ком величини становить r~2×1011 кг/м3 (приблизно 200 мільйонів тонн на 1 см3).
Ядра атомів є міцними утвореннями, проте ні кулонівські сили відштовхування між протонами, ні сили гравітаційного тяжіння між нуклонами ядра, не можуть забезпечити їх міцного зв'язку в ядрі. Ці особливі специфічні сили, що діють у ядрі між нуклонами, відносяться до класу сильних взаємодій і називаються ядерними силами. Саме вони утримують нуклони на відстанях ~10-15 м один від одного. Складний характер ядерних сил не дозволив до теперішнього часу розробити єдину теорію атомного ядра. Передбачається, що «чистих» протонів і нейтронів у ядрі немає, а є однорідна ядерна речовина, яка може існувати у двох станах: мати позитивний заряд або не мати заряду. Короткодія ядерних сил може бути пояснена на основі припущення про обмінний характер цих сил. Академік Тамм показав, що квантами ядерного поля не можуть бути електрони. Згідно гіпотезі, виказаній японським фізиком Х. Юкавою, взаємодія між нуклонами у ядрі здійснюється шляхом обміну з величезною швидкістю особливими частинками, маса яких у 200¸300 разів більша за масу електрона. Пізніше ці частинки були названі p-мезонами (піонами).
Маси всіх ядер завжди менші за сумарну масу нуклонів, із яких вони складаються. Зменшення маси ядра обумовлена тим, що при його утворенні виділяється енергія. Величина Dm, на яку зменшується сумарна маса всіх нуклонів при

| утворенні із них атомного ядра, називається дефектом маси ядра, розрахувати яку можна за формулою: |
де Z – кількість протонів у ядрі, (A-Z) – кількість нейтронів, mp та mn – маси протона і нейтрона, mя - маса ядра ізотопу. Оскільки mя=(mA-Z×me), де mA – атомна ма
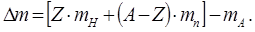
| са ізотопу, а me – маса електрону, то попереднє рівняння можна замінити наступним: де mH – маса ізотопу легкого водню, протію. |
Енергія DЕзв, яка потрібна для розщеплення ядра на його окремі складові – нукло-
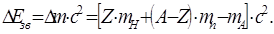
| ни, називається енергією зв'язку ядра і визначається так: Оскільки маси ізотопів елементів вимірюють- |
ся у позасистемних одиницях маси - атомних (а.о.м.), легко підрахувати, що на масу m=1 а.о.м. припадає енергія Е=m×c2»931 МеВ. Тому енергію зв¢язку ядра звичайно обчислюють у мегаелектронвольтах (1 МеВ=106 еВ=1,6×10-13 Дж) за фо-
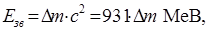
| рмулою: якщо дефект маси ядра Dm наданий у атомних одиницях маси (1 а.о.м.=1,66×10-27 кг). Згідно закону збе- |
реження енергії, при утворенні ядра із окремих нуклонів виділяється енергія, рівна його енергії зв'язку.
Відношення енергії зв'язку ядра до кількості нуклонів у ньому, називається питомою енергією зв'язку: Епит=Езв/А. Питома енергія зв'язку залежить від числа нуклонів А у ядрі і характеризує стійкість (міцність) атомних ядер: чим вона більша, тим стійкіше ядро. Для більшості ядер Епит»6¸8 МеВ/нуклон. Найстабільнішими є ядра із А=40¸100 (у них питома енергія приблизно стала і дорівнює Еmах»8,6 МеВ/нуклон. У міру збільшення А питома енергія зв'язку поступово зменшується і становить Еmin»7,6 МеВ/нуклон. Це зменшення зумовлене тим, що при зростанні кількості протонів у ядрі збільшується енергія їхнього кулонівського відштовхування. При А£12 Епит має характерні максимуми і мінімуми. Максимуми спостерігаються у ядер із парною кількістю протонів і нейтронів ( ,
,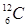 ,
,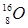 ), а мінімуми – із непарною (
), а мінімуми – із непарною (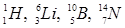 ). З цієї залежності виходить, що для отримання ядерної енергії принципово можливі два способи: поділ важких ядер на більш легкі, і злиття легких ядер у більш важкі. При обох процесах виділяється величезна кількість енергії. У наш час обидва ці процеси здійснені практично – це реакції поділу та термоядерні реакції).
). З цієї залежності виходить, що для отримання ядерної енергії принципово можливі два способи: поділ важких ядер на більш легкі, і злиття легких ядер у більш важкі. При обох процесах виділяється величезна кількість енергії. У наш час обидва ці процеси здійснені практично – це реакції поділу та термоядерні реакції).
Закономірності радіоактивних процесів
Природною радіоактивністю називається явище спонтанного (самодовільного) перетворення атомних ядер нестійких ізотопів одних хімічних елементів в… Експериментально було встановлено, що радіоактивне випромінювання має… Розпад ядер є випадковою подією, тому зміна радіоактивності зі спливанням часу повинна підлягати статистичній…А) 4,8×108. Б) 3,7×1010. В) 1,6×107. Г) 8,1×109. Д) 5,4×1011.
324. Визначте сталу розпаду радону l, якщо відомо, що за 1 добу кількість атомів радону зменшується на 18,2 %.
А) 1,2×10-5 с-1. Б) 8,7×10-6 с-1. В) 6,4×10-4 с-1. Г) 9,4×10-5 с-1. Д) 2,3×10-6 с-1.
325. Яка частка початкової маси деякого радіоактивного ізотопу розпадеться за середній час життя t цього ізотопу ?
А) 81 %. Б) 46 %. В) 72 %. Г) 63 %. Д) 54 %.
326. За проміжок часу t1=8 годин початкова кількість радіоактивного ізотопу зменшилась у 3 рази. У скільки разів вона зменшиться за проміжок t2=1 доба, вважаючи від початкового моменту часу ?
А)У 6 разів. Б) У 12 разів. В) У 27 разів. Г) У 9 разів. Д) У 18 разів.
327. Активність А деякого радіоактивного ізотопу за 8 діб зменшилась у 4 рази. Визначте період піврозпаду Т1/2 цього ізотопу.
А) 8 діб. Б) 4 доби. В) 2 доби. Г) 6 діб. Д) 1 доба.
328. Активність деякого радіоактивного ізотопу у початковий момент часу А0 становила 21,6 мКи, а через проміжок часу t=15 годин, вона становила А=1,8 мКи. Визначте період піврозпаду Т1/2 цього ізотопу.
А) 8,4 години. Б) 2,1 години. В) 6,3 години. Г) 10,5 годин. Д) 4,2 години.
329. Визначте активність А радіоактивного ізотопу полонію 210Ро, масою m=1 мкг, якщо період його піврозпаду Т1/2=138,4 доби.
А) 1,7×108 Бк. Б) 5,6×109 Бк. В) 9,8×107 Бк. Г) 8,4×108 Бк. Д) 2,1×1010 Бк.
330. Визначте активність А радіоактивного препарату 90Sr, масою m=0,1 мкг, якщо період його піврозпаду Т1/2=28 років.
А) 8,1×106 Бк. Б) 3,2×104 Бк. В) 5,3×105 Бк. Г) 6,7×107 Бк. Д) 1,1×106 Бк.
Визначте масу m радону 222Rn, активність якого А дорівнює 1 Ки, а період його піврозпаду Т1/2=3,82 доби. (1 Kи=3,7×1010 розпадів/с).
А) m=3,4×10-8 кг. Б) m=7,2×10-10 кг. В) m=4,8×10-6 кг. Г) m=6,5×10-9 кг. Д) m=9,1×10-7 кг.
Визначте масу m полонію 210Ро, активність якого А дорівнює 3,7×1010 Бк, а період його піврозпаду Т1/2=138 діб.
А) m=6,4×10-5 кг. Б) m=2,2×10-7 кг. В) m=4,5×10-4 кг. Г) m=7,1×10-6 кг. Д) m=8,7×10-8 кг. 333. Визначте питому активність A/m ізотопу урану 235U, період піврозпаду якого Т1/2=7,1×108 років. (1…РЕКОМЕНДОВАНА ЛІТЕРАТУРА
1. Трофимова Т.И. Курс физики: Учебное пособие для вузов.– М.: Высшая школа, 2003. - 542 с. 2. Дмитриева В.Ф., Прокофьев В.Л. Основы физики: Учебное пособие для… 3. Чолпан П.І. Основи фізики: підручник. - Київ: Вища школа, 2004. - 567 с.ЗМІСТ
ПЕРЕДМОВА..................................................................................................................3
Зміст модулю № 6 “ОСНОВИ АТОМНОЇ І ЯДЕРНОЇ ФІЗИКИ”....................4
Загальні вказівки до вивчення дисципліни.........................................................5
ОСНОВИ ТЕОРІЇ З РОЗДІЛУ“АТОМНА ФІЗИКА”..................................................7
ТЕСТОВІ ЗАВДАННЯ З РОЗДІЛУ “АТОМНА ФІЗИКА”.......................................11
Спектральні закономірності водню...................................................................11
Модель воднеподібного атома по Бору.............................................................13
Потенціали збудження та іонізації.....................................................................17
ОСНОВИ ТЕОРІЇ З РОЗДІЛУ“ЕЛЕМЕНТИ КВАНТОВОЇ МЕХАНІКИ”.............19
Хвильові властивості речовини..........................................................................19
Рівняння Шредінгера...........................................................................................20
Атом водню у квантовій механіці......................................................................22
ТЕСТОВІ ЗАВДАННЯ З РОЗДІЛУ“ЕЛЕМЕНТИ КВАНТОВОЇ МЕХАНІКИ”....25
Хвилі де Бройля...................................................................................................25
Співвідношення невизначеностей......................................................................28
Квантування орбітального моменту імпульсу електрона................................31
Квантування орбітального магнітного моменту електрона.............................34
Спін електрона. Заповнення електронних оболонок і шарів...........................35
Частинка у потенціальній ямі.............................................................................39
ОСНОВИ ТЕОРІЇ З РОЗДІЛУ “ЯДЕРНА ФІЗИКА”..................................................41
Закономірності радіоактивних процесів...........................................................43
Поняття про ядерні реакції.................................................................................46
ТЕСТОВІ ЗАВДАННЯ З РОЗДІЛУ “ЯДЕРНА ФІЗИКА”.........................................49
Будова ядра............................................………………………………………...49
Дефект маси і енергія зв¢язку ядра.....................................................................51
Явище радіоактивного розпаду..........................................................................54
Ядерні реакції.......................................................................................................58
Енергетичний вихід ядерних реакцій................................................................66
Відповіді на тестові завдання.....................................................................70
РЕКОМЕНДОВАНА ЛІТЕРАТУРА............................................................................71
ЗМІСТ.............................................................................................................................72
– Конец работы –
Используемые теги: мета, завдання, дисципліни, Місце, навчальному, процесі0.09
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Мета і завдання дисципліни, її місце у навчальному процесі
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов