рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Медицина
- /
- Внутренние болезни
Реферат Курсовая Конспект
Внутренние болезни
Внутренние болезни - раздел Медицина, ГДк 616.1/.4(075.8) ,бк 54.1 М16 Рецензенты: В. ...
ГДК 616.1/.4(075.8) ,БК 54.1 М16
Рецензенты:
В. А. Люсое — акад. РАЕН, засл. деятель науки РФ, проф., заи. кафедрой госпитальной терапии № 1 РГМУ;
Е.И. Соколов — акад. РАМН, проф., зав. кафедрой факультетской терапии МГМСУ
Маколкин В.И., Овчаренко СИ.
Внутренние болезни: Учебник. — 5-е изд., перераб. Ml6
и доп. — М.: ОАО «Издательство «Медицина», 2005. — 592 с: ил. — (Учеб. лит. Для студ. мед. вузов). — ISBN 5-225-04835-8
В 5-е издание учебника (4-е вышло в 1999 г.) внесены существенные изменения и дополнения, которые отражают современные принципы классификации, диагностики и лечения внутренних болезней, нашедших свое отражение в опубликованных в последние годы отечественных и международных рекомендациях. Список контрольных вопросов и задач расширен и дополнен.
Для студентов медицинских вузов.
ББК 54.1
ISBN 5-225-04835-8 © В.И. Маколкин, СИ. Овчаренко, 2005
Все права авторов защищены. Ни одна часть этого издания не может быть занесена в память компьютера либо воспроизведена любым способом без предварительного письменного разрешения издателя.
Оглавление
Предисловие ..........................................................................................................
Введение .................................................................................................................
Глава I. Болезни органов дыхания...................................................................... 16
Глава II. Болезни органов кровообращения......................................................... 105
Глава III. Болезни органов пищеварения.............................................................. 291
Глава IV. Болезни почек......................................................................................... 391
Глава V. Болезни системы крови........................................................................... 422
Глава VI. Системные васкулиты.............................................................................. 50°
Глава VII. Диффузные заболевания соединительной ткани ... 525
Глава VIII Болезни суставов.................................................................................... 556
Заключение..........................................................................................................
Ответы на контрольные вопросы и задачи............................................................ 591
http ://www. bestmed boo k. com /
ОГН — острый гломерунелонефрит
ОКС — острый коронарный синдром
OJI — острый лейкоз
ОФВ — объем форсированного выдоха
Пн — пневмония
ПТ — пароксизмальная тахикардия
ПТП — псевдотуморозный панкреатит
РА — ревматоидный артрит
РКМП — рестриктивная кардиомиопатия
РНК — рибонуклеиновая кислота
РСК — реакция связывания комплемента
РТГА — реакция торможения гемагглютинации
РФ — ревматоидный фактор
СВПТ — суправентрикулярная пароксизмальная тахикардия
СГ — симптоматические артериальные гипертонии
СЖК — свободные жирные кислоты
СКВ — системная красная волчанка
СРБ — С-реактивный белок
ССД — системная склеродермия
ТОРС — тяжелый острый респираторный синдром
УП — узелковый периартериит
ФЖЭЛ — форсированная жизненная емкость легких
ХАТ — хронический активный гепатит
ХАИ Г — хронический аутоиммунный гепатит
ХБ — хронический бронхит
ХБП — хронический болевой панкреатит
ХБХ — хронический бескаменный холецистит
ХГ — хронический гастрит
ХГН — хронический гломерулонефрит
ХЛЛ — хронический лимфолейкоз
ХЛП — хронический латентный (безболевой) панкреатит
XMJI — хронический миелолейкоз
XH3JI — хронические неспецифические заболевания легких
ХСН — хроническая недостаточность
ХП — хроническая пневмония
ХПГ — хронический персистируюгций гепатит
ХПН — хроническая почечная недостаточность
ХрИБС — хроническая ишемическая болезнь сердца
ХРП — хронический рецидивирующий панкреатит
ХХГ — хронический холестатический гепатит
ХЭ — хронический энтерит
ЦП — цирроз печени
ЧПЭСС — чреспищеводная электростимуляция сердца
ЧТКА — чрескожная транслюминальная коронарная ангиография
ЭГДС — эзофагогастродуоденоскопия
ЭИТ — электроимпульсная терапия
ЭРХПГ — эндоскопическая ретроградная холангиопанкреатография
ЭФИ — электрофизиологическое исследование
Я Б — язвенная болезнь
Предисловие
Все предыдущие издания учебника (1-е — в 1987 г., 2-е — в 1989 г., 3-е -в 1994 г., 4-е — в 1999 г.) были положительно встречены медицинской общественностью и студентами медицинских вузов и расходились сразу же после выхода в свет. Кроме того, 4-е издание получило высокую оценку — учебнику была присуждена премия Правительства РФ в области образования за 2002 г. Это лишний раз убедило авторов в правомерности избранного подхода к изложению фактического материала, направленного на скорейшее формирование у студентов клинического мышления. Авторы убеждены, что учебник для медицинских вузов не должен представлять себой лишь чисто информационное издание, задача учебника — научить студента пользоваться этой информацией у постели больного человека.
За период, прошедший после выхода в свет 4-го издания, были закончены многие международные многоцентровые исследования во многих областях внутренней медицины, что обусловило появление большого числа международных и отечественных рекомендаций по диагностике и лечению самых различных заболеваний. Кроме того, произошло значительное обновление фармацевтических препаратов — появление новых, прошедших всестороннюю аппробацию лекарственных средств и методов терапии согласно принципам доказательной медицины. Все это потребовало коррекции практически всех разделов учебника, особенно диагностических подходов и методов лечения. Кроме того, коррекции подверглись и существовавшие ранее представления о патогенезе ряда заболеваний. Нашли свое отражение в учебнике и некоторые вновь принятые классификации. В данном издании расширены некоторые главы, посвященные болезням легких, системным васкулитам. Вновь включена глава, посвященная нарушениям ритма сердца. В переработке некоторых глав учебника принимали участие сотрудники кафедры факультетской терапии № 1 Московской медицинской академии им. И.М. Сеченова профессора В.М. Махов, А.В. Недоступ, В.А. Сулимов, ассистент О.В. Благова, за что авторы выражают им искреннюю благодарность.
С учетом современных требований к тестовому контролю переработаны контрольные вопросы и задачи.
Авторы выражают признательность читателям за ценные замечания и советы. Большинство предложений, сделанных преподавателями медицинских вузов, практическими врачами и студентами, учтены при подготовке 5- го издания учебника.
Член-корр. РАМН, заслуженный деятель науки РФ, лауреат премии Правительства РФ в области образования профессор В.И. Маколкин
Лауреат премии Правительства РФ в области образования
профессор СИ. Овчаренко
Введение
Главное условие эффективного лечения заболевшего человека — правильное распознавание его болезни. Следует иметь в виду, что у разных людей одна и та же болезнь протекает по-разному. Это обусловлено индивидуальными особенностями организма. В связи с этим правильное распознавание болезни возможно лишь на основе строго научных фактов, которыми располагает врач. Эти факты, характеризующие отклонения от нормального функционирования различных органов и систем, врач устанавливает при систематическом обследовании больного.
Информацию о таких отклонениях можно получить из трех источников.
1. Беседа с больным (изучение жалоб, анамнеза болезни, анамнеза жизни).
2. Непосредственное (физическое) обследование больного: осмотр, пальпация, перкуссия, аускультация.
3. Данные лабораторно-инструментальных методов исследования (так называемые рутинные методы, производимые всем больным, и исследова ния по специальным показаниям, обусловленным особенностями клиниче ской картины болезни у больного).
По мере сбора информации дают предварительные диагностические заключения, а затем формируют окончательный развернутый клинический диагноз. Следовательно, каждый источник информации необходим для построения диагностической концепции.
Таким образом, три источника получения информации и выводы, которые делает врач после получения информации, можно условно рассматривать как три этапа диагностического поиска.
Первый этап диагностического поиска — выяснение жалоб, анамнеза болезни и жизни больного — является весьма существенным этапом для диагностики, так как квалифицированно проведенный расспрос, глубокий анализ полученной информации, группировка фактов, а затем логичное изложение материала, свободное от ненужной детализации или краткости, — есть залог грамотной и точной диагностики. История настоящего заболевания описывается с момента появления первых симптомов («дебют» болезни). Следует особо подчеркнуть, что анамнез болезни — отнюдь не хронологическое перечисление посещений врача поликлиники либо этапов стационарного лечения. Главное в данном разделе — отражение динамики развития болезни от ее начальных проявлений до появления типичных клинических синдромов и симптомов, осложнений, частоты и длительности периодов обострения и ремиссий, ослабления или усиления симптоматики в процессе лекарственной или немедикаментозной терапии (физиопроцедуры, санаторное лечение, массаж, ЛФК), влияние на развитие и течение болезни условий труда и быта, характера питания, вредных привычек.
В процессе работы следует тщательно изучить имеющуюся у больного медицинскую документацию из других учреждений (выписки, справки, эпикризы), позволяющую конкретизировать полученную информацию (шумы в сердце, гепатомегалия, асцит и т.д.), выявить изменения при ла-бораторно- инструментальном исследовании (анемия, увеличение СОЭ), эффект терапии, дозы и количество ряда лекарственных препаратов (глю-кокортикостероиды и ДР-)-
При заболеваниях, обострения которых протекают по единой схеме («стереотипно»), можно не перечислять аналогичную симптоматику несколько раз, а описать типичную картину, затем отметить, что подобные обострения отмечались в таком-то году (в весенне-осенний период, ежегодно и т.п.).
В ряде случаев в анамнезе настоящего заболевания имеются результаты, которые могут уточнить или отвергнуть предыдущую диагностическую концепцию (велоэргометрия, коронароангиография, эхокардиография и т.п.). Следует также отразить влияние заболевания на трудоспособность больного (временная или стойкая утрата, группа инвалидности).
Таким образом, из беседы с пациентом выясняют не только жалобы, но и этапы развития болезни, изменение ее течения с годами и под влиянием проводившегося лечения. Часть сведений можно получить от родственников больного. Естественно, что сам больной не все может сообщить врачу о своем заболевании. Часто одни симптомы кажутся больному наиболее важными, тогда как для постановки диагноза важны совсем иные. В связи с этим необходимо выявлять диагностически значимую информацию; полученные сведения врач должен творчески осмыслить и сделать выводы следующего порядка:
а) выявленные жалобы и течение болезни полностью соответствуют та ковым при такой-то нозологической форме; иначе говоря, после первого этапа диагностического поиска диагностическая концепция является впол не определенной и на последующих этапах ее надо лишь подтвердить, а также детализировать отдельные проявления болезни;
б) описанные больным симптомы встречаются при самых разных бо лезнях, в связи с чем после I этапа диагностического поиска можно лишь наметить круг болезней, в который входит заболевание данного пациента (речь идет о так называемом методе дифференциальной диагностики, о чем более подробно, с описанием конкретных ситуаций будет сказано да лее). Диагноз в данном случае может быть поставлен лишь после получе ния информации на II или даже III этапе диагностического поиска;
в) жалобы больного и данные анамнеза нехарактерны ни для какого определенного заболевания. Это так называемые общие симптомы (ела бость, утомляемость, потеря массы тела, субфебрилитет и пр.). При такой ситуации сделать какие-либо диагностические заключения после I этапа не представляется возможным.
Второй этап диагностического поиска. При непосредственном обследовании выявляют симптомы, которые могут быть обусловлены самим заболеванием, реакцией органов и систем на имеющееся заболевание, проявлением осложнений болезни. Объем информации, получаемой на II этапе, колеблется в широких пределах: от почти патогномоничных признаков (например, данные аускультации при митральном или аортальном стенозе) до отсутствия патологических симптомов (например, у больного с язвенной болезнью желудка или двенадцатиперстной кишки в стадии ремиссии). В связи с этим необнаружение каких-либо изменений в органах и системах не означает, что все жалобы имеют неврогенное происхождение
или больной здоров. Вместе с тем отсутствие каких-либо патологических находок на II этапе диагностического поиска при вполне определенных диагностических выводах I этапа (типичные жалобы и анамнез болезни) может свидетельствовать о доброкачественном течении заболевания или о ремиссии.
После II этапа могут быть сделаны такие же выводы, как и после I этапа, однако их определенность будет значительно выше, так как заключение базируется на информации, полученной из двух источников. Таким образом, выводы после II этапа (с учетом выводов I этапа) могут быть следующими: а) диагноз можно сформулировать; б) круг заболеваний, очерченный после I этапа, существенно сужается; в) по-прежнему нет никакой определенной диагностической концепции, в связи с чем заключение о диагнозе будет отложено до III этапа. При получении сведений на I и II этапах диагностического поиска особенно важна роль личного контакта врача с больным.
Третий этап диагностического поиска. Завершив II этап диагностического поиска, врач должен спланировать проведение параклинических исследований (являющихся III этапом диагностического поиска). Конечно, целью III этапа диагностического поиска является верификация диагноза путем исключения синдромно сходных заболеваний и подтверждения (компьютерная томография, MP-томография, эндоскопические исследования и т.д.) приоритетной диагностической концепции.
При ряде заболеваний необходимы прижизненные морфологические исследования (биопсия почки, печени, стернальная пункция) для формулировки клинико-морфологического диагноза.
План обследования больного на III этапе диагностического поиска состоит из нескольких разделов.
• Обязательные исследования, проводимые всем без исключения больным.
• Исследования, необходимые для дифференциальной диагностики и уточнения диагноза (дополнительные исследования).
• Консультации специалистов (окулист, уролог и др.).
• К обязательным исследованиям относят следующие:
1) общий анализ крови,
2) общий анализ мочи,
3) общий анализ кала,
4) биохимический анализ крови (общий белок, сахар, холестерин, билирубин, креатинин),
5) реакция Вассермана,
6) ЭКГ,
7) рентгенологическое исследование органов грудной клетки.
• Объем дополнительных исследований определяется в каждой кон кретной диагностической ситуации. Так, у легочного больного к обязатель ным клиническим анализам добавляются общий анализ мокроты, при не обходимости микробиологический анализ (посев) мокроты, исследование чувствительности микрофлоры к антибиотикам. Определяется перечень не обходимых биохимических, ферментных, иммунологических и других ис следований, инструментальные манипуляции (бронхоскопия, функция внешнего дыхания, компьютерная томография, бронхоальвеолярный ла- важ).
Больным, у которых возможны кровотечения либо предстоит перевод в хирургический стационар для операции, определяют группу крови и резус- фактор, анализ на ВИЧ, изучают коагулограмму.
• Консультации специалистов проводят для исключения либо подтверждения тех или иных диагностических предположений. Всем женщинам, находящимся на обследовании в стационаре, необходима консультация гинеколога.
В трудных диагностических ситуациях приходится прибегать к повторным исследованиям (в динамике), к сложным исследованиям (МР-томо- графия, радиоизотопные методы и т.д.).
План обследования является своеобразным «стержнем», на котором базируется этапность исследований, в ряде ситуаций составляется календарный план обследования.
После III этапа диагностического поиска могут быть сделаны следующие выводы:
а) диагноз, поставленный (или предполагаемый) на предыдущих этапах диагностического поиска, полностью подтверждается;
б) неопределенная диагностическая концепция двух предыдущих этапов реализуется в четкий диагноз;
в) диагноз остается неясным, в связи с чем требуется диагностическое хирургическое вмешательство (например, пробная лапаротомия) или дли тельное динамическое наблюдение за больным с обязательным выполнени ем ряда лабораторно-инструментальных исследований.
Как же осуществляется сам процесс диагностики? Информация по мере ее получения «мысленно» обрабатывается уже с первого момента встречи с больным. Этот анализ информации осуществляется по определенным направлениям.
1. Насколько получаемые сведения, сообщаемые больным, являются свидетельством существования патологического процесса, т.е. отличаются от нормы.
2. Что означают полученные физикальные данные (например, смещение левой границы относительной тупости кнаружи от левой грудино-клю-чичной линии; сухие свистящие хрипы; приступы сжимающих болей за грудиной, возникающие при физической нагрузке и пр.).
3. Свидетельствуют ли полученные лабораторно-инструментальные данные о наличии какого-либо патологического процесса. Далее следует самое важное в диагностическом процессе: полученную информацию сравнивают с так называемыми эталонами болезней, их «образами», которые хранятся в памяти врача, учебнике и медицинской литературе.
Следовательно, процесс диагностики складывается из зримых действий врача и последовательного ряда интеллектуальных (мыслительных) действий. Эти мыслительные операции проводятся на каждом этапе получения информации.
Прежде чем полученная информация будет сравниваться с «эталонами» (образцами) болезней, ее следует соответствующим образом «препарировать», т.е. обработать. Как это делается?
1. Вначале выявляют доминирующие симптомы, т.е. любые признаки болезни, доступные определению. При этом не имеет значения, какой источник информации используется.
2. Далее осуществляется «сложение» выявленных симптомов в синдромы.
Напомним, что синдром — это совокупность симптомов, имеющих единый патогенез. Синдром следует отличать от симптомокомплекса, т.е. простой суммы симптомов, их неспецифической комбинации.
3. После того как выявлены симптомы и произошло объединение их в синдромы, оказывается возможным локализовать патологический процесс в какой-либо системе организма или отдельно взятом органе (например, в печени, сердечно-сосудистой системе, почке, системе кроветворения и пр.), при этом симптом лишь «указывает», где локализован патологический процесс и крайне редко говорит о существе патологического процесса; синдром позволяет определить (выяснить) патологоанатомическую и патофизиологическую сущность патологического процесса (например, воспаление на иммунной или бактериальной основе, расстройства кровообращения в той или иной сосудистой области, бронхиальную обструкцию и пр.). Нередко у одного больного имеется несколько синдромов (например, синдром дыхательной недостаточности, бронхиальной обструкции, легочной гипертензии). Выделение ведущего (ведущих) синдромов уже существенно приближает нас к нозологической диагностике, так как тот или иной синдром (или группа синдромов) свойствен весьма ограниченному кругу болезней.
Таким образом, выделяя симптомы и синдромы, мы постоянно (по мере получения информации) сравниваем их с «эталонами» болезней и смотрим, какому же заболеванию соответствует полученный при исследовании пациента «образ» болезни.
Все сказанное схематично можно представить следующим образом (схема
1).
В результате проведенного диагностического поиска могут возникнуть Схема 1. СИМПТОМЫ-СИНДРОМЫ-БОЛЕЗНЬ
Симптомы Симптомы Симптомы Симптомы Симптомы Симптомы
|
| Болезнь(болезни) |
две ситуации.
1. «Образ» болезни, выявленный у обследуемого пациента, полностью и совершенно безапелляционно соответствует какому-то определенному (одному) заболеванию. Это так называемый прямой диагноз, так бывает не слишком часто. Более характерна другая ситуация.
2. «Образ» болезни «похож» на два, три заболевания и более. Тогда очерчивается «круг» заболеваний, которые надо дифференцировать, т.е. в данной ситуации мы пользуемся методом дифференциальной диагностики (проводя анализ полученной информации, смотрим, какому из дифференцируемых заболеваний информация соответствует в наибольшей степени). Для постановки диагноза часто нужна дополнительная информация (получаемая с помощью использованных ранее методов исследования) или же необходимо динамическое наблюдение за больным, во время которого симптоматика становится более отчетливой. Длительность такого наблюдения различна — от нескольких дней до нескольких месяцев (реже — несколько лет). Так бывает обычно в начальном периоде («дебюте») болезни.
Следует помнить, что значение каждого этапа диагностического поиска при том или ином заболевании и у каждого конкретного больного' весьма различно. Например, при язвенной болезни двенадцатиперстной кишки после I этапа диагностическую концепцию в большинстве случаев уже можно сформулировать вполне определенно, и на последующих этапах она обычно не меняется. При ревматическом митральном пороке с резким преобладанием стеноза или при стенозе устья аорты диагностическая концепция становится четкой после II этапа диагностического поиска, который необходим, если даже на I этапе не удается получить сведения о ранее перенесенном полиартрите, не оставившем после себя никаких изменений в суставах. Наконец, в ряде случаев поставить диагноз можно лишь на
Схема 2. ЭТАПЫ ДИАГНОСТИЧЕСКОГО ПОИСКА
|
Прием «типизации» (сравнение полученных данных с хрестоматийным образом болезни)

|
Нет диагностической концепции Предварительное диагностическое
 Соответствие полученных Полученные данные соответствуют
данн ых конкретной болезни многим болезням
Соответствие полученных Полученные данные соответствуют
данн ых конкретной болезни многим болезням
|
{
Прием «мобилизации памяти»
Дифференциальный диагноз (различные диагностические версии)
| Неясность диагноза |
__________ 1_________
Дополнительные методы исследования, повторный сбор анамнеза и физикальных данных
Развернутый клинический диагноз
Динамическое наблюдение
Ill этапе диагностического поиска (гемобластозы, латентная форма хронического нефрита и пр.). Однако заранее нельзя знать, какой из этапов будет определяющим. Поэтому при обследовании больного необходимо вести диагностический поиск на всех трех этапах.
Развернутый клинический диагноз при различных заболеваниях строится практически по единому образцу и отражает следующее:
1) этиологию (если она известна);
2) клинический (клинико-морфологический) вариант болезни;
3) фазу (ремиссия—обострение);
4) стадию течения (начальная, развернутая, терминальная);
5) отдельные наиболее выраженные синдромы (результат вовлечения в патологический процесс различных органов и систем);
6) осложнения.
На схеме 2 представлены все этапы диагностического поиска.
Далее в учебнике будет продемонстрировано значение различных этапов диагностического поиска в распознавании тех или иных заболеваний, а также представлены принципы современной терапии, предусматривающие выбор адекватных методов.
Лечение больного с любым заболеванием предполагает проведение ряда мероприятий.
1. Нелекарственные методы лечения (соблюдение режима труда и быта, питания, ограничение в пище некоторых продуктов).
2. Лекарственная терапия, которая подразделяется на терапию в «полной дозе» (когда имеется «дебют болезни, ее развернутая стадия или обострение) и поддерживающую терапию (лекарства можно давать в меньшей дозе, но это необязательное условие, так как в ряде случаев дозы лекарственных препаратов не уменьшаются при поддерживающей терапии).
3. Физиотерапевтическое лечение.
4. Санаторно-курортное лечение.
Естественно, у различных больных «набор» лечебных мероприятий может значительно различаться, но всегда надо помнить, что назначением одних только лекарств лечение не ограничивается.
Названия болезней, методов исследования и реакций приводятся сокращенно — в виде аббревиатур (см. Список сокращений).
Глава I
Болезни органов дыхания
Содержание
Пневмонии...........................................................
Бронхоэктатическая болезнь ..............................
Хронический бронхит.........................................
Хроническая обструктивная болезнь легких ....
Бронхиальная астма.............................................
Плеврит................................................................
Легочное сердце...................................................
Контрольные вопросы и задачи
Пневмонии
ПНЕВМОНИЯ (Пи) — острое инфекционное поражение нижних отделов дыхательных путей, подтвержденное рентгенологически, доминирующее в картине болезни и не связанное с другими известными причинами.
В определении Пн подчеркивается острый характер воспаления, поэтому нет необходимости употреблять термин «острая пневмония» (в Международной классификации болезней, принятой Всемирной организацией здравоохранения, рубрика «острая пневмония» отсутствует).
В зависимости от эпидемиологической обстановки заболеваемость Пн в России колеблется от 3—5 до 10—14 на 1000 населения.
Классификация. До последнего времени в нашей стране пользовались классификацией острой пневмонии (ОП), предложенной Е.В. Гембицким и соавт. (1983), являющейся модификацией классификации, разработанной Н.С. Молчановым (1962) и утвержденной XV Всесоюзным съездом терапевтов. В этой классификации выделяют следующие рубрики. Этиология: 1) бактериальные (с указанием возбудителя); 2) вирусные (с указанием возбудителя); 3) орнитозные; 4) риккетсиозные; 5) мико- плазменные; 6) грибковые (с указанием вида); 7) смешанные; 8) аллергические, инфекционно-аллергические; 9) неустановленной этиологии. Патогенез: 1) первичные; 2) вторичные.
Клинико-морфологическая характеристика: 1) паренхиматозные — кру- позшле, очаговые; 2) интерстициальные.
| 16 40 44 56 66 85 94 102 |
Локализация и протяженность: 1) односторонние; 2) двусторонние (1 и 2 с указанием протяженности).
Тяжесть: 1) крайне тяжелые; 2) тяжелые; 3) средней тяжести; 4) легкие и абортивные.
Течение: 1) острые; 2) затяжные.
Первичная ОП — самостоятельный острый воспалительный процесс преимущественно инфекционной этиологии. Вторичные ОП возникают как осложнение других болезней (болезни сердечно-сосудистой системы с нарушением кровообращения в малом круге кровообращения, хронические болезни почек, системы крови, обмена веществ, инфекционные болезни и пр.) или развиваются на фоне хронических заболеваний органов дыхания (опухоль, бронхоэктазы и пр.) и т.п.
Деление ОП на очаговую и крупозную правомочно лишь в отношении пневмококковой пневмонии.
Затяжным следует считать такое течение ОП, при котором в сроки до 4 нед не происходит полного ее разрешения.
К постановке диагноза интерстициальной Пи необходимо подходить с большой ответственностью. Такая осторожность обусловлена тем, что ин- терстициальные процессы в легком сопровождают большую группу как легочных, так и внелегочных заболеваний, что может способствовать гипердиагностике интерстициальной Пи.
Современное определение Пи подчеркивает инфекционный характер воспалительного процесса и таким образом исключает из группы Пи легочные воспаления другого происхождения (иммунные, токсические, аллергические, эозинофильные и др.), для которых (во избежание терминологической путаницы) целесообразно использовать термин «пнев- монит».
В связи с необходимостью проведения ранней этиотропной терапии Пи и невозможностью в большинстве случаев своевременно верифицировать ее возбудитель Европейским респираторным обществом (1993) предложена рабочая группировка Пи, основанная на клинико-патогенетическом принципе с учетом эпидемической ситуации и факторов риска. I. Внебольнично приобретенная пневмония.
П. Внутрибольнично приобретенная (госпитальная или нозокомиаль-ная) пневмония.
III. Пневмония при иммунодефицитных состояниях.
IV. Аспирационная пневмония.
Такая группировка клинических форм Пи позволяет выделить определенный спектр возбудителей, характерный для каждой формы заболевания. Это дает возможность более целенаправленно осуществлять эмпирический выбор антибиотиков на начальном этапе лечения Пи.
Из рабочей группировки в последние годы в ранее существующем понимании исключена атипичная Пи как пневмония, вызванная атипичными возбудителями и имеющая атипичную клиническую картину заболевания. Этим термином (атипичная пневмония) в России в настоящее время обозначают «тяжелый острый респираторный синдром — ТОРС».
Внебольничная Пн — острое заболевание, возникшее во внебольнич-ных условиях, относится к самым распространенным формам Пн и имеет наиболее характерную клиническую картину. По-прежнему Пн, которые возникают в замкнутых молодежных коллективах (школьники, студенты, солдаты) и часто носят характер эпидемической вспышки, протекают с атипичной симптоматикой.
К внутрибольничным (нозокомиальным) относят те Пн, которые развились в течение 48—72 ч и более после поступления больного в стационар по поводу другого заболевания.
2-971 ™v7 ?/ £„ аЮл™% № фоне тмененного иммунного статуса, встреча-™ I 50ЛЬНЫХ СПИДом, у лиц, получающих иммуносупрессивную тера-"™ 'У' ольны* с системными заболеваниями, относятся к категории Пн при иммунодефицитных состояниях.
Аспирационная пневмония встречается наиболее часто у лиц, страдающих алкоголизмом и наркоманией, реже - после наркоза
Этиология. Подавляющее большинство Пн, вызванных микроорганизмами, - это самостоятельные заболевания; реже встречаются Пн как проявление острого инфекционного заболевания.
При внебольничных Пн в 80-90 % случаев возбудителями являются Streptococcus pneumoniae, Haemophilus influenzae, Mycoplasma pneumoniae, Moraxella catarrhalis. Среди наиболее распространенных возбудителей Пн по- прежнему главным остается пневмококк. Реже возбудителем Пн являются Chlamydia psittaci, клебсиелла (палочка Фридлендера).
Для внутрибольничных (нозокомиальных) Пн характерно большое разнообразие этиологических агентов, включающих грамотрицательную флору (энтеробактерии, синегнойная палочка, ацинетобактер), золотистый стафилококк и анаэробы.
Пн у больных с иммунодефицитом, помимо пневмококков и грамотри- цательных палочек, часто вызывают Pneumocystis carinii, вирусы, в том числе цитомегаловирусы, считающиеся маркерами ВИЧ-инфекции,' грибы, Nocardia spp., микобактерии. Если у таких больных при исследовании крови отмечается нейтропения, то возбудителями чаще всего выступают Staphylococcus aureus, Escherichia coli, Pseudomonas aeruginosa, нередко приводящие к септическому течению заболевания.
Так как основной причиной аспирационной Пн является попадание в дыхательные пути микрофлоры ротоглотки или желудка, основными возбудителями являются анаэробные бактерии, грамотрицательная микрофлора и Staphylococcus aureus, находящиеся в носоглотке.
Основными возбудителями атипично протекающих Пн являются Mycoplasma pneumoniae, Chlamydia pneumoniae, Chlamydia psittaci, Legionella pneumophyla, Coxiella burnetti.
САОвС°?Гт7ь ТОРС относится к группе Coronaviras, маркированный как SAKS-CoV. Источником его являются животные (кошки, собаки), заболевание передается от человека к человеку.
В период эпидемии гриппа возрастает роль вирусно-бактериальных ассоциаций (чаще всего встречаются стафилококки), а также условно-пато- генных микроорганизмов. При вирусно-бактериальных Пн респираторные вирусы играют этиологическую роль лишь в начальном периоде болезни: основным этиологическим фактором, определяющим клиническую картину, тяжесть течения и исход Пн, остается бактериальная флора.
Патогенез. В патогенезе Пн основная роль принадлежит воздействию инфекционного возбудителя, попадающего в легкие извне. Чаще всего микрофлора попадает в респираторные отделы легких через бронхи: инга- ляционно (вместе с вдыхаемым воздухом) и аспирационно (из носо- или ротоглотки). Бронхогенный путь заражения является основным при первичных Пн.
Гематогенным путем возбудитель попадает в легкие преимущественно при вторичных Пн, развивающихся как осложнение при сепсисе и общеинфекционных заболеваниях, а также при тромботическом генезе Пн. Лимфогенное распространение инфекции с возникновением Пн наблюдается лишь при ранениях в грудную клетку. 18
Имеется также эндогенный механизм развития воспаления в легочной ткани, обусловленный активацией микрофлоры, находящейся в легких. Роть его велика особенно при внутрибольничных Пн.
Начальным звеном развития воспаления легких является адгезия мик- организмов к поверхности эпителиальных клеток бронхиального дерева (схема 3), чему значительно способствуют предшествующая дисфункция реснитчатого мерцательного эпителия и нарушение мукоцилиарного клиренса. Следующим после адгезии этапом развития воспаления является колонизация микроорганизма в эпителиальных клетках. Повреждение мембраны этих клеток способствует интенсивной выработке биологически активных веществ—цитокинов (интерлейкины 1,8, 12 и др.).
Схема 3. ПАТОГЕНЕЗ ПНЕВМОНИИ
Этиологические факторы
(инфекционные возбудители)
Адгезия к эпителиальным клеткам
Способствующие факторы
Колонизация эпителиальных клеток Выброс эндо- и экзотоксиновТаблица 7. Классификация легочного сердца
| Характер течения |
| Состояние компенсации |
| Преимущественный патогенез |
| Клиническая картина |
Острое ЛС (развитие в
течение не-
riffl ТТТ.1^Т.Г5Г 1ГЯ-
сов, дней)
Подострое Л С (развитие в течение нескольких недель, месяцев)
Хроническое Л С (развитие r течение ряда лет)
Декомпенси-
Компенсиро- ванное Лекомпенси- рованное
Компенсированное Лекомпенси- рованное по пратюжетту-
Дочковому
Васкулярный Бронхолегоч- ный Васкулярный Бронхолегоч- ныйХРОНИЧЕСКИЕ НЕСПЕЦИФИЧЕСКИЕ ЗАБОЛЕВАНИЯ ЛЕГКИХ
Повышение давления в бронхиолах и альвеолах Артериальная гилоксемия Снижение Рог и повышение Ffcoj в альвеолярном воздухе … Сужение артериолЛЕГОЧНАЯ ГИПЕРТЕНЗИЯ
Нарушение метаболизма миокарда правого желудочка ПЕРВИЧНОЕ ПОРАЖЕНИЕ СОСУДОВ ЛЕГКИХ ЛЕГОЧНОЕ СЕРДЦЕ (КОМПЕНСИРОВАННОЕ)Болезни органов кровообращения
Содержание
Ревматизм (ревматическая лихорадка)................................. 105
Инфекционный эндокардит....................................................... 116
Миокардит................................................................................. 128
Перикардит........................................................................... 136
Нарушения сердечного ритма и проводимости. —
Проф. А.В. Недоступ, канд. мед. наук О.В. Благова 146
Экстрасистолия............................................................. 148
Пароксизмальная тахикардия............................................ 154
Мерцательная аритмия...................................................... 159
Атриовентрикулярная блокада......................................... 166
Синдром слабости синусового узла................................. 170
Приобретенные пороки сердца............................................ 174
Пороки митрального клапана...................................... 175
Пороки аортального клапана....................................... 187
Пороки трехстворчатого клапана................................ 198
Кардиомиопатии................................................................... 203
Дилатационная кардиомиопатия....................................... 203
Гипертрофическая кардиомиопатия.................................. 206
Рестриктивная кардиомиопатия........................................ 211
Нейроциркуляторная дистония................................................. 213
Гипертоническая болезнь.......................................................... 222
Симптоматическая артериальная гипертония ... 241
Ишемическая болезнь сердца.................................................... 250
Стенокардия....................................................................... 251
Острый коронарный синдром........................................... 262
Инфаркт миокарда. — Проф. В.А. Сулимое . . 265
Сердечная недостаточность...................................................... 276
Контрольные вопросы и задачи.................................... 287
Ревматизм (ревматическая лихорадка)
РЕВМАТИЗМ (РЕВМАТИЧЕСКАЯ ЛИХОРАДКА) - системное воспалительное заболевание соединительной ткани с преимущественной локализацией процесса в сердечно-сосудистой системе, развивающееся у предрасположенных к нему лиц, главным образом молодого возраста, в связи с инфекцией (3-гемолитическим стрептококком группы А.
Это определение болезни [Насонова В.А., 1989] подчеркивает:
• преимущественное поражение сердечно-сосудистой системы;
• роль патологической наследственности;
• значение стрептококковой инфекции.
Сущность болезни заключается в поражении всех оболочек сердца, но главным образом миокарда и эндокарда с возникновением деформации клапанного аппарата — порока сердца и последующим развитием сердечной недостаточности. Поражение других органов и систем при ревматизме имеет второстепенное значение и не определяет его тяжести и прогноза.
Пик заболеваемости приходится на детский и юношеский возраст (5—15 лет) и не зависит от пола. Первичная атака ревматизма может быть у лиц в возрасте 20—30 лет, однако после 30 лет первичный ревматизм практически не встречается. После 40 лет ревматизмом не заболевают. Тем не менее можно встретить больного и старше 60 лет, страдающего ревматическим пороком сердца, однако из этого не следует, что он заболел впервые в этом возрасте; ревматическая атака у него была в молодом возрасте.
Этиология. Отмечено, что заболевшие ревматизмом незадолго до начала болезни перенесли ангину, обострение хронического тонзиллита, а в крови у них определялось повышенное количество стрептококкового антигена и противострептококковых антител. Такая связь с предшествующей стрептококковой инфекцией особенно выражена при остром течении ревматизма, сопровождающемся полиартритом.
В развитии ревматизма имеют значение социальные факторы (неблагоприятные бытовые условия, недостаточное питание), а также генетическая предрасположенность (хорошо известно существование «ревматических» семей), которая заключается в гипериммунном ответе на антигены стрептококка, склонности заболевших к аутоиммунным и иммунокомплексным процессам.
Патогенез. В ответ на попадание в организм стрептококковой инфекции вырабатываются противострептококковые антитела и образуются иммунные комплексы (антигены стрептококка + антитела к ним + комплемент), циркулирующие в крови и оседающие в микроциркуляторном русле. Повреждающее действие на миокард и соединительную ткань оказывают также токсины и ферменты стрептококка (схема 8).
Вследствие генетически обусловленного дефекта иммунной системы из организма больных недостаточно полно и быстро элиминируются стрептококковые антигены и иммунные комплексы. Ткани таких больных обладают повышенной склонностью фиксировать эти иммунные комплексы. Кроме того, важны перекрестно реагирующие антитела, которые, появляясь в ответ на присутствие антигенов стрептококка, способны реагировать с тканевыми, в том числе кардиальными антигенами организма. В ответ развивается воспаление на иммунной основе (по типу гиперчувствительности немедленного типа — ГНТ), при этом факторами, реализующими воспалительный процесс, являются лизосомные ферменты нейтрофилов, фагоцитирующих иммунные комплексы и разрушающихся при этом. Этот воспалительный процесс локализуется в соединительной ткани преимущественно сердечно-сосудистой системы и изменяет антигенные свойства ее и миокарда. В результате развиваются аутоиммунные процессы по типу гиперчувствительности замедленного типа (ГЗТ), и в крови больных обнаруживаются лимфоциты, реагирующие с миоцитами. Этим клеткам придают 106

|
Образование аутоантител к миокарду, соединительной ткани
ДЛИТЕЛЬНОЕ ИММУННОЕ ВОСПАЛЕНИЕ ПО ТИПУ ГЗТ С ОБРАЗОВАНИЕМ ГРАНУЛЕМ И СКЛЕРОЗА
большое значение в происхождении органных поражений (прежде всего сердца). В крови выявляются также противомиокардиальные антитела, но они имеют… Системный воспалительный процесс при ревматизме проявляется характерными… Другим морфологическим субстратом поражения сердца при ревмокардите является неспецифическая воспалительная реакция,…Таблица 10. Большие и малые критерии ревматизма
Кардит
Полиартрит
Хорея
| узелки |
Кольцевидная эритема Подкожные ревматические
Клинические:
артралгии лихорадка Лабораторные: острофазовые показатели (СОЭ, СРБ, лейкоцитоз)
Инструментальные: удлинение интервала Р—Q на ЭКГ признаки митральной или аортальной ре-гургитации при допплер-ЭхоКГ
ревматизма Американской ассоциации кардиологов, пересмотр которых производился в 1992 г. (табл. 10).
Свидетельства связи со стрептококковой инфекцией:
повышенный титр противострептококковых антител (ACJI-0, АГ и др.),
недавно перенесенная скарлатина.
Сочетание двух больших или одного большого и двух малых критериев указывает на большую вероятность ревматизма лишь в случаях тщательно документированной предшествующей стрептококковой инфекции (недавно перенесенная скарлатина, высевание из носоглотки стрептококков группы А, повышенные титры противострептококковых антител — ACJI-0, АГ,
АСК).
При постепенном начале ревматизма имеет значение предложенная А.И. Нестеровым (1973) синдромная диагностика: клинико-эпидемио-логический синдром (связь со стрептококковой инфекцией); клинико-иммунологический синдром (признаки неполной реконвалесценции, артралгии, повышение титров противострептококковых антител, а также обнаружение диспротеинемии и острофазовых показателей); кардиоваску-лярный синдром (обнаружение кардита, а также экстракардиальных поражений).
Дифференциальная диагностика. Распознавание активного ревматического процесса у больных с ранее сформировавшимся пороком сердца не представляет особенных трудностей. Первичный ревматизм, протекающий без ярких клинических проявлений, весьма сходен с другими заболеваниями, что заставляет проводить дифференциальную диагностику, в первую очередь с иифекциоиио-аллергическим миокардитом.
Для первичного ревмокардита в отличие от инфекционно-аллергиче-ского миокардита характерны:
а) связь заболевания с носоглоточной стрептококковой инфекцией;
б) латентный период в 1—3 нед от окончания предшествующей инфек ции до первых клинических проявлений ревматизма;
в) преимущественное возникновение болезни в детском и юношеском возрасте;
г) обнаружение полиартрита или острых артралгии как начальных про шений болезни;
Д) отсутствие «кардиальных» жалоб или их констатация лишь при целе- Направленном сборе анамнеза;
") частое выявление объективных симптомов поражения сердца;
ж) четкая корреляция выраженности клинических проявлений ревматиз-
а с лабораторными показателями активности ревматического процесса.
При ревмокардите отсутствует хронологическая связь с нестрептококковыми инфекциями, стрессовыми воздействиями; латентный период всегда присутствует и не укорочен. Инфекционно-аллергический миокардит отмечается у лиц молодого, среднего, пожилого возраста; характеризуется постепенным началом, отсутствием суставного синдрома в начале болезни- лабораторные признаки активности могут отсутствовать при наличии выраженных признаков кардита; отмечаются астенизация и вегетативная дисфункция.
Первичный ревмокардит следует дифференцировать от так называемых функциональных заболеваний сердца (см. «Нейроциркуляторная дистония»). Общими для обоих заболеваний являются «кардиальные» жалобы, связь ухудшения состояния с перенесенной инфекцией, субфебрилитет, молодой возраст.
Углубленный анализ симптомов показывает, что при первичном ревмокардите в отличие от нейроциркуляторной дистонии нет связи начала болезни с разнообразными стрессорными воздействиями, отсутствуют ас- теноневротические «кардиальные» жалобы (ощущение остановки, замирания сердца), так называемый респираторный синдром (чувство нехватки воздуха, неудовлетворенность вдохом) и вегетативно-сосудистые кризы. В то же время при нейроциркуляторной дистонии отмечается длительный анамнез, и больные попадают в поле зрения врача во время очередного обострения болезни, при этом не выявляется признаков поражения миокарда (увеличение размеров, глухость I тона, систолический шум, трехчленный ритм в сочетании с тахикардией), нет и лабораторных острофазовых показателей, а также измененных иммунологических показателей. Эффект седативной терапии и применения (3-адреноблокаторов отчетливо выражен.
Если в клинической картине первичного ревматизма доминирует поражение суставов (выраженный полиартрит), то дифференциальную диагностику необходимо проводить с реактивными артритами (развивающимися в ответ на кишечную или урогенитальную неспецифическую инфекцию), а также с системной красной волчанкой. Основу отличия ревматизма от этих заболеваний составляют такие признаки, как эпидемиологический анамнез, частое сочетание полиартрита с поражением сердца, быстрая динамика клинической симптоматики под влиянием противоревматической терапии.
Распознавание активного ревматического процесса у больных с наличием сформированного порока сердца (возвратного ревмокардита) основывается на тех же диагностических критериях, однако данные физикального исследования сердца, инструментальные и рентгенологические показатели в гораздо большей степени будут обусловлены существующим пороком сердца, а не активным ревматическим процессом. Поэтому при диагностике рецидива ревматизма следует ориентироваться на связь ухудшения состояния больного (проявляется появлением или нарастанием симптомов сердечной недостаточности) с перенесенной инфекцией, наличием артрал-гий, субфебрильной температуры, лабораторных показателей активности ревматического процесса (острофазовых и иммунологических).
Возвратный (рецидивирующий) ревмокардит на фоне того или иного порока сердца при наличии недостаточности кровообращения следует дифференцировать от инфекционно-аллергического (неспецифического) миокардита тяжелого течения. Основным при этом является отсутствие «ревматического» анамнеза, признаков клапанного порока сердца и лабораторных показателей активности при миокардите. 114
формулировка развернутого клинического диагноза осуществляется в со- етствнн с классификацией и номенклатурой ревматизма и включает иедуюшие пункты: 1) наличие активности процесса (степень активности) ли
ремиссии; 2) характер поражения сердца; 3) наличие (отсутствие) потения других органов и систем; 4) характер течения; 5) состояние кровообращения.
Лечение. В настоящее время при ревматизме лечение проводится в 3 этапа: 1) лечение в активной фазе в стационаре; 2) продолжение лечения больного после выписки в кардиоревматологических кабинетах поликлиники; 3) последующее многолетнее диспансерное наблюдение и профилактическое лечение в поликлинике.
Лечебные мероприятия включают: а) борьбу со стрептококковой инфекцией; б) подавление активного ревматического процесса (воспаление на иммунной основе); в) коррекцию иммунологических нарушений.
На I этапе (стационарном) показано соблюдение постельного режима в течение 2—3 нед, питание с ограничением хлорида натрия (поваренной соли) и достаточным количеством полноценных белков (не менее 1—1,5 г на 1 кг массы тела).
Этиотропная терапия осуществляется пенициллином, оказывающим бактерицидное действие на гемолитические стрептококки группы А. Пенициллин назначают в дозе 1,5—4 млн ЕД в течение 10 дней. Вместо пенициллина можно использовать полисинтетические пенициллины (ампициллин, оксациллин и пр.). При индивидуальной непереносимости пеницил-линов применяют макролиды: спирамицин по 6 млн ME в два приема в течение 10 дней; азитромицин по 0,5 г 1 раз в течение 3 дней; рокситроми-цин по 0,3 г 2 раза в день в течение 10 дней.
Активный ревматический процесс купируют различными нестероидными противовоспалительными препаратами (НПВП). Преимущество отдается индометацину и диклофенаку — наиболее эффективным средствам, оказывающим наименее выраженное побочное действие. Суточная доза этих препаратов составляет 100 мг. Вместо них можно назначать ацетилсалициловую кислоту по 4—5 г/сут. Эти препараты следует принимать до полной ликвидации активности ревматического процесса.
При высокой активности (III степень), тяжелом первичном ревмокардите с признаками сердечной недостаточности (чаще встречается у лиц молодого возраста) или признаками полисерозита показаны глюкокортико-стероидные препараты (преднизолон 1—1,5 мг/кг). По достижении клинического эффекта (обычно через 2 нед) дозу постепенно снижают с последующим назначением НПВП.
При вяло текущем процессе больший эффект достигается от проведения иммуносупрессивной терапии (коррекция иммунного гомеостаза) с помощью аминохинолиновых производных гидроксихлорохина (плаквени-ла), хингамина (делагила). Эти препараты назначают по 0,2 и 0,25 г соответственно 1—2 раза в сутки в течение длительного времени (не менее 1 года). Спустя год доза может быть уменьшена вполовину. На II этапе (поликлиническом) лекарственная терапия должна продолжаться в дозах, с которыми больные были выписаны из стационара. Длительность приема противовоспалительных препаратов при остром течении 'оьгчно 1 мес, при подостром — 2 мес; как уже упоминалось выше, амино-Хинолиновые
препараты принимают длительно (1—2 года).
Поликлинический этап предусматривает также обязательную бицилли- Нопрофилактику в течение 5 лет после перенесенной атаки ревматизма в 4°зах 1 500 000 ЕД бициллина-5 каждые 3 нед.
В задачу III этапа входит пребывание детей и подростков в местнол ревматологическом санатории, а у взрослых — направление на реабилита. цию в кардиологический санатории.
При хроническом тонзиллите хирургическое лечение должно прово. диться только при неэффективности консервативного, а также в случаях если обострение тонзиллита приводит к рецидиву ревматизма.
Больным с сердечной недостаточностью проводится соответствующая терапия ингибиторами ангиотензинпревращающего фермента (ИАПФ) сердечными гликозидами, мочегонными средствами (см. «Сердечная не. достаточность»).
Больных ревматизмом ставят на диспансерный учет не только с целью проведения противорецидивной терапии, но и для своевременного обнару. жения рецидива, а при прогрессировании клапанного порока — для своевременного направления в кардиохирургическое учреждение.
Прогноз. Непосредственная угроза для жизни при ревматизме наблюдается крайне редко. Прогноз в основном определяется выраженностью порока сердца и состоянием сократительной функции миокарда.
Профилактика. Первичная профилактика состоит из комплекса общественных и индивидуальных мер, направленных на предупреждение первичной заболеваемости (повышение жизненного уровня, пропаганда здорового образа жизни, в частности закаливания, улучшение жилищных условий, борьба со скученностью в детских садах, школах, общественных учреждениях).
Важным является раннее и эффективное лечение ангин и других острых стрептококковых заболеваний верхних дыхательных путей. Это достигается назначением пенициллина в течение первых 2 сут по 1 500 ООО ЕД, на 2-е сутки вводят бициллин-5 по 1 500 ООО ЕД. При непереносимости пе- [ нициллина можно назначать эритромицин в течение 10 дней. Любое лечение ангины должно продолжаться не менее 10 дней, что приводит к полному излечению стрептококковой инфекции.
Профилактика рецидива ревматической лихорадки (вторичная профилактика) проводится в стационаре сразу после окончания 10-дневного лечения пенициллинами (макролидами). Классический парентеральный режим — это бензатина бензилпенициллин (ретарпен, экстенциллин) по 1,2—2,4 млн ЕД внутримышечно 1 раз в течение 3—4 нед. Чем меньше возраст больного при первой атаке, тем больше вероятность рецидива. После пятилетнего наблюдения частота рецидивов, как правило, снижается с возрастом. Больные без ревмокардита в период первых атак должны получать противорецидивную пофилактику минимум 5 лет после последней атаки, по крайней мере до 21 года. Больным, имевшим поражение сердца в период предыдущей атаки, профилактику проводят минимум до 40 лет и более. Больным, перенесшим операцию на сердце по поводу ревматического порока сердца, вторичная профилактика проводится пожизненно.
Инфекционный эндокардит
ИНФЕКЦИОННЫЙ ЭНДОКАРДИТ (ИЭ) - полипозно-язвенное поражение клапанного аппарата сердца или пристеночного эндокарда (реже эндотелия аорты или крупной артерии), вызванное различными патогенными микроорганизмами или грибами и сопровождающееся тромбоэмбо-лиями, а также системным поражением сосудов и внутренних органов на фоне измененной реактивности организма, па
Термин «инфекционный эндокардит» в настоящее время вытеснил page использовавшиеся термины «бактериальный эндокардит», «затяжной Оптический эндокардит», так как лучше отражает причину заболевания, зываемого самыми разными микроорганизмами — бактериальными Рентами, риккетсиями, вирусами и грибами. 3 Наиболее часто заболевают ИЭ лица в возрасте 20—50 лет, несколько аще мужчины, чем женщины. Однако особенностью «современного» ИЭ Лпляется высокая частота заболевания в пожилом и старческом возрасте ?более 20 % всех случаев). Другая особенность ИЭ в настоящее время — увеличение числа больных с первичной формой болезни (более 50 %), появление новых клинических вариантов течения, значительное изменение характера возбудителя.
Этиология. Среди вызывающих ИЭ возбудителей наиболее часто встречайся кокковая флора — стрептококки (зеленящий стрептококк ранее встречался в 90 % случаев), а также стафилококки (золотистый, белый), энтерококк. Значительно реже причиной болезни является грамотрицательная флора кишечная палочка, синегнойная палочка, протей, клебсиелла. В последние годы важную роль стали играть патогенные грибы, протей, сарцины, бруцеллы, вирусы. У ряда больных истинный возбудитель заболевания не обнаруживается (частота отрицательного результата посева крови колеблется в пределах 20—50 %). Обнаружение возбудителя зависит от многих факторов: качества бактериологического исследования, длительности предшествующей антибактериальной терапии, характера возбудителя.
Источники инфекции и бактериемии при ИЭ самые разные:
• Операции в полости рта.
• Операции и диагностические процедуры в мочеполовой сфере.
• «Малые» кожные инфекции.
• Оперативное вмешательство на сердечно-сосудистой системе (в том числе протезирование клапанов).
• Длительное пребывание катетера в вене.
• Частые внутривенные вливания и эндоскопические методы исследования.
• Хронический гемодиализ (артериовенозный шунт).
• Наркомания (внутривенное введение наркотиков).
ИЭ может развиться на интактных клапанах — так называемый первичный эндокардит, а также на фоне предсуществующих (врожденных и приобретенных) изменений сердца и его клапанного аппарата — так называемый вторичный ИЭ. К числу этих изменений можно отнести пороки сердца (врожденные и приобретенные), пролапс митрального клапана, арте- риовенозные аневризмы, постинфарктные аневризмы, шунты при хроническом гемодиализе, состояние после операции на сердце и крупных сосудах (включая протезирование клапанов, комиссуротомию, искусственные сосудистые шунты).
Имеет значение в развитии ИЭ и ряд медицинских манипуляций (оперативные вмешательства в полости рта, катетеризация мочевого пузыря, Ректороманоскопия, установка внутривенного катетера. Наконец, имеет Так>ке значение ряд состояний, сопровождающихся снижением иммунитета: сахарный диабет, токсикомания, в том числе алкоголизм), ВИЧ-инфек-л11я, лечение мощными иммунодепрессантами. В настоящее время приобрел большое значение «ИЭ наркоманов».
Патогенез. Механизм развития заболевания сложен и изучен недоста- °чно, однако основные моменты развития ИЭ не вызывают сомнения
Лсхема 9). При наличии в организме очага инфекции под влиянием различ-
ИНФЕКЦИОННЫЙ I ФАКТОР
| БАКТЕРИЕМИЯ |
ИЗМЕНЕНИЕ РЕАКТИВНОСТИ ОРГАНИЗМА И НАРУШЕНИЕ МЕСТНОГО ИММУНИТЕТА
ИЗМЕНЕНИЕ ИММУННОГО СТАТУСА
ПРЕДШЕСТВУЮЩИЕ
- J НАРУШЕНИЕ СВОЙСТВ КЛАПАНОВ СЕРДЦАМИОКАРДИТА
ЭТИОЛОГИЧЕСКИЕ ФАКТОРЫ
«Обнажение» антигенов миокарда ИММУННАЯ РЕАКЦИЯИММУННОЕ И НЕИММУННОЕ ВОСПАЛЕНИЕ МИОКАРДА
На I этапе диагностического поиска наибольшее значение имеет выявление субъективных ощущений и связи их с перенесенной инфекцией. Заболевание… Миокардит развивается спустя короткое время после инфекций ЩЩ интоксикаций,… Больные миокардитом наиболее часто предъявляют жалобы на болевые ощущения в области сердца. Существенный признак —…Пароксизмальная тахикардия
В основе развития суправентрикулярных (СВ) ПТ в большинстве случаев лежит механизм re-entry (синусовая, предсердная и АВ-узловая реци-прокные… Часть нормальных анатомических структур, которые участвуют в формировании… СВПТ в Уз—3А всех случаев развивается у людей с отсутствием другой патологии сердца. Возникновение СВПТ возможно при…Q6
. У больных митральным стенозом с высокой легочной гипертензией по левому краю грудины может выслушиваться диастолический шум относительной недостаточности клапана легочной артерии (шум Грехе-
Стилла), который может быть принят за шум аортальной недостаточности. Отличие заключается в отсутствии ослабления II тона во втором межреберье справа, резком усилении II тона во втором межреберье слева от грудины, наличии сопутствующего систолического шума (шум изгнания). Кроме того, при шуме Грехема—Стилла имеется яркая картина митрального стеноза, а при рентгенологическом исследовании выявляется аневризматическое расширение легочной артерии.
# Относительная аортальная недостаточность (не являющаяся поро ком сердца в истинном смысле слова) наблюдается при расширении ате- росклеротической аорты или высокой артериальной гипертонии. Она сопровождается усиленным II тоном во втором межреберье справа от гру дины.
• Гипердиагностика аортальной недостаточности основывается на переоценке диагностической значимости периферических («сосудистых») симптомов: пульс, артериальное давление, пульсация периферических артерий. Высокий скорый пульс, понижение диастолического давления, усиление пульсации периферических артерий наблюдаются при состояниях, характеризующихся увеличенным выбросом крови и снижением периферического сопротивления (анемия, тиреотоксикоз, лихорадочное состояние). Однако внимательная аускультация, не выявляющая типичного диастолического шума, позволяет отвергнуть предположение о пороке сердца.
Лечение. При сердечной недостаточности, развивающейся при пороке сердца, проводят лечение общепринятыми методами.
Пролонгированные нитраты, антагонисты ионов кальция (верапамил) назначают при выраженном сердечном болевом синдроме. При выраженном гиперкинетическом типе кровообращения (при условии достаточной сократительной функции миокарда) могут быть назначены небольшие дозы fS-адреноблокаторов, уменьшающих ощущение усиленной пульсации.
Замена пораженного клапана протезом показана больным с увеличенным левым желудочком (при наличии выраженных признаков его гипертрофии на ЭКГ), снижении диастолического давления ниже 40 мм рт. ст., даже если у таких больных нет субъективных ощущений.
Сочетание стеноза устья аорты и аортальной недостаточности. Многие больные со стенозом устья аорты имеют легкую, клинически не значимую недостаточность клапана аорты. В то же время у многих больных с аортальной регургитацией выявляется легкий, клинически малозначимый стеноз устья аорты. Однако при наличии значительного стеноза устья аорты и аортальной недостаточности определяются систолический градиент между левым желудочком и аортой, равный 25 мм рт. ст., и, кроме того, значительная регургитация через аортальный клапан в левый желудочек.
акое сочетанное поражение имеет течение, сходное с таковым при изолированном стенозе устья аорты.
У этих больных определяются типичный систолический шум и ранний Дластолический шум. Записанный графически пульс сонной артерии обыч-
Нормален в отличие от такового при изолированном стенозе устья аор- ы- При рентгенологическом и эхокардиографическом методах исследования может определяться кальцификация клапана. На ЭКГ обнаруживаются Ыраженные признаки гипертрофии левого желудочка, на эхокардиограм-Ме — признаки стеноза устья аорты.
Преобладание аортальной недостаточности при сочетанном поражении определяется на основании выраженности периферических сосудистых симптомов: снижения диастолического давления, высокого скорого пульса
Более точные сведения о преобладании того или иного поражения можно получить при измерении давления в аорте и левом желудочке и по данным ангиокардиографии. Исследования проводят в кардиохирургиЛ ском стационаре для решения вопроса о характере оперативного вмегца~ тельства.
Пороки трехстворчатого клапана
Среди пороков трехстворчатого (трикуспидального) клапана недостаточность диагностируется наиболее часто, однако в изолированном виде встречается крайне редко: обычно недостаточность трехстворчатого клапана сочетается с пороками митрального или аортального клапана.
Недостаточность трехстворчатого клапана. Различают органическую (клапанную) и относительную недостаточность трехстворчатого клапана.
При органической недостаточности выявляются морфологические изменения клапанного аппарата: створок, хорд, сосочковых мышц. Однако в отличие от пороков митрального и аортального клапанов обызвествление створок клапана и подклапанные сращения обычно отсутствуют.
Относительная недостаточность не проявляется морфологическими изменениями клапанов. Створки клапана не полностью перекрывают правое предсердно-желудочковое (атриовентрикулярное) отверстие, так как сухожильное кольцо (место прикрепления створок клапана) резко растянуто. Это наблюдается при значительном расширении правого желудочка и увеличении его полости у больных с правожелудочковой недостаточностью.
Этиология. Наиболее частая причина трикуспидальной недостаточности — ревматизм, значительно реже — инфекционный эндокардит. Врожденная недостаточность трехстворчатого клапана в изолированном виде не встречается и обычно комбинируется с другими аномалиями клапанного аппарата.
Патогенез. Во время систолы правого желудочка возникает обратный ток крови из его полости в правое предсердие. Эта кровь вместе с кровью, поступающей из полых вен и коронарного синуса, переполняет правое предсердие, вызывая его дилатацию. В период систолы предсердий увеличенный объем крови поступает в правый желудочек, обусловливая его дальнейшие дилатацию и гипертрофию. В правое предсердие впадают полые вены, поэтому застой крови в его полости сразу передается на систему полых вен. При резко выраженной слабости правого предсердия (мерцательная аритмия) оно представляет вместе с полыми венами как бы один резервуар, растягивающийся при систоле желудочков, а во время диастолы опорожняющийся частично.
Снижение сократительной функции правого желудочка приводит к ре3" кому уменьшению количества крови, поступающей в легочную артерию, тем самым уменьшая застой крови в сосудах малого круга, обычно обусловленный декомпенсированным митральным или аортальным пороком сердца. Недостаточность трехстворчатого клапана способствует прогресси- рованию признаков застоя в большом круге кровообращения.
Клиническая картина. Проявления трикуспидальной недостаточности зависят от наличия клапанных признаков порока, обусловленных ретро-
Qx
гоадным током крови из желудочка в предсердие, а также симптомов застоя в большом круге кровообращения.
На I этапе диагностического поиска жалобы больных нехарактерны ш% данного порока. Они связаны с основным пороком сердца (митральным или аортальным) и значительным застоем в большом и малом круге кровообращения. Больные жалуются на одышку, однако умеренную, так как застой в малом круге с появлением трикуспидальной недостаточности уменьшается, а часть крови депонируется в правых отделах сердца и печени. Физическая активность больных ограничена в основном не уси-тением одышки, а резкой слабостью. Нередки боли в правом подреберье и эпигастрии, тошнота, снижение аппетита. Присоединение асцита обусловливает чувство тяжести и боли по всему животу. Таким образом, на I этапе можно составить представление лишь о выраженных расстройствах кровообращения.
На II этапе можно выявить прямые («клапанные») признаки порока: систолический шум, наиболее четко выслушиваемый у мечевидного отростка грудины. Он резко усиливается при выслушивании на высоте вдоха с задержкой дыхания, что объясняется увеличением объема регургитации и ускорением кровотока через прямые отделы сердца. Регургитация крови в правое предсердие обусловливает появление положительного венного пульса и систолической пульсации печени. Кроме этих симптомов, обязательно определяются прямые и косвенные признаки основного порока сердца, на фоне которого развилась трикуспидальная недостаточность. Пульс, артериальное давление в пределах физиологической нормы. Венозное давление, как правило, значительно повышено. Внешний вид больного определяется наличием выраженной недостаточности кровообращения. При длительно существующей трикуспидальной недостаточности и развитии гепатомегалии возможно появление небольшой желтуш-ности кожных покровов.
Таким образом, на II этапе можно поставить диагноз трикуспидальной недостаточности, а также диагноз основного порока сердца.
На III этапе диагностического поиска подтверждаются прямые и косвенные признаки митрального или аортального порока сердца. Сам порок трехстворчатого клапана также вносит «долю» в результаты инструментальных исследований. Рентгенологически обнаруживаются значительное увеличение правого желудочка и правого предсердия, расширение верхней полой вены. Застой в малом круге кровообращения может быть выражен нерезко. На ЭКГ появляются признаки значительной дилатации правого желудочка в виде полифазного комплекса rSr' в отведении Vi и глубокого зубца S в последующих грудных отведениях. На ФКГ с мечевидного отростка регистрируется систолический шум, начинающийся сразу после I тона.
Эхокардиограмма выявляет различной степени увеличение правого желудочка, а допплерография — выраженность регургитации.
Флебография (кривая пульса яремной вены) позволяет обнаружить высокую волну а в пресистоле, если сохраняется синусовый ритм.
Диагностика. Диагноз недостаточности трехстворчатого клапана осно- Ывается на обнаружении систолического шума у основания мечевидного отростка (с усилением на высоте вдоха), положительного венного пульса, методической пульсации печени. Такие симптомы, как увеличение право-о желудочка и правого предсердия (на рентгенограмме), синдром гипер-Рофии правого желудочка на ЭКГ, повышение венозного давления, непа- Огномоничны для порока и могут наблюдаться и при его отсутствии.
Следует признать характерным для данного порока такое сочетание симптомов, как заметное увеличение правых отделов сердца и отсутствие значительного застоя в малом круге.
Некоторые симптомы могут отсутствовать (положительный венный пульс, систолическая пульсация печени). В этих случаях единственным надежным признаком порока является характерный систолический шум.
При распознавании трикуспидальной недостаточности вызывает определенные затруднения дифференциация органической и относительной ее форм.
• Относительная недостаточность выявляется у больных с митраль ным стенозом и высокой легочной гипертензией. Если митральный стеноз не сопровождается высокой легочной гипертензией, то трикуспидальная недостаточность чаще является органической. Имеет значение динамика систолического шума у мечевидного отростка во время лечения. Усиление шума при улучшении состояния больного может свидетельствовать об ор ганическом поражении клапана, а ослабление шума, сочетающееся с улуч шением состояния больного, — об относительной недостаточности. Счита ется также, что более громкий и грубый шум скорее обусловлен органиче ским поражением клапана.
Трикуспидальная недостаточность, выявляемая у больных с митральным или аортальным пороком при значительном увеличении сердца, симптомах выраженной правожелудочковой недостаточности, мерцательной аритмии, чаще всего является относительной.
• Трикуспидальную недостаточность иногда приходится дифференцировать от слипчивого перикардита, при котором наблюдается выраженный застой в большом круге кровообращения. Однако слипчивый перикардит почти никогда не сочетается с пороками других клапанов, ау-скультативная симптоматика бедная, сердце не так увеличено, как при пороках. Поставить правильный диагноз помогают данные рентгенографии, обнаруживающей обызвествление листков перикарда, и рентгеноки-мографии, выявляющей отсутствие пульсации по тому или иному контуру сердца.
• При «чистом» митральном стенозе над верхушкой сердца может выслушиваться систолический шум, обусловленный относительной трикуспидальной недостаточностью. Эта ситуация возникает вследствие того, что при выраженной гипертрофии правого желудочка всю переднюю поверхность сердца образует именно этот отдел, а левый желудочек смещается назад. В результате такой ротации сердца смещаются точки наилучшего выслушивания клапанов: митрального — к средней или задней подмышечной линии, трехстворчатого — к левой срединно-ключичной линии. В подобных случаях систолический шум дифференцируют от шума при недостаточности митрального клапана: при относительной трикуспидальной недостаточности шум усиливается на высоте вдоха, а при митральной недостаточности — на высоте выдоха в положении больного на левом боку.
Лечение. Больным с трикуспидальной недостаточностью проводят лечение согласно общим принципам терапии недостаточности кровообращения. Назначают мочегонные и особенно антагонисты альдостерона — спй- ронолактон (верошпирон, альдактон).
Стеноз правого атриовентрикулярного отверстия (трикуспидальныи стеноз) — патологическое состояние, характеризующееся уменьшениел площади правого атриовентрикулярного отверстия, что создает препятствие движению крови из правого предсердия в правый желудочек. ИзолирО' адно трикуспидальный стеноз не встречается, он всегда сочетается с полками других клапанов.
Р Этиология. Наиболее частая причина трикуспидального стеноза — ревматизм. Врожденное поражение встречается крайне редко и всегда сочетайся с другими аномалиями клапанов и перегородок сердца. 6 Патогенез. Вследствие неполного опорожнения правого предсердия че-ез суженное отверстие при нормальном притоке крови из полых вен объ-лм крови в правом предсердии возрастает, давление также увеличивается. В результате возрастает градиент давления «правое предсердие — правый еЛудОчек», что способствует прохождению крови через суженное атрио-вентрикулярное отверстие в начале диастолы желудочков.
Расширение предсердия вызывает более сильное его сокращение и увеличение тока крови в правый желудочек в конце диастолы. Расширение правого предсердия сочетается с гипертрофией его стенки, однако эти компенсаторные механизмы несовершенны и кратковременны. С увеличением давления в правом предсердии повышается давление во всей венозной системе: рано увеличивается печень, появляется асцит, в дальнейшем развивается фиброз печени.
Клиническая картина. Проявления трикуспидального стеноза зависят от наличия клапанных признаков порока, обусловленных нарушением функции трикуспидального клапана, признаков дилатации правого предсердия, а также симптомов застоя в большом круге кровообращения.
На I этапе диагностического поиска жалобы не являются характерными для данного порока, так как они связаны с основным пороком (митральным или аортальным) и значительным застоем в большом круге кровообращения. Больные жалуются на быструю утомляемость и тяжесть или боли в правом подреберье, вызванные увеличенной печенью. Для трикуспидального стеноза характерно отсутствие жалоб, обусловленных застоем кровообращения в малом круге (одышка, кровохарканье, приступы отека легких), так как в правый желудочек и соответственно в легочную артерию попадает мало крови.
Таким образом, на I этапе можно составить представление лишь о выраженных расстройствах кровообращения.
На II этапе диагностического поиска можно выявить прямые («клапанные») признаки порока: диастолический шум у мечевидного отростка или у места прикрепления V ребра к грудине слева. Шум этот появляется или усиливается при задержке дыхания на высоте вдоха, что нехарактерно для диастолического шума, обусловленного митральным стенозом. На высоте вдоха часто появляется тон открытия трехстворчатого клапана (тон открытия митрального клапана не зависит от фазы дыхания и никогда не появляется на высоте вдоха, если отсутствует на высоте выдоха). Диастолический шум при синусовом ритме занимает преимущественно конец диастолы (пресистоличе- ский щум), а при мерцательной аритмии — начало диастолы (протодиасто- лический шум). Все эти признаки позволяют дифференцировать аускульта- Ивную картину при трикуспидальном и митральном стенозе.
Застой крови в правом предсердии обусловливает раннее увеличение ечени, набухание шейных вен, отеки. Отмечается выраженный пресисто- Ический венный пульс на яремных венах, а также пресистолический печенный пульс. Граница относительной тупости сердца резко смещена Право. Кроме этих признаков, обязательно выявляются прямые и косвен-ie симптомы «основного» порока сердца, на фоне которого развился три- Успидальный стеноз. Пульс, артериальное давление без особенностей. Верное давление, как правило, значительно повышено. При длительном существовании трикусиидального порока и развитии гепатомегалии возможно появление небольшой желтушности кожных покровов.
Таким образом, на II этапе можно поставить диагноз трикусиидального стеноза, а также диагноз основного порока сердца.
На III этапе диагностического поиска подтверждаются прямые и косвенные признаки митрального или аортального порока сердца. Сам три- куспидальный стеноз вносит «долю» в результаты инструментального исследования. Рентгенологически выявляется значительное увеличение правого предсердия, верхней полой вены, в то время как правый желудочек увеличен значительно меньше, чем при трикуспидальной недостаточности Признаки легочной гипертензии отсутствуют.
На ЭКГ при сохраненном синусовом ритме отмечается высокий острый зубец С в отведениях II, III, aVF и правых грудных. Изменения желудочкового комплекса обусловлены особенностями компенсаторной гипертрофии вследствие основного порока сердца. На ФКГ регистрируется высокочастотный убывающий диастолический шум (иногда с пресистолическим усилением) у мечевидного отростка или в месте прикрепления V ребра к грудине. Иногда в этой же области регистрируется тон открытия трехстворчатого клапана.
Эхокардиография помогает выявить диагностически важный признак — конкордантное движение створок трехстворчатого клапана в диастолу (этот признак обнаруживается нечасто в связи с трудностью визуализации задней створки клапана). Чаще отмечается резкое уменьшение скорости движения передней створки в фазу диастолы.
Диагностика. Распознавание порока основывается на обнаружении диастолического шума у мечевидного отростка, усиливающегося на высоте вдоха, часто в сочетании с там же выявляемым тоном открытия трехстворчатого клапана. При наличии синусового ритма диагноз подтверждается пресистолической пульсацией яремных вен и увеличенной печени. Другие симптомы: увеличение правого предсердия, измененные зубцы С во II, III, aVF и правых грудных отведениях, повышение венозного давления, увеличение печени, отеки непатогномоничны для порока.
Лечение. Наличие трикуспидального стеноза является показанием для имплантации искусственного клапана. Если по каким-либо причинам оперативное лечение не производится, следует использовать достаточные дозы мочегонных средств и антагонистов альдостерона — спиронолактона (ве- рошпирон, альдактон).
Прогноз. Прогноз определяется типом клапанного дефекта и его выраженностью, а также развивающейся недостаточностью кровообращения. При нерезко выраженном пороке сердца и отсутствии (или незначительно выраженной) недостаточности кроовообращения прогноз вполне удовлетворителен, больной длительное время трудоспособен. Существенно ухудшается прогноз при выраженных изменениях клапана и нарастающей недостаточности кровообращения, а также возникающих осложнениях, особенно нарушениях ритма сердца. После внедрения оперативных методов лечения (митральная комиссуротомия, протезирование клапана) прогноз улучшился, так как при своевременной и адекватно выполненной операции восстанавливаются гемодинамические характеристики, как внутрисердечные, так и внесердечные. Больные с пороком сердца (в том числе и после операции на сердце) подлежат диспансерному наблюД6' нию.
Профилактика. Предупреждение приобретенных пороков сердца сводится к первичной и вторичной профилактике ревматизма.
Кардиомиопатии
Термином «КАРДИОМИОПАТИИ» называют первичные изолированные поражения сердечной мышцы неопределенной этиологии, характери- нтоШиеся развитием выраженной дилатации различных камер сердца, гипер- Лофии миокарда либо нарушением расслабления (диастолической функций)- В финальной стадии болезни развиваются тяжелая застойная сердечная недостаточность и сложные нарушения сердечного ритма и проводимости.
В 1995 г. ВОЗ предложила классификацию кардиомиопатии. Согласно данной классификации, выделяются кардиомиопатии на основе их функциональной характеристики («функциональная классификация»), к которым относятся:
1) дилатационная;
2) гипертрофическая;
3) рестриктивная;
Это истинные формы кардиомиопатии (с неизвестной или малоизвестной этиологией), различающиеся патоморфологически, характером расстройств гемодинамики и клиническими проявлениями.
Кроме того, предложено выделять так называемые специфические формы кардиомиопатии, к которым относятся:
• ишемическая кардиомиопатия (следствие ИБС);
• кардиомипатия вследствие клапанных пороков сердца;
• гипертоническая кардиомиопатия;
• воспалительная кардиомиопатия (по существу в данном случае речь идет о неревматическом миокардите);
• метаболические кардиомиопатии (эндокринные, амилоидоз, глико- геноз и др.);
• генерализованные системные заболевания (диффузные заболевания соединительной ткани);
• аллергические и токсические реакции;
• нейромышечные изменения и мышечные дистрофии.
По существу так называемые специфические кардиомиопатии — проявление поражения миокарда при конкретных заболеваниях, которые являются частью этих заболеваний. Их можно рассматривать (кроме ишемиче-ской кардиомиопатии) как некоронарогенные поражения миокарда известной этиологии. Ишемическая кардиомиопатия — поражение сердца при различных вариантах ИБС, что также позволяет говорить о конкретной этиологии. В то же время «функциональная классификация» предполагает поражения миокарда неизвестной (или, быть может, предполагаемой) этиологии, что и будет рассмотрено ниже.
Дилатационная кардиомиопатия
Дилатационная кардиомиопатия (ДКМП) характеризуется диффузным расширением камер сердца, преимущественно левого желудочка, в сочетании с необязательным умеренным развитием гипертрофии миокарда.
Болезнь чаще встречается у мужчин среднего возраста во всех географических зонах, при этом возможные этиологические факторы (если выявится) М0ГУт быть весьма различными. Так, ДКМП может развиваться осле вирусной инфекции (является исходом вирусного миокардита при-еРно в 15 % случаев) или же после родов (так называемая послеродовая аРДИомиопатия). В числе возможных причин указывают на роль алкоголя, дефицит в пище селена и недостаточное усвоение карнитина. В 20—25 % случаев заболевание носит семейный характер (генетические нарушения) причем в этих случаях течение болезни наиболее неблагоприятное. Однако в большинстве случаев причину развития ДКМП выявить не удается.
Патогенез. Расстройства гемодинамики обусловлены снижением сократительной функции миокарда (сначала левого, а затем правого желудочка) что приводит к развитию застойной сердечной недостаточности в малом, я в дальнейшем и в большом круге кровообращения. У 2/5 больных в полостях желудочков на поздних стадиях болезни образуются пристеночные тромбы с последующим развитием эмболии по малому или большому кругу кровообращения.
Клиническая картина. Специфических признаков заболевания нет. Клиническая картина полиморфна и определяется: 1) симптомами сердечной недостаточности; 2) нарушениями ритма и проводимости; 3) тромбоэмбо- лическим синдромом. Все эти явления развиваются в терминальной стадии болезни, в связи с чем распознавание дилатационной кардиомиопатии до появления перечисленных симптомов представляет значительные трудности.
На I этапе диагностического поиска в ранней стадии заболевания симптомы могут не выявляться. При снижении сократительной функции миокарда появляются жалобы на повышенную утомляемость, одышку при физической нагрузке, а затем в покое. По ночам беспокоит сухой кашель (эквивалент сердечной астмы), позже — типичные приступы удушья. У 10 % больных наблюдаются характерные ангинозные боли. При развитии застойных явлений в большом круге кровообращения появляются тяжесть в правом подреберье (вследствие увеличения печени), отеки ног.
На II этапе диагностического поиска наиболее важным признаком является значительное увеличение сердца (признаки клапанного порока сердца или артериальной гипертонии отсутствуют). Обнаружение на ранних стадиях болезни кардиомегалии в большей или меньшей степени может быть случайным во время профилактического осмотра или обращения больного к врачу по поводу сердечных жалоб. Кардиомегалия проявляется расширением сердца в обе стороны, определяемым перкуторно, а также смещением верхушечного толчка влево и вниз. В тяжелых случаях выслушиваются ритм галопа, тахикардия, шумы относительной недостаточности митрального и/или трехстворчатого клапанов. В 20 % случаев развивается мерцание предсердий. Артериальное давление обычно нормальное или слегка повышено (вследствие сердечной недостаточности).
Остальные симптомы появляются только при развитии сердечной недостаточности и являются ее выражением (холодные цианотичные конечности, набухание шейных вен, отеки, увеличение печени, застойные хрипы в нижних отделах легких, увеличение числа дыханий в минуту).
На III этапе диагностического поиска лабораторно никаких изменений выявить не удается. Инструментальные методы исследования позволяют обнаружить: 1) признаки кардиомегалии; 2) изменения показателей нейтральной гемодинамики; 3) нарушения ритма и проводимости.
Фонокардиограмма подтверждает аускультативные данные в виде ритма галопа, довольно частого обнаружения систолического шума (вследствй относительной недостаточности митрального или трехстворчатого клапана). При застойных явлениях в малом круге кровообращения выявляют акцент II тона.
Рентгенологически обнаруживается значительное увеличение желуД°4' ков (часто в сочетании с умеренным увеличением левого предсердия). Ра' яцваюшиеся вследствие левожелудочковой недостаточности нарушения в isjioM круге кровообращения проявляются усилением легочного сосудистого рисунка, а также появлением транссудата в плевральных (чаще в правой) полостях.
Эхокардиография оказывает существенную помощь в диагностике, выявляя: 1) дилатацию желудочков со снижением сердечного выброса; 2) снижение движения стенок желудочков; 3) парадоксальное движение межжелудочковой перегородки во время систолы; 4) в допплеровском режиме можно обнаружить относительную недостаточность митрального и трехстворчатого клапанов.
На ЭКГ не отмечается каких-либо характерных изменений или сдвиги носят неспецифический характер. К ним относятся признаки гипертрофии левого желудочка и левого предсердия; нарушения проводимости в виде блокады передней ветви левой ножки предсердно-желудочкового пучка (пучка Гиса) или полной блокады левой ножки (15 % случаев); уплощение зубца Г в левых грудных отведениях; мерцание предсердий. Некоторые сложности возникают при появлении патологических зубцов Q в грудных отведениях, что заставляет заподозрить перенесенный ранее инфаркт миокарда. При морфологическом исследовании миокарда в таких случаях обнаруживают множество мелких рубчиков (не являющихся следствием коронарного атеросклероза).
Дополнительные инструментальные исследования не являются обязательными для постановки диагноза, однако их результаты позволяют детализировать степень расстройств гемодинамики и характер морфологических изменений миокарда.
Исследование показателей центральной гемодинамики выявляет низкий минутный и ударный объем (минутный и ударный индексы), повышение давления в легочной артерии.
Ангиокардиографически обнаруживают те же изменения, что и на эхо- кардиограмме.
Биопсия миокарда (прижизненная) неинформативна для определения этиологии кардиомиопатии. В некоторых случаях в биоптате можно обнаружить вирусный антиген, а также ухудшение энергопродукции митохондриями.
Биопсия миокарда оказывает существенную помощь при дифференциальной диагностике дилатационной кардиомиопатии и заболеваний сердца, протекающих с выраженным его увеличением:
1) при тяжелых диффузных миокардитах обнаруживается клеточная инфильтрация стромы в сочетании с дистрофическими и некротическими изменениями кардиомиоцитов;
2) при первичном амилоидозе, протекающем с поражением сердца (так называемый кардиопатический вариант первичного амилоидоза), наблюда- ется значительное отложение амилоида в интерстициальной ткани миокар-Да, сочетающееся с атрофией мышечных волокон;
3) при гемохроматозе (заболевание, обусловленное нарушением обмена железа) в миокарде находят отложения железосодержащего пигмента, наедаются различной степени дистрофия и атрофия мышечных волокон,
Разрастание соединительной ткани.
Диагностика. Распознавание дилатационной кардиомиопатии представляет существенные трудности, так как значительное увеличение сердца с сугствием или наличием сердечной недостаточности встречается с боль-Ж™
меньшей 4acTOTOg ПрИ других заболеваниях сердца. Среди этих "одеваний — диффузные миокардиты тяжелого течения, ИБС (постинфарктный кардиосклероз с развитием аневризмы сердца), приобретенные пороки сердца в стадии тотальной сердечной недостаточности, гипертоническая болезнь далеко зашедших стадий, болезни накопления (гемохрома- тоз, первичный амилоидоз с преимущественным поражением сердца).
Лечение. Основное лечение ДКПМ — борьба с развивающейся застойной сердечной недостаточностью, что осуществляется по общим принцу, пам (прежде всего ограничение физической активности и потребления поваренной соли до 1—2 г/сут).
Наиболее эффективно применение мочегонных препаратов. Преимуще. ство отдается так называемым петлевым диуретикам — фуросемиду и этак- риновой кислоте (урегит). Доза препарата и частота приема колеблются в зависимости от стадии недостаточности кровообращения. Рекомендуется начинать лечение с небольших доз: фуросемид по 20—40 мг, урегит по 25— 50 мг утром натощак 1—3 раза в неделю. Высокоэффективны ингибиторы ангиотензинпревращающего фермента (ИАПФ): каптоприл по 25—100 мг/сут, эналаприл по 2,5—10 мг/сут, рамиприл по 1,25—10 мг/сут периндоприл по 2—4 мг/сут, лизиноприл по 10—20 мг/сут. При назначении этих препаратов следует учитывать величину АД, так как они снижают АД. Для того чтобы избежать возникновения гипотонии, лечение начинают с небольших доз и, убедившись в отсутствии выраженного гипотензивного эффекта, дозу препарата увеличивают.
Дигоксин назначают при мерцательной аритмии в обычных дозах (при этом следует иметь в виду, что при ДКМП быстро может развиться дигита- лисная интоксикация, поэтому контроль за приемом препарата должен быть строгим).
Терапию (3-адреноблокаторами успешно можно проводить при ДКМП и застойной сердечной недостаточности. Лучше переносятся селективные (3- адреноблокаторы, при этом начальная доза препаратов должна быть очень низкой (например, метопролол — начиная с дозы 6,25—12,5 мг/сут). Лечебный эффект препарата в основном обусловлен его брадикардитиче- ским действием и, возможно, уменьшением действия катехоламинов на миокард. При тяжелой сердечной недостаточности назначают спиронолак- тоны в дозе 25—50 мг/сут.
При ДКМП можно проводить трансплантацию сердца. Основные показания — тяжелая застойная сердечная недостаточность и отсутствие эффекта от лекарственной терапии.
Гипертрофическая кардиомиопатия
Гипертрофическая кардиомиопатия (ГКМП) характеризуется массивной гипертрофией желудочков (преимущественно левого) и выраженным нарушением диастолической функции. Гипертрофия стенки левого желудочка более 15 мм неясного генеза считается диагностическим критерием ГКМП. Различают обструктивную (сужающую выходную часть левого желудочка) и необструктивную ГКМП. Гипертрофия может быть симметричной (увеличение толщины стенок всего левого желудочка) и асимметричной (увеличение толщины одной лишь стенки). В ряде случаев наблюдается только изолированная гипертрофия верхней части межжелудочковой перегородки нел посредственно под фиброзным кольцом клапана аорты (так называемый изолированный гипертрофический субаортальный стеноз — ИГСС) или апикальной части желудочков. Полость левого желудочка уменьшена, тогда как левое предсердие расширено.
ГКМП чаще встречается в молодом возрасте; средний возраст больных момент диагностики составляет около 30 лет. Однако заболевание может быть выявлено и значительно позднее — в возрасте 50—60 лет, в единичных случаях ГКМП обнаруживают у лиц старше 70 лет, что является ка-уистикой. Поздняя диагностика заболевания связана с нерезкой выраженностью гипертрофии миокарда и отсутствием значительных изменений Лдутрисердечной гемодинамики. Коронарный атеросклероз встречается у 15—25 % больных.
ГКМП наряду с длительным стабильным течением может осложняться внезапной смертью вследствие развивающихся нарушений желудочкового ритма сердца (пароксизмальная желудочковая тахикардия). У 5—9 % больных ГКМП осложняется инфекционным эндокардитом, который чаще поражает митральный, чем аортальный, клапан, при этом характерно атипичное течение ИЭ.
Этиология. Роль наследственности в возникновении ГКМП подтверждается при обследовании родственников больного (ГКМП выявляется в 17—20 % случаев). Заболевание возникает в результате мутации одного из четырех генов, кодирующих белки сердца ф-миозин тяжелых цепей, ген локализован в хромосоме 14; тропонин Т, ген локализован в хромосоме 1; а- тропомиозин, ген локализован в хромосоме 15; миозинсвязывающий белок С, ген локализован в хромосоме 11). Выживаемость больных ГКМП, возникающей вследствие мутации гена тяжелой цепи р-миозина, существенно ниже, нежели при мутации гена тропонина Т (в этой ситуации болезнь проявляется в более позднем возрасте).
Патогенез. При ГКМП отмечается два основных патологических механизма — нарушение диастолической функции сердца и у части больных — обструкция выходного тракта левого желудочка. В период диастолы поступает в желудочки недостаточное количество крови вследствие плохой их растяжимости, что приводит к быстрому подъему конечного диастолического давления. В этих условиях компенсаторно развиваются гиперфункция, гипертрофия, а затем и дилатация левого предсердия, а при его декомпенсации — легочная гипертензия («пассивного» типа).
Обструкция выходного отдела левого желудочка, развивающаяся во время систолы желудочков, обусловлена двумя факторами: утолщением межжелудочковой перегородки (миокардиальный) и нарушением движения передней створки митрального клапана. Сосочковая мышца укорочена, створка клапана утолщена и прикрывает пути оттока крови из левого желудочка вследствие парадоксального движения: в период систолы она приближается к межжелудочковой перегородке и соприкасается с ней. Вследствие обструкции левого желудочка в период систолы желудочков возника-ет градиент давления между полостью левого желудочка и начальной частью аорты. Градиент давления у одного и того же больного может варьировать в широких пределах, а ударный объем крови из левого желудочка поступает в аорту в первую половину систолы.
Сердечная недостаточность развивается в результате выраженных нарушений диастолической податливости гипертрофированного миокарда левого желудочка и снижения сократительной функции левого предсердия, ко-°Рое в течение некоторого времени играет компенсаторную роль.
Клиническая картина. Характерно чрезвычайное разнообразие симпто- ов, что является причиной ошибочной диагностики. Наиболее часто ста-ят диагноз ревматического порока сердца и ИБС вследствие сходства жа-°о (боли в области сердца и за грудиной) и данных исследования (интен-ивный систолический шум). В типичных случаях клиническую картину составляют: 1) признаки гипертрофии миокарда желудочков (преимуществ венно левого); 2) признаки недостаточной диастолической функции жеду- дочков; 3) признаки обструкции выходного тракта левого желудочка (не » всех больных); 4) нарушения ритма сердца.
Следует учитывать определенную стадийность течения ГКМП (классификация Нью-Йоркской ассоциации кардиологов — NYHA):
I стадия — градиент давления в выходном тракте левого желудоч, ка не превышает 25 мм рт. ст., жалобы обычно отсутствуют.
II стадия — градиент давления до 36 мм рт. ст., отмечаются жалобы при физической нагрузке.
III стадия — градиент давления до 44 мм рт. ст., жалобы на одыщ-ку, сердцебиения, стенокардию, обморочные состояния.
IV стадия — градиент давления > 80 мм рт. ст.; при стабильности высокого градиента возникают и нарастают гемодинамические, цереброва- скулярные и аритмические расстройства.
В связи со сказанным информация, получаемая на различных этапах диагностического поиска, может быть весьма различной.
Так, на I этапе диагностического поиска может не быть никаких жалоб. При выраженных расстройствах сердечной гемодинамики больные предъявляют следующие жалобы:
1) на боли за грудиной сжимающего характера, возникающие при физической нагрузке и исчезающие в покое; реже боли возникают в покое. Причина болей — диспропорция между увеличенной потребностью гипертрофированного миокарда в кровоснабжении и сниженным кровотоком в субэндокардиальных слоях миокарда вследствие плохого диастолического расслабления желудочков;
2) на одышку при физической нагрузке, обычно умеренно выраженную, но иногда и тяжелую;
3) головокружение, головные боли, наклонность к обморочным состояниям — следствие внезапного снижения сердечного выброса или пароксизмов аритмий, также уменьшающих выброс из левого желудочка и приводящих к временному нарушению церебрального кровообращения (пароксизмы мерцания предсердий, эктопические тахикардии).
Указанная симптоматика отмечается у больных с выраженной ГКМП. При нерезкой гипертрофии миокарда, незначительном снижении диастолической функции и отсутствии обструкции выходного отдела левого желудочка жалоб может не быть, и тогда ГКМП диагностируется случайно. Однако у части больных с достаточно выраженными изменениями сердца симптоматика бывает неопределенной: боли в области сердца ноющие, колющие, достаточно длительные.
При нарушениях ритма сердца появляются жалобы на перебои, головокружения, обморочные состояния, преходящую одышку. В анамнезе не удается связать появление симптомов заболевания с интоксикациями, перенесенной инфекцией, злоупотреблением алкоголем или какими-либо иными патогенными воздействиями.
На II этапе диагностического поиска наиболее существенным является обнаружение систолического пгума, измененного пульса и смешенного верхушечного толчка.
Аускультативно обнаруживаются следующие особенности: 1) максимум звучания систолического шума (шум изгнания) определяется в точке Боткина и над верхушкой сердца; 2) систолический пгум в большинстве случаев усиливается при резком вставании больного, а также при проведении пробы Вальсальвы; 3) II тон всегда сохранен; 4) шум не проводится на сосуды шей-
Пульс примерно у '/3 больных высокий, скорый, что объясняется отсут- тВием сужения на путях оттока из левого желудочка в самом начале сие-0 лы, но затем за счет сокращения мощной мускулатуры появляется функциональное» сужение путей оттока, что и приводит к преждевременному снижению пульсовой волны.
Верхушечный толчок в 34 % случаев имеет «двойной» характер: вначале 0Й пальпации ощущается удар от сокращения левого предсердия, затем от Левого желудочка. Эти свойства верхушечного толчка лучше выявляются в положении больного лежа на левом боку.
На Ш этапе диагностического поиска наибольшее значение имеют данные эхокардиографш:
1) асимметричная гипертрофия межжелудочковой перегородки, более выраженная в верхней трети, ее гипокинез;
2) систолическое движение передней створки митрального клапана, направленное вперед;
3) соприкосновение передней створки митрального клапана с межжелудочковой перегородкой в диастолу;
4) малый размер полости левого желудочка.
К неспецифическим признакам относятся увеличение размеров левого предсердия, гипертрофия задней стенки левого желудочка, уменьшение средней скорости диастолического прикрытия передней створки митрального клапана.
На ЭКГ не обнаруживается каких-либо специфических изменений. При достаточно развитой гипертрофии левого желудочка на ЭКГ могут появляться ее признаки. Изолированная гипертрофия межжелудочковой перегородки обусловливает появление зубца Q увеличенной амплитуды в левых грудных отведениях (V5 6), что осложняет дифференциальную диагностику с очаговыми изменениями вследствие перенесенного инфаркта миокарда. Однако зубец Q неширокий, что позволяет исключить перенесенный инфаркт миокарда. В процессе эволюции кардиомиопатии и развития гемодинамической перегрузки левого предсердия на ЭКГ могут появляться признаки синдрома гипертрофии левого предсердия: уширение зубца Р более 0,10 с, увеличение амплитуды зубца Р, появление двухфазного зубца Р в отведении V, с увеличенной по амплитуде и продолжительности второй фазой.
Для всех форм ГКМП общим симптомом является частое развитие желудочковых аритмий (экстрасистолия и пароксизмальная тахикардия). При суточном мониторировании (холтеровское мониторирование) ЭКГ эти нарушения ритма сердца хорошо документируются. Наджелудочковые аритмии выявляют у 25—50 % больных, у 25 % — обнаруживают желудочковую тахикардию.
При рентгенологическом обследовании в развитой стадии болезни выявляют увеличение левого желудочка и левого предсердия, расширение восходящей части аорты. Увеличение левого желудочка коррелирует с высотой Давления в левом желудочке.
На фонокардиограмме амплитуды I и II тонов сохранены (и даже увеличены), что отличает ГКМП от стеноза устья аорты, обусловленного сращением створок клапана (приобретенный порок), а также слышен систолический шум различной степени выраженности.
Кривая каротидного пульса в отличие от нормы двухвершинная, с дополнительной волной на подъеме. Такая типичная картина наблюдается лишь при градиенте давления «левый желудочек — аорта», равном 30 мм Рт- ст. При большей степени стеноза вследствие резкого сужения путей оттока на каротндной сфигмограмме определяется только одна пологая вер шина. р~
Инвазивные методы исследования (зондирование левых отделов сердца контрастная ангиография) в настоящее время не являются обязательными' так как эхокардиография дает вполне достоверную для постановки диагноза информацию. Однако в ряде случаев с помощью этих методов выявляют признаки, характерные для гипертрофической кардиомиопатии: градиент давления между левым желудочком и аортой от 50 до 150 мм рт. ст., повышение конечного диастолического давления в полости левого желудочка д0 18 мм рт. ст. Градиент давления уменьшается после введения (3-адренобло- каторов.
При контрастной ангиографии виден участок сужения путей оттока левого желудочка, коронарные артерии не изменены.
Сканирование сердца (с радиоизотопом таллия) помогает обнаружить утолщение межжелудочковой перегородки и свободной стенки левого желудочка.
Поскольку у 15—25 % больных наблюдается коронарный атеросклероз то у немолодых лиц с приступами типичных ангинозных болей следует проводить коронарографию, так как эти симптомы, как уже упоминалось, при ГКМП обычно обусловлены самим заболеванием.
Диагностика. Диагноз основывается на обнаружении характерного сочетания симптомов заболевания при отсутствии данных, свидетельствующих о синдромно сходной патологии.
Наиболее характерны для гипертрофической кардиомиопатии последовательно обнаруживаемые следующие симптомы: 1) систолический шум с эпицентром по левому краю грудины в сочетании с сохраненным II тоном; сохранение I—II тона на ФКГ в сочетании с мезосистолическим шумом; 2) изменения каротидной сфигмограммы; 4) увеличение левого желудочка по данным ЭКГ и рентгенологического исследования; 5) типичные признаки, обнаруживаемые при эхокардиографическом исследовании.
В диагностически трудных случаях показаны зондирование левых отделов сердца и ангиокардиография. Диагностические сложности обусловлены тем, что отдельно взятые симптомы гипертрофической кардиомиопатии могут встречаться при самых разнообразных заболеваниях. Поэтому окончательный диагноз кардиомиопатии возможен лишь при обязательном исключении следующих заболеваний: стеноз устья аорты (клапанного), недостаточность митрального клапана, ИБС, гипертоническая болезнь.
Лечение. В задачи лекарственной терапии входят:
• обеспечение симптоматического улучшения и продления жизни пациентам путем воздействия на основные нарушения гемодинамики;
• лечение возможной стенокардии, тромбоэмболических и неврологических осложнений;
• уменьшение выраженности гипертрофии миокарда;
• профилактика и лечение аритмий, сердечной недостаточности, предотвращение внезапной смерти.
Вопрос о целесообразности лечения всех пациентов остается дискуссионным.
Больным с неотягощенным семейным анамнезом, без выраженных проявлений гипертрофии левого желудочка (по данным ЭКГ и ЭхоК1;> жизнеопасных аритмий показано диспансерное наблюдение с систематическим проведением ЭКГ и ЭхоКГ. Рекомендуется избегать значительной физической активности.
Длительное (годами) лечение (даже при отсутствии жалоб) следует про- одить пациентам молодого возраста с отягощенным семейным анамнезом
в случаях выраженной гипертрофии левого желудочка и межжелудочковой
*ерегородки (толщина ее свыше 35 мм) или высокого внутрижелудочково- го градиента.
Используют (3-адреноблокаторы, которые снижают чувствительность миокарда к катехоламинам, потребность его в кислороде и градиент давления (возникающий или усиливающийся при физической нагрузке), удлиняют время диастолического наполнения и улучшают наполнение желудочка. Эти препараты могут быть признаны патогенетическими, так как в происхождении ГКМП, возможно, играет роль патологическая реакция ад- ренергических рецепторов миокарда на катехол амины. Назначают пропранолол в дозе 40—200 мг/сут, метопролол в дозе 100—200 мг/сут. Эффективны также антагонисты кальция — верапамил в дозе 120—360 мг/сут. Их применение обусловлено обнаружением повышенного числа рецепторов к антагонистам кальция в миокарде больных с ГКМП, что, возможно, отражает увеличение плотности кальциевых каналов, по которым ионы кальция проникают в миокард.
Бета-адреноблокаторы и антагонисты кальция, помимо действия на внутрисердечную гемодинамику, оказывают также и антиангинальный эффект.
При значительно выраженных симптомах, помимо (3-адреноблокато-ров или верапамила, назначают диуретики (гидрохлортиазид в дозе 25— 50 мг/сут).
При нарушениях желудочкового ритма назначают кордарон в дозе 600— 800 мг/сут в 1-ю неделю, затем по 200—400 мг/сут (под контролем холтеровского мониторирования).
Больным с обструктивной ГКМП, ограниченной гипертрофией и небольшим диастолическим наполнением левого желудочка также следует назначать р-адреноблокаторы.
При развитии сердечной недостаточности назначают мочегонные препараты (салуретики — фуросемид, урегит) и антагонисты альдостерона (ве- рошпирон, альдактон) в необходимых дозах.
При обструктивной ГКМП следует избегать применения сердечных гликозидов, нитратов, симпатомиметиков.
Прогноз. Годовая летальность составляет 3—8 %, причем внезапная смерть возникает в 50 % подобных случаев. Пожилые больные умирают от прогрессирующей сердечной недостаточности, а молодые — внезапно вследствие развития пароксизмов желудочковой тахикардии, полной ат- риовентрикулярной блокады с асистолией, острого инфаркта миокарда (который может возникнуть и при малоизмененных коронарных артериях). Нарастание обструкции выходного тракта левого желудочка либо снижение ег<л наполнения во время физической нагрузки также может быть причиной внезапной смерти.
Профилактика. Мероприятия первичной профилактики неизвестны.
Рестриктивная кардиомиопатии
РКМП (как синдром) может также наблюдаться при заболеваниях, ведущих к нарушению диастолического расслабления (так называемые болезни накопления —… Патогенез. При РКМП происходят нарушение диастолического наполнения… Клиническая картина. Проявления болезни чрезвычайно полиморфны, они определяются симптомами нарушения кровообращения в…Таблица 15. Факторы, влияющие на прогноз больного ГБ
| факторы риска сердечно | Поражение | Сопутствующая клиническая |
| сосудистых заболеваний | органов-мишеней | патология |
| Основные | Гипертрофия левого | Цереброеаскулярные заболе |
| Возраст: | жет/тточкя | вания |
| Мужчины > 55 лет, | Протеинурия и/или | Ишемический инсульт |
| женщины > 65 лет | незначительное | Геморрагический инсульт |
| Курение | повышение концен | Поеходяшее наоушение |
| Обтттий уоттегтепин | трации креатинина | мозгового кровообращения |
| > 6,5 ммоль/л | (1,22 мг/дл) | Патология сердца |
| Сахарный диабет (СД) | Ультразвуковые или | Инфаркт миокарда |
| Случаи ранних проявле | рентгенологические | Стенокардия |
| ний сердечно-сосудистой | данные о наличии | Реваскуляризация коро- |
| патологии в семейном | атеоосклеоотической | наоных аотеоий |
| анамнезе | бляшки | Хроническая сердечная |
| Генеп ал изо ванное или | не лостаточность | |
| Дополнительные, | очаговое сужение ар | Патология почек |
| негативно влияю | терий сетчатки | Диабетическая нефропатия |
| щие на псогноз | Почечная недостаточность | |
| Снижение ХС-ЛВП | (концентрация креатинина | |
| Повышение ХС-ЛНТ1 | r плазме > 2 мг/ ттл» | |
| Микроальбуминурия при | Патология сердца | |
| СД | Расслаивающая аневризма | |
| Нарушение толерантности | аорты | |
| к глюкозе | Патология артерий с кли | |
| Ожипение | ническими симптомами | |
| Малоподвижный образ | Гипертоническая ретинопа | |
| жични | тия | |
| Повышение содержания | Кровоизлияния или экссудаты | |
| фибриногена | ||
| Социально-экономическая | Отек соска зрительного | |
| группа высокого риска | нерва |
Таблица 16. Стратификация риска для оценки прогноза больного в зависимости от степени выраженности АГ и факторов риска
|
Примечание. Низкий риск означает, что вероятность развития мозгового инсульта или острого инфаркта миокарда (за 10 лет) составляет менее 4 %, средний риск — 4—5 %, высокий риск — 5—8 %, очень высокий риск — более 8 %.
Низкий риск — рекомендуется активное наблюдение за величиной АД и факторами риска в течение &-Г-12 мес, при этом возможны две ситуации:
• если САД > 150 или ДАЕГ> Уо мм рт. ст., следует начать медикаментозную терапию?
• если САД < 150 или ДАД < 90 мм рт. ст., то продолжают наблюдение; если все же в течение ближаиших месяцев АД не снижается ниже 140/90 мм рт. ст., то даже при низком риске надо начать прием лекарственных препаратов.
При рациональном выборе лекарственного препарата при ГБ необходимо учитывать следующие факторы:
• стоимость лечения и (связанная с этим) доступность препаратов;
•.имеющиеся факторы риска сердечно-сосудистых заболеваний у данного больного;
• поражение органов-мишеней, клинические проявления сердечно-со- судистых заболеваний, поражение почек и сахарный диабет;
• прочие сопутствующие заболевания, которые могут ограничивать (или способствовать) эффективности лечения;
• индивидуальные реакции больного на препараты различных классов;
• вероятность взаимодеиствия с препаратами, которые больной принимает по другим поводам.
Так, у молодых пациентов, особенно при наличии признаков симпати- котонии (тахикардия, высокий сердечный выброс), а также у лиц более старшего возраста при наличии приступов стенокардии следует назначать селективные р,-адреноблокаторы длительного действия — метопролол (в дозе 50—200 мг/сут), небиволол (в дозе 5—10 мг/сут) или бетаксолол (в дозе 10— 40 мг/сут). При наклонности к брадикардии, недостаточном эффекте или плохой переносимости |Згадреноблокаторов назначают антагонисты кальция пролонгированного действия — амлодипин, фело-дипин (в дозе 5—10 мг/сут в 1—2 приема), нифедипин GITS (в дозе 10—20 мг/сут), изоптин-SR 240 (240—480 мг в 1—2 приема). Антагонисты кальция, а также диуретики также показаны больным пожилого и старческого возраста.
Следует отметить, что блокада (3,-адренорецепторов может приводить к активации РААС (плазменной и тканевой), что в конечном счете обусловливает задержку натрия и воды. В связи с этим одновременно с ргадре- ноблокаторами (или же антагонистами кальция, оказывающими побочное действие — отеки лодыжек или голеней) назначают небольшие дозы мочегонных препаратов — гидрохлортиазид в малых дозах (12,5 мг ежедневно, иногда 25 мг).
При неэффективности (3,-адреноблокаторов или антагонистов кальция, а также при наличии у больного гипертрофии левого желудочка в качестве базисного препарата назначают ингибиторы АПФ (эналаприл в дозе 2,5—20 мг/сут, лизиноприл в дозе 10—30 мг/сут, периндоприл по 4 мг/сут, трандолаприл по 1—2 мг/сут, каптоприл по 25—100 мг/сут). Одновременно целесообразно добавлять небольшие дозы мочегонных препаратов. Существенно реже в качестве препарата первого выбора применяют блокаторы рецепторов к AT II — лозартан (50—10 мг/сут), валсартан (40—80—160 мг/сут), моксонидин, рилменидин (агонист 1,-имидоазолиновых рецепторов).
При недостаточной эффективности первоначально назначенного препарата и дальнейшего увеличения дозы следует применять два препарата — (Згадреноблокатор и антагонист кальция, ингибитор АПФ и антагонист кальция. Во всех случаях необходимо назначать небольшие дозы диуретиков (например, гидрохлортиазид в дозе 12,5 мг). 238
Можно с самого начала лечения назначать два препарата в малых дозах: например, сочетание ингибитора АПФ периндоприла (2 мг) и тиазидопо- добного диуретика индапамида (0,625 мг). При недостаточной эффективности низкодозовой комбинации составные ее части следует увеличивать (полнодозовая комбинация).
Комбинированное применение 2—3 препаратов оправдано вследствие существования так называемого эффекта ускользания, когда полная доза препарата оказывается недостаточной для гипотензивного эффекта или же (при несомненной эффективности) сопровождается побочными реакциями. Вероятно, «эффект ускользания» обусловлен тем, что подавление одного прессорного механизма сопровождается активацией другого. Это привело к тому, что монотерапия в настоящее время применяется все реже, уступив место комбинированной терапии.
Как уже было упомянуто, сосуществование ГБ и сопутствующих заболеваний накладывает определенный отпечаток на проводимую терапию: так, при одновременном наличии у больного ИБС целесообразно в качестве базисного препарата назначать [3,-адреноблокатор; при сахарном диабете — ингибиторы АПФ; при застойной сердечной недостаточности — ингибитор АПФ и диуретик; при суправентрикулярной тахикардии — верапа-мил; при почечной недостаточности — ингибитор АПФ и петлевой диуретик (фуросемид, урегит).
При бронхоспастических реакциях, облитерирующих поражениях сосудов нижних конечностей и сахарном диабете не следует назначать неселективные (3-адреноблокаторы 1-го поколения (пропранолол), а также атено-лол. Высокоселективные [3,-блокаторы 3-го поколения, обладающие вазо- дилатирующими свойствами за счет одновременной индукции оксида азота (небиволол), можно назначать этой категории больным.
При хорошем эффекте от применения ингибиторов АПФ, но одновременном развитии побочных явлений (сухой кашель) рекомендуется вместо ингибиторов АПФ назначать блокатор рецепторов к AT II — лозартан (25— 50 мг/сут) или валсартан (80—100 мг/сут).
Врач не должен стремиться к быстрому снижению АД, особенно у пожилых пациентов. При невысоких цифрах системного АД и выраженных головных болях показаны препараты барвинка (девинкан, винкатон, или винкапан). Для улучшения кровообращения в бассейне мозговых артерий дополнительно используют компламин (теоникол), кавинтон и другие подобные препараты. При тенденции к непрогнозируемым колебаниям АД у лиц пожилого возраста (особенно при ортостатической и постпрандиальной гипотонии) целесообразно назначать клоназепам в Дозе 0,5—2 мг/сут.
Применение всех гипотензивных средств при ГБ должно быть длительным, перерывы в лечении ведут к неблагоприятным последствиям (например, к появлению гипертонического криза).
Повышенная чувствительность или, напротив, толерантность к препарату и возникновение побочных явлений требуют его отмены и подбора Другого препарата.
При ГБ со злокачественным течением используют комбинации трех или четырех препаратов, например:
• (Згадреноблокатор + диуретик + ингибитор АПФ;
• ргадреноблокатор + диуретик + антагонист кальция.
В этой ситуации мочегонные (например, гидрохлортиазид) следует применять ежедневно или через день (в больших дозах, чем обычно).
Ранее применявшиеся препараты раувольфии, назначаемые изолированно (резерпин, раунатин), а также в комбинациях с другими средствами (адельфан, кристепин, трирезид) в настоящее время не используют. Точно так же при систематической терапии не применяют кальциевые антагонисты короткого действия (нифедипин), а также клофелин (клонидин, ката-прессан). Эти препараты назначают лишь для купирования гипертонических кризов.
Учитывая, что наиболее грозным осложнением ГБ является гипертонический криз, своевременная терапия его представляется весьма важной.
Главной целью проводимых мероприятий при гипертоническом кризе является быстрое снижение АД: ДАД до уровня примерно 100 мм рт. ст. (если энцефалопатия сопровождается судорогами, то их устраняют до начала гипотензивного лечения внутривенным введением 10—40 мг диазепа-ма в 5 % растворе глюкозы).
Выбор лекарственных препаратов, последовательность их введения определяют возрастом пациента, а также наличием осложнений (энцефалопатия, отек легких):
а) купирование неосложненного ГК у лиц молодого или среднего воз раста: внутривенное введение 1 мл 0,01 % раствора клонидина в 10 мл изо тонического раствора хлорида натрия медленно; в случае отсутствия эф фекта — 2 мл 0,25 % раствора дроперидола внутривенно или 1 мл 5 % рас твора пентамина внутримышечно или внутривенно в изотоническом рас творе хлорида натрия медленно (можно вводить повторно);
б) купирование неосложненного криза у лиц пожилого и старческо го возраста: первый этап — прием клонидина (0,15—0,3 мг внутрь, затем 0,05—0,1 мг каждый час, доводя дозу до 0,7 мг), нифедипина (10—20 мг) или каптоприла (25—50 мг); в случае отсутствия эффекта — клонидин (1 мл 0,01 % раствора).
В любом возрасте, если криз не купируется указанными препаратами при повторном их введении, показано капельное внутривенное введение 2—4 мг 0,25 % раствора дроперидола;
в) купирование криза, осложненного энцефалопатией: в сочетании с клонидином вводят внутривенно 60—80 мг фуросемида; в случае отсутст вия эффекта фуросемид вводят повторно в сочетании с дроперидолом;
г) купирование криза, осложненного отеком легких: внутривенно вво дят пентамин в сочетании с морфином или дроперидолом; в случае отсут ствия эффекта внутривенно вводят фуросемид со строфантином.
Если внезапные подъемы АД осложняются расслаиванием стенки аорты, необходимо быстро снизить систолическое давление до 110—115 мм рт. ст. Это достигается внутривенным введением арфонада в палате интенсивного наблюдения; одновременно консультируются с хирургом для решения вопроса о возможном оперативном вмешательстве.
Прогноз. При неосложненном течении и адекватной терапии больные длительно сохраняют трудоспособность. Соответствующее лечение может привести к длительной стабилизации процесса.
Профилактика. Первичная профилактика заключается в ограничении длительных воздействий неблагоприятных внешних факторов, способствующих возникновению заболевания, здоровом образе жизни (запрещение курения, ограничение приема алкоголя, достаточная физическая активность). Вторичная профилактика включает диспансерное наблюдение и рациональную гипотензивную терапию (при соблюдении рекомендаций в отношении здорового образа жизни). 240
Симптоматическая артериальная гипертония СИМПТОМАТИЧЕСКАЯ, ИЛИ ВТОРИЧНАЯ, АРТЕРИАЛЬНАЯ ГИПЕРТОНИЯ (СГ) — это АГ, причинно-связанная с определенными заболеваниями или повреждениями органов (или систем), участвующих в регуляции АД.
Она выявляется у 5—15 % больных, страдающих гипертонией. Классификация. Существует множество классификаций СГ, однако выделяют четыре основные группы СГ. I. Почечная (нефрогенная).
II. Эндокринная.
III. Гипертония, обусловленная поражением сердца и крупных артериальных сосудов (гемодинамическая).
IV. Центрогенная (обусловленная органическим поражением нервной системы). Иногда наблюдается группа СГ при сочетанных поражениях [Арабидзе Г.Г., 1982].
Возможно сочетание нескольких (чаще двух) заболеваний, потенциально способных привести к АГ, например: диабетический гломерулосклероз и хронический пиелонефрит; атеросклеротический стеноз почечных артерий и хронический пиело- или гломерулонефрит; опухоль почки у пациента, страдающего атеросклерозом аорты и мозговых сосудов и т.п. К основным вариантам СГ некоторые авторы относят и экзогенно обусловленную АГ [Кушаковский М.С., 1983; Гогин Е.Е. и др., 1997], развившуюся в результате отравлений свинцом, таллием, кадмием и т.д., а также лекарственными средствами (глюкокортикоиды, контрацептивные средства, индоме-тацин в сочетании с эфедрином и др.).
Однако и с приведенными добавлениями классификация не является исчерпывающей. Существует АГ при полицитемии, хронических обструк- тивных заболеваниях легких и прочих состояниях, не вошедших в классификацию.
В настоящем разделе рассмотрены четыре основные группы СГ. Этиология. Этиологическими факторами для СГ являются многочисленные заболевания, сопровождающиеся развитием АГ как симптома. Описано более 70 подобных заболеваний.
• Заболевания почек, почечных артерий и мочевыводящей системы:
а) приобретенные: диффузный гломерулонефрит, хронический пиелонефрит, интерстициальный нефрит, системные васкулиты, ами- лоидоз, диабетический гломерулосклероз, атеросклероз, тромбоз и эм болия почечных артерий, пиелонефрит на фоне мочекаменной болез ни, обструктивные уропатии, опухоли, туберкулез почек и т.п.;
б) врожденные: гипоплазия, дистопия, аномалии развития почеч ных артерий, гидронефроз, поликистоз почек, патологически подвиж ная почка и другие аномалии развития и положения почек.
• Заболевания эндокринной системы: феохромоцитома и феохромо- бластома; альдостерома (первичный альдостеронизм, или синдром Конна); кортикостерома; болезнь и синдром Иценко—Кушинга; акромегалия; диффузный токсический зоб.
• Заболевания сердца, аорты и крупных сосудов:
а) пороки сердца приобретенные (недостаточность клапана аорты и др.) и врожденные (открытый артериальный проток и др.); заболевания сердца, сопровождающиеся застойной сердечной недостаточностью и полной атриовентрикулярной блокадой;
б) поражения аорты врожденные (коарктация) и приобретенные (арте рииты аорты и ее ветвей, атеросклероз); стенозирующие поражения сонных и позвоночных артерий и др.
• Заболевания ЦНС: опухоль мозга; энцефалит; травмы; очаговые ишемические поражения и др.
Реноваскулярные (вазоренальные) АГ относятся к почечным СГ. Патогенез. Механизм развития СГ при каждом заболевании имеет отличительные черты. Они обусловлены характером и особенностями развития основного заболевания. Так, при почечной патологии и реноваскуляр-ных поражениях пусковым фактором является ишемия почки, а доминирующим механизмом повышения АД — повышение активности прессор-ных и снижение активности депрессорных почечных агентов.
При эндокринных заболеваниях первично повышенное образование некоторых гормонов является непосредственной причиной повышения АД. Вид гиперпродуцируемого гормона (альдостерон или другой минералокор- тикоид, катехоламины, СТГ, АКТГ и глюкокортикоиды) зависит от характера эндокринной патологии.
При органических поражениях ЦНС создаются условия для ишемии центров, регулирующих АД, и нарушений центрального механизма регуляции АД, вызванного не функциональными (как при ГБ), а органическими изменениями.
При гемодинамических СГ, обусловленных поражением сердца и крупных артериальных сосудов, механизмы повышения АД не представляются едиными и определяются характером поражения. Они связаны с: 1) нарушением функции депрессорных зон (синокаротидной зоны), снижением эластичности дуги аорты (при атеросклерозе дуги); 2) переполнением кровью сосудов, расположенных выше места сужения аорты (при ее коаркта-ции), с дальнейшим включением почечно-ишемического ренопрессорного механизма; с сужением сосудов в ответ на уменьшение сердечного выброса, увеличением объема циркулирующей крови, вторичным гиперальдосте- ронизмом и повышением вязкости крови (при застойной сердечной недостаточности); 3) увеличением и ускорением систолического выброса крови в аорту (недостаточность клапана аорты) при возрастании притока крови к сердцу (артериовенозные свищи) или увеличении продолжительности диастолы (полная атриовентрикулярная блокада).
Клиническая картина. Клинические проявления СГ в большинстве случаев складываются из симптомов, обусловленных повышением АД, и симптомов основного заболевания.
• Повышением АД можно объяснить головные боли, головокружение, мелькание «мушек» перед глазами, шум и звон в ушах, разнообразные боли в области сердца и другие субъективные ощущения. Обнаруживаемые при физикальном обследовании гипертрофия левого желудочка, акцент II тона над аортой — результат стабильной АГ. Выявляются характерные изменения сосудов глазного дна. Рентгенологически и электрокардиографически обнаруживают признаки гипертрофии левого желудочка (более подробно см. «Гипертоническая болезнь»),
• Симптомы основного заболевания:
1) могут быть ярко выраженными, в таких случаях характер СГ устанавливают на основании развернутой клинической симптоматики соответствующего заболевания;
2) отсутствуют — заболевание проявляется только повышением АД; в такой ситуации предположения о симптоматическом характере АГ возникают при: а) развитии АГ у лиц молодого возраста и старше 50—55 лет; б) остром развитии и быстрой стабилизации АГ на высоких цифрах; в) бессимптомном течении АГ; г) резистентности к гипотензивной терапии; д) злокачественном характере течения АГ.
По характеру течения СГ, как и гипертоническую болезнь, разделяют на доброкачественные и злокачественные формы. Синдром злокачественной АГ встречается у 13—30 % всех больных СГ.
Различная выраженность симптомов и широкий круг заболеваний, сопровождающихся АГ, обусловливают чрезвычайную вариабельность клинической картины СГ. В связи с этим этапы диагностического поиска будут представлены отдельно для каждой группы заболеваний, выделенных в классификации.
Почечная (нефрогенная) гипертония. Почечная АГ выявляется у 70—80 % больных СГ. Она возникает при заболеваниях паренхимы, почек, нарушениях оттока мочи (реноваскулярная, вазоренальная гипертония). Очень часто почечная АГ возникает при ренопаренхиматозной и вазоренальной патологии.
Клиническая картина многочисленных заболеваний, сопровождающихся АГ почечного генеза, может проявляться следующими синдромами: АГ и патологией мочевого осадка; АГ и лихорадкой; АГ и шумом над почечными артериями; АГ и пальпируемой опухолью брюшной полости; АГ (мо- носимптомно).
Эти синдромы могут быть выявлены на разных этапах диагностического поиска.
В задачу I этапа диагностического поиска входят: 1) сбор сведений о перенесенных ранее заболеваниях почек или мочевыводящей системы; 2) целенаправленное выявление жалоб, встречающихся при почечной патологии, при которой гипертония может выступать как симптом.
Указания на имеющуюся у больного патологию почек (гломеруло- и пиелонефрит, мочекаменная болезнь и т.д.), связь ее с развитием АГ позволяют сформулировать предварительную диагностическую концепцию.
При отсутствии характерного анамнеза наличие жалоб на изменение цвета и количества мочи, дизурические расстройства, появление отеков помогает связать повышение АД с почечной патологией без определенных высказываний о характере поражения почек. Эти сведения необходимо получить на последующих этапах обследования больного.
Если больной предъявляет жалобы на лихорадку, боли в суставах и животе, повышение АД, то можно заподозрить узелковый периартериит — заболевание, при котором почки являются лишь одним из органов, вовлеченных в процесс.
Сочетание повышенного АД с лихорадкой характерно для инфекции мочевыводящих путей (жалобы на дизурические расстройства), встречается также при опухолях почек.
На данном этапе в ряде случаев можно получить сведения, указывающие лишь на повышение АД. Следует учитывать возможность существования моносимптомных почечных АГ, поэтому возрастает значение последующих этапов обследования больного для выявления причины повышения АД.
На II этапе диагностического поиска выявляют симптомы, обусловленные повышением АД (описаны ранее) и основным заболеванием.
Наличие выраженных отеков при соответствующем анамнезе делает более достоверным предварительный диагноз гломерулонефрита. Возникают Предположения и об амилоидозе.
Если при физикальном обследовании больного выслушивается систолический шум над брюшной аортой у места отхождения почечных артерий, то можно предположить реноваскулярный характер АГ. Уточненный диагноз ставят по данным ангиографии.
Обнаружение при пальпации живота опухолевого образования у больных АГ позволяет предположить поликистоз почек, гидронефроз или гипернефрому.
Таким образом, на II этапе диагностического поиска могут возникнуть новые предположения о заболеваниях, обусловивших развитие АГ, а также подтвердиться диагностические концепции I этапа.
Завершить первые два этапа обследования необходимо формулировкой предварительного диагноза. Это делают для того, чтобы из огромного количества исследований, предполагаемых на III этапе, выбрать необходимые именно данному больному для постановки окончательного диагноза.
На основании оценки выявленных синдромов можно высказать предположения о заболеваниях, сопровождающихся АГ почечного генеза.
• Сочетание АГ и патологии мочевого осадка наблюдается при: а) хроническом и остром гломерулонефрите; б) хроническом пиелонефрите.
• Сочетание АГ и лихорадки наиболее часто встречается при: а) хроническом пиелонефрите; б) поликистозе почек, осложненном пиелонефритом; в) опухолях почки; г) узелковом периартериите.
• Сочетание АГ с пальпируемой опухолью в брюшной полости наблюдается при: а) опухолях почек; б) поликистозе; в) гидронефрозе.
• Сочетание АГ с шумом над почечными артериями характеризует стеноз почечных артерий различного происхождения.
• Моносимптомная АГ характерна для: а) фибромускулярной гиперплазии почечных артерий (реже стенозирующего атеросклероза почечных артерий и некоторых форм артериита); б) аномалий развития почечных сосудов и мочевыводящих путей.
На III этапе диагностического поиска производят: а) обязательное обследование всех больных (см. «Гипертоническая болезнь»); б) специальные исследования по показаниям.
Исследования по показаниям включают:
1) количественную оценку бактериурии, суточную потерю белка с мочой;
2) суммарное исследование функции почек;
3) раздельное исследование функции обеих почек (изотопная реногра-фия и сканирование, инфузионная и ретроградная пиелография, хромоци- стоскопия);
4) ультразвуковое сканирование почек;
5) компьютерную томографию почек;
6) контрастную ангиографию (аортография с исследованием почечного кровотока и каваграфия с флебографией почечных вен);
7) исследование крови на содержание ренина и ангиотензина.
Показания к проведению того или иного дополнительного исследования
зависят от предварительного диагностического предположения и результатов рутинных (обязательных) методов исследования.
Уже по результатам обязательных методов исследования (характер мочевого осадка, данные бактериологического исследования) можно иногда подтвердить предположение о гломеруло- или пиелонефрите. Однако для окончательного решения вопроса нужны дополнительные исследования.
Эти исследования включают анализ мочи по Нечипоренко, посев мочи по Гулду (с качественной и количественной оценкой бактериурии), проведение преднизолоновой пробы (провокация лейкоцитурии после внутривенного введения преднизолона), изотопной ренографии и сканирования, хромоцистоскопии и ретроградной пиелографии. Кроме того, следует безупречно выполнить инфузионную урографию.
1АЛ
В сомнительных случаях для окончательного диагноза латентно протекавшего пиелонефрита или гломерулонефрита производят биопсию почки.
Нередко патологический процесс в почках многие годы протекает скрыто и сопровождается минимальными и непостоянными изменениями мочи. Небольшая протеинурия приобретает диагностическое значение только при учете суточного количества теряемого с мочой белка: протеину-рию более 1 г/сут можно рассматривать как косвенное указание на связь дГ с первичным поражением почек. Экскреторная урография исключает (или подтверждает) наличие камней, аномалий развития и положения почек (иногда почечных сосудов), которые могут быть причиной макро- и микрогематурии.
При гематурии для исключения опухоли почек, помимо экскреторной урографии, проводят сканирование почек, компьютерную томографию и на завершающем этапе — контрастную ангиографию (аорто- и кавография).
Диагноз интерстициального нефрита, также проявляющегося микрогематурией, может быть поставлен только с учетом результатов биопсии почек.
Биопсия почки и гистологическое исследование биоптата позволяют окончательно подтвердить диагноз амилоидного поражения.
В случае предположения о вазоренальной гипертонии установить ее характер можно по данным контрастной ангиографии.
Эти исследования — биопсия почки и ангиография — проводят по строгим показаниям.
Ангиографию осуществляют больным молодого и среднего возраста при стабильной диастолической АГ и неэффективности лекарственной терапии (небольшое снижение АД наблюдается только после применения массивных доз препаратов, действующих на разные уровни регуляции АД).
Данные ангиографии трактуются следующим образом:
1) односторонний стеноз артерии, устья и средней части почечной артерии, сочетающийся с признаками атеросклероза брюшной аорты (неровность ее контура), у мужчин среднего возраста характерен для атеросклероза почечной артерии;
2) чередование на ангиограмме участков стеноза и дилатации пораженной почечной артерии с локализацией стеноза в средней трети ее (а не в устье) при неизмененной аорте у женщин моложе 40 лет свидетельствует о фибромускулярной гиперплазии стенки почечной артерии;
3) двустороннее поражение почечных артерий от устьев и до средней трети, неравномерность контуров аорты, признаки стеноза других ветвей грудной и брюшной аорты характерны для артериита почечных артерий и аорты.
Эндокринная гипертония. Среди эндокринных заболеваний, сопровождающихся АГ, не рассматривается диффузный токсический зоб, так как АГ при нем не вызывает сложностей в диагностике, а по своему механизму является преимущественно гемодинамической.
Клиническая картина других эндокринных заболеваний, протекающих с повышением АД, может быть представлена в виде следующих синдромов: АГ и симпатико-адреналовые кризы; АГ с мышечной слабостью и мочевым синдромом; АГ и ожирение; АГ и пальпируемая опухоль в брюшной полости (редко).
Выявление этих синдромов на разных этапах диагностического поиска позволяет предположить эндокринный генез АГ.
На I этапе диагностического поиска жалобы больного на возникновение гипертонических кризов, сопровождающихся приступами сердцебиений, мышечной дрожью, профузнымн потами и бледностью кожных покровов, головными болями, болями за грудиной, позволяют говорить о феохромоцитоме. Если перечисленные жалобы возникают на фоне лихорадки, похудения (проявление интоксикации), сопровождаются болями в животе (метастазы в регионарные забрюшинные лимфатические узлы?): вероятно предположение о феохромобластоме.
Вне кризов АД может быть нормальным или повышенным. Склонность к обморокам (особенно при вставании с постели) на фоне постоянно высокого АД также характерна для феохромоцитомы, протекающей без кризов.
Жалобы больного на повышение АД и приступы мышечной слабости снижение физической выносливости, жажду и обильное мочеиспускание.' особенно в ночные часы, создают классическую клиническую картину первичного гиперальдостеронизма (синдром Конна) и выявляют возможную причину АГ уже на I этапе диагностического поиска. Сочетание приведенных симптомов с лихорадкой и болями в животе делает вероятным предположение об аденокарциноме надпочечника.
Если больной предъявляет жалобы на увеличение массы тела, совпадающее по времени с развитием АГ (при алиментарном ожирении, как правило, увеличение массы тела происходит задолго до развития АГ), нарушения в половой сфере (дисменорея у женщин, угасание либидо у мужчин), то можно предположить синдром или болезнь Иценко—Кушинга. Предположение подкрепляется, если больного беспокоят жажда, полиурия, кожный зуд (проявление нарушений углеводного обмена).
Таким образом, I этап диагностического поиска является очень информативным для диагностики эндокринных заболеваний, сопровождающихся АГ. Сложности возникают при феохромоцитоме, не сопровождающейся кризами. В данной ситуации диагностическое значение последующих этапов, особенно III, чрезвычайно возрастает.
На II этапе диагностического поиска физикальные методы обследования позволяют выявить:
а) изменения .сердечно-сосудистои системы, развивающиеся под влия нием повышения АД;
б) преимущественное отложение жира на туловище при относительно худых конечностях, розовые стрии, угри, гипертрихоз, свойственные болез ни и синдрому Иценко—Кушинга;
в) слабость мышц, вялые параличи, судороги, характерные для синдро ма Конна; положительные симптомы Хвостека и Труссо; периферические отеки (изредка наблюдаются при альдостероме);
г) округлое образование в животе (надпочечник); уточнение характера опухоли возможно только на III этапе.
Необходимо провести провокационный тест: бимануальная пальпация области почек поочередно в течение 2—3 мин может вызвать катехолами- новый криз при феохромоцитоме. Отрицательные результаты этой пробы не исключают феохромоцитомы, так как она может иметь вненадпочечни-ковое расположение.
Этап III диагностического поиска приобретает решающее значение, поскольку позволяет: а) поставить окончательный диагноз; б) выявить локализацию опухоли; в) уточнить ее характер; г) определить тактику лечения.
Уже при проведении обязательных исследований обнаруживаются характерные изменения: лейкоцитоз и эритроцитоз в периферической крови, гипергликемия и гипокалиемия; стойкая щелочная реакция мочи (вследствие высокого содержания калия), характерная для первичного гиперальдо- 246
стеронизма. При развитии «гипокалиемической иефроиатии» выявляются полиурия, изостенурия, никтурия (исследование мочи по Зимницкому).
Из дополнительных методов исследования для выявления или исключения первичного альдостеронизма производят:
1) исследование суточного выделения калия и натрия в моче с подсчетом коэффициента Na/K (при синдроме Конна он более 2);
2) определение содержания калия и натрия в плазме крови до и после приема 100 мг гипотиазида (выявление гипокалиемии при первичном аль- достеронизме, если исходные показатели нормальные);
3) определение щелочного резерва крови (выраженный алкалоз при первичном альдостеронизме);
4) определение содержания альдостерона в суточной моче (увеличено при первичном альдостеронизме);
5) определение уровня ренина в плазме крови (понижение активности ренина при синдроме Конна).
Решающее значение для диагностики всех опухолей надпочечника имеют данные следующих исследований:
1) ретропневмоперитонеума с томографией надпочечников;
2) радионуклидного исследования надпочечников;
3) компьютерной томографии;
4) селективной флебографии надпочечников.
Особенно сложно выявить феохромоцитому вненадпочечниковой локализации. При клинической картине заболевания и отсутствии опухоли надпочечников (по данным ретропневмоперитонеума с томографией) необходимо произвести грудную и брюшную аортографию с последующим тщательным анализом аортограмм.
Из дополнительных методов для постановки диагноза феохромоцитомы до проведения указанных инструментальных методов производят следующие лабораторные исследования:
1) определение суточной экскреции с мочой катехоламинов и содержания ванилил-миндальной кислоты на фоне криза (резко повышено) и вне его;
2) раздельное исследование экскреции адреналина и норадреналина (опухоли, расположенные в надпочечниках и стенке мочевого пузыря, сек- ретируют адреналин и норадреналин, опухоли других локализаций — только норадреналин);
3) гистаминовый (провоцирующий) и регитиновый (купирующий) тесты (при наличии феохромоцитомы положительные).
Из дополнительных методов исследования при подозрении на болезнь и синдром Иценко—Кушинга производят:
1) определение в суточной моче содержания 17-кетостероидов и 17-ок- сикортикостероидов;
2) исследование суточного ритма секреции 17- и 11-оксикортикосте- роидов в крови (при болезни Иценко—Кушинга содержание гормонов в крови монотонно повышено в течение суток);
3) обзорный снимок турецкого седла и его компьютерную томографию (выявление аденомы гипофиза);
4) все описанные ранее инструментальные методы исследования надпочечников для выявления кортикостеромы.
Постановкой диагноза эндокринного заболевания заканчивается диагностический поиск.
Гемодинамическая гипертония. Гемодинамическая АГ обусловлена поражением сердца и крупных сосудов и развивается при: 1) атеросклерозе, брадикардии, аортальной недостаточности; 2) коарктации аорты (регионарная); 3) артериовенозных фистулах (гиперкинетический циркуляторный синдром); 4) сердечной недостаточности и пороках митрального клапана (ишемическая застойная).
Гемодинамическая АГ связана непосредственно с заболеваниями сердца и крупных сосудов, изменяющими условия системного кровотока и способствующими подъему АД. Характерно изолированное или преимущественное повышение систолического АД.
На I этапе диагностического поиска получают сведения о: а) времени возникновения повышения АД, его характере и субъективных ощущениях; б) различных проявлениях атеросклероза у лиц пожилого возраста и степени их выраженности (перемежающаяся хромота, резкое снижение памяти и т.д.); в) заболеваниях сердца и крупных сосудов, с которыми можно связать повышение АД; г) проявлениях застойной сердечной недостаточности; д) характере и эффективности лекарственной терапии.
Возникновение АГ на фоне существующих заболеваний и прогрессиро- вание ее в связи с ухудшением течения основного заболевания обычно свидетельствует о симптоматическом характере гипертонии (АГ — симптом основного заболевания).
На II этапе диагностического поиска выявляют: 1) уровень повышения АД, его характер; 2) заболевания и состояния, которыми определяется повышение АД; 3) симптомы, обусловленные АГ.
У большинства пожилых больных АД не отличается стабильностью, возможны беспричинные подъемы и внезапные понижения его. АГ характеризуется повышением систолического давления при нормальном, а иногда и пониженном диастолическом — так называемая атеросклеротическая гипертония, или возрастная (склеротическая) гипертония пожилых (без явных клинических проявлений атеросклероза). Выявление признаков атеросклероза периферических артерий (снижение пульсации на артериях нижних конечностей, похолодание их и т.д.) делает диагноз атеросклеротиче-ской АГ более вероятным. При аускультации сердца можно обнаружить интенсивный систолический шум над аортой, акцент II тона во втором межреберье справа, что свидетельствует об атеросклерозе аорты (иногда выявляется атеросклеретический порок сердца). Присоединение к уже существующей систолической АГ довольно стойкого повышения диастоличе-ского давления может свидетельствовать о развитии атеросклероза почечных артерий (систолический шум над брюшной аортой у пупка прослушивается не всегда).
Может быть выявлено резкое повышение АД на руках и снижение его на ногах. Сочетание такой АГ с усиленной пульсацией межреберных артерий (при осмотре и пальпации), ослаблением пульсации периферических артерий нижних конечностей, запаздыванием пульсовой волны на бедренных артериях позволяет с достоверностью заподозрить коарктацию аорты. Выявляют грубый систолический шум над основанием сердца, выслушиваемый над грудным отделом аорты спереди и сзади (в межлопаточной области), шум иррадиирует по ходу крупных сосудов (сонных, подключичных). Характерная аускультативная картина позволяет на II этапе с уверенностью поставить диагноз коарктации аорты.
При физикальном исследовании могут быть выявлены признаки недостаточности аортального клапана, незаращения артериального протока, пр°~ явления застойной сердечной недостаточности. Все эти состояния могут приводить к АГ.
На Ш этапе диагностического поиска можно поставить окончательный диагноз.
Обнаруживаемое при исследовании липидного спектра крови повышение уровня холестерина (чаше а-холестерина), триглицеридов, (3-липопро-теидов наблюдается при атеросклерозе. При офтальмоскопии могут быть выявлены изменения сосудов глазного дна, развивающиеся при атеросклерозе мозговых сосудов. Снижение пульсации сосудов нижних конечностей, иногда сонных артерий и изменение формы кривых на реограмме подтверждает атеросклеротическое поражение сосудов.
На III этапе диагностического поиска обнаруживают характерные электрокардиографические, рентгенологические и эхокардиографические признаки порока сердца (см. «Пороки сердца»).
Больным с коарктацией аорты ангиография обычно производится для уточнения локализации и протяженности пораженного участка (перед операцией). Если имеются противопоказания к оперативному лечению, то для постановки диагноза достаточно данных физикального исследования.
Центрогенная гипертония. Этот вариант гипертонии обусловлен органическими поражениями нервной системы.
На I этапе диагностического поиска выявляют характерные жалобы на пароксизмальное повышение АД, сопровождающееся тяжелыми головными болями, головокружениями и различными вегетативными проявлениями, иногда эпилептиформным синдромом. В анамнезе имеются указания на перенесенные травмы, сотрясение мозга, возможно, арахноидит или энцефалит.
Сочетание характерных жалоб с соответствующим анамнезом позволяет предположить нейрогенный генез АГ.
На II этапе диагностического поиска важно получить сведения, позволяющие высказать предположение об органических поражениях ЦНС. В начальной стадии болезни таких данных может не быть. При длительном течении болезни можно выявить особенности поведения, нарушения двигательной и чувствительной сферы, патологию со стороны отдельных черепных нервов. Сложно поставить правильный диагноз у лиц пожилого возраста, когда все особенности поведения объясняют развитием церебрального атеросклероза.
На III этапе получают наиболее важные для диагностики сведения.
Необходимость в проведении дополнительных методов исследования возникает при соответствующих изменениях глазного дна («застойные соски») и сужении полей зрения.
Главной задачей III этапа является четкий ответ на вопрос о том, есть у больного опухоль мозга или ее нет, так как только своевременная диагностика позволяет провести хирургическое лечение.
Больному, помимо рентгенографии черепа (информативность которой значима только при больших опухолях мозга), производят электроэнцефалографию, реоэнцефалографию, ультразвуковое сканирование и компьютерную томографию черепа.
Диагностика. Выявление СГ базируется на четком и точном диагнозе заболеваний, сопровождающихся повышением АД, и на исключении других форм СГ.
СГ может быть ведущим признаком основной болезни, и тогда она фигурирует в диагнозе: например, реноваскулярная гипертония. Если АГ является одним из многих проявлений заболевания и не выступает главным симптомом, то в диагнозе может не упоминаться, например при диффузном токсическом зобе, болезни или синдроме Иценко—Кушинга.
Лечение.
При аденоме гипофиза используют методы активного воздействия с помощью рентгено- и радиотерапии, лечения лазером, в ряде случаев производят… Лекарственная терапия основного заболевания (узелкового периарте- риита,… II. Лекарственная гипотензивная терапия. В подавляющем большинстве случаев терапия не ограничивается средствами,…Контрольные вопросы и задачи
Выберите один, наиболее правильный ответ на вопросы 37—76.
37. Ревматическая лихорадка (ревматизм) представляет собой системное воспалительное заболевание соединительной ткани, для которого характерны все перечисленные ниже признаки, кроме одного: А. Инфицирование гемолитическим стрептококком группы В. Б. Преимущественное поражение суставов и сердечно-со- судистой системы. В. Прямое действие стрептококка на оболочки сердца. Г. Влияние перекрестно реагирующих антител к стрептококку на оболочки сердца. Д. Изменение толерантности к собственным тканевым антигенам.
38. Перечисленные симптомы (кардит, полиартрит, подкожные узелки, эритема) характерны для: А. Инфекционного миокардита. Б. Ревмокардита. В. Перикардита. Г. Неспецифического миокардита. Д. Идиопатической кардиомиопатии.
39. Инфекционный эндокардит наиболее часто развивается на фоне следующих заболеваний, за исключением: А. Митрального стеноза. Б. Митральной недостаточности. В. Постинфарктной аневризмы левого желудочка. Г. Идиопатической гипертрофической кардиомиопатии. Д. Аортального порока сердца.
40. Из перечисленных очагов хронической инфекции наибольшее значение для развития инфекционного эндокардита имеют: А. Хронический тонзиллит. Б. Хронический ринит. В. Хронический холецистит. Г. Хронический цистит. Д. Зубные гранулемы.
41. Наиболее часто поражаются инфекционным эндокардитом: А. Молодые женщины. Б. Молодые мужчины. В. Старики. Г. Женщины пожилого возраста. Д. Дети.
42. В диагностике инфекционного эндокардита у больного с пороком сердца важную роль играет наличие: А. Гепатомегалии. Б. Шумов в сердце. В. Увеличения селезенки. Г. «Митрального румянца». Д. «Застойного бронхита».
43. Поражение клапана в сочетании с субфебрильной температурой тела, увеличением СОЭ и эмболиями указывает на: А. Миокардит. Б. Инфекционный эндокардит. В. Ревматический кардит. Г. Порок сердца. Д. Тромбофлебит.
44. Для инфекционного эндокардита характерно все, за исключением: А. Увеличения селезенки. Б. Протеинурии. В. Лихорадки. Г. Лейкоцитурии. Д. Увеличе-
45. Ранними электрокардиографическими признаками острого перикардита являются: А. Подъем выпуклого сегмента ST. Б. Подъем вогнутого сегмента ST.
Депрессия сегмента ST. Г. Негативный зубец Т. Д. Высокий заостренный ру-
46. Для слипчивого перикардита характерно все, кроме: А. Увеличения печени. ь- Обызвествления перикарда. В. Спадения яремных вен. Г. Похудения. Д. Расщеп ления сердечных тонов.
47. Самой частой причиной перикардита является: А. Распространение воспалительного процесса с других органов. Б. Туберкулез. В. Сепсис. Г. Ревматизм Д. Злокачественная опухоль.
48. Признаки правожелудочковой недостаточности при «малом» сердце и отсутствии верхушечного толчка являются чаще всего доказательством: А. Идиопатической гипертрофической кардиомиопатии. Б. Митральной недостаточности. В. Артериальной гипертонии. Г. Констриктивного перикардита. Д. Аневризмы сердца.
49. Из показателей гемодинамики основное значение в диагностике митрального стеноза имеет: А. Давление в легочной артерии. Б. Давление в левом предсердии. В. Давление в правом желудочке. Г. Давление в правом предсердии. Д. Градиент давления между левым предсердием и диастолическим давлением в левом желудочке.
50. Систолический шум изгнания отличается от систолического шума регурщ- тации следующим: А. Сливается с I тоном. Б. Возникает в первую треть систолы. В. Сопровождается III тоном. Г. Возникает через небольшой интервал после I тона и имеет ромбовидную форму на ФКГ. Д. Сливается со II тоном.
51. Женщина 40 лет, страдающая митральным стенозом, жалуется на одышку, усталость, которые постепенно прогрессируют. В настоящее время не может выполнять легкую домашнюю работу. Больной показаны: А. Бициллинопрофилакти-ка. Б. Мочегонные препараты. В. Препараты дигиталиса. Г. Митральная комиссу- ротомия. Д. Периферические вазодилататоры.
52. Для митрального стеноза характерно все, кроме: А. Тромбоэмболии в сосуды большого круга кровообращения. Б. Расширения зубца Р. В. Снижения систолического АД. Г. Укорочения систолы левого предсердия. Д. Повышения венозного давления.
53. Для стеноза устья аорты нехарактерно: А. Ослабление I тона. Б. Проведение шума на сонные артерии. В. Развитие активной легочной гипертензии. Г. Кальци-ноз клапанов аорты. Д. Снижение систолического АД.
54. Идиопатическая гипертрофическая кардиомиопатия характеризуется следующими признаками, за исключением одного: А. Кривая каротидного пульса обнаруживает замедленный подъем. Б. Шум усиливается в вертикальном положении. В. Часто встречается усиленный IV тон. Г. В 50 % случаев наблюдается митральная недостаточность. Д. Жалобы на головную боль и одышку.
55. Систолический шум при гипертрофической идиопатической кардиомиопатии похож на шум, возникающий при: А. Стенозе устья аорты. Б. Недостаточности клапана аорты. В. Трикуспидальной недостаточности. Г. Митральной недостаточности. Д. Недостаточности клапана легочной артерии.
56. При гипертрофической кардиомиопатии может иметь место: А. Сужение путей оттока из левого желудочка. Б. Митральная недостаточность. В. Гипертрофия левого желудочка. Г. Внезапная смерть. Д. Все вышеперечисленные признаки.
57. Для дилатационной кардиомиопатии в стадии сердечной недостаточности при аускультации характерны: А. Диастолический шум над легочной артерией. Б. Ритм галопа. В. Хлопающий I тон. Г. Диастолический шум над верхушкой. Д. Усиленный IV тон.
58. Если у больного с рестриктивной кардиомиопатией появится сердечная недостаточность, то следует применить: А. Препараты дигиталиса. Б. Фуросемид-В. Пропранолол. Г. Эуфиллин. Д. Оксигенотерапию.
59. При дилатационной кардиомиопатии конфигурация сердца напоминает встречаемую при: А. Митральном стенозе. Б. Аортальной гипертонии. В. Конст- риктивном перикардите. Г. Экссудативном перикардите. Д. Диффузном миокардите.
60. Больной 45 лет страдает гипертонической болезнью II стадии. При исследовании центральной гемодинамики вьювлены увеличенный сердечный выброс, а также наклонность к тахикардии. Какому препарату следует отдать предпочтение для снижения АД: А. Гидрохлотиазид. Б. Метопролол. В. Нифедипин. Г. Энала-прил. Д. Верошпирон.
61. При гипертонической болезни содержание ренина в крови: А. У всех значительно повышено. Б. У всех незначительно повышено. В. В пределах нормы-Г. У всех снижено. Д. Повышено, в пределах нормы, у некоторых снижено.
62. Для диагностики вазоренальной формы АГ необходимо выполнить следующие исследования, кроме одного: А. Урография. Б. Определение уровня ренина в
плазме крови. В. Ангиография почечных вен. i. w берга-
63. Рациональной терапией при вазоренальной гипертонии является применение1 А. Диуретиков. Б. |3-Адреноблокаторов. В. Бессолевой диеты. Г. Хирургического печения. Д. Ингибиторов АПФ.
64. В питании больного гипертонической болезнью обязательно следует ограничивать: А. Воду. Б. Сахар. В. Поваренную соль. Г. Специи (перец, хрен, горчица).
д Все перечисленное.
65. Основной лечебный эффект нитроглицерина у больных с приступом сте нокардии связан с: А. Расширением коронарных артерий. Б. Расширением пери ферических артерий. В. Дилатацией периферической венозной системы. Г. Увели чением коронарного кровотока вследствие увеличения частоты сокращений серд ца. Д- Замедлением частоты сокращений и снижением потребности миокарда в
кислороде.
66. Каждый из представленных признаков встречается при хронической постинфарктной аневризме, за исключением одного: А. Наличия постоянного подъема сегмента ST вследствие перенесенного инфаркта миокарда. Б. Локализации перенесенного инфаркта миокарда чаще при поражении передней стенки, чем диафраг- мальной. В. Увеличения риска разрыва сердца. Г. Повторных артериальных эмболии. Д- Диагноз аневризмы можно предположить при обнаружении на контуре сердца отложений извести (при рентгенологическом исследовании).
67. Больной 45 лет поступил в палату интенсивного наблюдения с острым передним инфарктом миокарда. АД 150/100 мм рт. ст., пульс 100 в минуту. Спустя 2 дня пожаловался на короткий приступ одышки. АД 100/70 мм рт. ст., пульс 120 в минуту, частота дыханий 32 в минуту, в нижних отделах легких появились мелкопузырчатые незвонкие влажные хрипы. В нижней части грудины, по левому ее краю, стал выслушиваться интенсивный систолический шум в сочетании с ритмом галопа. Насыщение крови кислородом в правом желудочке увеличено. Наиболее вероятный диагноз: А. Разрыв стенки с тампонадой сердца. Б. Дисфункция сосоч-ковой мышцы. В. Разрыв сосочковой мышцы. Г. Разрыв межжелудочковой перегородки. Д. Эмболия легочной артерии.
68. Мужчина 50 лет поступил в палату интенсивного наблюдения с острым диа- фрагмальным инфарктом миокарда. АД 140/90 мм рт. ст., пульс 80 в минуту, число дыханий 16 в минуту. При исследовании сердца выслушивается ритм галопа. Внутривенно введено 40 мг фуросемида, после чего был обильный диурез. Спустя 12 ч АД 80/60 мм рт. ст., пульс 88 в минуту, жалобы на боли в груди. Катетер Сван-Ган-за введен в легочную артерию (легочное капиллярное давление снижено до 4 мм рт. ст., при норме 5—12 мм рт. ст.). Наиболее целесообразная терапия в данный момент: А. Внутривенное введение жидкости. Б. Инфузия норадреналина. В. Ин-фузия допамина. Г. Внутривенно фуросемид (40 мг). Д. Внутривенно препараты дигиталиса.
69. Стенокардия является выражением: А. Митрального стеноза. Б. Относительной или абсолютной недостаточности кровоснабжения миокарда. В. Уменьшения венозного притока к сердцу. Г. Легочной недостаточности. Д. Атеросклероза аорты.
70. Какой из перечисленных симптомов является патогномоничным для стенокардии: А. Колющие боли в области сердца во время физической нагрузки. Б. Предсердная экстрасистолия после физической нагрузки. В. Загрудинная боль и депрессия сегмента ST, возникающие при нагрузке. Г. Зубец Q в отведениях III и aVF. Д. Негативный зубец Т в отведениях V2 6-
71. На 3-й неделе после инфаркта миокарда отмечаются боль в грудной клетке, повышение температуры тела, увеличение СОЭ, шум трения перикарда. Предпола гаемый диагноз: А. Распространение зоны поражения миокарда. Б. Идиопатиче- ский перикардит. В. Постинфарктный синдром. Г. Разрыв миокарда. Д. Разрыв сердечных хорд.
72. Для ИБС является все нехарактерным, за исключением одного: А. Подъем сегмента ST при проведении калиевой пробы. Б. Положительная проба с (Ь-адре- ноолокаторами. В. Реверсия негативного зубца Г при калиевой пробе. Г. Депрессия сегмента >ST при ВЭМ-пробе. Д. Депрессия сегмента 5Тпри пробе с гипервентиля- йией.
73. При остро возникшей сердечной астме назначают: А. Введение прессорных аминов. Б. Фуросемид внутривенно. В. Эуфиллин внутрь. Г. Пропранолол внутрь. Д- Ингаляцию симпатомиметика.
74. При правожелудочковой недостаточности наблюдаются перечисленные симптомы, за исключением одного: А. Отеки нижних конечностей. Б. Гипертензия в малом круге кровообращения. В. Набухание шейных вен. Г. Значительное повышение давления в легочных капиллярах. Д. Повышение конечного диастолического давления в правом желудочке.
75. Левожелудочковая недостаточность является осложнением следующих заболеваний, кроме одного: А. Стеноз устья аорты. Б. Недостаточность митрального клапана. В. Острый инфаркт миокарда. Г. Митральный стеноз. Д. Артериальная гипертония.
76. Левожелудочковая недостаточность ведет к перегрузке правых отделов сердца вследствие: А. Снижения коронарной перфузии. Б. Спазма легочных артериол. В. Ретроградной передачи повышенного давления на сосуды малого круга. Г. Снижения периферического сопротивления. Д. Повышения легочного сопротивления.
В вопросах 77—80 приведены симптомы (1, 2, 3 ...) и диагнозы (А, Б, В ...), выберите правильные комбинации «вопрос —ответ» (симптом—диагноз).
77. Вопрос: 1. Митральный стеноз. 2. Спленомегалия. 3. Узелки Гебердена.
4. Увеличение СОЭ. 5. Геморрагические высыпания. 6. Аннулярная эритема. 7. Эф фект от антибиотиков. 8. Эффект от цигостатиков. 9. Изолированное поражение клапана аорты.
А. Инфекционный эндокардит. Б. Ревматизм. В. Оба заболевания. Г. Ни то, ни
другое заболевание.
78. Вопрос: 1. Венозный застой. 2. Расширение границ сердца в обе стороны. 3. Верхушечный толчок в пределах сердечной тупости. 4. Шум трения перикарда.
5. «Втягивающий» верхушечный толчок. 6. Небольшие размеры тупости сердца. 7. Тупой кардиодиафрагмальный угол. 8. Увеличение печени.
A. Сухой перикардит. Б. Выпотной перикардит. В. Слипчивый перикардит.
79. Вопрос: 1. Систолический шум над верхушкой. 2. Дополнительный тон в систоле. 3. Дополнительный тон в диастоле. 4. Диастолический шум. 5. Неизменен ный I тон. 6. Разрыв сухожильных нитей. 7. Усиление систолического шума при проведении пробы Вальсальвы.
А Пролапс митрального клапана. Б. Недостаточность митрального клапана.
B. Оба заболевания. Г. Ни то, ни другое заболевание.
80. Вопрос: 1. Эпизодические подъемы АД. 2. Стабилизация диастолического АД. 3. Гипертрофия левого желудочка. 4. Склеротические изменения артерий глаз ного дна. 5. Церебральный инсульт. 6. Быстрое снижение АД после приема гипо тензивных препаратов. 7. Хроническая почечная недостаточность. 8. Инфаркт мио карда.
А Гипертоническая болезнь II стадии. Б. Гипертоническая болезнь I стадии.
В. Гипертоническая болезнь III стадии.
Глава III
Болезни органов пищеварения
ХРОНИЧЕСКИЙ ГАСТРИТ (ХГ) — заболевание желудка, характеризующееся хроническим воспалительным процессом его слизистой оболочки, выражающимся в… Статистические исследования показывают, что примерно 50 % трудо-Содержание
Хронический гастрит......................................................... 291
Язвенная болезнь............................................................... 304
Заболевания кишечника.................................................... 313
Хронический энтерит.................................................... 314
Неспецифический язвенный колит................................ 320
Болезнь Крона................................................................ 328
Синдром раздраженного кишечника............................. 333
Хронический гепатит. — В.М. Махов................................ 336
Цирроз печени. — В.М. Махов........................................... 352
Хронический холецистит.................................................. 365
Хронический панкреатит.................................................... 376
Контрольные вопросы и задачи................................ 388
способного населения развитых стран страдают ХГ.
Среди заболеваний органов пищеварения ХГ занимает первое место (около 35 %), а среди всех заболеваний желудка ХГ встречается в 80—85 % случаев, часто являясь предшественником таких заболеваний, как язвенная болезнь и рак желудка.
Классификация. В настоящее время пользуются классификацией ХГ, которая содержит основные положения так называемой Сиднейской системы (1990, 1994), которую в полной мере можно назвать этиопатогенетиче-сКой. Согласно этой системе выделяют:
• аутоиммунный — фундальный гастрит (ХГ «типа А»);
• ассоциированный с Helicobacter pylori (HP) — антральный гастрит (ХГ «типа В»);
• химически обусловленный (ХГ «типа С»), в том числе вследствие рефлюкса (рефлюкс-гастрит), воздействия алкоголя, нестероидных противовоспалительных препаратов (НПВП);
• смешанный гастрит (ХГ «типа А +
„ • особые формы ХГ (лимфоцитарныи, эозинофильныи, гранулематоз- ныи, гиперпластическии);
• идиопатический ХГ (с невыясненной этиологией и патогенезом).
Из числа всех ХГ 70 % приходится на гастриты, ассоциированные с
ИР, 15—18 % — на аутоиммунные ХГ. В группе ХГ «типа С» на долю «реф- люкс-гастрита» приходится менее 5 %, а около 10 % — на ХГ, ассоциируемые с НГТСП. На особые формы ХГ приходится около 1 % ХГ, в связи с этим такие формы ХГ называют «редкими».
Этиология. ХГ является полиэтиологическим заболеванием. В настоящее время к наиболее вероятным причинам, вызывающим ХГ, относятся следующие:
• инфицирование слизистой оболочки желудка HP;
• генетический фактор, приводящий к образованию аутоантител к об- кладочным клеткам;
• повреждающее действие дуоденального содержимого (желчных кислот, лизолецитина) на слизистую оболочку желудка при рефлюксе его содержимого после резекции желудка и органосберегающих операций.
Кроме того, выделяют две большие группы факторов — экзогенные и эндогенные; не являясь этиологическими, они могут приводить к обострению заболевания.
К экзогенным факторам относят: 1) нарушение питания (нарушение ритма приема пищи, переедание, недостаточное прожевывание пищи, злоупотребление грубой, острой, горячей пищей, неполноценное питание); 2) курение и алкоголь; 3) профессиональные вредности (заглатывание металлической, хлопковой пыли, паров, щелочей и кислот); 4) длительный прием некоторых лекарственных средств (НПВП, глюкокортикостероиды, препараты наперстянки).
К эндогенным факторам относят: 1) хронические инфекции (полости рта и носоглотки, неспецифические заболевания органов дыхания и туберкулез, хронический холецистит и пр.); 2) заболевания эндокринной системы (болезнь Аддисона, гипотиреоз, диффузный токсический зоб, болезнь Иценко— Кушинга, сахарный диабет); 3) нарушение обмена веществ (ожирение, дефицит железа, подагра); 4) заболевания, приводящие к тканевой гипоксии (сердечная и легочная недостаточность и пр.); 5) аутоинтоксикация (уремия).
Среди экзогенных факторов главное место отводят алиментарным нарушениям и приему лекарственных препаратов, среди эндогенных — воспалительным заболеваниям органов брюшной полости, эндокринным расстройствам и метаболическим нарушениям.
Патогенез. Представления о том, что ХГ является результатом перенесенного острого гастрита, не получили убедительного подтверждения. Считают, что ХГ является самостоятельным заболеванием, с самого начала характеризующимся хроническим течением.
Под влиянием различных этиологических факторов (и при участии сопутствующих) происходит ряд функциональных и морфологических изменений желудка, что проявляется секреторными и моторными нарушениями, находящими свое отражение в клинической картине болезни. Предполагают, что первоначально возникают функциональные расстройства секреции и моторики желудка. В дальнейшем к функциональным изменениям 292
присоединяются органические: так, в частности, избыток ионов водорода при гиперсекреции соляной кислоты угнетает активность сульфатазы (фермент, ответственный за поддержание нормальных соотношений компонентов желудочного сока), результатом чего является дальнейшее подавление желудочной секреции и повреждение эпителиальных структур слизистой оболочки желудка с последующим нарушением физиологической регенерации.
Нарушение физиологической регенерации железистого эпителия является основным звеном в развитии всех форм ХГ, кроме поверхностного, при котором этих нарушений нет или они незначительны. При всех остальных формах ХГ нарушение физиологической регенерации выражается в преобладании процессов пролиферации клеток эпителия над дифференциацией. Эпителий не стареет, а лишь теряет свойственные ему морфологические и функциональные признаки за счет вытеснения дифференцированных клеток более молодыми, незрелыми. Нарушение камбиального слоя эпителиальных клеток изменяет процессы репаративной регенерации. При ХГ не только уменьшается количество железистых клеток, но и происходит перестройка железистого аппарата; в слизистой оболочке появляются островки желез, аналогичных по своему строению кишечным железам. Все это приводит к снижению секреции соляной кислоты. Кроме структурных изменений, в слизистой оболочке появляется клеточная инфильтрация (неспецифическое воспаление).
При ХГ «типа А» в развитии атрофии слизистой оболочки принимают участие аутоиммунные процессы: образующиеся аутоантитела к обкладоч- ным клеткам желудочных желез приводят к их гибели.
При гастрите «типа В» основной причиной возникновения болезни является HP. Заражение происходит фекально-оральным и орально-оральным путем. Инфицирование возникает в детском, подростковом, а также молодом (до 20 лет) возрасте. Цитотоксин, вырабатывающийся большинством штаммов HP, и аммиак, образующийся при расщеплении мочевины уреазой, приводят к гибели эпителиальных клеток. Воспалительная реакция, развивающаяся в слизистой оболочке в ответ на внедрение ИР, сама по себе способствует нарушению целостности желудочного эпителия. Бактериальные ферменты нарушают целостность мембран эпителиальных клеток и снижают их резистентность к повреждающим факторам. Нарушается защитная функция желудочной слизи. Гастрит «типа В» развивается в молодом возрасте и встречается в 4 раза чаще, чем гастрит «типа А».
Моторно-эвакуаторные нарушения, в результате которых содержимое двенадцатиперстной кишки (секрет поджелудочной железы и желчные кислоты) попадает в желудок, также участвуют в повреждении слизистой оболочки. Этот механизм является главным в развитии рефлюкс-гастрита — гастрита «типа С», точно так же, как прием НПВП и злоупотребление алкоголем.
Кроме того, в слизистой оболочке желудка происходит раскрытие шунтов между артериями и венами. Шунтирование в подслизистом слое способствует развитию ишемии, которая приводит к повреждению слизистой оболочки желудка и ее желез, нарушению регенераторных процессов. Первоначально изменения слизистой оболочки локализуются в антральном отделе (по типу поверхностного гастрита), затем они распространяются по Направлению к фундальному отделу и становятся со временем диффузными. Кроме того, эти изменения распространяются и «вглубь», приобретая Постепенно атрофический характер.
хема 14. ПАТОГЕНЕЗ ХРОНИЧЕСКОГО ГАСТРИТА
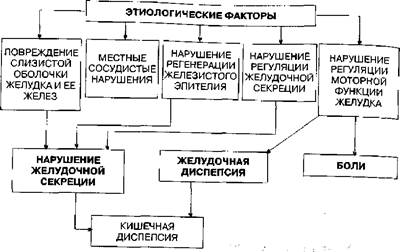
|
При ХГ изменяется также клеточный состав стромы слизистой оболочки желудка, увеличивается количество плазматических и уменьшается количество тучных клеток. Очевидно, с этим связано усиление синтеза иммуноглобулинов (плазматические клетки) и уменьшение выработки эндогенного гистамина (тучные клетки).
Развивающаяся структурная перестройка является основой морфологических изменений, способствующих длительному хроническому процессу в желудке (схема 14).
Клиническая картина. ХГ «типа А» обнаруживается преимущественно в среднем и пожилом возрасте, а наиболее часто встречающаяся форма ХГ — хеликобактерная («тип В») — развивается в молодом возрасте. Секреторная функция при ХГ «типа В» не нарушена или даже повышена в начале заболевания. При развитии гипацидности у этих больных не наблюдается гаст- ринемии, что является существенным отличием ХГ «типа В» от ХГ «типа А». Основные отличительные признаки ХГ «типа А» и «типа В» представлены в табл. 17.
При ХГ «типа А» при рентгенологическом исследовании отмечается угнетение моторики («вялый» желудок), тогда как при ХГ «типа В» — усиление моторики («раздраженный» желудок).
В зависимости от вовлечения в патологический процесс фундального или антрального отдела клиническая картина ХГ меняется. Так, при развитии процесса только в фундальном отделе отмечаются ранние, умеренной интенсивности разлитые боли в эпигастральной области; фундальный гастрит создает предпосылку для образования язвы желудка. При изменении слизистой оболочки антрального отдела центральное место в клинической картине занимают поздние боли, локализующиеся в пилородуоденальнои области, и синдром «ацидизма»; чаще встречается у лиц молодого возраста и предрасполагает к развитию язвы двенадцатиперстной кишки. 294
таблица 17. Характеристика ХГ «типа А» (аутоиммунного) и ХГ «типа В» /хеликобакгерного)
|
Клиническую картину распространенного ХГ составляют следующие основные синдромы: 1) желудочная диспепсия; 2) боли в эпигастрии; 3) кишечная диспепсия; 4) астеноневротический синдром. Реже встречаются анемический синдром, проявления полигиповитаминоза и гипокорти- цизма.
В тяжелых случаях ХГ «типа А» нередко развивается В^-дефицитная анемия и выявляются характерные клинические признаки: бледность кожи, глоссит, неврологические нарушения и др.
При обострении ХГ клинические проявления выражены ярко:
1) синдром желудочной диспепсии (у 90 % больных) включает «кислую» диспепсию (изжога, «раннее» ощущение голода, кислая отрыжка, кислый вкус во рту) и «дисмоторную» диспепсию (тяжесть, чувство распирания в эпигастральной области после еды, отрыжка, срыгивание, тошнота, рвота, снижение аппетита, неприятный вкус во рту);
2) боли в эпигастрии неинтенсивного характера;
3) симптомы «кишечной» диспепсии встречаются у 20—40 % больных и проявляются метеоризмом, урчанием и переливанием в животе; нарушением стула (запоры, поносы, неустойчивый стул);
4) астеноневротический синдром выражен практически у всех больных при обострении ХГ, о чем свидетельствуют раздражительность, неустойчивость настроения, мнительность, канцерофобия, быстрая утомляемость, плохой сон.
Клиническая картина гастрита с секреторной недостаточностью отличается от проявлений ХГ с сохраненной или повышенной секреторной функцией.
Хронический гастрит с выраженной секреторной недостаточностью.
На I этапе диагностического поиска: 1) делают предположение о заболевании желудка на основании жалоб на боли в… 2) уточняют вариант течения: хронический, доброкачественный (большая длительность заболевания, сохраненная…Схема IS. ПАТОГЕНЕЗ ЯЗВЕННОЙ БОЛЕЗНИ
| Способствующие факторы |
| _Эт, |
Этиологические факторы (?)
| Инфицирование Helicobacter pylori |
Нарушение нейроэндокринной регуляции
Понижение активности

| Повышение уровня гастрина |
| Повышение активности парасимпатической |
| Генетические предпосылки |
| Высокая желудочная секреция |
| Особенности строения эпителия слизистой оболочки |
| Нарушение моторики желудка и двенадцатиперстной кишки |
местных защитных механизмов слизистой оболочки желудка и двенадцатиперстной кишки
Повреждение слизистой оболочки желудка или двенадцатиперстной кишки
• по наличию осложнений: осложненная; неосложненная. Осложнения ЯБ проявляются кровотечением, пенетрацией, перфорацией, малигни-зацией, стенозом привратника и луковицы, перивисцеритами.
Клиническая картина. Клинические проявления ЯБ отличаются многообразием и зависят от фазы течения (обострения или ремиссия), клинико- морфологического варианта (ЯБ желудка или двенадцатиперстной кишки) и наличия осложнений.
При обострении ЯБ независимо от ее клинического варианта выражены следующие основные синдромы: 1) болевой (имеет определенные закономерности в зависимости от локализации язвы); 2) желудочной диспепсии; 3) кишечной диспепсии; 4) астеновегетативный; 5) локальных изменений; 6) осложнений.
Язвенная болезнь желудка. ЯБ желудка встречается, как правило, у людей зрелого возраста, чаще у мужчин. Дефект локализуется преимущественно на желудочной дорожке малой кривизны или в антральном отделе, но может обнаруживаться в кардиальном и пилорическом отделах.
На I этапе диагностического поиска выявляют жалобы, связанные с проявлением самой ЯБ, с наличием осложнений, вовлечением в процесс Других органов пищеварительной системы.
При обострении ЯБ желудка основной жалобой является боль в верхней половине эпигастральной области. Хотя локализация боли не имеет абсолютного значения, считают, что при язвах кардиальной части и язвах На задней стенке желудка боли локализуются за грудиной, могут иррадии-ровать в левое плечо (напоминают боли при стенокардии).
Для язв малой кривизны желудка характерен четкий ритм болей: возникают через 15—60 мин после еды, особенно при несоблюдении диеты. Сра
зу после приема пищи боли возникают, если язва локализуется в кардиаль- ной части или на задней стенке желудка.
О язве антрального отдела желудка свидетельствуют «голодные», ночные, поздние (через 2—3 ч после еды) боли, напоминающие боли при ЯБ двенадцатиперстной кишки. При язвах пилорической части боли интенсивные, не связанные с приемом пищи.
Присоединение болей опоясывающего характера или иррадиация их в спину, интенсивный характер болей требуют исследования поджелудочной железы на последующих этапах диагностического поиска (реактивный панкреатит, пенетрация в поджелудочную железу).
Синдром желудочной диспепсии выражен в меньшей степени, проявляется отрыжкой воздухом, пищей, срыгиванием; тошнота и рвота часто отмечаются при язвах канала привратника.
Рвота — нередкая жалоба при ЯБ, рвотные массы состоят преимущественно из примесей пищи. Частая рвота, усиливающаяся к вечеру, содержащая давно съеденную пищу, сочетающаяся с чувством переполнения желудка, похудением, может свидетельствовать о стенозе выходного отдела желудка.
Кишечный и астеновегетативный синдромы менее выражены при ЯБ желудка, чем при ЯБ двенадцатиперстной кишки. Часть больных жалуются на запоры, сочетающиеся с болями по ходу толстой кишки и вздутием живота.
Наклонность к кровотечениям характерна для язвы антрального отдела желудка у молодых; кровотечения у пожилых пациентов настораживают в отношении малигнизации (развитие язвы-рака желудка).
На этом этапе обследования оценивают эффективность проводившегося ранее лечения, выясняют частоту рецидивов, т.е. уточняют характер течения процесса — доброкачественный или прогрессирующий.
На II этапе диагностического поиска выявляют: а) симптомы локальных изменений; б) осложнения; в) вовлечение в процесс других отделов пищеварительной системы.
Физикальные признаки ЯБ при неосложненном течении немногочисленны. Как правило, отмечают умеренную локальную мышечную защиту в эпигастрии и точечную болезненность в различных отделах этой области. При кардиальных язвах выявляется точечная болезненность под мечевидным отростком; при язвах пилорической части — в пилородуоденальной зоне.
Разлитая болезненность в эпигастрии при одновременной локальной болезненности — признак обострения ХГ (ХГ сопутствует ЯБ) или перигастрита (осложнение ЯБ). При физикальном исследовании могут быть получены данные о развитии других осложнений. Так, появление шума плеска спустя 5—6 ч после приема жидкости свидетельствует о развитии стеноза привратника.
Бледность и влажность кожных покровов, субфебрильная температура тела, тахикардия, снижение АД, исчезновение болезненности в эпигаст- ральной области при пальпации живота являются признаками язвенного кровотечения.
На III этапе диагностического поиска можно: 1) определить характер нарушения желудочной секреции; 2) уточнить характер и локализацию язвенного поражения; 3) выявить или уточнить осложнения.
Исследование желудочной секреции выявляет ее нарушения в сторону понижения или умеренного повышения, т.е. характерного нарушения секреции при ЯБ желудка не существует.
Рентгенологическое исследование желудка примерно у 3/4 больных позволяет обнаружить главный признак ЯБ — «нишу». Поверхностные язвы, не сопровождающиеся воспалительной реакцией окружающей слизистой оболочки, рентгенологически могут не выявляться.
При отсутствии прямого рентгенологического признака («ниши») принимают во внимание косвенные признаки: «пальцевое» втяжение, задержку сульфата бария в желудке более 6 ч после его приема, локальную болезненность при пальпации во время исследования. При рентгенологическом исследовании могут быть выявлены рубцовое сужение привратника, опухоль желудка (полипы, рак и др.).
Наиболее ценную информацию о «нише», ее локализации, глубине, характере (наличие каллезной язвы) и для уточнения осложнений (малигни- заиия, пенетрация, кровотечение и пр.) дают результаты гастродуоденофиб- роскопии.
Гастроскопия в сочетании с прицельной биопсией облегчает выявление малигнизации язвы.
При наличии анемии и положительной реакции Вебера при исследовании кала можно с уверенностью говорить о рецидивирующих кровотечениях.
Язвенная болезнь двенадцатиперстной кишки. Язвенная болезнь двенадцатиперстной кишки встречается преимущественно у молодых мужчин; у женщин отмечается рост заболеваемости в период климакса.
В подавляющем большинстве случаев дефект локализуется в луковице двенадцатиперстной кишки, чаще на задней стенке; встречаются так называемые целующиеся язвы, поражающие как заднюю, так и переднюю стенку луковицы.
На I этапе диагностического поиска по совокупности жалоб можно с большой вероятностью предположить возможность обострения Я Б двенадцатиперстной кишки.
Самый главный симптом — боли, возникающие через 1,5—3 ч после приема пищи (так называемые поздние боли), часто натощак (голодные боли) и ночью (ночные боли), проходят после приема пищи и щелочей. Отчетливо проявляется сезонность болей (обострение весной и осенью).
Структура болевого синдрома может быть представлена следующим образом: голод — боль — пища — облегчение — голод — боль и т.д. Четкой локализации болей не отмечается: они могут быть в подложечной области, правом верхнем квадранте живота, около пупка и т.д.
Изменение характера боли указывает на возможность развития осложнения: при пенетрации в поджелудочную железу появляются боли в левом верхнем квадранте живота, они иррадиируют в позвоночник. Для пенетра- Ции язвы в желчный пузырь характерны доминирующие боли в правом подреберье с иррадиацией под правую лопатку, в спину.
Второй важный симптом — рвота, возникающая обычно на высоте болей, особенно при осложненных формах заболевания. Рвота, как правило, приносит облегчение (уменьшаются боли).
Ранним и наиболее частым симптомом является изжога (симптом «аци- Дизма»), Отрыжка кислым реже беспокоит больных, обычно возникает после приема пищи.
Характерны запоры, обусловленные изменением моторики кишечника, Патогномоничным для ЯБ двенадцатиперстной кишки.
Отличает данное заболевание также выраженность астеновегетативных Проявлений (повышенная раздражительность, нарушение сна, снижение Работоспособности и пр.).
На II этапе диагностического поиска данные менее информативны. При физикальном обследовании выявляют симптомы: 1) вегетативной дисфункции (повышенная потливость, красный и белый дермографизм, дис- гидроз); 2) локальной болезненности и напряжения мышц в эпигастрии и пилородуоденальной зоне; 3) усиления моторной функции желудка и толстой кишки (гиперперистальтика, спастическое состояние); 4) вовлечения в процесс других органов пищеварительной системы (поджелудочная железа, желчный пузырь).
Данные III этапа диагностического поиска позволяют: а) поставить окончательный диагноз; б) уточнить развитие осложнений; в) обнаружить вовлечение в патологический процесс других органов.
Для ЯБ двенадцатиперстной кишки характерно повышение секреторной функции желудка. При исследовании желудочного сока выявляется повышение базальной и стимулированной секреции соляной кислоты и пепсина в 1 '/2—2 раза по сравнению с показателями секреции у здоровых людей.
Прямым признаком ЯБ является обнаружение «ниши», которая наиболее часто локализуется в луковице двенадцатиперстной кишки, реже вне ее (постбульбарная). Основные методы диагностики — рентгенологический и эндоскопический (фиброгастродуоденоскопия).
Рентгенологическое исследование выявляет: 1) прямые признаки: а) «ниша» с радиарной конвергенцией складок; б) типичная деформация луковицы; 2) косвенные признаки: а) спазм привратника; б) дискинезия луковицы, повышение тонуса и усиление перистальтики двенадцатиперстной кишки; в) зубчатость контуров слизистой оболочки луковицы; г) гиперсекреция желудка.
Стеноз луковицы и степень его выраженности также обнаруживают рентгенологически.
Для диагностики постбульбарных язв используют рентгеноконтрастную дуоденографию, ее проводят при гипотонии двенадцатиперстной кишки.
При фиброгастродуоденоскопии выявляются язвенные дефекты слизистой оболочки.
Клинический анализ крови, выявляющий анемию, позволяет заподозрить массивное или рецидивирующее кровотечение.
Серийное исследование кала на скрытую кровь помогает выявить скрытое кровотечение.
Диагностика. Для постановки правильного диагноза необходимо учитывать ряд признаков.
• Основные: 1) характерные жалобы и типичный язвенный анамнез; 2) обнаружение язвенного дефекта при гастродуоденоскопии; 3) выявление симптома «ниши» при рентгенологическом исследовании.
• Дополнительные: 1) локальные симптомы (болевые точки, локальное мышечное напряжение в эпигастрии); 2) изменения баз&тьной и стимулированной секреции; 3) «косвенные» симптомы при рентгенологическом исследовании; 4) скрытые кровотечения из пищеварительного тракта.
Формулировка развернутого клинического диагноза учитывает: 1) клинический вариант (ЯБ желудка или двенадцатиперстной кишки); 2) форму заболевания (впервые выявленное, рецидивирующее); 3) локализацию язвы: малая кривизна, антральный отдел, канал привратника; внелукович-ная язва и сочетанные язвы (на основании данных эндоскопического и рентгенологического исследований); 4) фазу течения: обострение, стихающее обострение, ремиссия; 5) наличие осложнений: желудочно-кишечное 310
кровотечение, перфорация, пенетрация, стенозирование, перивисцерит, развитие рака, реактивного панкреатита.
Лечение. Консервативное лечение ЯБ всегда комплексное, дифференцированное с учетом факторов, способствующих заболеванию, патогенеза, покализации язвенного дефекта, характера клинических проявлений, степени нарушения функций гастродуоденальной системы, осложнений и сопутствующих заболеваний.
В период обострения больных необходимо госпитализировать возможно паныпе, так как установлено, что при одной и той же методике лечения длительность ремиссий выше у больных, лечившихся в стационаре. Лечение в стационаре должно проводиться до полного рубцевания язвы. Однако к этому времени все еще сохраняются гастрит и дуоденит, в связи с чем следует продолжить лечение еще в течение 3 мес в амбулаторных условиях.
Противоязвенный курс: 1) устранение факторов, способствующих рецидиву болезни; 2) лечебное питание; 3) лекарственная терапия; 4) физические методы лечения (физиолечение, гипербарическая оксигенация — ГБО, иглорефлексотерапия, лазеротерапия, магнитотерапия).
• Устранение факторов, способствующих рецидиву болезни, преду сматривает организацию регулярного питания, оптимизацию условий труда и быта, категорическое запрещение курения и употребления алкоголя, за прещение приема лекарственных препаратов, обладающих ульцерогенным эффектом.
• Лечебное питание обеспечивается назначением диеты, которая должна содержать физиологическую норму белка, жира, углеводов и витаминов. Предусматривается соблюдение принципов механического, термического и химического щажения.
• Лекарственная терапия имеет своей целью:
а) эрадикацию HP;
б) подавление избыточной продукции соляной кислоты и пепсина или их нейтрализацию и адсорбцию;
в) восстановление моторно-эвакуаторной функции желудка и двена дцатиперстной кишки;
г) защиту слизистой оболочки желудка и двенадцатиперстной кишки;
д) стимуляцию процессов регенерации клеточных элементов слизистой оболочки и купирование воспалительно-дистрофических изменений в ней.
• Эрадикация HP достигается проведением недельного курса «трех- компонентной» схемы (терапия первой линии):
омепразол 20 мг, амоксициллин 1000 мг, кларитромицин 250 мг (2 раза в день), или:
омепразол 20 мг, тинидазол 500 мг, кларитромицин 250 мг (2 раза в день), или:
ранитидин висмута цитрат (пилорид) 400 мг 2 раза в день в конце еды, кларитромицин 250 мг или тетрациклин 500 мг или амоксициллин 1000 мг (2 раза в день), тинидазол 500 мг 2 раза в день во время еды.
При неэффективности эрадикации назначают на 7 дней резервную че- тырехкомпонентную схему (терапия второй линии), состоящую из ингибитора протоновой помпы, препарата солей висмута и двух антимикробных Препаратов: омепразол 2 0 м г 2 раза в день (утром и вечером, не поздне-л 20 ч), коллоидный субцитрат висмута 120 мг 3 раза в день за «эО мин до еды и 4-й раз через 2 ч после еды перед сном, метронида-3 л 250 мг 4 раза в день после еды или тинидазол 500 мг 2 раза в день после еды, тетрациклин или амоксициллин по 500 мг 4 раза в день после еды.
После окончания комбинированной эрадикаиионной терапии следует продолжить лечение еще в течение 5 нед при ЯБ двенадцатиперстной кищ, ки и 7 нед при ЯБ желудка с использованием одного из следующих препаратов: ранитидин (300 мг в 19—20 ч) или фамотидин (40 мг в 19—20 ч) или ранитидин висмута цитрат (пилорид — 400 мг утром и вечером).
• Подавление избыточной секреции желудка достигается с помощью селективных м-холиноблокаторов — пирензепин (гастроцепин) в суточной дозе 75—100 мг (по 25—50 мг утром за 30 мин до завтрака и 50 мг перед сном).
Для снижения секреции используют также блокаторы Н2-рецепторы (фамотидин, ранитидин). Эти препараты, блокируя Н2-рецепторы, находящиеся в обкладочных клетках желудка, тормозят базальную и стимулированную гистамином и пентагастрином секрецию соляной кислоты. Используют также блокаторы «протонового насоса» — омепразол, применяемый 2 раза в день по 20 мг.
При лечении антисекреторными препаратами (омепразолом, блокатора-ми Н2-рецепторов и в меньшей степени гастроцепином) в слизистой оболочке желудка развивается гиперплазия гастрин- и гистаминобразуюгцих клеток. В связи с этим необходимы постепенная отмена этих препаратов после рубцевания язвы и обязательное сочетание их приема с нерастворимыми антацидами (алмагель, фосфалюгель, гелюсил лак), которые принимают только в промежутке между приемом пищи (через 1,5—2 ч после еды и на ночь) до наступления полной ремиссии.
• Для нормализации моторно-эвакуаторной функции желудка и двенадцатиперстной кишки назначают метоклопрамид (церукал) по 10 мг 3—4 раза в день или сульпирид (эглонил) по 50 мг 3 раза в день или дом-перидон (10 мг).
• Для защиты слизистой оболочки желудка и двенадцатиперстной кишки применяют коллоидный субцитрат висмута (де-нол), который, соединяясь с белками, освобождающимися в язвенном и эрозивном дефектах, образует вокруг них нерастворимый преципитат, покрывающий слизистую оболочку белково-висмутовой пленкой, Де-нол назначают по 1—2 таблетки за 30 мин до еды 3—4 раза в день. Другой препарат, образующий на поверхности слизистой оболочки защитный слой, резистентный к деструктивному действию соляной кислоты и пепсина — сукральфат (по 1 таблетке 3 раза в день за 30—40 мин до еды и 4-й раз — перед сном).
Де-нол и сукральфат особенно показаны больным, которые не могут самостоятельно прекратить курение, поскольку курение в несколько раз снижает эффективность блокаторов Н2-рецепторов.
В клиническую практику в последние годы введены новые препараты — синтетические аналоги простагландинов. Синтетический аналог простагландина Е, — риопростил — обладает выраженным антисекреторным эффектом, высокоэффективен также энпростил (аналог простагландина Е2).
• Физические методы лечения — тепловые процедуры в период стихания обострения (аппликации парафина, озокерита) при неосложненном течении заболевания и отсутствии признаков скрытого кровотечения.
При длительно нерубцующихся язвах, особенно у больных пожилого и старческого возраста, применяют в комплексной терапии ГБО, позволяющую уменьшить гипоксию слизистой оболочки выраженного органа. Наконец, имеется положительный опыт применения облучения язвенного де- 312
фекта лазером (через фиброгастроскоп); 7—10 сеансов облучения в существенной степени укорачивают сроки рубцевания.
В ряде случаев возникает необходимость в хирургическом лечении. Оперативное лечение показано больным ЯБ с частыми рецидивами при непрерывной терапии поддерживающими дозами противоязвенных препа-
Операпия безусловно показана в случаях пенетрации, перфорации язвы, стеноза пилородуоденального отдела с выраженными эвакуаторными нарушениями и при профузном желудочно-кишечном кровотечении.
В п е р и о д ремиссии ЯБ необходимо:
1) исключение ульцерогенных факторов (прекращение курения, упот ребления алкоголя, крепкого чая и кофе, лекарственных препаратов — НПВП);
2) соблюдение режима труда и отдыха, соблюдение диеты;
3) санаторно-курортное лечение;
4) диспансерное наблюдение с проведением поддерживающей терапии.
Непрерывная поддерживающая терапия проводится в течение нескольких
месяцев (и даже лет) антисекреторным препаратом в половинной дозе (например, принимать ежедневно вечером ранитидин по 150 мг или фамо- тидин по 20 мг).
Показаниями для непрерывной поддерживающей терапии являются:
• неэффективность проведенной эрадикационной терапии;
• осложнения (кровотечение или перфорация в анамнезе);
• наличие сопутствующих заболеваний, требующих приема НПВП;
• сопутствующий эрозивно-язвенный рефлюкс-эзофагит;
• возраст старше 60 лет в случае ежегодного обострения ЯБ, несмотря на адекватную терапию.
Прогноз. Для неосложненных форм ЯБ прогноз благоприятный, он ухудшается при часто рецидивирующих формах, серьезный при осложнениях.
Профилактика. В целях профилактики ЯБ рекомендуются устранение нервного напряжения, отрицательных эмоций, интоксикаций; прекращение курения, злоупотребления алкоголем; нормализация питания; соответствующее трудоустройство, активная лекарственная терапия хеликобактер- ной инфекции у больных ХГ.
Профилактическую терапию «по требованию» назначают при появлении симптомов, характерных для обострения ЯБ; она включает прием одного из антисекреторных препаратов (ранитидин, фамотидин, омепразол) в полной суточной дозе в течение 2—3 дней, а затем в половинной дозе — в течение 2 нед.
Заболевания кишечника
ЗАБОЛЕВАНИЯ КИШЕЧНИКА являются довольно частыми, однако>ш истинная встречаемость точно неизвестна, так как поражение ишетнш может быть как самостоятельной патологией, так и сопутствовать другимлза- болеваниям пищеварительного тракта (например, храптестмл тм/_дй> хроническому панкреатиту). Точный учет частоты заболевании ™еч™ затруднен еще и потому, что на различные патологические воздействия кишечник пеапгаует достаточно однотипной реакцией - поносом или запором. Между тем эти симптомы могут быть проявлением и сул6° флтм°" дальных расстройств и определяться также характером питания пациента.
В настоящее время нет единого подхода к классификации и диагностике заболеваний кишечника. Одни и те же страдания часто обозначаются различными терминами. В качестве самостоятельного диагноза фигурируют отдельные симптомы (запор, диарея, диспепсия) и синдромы, например синдром недостаточности всасывания (синдром мальабсорбции), синдром недостаточности пищеварения, синдром раздраженного кишечника, синдром избыточного роста бактерий в тонкой кишке, кишечная лимфоэкта-зия и пр.
В отечественной литературе термином «хронический энтерит» обозначают группу заболеваний, протекающих с многолетним нарушением кишечного пищеварения и всасывания, хотя некоторые авторы и не признают такое определение. Тем не менее при хроническом энтерите основными клиническими признаками являются синдромы мальабсорбции и нарушенного кишечного пищеварения, обусловливающие появление главного признака хронического энтерита — тонкокишечной диареи.
Термин «хронический колит» также трактуется чрезмерно широко и ошибочно включает в себя не только собственно воспалительные заболевания толстой кишки, но и ферментопатии, функциональную патологию, дисбактериоз, диспепсию (бродильную или гнилостную), неинфекционную диарею. Однако ряд авторов не признают существования неязвенных колитов, относя к воспалительным заболеваниям кишечника лишь неспецифический язвенный колит (НЯК) и гранулематозное поражение толстой кишки (болезнь Крона). Все это чрезвычайно затрудняет работу и не способствует единому подходу к заболеваниям кишечника.
В данном разделе наряду с неспецифическим язвенным колитом и болезнью Крона представлены хронический энтерит и синдром раздраженного кишечника.
Хронический энтерит
Хронический энтерит (ХЭ) — хроническое воспалительно-дистрофиче- ское заболевание тонкой кишки, приводящее к морфологическим изменениям слизистой оболочки и нарушению моторной, секреторной, всасывательной и других функций кишечника.
Для заболевания характерны воспалительные изменения слизистой оболочки (отек, нерезко выраженная инфильтрация слизистой оболочки лимфоцитами и плазматическими клетками, эрозии) с последующим развитием атрофических процессов. Одновременно поражаются кровеносные капилляры и лимфатические сосуды кишки, а также внутристеночные нервные сплетения. Дистрофические изменения обнаруживаются также в чревном сплетении и пограничных симпатических стволах.
Этиология. Причины развития ХЭ весьма разнообразны.
• Алиментарные нарушения, безрежимное питание, алкоголизм.
• Интоксикация лекарственными и химическими веществами.
• Воздействие проникающей радиации (как правило, ХЭ такой этиологии наблюдаются при рентгеновском облучении или лучевой терапии по поводу опухолей различного происхождения).
• Наследственно-конституциональный фактор; врожденный дефицит ферментов, в частности, участвующих в расщеплении различных углеводов.
• Заболевания пищеварительного тракта — «вторичные» энтериты.
Патогенез. В кишечнике развивается ряд патологических процессов, степень выраженности которых зависит от особенностей ведущего этиоло-
„ческого фактора. Так, нарушения моторики тонкой кишки и снижение барьерной функции стенки кишки (вследствие снижения продукции иммуноглобулинов и лизоцима, а также нарушения целостности эпителия) опосредованно приводят к нарушению переваривания (синдром мальдигестии) и всасывания (синдром мальабсорбции в узком смысле слова). Оба этих „ндрома обычно объединяются термином «мальабсорбция» (в широком понимании). Существенную роль в развитии синдрома нарушенного всасывания играет дисбактериоз — появление в тонкой кишке условно-патогенной или сапрофитной флоры и обильного ее роста (содержание бактерий в 1 мл составляет 105—107 и более). Часть бактерий вызывает гидролиз желчных кислот и препятствует их конъюгированию. Продукты гидролиза желчных кислот оказывают токсическое действие на слизистую оболочку кишки. Кроме того, недостаток желчных кислот препятствует образованию мицелл (соединение жирных кислот и моноглицеридов с желчными кислотами), что нарушает всасывание жиров. Кишечная флора может усиленно поглощать витамин В12, приводя к дефициту его в организме. Нарушается также выделение собственных ферментов, что приводит к нарушению всасывания углеводов и белка. Воспалительные изменения стенки кишечника обусловливают также экссудацию жидкой части крови и электролитов в просвет кишечника (синдром экссудативной энтеропатии).
Классификация. Как уже говорилось ранее, общепринятой классификации болезней кишечника (в том числе тонкой кишки) не существует. Суммируя имеющиеся данные, можно предположить следующую классификацию:
1. По этиологии (рассмотрена выше).
2. По клиническому течению: легкое, средней тяжести, тяжелое.
3. По характеру функциональных нарушений тонкой кишки: а) синдром недостаточности пищеварения; б) синдром недостаточности всасывания; в) синдром экссудативной энтеропатии.
4. По течению: фаза ремиссии, фаза обострения.
Клиническая картина. На I этапе диагностического поиска прежде всего удается выявить особенности начала заболевания, а также проявления основных синдромов. Медленное, постепенное начало более характерно для ХЭ алиментарной этиологии. Сведения о профессиональных вредностях, злоупотреблении лекарственными средствами (особенно слабительными на фоне постоянных запоров), эпизодах лучевой терапии, непереносимости отдельных видов пищи должны помочь в установлении этиологии заболевания.
Жалобы больных определяются выраженностью дискинетического, диспепсического и астеноневротического синдромов.
Наиболее часто больные жалуются на расстройство функции опорожнения, что проявляется преимущественно в виде диареи. Диарея (понос) характеризуется частым опорожнением кишечника и выделением неоформленных каловых масс. Диарея при ХЭ обладает всеми свойствами так называемой тонкокишечной диареи: стул обычно бывает 2—3 раза в день, обильный, так как нарушение переваривания и всасывания в тонкой кишке приводит к значительному увеличению количества непереваренной пищи, поступающей в толстую кишку. Поскольку резервуарная функция толстой кишки сохранена, дефекация происходит лишь несколько раз в День, но с выделением большого количества кала. Отсутствие воспалительных изменений в левой половине толстой кишки и прямой кишке исключает тенезмы, а также наличие в испражнениях крови. При ХЭ позывы к Дефекации возникают спустя 20—30 мин после приема пищи и сопровождаются сильным урчанием и переливанием в животе. Часто отмечается непереносимость молока. Вызывают обострение также прием острой пищи переедание, пиша, содержащая большое количество жиров и углеводов' Больные обращают внимание на своеобразный желтоватый (золотистый) цвет каловых масс, обусловленный присутствием в них невосстановленного билирубина и большого количества жира.
Дискинетический синдром проявляется также болями. При поражении тонкой кишки боли чаще локализуются возле пупка, носят тупой, распирающий характер, не иррадиируют, появляются через 3—4 ч после приема пищи, сопровождаются вздутием, переливанием в животе, затихают после согревания живота.
У больных ХЭ часто отмечается метеоризм — вздутие живота вследствие повышенного газообразования. Для преобладания бродильных процессов типично отхождение большого количества газов без запаха. При длительном течении ХЭ, особенно тяжелой формы, астеноневротический синдром выражен ярко: больные отмечают слабость, повышенную физическую и умственную утомляемость.
При поражении тонкой кишки вследствие нарушения всасывания продуктов расщепления белков, витаминов, липидов снижается масса тела, тогда как для преимущественного поражения толстой кишки этот симптом нехарактерен. Однако и в последнем случае возможно снижение массы тела вследствие добровольного отказа больного от приема пищи из-за боязни болей и расстройства функции кишечника.
Таким образом, после I этапа складывается впечатление о заболевании кишечника.
На II этапе диагностического поиска объем информации меньше. Однако эта информация также имеет значение для постановки диагноза, так как необнаружение ряда симптомов при несомненном предположении о наличии ХЭ будет указывать на более легкое течение заболевания, отсутствие осложнений.
Таким образом, данные II этапа будут во многом определяться вовлечением в патологический процесс кишечника, а также реакцией со стороны остальных органов пищеварительной системы. ХЭ, будучи в части случаев сам осложнением течения ряда заболеваний, способствует поражению печени, желчных путей, желудка, поджелудочной железы.
При тяжелом поражении тонкой кишки появляются признаки синдрома мальабсорбции: снижение массы тела, трофические изменения кожи (сухость, шелушение, истончение) и ее дериватов (выпадение волос, ломкость ногтей). Гиповитаминоз В2 проявляется хейлитом, ангулярным стоматитом; гиповитаминоз РР — глосситом, гиповитаминоз С — кровоточивостью десен.
При нарушении всасывания кальция в кишечнике возникают патологическая хрупкость костей, а также признаки гипопаратиреоидизма (положительные симптомы Хвостека и Труссо, в тяжелых случаях — судороги).
При развитии надпочечниковой недостаточности появляются признаки аддисонизма — гиперпигментация кожи, особенно кожных складок ладоней, слизистой оболочки рта, артериальная и мышечная гипотония. Нарушение функции половых желез у мужчин проявляется импотенцией, у женщин — аменореей. Однако эти эндокринные нарушения возникают тишь при тяжелом течении ХЭ, когда синдром мальабсорбции резко выражен.
При пальпации живота отмечается болезненность в области пупка — в юне Поргеса (болезненность при пальпации живота и сильном давлении Мб
несколько левее и выше пупка), симптом Герца (шум плеска при пальпа-!!ии слепой кишки вследствие быстрого пассажа химуса по тонкой кишке и поступления непереваренного и невсосавшегося жидкого содержимого и кишечного газа в слепую кишку).
На III этапе диагностического поиска прежде всего необходимо подтвердить предположение о поражении кишечника. Этому помогают результаты исследования кала, эндоскопии и рентгенологического метода.
Анализ кала предусматривает микроскопию, химическое и бактериологическое исследование. На основании результатов этих исследований выделяют типичные копрологические синдромы.
• Синдром недостаточности переваривания в тонкой кишке:
а) жидкий желтый кал щелочной реакции;
б) большое количество мышечных волокон, немного соединительной
ткани, нейтрального жира и йодофильной микрофлоры;
в) значительное количество жирных кислот и мыл;
г) очень большое содержание крахмала и перевариваемой клетчатки.
• Синдром ускоренной эвакуации из тонкой кишки:
а) жидкий желтый или светло-коричневый кал слабощелочной реакции;
б)значительное количество мышечных волокон, жирных кислот и мыл, немного соединительной ткани;
в) очень много нейтрального жира, крахмала и перевариваемой клет- Опредеденное значение имеет исследование бактериальной микрофлоры кала для выявления
дисбактериоза, наличие которого способствует развитию энтерита и в дальнейшем поддерживает его хроническое течение. У больных ХЭ уменьшено число бифидо- и лактобактерий, увеличено число гемолитических и лактозонегативных эшерихий, патогенного стафилококка, протея, гемолитического стрептококка. Восстановление нормальной бактериальной флоры в кишечнике является довольно хорошим критерием успешного лечения. При ХЭ с 317
|
преимущественным поражением тонкой кишки концентрация энтерокиназы и щелочной фосфатазы (ферменты, участвующие в процессе всасывания белка и жирных кислот) значительно повышается во всех ее отделах и в кале. Повышение концентрации ферментов в тонкой кишке объясняется компенсаторным увеличением выработки их и усиленной десквамацией кишечного эпителия, содержащего эти ферменты. Увеличение количества ферментов в кале обусловлено усилением моторики кишечника и нарушением
процессов дезактивации ферментов в дистальных отделах кишечника вследствие активации бактериальной флоры. Для выявления нарушения всасывания используют тест с D-ксилозой и витамином Вп (тест Шиллинга). Для проведения теста с D-ксилозой внутрь дают 5 г D-ксилозы — моносахарида, всасывающегося из верхнего отдела тонкой кишки без предварительного расщепления. При нарушении всасывания только из верхних отделов тонкой кишки понижается выделение D-ксилозы с мочой в первые 2 ч, а при более обширных поражениях — также с мочой за 5 ч. Если же выделение D-ксилозы нарушено только в первые 2 ч, а в течение последующих 5 ч протекает нормально, то нарушение всасывания в верхней части тонкой кишки компенсируется всасыванием в его дистальных частях. При поражении слизистой оболочки тонкой кишки нарушается вса-сьтание витамина Bi2. Тест Шиллинга заключается в следующем: боль-
Неспецифический язвенный копит
В ранней стадии НЯК проявляется нарушением целостности эпителия и сосудистой реакцией, позднее присоединяются изъязвления слизистой оболочки, не… НЯК болеют люди всех возрастных групп (чаще в возрасте 20—40 и 60— 70 лет),… Этиология. Точных сведений о причине развития болезни в настоящее время нет. Предполагается наследственная…Болезнь Крона
Неспецифическое иммунное воспаление распространяется на всю толщу кишечной стенки, имеет регионарный характер: зоны воспалительной инфильтрации… Распространенность БК в разных регионах мира колеблется в широких пределах —… Этиология. Причины развития болезни неизвестны. Предполагают этиологическую роль бактерий, вирусов, пищевых…Синдром раздраженного кишечника
Заболевание широко распространено, по данным мировой статистики, СРК страдают 15—20 % населения, женщины болеют в 2—4 раза чаще, чем мужчины.… Этиология и патогенез. Имеет значение наследственная предрасположенность… В патогенезе важное место отводится различным нарушениям двигательной функции кишечника. Эти нарушения, хотя и не…ПАТОГЕНЕЗ ХРОНИЧЕСКОГО БЕСКАМЕННОГО ХОЛЕЦИСТИТА
X ^фогенная. ФАКТОРЫ, СПОСОБСТВУЮЩИЕ ЗАСТОЮ ЖЕЛЧИ… ОБРАЗОВАНИЕ КАМНЕЙ _гФАКТОРЫ. ПРИВОДЯЩИЕ К ПОВРЕЖДЕНИЮ СЛИЗИСТОЙ ОВОЛОЧКИ ЖЕЛЧНОГО ПУЗЫРЯ
Г ПЕРФОРАЦИЯ ЖЕЛЧНОГО ПУЗЫРЯ ВОДЯНКА (ЭМПИЕМА) ЖЕЛЧНОГО ПУЗЫРЯБилиарно- ланкреатический рефлюкс
Истощение ингибиторов Ферментов Активация ферментов ' в ткани поджелудочной железы вирусная инфекция Аллергическим компонентБолезни почек
Содержание
Острый гломерулонефрит............................................................................ 391
Хронический гломерулонефрит . . . 398
Амилоидоз............................................................................ 408
Хроническая почечная недостаточность Контрольные вопросы 414 и задачи . 421
Острый гломерулонефрит
ОСТРЫЙ ГЛОМЕРУЛОНЕФРИТ (ОГН) - острое диффузное заболевание почек, развивающееся на иммунной основе и первично локализующееся в клубочках. Возникает вследствие различных причин (чаще всего после перенесенной инфекции), обычно заканчивается выздоровлением, но иногда приобретает хроническое течение.
При морфологическом исследовании (световая, иммунофлюоресцент-ная и электронная микроскопия) выявляется картина пролиферативного гломерулонефрита: наблюдаются пролиферация мезангиальных и эндоте-лиальных клеток, иногда — эпителия капсулы клубочка, а также инфильтрация нейтрофилами. Отмечаются отек и очаговая лейкоцитарная инфильтрация почечной интерстициальной ткани, дистрофия и атрофия канал ьцевого эпителия.
ОГН является самостоятельным заболеванием (так называемый первичный гломерулонефрит). Вместе с тем комплекс симптомов, напоминающих ОГН (остро возникшие артериальная гипертония, олигурия, отеки, протеи-нурия, изменения мочевого осадка), иногда развивается при хроническом гломерулонефрите (ХГН) и других заболеваниях почек; подобный симптомо-комплекс называется «остронефритическим синдромом» и рассматривается как выраженное обострение ХГН (или какого-то иного поражения почек). Ааким образом, остронефритический синдром может быть проявлением ИГН или же дебютом ХГН (или другого процесса); сделать окончательное заключение можно лишь в процессе динамического наблюдения за больным.
ОГН болеют преимущественно люди молодого и среднего возраста, Чаще мужчины.
Этиология. В происхождении ОГН четко прослеживается значение инфекции: острых ангин и фарингитов, вызванных так называемыми нефри- тогенными штаммами стрептококков. Основное значение имеет Р-гемотГ тический стрептококк группы А (особенно типы 12, 49); его выявляют' 60—80 % больных. В настоящее время возросла роль вирусной инфекци Примерно в Уз случаев этиологию ОГН установить не удается («немотий рованное» начало). ~
Возникновению заболевания способствует резкое охлаждение тела о бенно в условиях повышенной влажности.
Вакцинация является одним из факторов развития ОГН, причем 3/4 случаев поражение почек возникает после 2-й или даже 3-й инъекци вакцины. После стрептококковых инфекций латентный период, предщести вующий развитию симптомов болезни, составляет 2—3 нед. При остром охлаждении или парентеральном введении белка заболевание развивается в ближайшие дни после воздействия патогенного фактора.
Патогенез. Патогенез гломерулонефрита связывают с иммунными нарушениями. В ответ на попадание в организм инфекции к антигенам стрептококка появляются антитела, которые, соединяясь со стрептококковым антигеном, образуют иммунные комплексы, активирующие комплемент. Эти комплексы вначале циркулируют в сосудистом русле, а затем откладываются на наружной поверхности базальной мембраны клубочковых капилляров, а также в мезангии клубочков.
Кроме антигенов бактериального происхождения, в образовании иммунных комплексов могут принимать участие и другие экзогенные антигены (лекарственные препараты, чужеродные белки и пр.). Иммунные комплексы фиксируются на базальной мембране в виде отдельных глыбок. Фактором, непосредственно вызывающим клубочковое поражение, является комплемент: продукты его расщепления вызывают локальные изменения стенки капилляров, повышают ее проницаемость. К местам отложения иммунных комплексов и комплемента устремляются нейтрофилы, лизо-сомные ферменты которых усиливают повреждение эндотелия и базальной мембраны, отделяя их друг от друга. Наблюдается пролиферация клеток мезангия и эндотелия, что способствует элиминации иммунных комплексов из организма. Если этот процесс оказывается достаточно эффективным, то наступает выздоровление. В том случае, если иммунных комплексов много и базальная мембрана существенно повреждается, выраженная мезангиальная реакция будет приводить к хронизации процесса и развитию неблагоприятного варианта болезни — быстро прогрессирующего экстракапиллярного гломерулонефрита.
Клиническая картина. Выделяют наличие и выраженность следующих основных синдромов: мочевого, гипертензивного, отечного.
Мочевой синдром: в моче появляются белок (протеинурия), форменные элементы (гематурия, лейкоцитурия), цилиндры (цилиндрурия).
Протеинурия связана с повышенной фильтрацией плазменных белков через клубочковые капилляры — это так называемая клубочковая (гломеруляр-ная) протеинурия. Отложения иммунных комплексов могут вызывать локальные изменения капиллярной стенки в виде увеличения размеров «пор» базальной мембраны, что и обусловливает увеличенную проницаемость к пилляров для белковых субстанций. Фильтрации белков (в частности, м,5 У минов) способствует также потеря отрицательного заряда базальной мемор ной (в нормальных условиях отрицательный заряд мембраны отталкивает рицательно заряженные молекулы, в том числе молекулы альбумина).
Патогенез гематурии полностью неясен. Предполагают, что большое з чение имеет вовлечение мезангия, а также поражение интерстициальнои т ни. Гематурия может зависеть от некротизирующего воспаления почеч 392
пиол, почечной внутрисосудиетой гемокоагуляции. Эритроциты прони-а*т через мельчайшие разрывы базальной мембраны, изменяя свою форму. лЛейкоцитурия не связана с инфекцией мочевых путей, при ОГН она
словлена иммунным воспалением в клубочках и интерстициальнои тка- почек. Обычно лейкоцнтурня невелика, кроме того, при ОГН она на- Июдается нечасто.
Цилиндрурия — выделение с мочой белковых или клеточных образова-й канальцевого происхождения, имеющих цилиндрическую форму и ?нУЮ величину. Зернистые цилиндры состоят из плотной зернистой мас-образуются из распавшихся клеток почечного эпителия; их наличие сЫ| етельствует о дистрофических изменениях в канальцах. Восковидные «линдры имеют резкие контуры и гомогенную структуру. Гиалиновые цилиндры являются белковыми образованиями; предполагают, что они образованы гликопротеином, который секретируется в канальцах. Гипертонический синдром обусловлен тремя основными механизмами: 1) задержкой натрия и воды; 2) активацией ренин-ангиотензин-альдосте- роновой, а также симпатико-адреналовой систем; 3) снижением функции депрессо'рной системы почек.
Отечный синдром связывают со следующими факторами: 1) снижением клубочковой фильтрации вследствие поражения клубочков; уменьшением фильтрационного заряда натрия и повышением его реабсорбции; 2) задержкой воды вследствие задержки в организме натрия; 3) увеличением объема циркулирующей крови и развитием так называемого отека крови (Е.М. Таре- ев), что может способствовать развитию острой сердечной недостаточности; 4) вторичным гиперальдостеронизмом; 5) повышением секреции АДГ и увеличением чувствительности дистальных отделов нефрона к нему, что приводит к еще большей задержке жидкости; 6) повышением проницаемости стенок капилляров, что способствует выходу жидкой части крови в ткани; 7) снижением онкотического давления плазмы при массивной протеинурии. На I этапе диагностического поиска выясняют обстоятельства, предшествующие появлению жалоб. Эти жалобы, к сожалению, малоспецифичны и встречаются при самых различных заболеваниях. Часть из них все же позволяет предположить заболевание почек, особенно если эти жалобы появляются через 1—2 нед после перенесенной ангины, обострения хронического тонзиллита, переохлаждения, введения вакцин или сыворотки. Вместе с тем некоторые больные не предъявляют жалоб. Заболевание у них выявляют совершенно случайно или вообще не диагностируют. Так, некоторые больные могут отмечать уменьшение выделения мочи в сочетании с некоторой отечностью (пастозность) лица. При появлении отеков снижение суточного диуреза более заметно. Дизурические расстройства (болезненное частое мочеиспускание) наблюдаются лишь в 10—14 % случаев, у ряда больных они служат основанием для неправильной диагностики инфекции мочевыводящих путей. Боли в поясничной области несильные, ноющие, возникают в первые Дни болезни и выявляются у '/3 всех больных. Механизм болей связан, вероятно, с увеличением размеров почек. Длительность болей вариабельна: у которых больных они держатся несколько недель, на что обращают внимание врача
сами больные.
Пп рлШ симптомы: повышенная утомляемость, головная боль, одышка Ри физической нагрузке, кратковременное повышение температуры тела е сУбфебрильной — наблюдаются с различной частотой и не имеют серь-
ш диагностического значения ОДНЭКО ВЫраЖеННЭЯ ГОЛОВНЭЯ боЛЬ,
льная одышка в сочетании с дизурией, уменьшением выделения мочи
при соответствующих анамнестических данных достаточно убедите m указывают на возможность развития ОГН. "" °
На II этапе диагностического поиска не выявляют никаких патологич ских признаков. У части больных обнаруживают отеки (чаще под глазам особенно по утрам) вплоть до анасарки, асцита и гидроторакса. Время п явления отеков самое разное: чаще всего они появляются позднее 3-го дн болезни и весьма редко — в 1 -й день. л
Другой характерный признак ОГН — артериальная гипертония, котопа выявляется лишь у половины больных. Высота подъема АД обычно состав ляет 140—160/85—90 мм рт. ст., лишь редко достигая 180/100 мм рт. ст~
В ряде случаев обнаруживают признаки остро развивающейся сердечной недостаточности в виде одышки, тахикардии, умеренного расширения границ сердца и глухости тонов сердца, застойных (влажные мелкопузырчатые" незвонкие) хрипов в нижних отделах легких, увеличения печени. Причины сердечной недостаточности следующие: 1) увеличение объема циркулирующей крови вследствие задержки натрия и воды; 2) внезапное повышение АД до значительных цифр; 3) метаболические изменения миокарда.
III этап диагностического поиска является наиболее важным в диагностике ОГН, так как независимо от клинического варианта у всех больных выявляется мочевой синдром. Особенно важен этот этап для больных с моносимптомным течением болезни, так как только наличие мочевого синдрома позволяет поставить диагноз заболевания почек.
При исследовании мочи в 100 % случаев диагностируют протеинурию различной степени выраженности и гематурию, несколько реже лейкоци- турию и цилиндрурию (у 92—97 % больных). Для диагноза, кроме проте- инурии, большое значение имеет гематурия. Выраженность гематурии варьирует: наиболее часто отмечается микрогематурия (до 10 эритроцитов в поле зрения у 35 % больных), макрогематурия в настоящее время крайне редка (7 % случаев).
В однократной порции мочи иногда не обнаруживаются эритроциты, в связи с чем при подозрении на ОГН необходимо, кроме серии повторных исследований, провести исследование мочи по Нечипоренко (определение количества форменных элементов в 1 мкл). Относительная плотность мочи при ОГН обычно не меняется, однако в период нарастания отеков она может повышаться.
У части больных выявляются острофазовые показатели воспаления (повышение содержания фибриногена и а2-глобулина, СРВ, увеличение СОЭ). Количество лейкоцитов в крови меняется мало. Иногда отмечается умеренная анемия (обусловленная гиперволемией). При неосложненном течении ОГН содержание в крови азотистых веществ (креатинин, мочевина) не изменяется.
Иммунологические показатели свидетельствуют о наличии в крови циркулирующих иммунных комплексов, повышенном содержании анти-О-стреп- толизина, антигена к стрептококку, снижении содержания комплемента. ЦД- нако эти исследования не являются обязательными для диагностики 01 п.
В начальной фазе болезни наблюдается изменение пробы реое5 га — снижение клубочковой фильтрации и повышение канальцевой pea сорбции, нормализующейся по мере выздоровления.
При рентгенологическом исследовании у больных с выраженной аР Т3 лкаНОЙ гипертонией может отмечаться умеренное увеличение левого желудо4 который принимает прежние размеры по мере выздоровления больного.
На ЭКГ иногда выявляются изменения конечной части желудочков л комплекса в виде снижения амплитуды и инверсии зубца Т (преимуш 394
„о в левых грудных отведениях). Они возникают вследствие острого пе- веН"пряжения миокарда при артериальной гипертонии и метаболических 'Нинкционная биопсия почки показана лишь при затяжном течении забо- ания, когда возникает необходимость в проведении активной терапии Лоотикостероиды, цитостатики).
Выделяют три клинических варианта ОГН. . Моносимптомный: жалобы отсутствуют или выражены незначитель- нет отеков и артериальной гипертонии (повышение АД весьма незна- Но' льное и сохраняется недолго), имеется лишь мочевой синдром. В на- ч'шее время этот вариант наблюдается наиболее часто. с • Нефритический: выраженные отеки, олигурия; повышение АД Стречается несколько чаше, чем при моносимптомном варианте, достигает более высоких цифр.
• «Развернутый» (ранее именовавшийся как отечно-гипертонический): артериальная гипертония, часто достигающая высоких цифр (более 180/100 мм рт. ст.), выраженные отеки, сердечная недостаточность.
Осложнения. При ОГН наблюдаются следующие осложнения: 1) сердечная недостаточность (не более чем в 3 % случаев); 2) энцефалопатия (эклампсия) — судорожные припадки с потерей сознания. Отмечается крайне редко в связи с ранним применением дегидратационной терапии. Обычно припадки развиваются в период нарастания отеков, при высоком АД. После спинномозговой пункции приступ прекращается. Это дает основание полагать, что в его генезе имеют значение повышение внутричерепного давления и задержка жидкости. Иногда во время приступа отмечается острая потеря зрения при наличии только умеренного отека диска зрительного нерва. В большинстве случаев зрение полностью восстанавливается; 3) почечная недостаточность, протекающая по типу острой, характеризуется анурией и задержкой в крови азотистых продуктов. Это осложнение, как правило, успешно ликвидируется. В настоящее время острая почечная недостаточность как осложнение ОГН встречается очень редко (в 1 % случаев).
Течение. Преднефритический период обычно выпадает из поля зрения врача, и заболевание в этот период не диагностируется. Однако если проводить систематические исследования мочи, например, после проведения вакцинации или после перенесенной ангины, то можно выявить постепенное появление мочевого синдрома; систематическое измерение массы тела и АД также может выявить самые начальные изменения.
Собственно нефритический период представляет собой развернутую клиническую картину болезни с большим или меньшим числом симптомов (в зависимости от варианта), но с обязательными изменениями мочи.
Длительность отдельных симптомов варьирует: первыми исчезают общие жалобы и головная боль; из объективных признаков раньше всего исчезают отеки (если они определялись) — у '/з больных они сохраняются менее 2 нед, у остальных — в течение 3—4 нед. АД в 15 % случаев нормализуется в течение 1-й недели, в 52 % — в течение месяца, у остальных оольных АГ сохраняется значительно дольше.
Наиболее устойчивы изменения мочи: обычно допускается сохранение РотеинУРИи и изменений мочевого осадка в течение года. Если за этот пе-яод изменения мочи не проходят, то следует думать о формировании хронического гломерулонефрита.
Таким образом, течение типичного варианта ОГН циклическое, заверяется полной ликвидацией патологических симптомов. v Существуют также ациклические варианты течения болезни, когда нет казанной закономерности в появлении и исчезновении отдельных симптомов. У больных не отмечается и острого начала болезни, в связи с ч
своевременная диагностика затруднительна. Ациклические формы болез»
могут переходить в хронический гломерулонефрит. ш
Исходы заболевания: выздоровление, переход в хронический п мерулонефрит и смерть. В настоящее время выздоравливают около 50 % больных, у остальных процесс переходит в хронический. При ациклич ском течении, моносимптомной форме болезни вероятность развития хищнического нефрита особенно высока. р°~
В настоящее время ОГН практически не является причиной смепт (обычно причиной смерти может быть кровоизлияние в мозг в сочетании и эклампсией, а также острая недостаточность кровообращения).
Диагностика. Распознавание ОГН основывается на следующих признаках: 1) острое начало в сочетании с мочевым синдромом (протеинурия" микро- или, реже, макрогематурия); 2) преходящая артериальная гипертен-зия; 3) отеки; 4) отсутствие системных заболеваний и другой почечной патологии, гипертонии и протеинурии в прошлом.
Дифференциальная диагностика. Симптомы ОГН не являются специфичными, в связи с чем при постановке диагноза необходимо дифференцировать ОГН от ряда сходно проявляющихся заболеваний.
• ОГН необходимо отличать от ХГН. Это не представляет сложностей при четком остром начале ОГН и последующем полном обратном развитии симптомов. Чаще всего диагностика осложняется при отсутствии острого начала, а также при длительном сохранении отдельных признаков болезни (прежде всего мочевого синдрома). Обычно наблюдающееся острое заболевание является обострением латентно протекавшего ХГН, ранее не диагностированного. При сложности дифференциации приходится прибегать к пункционной биопсии почки.
• Трудно дифференцировать ОГН от пиелонефрита вследствие наличия леикоцитурии при обоих заболеваниях. Однако ОГН сопровождается более массивной протеинурией и в ряде случаев отеками. Дифференциальной диагностике помогают также клинические симптомы пиелонефрита (более выраженные боли в пояснице, сочетающиеся с повышением температуры тела, дизурические расстройства). При хроническом пиелонефрите указанная симптоматика в анамнезе больных наблюдается неоднократно. Диагностическую ценность имеют также выявление при пиелонефрите бактериурии, «активных» лейкоцитов, а также рентгенологическое (деформация чашек) и изотопно-ренографическое (асимметрия функции почек) исследования.
• ОГН необходимо дифференцировать от хронических диффузных заболеваний соединительной ткани, при которых ГН представляется как одно из проявлений болезни. Это наблюдается при выраженном мочевом, гипертоническом и отечном синдромах, недостаточной четкости других симптомов заболевания, чаще при системной красной волчанке (СКВ). Клинические проявления суставного синдрома, поражение кожи при СКВ и других систем и органов (в частности, сердца), выраженные иммунологические сдвиги (обнаружение противоорганных антител в высоком титре, LE-клеток, антител к ДНК и РНК), а также наблюдение за динамикой заболевания позволяют поставить правильный диагноз.
Формулировка развернутого клинического диагноза. ОГН учитывав . 1) клинический вариант заболевания; 2) наиболее выраженные синдром (отечный, гипертонический); 3) осложнения.
Лечение. В комплекс лечебных мероприятий входят: 1) режим; 2) дие 3) лекарственная терапия. „
• Режим. При выраженной клинической картине больной дол быть госпитализирован. Назначают строгий постельный режим до лик*
«и отеков и нормализации АД, в среднем на £—ч нед. щл.ипши..,.. . ** тели обеспечивает равномерное согревание тела, что приводит к умень-П00 ю спазма сосудов и снижению АД, а также к увеличению клубочко-ШеН фильтрации и диуреза. В стационаре больной находится 4—8 нед, в за-во'имости от полноты ликвидации основных симптомов болезни. Домаш-" лечение продлевают до 4 мес со дня начала заболевания (даже при лкойном течении ОГН). Такое длительное лечение является лучшей про-лГ-нактикой перехода ОГН в хронический гломерулонефрит.
. Диета. Основное правило — ограничение жидкости и поваренной в зависимости от выраженности клинической симптоматики. При fivoHOM начале болезни (отеки, олигурия, АГ) необходимо резко ограничить потребления натрия (до 1—2 г в день) и воды. В первые 24 ч рекомендуется полностью прекратить прием жидкости, что само по себе может привести к уменьшению отеков. В дальнейшем прием жидкости не должен превышать ее выделение. При отсутствии отеков и АГ общее количество выпитой воды за сутки должно быть равно объему выделенной за предыдущие сутки мочи плюс 300—500 мл. Больного переводят на диету с ограничением белка (до 60 г/сут), общее количество соли — не более 3—5 г/сут. Такую диету следует соблюдать до исчезновения всех внепочечных симптомов и резкого улучшения мочевого осадка.
• Лекарственная терапия. Назначают антибиотики, мочегонные и гипотензивные средства, а также иммуносупрессивную терапию, которую проводят только при определенных, достаточно «жестких» показаниях:
а) курс антибактериальной терапии следует проводить лишь в том слу чае, если связь ОГН с инфекцией достоверно установлена, возбудитель (стрептококк) выделен, а с момента начала заболевания прошло не более 3 нед. Обычно назначают пенициллин или полусинтетические пеницилли- ны в общепринятых дозах. Антибактериальную терапию следует проводить при наличии явных очагов хронической инфекции (тонзиллит, гайморит
и пр.);
б) мочегонные средства назначают лишь при задержке жидкости, повы шении АД и появлении сердечной недостаточности. Наиболее эффективен фуросемид (40—80—120 мг). Диуретики принимают до ликвидации отеков и артериальной гипертонии. Обычно нет необходимости назначать эти препараты длительно, 3—4 приемов оказывается достаточно;
в) при отсутствии отеков, но сохраняющейся АГ или при недостаточ ном гипотензивном эффекте диуретиков назначают гипотензивные препа раты (предпочтение отдается антагонистам кальция и ингибиторам АПФ). Длительность их применения, а также дозы обусловлены стойкостью со хранения АГ и степенью повышения АД;
г) иммуносупрессивную терапию (кортикостероиды) назначают лишь при нефротической форме ОГН и затянувшемся течении (преднизолон по 1 мг/кг с последующим постепенным снижением дозы; длительность при менения 4—8 нед); НПВП и цитостатики противопоказаны;
д) при ОГН с выраженными отеками и значительным снижением диу реза вводят гепарин по 20 000—30 000 ЕД/сут в течение 4—6 нед, добива ясь увеличения времени свертывания крови в 2—3 раза. Гепарин обладает Широким спектром действия: улучшает микроциркуляцию в почках, оказы- Вает противовоспалительное и умеренное иммуносупрессивное влияние;
е) при быстропрогрессируюшем гломерулонефрите (с быстрым развити- ем почечной недостаточности показана биопсия почки: при выявлении по- ДУлуний проводят пульс-терапию метилпреднизолоном по 500—1000 мг "Нутривенно ежедневно в течение 3—5 дней).
Лечение осложнений:
• при эклампсии внутривенно вводят сульфат магния, седуксен дп перидол; одновременно можно производить кровопускание (300—500м а также спинномозговую пункцию (если остальные назначения не дают и четливого эффекту); ~
• при острощ почечной недостаточности, не поддающейся лекарствен ной и диетическое терапии, — гемодиализ;
• при острой левожелудочковои недостаточности — мочегонные ере ства (фуросемид) внутривенно. -
После выписки из стационара больной должен соблюдать ряд рекомен даций: запрещаются работа в холодных и сырых помещениях, тяжелый физический труд; в течение 3 лет после перенесенного ОГН женщинам не рекомендуется беременность. Все эти мероприятия способствуют полному излечению. Больных, перенесших ОГН, ставят на диспансерный учет в целях динамического наблюдения и определения окончательного исхода болезни. Лица, перенесшие ОГН, должны находиться под наблюдением врача в течение 2 лет. В первые 6 мес мочу исследуют 1 раз в месяц, в последующие 1—2 года — 1 раз в 3 мес.
Прогноз. При ОГН прогноз благоприятный, однако при затянувшихся формах имеется вероятность перехода процесса в хронический.
Профилактика. Предупреждение ОГН сводится к эффективному лечению очаговой инфекции, рациональному закаливанию. В целях своевременного выявления начала болезни после вакцинации, перенесенных острых респираторных инфекций у всех больных необходимо обязательно исследовать мочу.
Хронический гломерулонефрит
ХРОНИЧЕСКИЙ ГЛОМЕРУЛОНЕФРИТ (ХГН) - хроническое диффузное заболевание почек, развивающееся преимущественно на иммунной основе. Характеризуется первичным поражением клубочкового аппарата с последующим вовлечением остальных структур почки и прогрессирующим течением, в результате чего развиваются нефросклероз и почечная недостаточность. В зависимости от преимущественной локализации и характера изменений в нефроне выделяют несколько основных морфологических вариантов ХГН. Морфологические особенности ХГН накладывают отпечаток на клинические проявления болезни, однако полного параллелизма между ними нет.
ХГН может быть самостоятельным заболеванием или одним из проявлений какого-либо другого (например, инфекционного эндокардита, СКВ, геморрагического васкулита). В последнем случае может создаться трудная для правильной диагностики ситуация, когда поражение почек выступает на первый план в картине болезни при отсутствии или минимальной выраженности других признаков системного заболевания. В то же время присоединение почечной патологии может сгладить ранее яркую картину основного заболевания. Эти ситуации могут быть обозначены как «нефритические маски» различных заболеваний. ХГН в 10—20 % случаев развивается как исход ОГН. Заболевание чаще встречается у лиц молодого возраста.
Этиология. Среди причин развития ХГН выделяют инфекционные токсические факторы.
Инфекционные факторы: бактериальные (стрептококк, стафил кокк, туберкулез, малярия, сифилис); вирусные (гепатит В, гепатит С, ЦИ мегаловирус, ВИЧ).
токсические факторы: органические растворители, алкоголь, ,апкотики, ртуть.
Связь ХГН с инфекцией особенно четко видна при инфекционном эн-одИте (ИЭ), когда массивная антибиотическая терапия приводит к из-ению ИЭ и ХГН (или ремиссии). Среди вирусов особенно часто выявится вирус гепатита В, причем поражение почек может не сочетаться с ПУСНЫМ гепатитом или циррозом печени. Токсические факторы как при-Бйна развития ХГН встречаются реже. К сожалению, этиологический фак-п при ХГН удается установить лишь в 10 % случаев. Патогенез. Отмечают два возможных механизма поражения почек: им-Лгнокомплексный и антительный. Иммунокомплексный механизм при ХГН аналогичен описанному при ОГН. ХГН развивается в тех случаях, когда гиперплазия эндотелия и мезангиальных клеток оказывается недостаточной, и иммунные комплексы не удаляются из почки, что приводит к хроническому течению воспалительного процесса. Развитие ХГН обусловливается также и антительным механизмом: в ответ на внедрение в организм различных антигенов иммунокомпетентная система вырабатывает антитела, тройные к базальной мембране капилляров, которые фиксируются на ее поверхности. Происходит повреждение мембраны, и ее антигены становятся чужеродными для организма, в результате чего вырабатываются аутоантитела, которые также фиксируются на базальной мембране. Комплемент оседает на мембране в зоне локализации комплекса аутоанти-ген — аутоантитело. Далее происходит миграция воспалительных клеток в очаг повреждения (нейтрофилов, макрофагов-моноцитов, тромбоцитов). Эти активированные клетки выделяют повреждающие факторы — активные радикалы кислорода, прокоагулянтные молекулы, протеазы, вазоак-тивные субстанции (эндотелии, эндотелиальный релаксирующий фактор), а также цитокины (интерлейкин-1, фактор некротизации опухоли, тромбо-цитарный фактор роста и др.), которые стимулируют пролиферацию собственных клеток почечных клубочков (мезангиальных, эндотелиальных, эпителиальных). Активация свертывающей системы усиливает коагулирующую активность и отложение фибрина в зоне расположения антигена и антитела. Хроническое течение процесса обусловливается постоянной выработкой аутоантител к антигенам базальной мембраны капилляров.
Кроме иммунных механизмов, в процессе прогрессирования ХГН принимают участие и неиммунные механизмы, среди которых следует упомянуть повреждающее действие белка (протеинурия) на клубочки и канальцы, снижение синтеза простагландинов (ухудшающее почечную гемодинамику), артериальную гипертонию (ускоряющую развитие почечной недостаточности), нефротоксическое воздействие гиперлипидемии.
Длительный воспалительный процесс, текущий волнообразно (с периодами ремиссий и обострений), приводит в конце концов к склерозу, гиа- линозу, запустеванию клубочков и развитию хронической почечной недостаточности (ХИН).
Клиническая картина. ХГН может быть весьма разнообразным по кли- етеским проявлениям в зависимости от клинического варианта заболевания. В свою очередь тот или иной клинический вариант болезни определятся различным сочетанием трех основных синдромов (мочевого, гипертонического, отечного) и их выраженностью, а также развивающейся со вре-
На I этапе диагностического поиска наибольшее значение для диагностики приобретают выявление заболевания почек, а также жалобы больных, примерно у у5 больных ХГН обнаруживают случайно, например при обследовании по поводу длительно существующей артериальной гипертонии, в0 время профилактического осмотра, при заполнении санаторно-курортных карт, диспансеризации, у женщин — во время беременности. В практической работе врач сталкивается со следующими наиболее типичными ситуациями:
1) острый гломерулонефрит не разрешается, мочевой синдром (а также АГ и отеки) не ликвидируется; через год можно говорить о сформировавшемся ХГН;
2) в анамнезе имеется ОГН, как будто бы полностью разрешившийся однако через несколько лет выявляется мочевой синдром (изолированный или в сочетании с АГ); ,,™т ,
ОГН»- c13a3V выявляется ХГН (в анамнезе нет указании на перенесенный
4) на фоне имеющегося заболевания (например, СКВ, инфекционного эндокардита и пр.) обнаруживаются изменения в моче (иногда АГ, отечный синдром), которые держатся стойко, что дает основание диагностировать ХГН.
Больные предъявляют различные жалобы: головные боли, утомляемость, болевые ощущения в пояснице; частота их колеблется в разных пределах! Некоторые больные жалоб не предъявляют (или они связаны с другим заболеванием); время от времени появляются дизурические расстройства. Все эти жалобы неспецифичны и могут быть при разнообразных заболеваниях.
Часть жалоб связана с наличием гипертонического синдрома (головные боли, головокружения, боли в области сердца, одышка при физической нагрузке, снижение зрения) или отечного синдрома (уменьшение выделения мочи, появление отеков различной степени выраженности). Изменение окраски мочи больные отмечают нечасто.
На II этапе диагностического поиска нет никаких патологических изменений или они обусловлены гипертоническим и/или отечным синдромом. В зависимости от выраженности артериальной гипертонии отмечается смещение левой границы сердца латерально, верхушечный толчок усилен и также смещен, выслушивается акцент II тона во втором межреберье справа от грудины, может выслушиваться систолический шум. АД колеблется в различных пределах, его повышение может быть стабильным или транзи- торным.
Отеки при ХГН выявляются далеко не у всех больных и обычно локализуются на лице, нижних конечностях или по всему телу. В тех случаях, если ХГН является симптомом какого-то другого заболевания, могут быть выявлены соответствующие признаки инфекционного эндокардита, СКВ и др. Таким образом, на этом этапе исследования сделать точное диагностическое заключение трудно.
III этап диагностического поиска является решающим. Не будет преувеличением утверждение, что у ряда больных диагноз можно поставить лишь после лабораторно-инструментальных исследований. Для больных ХГН типична протеинурия, которая может меняться в зависимости от клинического варианта болезни (в связи с этим крайне важно определять содержание белка в суточной моче). Характерна динамика мочевого осадка: гематурия выражена в различной степени и редко достигает степени макрогематурии. Цилиндрурия выявляется, как правило, часто.
При исследовании крови в период обострения гломерулонефрита у отдельных больных регистрируются острофазовые показатели (увеличение СОЭ, гипер-ос2-глобулинемия, повышение содержания фибриногена, появление СРВ). Однако эти показатели не являются основными признаками обострения.
При биохимическом исследовании крови пределы колебаний отдельных показателей (холестерин, триглицериды, общий белок и его фракции) весьма значительны и определяются клиническим вариантом ХГН. Уровень азотистых шлаков (креатинин, мочевина), а также величина клубочковой фильтрации зависят от функционального состояния почек (более подробно сМ- «Хроническая почечная недостаточность»).
Рентгенологическое обследование больных АГ позволяет выявить увеличение левого желудочка, а при длительном ее существовании — расширение восходящей части аорты, обусловленное развитием атеросклероза.
На ЭКГ при наличии АГ отмечается синдром гипертрофии левого желудочка, выраженной в различной степени.
При исследовании глазного дна обнаруживают изменения сосудов, обусловленные АГ.
Для выполнения пункционной биопсии почек имеются четкие показания: выявление тех или иных морфологических изменений в почках, что необходимо для выбора лечения, а также определения прогноза болезни.
Выделяют несколько морфологических вариантов заболевания:
1) минимальные изменения: незначительное расширение мезан- гия, очаговое утолщение базальных мембран капилляров; при электронно- микроскопическом исследовании выявляется слияние малых отростков по- доцитов;
2) мембранозный: диффузное утолщение стенок капилляров, обусловленное изменением базальной мембраны, на которой локализуются иммуноглобулин, комплемент и фибрин в виде отдельных гранул;
3) мезангиальный: иммунные комплексы откладываются в мезан-гии и под эндотелием сосудов клубочков, клетки мезангия реагируют на эти отложения. В рамках этого типа ГН выделяют мезангиопролифератив-ный ГН (выраженная пролиферация мезангиальных клеток), мезангиокапил- лярный (пролиферация мезангиальных клеток сочетается с неравномерным диффузным утолщением и расщеплением стенок капилляров), мезангио- мембранозный («минимальные изменения» в сочетании с увеличением количества мезангиальных клеток), лобулярный (пролиферация мезангиальных клеток сочетается со смещением капилляров к периферии долек и ранним гиалинозом центра сосудистых долек);
4) фокально-сегментарный: гломерулосклероз (гломерулогиали-ноз) начинается исключительно в юкстамедуллярных нефронах; в процесс вовлекаются отдельные клубочки (фокальные изменения), в них склерози- руются отдельные сегменты сосудистого пучка (сегментарные изменения). Остальные клубочки интактны;
5) фибропластический: склероз капиллярных петель клубочка, утолщение и склероз капсулы, образование сращений капсулы с сосуди стыми петлями.
Мезангиальный и фибропластический варианты рассматривают как воспалительный процесс, тогда как минимальные изменения, мембраноз-ные изменения и фокально-сегментарный гломерулосклероз (гиали-Ноз) — как невоспалительные гломерулопатии (В.В. Серов).
Клинические варианты ХГН. На основании данных всех этапов диагностического поиска выделяют клинические варианты заболевания (Е.М. Та- Реев):
• Латентный гломерулонефрит — самая частая форма (44 %), проявляющаяся изолированным мочевым синдромом (умеренная протеинурия, Гематурия, небольшая лейкоцитурия), иногда умеренной АГ. Течение медленно прогрессирующее; при отсутствии обострения процесса ХПН развивается через 15—20 лет (десятилетняя выживаемость составляет 85—90 %) Морфологически отмечают мезангиопролиферативный и мембранозный гломерулонефрит. Гемограмма и биохимические показатели без изменений.
• Гематурический гломерулонефрит — редкий вариант (6%), проявляется постоянной гематурией, иногда с эпизодами макрогематурии. Как самостоятельную, четко отграниченную форму выделяют ХГН с отложением в клубочках IgA (так называемая IgA-гломерулопатия, или болезнь Берже) поражающую чаше молодых мужчин и протекающую с эпизодами макрогематурии после респираторных инфекций. Морфологически выявляют клубочки с очаговой сегментарной или диффузной пролиферацией мезангия' базальная мембрана не изменена. Течение гематурической формы благоприятное, ХПН развивается поздно.
• Гипертонический гломерулонефрит, встречающийся у 21 % больных ХГН, проявляется преимущественно гипертоническим синдромом. Изменения в моче незначительны: протеинурия не превышает 1 г/сут, гематурия незначительная. Изменения со стороны сердечно-сосудистой системы и глазного дна соответствуют величине АГ и продолжительности ее существования. Морфологически отмечаются явления мезангиопролифератив-ного или мембранозно-пролиферативного (реже) гломерулонефрита. Течение болезни благоприятное и напоминает латентную форму, однако ХПН является обязательным исходом болезни. Если больной не умирает от ХПН, то причиной смерти являются осложнения АГ (инсульт, инфаркт миокарда, сердечная недостаточность).
• Нефротический гломерулонефрит, обнаруживаемый у 22 % больных ХГН, получил свое название по наличию у больных нефротического син дрома: сочетание упорных отеков с массивной протеинурией (более 3,5 г белка в сутки), гипоальбуминемией (развивающейся вследствие протеину- рии), гипер-а2-глобулинемией, гиперхолестеринемией, гипертриглицериде- мией. Течение умеренно прогрессирующее (морфологически отмечается мембранозный или мезангиопролиферативный гломерулонефрит) или уско ренно прогрессирующее (мезангиокапиллярный гломерулонефрит, фокаль но-сегментарный гломерулосклероз). Артериальная гипертония вначале от сутствует или незначительно выражена, высокие цифры АД появляются спустя 4—5 лет. Течение волнообразное: в периоды обострения нарастают отеки и протеинурия, в перерывах между рецидивами сохраняется умеренно выраженный мочевой синдром. Реже отмечаются постоянные отеки с выра женной протеинурией. ХПН возникает через 5—6 лет: отеки уменьшаются или исчезают полностью, развивается стойкая АГ.
Течение этого варианта ХГН характеризуется у части больных так называемыми нефротическими кризами, когда внезапно повышается температура тела, появляются рожеподобная эритема на коже, симптомы раздражения брюшины, падает АД, тромбозы почечных вен, резко ухудшающие функцию почек. В тяжелых случаях развивается синдром внутрисосудисто-го свертывания крови (ДВС-синдром). Патогенез нефротического криза не совсем ясен, по-видимому, имеет значение накопление в крови и отечной жидкости вазоактивных веществ, обладающих резким сосудорасширяющим действием (что усиливает сосудистую проницаемость и ведет к прогресси- рованию гиповолемии и падению АД).
• Смешанный гломерулонефрит (нефротический + гипертонический; характеризуется сочетанием нефротического синдрома и АГ. Эта фоР' ма — наиболее неблагоприятный вариант течения болезни (морфологически отмечается мезангиокапиллярный гломерулонефрит), встречающийся в 402 7 % случаев ХГН. Характеризуется неуклонно прогрессирующим течением. ХПН развивается спустя 2—5 лет; 10-летняя выживаемость составляет всего 30 %.
• В качестве самостоятельной формы выделяют пооострыи (злокачественный) гломерулонефрит — быстро прогрессирующий гломерулонефрит, характеризующийся сочетанием нефротического синдрома с АГ и быстрым (в течение первых месяцев болезни) развитием почечной недостаточности. Заболевание начинается как ОГН, однако симптомы не претерпевают обратного развития — напротив, стабилизируется АГ, остаются отеки, развиваются гипопротеинемия и гиперхолестеринемия. На этом фоне появляются признаки почечной недостаточности. Морфологически обнаруживают пролиферативный экстракапиллярный гломерулонефрит (пролиферация эпителия клубочков с образованием «полулуний»). Летальный исход через 1—2 года, однако возможны и более благоприятные результаты после применения пульс-терапии (ударные сверхвысокие дозы) кортикостероидов и цитостатиков или плазмафереза.
• ХГН, развивающийся при системных заболеваниях, занимает важное место среди всех случаев ХГН (до 19 %). Тем или иным системным заболеваниям свойствен определенный тип поражения почек. Так, при СКВ наиболее часто наблюдается ХГН нефротического или смешанного типа, развивающийся в первые 2 года болезни. Гематурическая форма встречается преимущественно при геморрагическом васкулите (болезнь Шенлейна—Ге- ноха), однако с увеличением возраста больных диагностируют ХГН нефро- тической и гипертонической форм.
Поражение почек встречается у 3/4 больных узелковым периартериитом и протекает в форме гипертонического варианта ХГН. Отмечается злокачественное течение гипертонического синдрома с быстрым развитием тяжелой ретинопатии, слепоты и почечной недостаточности.
При инфекционном эндокардите наблюдается латентная форма ХГН, однако со временем повышается АД. У части больных ХГН изначально нефротического типа, причем клиническая картина настолько яркая, что признаки поражения сердца отходят на второй план.
Течение. Оценка степени активности патологического процесса имеет большое значение для своевременного начала лечения. Об активности (обострении) ХГН свидетельствуют характерные клинические признаки.
1. Увеличение (в 10 раз и более) протеинурии и гематурии после какого- либо провоцирующего воздействия (например, после перенесенной инфекции, переохлаждения).
2. Переход одного клинического варианта ХГН в другой: например, переход латентного в нефротический, нефротического — в смешанный.
3. Прогрессирующее снижение азотовыделительной функции почек на протяжении нескольких недель — 1—2 лет.
Острофазовые показатели (величина СОЭ, содержание а2-глобулина, фибриногена, наличие СРВ и др.), применяемые для оценки течения других заболеваний (ревматизм, пневмония и др.), также являются критериями активности ХГН.
В качестве ретроспективного критерия течения ХГН используют срок наступления ХПН, при этом выделяют различные варианты течения ХГА.
1. Быстро прогрессирующий — терминальная хроническая недостаточность (ХПН) наступает через 6—8 мес от начала болезни. Морфологически обнаруживают пролиферативный экстракапиллярный гломерулонефрит.
2. Ускоренно прогрессирующий — терминальная ХПН наступает через 2—5 лет от начала болезни; морфологически обнаруживают чаще всего ме- зангиокапиллярный, фибропластический ГН, фокально-сегментарный гломерулосклероз .
3. Медленно прогрессирующий — терминальная ХПН наступает не ранее чем через 10 лет от начала болезни; морфологически обнаруживают мембранозный, мезангиопролиферативный ГН.
Эти ретроспективные критерии недостаточны для использования их в повседневной врачебной практике, однако они позволяют оценить значение морфологических изменений в развитии ХПН.
Осложнения. К осложнениям ХГН относят:
1) наклонность к инфекционным поражениям (пневмонии, бронхиты абсцессы, фурункулы);
2) раннии атеросклероз при наличии АГ с возможным развитием мозговых инсультов;
3) сердечная недостаточность как исход стабильно высокой АГ (встречается редко).
Диагностика. ХГН диагностируют в определенной последовательности.
• Прежде всего необходимо убедиться, что клиническая картина болезни обусловлена именно гломерулонефритом, а не иным поражением почек (пиелонефрит, амилоидоз, опухоль почки, мочекаменная болезнь и пр.), так как мочевой синдром может наблюдаться и при других заболеваниях почек.
• Определяют, какой ГН имеется: хронический или острый.
• Диагностировав ХГН, следует установить, что ХГН — это самостоятельная болезнь или заболевание почек развилось на фоне какой-то иной болезни.
Опорными признаками при постановке диагноза ХГН являются: 1) стабильно наблюдавшийся мочевой синдром; 2) длительность заболевания не менее 1—1,5 лет; 3) отсутствие причин, обусловливающих появление мочевого синдрома; 4) при наличии АГ и отечного синдрома — исключение прочих причин, их вызывающих.
Дифференциальная диагностика. Из изложенного следует, что диагноз ХГН основывается на тщательной дифференциации с другими заболеваниями. Наиболее сложно разграничить острый и хронический гломерулонефрит. Диагноз ОГН делает вероятным острое начало заболевания с появлением мочевого синдрома, АГ и отеков. Однако такая клиническая симптоматика может быть и при обострении ХГН, и тогда ХГН можно принять за начало ОГН.
Существенными для дифференциации являются следующие факты: 1) надежные сведения об отсутствии изменений мочи в предшествующий период, подтверждающие ОГН; 2) стойкость выявленного мочевого синдрома (как, впрочем, и АГ), свидетельствующая скорее о ХГН; 3) выявление почечной недостаточности, не претерпевающей обратного развития, делает диагноз ХГН достоверным. В остальных случаях вопрос о диагнозе решается только при динамическом наблюдении за больным в течение 1—2 лет; полное исчезновение симптомов свидетельствует о пользе ОГН, сохранение симптомов — о ХГН.
При дифференциации различных вариантов ХГН от сходных заболеваний необходимо иметь в виду ряд клинических факторов.
• Мочевой синдром, наблюдаемый при латентной форме ХГН, может встречаться при различных заболеваниях (пиелонефрит, амилоидоз, поражение почек при подагре). Основой для исключения хронического пиелонефрита является отсутствие высокой лейкоцитурии, бактериурии, периодической лихорадки с ознобами и дизурическими расстройствами. Ами-404 доидоз (начальная его стадия — протеинурическая) может быть заподозрен лри появлении изменений в моче у больных, страдающих хроническими инфекциями (туберкулез, остеомиелит, хронические нагноительные заболевания легких), ревматоидным артритом. О поражении почек при подагре (ложно думать при типичных приступах подагрического артрита (в том числе по данным анамнеза), повышенном уровне мочевой кислоты, обнаруже-нИи подкожных узлов (тофусов), изменениях суставов, выявляемых при рентгенологическом исследовании (подробнее см. «Подагра»),
• Гематурический ХГН следует дифференцировать от урологической патологии: мочекаменной болезни, опухолей, туберкулеза почки, заболева ний мочевого пузыря. Для этого необходимо применять специальные мето ды исследования (цистоскопия, контрастная урография, контрастная ан гиография, эхолокация почек).
Гематурический вариант ХГН может быть первым проявлением инфекционного эндокардита (первичной его формы), однако клиническая картина болезни (лихорадка, значительные гематологические сдвиги, а затем признаки поражения сердца) и эффект от терапии антибиотиками позволяют поставить правильный диагноз.
Гематурический вариант гломерулонефрита наблюдается при геморрагическом васкулите, однако наличие кожных высыпаний, абдоминалгии, артралгии нехарактерно для изолированного ХГН.
• Большие сложности представляет определение гипертонической формы ХГН. В клинической картине доминируют симптомы, обусловлен ные АГ. Однако более старший возраст больных, патологическая наследст венность, повышение АД до появления мочевого синдрома свидетельству ют в пользу гипертонической болезни.
Реноваскулярную гипертонию исключают с помощью рентгеиорадиоло- гических методов исследования (радиоизотопная ренография, внутривенная урография, ангиография); иногда при реноваскулярной гипертонии выслушивается систолический шум над областью стеноза почечной артерии. При гипертонической болезни и реноваскулярной гипертонии почечная недостаточность развивается редко (в отличие от ХГН).
• Нефротический гломерулонефрит дифференцируют прежде всего от амилоидоза почек. Вторичный амилоидоз почек исключается достаточно уверенно при учете основного заболевания (туберкулез, ревматоидный арт рит, хронические нагноительные заболевания). Сложнее распознать пер вичный (генетический, идиопатический) амилоидоз. Однако наличие в анамнезе лихорадочных приступов в сочетании с болями в животе, гепа- тоспленомегалия, поражение сердца, нейропатия позволяют с большей уверенностью поставить диагноз амилоидоза почек.
В ряде случаев точный диагноз возможен лишь после проведения пунк- Ционной биопсии.
Нефротический синдром может быть «спутником» опухолевого процесса — так называемая паранеопластическая нефропатия. Такую возможность следует учитывать при обследовании больных среднего и пожилого возраста, в связи с чем требуется провести тщательный диагностический поиск Для исключения опухоли. Дифференциальная диагностика ХГН нефроти-ческого типа и нефротического синдрома, обусловленного другими причинами, исключительно важна, так как определяет возможность проведения активной терапии (кортикостероиды, цитостатики), которая показана лишь При ХГН и может нанести больному вред при других заболеваниях.
• Вопрос о том, развивается ли ХГН на фоне какого-то другого забо левания, решается с учетом всей клинической картины болезни. При этом надо четко представлять возможности развития ХГН у больных инфеКци онным эндокардитом, СКВ, геморрагическим васкулитом и пр.
Формулировка развернутого клинического диагноза учитывает следую щие компоненты: 1) клинико-анатомическая форма ХГН (при наличи данных пункции почки указывается морфологическая форма гломерул нефрита); 2) характер течения (медленно, быстро прогрессирующий пп°" цесс); 3) фаза болезни (обострение, ремиссия); 4) состояние азотовыдети" тельной функции почек (отсутствие или наличие почечной недостаточно сти, стадия почечной недостаточности); 5) осложнения.
Лечение. Методы лечения больных ХГН определяются клиническим ва риантом, особенностями морфологических изменений в почке, активно" стью патологического процесса, развивающимися осложнениями. Общими мероприятиями при лечении являются следующие: 1) соблюдение определенного режима; 2) диетические ограничения; 3) лекарственная терапия (иммуносупрессивные препараты, диуретики, гипотензивные средства коррекция гиперлипидемии); 4) элиминация из крови циркулирующих иммунных комплексов (плазмаферез) и продуктов азотистого обмена (гемодиализ и гемосорбция).
Соблюдение режима питания, диеты, соблюдение здорового образа жизни обязательны для всех больных ХГН, тогда как лекарственная терапия показана не всем. Это означает, что не каждому больному, у которого выявлен ХГН, следует срочно назначать лекарственные препараты.
• Режим определяется клиническими проявлениями болезни. При ХГН следует избегать охлаждения, чрезмерного физического и психического утомления. Запрещается ночная работа. Один раз в год больной должен быть госпитализирован. При простудных заболеваниях больного следует выдержать на домашнем режиме и при выписке на работу сделать контрольный анализ мочи.
• Диета зависит от формы ХГН. При ХГН с изолированным мочевым синдромом можно назначить общий стол, но при этом следует ограничить прием соли (до 10 г/сут). При ХГН гипертонического и нефротического типов количество соли снижается до 3—5 г/сут. При нарастании отеков показано еще большее ограничение соли.
• Лекарственная терапия в значительной степени определяется формой ХГН, наличием или отсутствием обострения, особенностями морфологических изменений в почках. Лекарственная терапия складывается из: 1) активной терапии, направленной на ликвидацию обострения болезни (активность патологического процесса); 2) симптоматической терапии, воздействующей на отдельные симптомы болезни и развивающиеся осложнения.
Активная терапия по своему характеру является патогенетической, так как оказывает действие на существо патологического процесса — повреждение базальной мембраны и мезангия иммунными комплексами или антителами. В связи с этим содержанием активной терапии являются иммунная супрессия и воздействие на процессы гемокоагуляции и агрегации.
Иммунносупрессивная терапия осуществляется назначением кортико- стероидов, цитостатиков (как в отдельности, так и в комбинации).
Кортикостероиды показаны при нефротическом синдроме или ВЬ1рл женной протеинурии с высокой вероятностью развития нефротическо синдрома. Противопоказанием к кортикостероидам считают плохо крРР гируемую АГ и хроническую почечную недостаточность. Наиболее эффе тивны препараты этой группы при мезангиопролиферативном ГН или пр минимальных изменениях клубочков. При мембранозном ГН эффект четкий. При мезангиокапиллярном и при фокально-сегментарном ГН пр 406
нение кортикостероидов бесперспективно. Используют два пути введе- мпя кортикостероидов.
" . Внутрь — средняя суточная доза преднизолона составляет 1 мг/кг
течение 2 мес) с последующим постепенным снижением.( . Пульс-терапия — при высокой активности ХГН, в частности резком
щчении протеинурии, назначают метилпреднизолон в дозе 1000 мг УАгривенно капельно 1 раз в сутки 3 дня подряд с последующим перехо- St на обычные дозы.
Другими иммуносупрессивными препаратами являются цитостатики, которые назначают по следующим показаниям:
1) неэффективность кортикостероидов;
2) наличие осложнений кортикостероидной терапии;
3) морфологические формы, при которых эффект от кортикостероидов сомнителен или отсутствует (мезангиокапиллярный ГН);
4) сочетание нефротического ХГН с АГ;
5) нефриты при системных заболеваниях, когда кортикостероиды недостаточно эффективны;
6) рецидивирующий и стероидозависимый нефротические синдромы.
Используют циклофосфан по 2—3 мг/(кгсут), хлорамбуцил по
О 1—0,2 мг/(кгсут), циклоспорин по 2,5—3,5 мг/(кгсут). Препараты этой группы назначают внутрь; циклофосфан также в виде пульс-терапии по 15 мг/кг внутривенно ежемесячно.
На процессы гемокоагуляции и агрегации воздействуют гепарином и антиагрегантами. Гепарин назначают при ХГН нефротического типа со склонностью к тромбозам, при обострении ХГН с наличием выраженных отеков в течение 1—2 мес по 20 000—40 000 ЕД/сут (добиваясь увеличения продолжительности свертываемости крови в 2—3 раза). Вместе с гепарином назначают антиагреганты — дипиридамол (400—600 мг/сут) или кло- пидогрель (0,2—0,3 г/сут).
При высокой активности ХГН используют так называемую трехкомпо- нентную схему (цитостатики или кортикостероиды, антиагреганты, гепарин) или четырехкомпонентную схему, включающую цитостатик, предни-золон, гепарин и дипиридамол. Курс лечения может длиться неделями (и даже месяцами). При достижении эффекта дозы препаратов снижают.
Антигиперлипидемические средства назначают при гиперлипидемии (чаще при нефротическом синдроме), предпочтительны статины — например, ловастатин в дозе 20—60 мг/сут.
Симптоматическая терапия включает назначение мочегонных и гипотензивных средств, антибиотиков при инфекционных осложнениях.
Гипотензивные препараты (преимущественно ингибиторы АПФ или блокаторы кальциевых каналов) показаны больным ХГН, протекающим с АГ- АД необходимо снижать до нормальных цифр. Однако ингибиторы АиФ не только оказывают гипотензивный эффект, но и ингибируют процессы пролиферации в почечных клубочках (поэтому назначение АПФ можно отнести и к патогенетической терапии). Предпочтительно назначать недигидропиридиновые блокаторы кальциевых каналов (верапамил), так Как они оказывают сосудорасширяющее действие на эфферентную арте- Риолу почечного клубочка.
Мочегонные препараты назначают при ХГН нефротического типа с выраженными отеками как средство, лишь улучшающее состояние больного Wo не оказывающее действия на патологический процесс в почках). Обычно используют фуросемид (20—60 мг/сут).
Естественно, что объем лекарственной терапии зависит и от клинической формы ХГН.
При ХГН с изолированным мочевым синдромом (латентный ХГН) ail тивная иммуносупрессивная терапия не показана. Проводят регулярное на блюдение за больным с контролем АД и уровня креатинина в крови. Пп протеинурии более 1,5 г/сут назначают ингибиторы АПФ. ри
При гематурической форме ХГН рекомендуется длительный прием ин гибиторов АПФ и дипиридамола (эффект иммуносупрессивной терапий неотчетлив).
При гипертонической форме ХГН необходима коррекция АД ингиби торами АПФ. Следует снижать АД до 120—125/80 мм рт. ст. При обостре" ниях (особенно по типу острого нефритического синдрома) применяют ци. тостатики в составе трехкомпонентной схемы, иногда можно включать кортикостероиды (преднизолон в дозе 0,5 мг/кг/сут).
Нефротическая форма ХГН рассматривается как показание к назначению трех- или четырехкомпонентной схемы. При отеках назначают диуретики, а также антигиперлипидемические препараты.
При ХГН смешанного типа применяют трех- или четырехкомпонент-ные схемы. Назначают также ингибиторы АПФ, диуретики.
Больных ХГН ставят на диспансерный учет, периодически осматривают; не реже 1 раза в месяц исследуют мочу.
Больных направляют на курортное лечение в санатории, расположенные в зоне жаркого климата (Средняя Азия), на Южном берегу Крыма. В условиях сухого и жаркого климата происходит расширение периферических сосудов, улучшается почечная гемодинамика, возможно, что при длительном пребывании в таком климате улучшается иммунологическая реактивность. Климатическое лечение показано больным ХГН, протекающим с изолированным мочевым синдромом, особенно при выраженной протеинурии. На курорты можно направлять больных с гипертонической формой ХГН, но при условии умеренного повышения АД. Длительность лечения должна быть не менее 40 дней. При наличии эффекта лечение повторяют на следующий год.
Обострение любой формы ХГН является показанием к госпитализации. Нетрудоспособность более 2 мес (без обратного развития клинических признаков обострения болезни) является основанием для определения группы инвалидности.
Прогноз. Длительность жизни больных ХГН зависит от формы болезни и состояния азотовыделительной функции почек. Прогноз благоприятен при латентной форме ХГН, серьезен при гипертонической и гематурической ормах, неблагоприятен при протеинурической и особенно смешанной ормах ХГН.
Профилактика. Первичная профилактика ХПН заключается в рациональном закаливании, понижении чувствительности к холоду, рациональном лечении хронических очагов инфекции, использовании вакцин и сывороток только по строгим показаниям.
Амилоидоз
вешлл! *?2Э,2? Г ™болева™е> характеризующееся нарушением обмена ловд) котоппе пт1 ° ° ° Р^Уетс новое для организма вещество (ами-
^poLTnZeL^JBaeJCa в р™™х органах, приводя к склерозу и лфофии паренхимыл нарушению их функции
ком явЗ™ ИЛГ ллФичесиш нерастворимым фибриллярным белком, является сложным гликопротеидом, в котором фибриллярные и глобу-
оные белки тесно связаны с полисахаридами. Фибрилла амилоида состоит полипептидных белков; кроме фибриллярного белка, в состав амилоида юиТ и другой белок — так называемый Р-компонент, одинаковый при жх формах амилоида. Предполагают, что Р-компонент является нормаль-вс?м сывороточным белком, связанным с амилоидными фибриллами. ^ Амилоидоз может возникать как осложнение каких-либо заболеваний лИ развиваться как самостоятельный процесс. и В настоящее время выделяют несколько форм амилоидоза, имеющих
яойственный только им белковый состав амилоидных фибрилл. Определенному типу амилоидных фибрилл соответствует строго специфичный бе- лок-предшественник.
В классификации ВОЗ (1993): каждый тип амилоида имеет буквенное обозначение, в котором первая прописная буква «А» «указывает на амилоид», последующие буквы указывают на краткое название основного фибриллярного белка амилоида. Выделяют следующие типы амилоидоза.
• АА-амилоидоз — вторичный амилоидоз на фоне хронических воспалительных заболеваний, ревматоидного и псориатического артрита, болезни Бехтерева, лимфогранулематоза, а также семейной средиземноморской лихорадки (периодической болезни). Белком- предшественником АА-амилоида является острофазовый белок SAA (относящийся к а-глобулинам), синтезируемый клетками разных типов (гепатоцитами, нейтрофилами, фибробластами). Органами-мишенями являются почки, печень, селезенка, кишечник, надпочечники.
• AL-амилоидоз — первичный (идиопатический) амилоидоз, а также амилоидоз, развивающийся при множественной миеломе и В-клеточных опухолях. Белком-предшественником AL-амилоидоза являются вариабельные участки легких цепей моноклонального иммуноглобулина, продуцируемые аномальным клоном плазматических или В-клеток в костном мозге. Органами-мишенями являются почки, а также сердце, язык, желудочно- кишечный тракт, нервная система, кожа.
• ATTR-амилоидоз — наследственно-семейный амилоидоз. Белком-предшественником ATTR-амилоидоза является компонент молекулы преальбумина — транстиретин — транспортный белок для тироксина (тиреоидного гормона). Наследственный семейный амилоидоз является результатом мутации в гене, ответственного за синтез транстире-тина. Органами-мишенями являются нервная система (развитие полиней-ропатии), реже — почки и сердце. Данный тип амилоидоза развивается и в преклонном возрасте (старческий системный амилоидоз), он характеризуется меньшей тяжестью поражения и сочетается с атеросклерозом.
• А(32М-амилоидоз, развивающийся у больных, находящихся на плановом гемодиализе. Белком-предшественником является р2- микроглобулин, который плохо фильтруется через диализные мембраны. Основными органами-мишенями являются кости и периартику-лярные ткани.
Патогенез. Хорошо известны лишь отдельные звенья патогенеза. Под влиянием мутации генов, а также воздействия внешних факторов изменяется иммунитет — уменьшается количество Т-лимфоцитов. Это приводит к снижению контролирующего их воздействия на В-систему лимфоцитов, результате уменьшается количество В-клеток, несущих нормальные им- Уноглобулины, и увеличивается количество В-клеток, синтезирующих
предшественников амилоидной фибриллы. Амилоидобласты продуцируют олыцое количество фибриллярного белка, что обусловливает синтез ами-°ида.
Однако вследствие генетического дефекта амилоидокластов, способствующего снижению их ферментативной активности, достаточной резопк ции амилоида не происходит. В результате наблюдается усиленное отло* ние амилоида в тканях и органах.
При множественной миеломе амилоидоз развивается в результате по вышенной продукции плазмоцитами парапротеина, участвующего в по строении амилоида.
При поражении миокарда, периферических нервов (наблюдается ппе имущественно при идиопатической форме амилоидоза) амилоид отклады вается вокруг коллагеновых волокон соединительной ткани. Отложени" амилоида вокруг ретикулярных волокон наблюдается при поражении почек, кишечника, печени, надпочечников, поджелудочной железы (при наследственном и вторичном амилоидозе). Однако возможно сочетание пе- риколлагенового и периретикулярного отложения амилоида, что обеспечивает сочетанные поражения различных органов и систем.
При отложении амилоида в тканях уменьшается количество функционирующих элементов, кардиомиоцитов, гепатоцитов, нервных волокон почечных клубочков, что в последующем приводит к функциональной недостаточности органа.
Так, в сердце амилоид откладывается под эндокардом, в строме и сосудах миокарда, а также по ходу вен в эпикарде. Сердце при этом резко увеличивается в размерах, а количество кардиомиоцитов быстро убывает. Все это приводит к снижению сократительной функции миокарда и сердечной недостаточности, а также нарушениям проводимости и ритма сердца. В головном мозге при старческом амилоидозе амилоид находят в так называемых сенильных бляшках коры, сосудах и оболочках. В коже амилоид откладывается в сосочках и стенках сосудов, что приводит к резкой атрофии эпидермиса. В печени амилоид откладывается между звездчатыми ретику- лоэндотелиоцитами синусоидных сосудов, в стенках сосудов, протоков, в соединительной ткани портальных трактов. По мере накопления амилоида печеночные клетки атрофируются.
В почках амилоид откладывается в мембране клубочковых капилляров и канальцев нефрона, в мезангии, капиллярных петлях и по ходу артериол. По мере накопления амилоида большинство нефронов атрофируется, погибает или замещается соединительной тканью — возникает амилоидно-сморщенная почка.
В клинической картине амилоидоза почек выделяют три стадии: 1) начальную (протеинурическую); 2) развернутую (нефротическую); 3) терминальную (азотемическую).
Клиническая картина. Проявления амилоидоза разнообразны и определяются: 1) локализацией амилоида в том или ином органе; 2) степенью выраженности отложений амилоида в органе; 3) основным заболеванием, на фоне которого развился амилоид (при вторичной форме амилоидоза), 4) степенью снижения функции пораженных органов.
При диагностике могут возникнуть затруднения, обусловленные тем, что клинические проявления болезни будут заметны лишь при определен ном количестве отложившегося амилоида. В связи с этим неизбежен «ла тентный» период от момента отложения амилоида до появления симпто мов нарушения функционирования органа или системы.
Клиническая картина особенно яркая при поражении почек — наио лее частой локализации отложений амилоида. „
На I этапе диагностического поиска в начальной стадии практичес никакой информации, свидетельствующей о поражении почек амилоид зом, получить не удается. Жалобы больных связаны с основным заболе нием (при вторичном амилоидозе). 410
R анамнезе имеются сведения о наличии того или иного заболевания беркулез легких, остеомиелит, ревматоидный артрит и пр.), его течении, сводившейся терапии. Сами по себе эти сведения не позволяют диагно- ^оватъ амилоидоз почек, но обращают внимание врача на такую воз-
гоЖНОСТЬ.
В развернутой стадии амилоидоза больные предъявляют жалобы, обу- оаленные развитием нефротического синдрома, на уменьшение количе-сЛ мочи, отеки различной распространенности и выраженности, а также ст слабость, отсутствие аппетита, снижение работоспособности. Наряду с н-гим при вторичном амилоидозе жалобы обусловлены клиническими проявлениями основного заболевания.
В терминальной стадии жалобы вызваны развивающейся хронической почечной недостаточностью: снижение аппетита, тошнота, рвота (диспепсические расстройства), головные боли, бессонница (нарушения функции нервной системы), кожный зуд.
На II этапе диагностического поиска в ранней стадии могут обнаруживаться только симптомы, характерные для основного заболевания (при вторичном амилоидозе).
В развернутой стадии выявляют: 1) отеки различной локализации и выраженности; при значительной задержке жидкости в организме могут появляться гидроторакс, гидроперикард, преходящий асцит; 2) артериальную гипертонию (встречается у 12—20 % больных амилоидозом), дилатацию и гипертрофию левого желудочка; 3) увеличение печени и селезенки вследствие отложения в тканях амилоида (печень и селезенка плотные, безболезненные, с заостренным краем); 4) симптомы основного заболевания (при вторичном амилоидозе).
В терминальной стадии симптоматика определяется выраженностью почечной недостаточности: 1) дистрофический синдром (изменения кожи и слизистых оболочек); 2) серозно-суставной синдром (остеоартропатии, вторичная подагра, сухой перикардит, плеврит); 3) артериальная гипертония.
На III этапе диагностического поиска при амилоидозе получают наиболее значимую для постановки диагноза информацию, которую можно сгруппировать следующим образом: 1) мочевой синдром; 2) нарушения белкового и липидного обмена; 3) обнаружение отложения амилоидных масс.
Мочевой синдром: 1) протеинурия — важнейший симптом амилоидоза, развивается при всех его формах, но наиболее часто при вторичном амилоидозе. Протеинурия обычно бывает значительной, за сутки выделяется 2— 20 г белка, основную часть которого составляют альбумины. В меньших количествах выделяются глобулины, возможно выведение с мочой сывороточного предшественника амилоида (белок SAA). В терминальной стадии протеинурия сохраняется. В моче можно обнаружить а- и особенно у-гли- копротеиды.
Соответственно степени протеинурии обнаруживают гиалиновые и Реже зернистые цилиндры. Нечасто диагностируется микрогематурия или леикоцитурия, однако выраженность ее не соответствует степени протеинурии (как это наблюдается при гломерулонефритах). Степени нарушений липидного обмена при амилоидозе соответствует липоидурия с наличием Двоякопреломляющих кристаллов в осадке мочи.
Нарушения белкового и липидного обмена: 1) гипопротеинемия в сочета-ии с гипоальбуминемией и гипер-а2- и гипер-у-глобулинемией; 2) гипер-
холестеринемия, гипертриглицеридемия, гипер-|3-липопротеидемия. Выраженная диспротеинемия и нарушения липидного обмена приводят к значительному увеличению СОЭ.
Большое значение для диагноза имеет обнаружение амилоидных масс органах и тканях: в печени (50 % случаев), селезенке (при пункдионно? биопсии), слизистой оболочке десны и прямой кишки.
В начальной стадии (протеинурической) при биопсии слизистой оболоч ки десны чаще получают отрицательный результат, а прямой кишки — поло жительный; в развернутой стадии (нефротической) в первом случае результа' ты положительные у половины больных, а во втором — еще чаще.
Наконец, при хронической почечной недостаточности данные биопсии ткани десны положительны более чем в половине наблюдений, а слизистой оболочки прямой кишки почти во всех случаях. Следовательно, биопсию слизистой оболочки десны следует рекомендовать при далеко зашедшем процессе, а прямой кишки — в любой стадии амилоидоза.
При подозрении на идиопатический амилоидоз (протекает чаще с поражением сердца, периферических нервов, реже — почек) целесообразно прежде всего делать биопсию слизистой оболочки десны, а при вторичном (приобретенном) амилоидозе и наследственных его формах (протекают с преимущественным поражением почек) — биопсию слизистой оболочки прямой кишки.
Ряд других исследований помогает: 1) уточнить диагноз заболевания, на фоне которого развился амилоидоз; 2) оценить функциональное состояние почек (проба Реберга, Зимницкого, содержание креатинина в крови).
Течение. Клиническая картина амилоидоза почек имеет определенные особенности, отличающие его от поражения почек иного происхождения: 1) нефротический синдром развивается постепенно и нередко после длительной стадии протеинурии, отличается упорным течением, отеки часто резистентны к различным мочегонным средствам. При ХГН нефротический синдром возникает, как правило, уже в начале болезни и в дальнейшем часто рецидивирует; 2) артериальная гипертония наблюдается нечасто, даже в стадии хронической почечной недостаточности; 3) при первичном амилоидозе хроническая почечная недостаточность протекает более доброкачественно в отличие от вторичного амилоидоза или ХГН (вследствие меньшей тяжести поражения клубочков по сравнению со вторичными формами амилоидоза); 4) течение вторичного амилоидоза в значительной степени зависит от основного заболевания, при частых обострениях которого возможно значительное прогрессирование амилоидоза.
Осложнения. При амилоидозе в 2—5 % случаев развиваются: 1) тромбоз почечных вен (при вторичном амилоидозе), что проявляется гематурией и болями в поясничной области, нарастанием протеинурии и снижением диуреза; 2) интеркуррентная инфекция; 3) фибринозно-гнойный перитонит, появление которого сопровождается резким увеличением асцита.
Диагностика. Клинические проявления амилоидоза неспецифичны. Ка ждый из симптомов (отеки, протеинурия, артериальная гипертония) может встречаться при различных заболеваниях почек. Единственным методом достоверной диагностики амилоидоза является биопсия органа (почка, пе чень, слизистая оболочка прямой кишки или десны), однако она не всегд выполнима. Поэтому в большинстве случаев приходится ориентироватьс на клинические проявления патологического процесса.
, Наличие стойкой тяжелой сердечной недостаточности, синдрома не-
таточности всасывания, полинейропатии (если при этом последние три '1ондРоыа Трудно объяснить
другими причинами). oV[2] Можно предположить наличие амилоидоза при следующих лаборатор- признаках нефротического синдрома (который, как известно, может взвиваться и при других заболеваниях почек):
а) выраженная диспротеинемия + гипоальбуминемия + гипер-а2- и rvinep-Y-глобулинемия;
б) повышение уровня а2-гликопротеида, pj-липопротеидов;
в) появление в моче а- и особенно у-гликопротеидов и а-липопротеидов.
Во всех случаях вероятность развития амилоидоза увеличивается при
обнаружении гепато- и спленомегалии, а также изменений сердца, свойственных амилоидозу (в подобных случаях речь идет об идиопатическом генерализованном амилоидозе).
Следовательно, диагноз амилоидоза почек с достаточной уверенностью можно поставить в развернутой (нефротической) или терминальной стадии, тогда как в начальной (протеинурической) стадии это сделать намного труднее. В этих случаях преходящую или постоянную протеинурию приходится дифференцировать от протеинурии при гломерулонефритах (остром, хроническом). При этом следует учитывать:
1) более медленное прогрессирование поражения почек при амилоидозе;
2) отсутствие при амилоидозе четкой связи с простудными заболеваниями;
3) постоянную микрогематурию при гломерулонефритах (при амилоидозе в 20 % случаев).
Иногда правильный диагноз можно поставить лишь после периода длительного наблюдения за больным. Вопрос решается значительно быстрее, если имеется возможность произвести пункционную биопсию почки.
Формулировка развернутого клинического диагноза амилоидоза учитывает следующие компоненты: 1) форму амилоидоза; 2) стадию амилоидоза (протеинурическая, нефротическая, терминальная); 3) функциональное состояние почек (отсутствие или наличие почечной недостаточности, степень ее выраженности); 4) основное заболевание (при вторичном амилоидозе); 5) состояние других органов (сердце, печень, нервная система и пр.) при идиопатическом (первичном) амилоидозе.
Лечение. Лечебные мероприятия зависят от типа амилоидоза, поражения органов-мишеней и клинической формы болезни:
1) в первую очередь лечение должно быть направлено на снижение синтеза белков-предшественников амилоидных фибрилл;
2) воздействие на клинические проявления болезни (нефротический синдром, артериальная гипертония, хроническая почечная недостаточность, нарушения ритма сердца ХСН).
При АА-амилоидозе лечение должно быть направлено на обязательное Удаление очага, стимулирующего образование сывороточного белка SAA:
• устранение очагов хронического гнойного воспаления (консервативное или хирургическое лечение — бронхоэктатической болезни, остеомиелита, болезни Крона, неспецифического язвенного колита);
• активная иммуносупрессивная терапия ревматоидного артрита;
• лечение периодической болезни колхицином (при развившемся 'милоидозе почек препарат назначают пожизненно в дозе 1,8—2 мг/сут);
• хирургическое удаление опухоли.
По-прежнему рекомендуется «печеночная» терапия — прием 80—120 г &,Рой печени в течение 6—12 мес.
При LA-амилоидозе лечение направлено на подавление продукции м ноклональных легких цепей иммуноглобулинов:
• при множественной миеломе проводят различные схемы химиотеп пии — чаще всего сочетание цитостатика мелфалана с преднизолоно (мелфалан в дозе 0,15 мг/кг, преднизолон — 0,8 мг/кг) курсами по 7 ДнЛ' каждые 4—6 нед. Длительность лечения до 2—3 лет. Результаты лечещ/ при поражении почек лучше, чем при поражении сердца.
Воздействие на основные клинические проявления болезни предусматривает ликвидацию отеков, АГ, а также мероприятия, направленные борьбу с развивающейся почечной недостаточностью:
а) при развитии нефротического синдрома и отеков необходимо физио логическое содержание в пище белка [около 1 гДкгсут)], уменьшение по варенной соли (до 2—4 г/сут), а также прием диуретиков — тиазидных (гидрохлортиазид по 25—100 мг/сут), их можно комбинировать с спироно- лактонами (верошпирон, альдактон в дозе 25—200 мг/сут). Однако при вы раженной почечной недостаточности тиазидные диуретики противопоказа ны. Поэтому при выраженном снижении скорости клубочковой фильтра ции (менее 20 мл/мин) назначают петлевые диуретики (фуросемид — на чальная доза 20—40 мг, максимальная — до 400 мг). Фуросемид позволяет несколько увеличить прием натрия;
б) артериальная гипертония нечасто встречается при амилоидозе, одна ко, когда она достигает высоких цифр, необходимо назначение гипотен зивных средств различного типа. Предпочтение следует отдавать ингибито рам АПФ (эналаприл, лизиноприл, периндоприл и др.), так как эта группа препаратов, кроме гипотензивного действия, обладает нефропротективным эффектом (замедляет развитие склероза почечной ткани). При непереноси мости АПФ назначают блокаторы рецепторов AT II (валсартан, лозартан, ирбесартан и др.). Среди блокаторов кальциевых каналов предпочтительны ретардные недигидропиридиновые препараты (верапамил, дилтиазем), ко торые снижают внутриклубочковую гипертензию за счет расширения эф ферентной артериолы клубочков (как, впрочем, и афферентной артерио- лы). ИАПФ и блокаторы кальциевых каналов можно комбинировать;
в) при развитии почечной недостаточности лечение проводится по об щепринятому плану (ограничение белка в пище, достаточное введение жидкости, коррекция минерального обмена). При почечной недостаточно сти, обусловленной амилоидозом, возможно применение гемодиализа и трансплантации почек.
Прогноз. Длительность протеинурического периода установить трудно, однако после его выявления обычно через 3 года развиваются отеки, на фоне которых быстро возникает ХПН. После развития ХПН пациенты живут обычно менее одного года, после развития хронической сердечной недостаточности — около 4 мес. Все это делает прогноз весьма серьезным.
Профилактика. При идиопатическом и генетическом амилоидозе меры первичной профилактики не известны. При вторичном амилоидозе профилактика состоит в лечении заболеваний, ведущих к развитию амилоидоза.
Хроническая почечная недостаточность
ХРОНИЧЕСКАЯ ПОЧЕЧНАЯ НЕДОСТАТОЧНОСТЬ (ХПН) - снн-дром, развивающийся вследствие уменьшения числа и изменения функн оставшихся нефронов, что приводит к нарушению экскреторной и секретор ной функций почек, которые не могут больше поддерживать нормальный
внутренней среды организма. Иногда снижение скорости клуоочковои с^храции (СКФ) длительное время протекает бессимптомно и пациент
<lPeT себя здоровым вплоть до уремии. Совокупность всех клинических и сч5ораторных признаков, развивающихся при ХПН, называется уремией.
ХПН представляет собой конечную фазу любого прогрессирующего по-
я-жения почек. Этиология. Наиболее часто причинами ХПН являются: 1) заболевания, отекающие с первичным поражением клубочков — гломерулонефриты; ?? поражения почечных сосудов: стеноз почечных артерий, артериальная ипертония (гипертоническая болезнь, злокачественная гипертония); 3) заболевания, протекающие с первичным поражением канальцев и интерсти-тия почки — хронический пиелонефрит, интерстициальный нефрит; 4) заболевания мочевыводящей системы: мочекаменная болезнь, гидронефроз, ОПУХОЛИ нервной системы; 5) диффузные заболевания соединительной ткали" 6) болезни обмена веществ: сахарный диабет, амилоидоз, подагра, нарушение обмена кальция; 7) врожденные заболевания почек: поликистоз,
гипоплазия почек.
Патогенез. Несмотря на разнообразие причинных факторов, морфологические изменения в почках однотипны и сводятся к развитию склеротических процессов, запустеванию клубочков с утратой морфологических особенностей исходного патологического процесса и гипертрофией оставшихся нефронов. Эти нефроны неполноценны в структурном и функциональном отношении, степень усиления их функции недостаточна.
Значительное уменьшение массы действующих нефронов при ХПН проявляется в неспособности почки поддерживать нормальный водно- электролитный и осмотический гомеостаз.
• При ХПН в организме задерживаются продукты обмена, азотистые шлаки (мочевина, креатинин, мочевая кислота), которые не могут быть выведены из организма другим путем. Задержка креатинина является наиболее четким показателем степени ХПН.
• Нарушается водно-электролитное равновесие. На ранних стадиях ХПН изменяется концентрационная функция почек; оставшиеся нефроны функционируют в условиях повышенной осмотической нагрузки и должны вывести в минуту гораздо больше растворимых веществ, чем нормальные нефроны. Для этого им необходимо повысить объем выводимой мочи — развивается полиурия, изменяется суточный ритм выведения мочи, возникает изостенурия. В терминальной стадии ХПН объем мочи резко уменьшается и развиваются олигурия и анурия.
• По мере нарастания ХПН почки теряют способность сохранять на трий — наблюдается так называемое солевое истощение. Однако у некото рых больных отмечается тенденция к задержке натрия.
В ранней стадии ХПН (полиурической) выявляется гипокалиемия, в конечной стадии — гиперкалиемия.
• Нарушается кислотно-основное равновесие, развивается ацидоз, чему способствует выраженная потеря бикарбонатов с мочой (следствие нарушения реабсорбции бикарбонатов в условиях снижения активности
арбоангидразы), а также снижение секреции канальцами водородных ионов и органических кислот.
• Изменяется фосфорно-кальциевый обмен — развиваются гипокаль-
иемия вследствие снижения всасывания кальция в кишечнике, а также
гиперфосфатемия.
• Нарушается выработка эритропоэтина в почках, что вызывает разви
тие анемии.
Выработка ренина продолжается, что способствует развитию стойка АГ. У части больных задержка натрия также способствует поддержание высокого уровня АД. *>
Классификация. Е.М. Тареев предложил простое и удобное в практике ском отношении деление ХПН на стадии по величине СКФ. Легкая: СКФ равна 30—50 мл/мин. Умеренная: СКФ равна 10—30 мл/мин. Тяжелая: СКФ равна 5—10 мл/мин. Терминальная: СКФ менее 5 мл/мин.
В легкой и умеренной стадиях основным методом лечения больных является консервативная терапия, но в тяжелой и терминальной стадиях необходима заместительная почечная терапия — внепочечное очищение крови (гемодиализ, перитонеальный диализ) или трансплантация почки.
Клиническая картина. Проявления ХПН зависят от: 1) стадии ХПН' 2) выраженности нарушений различных компонентов гомеостаза.
В клинической картине ХПН можно выделить следующие синдромы: 1) неврологический; 2) гастроэнтерологический; 3) дистрофический; 4) анемически-геморрагический; 5) серозно-суставной и костный.
На I этапе диагностического поиска в начальной стадии ХПН больные могут не предъявлять никаких жалоб; клиническая картина обусловлена проявлением заболевания, в результате которого развилась ХПН. При про- грессировании ХПН прежде всего появляются признаки неврологического синдрома: слабость, сонливость, утомляемость, апатия. Гастроэнтерологический синдром выражается тошнотой, рвотой, потерей аппетита вплоть до отвращения к пище, поносом (реже запором). Иногда больных можно накормить лишь утром. Обычно диспепсические жалобы связывают с развитием уремического гастрита, однако большее значение, вероятно, имеет уремическая интоксикация, так как после гемодиализа жалобы быстро исчезают. При нарастании почечной недостаточности гастроэнтерологический синдром прогрессирует, появляются признаки энцефалопатии (вялость, раздражительность, бессонница), а также симптомы периферической нейропатии (расстройство чувствительности и моторики).
Задержкой «уремических токсинов» объясняются зуд, носовые и желу- дочно-кишечные кровотечения, подкожные геморрагии. При длительной задержке мочевой кислоты в организме могут появиться боли в суставах — проявление «уремической» подагры. Артериальная гипертония приводит к снижению зрения вследствие развития тяжелой ретинопатии.
В анамнезе у некоторых больных выявляется какое-либо заболевание почек, так что указанные жалобы не являются неожиданностью для врача. Быстрота развития симптомов ХПН от момента выявления заболевания почек различна; иногда проходят многие годы; при злокачественном (по-достром) гломерулонефрите ХПН развивается через несколько месяцев после начала болезни.
На II этапе диагностического поиска в начальном периоде ХПН выявляют снижение массы тела, сухость кожных покровов (в том числе в подмышечных впадинах), бледно-желтоватый цвет кожных покровов вследствие развития анемии и задержки урохромов. Появляется аммиачный запах изо рта. Кожа имеет следы расчесов, шелушится, нередко обнаруживаютс подкожные геморрагии.
При исследовании органов кровообращения выявляются АГ, расшир ние границ сердца влево, акцент II тона во втором межреберье справа грудины. Однако у некоторых больных при ХПН могут быть нормальн показатели АД. В терминальной стадии развивается уремический перик ] 416
появляющийся шумом трения перикарда, одышкой. Серозно-сустав-
& синдром может также выражаться в развитии плеврита (чаще сухого) и явлении «уремической» подагры (тофусы, деформация суставов — см.
пПодагра»)- Язык сухой, обложен коричневатым налетом. При пальпации вота выявляется разлитая болезненность в эпигастрии и по ходу толстой
*" у больных с ХПН отмечается склонность к инфекциям: часто возника-т пневмонии, резко ухудшающие функциональное состояние почек. На-1остание неврологической симптоматики проявляется в судорожных по-Логиваниях, полинейропатии, развитии коматозного состояния с большим шумным дыханием (Куссмауля), причиной которого является про-пэессирующий ацидоз. Часто отмечается гипотермия, при инфекциях (пневмониях) температура тела иногда не повышается.
Вследствие развивающегося остеопороза могут наблюдаться патологические переломы.
На III этапе диагностического поиска прежде всего необходимо оценить функциональное состояние почек и степень задержки азотистых шлаков.
При проведении пробы Зимницкого отмечается монотонное выделение мочи низкой относительной плотности (изо-, гипостенурия). В осадке уменьшается содержание форменных элементов, снижен уровень протеи- нурии.
Степень задержки креатинина и определяемая по уровню эндогенного креатинина в сопоставлении с креатининурией клубочковая фильтрация являются надежными критериями определения функционального состояния почек. Уровень креатининемии увеличивается по мере ухудшения состояния больного.
При далеко зашедшей ХПН в крови повышается содержание мочевой кислоты — появляется гиперурикемия. В периферической крови определяется гипохромная анемия, сочетающаяся с токсическим лейкоцитозом (6—8 109/л) и нейтрофилезом. Отмечается тромбоцитопения со снижением агрегации тромбоцитов, что является одной из причин кровоточивости.
Нарушение выделения водородных ионов обусловливает появление метаболического ацидоза.
В терминальной стадии ХПН отмечается появление гиперкалиемии.
Данные инструментальных методов исследования более детально характеризуют состояние органов при ХПН. На ЭКГ— синдром гипертрофии левого желудочка (следствие АГ), при появлении гиперкалиемии ЭКГ может измениться: повышается сегмент ST и увеличивается амплитуда позитивного зубца Т.
При исследовании глазного дна отмечается выраженная ретинопатия.
Рентгенологическое исследование грудной клетки выявляет своеобразные изменения в легких: так называемое уремическое легкое (двусторонние очаговые затемнения от ворот легкого, обусловленные левожелудоч-ковой недостаточностью или повышенной транссудацией из легочных капилляров).
При рентгенографии костей обнаруживается их деминерализация.
Желудочная секреция снижена, а при гастроскопическом исследовании вы- вляют изменения слизистой оболочки (преобладают явления атрофии и ее перестройка).
Течение. В значительной мере течение ХПН определяется основным аоолеванием. При ХГН почечная недостаточность отличается более быстрым прогрессированием, чем при других заболеваниях.
Постепенное прогрессирование ХПН отмечается у лиц зрелого возраст со спокойным течением болезни, редкими обострениями и относитечюз стабильной гипертонией. "
Более быстрое прогрессирование ХПН отмечается у лиц разного воч раста, у которых обострение основного заболевания почек способствуй усугублению АГ; часто одновременно появляются отеки.
Диагностика. Распознавание ХПН обычно не представляет затрудне ний. Диагноз основывается на данных анамнеза (наличие длительно существующего заболевания почек), непосредственного обследования больного' результатах лабораторного исследования (снижение величины СКФ, сни' жение показателей красной крови, появление азотистых шлаков и др)
^Значительно сложнее дифференцировать заболевание почек, привел^
Большие сложности возникают при дифференциации первично- и вторично- сморщенной почки. Следует ориентироваться на анамнез: при первично- сморщенной почке имеются данные о длительно существующей артериальной гипертонии без четких указаний на патологию почек, суточная протеинурия небольшая, изменения мочевого осадка также несущественны. Отмечается значительная выраженность изменений органов-мишеней — сердца (выраженная гипертрофия левого желудка) и глазного дна. Трудности возникают в случаях развития ХПН при амилоидно-смор-щенной почке. При вторичном амилоидозе имеются указания на основное заболевание, приведшее к поражению почек (туберкулез, остеомиелит, ревматоидный артрит и пр.), а также длительное существование нефротиче-ского синдрома. Сложнее случаи первичного (семейного) амилоидоза, когда врач, не зная предшествующего анамнеза, наблюдает больного в период развития у него ХПН. Следует иметь в виду, что ХПН у таких больных развивается в возрасте 15—20 лет.
Формулировка развернутого клинического диагноза при ХПН аналогична таковой при ХГН, амилоидозе: 1) заболевание, приведшее к возникновению ХПН (название, клиническая форма, морфологический вариант); 2) характер течения и фаза процесса (обострение, ремиссия); 3) стадия ХПН; 4) основные синдромы ХПН при их достаточной выраженности.
Лечение. Основная задача заключается в поддержании гомеостаза и замедлении прогрессирования поражения почек, улучшении самочувствия больного.
Лечение ХПН включает несколько направлений:
• предупреждение и устранение причин, вызывающих ухудшение функции почек, у больных с медленно прогрессирующей почечной недостаточностью;
• воздействие на основные клинические проявления ХПН — водно- электролитные нарушения (гипергидратация, гиперкалиемия), метаболический ацидоз, АГ, анемию, остеодистрофию;
• при снижении СКФ менее 10 мл/мин — применение активных методов (гемодиализ, перитонеальный диализ, трансплантация почки).
Неожиданное быстрое снижение СКФ у больных ХПН (как и у почеч ных больных с сохранной функцией почек) может быть вызвано различными причинами:
1) снижением объема циркулирующей крови (ОЦК) вследствие чрезмерного ограничения натрия в пище или неправильного использован диуретиков;
2) внезапным развитием тяжелой АГ; нПВП
3) применением нефротоксических лекарств (аминогликозиды, НП*> циклоспорин, рентгеноконтрастные вещества).
Адекватный прием жидкости определяют рядом факторов - выражен- Л лпеатининемии, величиной СКФ. , ч
«ЛК Содержании креатинина более 4 мг% (354 мкмоль/л) но менее
п£ П 326 мкмоль/л) или величине клубочковой фильтрации 40 мл/мин, 15 ииже 10 мл/мин, больной должен принимать такое количество жидко- ноН1пт5>ое обеспечивает суточный диурез 2-3 л. Такой диурез позволя-ст еньшить реабсорбцию шлаков и способствует максимальному их выве-
^При клубочковой фильтрации менее 15 мл/мин (когда у больного обра-тся не более 1 л мочи в день) прием жидкости корригируют с учетом иуреза: суточный прием жидкости равен количеству выделенной мочи за предыдущий день плюс 300—500 мл.
. Регуляция введения натрия и калия осуществляется в соответствии с данными клинического обследования больного. Прием хлорида натрия больным ХПН без отеков и АГ не следует ограничивать. Ограничивают прием хлорида натрия до 3—5 г/сут только больным ХГН при наличии отеков и выраженной гипертензии.
При умеренной гиперкалиемии (6—5 ммоль/л) необходимо сократить в пище продукты, содержащие калий; не следует назначать калийсберегающие мочегонные средства (спиронолактон или верошпирон); показано использование ионообменных смол. При содержании в крови 6,5—7 ммоль/л калия внутривенно вводят 5 % раствор глюкозы (500 мл) с 8 ЕД инсулина. При выраженной гиперкалиемии (более 7 ммоль/л) показано введение тех же средств с 20—30 мл 10 % глюконата кальция или 200 мл 5 % гидрокарбоната натрия. Введение гидрокарбоната натрия особенно показано при метаболическом ацидозе и не рекомендуется в случаях, когда противопоказано введение хлорида натрия. Борьба с ацидозом позволяет снизить гиперкалиемию.
Для уменьшения образования и задержки конечных продуктов белкового обмена у больных с умеренным и стабильным снижением СКФ (25—55 мл/ми) рекомендуется умеренное ограничение белка (0,8—1 г/кг, т.е. 50—60 г/сут), при этом 40 г белка должно быть животного происхождения.
В случае дальнейшего прогрессирования ХПН или развития уремических симптомов необходимо перевести больного на малобелковую диету с ограничением белка до 0,8 г/кг/сут.
При величине СКФ 13—25 мл/мин суточное количество белка составляет 0,6 гДкгсут) (до 40 г/сут, при этом 30 г/сут белка должно иметь животное происхождение). Широко используют картофельную и картофель-но-яичную диету.
Если СКФ равна 10—13 мл/мин и менее, белок ограничивают до 0,3 г/кг (20 г/сут) с добавлением кетоаналогов незаменимых аминокислот (кетосте- Рил), причем весь белок должен быть полноценным. Высокая энергетическая Ценность пищи при этом обеспечивается за счет углеводов и жиров. Высокая калорийность пищи уменьшает распад собственного белка. Источником ка- л?№й может быть раствор глюкозы, применяемый внутрь или внутривенно (Ш мл 5 % раствора с 10 ЕД инсулина).
Существенно улучшает течение ХПН рациональное использование дие-ы в сочетании с сорбентами — веществами, связывающими и выводящи-и азотистые вещества. В качестве сорбентов применяют энтеродез, поли-фепан, угли «СКН», оксицеллюлозу, окисленный крахмал, карболен. Энте- Росорбенты, изготовленные на основе ионообменных смол, весьма эффективны. Однако сорбенты противопоказаны больным с желудочно- Шечными кровотечениями; при их приеме могут развиваться запоры, у еКоторых больных усиливаются тошнота и рвота.
• Гипотензивная терапия предотвращает прогрессирование ХПи АД следует поддерживать на уровне 130/80 мм рт. ст., причем при сод жании белка в моче более 1 г/сут необходим более низкий уровень АД р~ 125/75 мм рт. ст. Возможно назначение гипотензивных препаратов разн —" классов, однако лучшими нефропротективными свойствами обладают и1^ гибиторы АПФ из-за их способности ингибировать внутрипочечные э<Ъ~ фекты ангиотензина II (снимают спазм выносящей артериолы клубочков внутриклубочковую гипертензию), а также его пролиферативные эффекта11 Рекомендуются ретардные препараты, метаболизирующиеся в печени (пя' миприл, фозиноприл) в обычных дозах. Можно назначать блокаторы рецепторов к ангиотензину II (лозартан, валсартан). При противопоказаниях к ингибиторам АПФ применяют (3-адреноблокаторы (метопролол, небиво-лол, бетаксолол) в необходимых дозах. Оправдано применение и недигид- ропиридиновых блокаторов кальциевых каналов (пролонгированные формы верапамила).
• Для лечения анемии назначают рекомбинантный человеческий эри- тропоэтин (препараты, назначаемые в виде инъекций, — рекормон, эпрекс эпомакс). Препараты эритропоэтина противопоказаны при неконтролируемой артериальной гипертонии, а также при их непереносимости. Лечение эритропоэтином следует начинать после устранения дефицита железа. Анд- рогены (тестостерон пропионат, сустанон, тестэнат) применяют в больших дозах в виде внутримышечных инъекций. Андрогены активируют синтез эритропоэтина.
• При почечной (уремической) остеодистрофии применяют препараты, связывающие фосфор в кишечнике — в первую очередь препараты кальция (карбонат или ацетат кальция), а также ограничивают прием продуктов, богатых фосфором.
• Борьба с инфекционными осложнениями является важной задачей. У больных с ХПН в связи со значительным угнетением иммунитета часто возникают инфекционные осложнения (пневмонии, инфекции мочевых путей), приводящие к значительному снижению функции почек. Следует применять антибиотики, не оказывающие нефротоксического действия: пенициллин, оксациллин, метициллин, эритромицин в обычных дозах.
В терминальной стадии ХПН необходимо проведение хронического гемодиализа — метода, с помощью которого осуществляется внепочечное очищение крови. Метод основан на диффузии через полупроницаемую мембрану веществ, задерживающихся в крови при уремии. Сеансы гемодиализа продолжительностью 5 ч проводят обычно 3 раза в неделю.
Показания к проведению гемодиализа: 1) величина клубочковой фильтрации менее 10 мл/мин; 2) стабильное снижение суточного диуреза ниже 700 мл; 3) повышение содержания креатинина крови более 700 мкмоль/л, 4) увеличение содержания калия в сыворотке крови более 7 ммоль/л (Н?Р" ма 3,4—5,3 ммоль/л); 5) симптомы начинающегося перикардита, эниеф ■ лопатии и нейропатии.
К другим методам лечения ХПН относятся трансплантация почек и ритонеальный гемодиализ.
Прогноз. На ранних стадиях ХПН больные трудоспособны, однако рушение функции почек приводит к инвалидности. Введение програМ**ть го гемодиализа и трансплантации почки позволило несколько улучи прогноз. -и
Профилактика. С целью профилактики тщательно проводят лечени болеваний, способствующих развитию ХПН.
Контрольные вопросы и задачи
На вопросы 124—138 выберите один наиболее правильный ответ.
124 Острый диффузный гломерулонефрит чаще всего развивается вследствие Секции: А. Стафилококковой. Б. Вирусной. В. Стрептококковой. Г. Кишечной1111 пчки Д- Другими грамположительными бактериями.
125 В патогенезе гломерулонефрита принимают участие следующие факторы: Иммунное воспаление. Б. Отложение комплексов антиген — антитело на мем-Й не клубочка. В. Образование капиллярных микротромбов. Г. Ни один из пере-лгпенных факторов. Д. Все перечисленные факторы.
126 При остром гломерулонефрите наиболее часто наблюдаются: А. Отеки, к Лейкоиитурия. В. Артериальная гипертония. Г. Протеинурия. Д. Боли в поясничной области.
127 Из перечисленных симптомов для хронического гломерулонефрита нефротического типа не характерны: А. Отеки. Б. Гематурия. В. Протеинурия. Г. Артериальная гипертония. Д. Боли в пояснице.
128. Для обострения хронического гломерулонефрита гипертонического типа характерны все симптомы, кроме: А. Протеинурии. Б. Гематурии. В. Цилиндрурии. Г Отеков. Д. Артериальной гипертонии.
129. Геолог 26 лет, страдающий хроническим тонзиллитом, в экспедиции перенес ангину; спустя 2 нед отметил отеки век, слабость, снижение работоспособности. Появились одышка, отеки лица, поясницы. Через 3 мес после начала болезни отмечаются отеки лица, поясницы, гидроторакс. Глухие тоны сердца. АД 125/80 мм рт. ст. Анализ мочи: относительная плотность 1021, белок 9 г/л, эритроциты 15—20 в поле зрения, гиалиновые цилиндры 2—4 в препарате. Предполагаемый диагноз: А. Острый гломерулонефрит (гематурический вариант). Б. Острый гломерулонефрит с нефротическим компонентом. В. Сердечная недостаточность в результате развития диффузного миокардита. Г. Обострение хронического гломерулонефрита смешанного типа. Д. Амилоидоз почек.
130. Макрогематурия характерна для всех перечисленных заболеваний, кроме: А. Острого нефрита. Б. Инфаркта почки. В. Поликистоза почек. Г. Амилоидоза почек. Д. Почечной колики.
131. Проба Нечипоренко позволяет: А. Оценить величину клубочковой фильтрации. Б. Уточнить величину относительной плотности мочи. В. Оценить степень гематурии и цилиндрурии. Г. Уточнить величину канальцевои реабсорбции. Д. Определить величину протеинурии.
132. Показателем, позволяющим предположить наличие нефротического синдрома, является: А. Величина фильтрации. Б. Уровень креатинина крови. В. Величина протеинурии. Г. Уровень холестерина сыворотки. Д. Величина канальцевои реабсорбции воды.
133. Для хронического латентного гломерулонефрита характерны все симптомы, кроме: А. Гематурии. Б. Отеков. В. Протеинурии. Г. Цилиндрурии. Д. Небольшой лейкоцитурии.
134. Из перечисленных заболеваний наиболее частой причиной вторичного амилоидоза является: А. Ревматизм. Б. Остеоартроз. В. Ревматоидный полиартрит.
■ Хронический панкреатит. Д. Подагра.
135. Наиболее ранними симптомами при развитии ХПН являются: А. Умень шение диуреза. Б. Диспепсические расстройства. В. Повышение АД. Г. Появление отеков Д. Развитие анемии.
к л ш Достоверным признаком ХПН является: А. Артериальная гиперто-п п Гиперкалиемия. В. Повышение уровня креатинина крови. Г. Олигурия. **• Протеинурия. л '37. В диете больного с ХПН следует прежде всего уменьшить: А. Жиры Б. Ко-
п» 0 ЖИД10С™_ в. Углеводы. Г. Белки. Д. Поваренную соль. Б к Показанием к гемодиализу являются: А. Инфекционные осложнения. Пе Раженные отеки. В. Стабильная артериальная гипертония. Г. Повышение со-сшалия кРеатинина в плазме крови более 106 мкмоль/л. Д. Профессирукяцее "ижение зрения.
Г л ава V Болезни системы крови
Содержание
Гемобластозы....................................................................... 422
Острый лейкоз.................................................................. 422
Хронические лейкозы....................................................... 433
Хронический миелолейкоз............................................... 434
Эритремия (истинная полицитемия, болезнь
Вакеза)......................................................................... 439
Хронический лимфолейкоз......................................... 445
Множественная миелома.................................................. 450
Анемии................................................................................. 458
Железодефицитная анемия.............................................. 458
Сидероахрестическая анемия........................................... 464
В^-дефицитная анемия..................................................... 465
Гемолитические анемии................................................... 470
Наследственный микросфероцитоз (болезнь
Минковского—Шоффара)........................................... 471
Талассемия........................................................................ 473
Аутоиммунная гемолитическая анемия .... 474
Пароксизмальная ночная гемоглобинурия. . . 477
Гипопластическая (апластическая) анемия . . . 479
Геморрагические диатезы.................................................... 482
Тромбоцитопенические пурпуры................................... 486
Идиопатическая тромбоцитопеническая пурпура 487
Гемофилии....................................................................... 489
Ангиопатии (вазопатии).................................................. 491
Диссеминированное внутрисосудистое свертывание
крови................................................................................ 493
Контрольные вопросы и задачи.............................. 496
Гемобластозы Острый лейкоз
ОСТРЫЙ ЛЕЙКОЗ (ОЛ) — опухолевое заболевание кроветворной о темы, при котором субстрат опухоли составляют бластные клетки. Опу? левая трансформация осуществляется на самых ранних этапах диффере
йоования стволовой кроветворной клетки, и дальнейшего ее созревания 1 происходит. Термин «острый лейкоз» отражает не временной фактор длительность течения болезни), а морфологические и цитохимические собенности опухолевых клеток.
Qjl — одно из наиболее тяжелых заболеваний из группы гемобластозов, ни занимают основное место в структуре заболеваемости этими процесса-0,, составляя приблизительно у3 от их общего числа. Встречаются OJI у т любого возраста, при этом отмечается два пика заболеваемости: в воз-1 те 3— 4 и 60—69 лет (мужчины болеют чаще, чем женщины). В прошлом ?яо середины 60-х годов XX в.) OJI в течение нескольких месяцев приводил к смерти больных (на этом основании ранее был предложен термин «острый лейкоз»), В настоящее время достигнуты значительные успехи в его лечении: в большинстве случаев (20—40 %) удается достигнуть полной ремиссии, которая может длиться более 5 лет у 10—20 % больных острыми нелимф'областными лейкозами и у 50 % больных острыми лимфобластны-ми лейкозами. В успехе лечения ОЛ исключительно большое значение имеет фактор времени: чем раньше будет диагностировано заболевание и чем раньше будет начато лечение, тем больше шансов на его успех.
Этиология. Причины заболевания неизвестны. Тем не менее признается существование ряда факторов, способствующих развитию ОЛ: 1) хромосомные аномалии; 2) облучение; 3) токсические влияния вследствие загрязнения внешней среды, лекарственной терапии; 4) предшествующие заболевания системы кроветворения (рефрактерные формы анемий, паро- ксизмальная ночная гемоглобинурия, так называемые миелодисплазии).
Эпидемиологические исследования показывают, что в семьях больных ОЛ риск заболеваемости повышается почти в 3—4 раза. На значение генетических факторов в развитии ОЛ указывает и увеличение заболеваемости при некоторых генетических нарушениях и аномалиях развития (болезнь Дауна, некоторые виды анемий и др.). Предполагается, что роль генетических факторов ограничивается формированием предрасположенности к развитию ОЛ, которая затем реализуется при воздействии различных факторов (лучевых, химических, экзо- и эндотоксических воздействий).
Патогенез. Как уже говорилось, в основе болезни лежит пролиферация опухолевых бластных клеток в костном мозге, которые затем метастазиру-ют в различные органы (селезенка, печень, головной мозг и пр.). OJI сопровождается угнетением нормального ростка кроветворения, что связано с несколькими факторами: 1) «повреждение» кроветворного окружения вокруг опухоли; 2) «вытеснение» нормального ростка гемопоэза; 3) выработка властными клетками ингибиторов, подавляющих рост нормальных кроветворных клеток (схема 20).
Классификация. Опухолевая трансформация при ОЛ происходит на стадиях дифференцировки родоначальных кроветворных клеток. В связи с этим ОЛ в первую очередь разделяют на острые лимфобластные (ОЛЛ), т.е. относящиеся к клеткам — предшественницам лимфопоэза, и острые нелим- Фобластные (ОНЛЛ) или, как их называют, острые миелоидные лейкозы (иМЛ), относящиеся к клеткам-предшественницам миелопоэза. Они составляют основную массу ОЛ у взрослых. Каждая из этих двух больших JPynn ОЛ неоднородна, в них выделяют различные формы на основании Чйтогенетических, иммунологических и морфологических характеристик.
К группам ОМЛ относится 10 % ОЛ, возникших из клеток-предшест-енниц эритроидного и мегакариоцитарного рядов. Поэтому правильнее их «азывать ОНЛЛ.
Схема 20. ПАТОГЕНЕЗ ЛЕЙКОЗА ЭТИОЛОГИЧЕСКИЕ ФАКТОРЫ

|
На основе иммунофенотипической характеристики выделяют следующие варианты острого миелоидного лейкоза:
• острый малодифференцированный лейкоз;
• острый миелобластный лейкоз без созревания;
• острый миелобластный лейкоз с созреванием;
• острый промиелобластный лейкоз;
• острый миеломонобластный лейкоз;
• острый монобластный лейкоз;
• острый эритромиелоз;
• острый мегакариобластный лейкоз.
На основе иммунологической и цитогенетической характеристики выделяют следующие варианты острого лимфобластного лейкоза:
• пре-пре-острый лимфобластный лейкоз;
• пре-В-острый лимфобластный лейкоз;
• В-острый лимфобластный лейкоз;
• Т-острый лимфобластный лейкоз.
В течении острого лейкоза выделяют несколько стадий. I. Начальная оценивается чаще всего ретроспективно. II. Развернутая —с четкими клиническими и гематологичес ми проявлениями болезни, в ней в свою очередь различают: 1) пер У «атаку»; 2) ремиссию (полную или неполную); 3) рецидив болезни; Vе рой рецидив и т.д.
III. Терминальная — отсутствие эффекта от цитостатической пии, выраженное угнетение нормального кроветворения, язвенно-нек-Лийческие процессы.
Выделение стадий OJI необходимо прежде всего в практическом отно-ении, так как в различных стадиях проводится различное лечение (могц- цитостатическая терапия — в развернутой стадии в период первой таки» или рецидива, поддерживающая — в период ремиссии).' Клиническая картина. Проявления OJI могут быть весьма многообразный, в связи с чем их можно представить в виде «больших» синдромов. I. Гиперпластический синдром (называемый также синдромом йкемической пролиферации), обусловленный опухолевым ростом как в костном мозге, так и вне его (метастазирование):
1) увеличение селезенки, печени, лимфатических узлов (периферические, в средостении, брюшной полости), миндалин; 2) поражения кожи (кожные лейкозные инфильтраты — неспецифическая гемодермия, или лейкемиды), мозговых оболочек (нейролейкоз или нейролейкемия), почек, миокарда, легких.
И. Анемический синдром.
Ш. Геморрагический синдром — от мелкоточечных и мелкопятнистых единичных или редких высыпаний на коже и слизистых оболочках до обширных кровоизлияний и профузных кровотечений (носовые, маточные, почечные, желудочно-кишечные и пр.).
IV. Интоксикационный синдром — снижение массы тела, лихорадка, потливость, выраженная слабость.
На I этапе диагностического поиска можно отметить ряд вариантов начала заболевания и дальнейшего его течения. Примерно в половине случаев (преимущественно у лиц молодого возраста) отмечается острое начало заболевания. Обычно это активные, энергичные люди, не привыкшие уделять внимание своему самочувствию и обращающиеся к врачу лишь в крайних случаях. Острое начало болезни протекает под видом ангины, гриппа, острого респираторного заболевания. У некоторых больных, помимо выраженной интоксикации и лихорадки, развивается тяжелый приступ болей в животе, сопровождающийся диспепсическими расстройствами. Таких больных нередко направляют в инфекционное отделение с подозрением на заболевания тифо-паратифозной группы.
У 10 % больных заболевание начинается профузными кровотечениями (носовые, маточные, желудочно-кишечные); некоторые больные впервые обращаются по поводу гиперпластического гингивита и язвенного стоматита. Примерно в 20 % случаев начальная стадия OJI проходит мимо внимания врача и самого больного, что обусловлено неспецифическими симптомами, выраженными в весьма незначительной степени. Тем не менее при Ретроспективной оценке развития болезни удается установить, что еще до Обращения к врачу у больного отмечались нарастающая слабость, повышенная утомляемость, боли в костях, мышцах и суставах, незначительное Увеличение лимфатических узлов или единичные кровоизлияния в кожу, а которые больные не обращали внимания, объясняя их мелкими травма-и, и лишь при нарастании числа «синяков» обращались к врачу. Боли в остях и суставах иногда носят упорный характер, и больные могут нахо-ться под наблюдением врача с диагнозом остеоартроз, ревматоидный Ртрит (к сожалению, анализ крови таким больным своевременно не про-
Наконец, у 52 % больных явных изменений общего состояния не на- тупает, а заболевание обнаруживается при случайном исследовании крови
^нап^име^^пззи^испрнсерном обследовании, оформлении санаторно-
Более реальная возможность диагностики OJI возникает в развернут стадии заболевания. Однако и в это время клиническая картина весьма л риабельна, так как те или иные синдромы выражены в разной степейл Синдром опухолевой интоксикации становится значительно выражение' и проявляется повышением температуры тела, резкой слабостью, потлива! стью, прогрессирующим снижением массы тела.
Гиперпластический синдром проявляется увеличением лимфатически узлов и селезенки, обнаруживаемым самим больным. При метастатических поражениях жалобы весьма разнообразны: сильная головная боль, кашель одышка, упорный «радикулит», боли в животе, рвота, понос, парестезии' кожный зуд; они часто «уводят» мысль врача от OJI и дают возможность предполагать самостоятельные заболевания различных органов.
При нарастании анемического синдрома признаки гипоксически-цир- куляторного синдрома начинают преобладать в клинической картине и дают основание предполагать любую форму анемии.
Точно так же проявления геморрагического синдрома могут быть весьма существенными (обширные геморрагии, кровотечения).
Некоторые больные могут сообщить, что ранее им уже ставили диагноз OJI, по поводу которого проводили цитостатическую терапию. В таком случае ухудшение состояния достаточно связать с ранее выявленным заболеванием.
Таким образом, на I этапе диагностического поиска может быть достаточно данных для углубленного обследования больного (и обязательного проведения исследования крови).
На II этапе диагностического поиска в развернутой стадии болезни можно обнаружить клинические проявления указанных ранее синдромов.
Гиперпластический синдром проявляется: 1) увеличением лимфатических узлов, чаще шейных, с одной или с обеих сторон, плотноватой консистенции, безболезненных (характерно для ОЛЛ); 2) нерезко выраженным увеличением селезенки (плотноватая, безболезненная или слегка чувствительная, выступает из-под реберного края на 3—6 см); 3) увеличением печени: плотноватая, чувствительная, пальпируется на 2—4 см ниже реберного края. Эти физикальные данные могут наблюдаться и при других заболеваниях системы крови.
У больных ОЛ иногда обнаруживаются плотноватые инфильтраты на коже розоватого или светло-коричневого цвета, обычно множественные (лейкемиды). При поражении легких наблюдаются симптомы бронхиальной обструкции (ослабление дыхания, удлинение выдоха, сухие хрипы), очаговые инфильтративные изменения (притупление перкуторного звука, ослабление дыхания или жесткое дыхание, сухие и влажные хрипы): Однако отличить специфический лейкозный пневмонит от бактериальной пневмонии, нередко осложняющей ОЛ, трудно. При поражении миокарда выявляют небольшое расширение границ сердца, тахикардию, глухие тон сердца, в тяжелых случаях — признаки сердечной недостаточности.
Поражение пищеварительного тракта может проявляться болезненн стью при пальпации в эпигастрии.
При поражении ЦНС (нейролейкоз) обнаруживают ригидность зат лочных мышц, симптом Кернига, нарушение функции черепных нерв снижение мышечного тонуса и другие симптомы. а.
Эти явления дают основание подозревать не ОЛ, а самостоятельное болевание того или иного органа.
Анемический синдром проявляется бледностью кожных покровов, та- аодией, систолическим шумом во всех точках, снижением АД. Для ге- хоорагического синдрома характерны кожные геморрагии петехиально- Зистого характера.
Стедует иметь в виду, что указанные многообразные клинические прошения могут отсутствовать, и физикальное исследование в этих случаях ЯБ дает никакой информации. Поэтому предположение об OJI на II этапе ^т и не возникнуть. Решающим для диагноза OJI является III этап. и° Задачами III этапа диагностического поиска являются установление ди-ноза OJI и определение его формы, а также выявление органных поражений и осложнений.
Этот этап диагностики относительно прост: для подтверждения опухолевой трансформации костномозгового кроветворения необходимо провести исследование периферической крови и костного мозга. При OJI клиническая симптоматика становится вполне определенной, когда «плацдарм» кроветворения существенно заменен властными клетками. В развернутой стадии болезни общая масса опухоли составляет 1012 клеток на 1 м2 площади тела.
При исследовании крови число лейкоцитов может колебаться от низких цифр до высоких — гиперлейкоцитоз (в настоящее время благодаря современной диагностике установлено, что оно составляет 20—50 1 09/л, весьма часто — в 50 % случаев), может наблюдаться лейкопения. Основным признаком OJI является наличие в крови опухолевых бластных клеток (бластемия). Эти клетки обнаруживаются в мазках крови в количестве от 5— 10 до 80—90 %. Характерно так называемое лейкемическое зияние — очень малое количество зрелых гранулоцитов — сегментоядерных и практически полное отсутствие палочкоядерных, юных, метамиелоцитов. При алейкемической фазе болезни бласты в периферической крови единичные или же вообще отсутствуют. В этих случаях диагноз ставят по результатам исследования пунктата костного мозга, при котором обнаруживается значительное повышение содержания бластных клеток (увеличение в стернальном пунктате бластных клеток более 30 % полностью подтверждает диагноз OJT).
Существует правило: необходимо в течение всей жизни больного OJI хранить пунктаты костного мозга и мазки периферической крови, так как под влиянием проводимой цитостатической терапии картина крови и костного мозга становится нетипичной для OJI (в препаратах появляются так называемые терапевтические бласты с более грубым ядром и их практически нельзя отличить от лимфоцитов). При повторных обращениях больного в другие лечебные учреждения диагноз OJI может быть подтвержден лишь при изучении первичных препаратов.
Другие гематологические показатели не имеют самостоятельного диагностического значения, хотя анемию и тромбоцитопению, сопутствующие ИЛ, нередко можно рассматривать как косвенные критерии диагноза ОЛ, особенно если анемия и тромбоцитопения сочетаются с лихорадкой неясного генеза и спленомегалией.
Анемия (обычно нормохромного и макроцитарного типа) усиливается о мере прогрессирования заболевания и рассматривается как проявление Угнетения нормального кроветворения. То же происхождение имеет и Ромбоцитопения. В некоторых случаях анемия и тромбоцитопения имеют Утоиммунное происхождение, что сопровождается умеренной желтушно- тью, ретикулоцитозом, повышенным содержанием непрямого билирубина кРови, положительной пробой Кумбса.
В некоторых случаях может быть так называемая малопроцентная л0 ма OJI. Для нее характерны незначительно выраженная клиническая си птоматика, склонность к цитопении, особенно анемии, с увеличением бч стных клеток до 20 % как в крови, так и в костном мозге. Эта картина жет сохраняться несколько месяцев, в конечном итоге развивается титш~ ная картина OJI.
Властные клетки при всех формах OJI характеризуются крупными па мерами, большим ядром, занимающим почти всю клетку и отличающим нежно-сетчатым строением хроматина с крупными единичными ядрыщкая ми. Цитоплазма клеток в виде узкого ободка голубоватого или серо-голу" бого цвета, с единичными мелкими гранулами или без гранул.
Обычно морфологическое исследование окрашенных гематологическими красителями (в мазках крови) властных клеток не позволяет с уверенностью дифференцировать формы OJI (исключение составляют бласты при остром промиелоцитарном лейкозе — обильная крупная фиолетовая зернистость цитоплазмы с наличием телец Ауэра и различная форма ядер клеток).
Различать властные клетки при разных вариантах OJI можно с большой достоверностью по их цитохимическим свойствам.
Для определения острого лимфобластного лейкоза наиболее характерна ШИК-реакция (окраска на гликоген), выявляющая в цитоплазме крупные гранулы, чаще в виде ожерелья. Для острого недифференцированного лейкоза в первую очередь характерна положительная реакция на пероксидазу, а для различных его форм, также в сочетании с положительной реакцией ' на неспецифическую эстеразу (острый монобластный лейкоз и острый миеломонобластный лейкоз), кислые мукополисахариды (острый промие- лоцитарный лейкоз) и некоторые другие.
Для дифференциации острого лимфобластного лейкоза большое значение имеют иммунологические методы (обнаружение поверхностных иммуноглобулинов, способность к розеткообразованию и т.д.). Наконец, начинают приобретать все большую роль методы выявления поверхностных клеточных дифференцировочных антигенов, которые в характерном для каждого типа клеток сочетании появляются и исчезают по мере созревания клетки (для этого используют специфические моновалентные антисыворотки).
Определение степени органных поражений решается с помощью лабо- раторно-инструментальных методов, а при необходимости — гистологических и цитологических.
Последние становятся особенно актуальными в периоде ремиссии для оценки ее полноты. С этой целью производят пункцию костного мозга, увеличенных лимфатических узлов, селезенки, печени, инфильтратов кожи, увеличенного яичка.
Обнаружение властных клеток в пунктатах, а также в спинномозговой и плевральной жидкостях указывает на соответствующее органное поражение и исключает полную ремиссию после проведенной терапии. При подозрении на поражение лимфатических узлов средостения и корней легких проводят томографию и рентгенографию грудной клетк В случае лейкозного пневмонита на рентгенограмме усилен легочный Р сунок и выявляются мелко- и крупноочаговые тени в легочнойткани' При лейкемической инфильтрации миокарда могут быть изменения ЭКГ в виде снижения вольтажа и появления отрицательных зубцов /-Однако указанные изменения ЭКГ могут быть связаны не только специфической инфильтрацией миокарда, но и с миокардиодистрофи> обусловленной опухолевой интоксикацией, кардиотоксическим действ цитостатических препаратов, применяемых при лечении OJI. 428
гтри лейкемической инфильтрации печени ультразвуковое исследование являет ее увеличение и мелкоочаговые изменения эхогенности органа. 93 топная сцинтиграфия в подобных случаях также помогает обнаружить личение органа, снижение поглощения радиофармацевтического препа-^а с его диффузно-неравномерным накоплением. Однако эти изменения Рлсят неспецифический характер и свидетельствуют лишь о диффузных н менениях ткани печени, которые могут развиться в результате неспеци-Аического реактивного гепатита, а также токсического гепатита медика-ентозного (цитостатики) генеза. В последнем случае правильной интерпретации указанных инструментальных данных будут способствовать ре-ультаты анамнеза, физикального исследования (нарастающее увеличение азмеров печени, желтуха) и биохимических реакций, выявляющих значительную
гиперферментемию, гипербилирубинемию.
При ультразвуковом исследовании выявляют чаще двустороннее увеличение почек, обусловленное специфическим поражением почек с диффузными эхоструктурами в ткани; в моче — умеренную протеинурию, гематурию, цилиндрурию. Эти изменения могут быть проявлением опухолевой интоксикации. Для нейролейкемии характерны высокий цитоз, повышенное содержание белка в спинномозговой жидкости и обнаружение в мазках бластных клеток. Серьезным осложнением цитостатической терапии является развитие агранулоцитоза, о котором судят по выявлению в крови резкой леикопении (до 1 ■ 109/л и менее), уменьшению числа ней-трофилов (вплоть до их исчезновения), появлению относительного лим- фоцитоза.
Диагностика. Несмотря на то что клиническая картина OJI очерчена довольно ярко, все же признаков, патогномоничных только для этого заболевания, практически нет. В связи с этим даже такие, казалось бы, характерные для гемобластозов симптомы, как увеличение селезенки, печени, лимфатических узлов, анемия, позволяют врачу лишь заподозрить OJI и срочно провести исследование крови. Морфологические методы — исследование костного мозга и периферической крови — позволяют диагностировать ту или иную форму OJI. Однако в настоящее время наиболее точным методом диагностики является цитохимическое исследование. Иммунофенотипирование бластов имеет то преимущество, что его можно проводить параллельно с цитохимическим исследованием. Иммунофенотипирование позволяет определить с помощью моноклональных антител наличие или отсутствие кластеров дифференцировки бластных клеток (CD-маркеры).
Существует ряд правил, которые следует помнить любому врачу, чтобы Диагностировать OJI. Обязательно динамическое исследование крови при всех рефрактерных к лечению и рецидивирующих ангинах, респираторных заболеваниях, гриппе, особенно если эти заболевания сопровождаются лимфаденопатией, геморрагиями, а также артралгиями. Особая гематологическая настороженность должна быть при всех лимфаденитах и гиперпла- тических гингивитах. Назначение таким больным различных физиотерапевтических и тепловых процедур без предварительного исследования крови может принести вред.
Дифференциальная диагностика. При постановке диагноза OJI, особен- 0 при лейкопении, отсутствии гранулоцитов, следует проводить диффе- Ренциальный диагноз с рядом заболеваний, ей лгРанУ°читозы не сопровождаются бластозом костного мозга, редукци-
и эритроидного роста кроветворения, геморрагический синдром отмечает- " Редко, селезенка не увеличена.
Гипопластические анемии не протекают с увеличением лимфатическр узлов и селезенки. В миелограмме не увеличено количество бластных к? * ток. Важное значение для диагностики имеет трепанобиопсия: преоблал ние в трепанате жировой ткани свидетельствует о наличии гипогшастич ской анемии.
При диффузных заболеваниях соединительной ткани, хронических акгпи ных гепатитах могут наблюдаться лимфаденопатия, увеличение селезенке анемия, тромбоцитопения, нейтропения, в пунктате костного мозга кот*' чество б ластов может быть повышено до 10—20 %. В таких случаях необх дима трепанобиопсия крыла подвздошной кости и повторные исследова" ния крови и костного мозга. Кроме того, учет всей клинической картины помогает правильно оценить симптомы заболевания.
С симптоматикой OJI сходна клиническая картина инфекционного моно- нуклеоза — острое начало, лихорадка, ангина; увеличение печени, селезенки, лимфатических узлов; лейкоцитоз с наличием широкопротоплазменных мононуклеаров в гемограмме. Однако в отличие от OJI отсутствуют анемия и геморрагический синдром; увеличенные болезненные лимфатические узлы локализуются по заднему краю грудино-ключично-сосцевид-ной мышцы. В мазке крови вместо бластных клеток обнаруживают 60—70 % мононуклеаров, большинство из которых составляют средне- и широкопротоплазменные лимфоциты, увеличено количество моноцитов, тромбоцитопения отсутствует.
Существенные трудности возникают при дифференциации OJI и властного криза хронического миелолейкоза (XMJI). Клинические признаки, исследование крови и костного мозга не позволяют дифференцировать заболевания. В таких случаях существенную пользу оказывает исследование хромосом. Обнаружение Ph-хромосомы свидетельствует о хроническом миелолейкозе.
Лейкемоидные реакции — значительное повышение количества лейкоцитов со сдвигом лейкоцитарной формулы влево. Причиной лейкемоидных реакций могут быть тяжелые инфекционные и воспалительные заболевания, прием некоторых медикаментов, интексикации, травмы. В отличие от OJI при лейкемоидных реакциях бласты не обнаруживаются.
Формулировка развернутого клинического диагноза учитывает: 1) форму OJI; 2) стадию заболевания; 3) наличие внекостномозговых поражений; 4) осложнения.
Лечение. Цель современной терапии ОЛ у взрослых лиц — достижение длительной выживаемости (без возникновения рецидивов болезни). Это оказалось возможным при условии внедрения программного лечения, т.е. поэтапного уничтожения лейкозных клеток с помощью различных комбинации цитостатических средств, а также комплекса мероприятий, направленных на лечение и предупреждение агранулоцитоза, тромбоцитопении, анемии, синдрома диссеминированного внутрисосудистого свертывания крови (Дл. 2' Использование таких программ позволяет добиться ремиссии у 60—oU А взрослых больных лейкозом и полного выздоровления у 20—30 %.
При ОЛ руководствуются определенными принципами лечения.
• Его начинают сразу же после постановки диагноза.
• Оно должно быть дифференцированным и зависеть от морфолог ческого и цитохимического типа ОЛ. ч
• Одновременно назначают несколько препаратов (полихимиотерапи
• Следует стремиться к достижению лейкопении. в,
• В стадии ремиссии необходимо проводить поддерживающую рапию.
Лекарственные препараты не способствуют превращению лейкемиче-х
клеток в нормальные, а уничтожают их. Основная задача тера-сКл____ санация
организма от лейкемических клеток, что достигается при-пнением большого количества химиопрепаратов с различным механизмом ** йствия. Антилейкемические препараты наиболее активны по отношению леляшимся клеткам, причем некоторые из них активны в какой-то опре-* ленный период митоза (фазово- и циклоспецифические препара-ле, — меркаптопурин, цитобарин, или цитозар, метотрексат), другие — в те-ть ие „сего митотического цикла (циклонеспецифические — циклофос-1ан винкристин, преднизолон).
Существуют определенные этапы при проведении химиотерапии:
• вызывание ремиссии (индукция) проводится при первой «атаке» ОЛ и рецидивах болезни;
• закрепление (консолидация) ремиссии — 2—3 курса лечения препаратами, вызвавшими ремиссию (реже — иными);
• противорецидивная терапия (поддерживание ремиссии) проводится в течение всего периода ремиссии;
• профилактика нейролейкемии.
Невыполнение одного из этапов такого программного лечения, необоснованные изменения в схемах химиотерапии приводят к неизбежному развитию рецидива и лишают больного шансов на полное выздоровление. Следует также отчетливо представлять, на основании каких признаков можно говорить о наступлении ремиссии или рецидива.
Ремиссия характеризуется следующими показателями, сохраняющимися на протяжении не менее 1 мес:
• в костном мозге число бластных клеток не превышает 5 %, представлены все ростки кроветворения с нормальными признаками созревания, мегакариоциты обнаруживаются, клеточность костного мозга более 20%;
• в периферической крови — абсолютное число нейтрофилов не менее 1,5 109/л, тромбоцитов не менее 100 1 09/л, бластные клетки не обнаруживаются;
• не имеется очагов экстрамедуллярного лейкемического роста (включая отсутствие нейролейкемии).
Рецидив диагностируется при обнаружении в пунктате костного мозга 5— 20 % бластов (повторное обнаружение бластов в костном мозге более 5 % подтверждает рецидив), а также любого экстрамедуллярного лейкемического поражения (даже без вовлечения в патологический процесс костного мозга).
При назначении полихимиотерапии следует иметь в виду, что те или иные морфологические варианты ОЛ оказываются чувствительными к комбинациям определенных препаратов.
При остром миелобластном лейкозе индукция ремиссии проводится с помощью программы «7+3»: цитарабин 100 мг/м внутривенно капельно каждые 12 ч в течение 7 дней, рубомицин 45(60) мг/(м сут) внутривенно труйно или капельно быстро в течение 3 дней. Помимо химиотерапии, •язательным компонентом является так называемая сопроводительная терапия, направленная на профилактику осложнений, связанных с примене-Ием цитостатиков (переливание эритроцитной массы и свежезаморожен-°и плазмы, стерилизация кишечника неадсорбирующимися антибиотика-и, гидратационная терапия, противорвотные препараты). Индукционная Рапия предполагает проведение двух аналогичных курсов полихимиоте-
Консолидация ремиссии — два курса «7+3».
Поддерживающая терапия — курсы «7+3» с интервалом 6 нед в течен года с заменой рубомицина на тиогуанин в дозе 60 мг/м 2 раза в де внутрь. На фоне поддерживающей терапии должны проводиться контролЛ ные стернальные пункции (1 раз в 3 мес). Профилактика нейролейкеми осуществляется эндолюмбальным введением цитостатиков (метотрекса цитозар) в сочетании с преднизолоном. Вместо этого осуществляют так*' облучение головы.
При локализации очагов лейкемической инфильтрации в средостении глотке, яичке проводится рентгенотерапия этих областей.
При остром лимфобластном лейкозе терапия носит постоянный, а курсовой характер и зависит от группы риска (стандартный или высокий)
К группе стандартного риска относят больных с пре-пре-В-, пре-В- и Т- клеточным лейкозом в возрасте 15—35 лет и 51—65 лет, не лечившихся по поводу данного заболевания ранее, с числом лекоцитов менее 30 109/л у которых получена ремиссия в течение 28 дней терапии.
К группе высокого риска относят больных с пре-пре-В-клеточным OJIJI, лимфобластным и Ph+ острым лимфобластным лейкозом в возрасте 15—50 лет; общим пре-пре-В- и Т-клеточным OJIJI в возрасте 35—50 лет-при экспрессии миелоидных маркеров на лимфобластах; с числом лейкоцитов более 30 109/л, при отсутствии ремиссии на 28-й день терапии.
При стандартном риске индукция ремиссии состоит из комбинации вин- кристина, преднизолона, рубомицина, L-аспарагиназы, циклофосфамида (вводимых внутривенно и внутрь) и шести люмбальных пункций с интрате- кальным введением метотрексата, преднизолона и цитарабина (цитозара).
Консолидацию ремиссии проводят в течение 5 дней на 13-й, 17-й и после проведения реиндукции на 31-й, 35-й неделе лечения. Применяют два препарата — этопозид и цитарабин.
Реиндукцию ремиссии проводят с 21-й по 26-ю неделю лечения и далее через 3 мес после последнего курса консолидации с интервалом 3 мес в течение 2 лет. Препараты и их дозы аналогичны применяемым при индукции ремиссии.
Поддерживающую терапию проводят метотрексатом и меркаптопури-ном через 3—4 нед после последнего курса консолидации в течение 2 лет.
Профилактика нейролейкемии осуществляется с помощью эндолюм- бального введения метотрексата, цитозара и преднизолона или облучения головы с обоих латеральных полей.
В последние годы для лечения рецидива OJI или его профилактики применяют трансплантацию костного мозга (аллогенного или аутологично- го, полученного в период ремиссии) после предварительного введения больших доз циклофосфана (50 мг на 1 кг массы тела в течение 4 дней) и однократного тотального облучения в дозе 10 Гр.
Инфекционные осложнения OJI являются весьма грозными, в связи с чем активная терапия антибиотиками широкого спектра действия Д°л*? проводиться своевременно и в достаточных дозах. Профилактикой "^ф6*;- ционных осложнений, особенно у больных с гранулоцитопенией, ят?еТ тщательный уход за кожей и слизистой оболочкой рта, помещение110ных в специальные асептические палаты, стерилизация кишечника с по щью неадсорбируемых антибиотиков (канамицин, неомицин).
При развитии геморрагического диатеза необходимо переливание тр боконцентратов (1—2 раза в неделю) и свежезамороженной плазмы,.
В настоящее время внесены существенные дополнения в теРап °лел-ного из самых тяжелых вариантов OJI — острого промиелоцитарного
(ОПЛ), при котором развиваются серьезные геморрагические осложняя, обусловленные ДВС-синдромом, даже в период индукции ремиссии Неянда'ртными химиотерапевтическими препаратами, в том числе даунору- йпмииином (ДНР) и цитозин-арабинозадом (Ага-С).
Применение более высоких доз ДНР (> 45 мг/м2), а также нового пре-оата ATRA (производное трансретиноевой кислоты) в сочетании с цито- татическими средствами и трансфузиями свежезамороженной плазмы и лпомбоконцентратов позволило снизить процент летальности таких боль-ых от кровоизлияния в мозг и добиться полной клинико-гематологической
ремиссии у 85—96 % из них.
Прогноз. В процессе лечения могут быть достигнуты:
1) полная клинико-гематологическая ремиссия (клиническая компенсация без признаков лейкозной инфильтрации селезенки, печени и других органов, нормальный или близкий к норме анализ крови, в пунктате костного мозга число бластных клеток не превышает 5 %, а общее число лим-фоидных и бластных клеток не более 40 %);
2) частичная клинико-гематологическая ремиссия (клиническая компенсация или улучшение, небольшие изменения в анализе крови с увеличением числа зрелых клеток, исчезновением или резким уменьшением числа бластных клеток в крови и пунктате костного мозга);
3) выздоровление (состояние полной клинико-гематологической ремиссии с безрецидивным течением на протяжении 5 лет и более). При ОЛЛ программная терапия позволяет более чем у 50 % детей добиться полной клинико-гематологической ремиссии в течение 5 лет.
Ремиссии получают у 74—79 % взрослых больных, продолжительность ремиссий в среднем 2 года. Прогностически наименее эффективно лечение всех форм ОЛ с парциальной цитопенией и панцитопенией.
Профилактика. Первичной профилактики ОЛ не существует. Вторичная профилактика сводится к тщательному контролю за состоянием больного и правильному проведению противорецидивной терапии. Больных ОЛ ставят на диспансерный учет.
Хронические лейкозы
Как уже упоминалось, среди хронических лейкозов выделяют миело- пролиферативные и лимфопролиферативные заболевания (опухоли лимфатической системы). К числу хронических миелопролиферативных процессов относят хронический миелолейкоз, эритремию (истинную полицитемию), сублейкемический миелоз (идиопатический миелофиб-Роз, алейкемический миелоз, миелоидная спленомегалия), эссенциальную тромбоцитемию (хронический мегакариоцитарный лейкоз, геморрагическая тромбоцитемия).
Для всей группы миелопролиферативных заболеваний (лейкозов) характерен дефект (мутация) на уровне полипотентной стволовой клетки, тот дефект далее продуцируется на следующем классе стволовых клеток Рлигопотентных) — клетках-предшественницах смешанной культуры. Эти уЛетки дают начало трем линиям миелоидного кроветворения — эритроци- арного, гранул оцитарного и мегакариоцитарного. Создается миелоидная Ролиферация — основной признак, характеризующий субстрат этих завоеваний, при этом продукция клеток осуществляется из одного или нескольких ростков миелоидного кроветворения (эритробластического, гра- яулоцитарного, мегакариоцитарного).
Согласно классификациям ВОЗ (2001) и А.И. Воробьева и М. Брил ант, выделяют зрелоклеточные В-клеточные опухоли лимфатической си темы. К их числу относят хронический лимфолейкоз (различные его (ЪИс~ мы), В- клеточный пролимфоцитарный лейкоз, лимфоплазмоцитарнл-лейкоз, лимфоцитома селезенки, волосатоклеточный лейкоз, а также rnv пу парапротеинемических гемобластозов — заболеваний, при которых cm холевые клетки секретируют патологический белок (парапротеин); к н относят множественную миелому (миеломная болезнь); лимфоплазмопи* тарный лейкоз; макроглобулинемию Вальденстрема; болезнь тяжелых ц пей, моноклональную гаммапатию, солитарную плазмоцитому кости тл~ костную плазмоцитому, первичный амилоидоз.
Далее будут рассмотрены наиболее часто встречающиеся хронические лейкозы: хронический миелолейкоз, эритремия, хронический лимфолейкоз, множественная миелома.
Хронический миелолейкоз
Этиология и патогенез. Причиной патологического роста клеток считается мутация клетки-предшественницы миелопоэза (частично детерминированная… По мере течения болезни моноклоновая стадия сменяется поликлоно-вой, что… XMJI чаще наблюдается у взрослых в возрасте 30—70 лет; отмечается небольшое преобладание мужчин. ХМЛ — наиболее…ЦНС.
Однако и на II этапе поставить окончательно диагноз эритремии нельзя, так как многие ее симптомы могут быть при симптоматических эритро- цитозах. Кроме того, такие симптомы, как АГ, спленомегалия и гепатомегалия, характерны для самых разнообразных заболеваний.
В связи с этим III этап диагностического поиска приобретает решающее значение, так как позволяет: а) поставить окончательный диагноз; б) уточнить стадию эритремии; в) выявить осложнения; г) осуществить контроль за лечением.
Анализ периферической крови обнаруживает эритроцитоз, увеличение содержания гемоглобина и показателя гематокрита, что, однако, встречается и при симптоматических эритроцитозах. Диагностическое значение имеет повышение уровня гемоглобина в сочетании с эритроцитозом, лейкоцитозом и тромбоцитозом. При исследовании лейкоцитарной формулы обнаруживают сдвиг влево до незрелых форм гранулоцитов. Если изменения в периферической крови незначительны или данные неубедительны (например, эритроцитоз не сочетается с тромбоцитозом), то необходимо провести исследование костного мозга (трепанобиопсия). Наличие в трепанате тоталь- 442 лой трехростковой гиперплазии костного мозга с преобладанием формен-щДх элементов эритропоэза, замещение жировой ткани красным ростком костного мозга дают возможность поставить окончательный диагноз. Расширение «плацдарма» кроветворения выявляется также с помощью радио-нуклидного сканирования костей с пР. Гистохимическое исследование выявляет повышенную активность щелочной фосфатазы нейтрофилов.
Осложнения. Течение эритремии осложняют: 1) сосудистые тромбозы (мозговых, коронарных, периферических артерий); 2) геморрагический синдром: кровотечения после малых оперативных вмешательств (экстракция зуба), из сосудов пищеварительного тракта, геморроидальных узлов, что обусловлено плохой ретракцией кровяного сгустка вследствие изменения функциональных свойств тромбоцитов; 3) эндогенная урикемия и ури- козурия (вследствие повышенной гибели клеток на ядерных предстадиях их созревания), что проявляется симптомами мочекаменной болезни и подагрического артрита.
Исходами болезни являются ситуации, указанные в III стадии течения болезни (миелофиброз, хронический миелолейкоз, острый лейкоз, анемия).
Диагностика. Эритремию можно заподозрить у лиц с наличием стойкого эритроцитоза в сочетании с нейтрофильным лейкоцитозом, тромбоцитозом при отсутствии заболеваний (или состояний), которые могли бы вызвать эритроцитоз.
Диагностическими критериями эритремии (в развернутой стадии) являются:
Категория «А».
• Увеличение массы циркулирующих эритроцитов.
• Нормальное насыщение артериальной крови кислородом (более 92%).
• Увеличение селезенки.
Категория «Б».
• Лейкоцитоз более 12 109/л (при отсутствии явных причин для появления лейкоцитоза).
• Тромбоцитоз более 400-109/л.
• Увеличение содержания щелочной фосфатазы нейтрофилов (при отсутствии инфекции).
• Увеличение ненасыщенной витамин В^-связывающей способности сыворотки крови.
Диагноз ЭР достоверен при наличии трех признаков категории А или Двух признаков категории А и одного признака категории Б.
Затруднения в постановке диагноза обусловлены развитием так называемого симптоматического эритроцитоза при целом ряде заболеваний. Выделяют абсолютные и относительные эритроцитозы. При абсолютных эритроци- тозах отмечают увеличение массы циркулирующих эритроцитов и повышенный эритропоэз. Для относительных эритроцитозов характерны уменьшение объема циркулирующей плазмы и нормальная масса циркулирующих эритроцитов. Относительные эритроцитозы часто выявляют у мужчин, страдающих гипертонией, ожирением, неврастенией, принимающих мочегонные средства. Вторичный абсолютный эритроцитоз развивается у курящих, он обусловлен увеличением содержания в крови окиси углерода.
Причины развития симптоматических эритроцитозов: 1) генерализованная тканевая гипоксия (легочная патология, заболевания сердца, гемоглобинопатии, ожирение и т.д.); 2) паранеопластические реакции (опухоли Ночек, опухоли коркового и мозгового вещества надпочечников, гипофиза, яичников, сосудистые опухоли, опухоли других органов); 3) ишемия почек (стеноз почечной артерии, гидронефроз, поликистоз и другие аномалии почек); 4) неустановленные причины (заболевание ЦНС, портальная гипертензия).
Относительные эритроцитозы наблюдаются при эксикозах (обезвоживание вследствие поноса, рвоты, повышенной потливости и др.). Дифференциальная диагностика основывается на учете всей клинической картины. В сложных случаях необходимо исследовать содержание эритропоэти-на в крови; при эритремии оно не повышается.
Формулировка развернутого клинического диагноза включает сведения о- 1) стадии заболевания; 2) наличии осложнений; 3) фазе процесса (обострение или ремиссия); 4) наличии выраженных синдромов (портальная гипер-тензия,
ие. Весь комплекс лечебных мероприятий при ЭР представляется следующим.
В развернутой стадии болезни при наличии плеторического синдрома, но без лейко- и тромбоцитоза применяют кровопускания как самостоятельный метод терапии, при этом необходимо добиваться снижения уровня гематокрита до нормальных значений (менее 45 %). Забирают по 400— 500 мл крови через день (в условиях стационара) или через 2 дня (в условиях поликлиники). Для профилактики тромбозов (развиваются в результате кровопускания, а также как осложнение эритремии) назначают ацетилсалициловую кислоту в дозе 0,5—1 г/сут накануне и в день кровопускания, а затем в течение 1—2 нед после окончания кровопусканий. Кроме ацетилсалициловой кислоты, назначают и другие дезагреган-ты — тиклид, плавике, пентоксифиллин. Перед кровопусканием для профилактики тромбоэмболии легочной артерии целесообразно вводить внутривенно 5000 ЕД гепарина (через иглу Дюфо), а также по 5000 ЕД гепарина под кожу живота 2 раза в сутки в течение нескольких дней после кровопускания. При плохой переносимости кровопусканий, наблюдаемой у лиц с выраженным атеросклерозом мозговых сосудов, ограничиваются эксфу-зией 350 мл (2 раза в неделю). При кровопусканиях необходимо снизить гемоглобин до 150 г/л.
Если кровопускания недостаточно эффективны, а также при формах болезни, протекающих с панцитозом и спленомегалией, назначают цито- статическую терапию. Возраст больных более 55 лет расширяет показания к применению цитостатиков. Косвенными показаниями к цитостатической терапии являются и другие признаки миелопролиферативного синдрома (зуд), а также тяжесть заболевания, висцеральные сосудистые осложнения (инсульт, инфаркт миокарда), истощение.
Противопоказания к цитостатической терапии: молодой возраст больных, рефрактерность к лечению на предыдущих этапах, а также чрезмерно активная в прошлом цитостатическая терапия из-за опасения перехода заболевания в фазу анемии. Эффект цитостатической терапии следует оценивать через 3 мес после окончания лечения; это объясняется тем, что продуцированные до лечения эритроциты живут в среднем около 2—3 мес. Снижение количества лейкоцитов и тромбоцитов наступает значительно раньше, соответственно срокам их жизни. Критерием эффективности цитостатической терапии является достижение гематологической ремиссии (полной, когда все показатели крови нормализуются, или частичной, при которой остается несколько повышенным количество эритроцитов, лейкоцитов и/или тромбоцитов).
Из цитостатических препаратов на первом этапе обычно назначают гидроксимочевину (гидреа) в дозе 30—50 мг/(кгсут) (по 2—3 капсулы в 444
день). Во время лечения необходимо контролировать число лейкоцитов. Гидреа сочетают с а-интерфероном в дозе 3—5 млн ME подкожно 3—7 раз в неделю длительно (не менее года), что позволяет купировать тромбоци-тоз, плетору, кожный зуд.
При гипертромбоцитозе применяют анагрелид.
• На исходы эритремии (миелофиброз, острый лейкоз, хронический миелолейкоз) воздействуют согласно принципам лечения этих заболеваний: при миелофиброзе применяют анаболические стероиды, нитостати-ки и переливания эритроцитной массы; при остром лейкозе показана полихимиотерапия, при хроническом миелолейкозе — цитостатические препараты.
• Симптоматическую терапию при приступах эритромелалгии проводят с помощью антиагрегантов, нестероидных противовоспалительных препаратов (ацетилсалициловая кислота, индометацин). Артериальную гипертонию, приступы стенокардии ликвидируют в соответствии с правилами лечения этих состояний.
• При осложнениях эритремии тромбозом сосудов применяют анти- коагулянтную и антиагрегантную терапию.
• Больных эритремией ставят на диспансерный учет с частотой обращения к врачу и назначением анализов периферической крови 1 раз в 3 мес.
Прогноз. При неосложненном течении эритремии продолжительность жизни может достигать 15—20 лет (в дальнейшем возникают осложнения). Если же осложнения со стороны сердечно-сосудистой системы развиваются достаточно рано или болезнь прогрессирует, продолжительность жизни сокращается. Своевременно начатая терапия удлиняет продолжительность жизни, хотя это наблюдается не во всех случаях.
Профилактика. Радикальных мер предупреждения болезни не существует, в связи с чем можно говорить лишь о вторичной профилактике, заключающейся в динамическом наблюдении за больными и проведении проти- ворецидивной терапии.
Хронический лимфолейкоз
Однако эти лимфоциты функционально неполноценны, что проявляется в нарушении иммунной системы, повышенной склонности к аутоиммунным реакциям и… ХЛЛ — наиболее часто встречающийся в практике врача лейкоз; он составляет 30… Этиология. В происхождении ХЛЛ большое значение имеют наследственная предрасположенность и нарушения иммунологической…Множественная миелома
ММ наиболее часто встречается у лиц на пятом-шестом десятилетии (у детей ММ неизвестна); в молодом возрасте (до 40 лет) заболевание встречается… Этиология. Причины заболевания, как и этиология опухолей вообще, неизвестны. … Патогенез. В основе заболевания лежит пролиферация плазматических клеток организма. Плазмоцит (плазматическая клетка)…Талассемия
Клиническая картина. Бета-талассемия протекает в двух вариантах: 1) большая талассемия (анемия Кули), наблюдающаяся в детском возрасте (гомозиготная… На I этапе диагностического поиска можно выявить жалобы на повышенную… На II этапе диагностического поиска возможно выявление в периоды обострения умеренной желтушности кожных покровов, у…Аутоиммунная гемолитическая анемия
1) симптоматическую форму (анемия развивается на фоне какого-то определенного заболевания: гемобластоза, системного заболевания соединительной… 2) идиопатическую форму, когда выявить определенное заболевание не удается… При АИГА вырабатываются антитела к собственному антигену эритроцитов. Первым этапом патогенеза АИГА является…Пароксизмальная ночная гемоглобинурия
В основе заболевания лежит выработка патологического клона эритроцитов с повышенной чувствительностью к различным гемолитическим агентам (таким… При ПНГ гемолиз происходит внутрисосудисто, поэтому в плазме крови… Клиническая картина. Проявления болезни определяются выраженностью внутрисосудистого гемолиза, а также возникновением…Тромбоцитопенические пурпуры
A. Тромбоцитопении вследствие повышенного разрушения тромбо цитов: I. Наследственные формы (обусловленные дефектами ферментов глико лиза или… II. Приобретенные формы:Идиопатическая тромбоцшпопеническая пурпура
Клиническая картина. Проявления болезни определяются геморрагическим синдромом. Как правило, болезнь течет волнообразно: «спокойные» периоды… На I этапе диагностического поиска можно получить информацию о жалобах… На II этапе диагностического поиска в период обострения заболевания можно обнаружить пятнисто-петехиальный тип…СОЭ.
141. У больной острым лейкозом в развернутой стадии заболевания, в период рецидива болезни отмечены повышение температуры тела, появление небольшой желтухи, болей в левом подреберье, увеличение размеров селезенки. При лабораторном исследовании выявлены нарастающая анемия с ретикулоцитозом, повышение уровня непрямого билирубина в сыворотке крови. Эту ситуацию следует расценить как: А. Прогрессирование лейкоза. Б. Острый вирусный гепатит. В. Развитие аутоиммунной гемолитической анемии. Г. Развитие инфаркта селезенки. Д. Развитие токсико-аллергического гепатита.
142. У больного 40 лет после перенесенного 2 мес назад респираторного заболевания отмечаются возрастающая слабость, лихорадка, при осмотре — бледность кожных покровов, на коже туловища и конечностей — необильные петехиально- пятнистые геморрагические высыпания, подмышечные лимфатические узлы увеличены, мягкие, безболезненные размером 2—1 см; печень и селезенка не увеличены. Анализ крови: НБ 100 г/л, эритроциты 31012/л; цв. пок. 1,0; лейкоциты 3,5-109/л; лейкоцитарная формула: бластные клетки 32 %; нейтрофильные миелоциты 0,5 %; метамиелоциты 0,5 %; палочкоядерные 3 %; сегментоядерные 35 %; эозинофилы 1 %; лимфоциты 20 %; моноциты 8 %; СОЭ 20 мл/ч; тромбоциты 55 10 /л. Больному можно поставить диагноз: А. Сепсис. Б. Острый лейкоз. В. Геморрагический васкулит. Г. Тромбоцитопеническая пурпура. Д. Обострение латентно протекающего лимфолейкоза.
143. Указать основной метод лечения рецидива острого лейкоза: А. Курсовая полихимиотерапия. Б. Курсовая монохимиотерапия. В. Антибиотикотерапия. Г. Глю- кокортикоидная терапия. Д. Гемотрансфузии.
144. В основе патогенеза эритремии лежит: А. Пролиферация лейкоцитов и эритроцитов. Б. Пролиферация лейкоцитов, эритроцитов, тромбоцитов. В. Преимущественная пролиферация эритроидных элементов. Г. Пролиферация эритроцитов „ тромбоцитов. Д. Все варианты верны в равной степени.
145. Наиболее важным в развитии гемодинамических нарушений при эритремии является: А. Изменение сосудистой стенки. Б. Изменения реологических свойств крови с тенденцией к агломерации форменных элементов. В. Замедление скорости кровотока. Г. Региональные сосудистые спазмы. Д. Все факторы в равной степени.
146. Клинические проявления эритремии характеризуются всеми перечисленными синдромами и симптомами, за исключением: А. Миелопролиферативного синдрома. Б. Лимфопролиферативного синдрома. В. Плеторического синдрома. Г. Тромбозов. Д. Гепатоспленомегалии.
147. У больного с эритремией при наличии выраженного акроцианоза, сплено- мегалии, артериальной гипертонии, остаточных явлений тромбоза сосудов сетчатки, панцитоза без очагов экстрамедуллярного кроветворения, вероятнее всего, имеет место: А. I стадия болезни. Б. ПА стадия. В. ПБ стадия. Г. III стадия. Д. Данных недостаточно.
148. Наиболее важным фактором, определяющим назначение цитостатических препаратов как основного метода лечения эритремии, является: А. Наклонность к тромбоэмболии. Б. Выраженный миелопролиферативный синдром. В. Резко выраженный плеторический синдром. Г. Увеличение показателя гематокрита и вязкости крови. Д. Все факторы важны в равной степени.
149. Наиболее информативным методом для подтверждения миелопролиферативного синдрома при хроническом миелолейкозе является: А. Определение лейкоцитарной формулы крови. Б. Стернальная пункция. В. Трепанобиопсия костного мозга. Г. Пункция лимфатического узла. Д. Пункция печени.
150. Наиболее частый клинический симптом хронического миелолейкоза: А. Лихорадка. Б. Кровоточивость. В. Увеличение лимфатических узлов. Г. Увеличе ние печени. Д. Увеличение селезенки.
151. Больная 52 лет в течение 1,5 года отмечает боли в левом подреберье. При осмотре обнаружены небольшие геморрагии на коже, увеличенная селезенка, выступающая на 7 см из-под края реберной дуги. Анализ крови: НЬ 100 г/л, лейкоциты 5 10 /л (миелобласты 1 %, промиелоциты 1 %, нейтрофильные миелоциты 3 %, нейтрофильные метамиелоциты 8 %, нейтрофильные палочкоядерные 12 %, сег- ментоядерные 55 %, эозинофилы 5 %, базофилы 2 %, лимфоциты 12 %, моноциты 1 %). Предполагаемый диагноз: А. Тромбофлебитическая спленомегалия. Б. Абсцесс селезенки. В. Хронический миелолейкоз. Г. Цирроз печени. Д. Острый лейкоз.
152. Наиболее информативным методом для подтверждения лимфопролиферативного синдрома при хроническом лимфолейкозе является: А. Определение лейкоцитарной формулы крови. Б. Пункция лимфатического узла. В. Пункция селезенки. Г. Биопсия лимфатического узла. Д. Пункция печени.
153. Наиболее характерный клинический симптом хронического лимфолейкоза:
A. Лихорадка. Б. Боли в костях. В. Кровоточивость. Г. Увеличение лимфатических узлов. Д. Увеличение печени.
154 Больной 62 лет в течение года жалуется на слабость, увеличение шейных, подмышечных и паховых лимфатических узлов. Лимфатические узлы мягкие, безболезненные при пальпации. Анализ крови: лейкоциты 40 10% (эозинофилы 1 %, палочкоядерные 3 %, сегментоядерные 15 %, лимфоциты 75 %, моноциты 6 %). Предполагаемый диагноз: А. Реактивный лимфаденит. Б. Хронический лимфолей-коз.
B. Лимфогранулематоз. Г. Лейкемоидная реакция. Д. Метастазы злокачественной опухоли в лимфатические узлы.
155. Наиболее информативным методом для подтверждения диагноза лимфогранулематоза является: А. Определение лейкоцитарной формулы крови. Б. Пункция лимфатического узла. В. Радиоизотопное исследование лимфатической системы. Г. Биопсия лимфатического узла. Д. Пункция селезенки.
156. Решающим в постановке диагноза лимфогранулематоза является: А. Выявление нейтрофильного лейкоцитоза. Б. Обнаружение увеличения забрюшинных и медиастинальных лимфатических узлов. В. Обнаружение клеток Березовского— Штернберга. Г. Выявление анемии аутоиммунного происхождения. Д. Выявление признаков опухолевой интоксикации.
157. Больной 27 лет заболел остро: повысилась температура тела до 39 °С, появились проливные поты, ознобы; спустя 2 нед под влиянием антибиотиков (?) и жаропонижающих средств температура тела снизилась до 37,8—38,4 "С, потливость оставалась. Врач обнаружил увеличенные шейные лимфатические узлы (слева) плотной консистенции, гиперемию и увеличение миндалин, а также легкий систолический шум над верхушкой и основанием сердца. Анализ крови: НБ 95 г/л; эритроциты 3,210 /л, цв. пок. 0,9; лейкоциты 12,5-10 /л (базофилы 2 %, эозинофилы 6%, па- лочкоядерные 10 %, сегментоядерные 64 %; лимфоциты 8 %, моноциты 10 %); СОЭ 60 мм/ч. Предполагаемый диагноз: А. Инфекционный эндокардит. Б. Острый лейкоз. В. Лимфогранулематоз. Г. Инфекционное заболевание неясного происхождения. Д. Реактивный лимфаденит.
158. Для диагноза железодефицитной анемии важны следующие показатели: А Снижение гематокрита. Б. Снижение цветового показателя. В. Снижение гемо глобина. Г. Снижение количества лейкоцитов. Д. Гипербилирубинемия.
159. Среди клинических симптомов железодефицитной анемии реже всего наблюдаются: А. Глоссит. Б. Субфебрильная температура тела. В. Желтуха. Г. Анорек- сия. Д. Выпадение волос.
160. Наиболее частой причиной железодефицитной анемии являются: А. Кро- вопотери. Б. Глистная инвазия. В. Врожденный дефицит железа. Г. Авитаминоз. Д. Недостаточное поступление железа с пищей.
161. У больной 40 лет с язвенной болезнью двенадцатиперстной кишки появились резкая слабость, головокружение одышка, сердцебиения; снизилось АД. Анализ крови: НБ 70 г/л; лейкоциты 14-10 /л. Можно думать об осложнении: А. Инфекционное заболевание. Б. Острая кровопотеря. В. Гемолитический криз. Г. Перфорация язвы. Д. Реактивный панкреатит.
162. Наиболее частой причиной В л-дефицитных анемий являются: А. Крово- потери. Б. Глистная инвазия. В. Атрофия желез желудка. Г. Беременность. Д. Алиментарный фактор.
163. Диагноз В]2-дефицитной анемии становится несомненным при изменении следующего лабораторного показателя: А. Повышение цветового показателя. Б. Снижение количества эритроцитов. В. Макроцитоз эритроцитов. Г. Мегалобла-стоз костного мозга. Д. Снижение количества лейкоцитов.
164. У больной 62 лет, страдающей анемией Аддисона—Бирмера, резко ухудшилось состояние: субфебрильная температура тела, резкая слабость, головокружение, спутанное сознание, головная боль. Анализ крови: НБ 50 г/л; эритроциты 1,09 10 V';
- пок- 1,3. Можно предположить: А. Рецидив болезни. Б. Острую кро-вопотерю. В. Острую инфекцию. Г. Гемолитический криз. Д. Нарушение мозгового кровообращения.
165. Признаками внутриклеточного гемолиза являются все перечисленные, кроме: А. Увеличения содержания в крови непрямого билирубина. Б. Ретикулоцитоза.
В. Анемии. Г. Наличия в моче свободного гемоглобина. Д. Увеличения содержания в кале стеркобилина.
166. Диагноз гемолитической анемии становится несомненным при изменении следующего показателя: А. Снижение содержания гемоглобина. Б. Увеличение количества ретикулоцитов. В. Гипербилирубинемия. Г. Изменение осмотической резистентности эритроцитов. Д. Снижение продолжительности жизни эритроцитов.
167. Признаками р-талассемии являются все перечисленные показатели, кроме: А. Снижения количества эритроцитов и содержания гемоглобина. Б. Увеличения цветового показателя. В. «Мишеневидной» формы эритроцитов. Г. Увеличения содержания сывороточного железа. Д. Положительной десфераловой пробы.
168. Больная 28 лет в прошлом отмечала слабость, периодическое появление легкой желтушности кожи. После сильного переохлаждения появились озноб, боли в мышцах, а также в верхней половине живота. Через день — умеренная желтуха, темные кал и моча. При исследовании определяются умеренное увеличение печени и селезенки, желтушность кожи и слизистых оболочек. Анализ крови: НБ 80 г/л, эритроциты 2,810 /л; цв. пок. 0,8; тромбоциты 23-10 /л; лейкоциты 9,5лОул (формула не изменена); СОЭ 20 мм/ч, билирубин 77 мкмоль/л; прямой 8,о мкмоль/л. Наиболее вероятно: А. Обострение хронического холецистита. Б. Острое инфекционное заболевание. В. Железодефицитная анемия. Г. Хронический гепатит. Д. Гемолитическая анемия.
169. Больной 37 лет спустя 12 дней после перенесенного гриппа отметил по вторный подъем температуры тела, озноб, боли в пояснице, потемнение мочи, за тем появилась легкая желтушность склер. Врач определил умеренное увеличение печени. Анализ крови: НЬ 78 г/л, эритроциты 2,6 1012/л, тромбоциты 210109/л, лейкоциты 6,2 10 /л, в моче увеличено содержание уробилина. Общий билирубин 49,6 мкмоль/л, прямой 5,1 мкмоль/л. Заподозрена гемолитическая анемия. Наибо лее важным для установления диагноза из перечисленных исследований является: д. Пункция селезенки. Б. Определение продолжительности жизни эритроцитов. В. Определение осмотической стойкости эритроцитов. Г. Проба Кумбса. Д. Опре деление содержания железа в сыворотке крови.
170. Наиболее существенным исследованием для диагноза гипопластической анемии является: А. Исследование периферической крови. Б. Стернальная пунк ция. В. Пробы Кумбса. Г. Определение осмотической стойкости эритроцитов. Д. Десфераловая проба.
171. У больного 20 лет в течение последних 2 мес отмечаются нарастающие слабость, кровоточивость (кожные геморрагии, носовые кровотечения), субфеб рильная температура тела. Лимфатические узлы, печень, селезенка не увеличены. Анализ крови: НЬ 50 г/л; эритроциты 1,51012/л, цв. пок. 1,0; лейкоциты 1,8-109/л, палочкоядерные 1 %; сегментоядерные 38 %; эозинофилы 1 %, лимфоциты 55 %, моноциты 5 %; тромбоциты 30109/л; СОЭ 60 мм/ч. Предполагаемый диагноз: А. Острый лейкоз. Б. Апластическая анемия. В. Железодефицитная анемия. Г. Ге молитическая анемия. Д. Вл-дефицитная анемия.
172. Наиболее типичная особенность течения заболевания при гемофилии: А. Болезнь с детства. Б. Болезнь возникла после инфекции. В. Острое течение со спонтанной ремиссией. Г. Заболевание связано с лучевой терапией. Д. Болезнь проявилась после приема сульфаниламидных препаратов.
173. Больная 35 лет в течение последних 5 лет отмечает частые носовые кровотечения, периодические образования синяков на коже. Чувствовала себя удовлетворительно, к врачам не обращалась. 2 нед назад после обильного носового кровотечения усилились слабость, головокружение. Бледная, на коже груди, ног обильные петехиальные геморрагические высыпания и единичные экхимозы. Органы без особенностей. Анализ крови: НЬ 90 г/л; эритроциты 4,2 10'2/л, цв. пок. 0,64; лейкоциты 6,2109/л, палочкоядерные 3 %, сегментоядерные 67 %, эозинофилы 2 %, лимфоциты 23 %, моноциты 5 %; тромбоциты 10-109/л; СОЭ 15 мм/ч. Ваше мнение о диагнозе: А. Апластическая анемия. Б. Геморрагический васкулит. В. Гемофилия. Г. Железодефицитная анемия. Д. Тромбоцитопеническая пурпура.
174. Наиболее типичный характер кровоточивости при геморрагическом васкулите: А. Гематомы. Б. Петехиально-пятнистый. В. Васкулитно-пурпурный. Г. Смешанный микроциркуляторно-гематомный. Д. Ангиоматозный.
175. Достоверным критерием диагностики множественной миеломы является одно из перечисленных исследований: А. Исследование периферической крови. Б. Рентгенография костей. В. Исследование костного мозга. Г. Электрофорез белков крови. Д. Исследование мочи.
176. Больная 37 лет в течение многих лет отмечает петехиально-пятнистые высыпания на коже, слизистых оболочках. Лейкограмма без патологии. Тромбоциты 132109/л. Симптом щипка отрицательный. Протромбиновый индекс 95 %. АЧТВ 35 с. Время кровотечения 19 мин. Предварительный диагноз: А. Идиопатическая тромбоцитопеническая пурпура. Б. Гемофилия. В. Геморрагический васкулит. Г. Тромбоцитопатия. Д. Синдром Ослера—Рандю.
Глава VI Системные васкулиты
Содержание
Системные васкулиты.......................................................... 500
Узелковый полиартериит................................................. 501
Микроскопический полиартериит (полиангиит) . 509 Неспецифический аортоартериит (болезнь Такаясу) 511
Гранулематоз Вегенера........................................................ 516
Геморрагический васкулит (болезнь Шенлейна—
Геноха)............................................................................. 520
Контрольные вопросы и задачи.................................. 523
Системные васкулиты
СИСТЕМНЫЕ ВАСКУЛИТЫ (СВ) — гетерогенная группа заболеваний различной этиологии, в основе которых лежит генерализованное поражение сосудов с иммунным воспалением, некрозом сосудистой стенки и вторичным вовлечением в патологический процесс различных органов и систем. Клинические проявления зависят от типа, размера и локализации пораженных сосудов, а также активности системного воспаления. Воспалительное поражение сосудистой стенки (артерий или вен различного калибра) часто приводит к развитию окклюзии сосуда, нарушению микроциркуляции и последующей ишемии органов и тканей (вплоть до инфарктов и некрозов).
В соответствии с классификацией, предложенной отечественными авторами в 1997 г., различают первичные и вторичные СВ.
Первичные СВ — генерализованные поражения сосудов, являющиеся самостоятельными нозологическими формами.
Вторичные СВ — поражения сосудов (чаще всего локального характера), развивающиеся при других заболеваниях (например, при инфекционном эндокардите, группе диффузных заболеваний соединительной ткани, ревматоидном артрите и пр.), а также при опухолях, инфекциях, лекарственной болезни.
Этиология. Причина возникновения большинства первичных СВ неизвестна. Лишь некоторые формы СВ удается четко связать с определенными пусковыми факторами: лекарственная гиперчувствительность, вирус гепатита В или С, цитомегаловирус, парвовирус В19, ВИЧ-инфекция. Обостре- 500
ния некоторых СВ ассоциируются с бактериальной инфекцией верхних дыхательных путей, особенно с носительством золотистого стафилококка. Большое значение имеют генетически обусловленные нарушения иммунной системы.
Патогенез. Механизм поражения сосудистой стенки расшифрован далеко не полностью. Выделяют несколько основных патогенетических механизмов, которые определяют клинические особенности той или иной формы СВ:
• поражение сосудов, связанное с иммунными комплексами;
• поражение сосудов, обусловленное антинейтрофильными цитоплаз- матическими антителами (АНЦА);
• поражение сосудов, связанное с органоспецифическими антителами;
• поражение сосудов, развившееся вследствие нарушения клеточного иммунного ответа и образования гранулем.
Все перечисленные механизмы встречаются как в отдельности, так и в сочетании.
В зависимости от клинической активности васкулита выделяют следующие фазы заболевания:
• полная ремиссия — отсутствие признаков активности патологического процесса и необходимости в терапии при нормальном уровне С-ре-активного белка;
• частичная ремиссия — существенное уменьшение активности процесса;
• неактивная фаза — пациенты считаются «неактивными», если у них наблюдается полная ремиссия, не требующая поддерживающей терапии;
• «большое» обострение — вовлечение в патологический процесс жизненно важных органов и систем (легкие, почки, ЦНС, сердечно-сосудистая система), когда требуется адекватная терапия (кортикостероиды, цито- статики, плазмаферез);
• «малое» обострение — возврат нерезко выраженных симптомов.
СВ характеризуются хроническим течением с периодами обострения и
ремиссий; обострения возникают под влиянием неспецифических факторов (инсоляция, переохлаждение, неспецифическая инфекция, вакцинация).
В данной главе будут рассмотрены клиническая картина и диагностический поиск при узелковом полиартериите, микроскопическом полиартериите (полиангиите), неспецифическом аортоартериите (артериит Такаясу), гранулематозе Вегенера, геморрагическом васкулите.
Узелковый полиартериит
Узелковый полиартериит (УП) — системный васкулит с преимущественным вовлечением в процесс артерий среднего и мелкого калибра. Сущность заболевания состоит в развитии деструктивно-пролиферативного панартериита, обусловленного снижением иммунной реактивности. Как исход и осложнения васкулита развиваются облитерации и тромбоз сосудов, аневризмы, разрывы сосудов. Это приводит к поражению внутренних органов, кровоснабжение которых осуществляется патологически измененными сосудами. В органах развиваются инфаркты, очаги некроза, атрофии и склероза с последующей функциональной недостаточностью.
УП относится к редким заболеваниям, частота его колеблется от 0,7 до 6,3 на 100 ООО населения. Мужчины болеют в 2,5—3 раза чаще, средний возраст заболевших составляет 35—45 лет.
Этиология. Точные причины развития УП неизвестны, однако имеющиеся наблюдения позволяют считать, что УП может развиться после приема некоторых лекарственных веществ (сульфаниламиды, антибиотики, препараты висмута, йода, в том числе рентгеноконтрастные фурагиновые производные, анальгетики, туберкулостатики), введения сывороток. Большое значение придают перенесенной вирусной инфекции: в крови больных УП достаточно часто (от 30 до 80 %) обнаруживаются в большом количестве поверхностный антиген гепатита В (HBsAg), а также циркулирующие иммунные комплексы, имеющие в своем составе этот антиген. Известна роль и других вирусов в этиологии УП: цитомегаловирус, herpes simplex. Генетическая предрасположенность также играет определенную роль в развитии У П.
Патогенез. Под воздействием различных внешних факторов на фоне генетически детерминированной измененной иммунной реактивности развивается нарушение иммунного ответа, что проявляется в образовании большого количества мелких растворимых иммунных комплексов, циркулирующих в сосудистом русле. В состав иммунного комплекса входят антиген (в частности, HBs-антиген), антитело к нему и комплемент. Иммунные комплексы активно откладываются под эндотелием сосудов, что сопровождается повышением сосудистой проницаемости, развивающейся под влиянием ва- зоактивных аминов, которые высвобождаются из базофилов и тучных клеток или тромбоцитов при их дегрануляции в результате активации комплемента. Отложение иммунных комплексов в стенке сосуда приводит к воспалительному процессу и развитию выраженных морфологических изменений стенки. Важная роль отводится реологическим и микроциркуляторным нарушениям, а также нарушениям процесса гемостаза (с появлением тенденции к гиперкоагуляции). Воспалительный процесс стенки сосуда в сочетании с нарушением микроциркуляции и микротромбозами обусловливает широкий спектр патологических изменений сосудов. В дальнейшем в патологический процесс вовлекаются внутренние органы (особенно часто почки), что делает весьма разнообразной клиническую картину.
Клиническая картина. В связи со множественностью поражения различных сосудистых областей клиническая картина УП отличается выраженной полиморфностью (поражаются самые разные органы). Особенностью заболевания является несоответствие морфологических изменений органов их клиническим проявлениям: при значительных морфологических изменениях симптоматика со стороны пораженного органа или системы может полностью отсутствовать. Схематически клинические проявления УП можно представить в виде следующих синдромов.
• Почечный (встречается у 60—80 % больных) — может быть следствием поражения почечных артерий и/или клубочков. По современным представлениям при классическом УП преобладает сосудистый тип почечной патологии (субклинические и латентные формы гломерулонефрита встречаются значительно реже). Быстрое нарастание почечной недостаточности, как правило, связано с множественными (обычно безболевыми) инфарктами почек. У Уз больных наблюдается АГ, которая на ранних стадиях болезни связана с почечным васкулитом или инфарктом почки, на поздних стадиях — с вторичным поражением клубочков. Наличие почечной патологии является прогностически неблагоприятным признаком.
• Нейропатический (встречается у 50—60 % больных); характерны несимметричные множественные мононевриты, реже менингоэнцефа-литы, мозговые инсульты (возможно появление эпилептических припадков, психических нарушений), полиневриты.
• Абдоминальный (6—44 %) проявляется болями в животе в сочетании с диспепсическими расстройствами, желудочно-кишечными кровотечениями (6—7 %), симптомами перитонита, что обусловлено появлением некрозов и язв тонкой, а иногда и толстой кишки; возможно увеличение печени, иногда селезенки, наблюдается поражение поджелудочной железы, имитирующее хронический панкреатит и реже — опухоль.
• Сердечно-сосудистый (36—58 %) в виде АГ, кардиомегалии, коронарита, нарушений ритма сердца, стенокардии (с нетипичными болями), инфарктов миокарда (чаще без зубца Q), протекающих без выраженного болевого приступа.
Выделявшийся ранее «астматический» (легочный) вариант в настоящее время рассматривается как самостоятельная нозологическая форма— синдром Черджа —Строе.
На I этапе диагностического поиска можно получить сведения, указывающие на особенности начала болезни, остроту процесса, преимущественное поражение тех или иных органов.
В анамнезе больных УП можно отметить острый гепатит с желтухой, контакт с больным вирусным гепатитом, переливание крови, а также появление первых симптомов болезни после приема лекарственных средств. Болезни предшествуют также острые респираторные заболевания, охлаждение, инсоляция, вакцинация, психоэмоциональный стресс.
Болезнь обычно развивается постепенно, реже отмечается острое начало (чаще у больных лекарственным УП). Первыми симптомами классического УП являются лихорадка, боли в мышцах, кожные высыпания, похудение. Выраженность всех этих признаков может быть различной. Лихорадка среди этих симптомов стоит на первом месте; она отличается неправильным типом, не поддается лечению антибиотиками, но быстро снижается при назначении глюкокортикоидов. В дальнейшем при развитии органной симптоматики температура тела нормализуется, так что значительным «упорством» лихорадка отличается лишь в самом начале болезни. Похудение при УП достигает достаточно выраженной степени, что создает предпосылки для диагностических ошибок (у таких больных прежде всего предполагают онкологическое заболевание).
Миалгии, а также артралгии доминируют в начале заболевания. Обычно отмечают боли в икроножных мышцах и коленных суставах.
В ряде случаев в самом начале болезни (и позднее) могут наблюдаться абдоминальные кризы — приступы сильных болей в животе без четкой локализации, иногда сопровождающиеся расстройством стула. При дальнейшей эволюции болезни появляются симптомы поражения других органов.
Для поражения почек с гипертоническим синдромом характерны «церебральные жалобы», связанные с повышением АД. При поражении сердца, хотя морфологической его основой и является коронарит, болевой синдром наблюдается нечасто. Более типично развитие сердечной недостаточности и нарушений ритма с соответствующими жалобами. Поражение периферических сосудов проявляется болями в конечностях, парестезиями, нарушением чувствительности.
В целом на I этапе выявляются различные симптомы, напоминающие субъективную симптоматику самых разных заболеваний, что значительно затрудняет диагностику.
На II этапе диагностического поиска в начале развития болезни не удается выявить каких-либо существенных изменений со стороны внутренних органов. В развитой стадии болезни может определяться высокая устойчивая АГ. Для УП характерно поражение сердца по типу кардиосклероза с нарушением ритма сердца и сердечной недостаточностью. Абдоминальный синдром в ряде случаев проявляется тромбозами сосудов брыжейки с развитием инфарктов органов брюшной полости (поджелудочная железа, селезенка), что сопровождается симптомами раздражения брюшины и резкой болезненностью при пальпации живота. Другое проявление абдоминального синдрома — развитие перитонита в результате перфорации язв или гангрены кишечника; на абдоминальный синдром могут указывать желудочно- кишечные кровотечения.
Для нейропатического синдрома характерны моно- и полиневриты (обязательно асимметричные). Чаще поражаются нижние конечности с развитием пареза стопы.
У 15—30 % больных наблюдают изменения кожи в виде узелков по ходу сосудистых стволов; иногда — гангрена кончиков пальцев.
На III этапе диагностического поиска можно получить информацию, свидетельствующую об активности процесса и поражении внутренних органов. На активность процесса указывают острофазовые показатели (ней- трофильный лейкоцитоз, увеличение СОЭ, диспротеинемия в сочетании с гипер-а2-глобулинемией, появление СРБ). Нередко развивается гипохром-ная анемия. Специфических иммунологических тестов для распознавания УП не существует. Важное значение имеют обнаружение маркеров вируса гепатита В или С (HBV ДНК или HCV РНК) с активной репликацией в сыворотке крови, повышение уровня ACT и АЛТ, у-ГТ, ЩФ.
При поражении почек закономерно выявляются протеинурия, микрогематурия. В случае прогрессирования поражения почек отмечают увеличение содержания мочевины и креатинина, почечная фильтрация снижается.
При поражении сердца на ЭКГ могут выявляться инфарктоподобные изменения, при рентгенологическом исследовании — увеличение размеров сердца (преимущественно за счет левого желудочка).
Биопсию скелетной мышцы и кожи целесообразно проводить только в случаях выраженных миалгий (обычно в острой фазе болезни) или при изменениях кожи. Кожная биопсия позволяет выявить поражение мелких сосудов, но этот признак недостаточно специфичен и не всегда коррелирует с системным поражением сосудов. Мышечная биопсия дает положительные результаты у 30—50 % больных.
Биопсия почки имеет значение для дифференциации классического УП и микроскопического полиартериита.
Ангиография показана в случае невозможности провести биопсию или при получении неспецифических результатов, а также перед биопсией почки для выявления микроаневризм, которые при биопсии могут привести к кровотечению.
Течение. УП представляет собой прогрессирующее заболевание с различными вариантами течения — от медленно развивающегося до острых форм. В настоящее время выделяют следующие варианты течения УП:
1) благоприятное (доброкачественное) течение отмечается у больных с кожными поражениями без поражения внутренних органов. У таких больных могут быть рецидивы кожного васкулита с длительными ремиссиями до 3—5 лет;
2) медленно прогрессирующее течение без АГ наблюдается у половины больных. В клинической картине доминируют остаточные признаки периферических невритов и нарушения кровообращения в конечностях. Правильная лекарственная терапия позволяет поддерживать удовлетворительное состояние больных до 10 лет и более, некоторые больные сохраняют трудоспособность;
ЪПА
3) рецидивирующее течение возможно при различных вариантах болезни, обострения возникают при отмене терапии (кортикостероиды, цитоста- хические препараты) или снижении дозы, а также после интеркуррентной инфекции, лекарственной аллергии, охлаждения. Появление новых органных поражений существенно ухудшает прогноз;
4) быстро прогрессирующее течение отмечается при тяжелом поражении почек со злокачественной АГ. Прогноз определяется быстротой развития почечной недостаточности, сердечной недостаточностью. Длительность болезни при злокачественной артериальной гипертонии обычно не превышает 2—5 лет;
5) острое течение (с продолжительностью жизни 6 мес — 1 год) в на стоящее время наблюдается редко, что связано со своевременной диагно стикой и ранним началом лечения. При остром течении выявляют множе ственное поражение внутренних органов с тяжелой нефропатией, корона- ритом, быстро прогрессирующей сердечной и почечной недостаточностью, тяжелым абдоминальным синдромом, кахексией.
Причиной смерти более чем у половины больных УП является поражение почек с развитием ХПН или АГ. В 10—12 % случаев причиной смерти могут быть церебральные нарушения вследствие васкулита головного мозга. Сердечная недостаточность, обусловленная поражением коронарных сосудов или артериальной гипертонии, является причиной смерти у 15 % больных. Поражение пищеварительного тракта (перфорация язв кишечника с перитонитом и кровотечением) бывает причиной смерти 12—14 % больных. В ряде случаев смерть наступает от осложнений лекарственной терапии, инфекции (в том числе туберкулеза, сепсиса).
Диагностика. Так как при УП нет каких-либо патогномоничных симптомов, диагностика может представлять существенные трудности. Основным опорным пунктом для постановки диагноза является клиническая картина заболевания.
Ниже представлены критерии УП (разработанные Американской коллегией ревматологов).
1. Похудение более чем на 4 кг.
2. Сетчатое ливедо (расширение мелких кожных сосудов в виде сетки).
3. Болезненность в области яичек (по данным отечественных клиницистов, этот признак встречается редко).
4. Миалгий.
5. Мононеврит или полинейропатия.
6. АД диастолическое более 90 мм рт. ст.
7. Повышение уровня креатинина в сыворотке крови.
8. Наличие маркеров HBV в сыворотке крови.
9. Патологические изменения при артериографии.
10. Данные биопсии (некротизирующий васкулит, фибриноидный нек роз, нейтрофильный инфильтрат).
Три критерия и более обладают чувствительностью 82 % и специфичностью 87 %.
Для клинической диагностики наиболее характерны следующие признаки [Семенкова Е.Н., 2001]:
• мужской пол (соотношение среди больных мужчин и женщин 6:1);
• поражение почек (80 %);
• злокачественная АГ (30 %);
• выявление маркеров HBV в сыворотке крови (частота признака — до
Клинические синдромы:
• на ранней стадии (1—3 мес) — лихорадка, истощение, миалгии;
• в развернутой стадии — поражение почек (злокачественная АГ); множественный неврит; абдоминальный синдром; коронарит; лейкоцитоз, увеличение СОЭ.
Дифференциальная диагностика. Чаще всего в дебюте УП следует дифференцировать от инфекционного эндокардита, острых инфекционных заболеваний, лимфогранулематоза, первичного туберкулеза, рака поджелудочной железы, острого гломерулонефрита. Дифференциальная диагностика основывается на следующих положениях.
• Острые инфекционные заболевания имеют специфиче ские клинические и лабораторные (в том числе серологические) особенно сти, заканчиваются выздоровлением, тогда как УП — заболевание хрониче ское, и уже через 3 мес (максимальный срок) выявляются органные пора жения. К этому же времени (или намного раньше) острые инфекционные заболевания заканчиваются.
Инфекционный эндокардит (первичный) характеризуется ознобами с проливным потом, что менее характерно для УП, однако самое существенное отличие — появление диастолического шума в точке Боткина. Не менее существенным считается положительный эффект от лечения антибиотиками при инфекционном эндокардите, чего не наблюдается при УП.
• При лимфогранулематозе отмечается лихорадочная реакция с потом и кожным зудом; кроме того, почти во всех случаях выявляется увеличение регионарных лимфатических узлов (шейных, подмышечных, средостения). Диагноз ставят после морфологического исследования увеличенных лимфатических узлов (цитологическое исследование пунктата, гистологическое исследование биопсированного узла), в котором обнаруживаются клетки Березовского—Штернберга.
• При первичном туберкулезе могут быть параспецифические реакции в виде лихорадки и острофазовых показателей, что при отсутствии четких изменений в легких существенно затрудняет диагностику. Проведение туберкулиновых проб, динамическое исследование легких, а также проведение антибактериальной терапии ex juvantibus позволяет поставить правильный диагноз. Кроме того, при туберкулезе не наблюдается резкого похудения больного, миалгии и артралгии, а в дальнейшем — патологических изменений внутренних органов.
• Существенные трудности возникают, если УП дебютирует изоли рованным почечным синдромом в виде развития диффузно го гломерулонефрита (с измененным мочевым осадком, протеин- урией и высокой АГ). «Общие» симптомы могут быть незначительными и расцениваются как закономерный спутник острого гломерулонефрита. Точная дифференциальная диагностика возможна лишь по мере течения заболевания, когда выявляется упорство гипертонического синдрома, а главное — присоединение других органных поражений (в частности, поли- нейропатии). Развивающееся похудение больного, значительное увеличе ние СОЭ с появлением анемизации несвойственны течению острого гло мерулонефрита (даже если намечается тенденция к его хронизации). Слож ности могут возникнуть при подостром (экстракапиллярном) злокачествен ном гломерулонефрите с быстрым развитием почечной недостаточности. Однако и в этой ситуации общетоксическая симптоматика, а также пора жение ЦНС (и внутренних органов) будут свидетельствовать о наличии УП. Известную помощь в дифференциальной диагностике могла бы ока-
Зать пункционная биопсия почки, однако при УП эта процедура является опасной (возможно кровотечение из аневризматически расширенных сосудов почки). Окончательное суждение о диагнозе возможно при динамическом наблюдении за больным.
• Рак поджелудочной железы в ряде случаев протекает с выраженными паранеопластическими реакциями в виде высокой лихорадки, миалгии, похудения и тромбангиита. Подобная клиническая картина сходна с дебютом УП. Необходимо выявить симптомы, характерные для поражения поджелудочной железы. Это прежде всего болевой синдром в области проекции поджелудочной железы с иррадиацией болей в левое подреберье (часто опоясывающих). Гиперферментемия (повышение уровня амилазы крови, ингибитора трипсина, липазы), стеаторея в подобных случаях указывают на заболевание поджелудочной железы. Однако для доказательства опухолевого поражения нужны дополнительные данные, которые могут быть получены при ультразвуковом исследовании поджелудочной железы, а также ангиографии.
Формулировка развернутого клинического диагноза УП учитывает: 1) форму течения болезни; 2) главные клинические синдромы; 3) наличие и выраженность функциональной недостаточности органов и систем (при поражении почек — почечной недостаточности, при поражении сердца — сердечной и др.).
Лечение. Комплекс лечебных мероприятий предусматривает следующее:
1) подавление воспаления, развившегося в результате отложения иммунных комплексов, и регулирование (модулирование) иммунного ответа;
2) нормализацию процесса гемостаза в связи с развитием гиперкоагуляции;
3) попытку удаления из организма иммунных комплексов с целью предупреждения отложения их в сосудистую стенку;
4) воздействие на отдельные резко выраженные синдромы.
При лечении УП следует учитывать форму и степень активности патологического процесса, а также преимущественное поражение тех или иных органов или систем.
Подавление иммунного воспаления и модулирование иммунного ответа при остром течении болезни осуществляются с помощью комбинированной терапии: кортикостероиды в сочетании с цитостатиками. При этом следует помнить, что наличие маркеров вирусной инфекции (гепатит В) накладывает отпечаток на характер проводимого лечения.
При активном УП, не связанном с HBV-инфекцией, первоначально назначают преднизолон в дозе 1 мг/(кг-сут) в несколько приемов (если не развивается злокачественная АГ), после наступления клинического улучшения (обычно после 1—2 мес лечения) дозу препарата постепенно снижают до 5 мг/сут, постепенно замедляя скорость снижения дозы (чем меньше начальная доза, тем медленнее снижение). Средняя продолжительность лечения составляет 18—24 мес. Для поддерживающей терапии препарат можно назначать однократно (утром) через день в дозе 10 мг.
При недостаточной эффективности такой терапии, а также при имеющемся поражении почек преднизолон сочетают с цитостатиком циклофос- фамидом — по 2 мг/(кгсут) внутрь (1—2 мес), циклофосфамид дают в течение 12 мес, постепенно снижая его дозу до 0,5 мг/кг.
При генерализованном УП с быстропрогрессирующим поражением почек назначают пульс-терапию преднизолоном в дозе 15 мг/кг (три сеанса) в сочетании с циклофосфамид ом, который также можно назначать в виде пульс-терапии (0,5—2,5 мг/кг) 1 раз в 2—4 нед (в течение 3 мес). Во время пульсгтерапии рекомендуется интенсивная гидратация (до 2—3 л жидкости в сутки).
Необходимо следить за показателями крови: при тенденции к лейкопении дозу цитостатика уменьшают, а при снижении числа лейкоцитов до 3 10 /л, а тромбоцитов до 100 • 109/л — временно прекращают прием цитостатика. Рецидивы УП без HBV-инфекции развиваются редко (до 10 % случаев). Причиной 42 % летальных исходов является активность васкули-та (Е.Н. Семенкова).
При генерализованном УП, ассоциированным с HBV-инфекцией, методом выбора является комбинация противовирусной терапии с плазмафере-зом. Вначале назначают преднизолон по 1 мг/(кгсут) в течение 1 мес для быстрого устранения наиболее опасных для жизни проявлений УП, переводя затем на поддерживающие дозы. Далее проводят плазмаферез (5—7 процедур) для удаления иммунных комплексов и назначают противовирусные препараты видабрадин (внутривенно) или а-интерферон в дозе 3 млн ЕД 3 раза в неделю. Монотерапия противовирусными препаратами неэффективна.
При поражении сердца показано сочетанное лечение преднизолоном и цитостатиками (предпочтительна гидроксимочевина по 500 мг/сут).
Следует строго следить за показателями крови: при тенденции к лейкопении дозу цитостатика уменьшают, а при снижении числа лейкоцитов до 3 109/л, а тромбоцитов до 100 109/л временно отменяют.
Симптоматическое лечение УП очень важно для предотвращения сосудистых катастроф, тромбозов. Нормализация нарушений гемостаза осуществляется также с помощью гепарина, а в последующем — антиагрегантами (дипиридамол или клопидогрель).
С целью улучшения процессов микроциркуляции периодически назначают сосудорасширяющие средства: внутрь препараты никотиновой кислоты и парентерально — ксантинола никотинат (компламин, теоникол) в обычных дозах.
При полиневритическом синдроме используют физиотерапевтические методы лечения (продольный электрофорез новокаина на нижние конечности), витамины группы В в обычных дозах. Следует применять массаж и гидротерапию.
Коррекция АГ — первоначальная задача врача, так как она чаще всего определяет прогноз болезни и затрудняет проведение иммуносупрессивной терапии. Показана комбинация гипотензивных препаратов в достаточно высоких дозах и салуретиков. Дозы салуретиков должны быть высокими (фуросемид по 200 мг/сут). Спиронолактон (верошпирон) назначают при развитии вторичного гиперальдостеронизма, осложняющего иногда АГ у больных (доза верошпирона 300—400 мг/сут), в качестве гипотензивных препаратов используют прежде всего ингибиторы АПФ, а также (3-адрено- блокаторы или блокаторы «медленных» кальциевых каналов.
Прогноз. Для жизни прогноз при развитии органных изменений неблагоприятен: наибольшую опасность представляют перфорация кишечника и развитие злокачественной АГ. При хронических формах УП с невысокой активностью патологического процесса возможно длительное сохранение удовлетворительного самочувствия и ограничения трудоспособности. При отсутствии лечения пятилетняя выживаемость составляет только 5 %, при проведении иммуносупрессивной терапии — до 40 %.
Профилактика. Основное значение имеет предупреждение лекарственной непереносимости у лиц с повышенной чувствительностью к лекарствам. Необходимо также учитывать противопоказания к введению чужеродных сывороток и вакцин.
Микроскопический полиартериит (полиангиит)
Микроскопический полиартериит (микроскопический полиангиит) —
некротизирующий васкулит с небольшим количеством иммунных депозитов или без них, поражающий преимущественно мелкие сосуды (в клинической картине доминируют некротизирующий нефрит и легочные капил- ляриты).
Микроскопическим полиартериитом (МПА) чаще болеют мужчины (1,3:1), средний возраст заболевших около 40 лет.
Этиология и патогенез. Причины возникновения заболевания не изучены, предполагается роль некоторых вирусов и иммуногенетических факторов.
Основным патогенетическим механизмом развития поражения почек и легких при МПА считают образование аутоантител к различным цитоплаз- матическим компонентам нейтрофилов — антинейтрофильных цитоплаз- матических антител (АНЦА). Эти аутоантитела специфичны в отношении ферментов нейтрофилов: сериновой протеиназы 3 (цАНЦА имеют цито- плазматическое свечение) и в отношении миелопероксидазы (пАНЦА имеют перинуклеарное свечение). В активную фазу болезни АНЦА обнаруживаются в 100 % случаев. Выявлено также повышение продукции неоптери-на (показатель у-интерферонзависимой активации моноцитарных фагоцитов) у больных тяжелым васкулитом, что указывает на участие клеточного иммунитета в патогенезе МПА.
Некротизирующий васкулит при МПА носит распространенный характер, поражая многие органы и системы, но наиболее выраженные изменения отмечаются в почках, легких, коже. В почках выявляется фокальное сегментарное воспаление с некрозом, экстракапиллярной пролиферацией (образованием полулуний в гломерулах) и отложением иммунных комплексов и комплемента в клубочках. В легких поражаются капилляры; фибри- ноидные тромбы обнаруживаются в капиллярах межальвеолярных перегородках. В воспалительном клеточном инфильтрате преобладают полиморфно- ядерные лейкоциты; гранулемы отсутствуют.
Клиническая картина. Начало заболевания обычно острое или подо- строе, однако у части больных в течение нескольких месяцев имеется продромальная фаза.
На I этапе диагностического поиска в начале болезни можно отметить миалгии (преимущественно нижних конечностей), артралгии, повышение температуры тела до субфебрильных цифр. В дальнейшем лихорадка становится фебрильной, носит постоянный характер и не проходит при приеме антибиотиков и НПВП. Боли в крупных суставах отмечаются у половины больных, несколько реже развиваются стойкие артриты (с поражением крупных и мелких суставов), так что у больных ошибочно диагностируется ревматоидный артрит (и проводится соответствующее лечение, однако без успеха). Масса тела прогрессивно снижается. Больные предъявляют жалобы на кашель, часто с кровохарканьем (вплоть до легочных кровотечений), нарастающую одышку, боли в грудной клетке. Отмечаются также кровянистые выделения из полости носа. В анамнезе могут быть сведения о развитии АГ. Кроме того, больные сообщают, что в прошлом при исследовании мочи выявляли какие-то изменения.
На II этапе диагностического поиска у 50 % больных выявляется типичный признак — изменения кожи в виде сосудистой пурпуры. Значительно реже развиваются эритема, узелковые или буллезные высыпания, ливедо, в отдельных случаях — обширные некрозы кожи и подлежащих тканей. При длительности заболевания более 6—8 мес выявляется умеренная АГ (в пределах 150—160/90—95 мм рт. ст.). В легких выслушиваются влажные звонкие мелкопузырчатые хрипы (свидетельство фиброзирующего альвеолита), учащается дыхание (особенно при развитии легочной недостаточности по рестриктивному типу).
У 25 % больных обнаруживаются поражения глаз в виде кератоконъ- юнктивита и эписклерита, обычно обратимые.
Стойкие артриты крупных и мелких суставов с ограничением подвижности выявляются у 12—20 %.больных.
Данные, получаемые на II этапе диагностического поиска, позволяют заподозрить системное поражение.
Для окончательной постановки диагноза необходимы данные III этапа диагностического поиска.
Лабораторные исследования: отмечаются острофазовые показатели (умеренный нейтрофильный лейкоцитоз, увеличение СОЭ, появление СРВ, диспротеинемия) и гипохромная анемия.
Наиболее надежным иммунологическим тестом в активную фазу болезни является наличие в сыворотке крови АНЦА (цАНЦА и пАНЦА). В отличие от УП при МПА не находят маркеров вируса гепатита В. В ряде случаев обнаруживают в низком титре ревматоидный фактор (РФ), антинукле-арные антитела.
При исследовании мочи в 80 % случаев выявляют умеренную протеи- нурию и микрогематурию (65—70 %).
При нефротическом синдроме (15—20 %) выявляется гипоальбумине-мия. Однако в отличие от классических проявлений нефротического синдрома гиперлипидемия отсутствует. При быстропрогрессирующем гломеру- лонефрите развивается почечная недостаточность (снижение СКФ, увеличение содержания креатинина в сыворотке крови).
При поражении легких рентгенологически обнаруживаются двусторонние (реже — односторонние) инфильтраты. Спустя 1 —3 года после начала болезни развивается легочный фиброз с соответствующей картиной. Если в клинической картине доминирует кровохарканье, то исходом такого геморрагического альвеолита является легочный гемосидероз с развитием рестриктивной дыхательной недостаточности и легочной гипертензией.
При биопсии кожи, слизистой оболочки верхних дыхательных путей выявляется некротизиующий васкулит, в почках — фокально-сегментарный гломерулонефрит.
Диагностика. Распознавание МПА основывается на следующих клинических, иммунологических и морфологических признаках (Е.Н. Семенкова). Клинические признаки:
• геморрагический альвеолит с кровохарканьем и вторичной гипо- хромной анемией; рентгенологически выявляются альвеолярно-интерсти- циальные инфильтраты (двусторонние, возможно, асимметричные);
• гломерулонефрит (часто быстропрогрессирующее течение) с возможным развитием олигурической острой почечной недостаточности, нефротического синдрома и поздней умеренной АГ:
путей' °®Ратимо® поражение слизистых оболочек верхних дыхательных
• системность поражения (кожа, суставы, орган зрения, периферическая нервная система.
Иммунологические признаки:
• в активную стадию болезни наличие в сыворотке крови гиперпро дукции антител к цитоплазме нейтрофилов (цАНЦА и пАНЦА).
Морфологические признаки:
• распространенный некротизирующий васкулит мелких сосудов, диагностируемый при биопсии слизистых оболочек верхних дыхательных путей, кожи, ткани легкого, почки;
• фокально-сегментарный некротизирующий гломерулонефрит, часто — с полулуниями.
Дифференциальная диагностика. МПА по своим проявлениям напоминает множество заболеваний, однако на практике его следует дифференцировать с УП, синдромом Черджа—Строе, гранулематозом Вегенера.
В отличие от УП при МПА поражаются мелкие сосуды, АГ развивается редко, отсутствует инфицирование вирусом гепатита В, значительно чаще обнаруживаются АНЦА (при обострении болезни в 100 % случаев).
В отличие от гранулематоза Вегенера (см. далее) при МПА отсутствуют гранулемы с распадом в верхних дыхательных путях.
При синдроме Черджа—Строе характерны приступы бронхиальной астмы, эозинофильные инфильтраты в органах и тканях, высокий процент эозинофилии крови, нечастое выявление АНЦА (10—15 %).
Течение. Молниеносное, заканчивающееся в течение нескольких недель смертельным исходом (вследствие легочного кровотечения или острой почечной недостаточности).
• Подострое — характерно для больных с тяжелыми вариантами гломерулонефрита (с нефротическим синдромом или быстропрогрессирую- щий).
• Непрерывнорецидивирующий — рецидивы в сроки от 6 мес до 1 года (доминируют признаки неспецифического воспаления — лихорадка, миалгии, артралгии, сосудистая пурпура, нейропатия, а также обострение гломерулонефрита или альвеолярные кровотечения).
• Латентное течение — легкий альвеолит с эпизодами кровохарканья, суставной синдром, гематурический вариант гломерулонефрита с сохранной функцией почек.
Лечение. Используют высокие дозы преднизолона — 1 мг/(кгсут) и пульс- терапию циклофосфамидом (1000 мг внутривенно) каждые 10—12 дней, обычно в сочетании с приемом цитостатиков внутрь. По мере стихания симптоматики переходят на прием внутрь преднизолона и циклофосфамида. Плазмаферез проводят у больных с почечной недостаточностью при подготовке к гемодиализу или же при легочном кровотечении. В период ремиссии назначают азатиоприн.
Прогноз. Возраст старше 50 лет, повышение уровня креатинина в сыворотке крови (более 500 мкмоль/л), высокая протеинурия и отсутствие адекватной терапии являются крайне неблагоприятными признаками.
Неспецифический аортоартериит (болезнь Такаясу)
Неспецифический аортоартериит (НАЛ) — хроническое воспалительное поражение крупных артерий, преимущественно аорты и ее ветвей (значительно реже — ветвей легочной артерии).
НАА — редкое заболевание (2,6 случая на 1 млн населения в год), как и узелковый полиартериит. Болеют НАА преимущественно молодые женщины и девушки (соотношение заболевших женщин и мужчин составляет 8:1), хотя болезнь может возникнуть и в более позднем возрасте. Заболевание чаще встречается в Азии, Южной Америке, реже — в Европе.
Этиология и патогенез. Причины развития НАА в настоящее время неясны. Поражение сосудов имеет иммунокомплексный характер, что подтверждается обнаружением в период обострения циркулирующих иммунных комплексов и антиаортальных антител в сыворотке крови и в стенке аорты. Отмечено, что у заболевших лиц чаще, нежели в популяции, встречаются антигены гистосовместимости HLA-B5, HLA-A10, что указывает на генетическую предрасположенность.
Морфологически существует два типа поражения — гранулематозный (характерен для активной фазы болезни) и склеротический.
В активной фазе болезни НАА представляет собой панартериит с воспалительной инфильтрацией одноядерными и иногда гигантскими клетками. Выражена пролиферация клеток интимы. По мере стихания воспаления преобладают склеротические изменения (фиброзирование, рубцевание медии, дегенерация и разрывы эластической мембраны).
Нередко находят на фоне воспаления атеросклеротические изменения на различных стадиях.
Поражение сосудов носит сегментарный характер, при этом внутриор- ганные артерии обычно не поражаются.
Клиническая картина. В связи с множественностью поражения различных сосудистых областей клиническая картина НАА отличается выраженной полиморфностью. На основании преимущественного вовлечения сосудов в патологический процесс принято выделять четыре типа поражения: I тип — поражение ограничивается дугой аорты и ее ветвями; II тип — поражается грудная и брюшная части аорты;
Ш тип — поражение дуги аорты и ее нисходящей части (так называемый смешанный тип, наиболее часто встречающийся — в 65 % случаев);
IV тип — указанные выше поражения сочетаются с поражением ветвей легочной артерии.
Естественно, что в зависимости от типа поражения клиническая картина болезни будет существенно различаться. Схематически клинические проявления НАА можно представить в виде так называемых ишемических синдромов.
• Церебральные расстройства в сочетании с асимметрией пульса и АД на верхних конечностях (поражение брахиоцефальных сосудов).
• Артериальная гипертония (вследствие поражения брюшной части аорты и почечных сосудов).
• Коронарит (поражение аорты и ее ветвей, в частности коронарных).
• Недостаточность клапана аорты (в сочетании с поражением восходящей части дуги аорты).
• Поражение сосудов брюшной полости (иногда в сочетании с рено- васкулярной гипертонией).
• Артериит легочных сосудов (развитие легочной гипертонии).
Все сказанное указывает на чрезвычайную полиморфность клинической картины НАА, различающуюся у больных весьма существенно.
На I этапе диагностического поиска можно получить сведения, указывающие на поражение того или иного сосудистого бассейна, а также на остроту течения болезни.
У лиц молодого возраста (до 20 лет) болезнь обычно начинается остро и характеризуется лихорадкой, астенией, артралгиями, миалгиями. В более старшем возрасте в жалобах доминируют симптомы, обусловленные ишемией различных органов и систем. Так, больные могут жаловаться на головные боли, головокружения, обмороки, что обусловлено поражением сосудов головного мозга. При поражении сосудов брюшной полости могут
быть жалобы на боли в животе, нарушение стула, вздутие живота. При поражении церебральных сосудов появляются симптомы, связанные с нарушением зрения (преходящая слепота, снижение остроты зрения). Поражение легочной артерии может вызвать боли в грудной клетке, одышку, иногда кровохарканье. При поражении коронарных артерий больные могут предъявлять жалобы на приступы сжимающих (ангинозных) болей за грудиной. Наконец, у части больных отмечается прогрессирующая потеря массы тела, чаще всего в сочетании с повышением температуры тела, обычно снижающейся при приеме нестероидных противовоспалительных препаратов. Некоторые пациенты могут сообщить сведения об обнаружении у них изменений показателей крови (в частности, увеличение СОЭ). Однако эти признаки могут наблюдаться при многих заболеваниях, поэтому после I этапа диагностического поиска нельзя сделать вывод о наличии НАА. Правильнее включить в круг диагностического поиска наряду с другими заболеваниями и НАА. Подобная неспецифичность жалоб, естественно, затрудняет диагностический поиск, в связи с чем сбор информации на последующих этапах имеет большое значение.
На II этапе диагностического поиска следует направить все внимание на выявление признаков, свидетельствующих о поражении артериальных сосудов различных сосудистых областей. Прежде всего следует внимательно исследовать лучевые артерии: характерный признак НАА — отсутствие (или ослабление) пульса с одной стороны или же асимметрия поражения. Важно оценить характер пульсации на сонных и плечевых артериях. Типична асимметрия АД на руках (более 30 мм), иногда нельзя определить АД на одной (или обеих) руках. Другой характерный симптом — выслушивание систолического шума над крупными сосудами — сонными, подключичными. Чрезвычайно важно обнаружение систолического шума слева (или справа) от пупка у лиц с повышенным АД. Эти находки свидетельствуют о несомненном поражении почечных артерий. Кроме того, обнаружение усиления пульсации брюшной части аорты (в сочетании с систолическим шумом, выслушиваемым над ней) также указывает на поражение брюшной части аорты.
Существенным является обнаружение протодиастолического шума над областью аортального клапана (в точке Боткина или во втором межреберье справа от грудины), что говорит о поражении восходящей части аорты. У части больных можно обнаружить высокую АГ. Размеры сердца у таких пациентов увеличены (за счет левого желудочка).
В ряде случаев можно одновременно с указанными выше симптомами обнаружить признаки артрита крупных суставов, поражения кожи (узловатая эритема, уртикарные или геморрагические высыпания). Таким образом, на II этапе диагностического поиска наиболее существенными являются признаки поражения артериальных сосудов. Однако эти симптомы могут быть не столь резко выраженными, более того, высокая АГ может увести мысль врача в совершенно другом направлении. Для окончательного подтверждения диагноза НАА необходимы сведения, получаемые на Ш этапе диагностического поиска.
Сведения, получаемые на данном этапе, следует подразделить следующим образом: 1) указывающие на поражение артериальных стволов; 2) признаки поражения органов; 3) активность патологического процесса (иммунное воспаление и неспецифические признаки).
Поражение артериальных стволов обычно достаточно четко определяется при непосредственном исследовании, однако допплерография позволяет Достоверно судить о поражении сосудов. Все более широко используют магнитно-резонансную томографию (МРТ), что исключает лучевую нагрузку на пациента. Метод достаточно детально визуализирует поражение артерий. При исследовании почечных, коронарных артерии или артерий головного мозга используют ангиографию, свидетельствующую о поражении сосудов и степени его выраженности.
Среди симптомов поражений внутренних органов наибольшее значение имеют признаки, указывающие на патологию почек и сердца. При поражении почек у больных НАА выявляются протеинурия (обычно не более 1 г/сут), микрогематурия; при прогрессировании почечного поражения возможно повышение содержания креатинина в сыворотке крови.
Поражение сердца, обусловленное изменением коронарных артерий, определяется на ЭКГ (выявляющей в ряде случаев крупноочаговые изменения, характерные для инфаркта миокарда), а также на эхокардиограмме, выявляющей снижение сократительной функции миокарда.
Специфических лабораторных признаков НАА не существует. В активной фазе болезни отмечаются увеличение СОЭ, повышение уровня аз-глобулинов, умеренная гипохромная анемия. Существенных иммунных сдвигов выявить не удается (несмотря на несомненный аутоиммунный характер болезни).
Течение. По характеру течения НАА представляет собой прогрессирующее заболевание с разными вариантами течения — от медленно развивающихся до острых форм. В настоящее время выделяют несколько вариантов течения НАА.
Острое течение — болезнь начинается с лихорадки, суставного синдрома, увеличения СОЭ, анемии. Ишемические признаки возникают в течение первого года заболевания и быстро прогрессируют. Терапия обычно малоэффективна.
Подострое течение — все признаки болезни развиваются достаточно медленно. Температура обычно невысокая, остальные лабораторные показатели изменены умеренно. Признаки ишемии органов и систем выявляются постепенно. Лабораторные признаки (СОЭ, анемия, гипергаммагло- булинемия выражены умеренно).
Хроническое течение обычно наблюдается у лиц старше 30 лет. В клинической картине доминируют симптомы поражения сосудов и ишемические синдромы. Повышение температуры, лабораторные показатели изменены нерезко.
Причинами смерти больных с НАА являются сердечная недостаточность, церебральные нарушения, острый инфаркт миокарда.
Диагностика. О наличии НАА предполагают на основании комплекса признаков: асимметрия и исчезновение пульса, сосудистые шумы над проекцией крупных сосудов, артериальная гипертония у молодых лиц, предъявляющих характерные жалобы.
Ниже представлены диагностические критерии НАА Американской ревматологической ассоциации (1990):
• возраст < 40 лет;
• «перемежающаяся хромота» верхних конечностей — быстрое развитие усталости и ощущение дискомфорта при работе руками;
• ослабление пульса на лучевой артерии, ослабление пульсации на одной или обеих плечевых артериях;
• разница систолического АД на правой и левой плечевых артериях более 10 мм рт. ст.;
аортой'СИСТ Ч6СКИИ ш-ум над подключичными артериями или брюшной
• ангиографические изменения: локальное или сегментарное сужение аорты и/или ее ветвей, не связанное с атеросклерозом.
В процессе диагностики приходится проводить дифференциацию с целым рядом болезней, имеющих сходную симптоматику с НАА. Сходство с другими болезнями приводит к тому, что правильный диагноз НАА устанавливается в среднем спустя 18 мес после начала болезни, однако в ряде случаев этот период может быть равен нескольким годам.
Инфекционный эндокардит диагностируют обычно в начале болезни при остром ее течении в связи с высокой лихорадкой, суставным синдромом, наличием недостаточности клапана аорты. Однако дальнейшее наблюдение выявляет поражение магистральных сосудов и отсутствие эффекта от массивной антибиотикотерапии.
Артериальная гипертония, ранее трактовавшаяся как гипертоническая болезнь (часто злокачественного течения), может быть отвергнута на основании признаков поражения почечных артерий и брюшной части аорты, наличия в анамнезе эпизодов лихорадки и эффективности нестероидных противовоспалительных препаратов (и кортикостероидов), наличия показателей воспалительного процесса (прежде всего увеличения СОЭ).
Артриты, в том числе ревматоидный артрит, приходится дифференцировать от НАА. Однако при ревматоидном артрите не отмечаются отчетливые поражения артериальных сосудов.
Наибольшие сложности отмечаются при дифференциации артериальной гипертонии, обусловленной фибромускулярной дисплазией почечных сосудов, от артериальной гипертонии при НАА. В отличие от НАА при фибромускулярной дисплазии почечных сосудов не отмечается общевоспалительных признаков (лихорадка, изменения острофазовых показателей), поражения дуги аорты и ее ветвей.
Наиболее важные дифференциально-диагностические признаки НАА — распространенность поражения артерий, чаще нескольких сосудистых областей, клинико-лабораторные признаки неспецифического воспаления.
Лечение. Терапия НАА имеет следующие задачи: 1) воздействие на активность иммунного воспаления; 2) борьба с ишемическими осложнениями; 3) лекарственная коррекция артериальной гипертонии.
При высокой степени активности патологического процесса (острое течение НАА) следует назначать преднизолон в дозе 30—40 мг/сут до достижения клинического эффекта, затем дозу постепенно снижают до поддерживающей (5—10 мг/сут). Если ремиссия не достигнута, то добавляют ме- тотрексат в средней дозе 15 мг/сут. В случае неэффективности сочетанной терапии (как и в случае наличия противопоказаний для преднизолона или развитии побочных эффектов при их применении) назначают циклофосфамид в дозе 2 мг/(кгсут), поддерживающую терапию проводят не менее 2 лет. Азатиоприн в дозе 50—75 мг/сут назначают в течение 1 года.
При подостром течении болезни дозы препаратов меньше (преднизолон 20—30 мг/сут, поддерживающая доза 5—7,5 мг/сут.
При быстром развитии ишемических расстройств (инфаркт миокарда, тромбозы мозговых и периферических сосудов) проводят лечение гепарином, антиагрегантами, тромболитическими препаратами (фибринолизин, стрептокиназа, урокиназа). При стихании острых явлений и переходе болезни в хроническое состояние назначают ангиопротекторы (продектин в Дозе 0,75—1 г/сут) в сочетании с антиагрегантами (дипиридамол) и сосудистыми препаратами (пентоксифиллин).
При высокой АГ проводят лечение преимущественно ингибиторами АПФ (при отсутствии двустороннего стеноза почечных артерий), менее эффективны антагонисты кальция, мочегонные препараты.
Хирургическое лечение показано при реноваскулярной гипертонии, выраженных ишемических явлениях головного мозга, конечностей.
Прогноз. Длительность жизни зависит от наличия осложнений, активности патологического процесса и успеха лечения (консервативного и хирургического). Причины смерти больных - сердечная недостаточность инфаркт миокарда, нарушения мозгового кровообращения.
Гранулематоз Вегенера
Гранулематоз Вегенера (ГВ) — системный васкулит, для которого характерны некротизирующее гранулематозное воспаление и некротизирующий васкулит, поражающий мелкие сосуды верхних дыхательных путей, легких и почек. ГВ встречается одинаково часто у мужчин и женщин, средний возраст заболевших составляет 35—45 лет.
Этиология и патогенез. Причины возникновения болезни неизвестны. Предполагают роль вирусной инфекции (цитомегаловирус, вирус Эпштей- на—Барр). Отмечена связь обострения болезни с персистированием золотистого стафилококка в полости носа.
В основе ГВ лежат разнообразные нарушения клеточного и гуморального иммунитета. Роль иммунных нарушений подтверждается обнаружением в крови антинейтрофильных цитоплазматических антител (АНЦА), реагирующих с ферментами нейтрофилов (особенно с протеиназой 3). Клеточные иммунные реакции выражаются в формировании гранулем во внутренних органах и наличии активированных Т-лимфоцитов в воспалительном инфильтрате почек и легких. Нейтрофилы являются основными клетками-мишенями для АНЦА. Ферменты, освобождающиеся при дегра- нуляции нейтрофилов, повреждают базальную мембрану клубочков. Формируется гломерулонефрит с полулуниями.
Морфологически обнаруживают деструктивные васкулиты и полиморф- но-клеточные гранулемы с многоядерными клетками. Эти изменения локализуются в верхних дыхательных путях и в легких. Гранулемы могут некро- тизироваться и распадаться. В почках обнаруживают некротизирующий васкулит мелких и средних артерий, фибриноидный некроз с деструкцией гломерулярных капилляров в сочетании с полиморфно-клеточными инфильтратами, в мезангиуме — отложения иммуноглобулинов и компонентов комплемента.
Клиническая картина. Проявления болезни складываются из признаков поражения верхних дыхательных путей, легких и почек, кроме того, наблюдаются общие неспецифические признаки, реже — органные поражения.
Принято различать локальный, ограниченный и генерализованный варианты ГВ. При локальном Г В патологические изменения ограничиваются верхними дыхательными путями. Ограниченный ГВ характеризуется наряду с поражением верхних дыхательных путей изменениями в легких. Поражение почек при ограниченном варианте не развивается. Генерализованный ГВ протекает с поражением верхних дыхательных путей, легких и почек.
Кроме того, выделяют различные варианты течения болезни. Для острого ГВ характерны короткий период начальных проявлений болезни (не более 1—2 мес), бурное прогрессирование патологического процесса с образованием множественных инфильтратов в легких и прогрессирующим развитием дыхательной и почечной недостаточности. При отсутствии адек- 516 ватного лечения больные умирают через 5—6 мес от момента начала болезни. Рецидивирующее течение наблюдается у большинства больных. Оно характеризуется более длительным начальным этапом болезни (до года и более), в легких выявляют отдельные (не множественные) инфильтраты; почечный процесс развивается медленно. При адекватном лечении и отсутствии осложнений больные живут 7—10 лет. Для этой группы больных характерны рецидивы, возникающие при снижении дозы лекарств (имму- носупрессоров), неспецифической инфекции, травме и т.д. Хроническое течение встречается редко и характеризуется отсутствием рецидивов на протяжении многих лет. Подобное течение свойственно, как правило, локальным вариантам ГВ.
Таким образом, для ГВ характерны чрезвычайная полиморфность проявлений болезни, различный темп появления симптомов и осложнений, а также выраженность общих неспецифических проявлений.
На I этапе диагностического поиска следует выявить особенности дебюта болезни, последовательность развертывания симптоматики. Вне зависимости от варианта болезни и особенностей ее течения первыми симптомами обычно являются признаки поражения верхних дыхательных путей; типичны жалобы на сухость в носу, затруднение носового дыхания, носовые кровотечения. Первым признаком болезни может быть гнойный отит, сопровождающийся лихорадкой, плохим самочувствием, артралгиями. В 15—20 % случаев болезнь дебютирует с поражения легких, что проявляется надсадным кашлем, лихорадкой, иногда кровохарканьем. Среди общих признаков следует отметить лихорадку, при этом эффект от применения антибиотиков отсутствует.
У части больных в начале болезни могут отмечаться боли в крупных (реже в мелких) суставах. Возможно развитие артритов (чаще голеностопных и коленных суставов) без развития стойкой деформации.
Распространение патологического процесса на гортань, глотку и трахею проявляется охриплостью голоса, болями в горле. Естественно, что в подобных ситуациях возникает предположение прежде всего о банальном (инфекционном) поражении верхних дыхательных путей и легких, однако упорное лечение, в том числе антибиотиками, эффекта не дает. Именно стойкость симптомов, отсутствие эффекта от традиционного лечения в сочетании с лихорадкой позволяют включить в круг диагностического поиска и ГВ. Данные анамнеза позволяют выявить (если болезнь длится достаточно долго) и характер ее течения — с рецидивами, «спокойное» хроническое. В большинстве случаев больным ГВ не ставят правильный диагноз, как правило, в анамнезе у больных ГВ фигурируют такие диагнозы, как рецидивирующая пневмония, то или иное поражение верхних дыхательных путей. Однако «нехарактерность» течения предполагаемого банального поражения легких и верхних дыхательных путей может говорить о возможном развитии ГВ, особенно если в анамнезе имеются сведения о выявлявшихся изменениях мочи (протеинурия).
На II этапе диагностического поиска следует стремиться к выявлению симптомов, представляющих собой внешнее выражение патологического процесса. Однако частота тех или иных находок и выраженность симптоматики будут обусловлены как вариантом течения болезни, наличием или отсутствием ремиссии, так и степенью генерализации болезни (вовлечение в патологический процесс различных органов и систем).
Так, у ряда больных могут наблюдаться поражения кожи в виде полиморфной экзантемы, геморрагических и папулезных высыпаний, локализующихся в области крупных суставов (коленные, локтевые), на ягодицах, бед- pax. При поражении слизистых оболочек носа возможно разрушение хряща и костной ткани носовой перегородки, что обусловливает деформацию носа («седловидный» нос). Возможно также некротическое поражение миндалин.
При поражении легких изменяется аускультативная симптоматика (сухие и влажные мелкопузырчатые хрипы), при выпоте в плевральной полости выслушивается ослабленное дыхание. Однако все эти изменения достаточно скудны по сравнению с изменениями, выявляемыми при рентгенологическом исследовании.
При поражении бронхов различного калибра возможно появление бронхообструктивного синдрома с соответствующими физикальными признаками, что в ряде случаев трактуется как проявление бронхиальной астмы (тем более что в крови больных может выявляться эозинофилия).
К редким симптомам ГВ следует отнести поражение сердца, встречающееся в 15—25 % случаев и являющееся исходом васкулита и гранулемато-за. Могут развиваться миокардит, перикардит. Описаны случаи формирования недостаточности митрального или аортального клапанов вследствие поражения эндокарда. Возможно также развитие коронарита, проявляющегося в виде типичных ангинозных приступов, вплоть до развития острого инфаркта миокарда.
Желудочно-кишечный тракт при ГВ поражается редко (в 5—10 % случаев), что, кроме субъективной симптоматики (боли в животе, анорексия), может проявляться желудочно-кишечными кровотечениями. В остром периоде болезни возможно увеличение печени (что также является следствием васкулита).
Несмотря на достаточно частое поражение почек при ГВ — третий классический признак болезни, артериальная гипертония нехарактерна. Однако удлинение жизни больных в связи с успешным лечением обусловливает появление гипертонии примерно у 20 % больных, при этом повышение АД обычно нерезкое.
Таким образом, данные II этапа диагностического поиска наряду с поражением верхних дыхательных путей и легких могут выявить и другие симптомы (при несомненном доминировании первых). Эти данные при соответствующих жалобах больного подтверждают мнение врача о правильности предполагаемого диагноза ГВ.
Данные III этапа диагностического поиска имеют решающее значение в диагностике, при этом риноскопия, ларингоскопия, биопсия слизистой оболочки носа имеют важное значение, так как позволяют выявлять патологические изменения, характерные для ГВ.
При рентгенологическом и рентгенотомографическом исследовании легких видны единичные или множественные округлые инфильтраты, преимущественно в средних и нижних легочных полях. В некоторых случаях эти изменения могут оставаться в течение многих месяцев, иногда под влиянием иммуносупрессивной терапии они рассасываются. Возможен распад инфильтратов с появлением тонкостенных полостей и уровнем жидкости. При бронхоскопии можно обнаружить диффузный эрозивный бронхит с сужением и рубцовой деформацией бронхов.
При поражении сердца, а также развитии АГ на ЭКГ могут выявляться признаки синдрома гипертрофии левого желудочка, а также «ишемиче-ские» изменения в виде депрессии сегмента ST. При поражении почек наблюдаются протеинурия (3 г/сут белка и более) и микрогематурия. Про-грессирование патологического процесса в почках в 50 % случаев заканчивается почечной недостаточностью (снижение клубочковой фильтрации,
гиперкреатининемия).
Специфических лабораторных тестов при ГВ не существует. Изменение ряда показателей отражает активность процесса. Увеличение СОЭ в острой фазе болезни отмечается у всех больных, достигая 70—80 мм/ч; меньшие величины СОЭ наблюдаются при рецидиве болезни. Лейкоцитоз более Ю- Ю9/л наблюдается достаточно часто при высокой активности ГВ. У 10 % больных отмечается эозинофилия, достигающая иногда 40—60 %. В активной стадии болезни в половине случаев имеется гипохромная анемия. Следует отметить, что для ГВ считается типичным гипертромбоцитоз (более 400 109/л), способствующий нарушениям реологических свойств крови и наклонности к тромбообразованию.
Почти постоянно определяется диспротеинемия с гипоальбуминемией и повышением уровня глобулинов.
При иммунологическом исследовании у 95 % больных в острой фазе заболевания обнаруживают антинейтрофильные антитела к протеиназе 3. Ревматоидный фактор (РФ) находят у подавляющего большинства больных, при этом величина титра РФ коррелирует с остротой течения болезни. Обнаружение противоядерных антител (АИФ) и LE-клеток нехарактерно. В противоположность узелковому периартерииту при ГВ HbsAg не обнаруживают.
При быстропрогрессирующем нефрите показана биопсия почки (обычно обнаруживают некротизирующий гломерулит).
Диагностика. Распознавание ГВ — не всегда простая задача. Нет сложностей при наличии классической триады — язвенно-некротического поражения верхних дыхательных путей с деформацией спинки носа, типичных изменений легких и почек. При «легочном дебюте» болезни диагностические трудности возрастают. Поражение почек обычно появляется в развернутый период болезни. Наиболее сложен диагноз при атипичном начале болезни. Если болезнь начинается с отита, поражения глаз, артрита, кожных проявлений, в том числе геморрагических, обязателен осмотр больного оториноларингологом для уточнения состояния верхних дыхательных путей, придаточных пузах носа. С момента появления первых симптомов болезни до установления точного диагноза иногда проходит большой промежуток времени, когда считают, что больные страдают банальным поражением верхних дыхательных путей, пневмонией, бронхиальной астмой, гломерулонефритом, артритом. Анализ всей клинической картины в совокупности и дифференцирование с синдромально сходными заболеваниями позволяют в конце концов поставить правильный диагноз.
Ниже приводятся диагностические критерии Американской ассоциации ревматологов (1990):
• воспаление слизистой оболочки носа и полости рта: язвы в полости рта, гнойные или кровянистые выделения из носа;
• изменения при рентгенологическом исследовании легких: узелки, инфильтраты, полости;
• изменения мочи: микрогематурия;
• биопсия: гранулематозное воспаление в стенке артерии или перива- скулярном пространстве.
Для постановки диагноза необходимо наличие двух критериев (чувствительность 88 %, специфичность 92 %).
ГВ обычно приходится дифференцировать от легочной патологии (стафилококковая пневмония, абсцесс легкого, туберкулез легких, опухоль легких), при генерализованной форме болезни с высокой активностью патологического процесса — от сепсиса; при геморрагических поражениях кожи — от геморрагического васкулита, а при поражении почек — от гло- мерулонефрита (обычно быстропрогресснрующего с почечной недостаточностью).
Лечение. Учитывая иммунопатологический характер процесса, следует проводить терапию иммуносупрессорами. В настоящее время используют комбинацию преднизолона и циклофосфамида. В активную фазу болезни назначают преднизолон в дозе 1 мгДкгсут) внутрь в течение месяца с последующим переходом на режим приема через день и постепенным медленным снижением дозы. Лечение отменяют через 6 мес.
Циклофосфамид назначают в дозе 2 мг/(кгсут) внутрь на протяжении не менее 1 года, затем дозу снижают на 25 мг каждые 2—3 мес. Возможно применение циклофосфамида в режиме пульс-терапии по 0,7 мг на 1 м2 поверхности тела ежемесячно в течение года (на фоне одновременного приема преднизолона). В дальнейшем (при наличии несомненного положительного эффекта) циклофосфамид заменяют азатиоприном. Ремиссии при лечении преднизолоном в комбинации с циклофосфамидом более стойкие, чем в комбинации с азатиоприном.
Экстракорпоральные методы (гемосорбция, плазмаферез) применяют при острых формах ГВ, плохо поддающихся лечению иммунодепрессанта-ми. Плазмаферез рекомендуется при прогрессирующем поражении почек и непереносимости цитостатиков.
При лечении циклофосфамидом следует иметь в виду возможность осложнений — цитопения, инфекция, геморрагический цистит, желудочно- кишечные расстройства.
Прогноз. При нелеченом ГВ больные умирают в период от 5 мес до 2 лет. Применение преднизолона и цитостатиков позволило достичь 5-летней выживаемости у 61 % больных. Прогноз болезни и выживаемость больных зависят от своевременно начатого лечения, использования циклофосфамида, длительности лечения (не менее 5 лет), переносимости препаратов, а также возникших осложнений.
Геморрагический васкулит (болезнь Шенлейна—Геноха)
Геморрагический васкулит (ГВ) относится к группе системных аутоиммунных васкулитов; поражаются мелкие сосуды — капилляры и артериолы. Причиной васкулита является отложение иммунных комплексов, содержащих IgA, в стенке сосуда, это приводит к воспалительным изменениям и последующему повышению проницаемости сосудов. Воспалительные изменения стенки сосуда сопровождаются образованием микротромбов, пери- васкулярным отеком, развитием дистрофических изменений в окружающих тканях, причем в выраженных случаях в тканях могут образовываться очаги некроза.
Заболевание встречается чаще у детей и лиц молодого возраста (40 % составляют лица до 20 лет) после стрептококковой ангины или обострения хронического тонзиллита, фарингита, после введения вакцин и сывороток, при лекарственной непереносимости, переохлаждении. Пик заболеваемости приходится на весну.
Этиология и патогенез. В качестве провоцирующего фактора могут выступать инфекция (наиболее часто — (3-гемолитический стрептококк группы А, а также микоплазмы, респираторные вирусы), прием некоторых лекарств, вакцинация.
Иммунное воспаление выражается в отложении иммунных комплексов (в их состав входят IgA, СЗ-компонент комплемента, пропердин) в стенки мелких сосудов, что приводит к активации системы комплемента и внутри- сосудистого свертывания, в свою очередь это обусловливает нарушение микроциркуляции. Повышение проницаемости стенки сосудов обусловливает геморрагический синдром.
Клиническая картина. Заболевание складывается из кожного геморрагического синдрома, поражения суставов (артралгии, артрит), абдоминального и почечного синдромов. Абдоминальный синдром обусловлен геморрагиями в брюшину и нарушением микроциркуляции в сосудах брюшной полости; почечный синдром представляет собой иммунокомплексный гломерулонефрит, чаще всего геморрагического типа, реже наблюдаются высокая протеинурия, АГ. В дальнейшем может формироваться хронический гломерулонефрит с последующим развитием почечной недостаточности.
Различают молниеносную форму, острые, хронические формы (затяжные или рецидивирующие), а также рецидивирующие формы течения с длительными ремиссиями.
Основным проявлением болезни является геморрагический синдром, выраженный в различной степени, а также вовлечение в патологический процесс суставов, сосудов брюшной полости и почек, при этом наличие двух последних синдромов не является обязательным.
На I этапе диагностического поиска удается выяснить, что после ряда указанных выше причин у больного повышается температура тела (от субфебрильных до фебрильных цифр) и появляются эритематозные, иногда зудящие папулы на разгибательных поверхностях предплечий, стопах, голенях, ягодицах, области пораженных суставов. Высыпания в процессе обратного развития проходят все стадии кровоизлияния, пигментация иногда сохраняется в течение длительного времени. Сыпь мелкопятнистая, симметричная. Пятна осязаемы, поэтому кожный синдром получил название «пальпируемая пурпура». При надавливании пятно не исчезает. Через 2—3 сут сыпь исчезает.
Поражение суставов отмечается в 59—100 % случаев в виде болей и припухлости чаще крупных суставов. Боли бывают различные — от кратковременных ломящих до острейших, обездвиживающих больного. Артрит развивается в результате периартикулярного процесса, нередко с геморрагиями в околосуставные ткани или внутрисуставно. Длительность суставного синдрома редко превышает 1—2 нед. Характерно волнообразное течение поражения суставов. Деформация суставов практически не развивается.
При абдоминальном синдроме больные отмечают боли типа кишечной колики, обычно они локализуются вокруг пупка, но нередко и в других частях живота, симулируя аппендицит, холецистит, панкреатит. Одновременно с болями в животе могут появиться рвота с кровью, жидкий стул с прожилками крови. При вовлечении в патологический процесс почек может отмечаться изменение цвета мочи (макрогематурия).
Данные II этапа диагностического поиска бывают различными, что зависит от остроты патологического процесса, а также от длительности заболевания. На высоте заболевания отмечаются геморрагические высыпания, артрит крупных, чаще голеностопных суставов. При абдоминальном синдроме, кроме болей, появляются резкая болезненность живота, симптомы раздражения брюшины. Абдоминальный синдром, обусловленный кровоизлияниями в брюшину, в выраженных случаях представляет собой картину острого живота, что определяет тактику совместного наблюдения больных терапевтом и хирургом.
Поражение почек чаще развивается у взрослых, чем у детей, причем тяжесть поражения не коррелирует с выраженностью геморрагического синдрома и поражением суставов. Почки обычно поражаются в течение первого месяца болезни на фоне развернутой картины кожного геморрагического синдрома, реже поражение почек присоединяется во время одного из рецидивов болезни. Лишь изредка болезнь начинается как острый гломерулонефрит с последующим присоединением пурпуры, артралгий, болей в животе.
На III этапе диагностического поиска следует прежде всего исследовать систему гемостаза. Длительность кровотечения и количество тромбоцитов не отличаются от нормы. Показатели коагуляционного гемостаза также не изменены, однако в тяжелых случаях болезни может развиться вторичный ДВС-синдром, для которого характерна пролонгированная гиперкоагуляция с гиперфибринемией. Однако в отличие от первичного ДВС-синдрома при геморрагическом васкулите не развивается II фаза гипокоагуляции со снижением уровня фибриногена и тромбоцитопенией.
При остром течении болезни отмечаются острофазовые показатели (нейтрофильный лейкоцитоз, увеличение СОЭ, повышение содержания аз- глобулинов, фибриногена). В ряде случаев в крови повышен уровень циркулирующих иммунных комплексов (ЦИК), что подтверждает иммунный характер заболевания. У половины больных выявляется повышение уровня IgA в крови.
В случае поражения почек при исследовании мочи выявляются умеренная протеинурия, а также достаточно выраженная гематурия.
Диагностика. Распознавание болезни несложно при наличии классических признаков — поражения кожи, суставов, болей в животе и поражения почек. Труднее поставить диагноз при преобладании в клинической картине абдоминального синдрома или поражения почек, когда еще кожный геморрагический синдром не выражен.
В установлении диагноза геморрагического васкулита важную роль играет биопсия кожи. Для биопсии берут участок изменений кожи со свежими геморрагическими высыпаниями. Изменения локализуются в сосочко-вом слое дермы и выражаются в микроваскулитах мелких сосудов с инфильтрацией мононуклеарными клетками (лимфоциты, плазмоциты, макрофаги). Диагноз подтверждается обнаружением в сосудах иммунных комплексов, содержащих IgA. При выраженном почечном синдроме и определении показаний к активной терапии (кортикостероиды, цитостатиче- ские препараты) иногда приходится прибегать к пункционной биопсии почки. При геморрагическом васкулите противопоказаний к пункции почки нет. Иммуногистологическое исследование ткани почки обнаруживает интенсивное отложение IgA, СЗ-компонента комплемента в мезангиуме и вдоль базальной мембраны клубочков.
Лечение. Комплекс лечебных мероприятий определяется фазой болезни (обострение, ремиссия), доминированием того или иного синдрома.
Все больные ГВ в фазе обострения должны быть госпитализированы. Следует избегать охлаждения и длительной нагрузки на ноги (стояние, ходьба), что может усиливать геморрагические высыпания на ногах. Необходимо исключить введение вакцин и сывороток.
Очаги инфекции (например, хронический тонзиллит) требуют дифференцированного подхода и не должны служить поводом для необоснованного назначения антибиотиков.
При поражении кожи и суставном синдроме назначают аскорбиновую кислоту, рутин, антигистаминные препараты. При упорных рецидивах на- 522
значают нестероидные противовоспалительные препараты, например индо- цетацин по 150—200 мг/сут в течение месяца с последующим переходом на поддерживающую дозу — 50—75 мг/сут. Одновременно назначают препараты 4-аминохинолинового ряда — хингамин (делагил) или гидроксихлоро-хил (плаквенил) по 0,25—0,5 г/сут в течение 5—6 мес.
При абдоминатьном синдроме назначают гепаринотерапию — вначале в суточной дозе 300—400 ЕД/кг внутривенно капельно или под кожу живота каждые 6 ч. В процессе лечения необходим контроль за гипокоагуляцион- ным эффектом с помощью аутокоагуляционного теста. При отсутствии эффекта дозу гепарина увеличивают до 800 ЕД/кг. Назначают также свежезамороженную плазму внутривенно струйно 300—400 мл в течение 3—4 дней. С целью улучшения реологических свойств крови назначают дипиридамол (курантил), пентоксифиллин (трентал).
Лечение при гломерулонефрите определяется его клиническим вариантом и течением. При латентном гломерулонефрите с умеренной протеину-рией и гематурией назначают делагил или плаквенил на протяжении не менее 6 мес. При массивной гематурии, сочетающейся с пурпурой и суставным синдромом, эффективны индометацин, антиагреганты (курантил по 250—300 мг/сут с последующим снижением дозы до 50—150 мг/сут в течение нескольких месяцев).
При нефротическом или смешанном варианте гломерулонефрита применяют комплексное лечение иммунодепрессантами в сочетании с антикоагулянтами (гепарин) и антиагрегантами (курантил). Иммунодепрессан-ты — цитостатики (азатиоприн или циклофосфан) назначают в дозе 100—150 мг/сут в сочетании с преднизолоном (до 30 мг/сут); затем переходят на поддерживающую терапию — преднизолон по 5—15 мг/сут, азатиоприн по 50—75 мг/сут, курантил.
Прогноз. При кожной и кожно-суставной формах болезни прогноз вполне благоприятен. При абдоминальном синдроме прогноз гораздо серьезнее: инвагинация кишечника заканчивается смертью в 13 % случаев (у оперированных больных), при перфорации кишечника умирают более половины больных. У большинства больных с почечным синдромом прогноз плохой (10-летняя выживаемость больных с поражением почек составляет всего 51 %, причем неизмененная функция почек отмечена лишь У 37 %, у остальных развивается хроническая почечная недостаточность). Прогноз значительно хуже у лиц старшей возрастной группы, у больных с нефротической, гипертонической или смешанной формами гломерулонефрита.
Контрольные вопросы и задачи
На вопросы 177—188 выберите один наиболее правильный ответ.
177. При узелковом периартериите наблюдаются следующие признаки, за исключением: А. Сегментарного или очагового поражения сосудов. Б. Вовлечения в процесс мелких и средних сосудов. В. Эозинофилии. Г. Одной и той же стадии патологического процесса во всех пораженных сосудах. Д. Повреждения сосудов, питающих стенку крупных сосудов.
178. Поражение сердечно-сосудистой системы при узелковом периартериите может включать: А. Артериальную гипертонию. Б. Коронарную недостаточность. В- Перикардит. Г. Миокардит. Д. Все перечисленное.
179.У 23-летней девушки в течение 4 мес лихорадка до 38,5 °С, боли в крупных суставах и мышцах, отмечено преходящее снижение зрения. АД на правой руке 140/85 мм рт. ст., на левой 80/65 мм рт. ст. На правой сонной артерии выслушивается фубый систолический шум. В анализе крови — СОЭ 45 мм/ч. Наиболее вероятный диагноз: А. Туберкулез. Б. Ревматизм. В. Неспецифический аортоартериит. Г. Инфекционный эндокардит. Д. Узелковый периартериит.
180. Какое исследование необходимо провести для подтверждениядиагноза? А Повторные посевы крови. Б. Пробу Пирке. В. Ангиографию. Г. Определение уровня ревматоидного фактора в крови. Д. Кожно-мышечную биопсию.
181. Все перечисленное применяют при лечении гранулематоза Вегенера, кроме одного: А. Преднизолон. Б. Азатиоприн. В. Плазмаферез. Г. Циклофосфан. Д. Ге- мотрансфузии.
182. При начале классического узелкового периартериита отмечаются все перечисленные симптомы, кроме одного: А. Лихорадка. Б. Иридоциклит. В. Миалгии. Г. Снижение массы тела. Д. Увеличение СОЭ.
183. У 61-летней женщины в течение 3 мес рецидивирующие геморрагические высыпания на коже голеней, преимущественно в области голеностопных суставов, которые увеличены в объеме, движения в них болезненны. Отмечается субфебрилитет. СОЭ 48 мм/ч. В моче белок 1,5 г/сут, 60—70 эритроцитов в поле зрения. Наиболее вероятный диагноз: А. Инфекционный эндокардит. Б. Острый нефрит. В. Геморрагический васкулит. Г. Опухоль почки. Д. Узелковый периартериит.
184. О каком заболевании из перечисленных следует думать при появлении у мужчины 24 лет нарушений речи, судорог и головокружении? А. Неспецифическии аортоартдшит. Б. Узелковый периартериит. В. Гранулематоз Вегенера Г. Гиперто- ническии криз. Д. Приступ эпилепсии.
185. Какой препарат (из перечисленных) наиболее подходит для лечения артериальной гипертензии у больного неспецифическим аортоартериитом? А. Нифеди- пин. Б. Гипотиазид. В. Празозин. Г. Эналаприл. Д. Клофелин.
186. ^идцатилетняя женщина предъявляет жалобы на повышение температуры тела до 37,8 С, слабость, что отмечается в течение 7 мес. Выслушивается систолический шум слева от пупка. АД — 180/110 мм рт. ст.; СОЭ 40 мм/ч. Наиболее вероятный диагноз: А. Узелковый периартериит. Б. Острый гломерулонефрит (затянувшийся). В. Неспецифический аортоартериит. Г. Фиброзно-мышечная дисплазия почечной артерии. Д. Системная красная волчанка.
187. Что из перечисленного нехарактерно для гранулематоза Вегенера? А. Лихорадка. Б. Осиплость голоса. В. Деформации голеностопных суставов. Г. Кожные поражения. Д. Пневмония.
188.При следающих заболеваниях следует думать о гранулематозе Вегенера, оме одного: А. Туберкулез легких. Б. Гломерулонефрит. В. Ревматизм. Г. Сепсис. Стафилококковая пневмония.
Глава VII
Диффузные заболевания соединительной ткани
Содержание
Диффузные заболевания соединительной ткани . . 525
Системная красная волчанка........................................... 526
Системная склеродермия................................................. 539
Дерматомиозит................................................................ 548
Контрольные вопросы и задачи.................................. 554
Диффузные заболевания соединительной ткани
ДИФФУЗНЫЕ ЗАБОЛЕВАНИЯ СОЕДИНИТЕЛЬНОЙ ТКАНИ (ДЗСТ), или коллагенозы (термин, имеющий историческое значение), — группа заболеваний, характеризующихся системным иммуновоспалитель-ным поражением соединительной ткани и ее производных. Данное понятие является групповым, но не нозологическим, в связи с чем этим термином не следует обозначать отдельные нозологические формы. ДЗСТ объединяют достаточно большое число заболеваний. Наиболее часто встречающимися являются системная красная волчанка (СКВ), системная склеродермия (ССД), дерматомиозит (ДМ); к этой группе заболеваний относят также ревматическую лихорадку (традиционно описываемую в разделе заболеваний сердечно-сосудистой системы). В настоящее время доказано, что при ДЗСТ происходят глубокие нарушения иммунного гомеостаза, выражающиеся в развитии аутоиммунных процессов, т.е. реакции иммунной системы, сопровождающиеся появлением антител или сенсибилизированных лимфоцитов, направленных против антигенов собственного организма (аутоантигенов).
Основой аутоиммунной патологии является иммунорегуляторный дисбаланс, выражающийся в угнетении супрессорной и увеличении «хелпер- ной» активности Т-лимфоцитов с последующей активацией В-лимфоцитов и гиперпродукцией аутоантител самой разной специфичности.
Ймеется ряд общих черт, объединяющих ДЗСТ:
• общность патогенеза — нарушение иммунного гомеостаза в виде неконтролируемой выработки аутоантител и образования иммунных комплексов антиген — антитело, циркулирующих в крови и фиксирующихся в тканях с последующим развитием тяжелой воспалительной реакции (особенно в микроциркуляторном русле, почках, суставах и пр.);
• сходство морфологических изменений (фибриноидное изменение основного вещества соединительной ткани, васкулиты, лимфоидные и плазмоклеточные инфильтраты и пр.);
• хроническое течение с периодами обострений и ремиссий;
• обострение под влиянием неспецифических воздействий (инфекция, инсоляция, вакцинация и др.);
• многосистемность поражения (кожа, суставы, серозные оболочки, почки, сердце, легкие);
• лечебный эффект иммуносупрессорных средств (глюкокортикосте- роиды, цитостатики).
Все заболевания, входящие в эту группу, отличаются самостоятельными клиническими и морфологическими проявлениями, поэтому в каждом конкретном случае следует стремиться к точному нозологическому диагнозу.
В данной главе рассматривается диагностический поиск при системной красной волчанке, системной склеродермии, дерматомиозите.
Системная красная волчанка
Системная красная волчанка (СКВ) — системное аутоиммунное заболевание лиц молодого возраста (преимущественно женщин), развивающееся на фоне генетически обусловленного несовершенства иммунорегуляторных процессов, приводящего к неконтролируемой продукции антител к собственным клеткам и их компонентам, с развитием аутоиммунного и иммуно- комплексного хронического поражения [Насонова В.А., 1989]. Сущность заболевания состоит в иммуновоспалительном поражении соединительной ткани и микроциркуляторного русла, кожи, суставов и внутренних органов (при этом висцеральные поражения являются ведущими, определяя течение и прогноз болезни).
СКВ, по данным разных авторов, встречается с частотой 2,7—4,8 на 100 ООО населения, в молодом и среднем возрасте соотношение больных женщин и мужчин 9:1 (в детском возрасте или после менопаузы соотношение уменьшается до 2:1). Это обстоятельство подтверждает предположение, что в возникновении и развитии СКВ определенная роль принадлежит половым гормонам. Хотя заболевание у мужчин развивается значительно реже, протекает оно столь же тяжело, как и у женщин.
СКВ принадлежит к генетически детерминированным заболеваниям: исследования популяции показали, что предрасположенность к возникновению СКВ связана с определенными генами П класса гистосовместимо-сти (HLA), генетически обусловленным дефицитом отдельных компонентов комплемента, а также полиморфизмом генов некоторых рецепторов и фактором некроза опухоли а (ФНО-а).
Этиология. Конкретный этиологический фактор при СКВ не установлен, однако ряд клинических проявлений (цитопенический синдром, эритема и энантема) и определенные закономерности болезни позволяют сближать СКВ с заболеваниями вирусной этиологии. В настоящее время придается значение вирусам, принадлежащим к РНК-группе (так называемые медленные, или латентные, вирусы). Обнаружение семейных случаев заболевания, частое выявление в семьях других ревматических или аллергических заболеваний, различных нарушений иммунитета позволя- 526 ют думать о возможном значении еемеино-генетичеекои предрасположенности.
Выявлению СКВ способствует целый ряд неспецифических факторов — инсоляция, неспецифическая инфекция, введение сывороток, прием некоторых лекарственных средств (в частности, периферических вазодила- таторов из группы гидралазинов), стресс. СКВ может начаться после родов, перенесенного аборта. Все эти данные позволяют рассматривать СКВ как мультифакториальное заболевание.
Патогенез. Вследствие воздействия на иммунную систему вируса (а возможно, и противовирусных антител) на фоне наследственной предрасположенности возникает дисрегуляция иммунного ответа, что приводит к гиперреактивности гуморального иммунитета. В организме больных происходит неконтролируемая продукция антител к различным тканям, клеткам, белкам организма (в том числе к различным клеточным органеллам и к ДНК). Установлено, что при СКВ вырабатываются аутоантитела только примерно к 40 из более 200 потенциальных антигенных клеточных компонентов. В последующем происходит образование иммунных комплексов и отложение их в различных органах и тканях (преимущественно в микроциркуляторном русле). Характерны разнообразные дефекты иммунорегуля-ции, характеризующиеся гиперпродукцией цитокинов (ИЛ-6, ИЛ-4 и ИЛ-10). Далее разыгрываются процессы, связанные с элиминацией фиксированных иммунных комплексов, что приводит к высвобождению лизосом-ных ферментов, повреждению органов и тканей и развитию иммунного воспаления. В процессе воспаления и деструкции соединительной ткани высвобождаются новые антигены, в ответ на которые формируются антитела, образуются новые иммунные комплексы, и, таким образом, создается порочный круг, обеспечивающий хронизацию заболевания.
Классификация. В настоящее время в нашей стране [Насонова В.А., 1972—1986] принята рабочая классификация клинических вариантов течения СКВ, учитывающая: 1) характер течения; 2) активность патологического процесса; 3) клинико-морфологическую характеристику поражения органов и систем.
Характер течения болезни:
острое, подострое, хроническое (рецидивирующий полиартрит, синдром дискоидной волчанки, синдром Рейно, синдром Верльгофа, синдром Шегрена).
Фаза и степень активности процесса.
Фаза активная: высокая активность (III), умеренная (II), минимальная (I).
Фаза неактивная (ремиссия).
Клинико-морфологическая характеристика поражений:
• кожи (симптом «бабочки», капилляриты, экссудативная эритема, пурпура, дискоидная волчанка и др.);
• суставов (артралгии, острый, подострый и хронический полиартрит);
• серозных оболочек (полисерозит: плеврит, перикардит, переспле- нит);
• сердца (миокардит, эндокардит, недостаточность митрального клапана);
• легких (острый, хронический пневмонит, пневмосклероз);
• почек (люпус-нефрит нефротического или смешанного типа; мочевой синдром);
• нервной системы (менингоэнцефалополирадикулоневрит, полиневрит).
Выделяют острое, подострое и хроническое течение болезни. Острое течение: внезапное начало — больные могут указать день, когда началась лихорадка, полиартрит, появились изменения на коже. В ближайшие 3—6 мес развиваются полисиндромность, гломерулонефрит (люпус-нефрит), поражение ЦНС. Продолжительность заболевания без лечения не более 1—2 лет, однако при своевременном распознавании и активном лечении глюкокортикостероидами и многолетней поддерживающей терапии можно добиться полной ремиссии. Этот вариант болезни наблюдается преимущественно у подростков, детей и молодых.
Подострое течение: встречается наиболее часто, начинается как бы исподволь, с общих симптомов, артралгий, рецидивирующих артритов, разнообразных неспецифических поражений кожи. Отчетлива волнообраз-ность течения. Развернутая картина болезни формируется через 2—3, реже — через 3—4 года.
Хроническое течение: заболевание длительное время проявляется рецидивами различных синдромов — полиартрита, реже полисерозита, синдромом дискоидной волчанки, синдромом Рейно. На 5—10-м году болезни присоединяются другие органные поражения (почки, легкие).
При хроническом течении болезни у 20—30 % больных развивается так называемый антифосфолипидный синдром, представляющий клинико-лабо- раторный симптомокомплекс (венозные и/или артериальные тромбозы, различные формы акушерской патологии, тромбоцитопения и разнообразные поражения органов). Характерный иммунологический признак — антитела, реагирующие с фосфолипидами и фосфолипидсвязывающими белками (более детально о антифосфолипидном синдроме будет сказано далее).
Выделяют также три степени активности патологического процесса, т.е. выраженность потенциально обратимого иммуновоспалительного повреждения, определяющая характер терапии у каждого конкретного больного. Активность следует отличать от «тяжести» болезни, под которой понимают совокупность необратимых изменений, потенциально опасных для жизни больного.
Клиническая картина. Проявления болезни чрезвычайно разнообразны, что определяется множественностью поражения органов и систем, характером течения, фазой и степенью активности воспалительного процесса.
На I этапе диагностического поиска получают информацию, на основании которой можно составить представление: 1) о варианте начала заболевания; 2) о характере течения болезни; 3) о степени вовлечения в патологический процесс тех или иных органов и систем; 4) о проводимом ранее лечении и его эффективности, а также возможных осложнениях лечения.
Варианты начала болезни могут быть разнообразными. Наиболее часто болезнь начинается с сочетания различных синдромов; моносимптомное начало, как правило, нехарактерно. В связи с этим предположение о возможности СКВ возникает с того момента, как у больного выявлено такое сочетание, что чрезвычайно важно для диагностики СКВ.
В раннем периоде СКВ наиболее частыми являются синдромы поражения суставов, кожи, серозных оболочек, а также лихорадка. Таким образом, наиболее «подозрительными» в отношении СКВ будут разнообразные сочетания: 1) лихорадка, полиартрит, трофические изменения кожи (в частности, выпадение волос — алопеция); 2) полиартрит, лихорадка, поражение плевры (плеврит); 3) лихорадка, трофические нарушения кожи, пора- 528 зкения плевры. Диагностическая значимость этих сочетаний в существенной мере повышается, если поражение кожи заключается в развитии эритемы, однако в начальном периоде болезни эритема встречается лишь в 25 % случаев; все же это обстоятельство не снижает диагностического значения перечисленных сочетаний.
Малосимптомное начало болезни нехарактерно, однако отмечен дебют СКВ с развития массивных отеков вследствие развития с самого начала патологического процесса диффузного гломерулонефрита (люпус-нефрита) нефротического или смешанного типа.
Вовлечение в патологический процесс различных органов проявляется симптомами их воспалительного поражения: артрит, миокардит, перикардит, пневмонит, гломерулонефрит, полиневрит и пр.
Сведения о проводимом ранее лечении позволяют судить: 1) об его адекватности; 2) об остроте течения болезни и степени активности процесса (начальные дозы кортикостероидов, длительность их применения, поддерживающие дозы, включение в лечебный комплекс цитостатиков при выраженных иммунных нарушениях, высокой активности люпус-нефрита и т.д.); 3) о наличии осложнений кортикостероидной и цитостатической терапии.
На I этапе могут быть сделаны определенные выводы относительно диагноза при длительном течении болезни, однако в дебюте болезни диагноз устанавливается на последующих этапах исследования.
На II этапе диагностического поиска можно получить много данных, свидетельствующих о поражении органов и степени их функциональной недостаточности.
Поражение опорно-двигательного аппарата проявляется полиартритом, напоминающим ревматоидный артрит (РА), симметричным поражением мелких суставов кисти (проксимальных межфаланговых, пястно-фаланго-вых, лучезапястных) и крупных суставов (реже). При развернутой клинической картине болезни определяется дефигурация суставов, обусловленная периартикулярным отеком. С течением болезни развиваются деформации мелких суставов. Поражение суставов может сопровождаться диффузными миалгиями, очень редко — истинным полимиозитом с отеком и слабостью мышц. Иногда возникают лишь артралгий.
Кожные покровы поражаются так же часто, как и суставы. Наиболее типичны эритематозные высыпания на лице в области скуловых дуг и спинки носа («бабочка»). Повторяющие очертания «бабочки» воспалительные высыпания на носу и щеках наблюдаются в различных вариантах: 1) сосудистая (васкулитная) «бабочка» — нестойкое, пульсирующее, разлитое покраснение кожи с цианотичным оттенком в средней зоне лица, усиливающееся при воздействии внешних факторов (инсоляция, ветер, холод) или волнении; 2) «бабочка» типа центробежной эритемы (изменения кожи локализуются только в области переносицы). Кроме «бабочки», могут наблюдаться дискоидные высыпания — эритематозные приподнимающиеся бляшки с кератическим нарушением и последующей атрофией кожи лица, конечностей и туловища. Наконец, у части больных наблюдают неспецифическую экссудативную эритему на коже конечностей, грудной клетки, признаки фотодерматоза на открытых частях тела.
К поражениям кожных покровов относят капилляриты — это мелкоточечная геморрагическая сыпь на подушечках пальцев рук, ногтевых ложах, ладонях. Кожные поражения могут сочетаться с энантемой на твердом небе. На слизистой оболочке рта или носоглоточной области могут обнаруживаться безболезненные изъязвления.
Серозные оболочки поражаются у 90 % больных (классическая диагностическая триада: дерматит, артрит, полисерозит). Особенно часто выявляют поражение плевры, перикарда, реже — брюшины. Симптоматика плеврита и перикардита описана в предыдущих разделах «Руководства», подчеркнем лишь ее особенности при СКВ: 1) чаще встречаются сухой плеврит и перикардит; 2) при выпотных формах количество экссудата невелико; 3) поражение серозных оболочек длится кратковременно и обычно диагностируется ретроспективно при рентгенологическом исследовании по плевроперикардиальным спайкам или утолщению костальной, междолевой, медиастинальной плевры; 4) отмечается выраженная тенденция к развитию слипчивых процессов (всевозможные сращения и облитерации серозных полостей).
Поражение сердечно-сосудистой системы весьма характерно для СКВ и наблюдается на различных этапах болезни.
Наиболее часто возникают перикардиты, имеющие тенденцию к рецидивам. Значительно чаше, чем это представлялось прежде, поражается эндокард в виде бородавчатого эндокардита (волчаночный эндокардит) на створках митрального, а также аортального или трехстворчатого клапанов. При длительном течении процесса на II этапе можно выявить признаки недостаточности соответствующего клапана (признаков стенозирования отверстия, как правило, не отмечается).
Очаговый миокардит практически никогда не распознается, однако диффузный миокардит, протекающий тяжело, дает определенную симптоматику (см. «Миокардит»),
Поражение сосудов может проявляться в виде синдрома Рейно: приступообразно развивающиеся нарушения артериального кровоснабжения кистей и/или стоп, возникающие под воздействием холода или волнений. Во время приступа отмечаются парестезии, кожа пальцев становится бледной и/или цианотичной, пальцы холодные. Поражаются преимущественно II—V пальцы кистей и стоп, реже другие дистальные участки тела (нос, уши, подбородок и ДР-)-
Поражения легких могут быть обусловлены основным заболеванием и вторичной инфекцией. Воспалительный процесс в легких (пневмонит) протекает либо остро, либо тянется месяцами и проявляется, как и при пневмонии, признаками синдрома воспалительной инфильтрации легочной ткани (следует отметить особенность процесса в виде малопродуктивного кашля в сочетании с одышкой). Другой вариант поражения легких — хронические интерстициальные изменения (воспаление периваску-лярной, перибронхиальной и междольковой соединительной ткани), проявляющиеся медленно прогрессирующей одышкой и изменениями легких при рентгенологическом исследовании; физикальные изменения практически отсутствуют, так что судить о подобном поражении легких на II этапе диагностического поиска практически невозможно.
Поражение пищеварительного тракта проявляется в основном субъективными признаками, выявляемыми на I этапе. При физикальном исследовании иногда можно обнаружить неопределенную болезненность в эпигастрии и в области проекции поджелудочной железы, а также стоматит. В ряде случаев развивается гепатит: при обследовании отмечают увеличение печени, ее болезненность.
Наиболее часто при СКВ поражаются почки (волчаночный гломерулонефрит или люпус-нефрит), от эволюции которого зависит дальнейшая судьба больного. Поражение почек при СКВ может протекать в виде различных вариантов, поэтому данные непосредственного обследования больного могут широко варьировать. При изолированной патологии мочевого осадка не обнаруживают каких-либо изменений во время физи-кального исследования; при гломерулонефрите, протекающем с нефроти-ческим синдромом, определяются массивные отеки, нередко АГ. В случае формирования хронического нефрита с постоянной АГ выявляют увеличение левого желудочка, акцент II тона во втором межреберье справа от грудины.
Аутоиммунная тромбоцитопения (синдром Верлъгофа) проявляется типичными геморрагическими высыпаниями различной величины на коже внутренней стороны конечностей, груди, живота, на слизистых оболочках. Наблюдаются также кровотечения после незначительных травм, например после экстракции зуба, носовые кровотечения, изредка имеющие профуз-ный характер и приводящие к анемизации. Кожные кровоизлияния приобретают со временем различную окраску (сине-зеленоватую, бурую, желтую). СКВ может длительно проявляться лишь синдромом Верльгофа без других типичных для СКВ клинических симптомов.
Поражение нервной системы выражено в различной степени у многих больных во всех фазах болезни, так как в патологический процесс вовлекаются практически все отделы нервной системы. Больные предъявляют жалобы на головные боли типа мигрени, могут быть судорожные припадки. Возможны нарушения мозгового кровообращения (вплоть до развития инсульта). При непосредственном обследовании больного обнаруживают признаки полиневрита с нарушением чувствительности, болезненностью нервных стволов, снижением сухожильных рефлексов, парестезиями. Органический мозговой синдром характеризуется эмоциональной лабильностью, эпизодами депрессии, нарушением памяти, слабоумием.
Отмечается увеличение всех групп лимфатических узлов, селезенки, печени (обычно умеренное) при генерализации процесса.
Поражение органа зрения проявляется в виде сухого кератоконъюнкти- вита, что обусловлено патологическими изменениями слезных желез и нарушением их функции. Сухость глаз приводит к развитию конъюнктивита, эрозий роговицы или кератита с нарушением зрения.
При антифосфолипидном синдроме дополнительно к указанной клинической картине могут выявляться тромбозы — венозные (в глубоких венах нижних конечностей с повторными тромбоэмболиями легочной артерии), артериальные (в артериях головного мозга, приводящие к инсультам и транзиторным ишемическим атакам). Со стороны сердца могут выявляться клапанные пороки, внутрисердечные тромбы (имитирующие миксому сердца), тромбозы коронарных артерий с развитием инфаркта миокарда. Поражения кожи при антифосфолипидном синдроме разнообразны, наиболее частое из них — livedo reticularis.
Таким образом, после II этапа исследования выявляется полиорган-ность поражения, причем степень поражения органов весьма различна: от едва заметных клинических (даже субклинических) до выраженных, значительно превалирующих над остальными, что создает предпосылки для диагностических ошибок вследствие интерпретации этих изменений как проявление самостоятельных заболеваний (например, гломерулонефрита, миокардита, артрита).
Этап III диагностического поиска при СКВ имеет очень большое значение, так как: 1) помогает поставить окончательный диагноз; 2) демонстрирует выраженность иммунных нарушений и степень поражения внутренних органов; 3) выявляет степень активности патологического (волчаноч-ного) процесса.
На III этапе наибольшее значение имеют лабораторные исследования крови. Выделяют две группы показателей:
1) непосредственно имеющие диагностическое значение (обнаруживающие выраженные иммунные нарушения):
а) LE-клетки (клетки красной волчанки) — зрелые нейтрофилы, фаго цитирующие ядерные белки других клеток крови, распавшихся под воздей ствием антинуклеарного фактора;
б) антинуклеарный фактор (АНФ) — гетерогенная популяция аутоантител, реагирующих с различными компонентами клеточного ядра и цирку лирующих в крови (в высоком титре — 1:32 и выше, выявляется у 95 % больных); отсутствие АНФ в подавляющем большинстве случаев не под тверждает диагноз СКВ;
в) антитела к нативной (т.е. к целой молекуле) ДНК; повышение их концентрации коррелирует с активностью заболевания и развитием волча- ночного нефрита;
г) антитела к Sm-ядерному антигену, Ro/La рибонуклеопротеину; эти антитела рассматриваются как специфичные для СКВ (они обнаруживают ся методом иммунофлюоресценции в 30 %, а методом гемагглютина- ции — в 20 % случаев);
д) феномен «розетки» — лежащие свободно измененные ядра в тканях (гематоксилиновые тельца), окруженные лейкоцитами;
е) диагностика антифосфолипидного синдрома при СКВ основана на определении «волчаночных антикоагулянтов» — специфических антител к фосфолипидам, которые выявляются при определении свертываемости крови с помощью функциональных тестов (увеличенное тромбопластино- вое время) и антител к кардиолипину с помощью иммуноферментного ме тода. Сам термин «волчаночный антикоагулянт» неверен, так как главным клиническим проявлением присутствия указанных антител является тром боз (а не кровотечение).
Данные антитела обнаруживаются и при так называемом первичном антифосфолипидном синдроме — самостоятельном заболевании, при котором наблюдаются тромбозы, акушерская патология, тромбоцитопения, сетчатое ливедо, аутоиммунная гемолитическая анемия.
2) Неспецифические острофазовые показатели, к которым относятся:
а) диспротеинемия с повышением содержания ос2- и у-глобулинов в сы воротке крови;
б) появление С-реактивного белка;
в) увеличение содержания фибриногена;
г) увеличение СОЭ.
При выраженных суставных поражениях может обнаруживаться в небольшом титре РФ (ревматоидный фактор) — антитело к Fc-фрагменту IgG. РФ выявляется с помощью реакции Ваалера—Розе или латекс-теста.
При исследовании периферической крови может выявляться лейкопения, часто выраженная (1—1,2109/л крови), со сдвигом лейкоцитарной формулы крови до метамиелоцитов и миелоцитов в сочетании с лимфопе-нией (5—10 % лимфоцитов). Обнаруживается умеренная гипохромная анемия, в некоторых случаях — гемолитическая анемия (с желтухой, ретикуло-цитозом, положительной пробой Кумбса). Также редко наблюдается тромбоцитопения, проявляющаяся геморрагическим синдромом.
Для поражения почек характерны изменения в моче, которые можно классифицировать следующим образом [Тареева И.Е., 1983]:
1) субклиническая протеинурия (содержание белка в моче 0,5 г/сут, часто в сочетании с небольшой лейкоцитурией и эритроцитурией);
2) более выраженная протеинурия, являющаяся выражением нефрит ческого синдрома, сопровождающего подострый или активный волчаночный нефрит. Очень высокая протеинурия (как при амилоидозе) встречается редко. Отмечается умеренная гематурия. Лейкоцитурия может быть следствием как волчаночного воспалительного процесса в почках, так и нередкого присоединения вторичной инфекции мочевых путей. Очень высокая лейкоцитурия — следствие вторичной мочевой инфекции.
При пункционной биопсии почек выявляют неспецифические мезангио- мембранозные изменения, часто с фибропластическим компонентом. Характерным является: 1) обнаружение в препаратах свободно лежащих в почечной ткани измененных ядер (гематоксилиновые тельца); 2) капиллярные мембраны клубочков принимают вид «проволочных петель»; 3) отложение иммунных комплексов в виде электронно-плотных депозитов на базальной мембране клубочков в «проволочных петлях», фибриноидных отложениях.
Рентгенологическое исследование выявляет: 1) изменения в суставах при суставном синдроме — эпифизарный остеопороз в суставах кистей и луче- запястных суставах; лишь при хроническом течении артрита и деформациях отмечают сужение суставной щели с подвывихами; 2) изменения в легких при развитии пневмонита; при длительном течении болезни — диско-видные ателектазы, усиление и деформацию легочного рисунка, что сочетается с высоким стоянием диафрагмы; 3) развитие «волчаночного» порока сердца или экссудативного перикардита.
Электрокардиографическое исследование помогает обнаружить неспецифические изменения конечной части желудочкового комплекса (зубец Т и сегмент 57), аналогичные описанным ранее при миокардите и перикардите.
Компьютерная томография (КТ) головного мозга и магнитно-резонансная томография (МРТ) позволяют выявить патологические изменения у больных с поражением ЦНС.
При проведении диагностического поиска необходимо определить степень активности волчаночного процесса (табл. 21).
Диагностика. В случаях классического течения СКВ диагноз прост и основывается на обнаружении «бабочки», рецидивирующего полиартрита и полисерозита, составляющих клиническую диагностическую триаду, дополняемую присутствием LE-клеток или антинуклеарного фактора в диагностических титрах. Вспомогательное значение имеют молодой возраст больных, связь с родами, абортами, началом менструальной функции, инсоляцией, инфекцией. Значительно сложнее установить диагноз в других случаях, особенно если перечисленные выше классические диагностические признаки отсутствуют. В этой ситуации помогают диагностические критерии, разработанные Американской ревматологической ассоциацией (АРА) в 1982 г. и пересмотренные в 1992 г. (табл. 22).
Диагноз достоверен при наличии четырех критериев или более. Если имеется менее четырех критериев, то диагноз СКВ сомнителен и требуется динамическое наблюдение за больным. Такой подход обоснован: он четко предостерегает врача от назначения больным кортикостероидов, так как с такими же симптомами могут протекать и другие заболевания (в том числе паранеопластический синдром), при которых кортикостероиды противопоказаны.
Дифференциальная диагностика. СКВ следует дифференцировать от целого ряда заболеваний. Насколько велик перечень органов и систем, вовлекаемых в патологический процесс при СКВ, настолько же обширен список заболеваний, которые могут быть ошибочно диагностированы у
[Насонова Вл 1989]™аКТИВНОСТИ патологического процесса при СКВ
| Показатель Степень активности
|
вания Яти rrSfinJ60™6" степени может имитировать различные заболе- та™ иии ™™ ОСо&нно чаото встречаются в дебюте заболевания, а оК™е * „/РУЮТМ п°р™ен™ 1-2 органов (систем). Например, ик nSS? ™* 6оЛ,зни n°p™eHra плевры может быть расценено
или HSuLZIMI э™™; миокардит - как ревматический б™ет rWf Сё¥авй<*
диаРнОЗ ТОЛЬКО
Фекгтиолнотлб ЧаСТо Пр^да1051 Дифференцировать от ревматизма, ин- шглскилпиял тИГа^роНического л^^о гепатита (ХАГ), гемор- глуппы даст (тР°м6оЦитопенической пурпуры), других болезней из
Таблица 22. Диагностические критерии СКВ
|
Необходимость дифференциации с ревматизмом возникает, как правило, у подростков и юношей в дебюте заболевания при наличии артрита и лихорадки. Ревматический артрит отличается от волчаночного большей остротой проявлений, преимущественным поражением крупных суставов, скоротечностью. Не следует придавать дифференциально-диагностическое значение предшествующей инфекции — ангине, поскольку она может явиться неспецифическим фактором, вызывающим клинические признаки СКВ. Диагноз ревматизма становится достоверным с момента появления признаков поражения сердца (ревмокардит); последующее динамическое наблюдение позволяет выявить формирующийся порок сердца, тогда как при СКВ, если и возникает недостаточность митрального клапана, то она выражена незначительно, без отчетливых гемодинамических нарушений, митральная регургитация выражена нерезко. В отличие от СКВ в острой стадии ревматизма отмечается лейкоцитоз; LE-клетки, АНФ не обнаруживаются.
Дифференциальный диагноз между СКВ и ревматоидным артритом труден в начальной стадии болезни из-за сходства клинической симптоматики: симметричного поражения мелких суставов кисти, вовлечения в процесс других суставов, «утренней скованности». Дифференциация основывается на преобладании при РА в пораженных суставах пролиферативного компонента, раннего развития гипотрофии мышц, приводящих в движение пораженные суставы, стойкости поражений суставов. Эрозии суставных поверхностей отсутствуют при СКВ, но являются характерным признаком РА. Ревматоидный фактор (РФ) в высоком титре характерен для РА, при СКВ он обнаруживается редко и в невысоком титре. Исключительно сложен дифференциальный диагноз СКВ и висцеральной формы РА. Облегчающим обстоятельством является то, что уточненная диагностика в обоих случаях не влияет на характер лечения (кортикостероидная терапия).
При хроническом активном гепатите (ХАГ) могут развиваться системные проявления в виде лихорадки, артрита, плеврита, кожных высыпаний, гломерулонефрита; обнаруживаются лейкопения, тромбоцитопения, LE- клетки, АНФ. При дифференциации следует учесть: 1) ХАГ развивается чаще в среднем возрасте; 2) в анамнезе больных ХАГ имеется острый вирусный гепатит; 3) при ХАГ выявляются выраженные изменения структуры и функции печени — цитолитический и холестатический синдромы, признаки печеночной недостаточности, гиперспленизм, а затем и портальная гипертензия; 4) при СКВ поражение печени не слишком частое и протекает в виде гепатита легкого течения (с умеренными признаками цитолитического синдрома); 5) при ХАГ выявляются различные маркеры вирусного поражения печени (противовирусные антитела и сам вирусный антиген).
При инфекционном эндокардите (первичном) быстро выявляют поражение сердца (недостаточность аортального или митрального клапана), отчетливый эффект антибиотической терапии, LE-клетки, антитела к ДНК, АНФ, как правило, не обнаруживаются. Своевременно проведенный посев крови позволяет обнаружить рост патогенной микрофлоры.
При тромбоцитопенической пурпуре (идиопатической или симптоматической) отсутствуют многие синдромы, наблюдаемые при СКВ, нет лихорадки, типичных лабораторных признаков (LE-клетки, АНФ, антитела к ДНК).
Наиболее сложна дифференциация с другими нозологическими формами из группы ДЗСТ. Такие заболевания, как системная склеродермия и дерматомиозит, могут иметь много общих черт с СКВ; сложность диагностики усугубляется возможностью обнаружения при этих заболеваниях АНФ и LE- клеток (хотя и в меньшем титре). Основой дифференциации является более частое и более выраженное поражение внутренних органов (в особенности почек) при СКВ, совершенно иной характер поражения кожи при ССД, четкий миопатический синдром при ДМ. Однако в ряде случаев только длительное динамическое наблюдение за больным позволяет поставить правильный диагноз. Иногда на это уходит много месяцев и даже лет, особенно при хроническом течении СКВ с минимальной степенью активности.
Формулировка развернутого клинического диагноза СКВ учитывает все рубрики, приведенные в рабочей классификации заболевания; диагноз должен отражать: 1) характер течения болезни (острое, подострое, хроническое). При хроническом течении (обычно моно- или олигосиндромное) следует указать ведущий клинический синдром; 2) активность процесса; 3) клинико- морфологическую характеристику поражения органов и систем с указанием стадии функциональной недостаточности (например, при люпус-нефрите — стадия почечной недостаточности, при миокардите — наличие или отсутствие сердечной недостаточности, при поражении легких — наличие или отсутствие дыхательной недостаточности и пр.); 4) ука- 536 зание на проводимую терапию (например, кортикоетероидами); 5) осложнения терапии (если они имеются).
Лечение. Учитывая патогенез болезни, больным СКВ показана комплексная патогенетическая терапия, задачами которой являются: 1) подавление иммунного воспаления и иммунокомплексной патологии (неконтролируемого иммунного ответа); 2) предупреждение осложнений иммуносу- прессивной терапии; 3) лечение осложнений, возникающих в процессе проведения иммуносупрессивной терапии; 4) воздействие на отдельные, резко выраженные синдромы; 5) удаление из организма циркулирующих иммунных комплексов и антител.
Прежде всего необходимо исключить психоэмоциональные стрессы, инсоляцию, активно лечить сопутствующие инфекции, потреблять пищу с низким содержанием жира и высоким содержанием полиненасыщенных жирных кислот, кальция и витамина D. В период обострения болезни и на фоне лечения цитостатическими препаратами необходима активная контрацепция. Не следует принимать контрацептивы с высоким содержанием эстрогенов, поскольку они вызывают обострение болезни.
Для подавления иммунного воспаления и иммунокомплексной патологии при лечении СКВ используют основные иммуносупрессоры: кортикостероиды, цитостатические препараты, аминохинолиновые производные. Длительность лечения, величина, выбор препарата, а также поддерживающие дозы определяются: 1) степенью активности заболевания; 2) характером течения (острота); 3) обширностью вовлечения в патологический процесс внутренних органов; 4) переносимостью кортикостероидов или цито-статиков и наличием (или отсутствием) осложнений иммуносупрессивной терапии; 5) наличием противопоказаний.
В начальных стадиях болезни с признаками минимальной активности процесса и преобладанием в клинической картине поражения суставов можно назначать НПВП, однако даже при минимальной активности патологического процесса средством выбора являются ГКС. Больные должны находиться на диспансерном учете с тем, чтобы при первых же признаках обострения заболевания врач своевременно мог назначить кортикостероидную терапию.
При хроническом течении болезни с преимущественным поражением кожи можно применять 0,25 г/сут хингамина (делагила, резохина) или гид- роксихлорохина (плаквенила) в течение многих месяцев. При появлении признаков генерализации процесса (вовлечение в патологический процесс внутренних органов), а также признаков активности необходимо немедленно перейти на более действенную иммуносупрессивную терапию ГКС.
Таким образом, основным методом лечения СКВ является кортикосте- роидная терапия; при ее проведении следует придерживаться следующих принципов:
1) начинать лечение только при достоверном диагнозе СКВ (при подозрении на СКВ кортикостероиды назначать не следует);
2) доза ГКС должна быть достаточной для подавления активности патологического процесса;
3) лечение «подавляющей» дозой следует проводить до наступления выраженного клинического эффекта (улучшение общего состояния, нормализация температуры тела, улучшение лабораторных показателей, положительная динамика органных изменений), обычно для этого требуется приблизительно 2 мес;
4) после достижения эффекта следует постепенно переходить на поддерживающие дозы;
5) обязательна профилактика осложнений кортикостероидной терапии.
Терапия ГКС показана при II и III степени активности патологического процесса, что всегда бывает при подостром и остром течении СКВ. Больным со II степенью активности назначают средние дозы (< 40 мг/сут) в течение 3— 5 нед с постепенным снижении дозы до минимальной поддерживающей.
При III степени назначают большие дозы [1 мг/(кгсут) и более]. Длительность приема больших доз составляет 4—12 нед. Уменьшение дозы следует проводить медленно, под тщательным клинико-лабораторным контролем, а поддерживающие дозы препаратов (10—15 мг) следует принимать многие годы.
Для предупреждения побочных действий ГКС применяют: 1) препараты калия (оротат калия, хлорид калия, панангин); 2) анаболические препараты (метандростенолон по 5—10 мг); 3) мочегонные (салуретики); 4) гипотензивные средства (ингибиторы АПФ); 5) антацидные препараты.
При развитии тяжелых осложнений назначают: 1) антибиотики (при вторичной инфекции); 2) противотуберкулезные препараты (при развитии туберкулеза, чаще всего легочной локализации); 3) препараты инсулина, диету (при развитии сахарного диабета); 4) противогрибковые средства (при кандидозе); 5) курс противоязвенной терапии (при появлении «стероидной» язвы).
Во время кортикостероидной терапии возникают ситуации, когда необходимо введение экстравысоких доз преднизолона (1000 мг внутривенно капельно в течение 30 мин в течение 3 дней): 1) резкое увеличение («всплеск») активности процесса (III степень), несмотря на, казалось бы, адекватно проводимую терапию; 2) резистентность к дозам, с помощью которых ранее достигали положительного эффекта; 3) выраженные органные изменения (нефротический синдром, пневмонит, генерализованный васку-лит, цереброваскулит).
Полагают, что подобная пульс-терапия приостанавливает образование иммунных комплексов за счет торможения синтеза антител к ДНК. Вызванное кортикостероидами понижение уровня антител к ДНК ведет к образованию иммунных комплексов меньших размеров за счет диссоциации более крупных.
Значительное подавление активности процесса после проведения пульс- терапии позволяет в дальнейшем назначать небольшие поддерживающие дозы кортикостероидов. Пульс-терапия наиболее успешна у больных молодого возраста с небольшой длительностью заболевания.
Лечение ГКС не всегда оказывается успешным, что обусловливается: 1) необходимостью снижения дозы при развитии осложнений (хотя такая терапия эффективна у данного больного); 2) непереносимостью препаратов; 3) резистентностью к терапии кортикостероидами (выявляется обычно достаточно рано). В подобных случаях (особенно при развитии пролифера- тивного или мембранозного люпус-нефрита) назначают цитостатики: циклофосфамид (болюсное введение в дозе 0,5—1 г/м2 внутривенно ежемесячно в течение не менее 6 мес, а затем каждые 3 мес в течение 2 лет) в сочетании с 10—30 мг/сут преднизолона. В дальнейшем можно возратиться к терапии ГКС, так как резистентность к ним обычно исчезает.
Для лечения менее тяжелых, но резистентных к ГКС проявлений болезни назначают азатиоприн [1—4 мгДкгсут)] или метотрексат (примерно 15 мг/нед) и циклоспорин [менее 5 мгДкгсут)] в сочетании с невысокими дозами преднизолона (10—30 мг/сут).
Критериями оценки эффективности применения цитостатиков служат. 1) уменьшение или исчезновение клинических признаков; 2) исчезнове- 538
ние стероидорезистентности; 3) стойкое снижение активности процесса; 4) предотвращение прогрессирования люпус-нефрита.
Осложнения цитостатической терапии: 1) лейкопения; 2) анемия и тромбоцитопения; 3) диспепсические явления; 4) инфекционные осложнения.
При появлении лейкопении (лейкоцитов менее 3,0 109/л) дозу препарата следует снизить до 1 мг/кг, а при дальнейшем нарастании лейкопении препарат отменяют и увеличивают дозу преднизолона на 50 %.
В последние годы широкое распространение получили экстракорпоральные методы лечения — плазмаферез, гемосорбция. Эти методы позволяют удалять из организма циркулирующие иммунные комплексы, повышать чувствительность клеточных рецепторов к ГКС, уменьшать интоксикацию. Их применяют при генерализованном васкулите, тяжелом органном поражении (люпус-нефрит, пневмонит, цереброваскулит), а также при выраженных иммунных нарушениях, плохо поддающихся кортикостероидной терапии.
Обычно экстракорпоральные методы применяют в сочетании с пульс- терапией или же самостоятельно, если пульс-терапия неэффективна. Следует отметить, что при цитопеническом синдроме экстракорпоральные методы не используют.
У больных с высоким уровнем антифосфолипидных антител в сыворотке крови (но без клинических проявлений антифосфолипидного синдрома) применяют небольшие дозы ацетилсалициловой кислоты (75 мг/сут). При достоверном антифосфолипидном синдроме (с клиническими проявлениями) назначают гепарин и малые дозы аспирина.
Прогноз. В последние годы в связи с эффективными методами лечения прогноз улучшился (примерно у 90 % больных удается добиться ремиссии). Однако у 10 % больных, особенно при поражении почек (смерть наступает вследствие прогрессирования ХПН) или при цереброваскулите, прогноз неблагоприятен.
Профилактика. Своевременная адекватная терапия обеспечивает предупреждение рецидивов болезни. Для первичной профилактики выцеляют группу «угрожаемых» лиц, к которым относятся прежде всего родственники больных, а также лица, страдающие изолированным кожным поражением (дискоидная волчанка). Эти лица должны избегать инсоляции, переохлаждения, не должны подвергаться прививкам, им не показаны грязелечение и другие бальнеопроцедуры.
Системная склеродермия
Системная склеродермия (ССД) — системное заболевание соединительной ткани и мелких сосудов, характеризующееся воспалением и распространенными фиброзно-склеротическими изменениями кожи и висцеральных органов. Это определение болезни отражает существо ССД — фиброзную «трансформацию» соединительной ткани, являющейся «каркасом» внутренних органов, составным элементом кожи и кровеносных сосудов. Подобное безудержное развитие фиброза связано с избыточным коллаге- нообразованием в связи с нарушением функционирования фибробластов.
Частота болезни колеблется от 0,6 до 19 на 1 млн населения в год. Заболевание чаще встречается у женщин (соотношение 3:1) в возрасте 30—60 лет.
Этиология. Причина развития болезни неизвестна. Придается значение вирусам, так как имеются косвенные свидетельства о их роли в возникновении ССД: обнаружены вирусоподобные включения в пораженных тканях и повышенные титры антивирусных антител. Установлена семейно-генети- ческая предрасположенность к ССД, так как у родственников больных обнаруживают изменения белкового обмена в виде гипергаммаглобулинемии, синдром Рейно, а иногда и ССД.
К неблагоприятным факторам, способствующим проявлению болезни и ее обострениям, следует отнести факторы внешней среды (длительный контакт с поливинилхлоридом, кремниевой пылью), лекарственные средства (блеомицин, L-триптофан), а также охлаждение, травмы, нарушение нейроэндокринных функций, профессиональный фактор в виде вибрации.
Патогенез. В основе патогенеза лежит нарушение процесса взаимодействия различных клеток (эндотелиальных, гладкомышечных клеток сосудистой стенки, фибробластов, Т- и В-лимфоцитов, моноцитов, тучных клеток, эозинофилов) друг с другом и с компонентами соединительнотканного матрикса. Результатом всего перечисленного является селекция популяции фибробластов, устойчивых к апоптозу и функционирующих в автономном режиме максимальной синтетической активности, что активирует неофибриллогенез и способствует изменению гликопротеидов основного вещества соединительной ткани. В результате развиваются фиброзно- склеротические изменения соединительной ткани. Параллельно происходит дисрегуляция иммунного ответа организма на внедрение вируса, что проявляется гиперпродукцией антител к собственным тканям (аутоантите-ла). Затем формируются иммунные комплексы, оседающие в микроцирку- ляторном русле и внутренних органах, что приводит к развитию иммунного воспаления, однако выраженность иммунных и аутоиммунных нарушений при ССД не столь велика, как при СКВ.
Фиброзно-склеротические изменения соединительной ткани, поражение сосудов и внутренних органов (на основе иммунного воспаления) обусловливают многообразие клинических проявлений заболевания (схема 23).
Классификация. В нашей стране принята рабочая классификация ССД, учитывающая характер течения, стадию развития болезни и клинико-мор- фологическую характеристику поражения органов и систем.
Характер течения.
Быстропрогрессирующее.
Хроническое.
Стадия: I. Начальная. II.
Генерализованная.
III. Терминальная.
Клинике-морфологическая характеристика поражения.
Кожа и периферические сосуды (плотный отек, индурация, гиперпигментация, телеангиэктазии, синдром Рейно).
Опорно-двигательный аппарат (артралгии, полиартрит, псевдоартрит, полимиозит, кальциноз, остеолиз).
Сердце (миокардиодистрофия, кардиосклероз, порок сердца — чаше всего недостаточность клапана).
Легкие (интерстициальная пневмония, склероз, адгезивный плеврит).
Пищеварительная система (эзофагит, дуоденит, спруподобный синдром).
Почки (истинная склеродермическая почка, хронический диффузны гломерулонефрит, очаговый гломерулонефрит).
а 23. ПАТОГЕНЕЗ СИСТЕМНОЙ СКЛЕРОДЕРМИИ

|
Нервная система (полиневрит, нейропсихические расстройства, вегетативные нарушения).
В последние годы стали выделять «пресклеродермию», «диффузную кожную склеродермию», «ограниченную (лимитированную) склеродермию», включающую синдром CREST (об этом синдроме будет сказано ниже), и «склеродерму без склеродермии» (этот вариант весьма редок — не более 5 % от числа всех больных с ССД).
Для хронического течения (наиболее частого при ССД) характерны прогрессирующие вазомоторные нарушения по типу синдрома Рейно и обусловленные ими трофические расстройства, что является единственным проявлением заболевания в течение многих лет. В дальнейшем присоединяются уплотнение кожи и периартикулярных тканей с образованием ос- теолиза и медленно прогрессирующие склеротические изменения внутренних органов (пищевода, сердца, легких).
Быстропрогрессирующее течение характеризуется тяжелыми фиброзными периферическими и висцеральными поражениями уже в первый год болезни и нередким поражением почек по типу истинной склеродермической Почки (что является наиболее частой причиной смерти больных).
Учитывая прогрессирующий характер болезни, для оценки эволюции и степени нарастания патологического процесса выделяют три стадии течения.
Стадия I — начальных проявлений — преимущественно суставные изменения при подостром течении и вазоспастические — при хроническом.
Стадия II — генерализации процесса — полисиндромность и полисистемность поражения многих органов и систем.
Стадия III — терминальная — преобладание тяжелых склеротических, дистрофических или сосудисто-некротических процессов, нередко с отчетливыми нарушениями функции одного или нескольких органов.
Клиническая картина. Болезнь отличается полиморфностью и полисин- дромностью, отражая генерализованный характер заболевания в целом. Практически нет органа или системы, которые не вовлекаются в патологический процесс.
На I этапе диагностического поиска получают информацию, на основании которой можно составить представление о диагнозе и варианте начала болезни, характере течения процесса, вовлечении в патологический процесс различных органов, проводимом ранее лечении и его эффективности, а также осложнениях.
Чаще болезнь начинается с поражения кожи, затем постепенно присоединяется поражение органов (типичная форма); в других случаях (атипичная форма) в клинической картине с самого начала доминирует поражение внутренних органов при минимальных кожных проявлениях, что затрудняет диагностику. По мере течения болезни можно составить представление о характере течения (острое, подострое, хроническое).
Жалобы больных при вовлечении в патологический процесс внутренних органов соответствуют субъективным симптомам при том или ином их поражении (плеврит, артрит, синдром Рейно, дуоденит и пр.). Вместе с тем больные могут предъявлять жалобы, наиболее часто встречающиеся именно при ССД: затруднение глотания и поперхивания при глотании (в результате поражения верхней части пищевода). Вазоспастические нарушения при синдроме Рейно не ограничиваются пальцами рук, а распространяются на кисти, стопы, нередко больные испытывают чувство онемения в области губ, какой-либо части лица, кончика языка, предъявляют жалобы на сухость слизистой оболочки рта, конъюнктивы, невозможность плакать («нет слез»). Поражение кожи лица проявляется ощущением «стянутости» кожи и рта (трудно открыть рот). Как правило, температура тела не повышена. Похудение (иногда значительное) отмечается обычно при прогресси-ровании и генерализации болезни.
После I этапа (при длительном течении ССД) можно сделать предварительное заключение о диагнозе, однако в самом начале болезни сделать это бывает крайне трудно, так как проявления ССД существенно напоминают другие заболевания из группы диффузных заболеваний соединительной ткани (СКВ, РА, ДМ), а при моно(олиго)синдромности — другие заболевания, характеризующиеся поражением лишь одного органа (сердце, легкие и пр.).
На II этапе диагностического поиска получают данные, свидетельствующие о поражении органов и систем и их функциональной недостаточности. При развернутой клинической картине болезни поражение кожи наблюдается у подавляющего большинства больных и выражается в последовательном развитии отека, индурации, а затем атрофии (с преимущественной локализацией на лице и кистях). Возможны также трофические изменения кожи в виде депигментации, подчеркнутого сосудистого рисунка и телеангиэктазий. Поражение слизистых оболочек выражается в повышенной сухости. На коже могут появляться изъязвления, гнойничковая сыпь; волосы выпадают, ногти деформируются. В конечной стадии болез- 542 ни кожа лица становится плотной, не берется в складку, лицо амимично, маскообразно. Характерная форма рта: губы тонкие, собраны в нерасправ- ляюшиеся складки, постепенно теряется способность широко раскрывать рот (симптом «кисета»),
Вазоспастические изменения при синдроме Рейно в виде побеления кожной поверхности отмечаются в области лица, губ, кистей и стоп.
Изменение суставов проявляется в их дефигурации за счет преимущественного поражения периартикулярных тканей, а также истинного склеродер- мического полиартрита с преобладанием экссудативно-пролиферативных или фиброзно-индуративных изменений. Характерно развитие «склеродер- мической кисти»: укорочение пальцев (вследствие остеолиза ногтевых фаланг), истончение их кончиков, деформация ногтей, легкие сгибательные контрактуры. Такую кисть сравнивают с птичьей лапой (склеродактилия).
Поражение мышц, морфологически представляя собой фиброзный ин- терстициальный миозит или миозит с дистрофическими и некротическими изменениями, выражается в миастеническом синдроме, атрофии, уменьшении мышечной массы и нарушении движений. В мышцах возможны болезненные уплотнения (кальцинаты). Особенно часто отложения солей кальция наблюдаются в мягких тканях пальцев рук.
Поражение пищеварительного тракта: эзофагит, дуоденит, синдром нарушенного всасывания или упорные запоры — в основном выявляется на I и III этапах диагностического поиска.
Поражение органов дыхания выражается в виде пневмонита, протекающего остро или хронически, вяло. Физикальные данные крайне скудны, в выраженных случаях выявляют только эмфизему легких. Значительно большую информацию дает рентгенологическое исследование, оказывающее существенную помощь при выявлении двустороннего базального пневмосклероза, характерного для ССД.
При выраженном пневмосклерозе и длительном его существовании развивается легочная гипертензия, приводящая вначале к гипертрофии правого желудочка, а затем к его недостаточности. Легочная гипертензия проявляет себя цианозом, акцентом II тона во втором межреберье слева от грудины, одышкой, резким снижением толерантности к физической нагрузке, резким усилением пульсации в эпигастрии (обусловленной гипертрофией правого желудочка).
Поражение сердца занимает основное место среди висцеральных проявлений ССД как по частоте, так и по влиянию на исход болезни. Для ССД характерен так называемый первичный кардиосклероз, не связанный с предшествующими некротическими или воспалительными изменениями миокарда. Отмечают увеличение сердца (иногда значительное), а также нарушения сердечного ритма (экстрасистолия или мерцательная аритмия). Поражение эндокарда приводит к развитию порока сердца, практически всегда — к митральной недостаточности. Сочетание кардиосклероза и митральной недостаточности может обусловить в ряде случаев развитие сердечной недостаточности со всеми характерными ее признаками. Перикардит при ССД наблюдается редко и протекает чаще как сухой.
Поражение мелких сосудов — «склеродермическая ангиопатия» — проявляется в виде вазомоторных нарушений (синдром Рейно) и характеризующихся пароксизмальным вазоспазмом с характерной последовательностью изменений окраски кожи пальцев (побеление, цианоз, покраснение) и сопровождающихся ощущением напряжения и болезненностью. В выраженных случаях синдром Рейно приводит к кровоизлияниям, некрозу тканей пальцев, телеангиэктазиям.
Поражение почек при ССД (у 80 % больных) обусловлено патологией сосудов (но не развитием фиброза). Наиболее тяжелое проявление — скле- родермический почечный криз, обычно развивающийся в первые 5 лет болезни у больных с диффузной формой ССД и проявляющийся в виде злокачественной АГ (АД > 170/130 мм рт. ст.), быстропрогрессирующей почечной недостаточности, гиперренинемии (у 90 % больных) и неспецифических признаков (одышка, головные боли, судороги). При поражении почек (изолированная патология мочевого осадка) физическое исследование не выявляет никаких существенных патологических признаков.
В основе поражения нервной системы лежат сосудистые, дистрофические и фиброзные изменения, проявляющиеся симптоматикой полиневрита с нарушением рефлексов и чувствительности.
Таким образом, после II этапа выявляется полиорганность поражения с преимущественным поражением кожи и ее дериватов. Степень выявленных изменений весьма различная — от субклинических до значительно выраженных. Возможность постановки диагноза ССД при преимущественном поражении кожи более высокая, чем в случаях преобладания висцеральных поражений. В последнем случае имеются предпосылки для диагностических ошибок, если на первый план выступает поражение какого-нибудь одного органа (почки, сердце).
На III этапе диагностического поиска можно: 1) определить степень активности процесса; 2) уточнить выраженность поражения внутренних органов; 3) провести дифференциальную диагностику с другими заболеваниями из группы хронических диффузных поражений соединительной ткани.
В определении степени активности наибольшее значение имеют неспецифические острофазовые показатели, к которым относятся: а) диспротеи- немия с повышением уровня а2- и у-глобулинов; б) появление СРВ; в) увеличение содержания фибриногена; г) повышение СОЭ.
О наличии и выраженности иммунных нарушений можно судить по обнаружению ревматоидного фактора (выявляется в 40—50 % случаев), анти- нуклеарных антител (в 30—80 %), LE-клеток (в 2—7 % случаев). В отличие от СКВ все эти показатели при ССД выявляются в значительно меньшем титре и реже.
Наибольшее диагностическое значение придают так называемым скле- родермическим антителам:
• антитело Scl-70 выявляют чаще при диффузных формах ССД (40 %); присутствие данного антитела в сочетании с носительством HLA-DR3/DRw52 является прогностически неблагоприятным фактором у больных с синдромом Рейно, увеличивая риск развития легочного фиброза при ССД в 17 раз;
• антитело к центромере (центромера является элементом хромосомы) обнаруживают у 205 больных (большинство из них имеет признаки CREST- синдрома).
Из прочих показателей, указывающих на нарушение обмена коллагена, следует отметить увеличение содержания оксипролина в моче и крови.
При поражении почек наблюдается выраженная в той или иной степени протеинурия в сочетании с минимальными изменениями мочевого осадка (микрогематурия, цилиндрурия). При «истинной склеродермическои почке» (развитие некрозов почечной ткани вследствие поражения почеч ных сосудов) может возникнуть острая почечная недостаточность с уьош-чением содержания в крови мочевины и креатинина. В целом же при ССД отмечается диссоциация между выявляемыми при пункционной биопсии выраженными морфологическими изменениями почечной ткани и сосуд< и сравнительно умеренными клиническими (в том числе лабораторными) проявлениями поражения почек. Если вследствие поражения почек развивается АГ, то отмечаются изменения глазного дна (сужение артерий и расширение вен).
При поражении сердца на ЭКГ — неспецифические изменения конечной части желудочкового комплекса (снижение амплитуды и инверсия зубца 7), иногда нарушения внутрижелудочковой проводимости. Рентгенологически определяется увеличение сердца. Рентгенография помогает обнаружить кальцинацию мышц и мягких тканей пальцев кисти, а также дифференцировать изменения суставов при ССД от изменений при РА (при ССД не выявляются эрозии суставных поверхностей). В 60—70 % случаев на рентгенограмме отмечается поражение пищеварительного тракта, особенно пищевода и кишечника. Изменения пищевода выражаются в виде диффузного его расширения в сочетании с сужением в нижней трети, ослаблением перистальтики и некоторой ригидностью стенок.
При биопсии кожи, синовиальной оболочки и мышц выявляются характерные для ССД фиброзные изменения, а также изменение сосудов. Однако данные морфологического исследования не имеют решающего значения в постановке диагноза.
Диагностика. Распознавание болезни основывается на выявлении «больших» и «малых» диагностических критериев.
«Большие» критерии:
• проксимальная склеродерма — симметричное утолщение, уплотне ние и индурация кожи пальцев и кожи проксимально от пястно-фаланго- вых и плюснефаланговых суставов. Изменения могут затрагивать лицо, шею, туловище (грудная клетка и живот).
«Малые» критерии:
• склеродактилия — перечисленные выше кожные изменения, ограниченные вовлечением в патологический процесс пальцев;
• рубцы на кончиках пальцев или потеря вещества в подушечках пальцев;
• двусторонний базальный легочный фиброз.
У больного ССД должны быть либо главный критерий («большой»), либо по крайней мере два из «малых» критерия. Чувствительность — 91%, специфичность — 98 %.
Наиболее типично для ССД сочетание кальциноза, синдрома Рейно, эзофагита, склеродактилии и телеангиэктазий (синдром CREST — по первым буквам английских наименований перечисленных симптомов).
Диагностика ССД на ранних стадиях болезни основывается на наличии «триады» первоначальных признаков (появляющихся наиболее рано): синдром Рейно + суставной синдром (чаще полиартралгии) + плотный отек кожи. Существенно реже в ранней стадии обнаруживается одна из висцеральных локализаций процесса.
Значительные трудности в диагностике ССД наблюдаются при отсутствии характерного кожного синдрома у больных с выраженной полисин-Дромной висцеральной патологией (так называемая ССД без склеродермии). В этих случаях существенную помощь оказывает рентгенологическое исследование, выявляющее нарушение моторики пищевода и его расширение, дилатацию двенадцатиперстной и толстой кишки.
Дифференциальная диагностика. ССД следует дифференцировать от целого ряда заболеваний и прежде всего от других диффузных заболеваний соединительной ткани, а также от болезней, клиническая картина которых весьма сходна с клинической картиной поражения какого-либо органа при
ССД (при условии доминирования поражения этого органа). Например, при склеродермическом поражении сердца — с атеросклеротическим кардиосклерозом, ревмокардитом, неспецифическим миокардитом; при легочном поражении — с хронической пневмонией, туберкулезом, профессиональными заболеваниями легких (пневмокониоз); при поражении пищевода следует исключить рак пищевода.
Основой для такой дифференциации являются типичные для ССД признаки.
• Преобладание своеобразных кожных поражений в сочетании с синдромом Рейно и нерезко выраженными лабораторными данными при ССД в отличие от кожных поражений при СКВ, сочетающихся с более высокой активностью патологического процесса (по данным лабораторных исследований).
• В отличие от СКВ при ССД поражение внутренних органов не сочетается с признаками выраженных иммунных нарушений (АНФ, РФ; антитела к ДНК встречаются в меньшем титре, частота обнаружения и количество LE- клеток также невелики).
• Суставной синдром при ССД в отличие от РА сочетается с мышечными контрактурами, отложением кальция в мягких тканях и мышцах, фиброзными анкилозами, остеолизом концевых фаланг. Деструктивные изменения костной ткани при СКД отсутствуют, преобладает поражение пе-риартикулярных тканей.
• Поражение сердца при ССД в отличие от ИБС не сопровождается ангинозными болями, на ЭКГ отсутствуют признаки перенесенного инфаркта миокарда. В отличие от ревматического поражения сердца при ССД никогда не развиваются стенозы (митральный, устья аорты); обычно имеется умеренно выраженная изолированная митральная недостаточность.
• Доминирующее поражение какой-либо системы или органа при ССД всегда сочетается с кожными и мышечными поражениями, а также синдромом Рейно, тогда как при других заболеваниях (хроническая пневмония, атеросклеротический кардиосклероз, заболевания кишечника, язвенная болезнь), от которых приходится дифференцировать ССД, в клинической картине отмечается «моносиндромность».
• При ССД доминируют кожные поражения и синдром Рейно, тогда как при ДМ на первый план выступает поражение мышц в сочетании со своеобразным параорбитальным отеком лилового цвета («симптом очков»),
• Кортикостероиды при ССД не дают такого разительного положительного эффекта, как при СКВ.
В ряде случаев, когда ССД проявляется суставным, кожным и астено- вегетативным синдромами, лишь длительное динамическое наблюдение позволяет поставить правильный диагноз.
Формулировка развернутого клинического диагноза учитывает рубрики, приведенные в рабочей классификации; диагноз должен отражать: 1) характер течения; 2) стадию; 3) клинико-морфологическую характеристику поражения органов и систем организма с указанием стадии функциональной недостаточности (например, при пневмосклерозе — стадию легочной недостаточности, при поражении почек — стадию почечной недостаточности и пр.).
Лечение. Терапия при ССД должна быть комплексной и учитывать следующие аспекты: 1) воздействие на сосудистые осложнения и в первую очередь — синдром Рейно; 2) воздействие на развитие фиброзных изменений; 3) иммуносупрессия и противовоспалительное действие; 4) воздействие на локальные проявления болезни.
• Следует избегать холода, курения, местного воздействия вибрации, стрессовых ситуаций, приема препаратов, вызывающих периферический вазоспазм ((3-адреноблокаторы без вазодилатирующего действия).
• Фармакотерапия синдрома Рейно предусматривает назначение блокаторов медленных кальциевых каналов — амлодипина (5—20 мг/сут), нифе- дипина пролонгированного действия (нифедипин GITS, кордафлекс, адалат SR по 30—90 мг/сут), фелодипина (5—10 мг/сут), а также верапамила пролонгированного действия (изоптин SR-240, верогалит) по 240—480 мг/сут или дилтиазема (алтиазем РР) по 120—360 мг/сут.
Хороший эффект оказывает пентоксифиллин — внутрь по 400 мг 3 раза в сутки. Назначают также антиагреганты — дипиридамол (300—400 мг/сут) или тиклопидин (500 мг/сут).
В критических ситуациях (легочная гипертензия, гангрена, почечный криз) внутривенно вводят синтетические простагландины на протяжении 6— 24 ч в течение 2—5 сут: алпростадид по 0,1—0,4 мкгДкгмин) или ило-прост по 0,5—2 нг/(кгмин).
• Препаратом, разрушающим внутренние связи в молекуле коллагена, а также тормозящим избыточное коллагенообразование, является D-пеницилл- амин. Его назначают при подостром течении (с быстро нарастающими ин- дуративными изменениями кожи, явлениями прогрессирующего генерализованного фиброза) по 125—500 мг/сут (через день) натощак. Рекомендовавшиеся ранее высокие дозы (750—1000 мг/сут) эффективность терапии не повышают, но значительно возрастает частота побочных эффектов. При лечении D-пеницилламином необходимо следить за анализами мочи, так как на 6—12-м месяце от начала лечения может появиться протеинурия (при ее нарастании до 0,2 г/сут препарат отменяют). При выраженных кожных поражениях показана ферментотерапия — лидаза в виде подкожных инъекций вблизи пораженных участков или электрофорез с этим препаратом.
• При активном воспалительном процессе (миозит, альвеолит, серо-зит, рефрактерный артрит, теносиновит) назначают преднизолон по 15— 20 мг/сут (до достижения терапевтического эффекта), затем постепенно снижают дозу до поддерживающей (5—10—15 мг/сут), однако это не предупреждает развития фиброза. Имеются сведения об эффективности цитоста-тиков (метотрексат внутрь по 15 мг в неделю или циклоспорин А внутрь по 2—3 мг/(кг-сут).
• При склеродермическом почечном кризе используют ингибиторы АПФ для снятия сосудистых спазмов и предотвращения развития «скле- родермической» почки (каптоприл по 100—150 мг/сут, эналаприл по 10—40 мг/сут) под контролем АД.
• При поражении пищевода с целью профилактики дисфагии рекомендуется частое дробное питание, исключение приема пищи позднее 18 ч. Лечение дисфагии предусматривает назначение прокинетиков: метоклопра- мид (10 мг 3—4 раза в сутки). При рефлюкс-эзофагите назначают омепра-зол внутрь по 20 мг/сут.
• Воздействие на локальные проявления болезни предусматривает аппликации димексида (25—50 % раствор). В периоды отсутствия активности патологического процесса можно рекомендовать ЛФК, массаж.
Прогноз. При ССД прогноз определяется вариантом течения и стадией развития. Отмечено, что чем больше времени отделяет развернутую стадию от первых проявлений болезни (в частности, синдрома Рейно), тем благоприятнее прогноз. Пятилетняя выживаемость пациентов составляет 30— 70 %. В последние годы процент выживаемости повысился, что связано с более успешной борьбой с почечным склеродермическим кризом.
Профилактика. К группе «угрожаемых» относят лиц со склонностью к вазоспастическим реакциям, иолиартралгиям, а также родственников больных, страдающих различными диффузными заболеваниями соединительной ткани. Такие лица не должны подвергаться воздействию провоцирующих факторов (охлаждение, вибрация, травматизация, воздействие химических веществ, инфекции и пр.). Больных ССД ставят на диспансерный учет. Систематически проводимое лечение (в частности, правильно подобранная поддерживающая терапия) является лучшим средством профилактики обострений.
Дерматомиозит,
Дерматомиозит (ДМ) — системное воспалительное заболевание скелетной и гладкой мускулатуры и кожи; реже отмечается вовлечение в патологический процесс внутренних органов. При отсутствии поражения кожи используют термин «полимиозит» (ПМ).
Сущность заболевания состоит в прогрессирующем тяжелом некротическом миозите с преимущественным поражением мышц проксимальных отделов конечностей. По мере прогрессирования заболевания мышечная ткань атрофируется и замещается фиброзной. Аналогичные процессы наблюдаются и в миокарде. В паренхиматозных органах развиваются дистрофические процессы, в патологический процесс вовлекаются также сосуды мускулатуры, внутренних органов и кожи.
Дерматомиозит/полимиозит (ДМ/ПМ) — редкое заболевание. Болеют люди всех возрастных групп — от детей до стариков, но чаще дети до 15 лет и лица зрелого возраста (40—60 лет). Женщины болеют в 2—3 раза чаще, чем мужчины.
Этиология. Выделяют две формы ДМ/ПМ — идиопатический и вторичный (опухолевый). Этиология идиопатического ДМ неизвестна. Однако известны факторы, способствующие выявлению (а в дальнейшем и обострению) данного заболевания: 1) инсоляция; 2) охлаждение; 3) инфекция (ОРЗ, грипп, ангина и пр.); 4) гормональная перестройка (климакс, беременность, роды); 5) эмоциональный стресс; 6) физическая травма, хирургическое вмешательство; 7) сенсибилизация лекарственными препаратами (аминазин, инсулин, антибиотики, D-пеницилламин); 8) вакцинация; 9) контакт с эпоксидными смолами, фоторастворителями; 10) физиотерапевтические процедуры.
Имеет значение, по-видимому, наследственная предрасположенность: у больных обнаруживаются антигены B-8/DR3, В14, В40 HLA-системы. Это, однако, тесно связано не с самим заболеванием, а с определенными иммунными нарушениями, в первую очередь гиперпродукцией миозитспе- цифических аутоантител.
Опухолевый (вторичный) ДМ составляет 25 % всех случаев заболевания и развивается у больных, страдающих злокачественными опухолями. Наиболее часто ДМ возникает при раке легкого, кишечника, предстательной железы, яичника, а также при гемобластозах. Появление ДМ у лиц старше 60 лет почти всегда указывает на опухолевое его происхождение.
Патогенез. Под влиянием вируса и генетического фактора (при участии предрасполагающих факторов) или опухолевых антигенов происходит нарушение (дисрегуляция) иммунного ответа, выражающееся в дисбалансе В- и Т-системы лимфоцитов: в организме вырабатываются антитела к скелетным мышцам, происходит сенсибилизация к ним Т-лимфоцитов. Реакция антиген — антитело и цитотоксический эффект сенсибилизированных
Схема 24. ПАТОГЕНЕЗ ДЕРМАТОМИОЗИТА
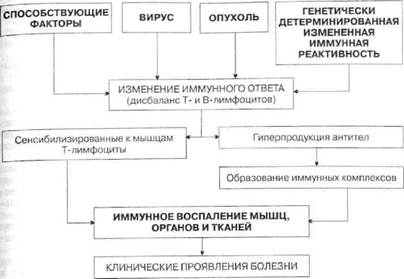
|
к мышцам Т-лимфоцитов способствуют образованию иммунных комплексов и отложению их в мышцах, а также в микроциркуляторном русле различных органов. Элиминация иммунных комплексов приводит к высвобождению лизосомных ферментов и развитию иммунного воспаления в мышцах и внутренних органах. При воспалении высвобождаются новые антигены, способствующие дальнейшему образованию иммунных комплексов, что ведет к хронизации заболевания и вовлечению в патологический процесс не пораженных ранее мышц. Основные звенья патогенеза ДМ представлены на схеме 24.
Клиническая картина. Проявления болезни отличаются системностью и полисиндромностью. Основными синдромами являются: 1) мышечный (миозит, мышечные атрофии, кальцификация); 2) кожный (эритема, отек кожи, дерматит, пигментация и депигментация, телеангиэктазии, гиперкератоз, крапивница); 3) суставной (артралгии, поражение периартикулярных тканей, истинные артриты встречаются редко); 4) висцеральный (миокардит, кардиосклероз, пневмонит, аспирационные пневмонии, пневмофиб-роз, желудочно-кишечные кровотечения, «миоглобулинурическая почка» с развитием ОПН, полинейропатии).
Выделяют следующие периоды течения болезни:
I период (начальный) — от нескольких дней до 1 мес и более, проявляется только мышечными и/или кожными признаками;
II период (манифестный) — определяется развернутая картина болезни;
III период (терминальный) проявляется дистрофическими изменениями внутренних органов и признаками выраженной их функциональной недостаточности; в этом периоде наблюдаются осложнения.
Различают три формы течения болезни:
1) острая: быстро нарастает генерализованное поражение скелетной мускулатуры, приводящее к полной обездвиженности больного; прогрессирует поражение мышц глоточного кольца и пищевода (дисфагия, дизартрия); быстро развивается поражение внутренних органов (особенно сердца) с летальным исходом через 2—6 мес от начала болезни;
2) подострая: более медленное, постепенное нарастание симптоматики; тяжелое поражение мышц и висцериты появляются через 1—2 года;
3) хроническая: длительное циклическое течение; преобладают процессы атрофии и склероза; возможно локальное поражение мышц.
На I этапе диагностического поиска получают сведения о характере начала заболевания: острое (повышение температуры тела до 38—39 "С, кожная эритема и боли в мышцах) или постепенное (умеренная слабость, нерезкие миалгии и артралгии, усиливающиеся после физической нагрузки, инсоляции или других неблагоприятных воздействий).
Наиболее характерные жалобы обусловлены мышечными поражениями: больные отмечают слабость, не могут самостоятельно сесть или встать, им крайне трудно подниматься по лестнице, нередки боли в мышцах. Мышечная слабость и болезненность локализуются симметрично в проксимальных отделах конечностей, а также в спине и шее.
При поражении глоточных мышц больные жалуются на поперхивание при глотании, жидкая пища выливается через нос. Носовой оттенок голоса, охриплость обусловлены поражением мышц гортани.
При поражении кожи больные отмечают стойкое изменение ее окраски в местах, подверженных действию солнца («зона декольте», лицо, кисти), а также на наружных поверхностях бедер и голеней. Характерно появление параорбитального отека лилового цвета (симптом очков). При поражении слизистых оболочек больные жалуются на сухость, жжение в глазах, отсутствие слез («сухой синдром»).
Вовлечение в патологический процесс различных органов проявляется симптомами, свойственными миокардиту, кардиосклерозу, пневмониту, гломерулонефриту, полиневриту, артриту и пр.
Проводимое лечение позволяет судить об его адекватности, а косвенно и о характере течения: использование аминохинолиновых препаратов свидетельствует о хроническом течении, применение преднизолона и цитостатиков — о более остром течении болезни.
На II этапе диагностического поиска при развернутой клинической картине болезни прежде всего обращает внимание симметричное поражение мышц: плотные, тестоватые на ощупь, увеличены в объеме, болезненны при пальпации. При поражении мимической мускулатуры отмечается некоторая маскообразность лица. В дальнейшем наблюдается атрофия мышц, особенно выраженная со стороны плечевого пояса. Поражаются также дыхательные мышцы и диафрагма. При пальпации мышц можно обнаружить локальные уплотнения — кальцинаты, которые располагаются и в подкожной жировой клетчатке. Кальциноз чаще развивается у молодых людей с распространенным поражением мышц при переходе острого течения в по-дострое или хроническое. Нередко отмечается снижение массы тела на 10-20 кг.
Поражение кожи не является обязательным для ДМ, но при его наличии на открытых частях тела отмечаются отек, эритема (в особенности над суставами — так называемая надсуставная, а также в околоногтевых зонах в сочетании с микронекрозами в виде темных точек — синдром Готтрона), капилляриты, петехиальные высыпания, телеангиэктазии. Эритема отличается большой стойкостью, синюшным оттенком, сопровождается зудом и шелушением. Типичен «симптом очков» — эритема вокруг глаз. Нередко отмечаются покраснение, шелушение и растрескивание кожи ладоней («рука механика или ремесленника»), ломкость ногтей и повышенное выпадение волос.
Довольно часто встречается достаточно выраженный синдром Рейно.
Физические проявления висцеральных поражений при ДМ, так же как и при ССД, не слишком ярки в отличие от СКВ. Можно отметить известную диссоциацию между выраженностью патоморфологических изменений органов и их клиническим проявлением. Поражение сердца (миокардит, кардиосклероз) проявляется такими неспецифическими признаками, как увеличение размеров его, глухость тонов, тахикардия, нарушение ритма в виде экстрасистолии. Выраженные изменения миокарда могут привести к появлению симптомов сердечной недостаточности.
Поражение легких в виде пневмонита проявляется крайне скудно. Развивающийся фиброз обнаруживают по признакам эмфиземы легких и дыхательной недостаточности. Аспирационная пневмония характеризуется всеми свойственными пневмонии физикальными симптомами.
Для поражения пищеварительного тракта характерна дисфагия: твердая пища срыгивается, а жидкая выливается через нос. Поражение сосудов желудка и кишечника может привести к желудочно-кишечным кровотечениям со всеми характерными для этого осложнения признаками. Иногда отмечается умеренное увеличение печени, реже — гепатолиенальный синдром с увеличением лимфатических узлов.
Неврологическая симптоматика проявляется изменениями чувствительности: гиперестезией периферического или корешкового характера, типе- ралгезией, парестезией и арефлексией.
На III этапе диагностического поиска существенную помощь оказывают методы исследования, позволяющие оценить остроту воспалительного процесса и распространенность поражения мышц.
Об остроте процесса можно судить по неспецифическим острофазовым показателям (увеличение СОЭ, повышение содержания фибриногена и СРВ, гипер-ос2-глобулинемия) и показателям, свидетельствующим об иммунных сдвигах (появление в невысоком титре ревматоидного фактора, увеличение содержания у-глобулинов, антител к нуклеопротеиду и растворимым ядерным антигенам; выявляются также антитела Mi2, Jol, SRP; в случае идиопатического ДМ повышается содержание IgG).
При хроническом, вялом течении болезни изменения острофазовых показателей могут отсутствовать (СОЭ может быть не увеличена).
Распространенность поражения мышц характеризуется рядом биохимических показателей. Повышаются индекс креатин/креатинин за счет появления в моче креатина при снижении креатинурии. При значительном поражении мышц может наблюдаться миоглобинурия. Увеличение активности трансаминаз неспецифично для поражения скелетной мускулатуры. У некоторых больных с миопатическим синдромом увеличение трансаминаз позволяет предположить гепатит.
Иммунологическое исследование выявляет миозитспецифические антитела (AT). К ним относятся AT к аминоацилсинтетазам транспортной РНК (ан- тисинтетазные AT), в первую очередь AT к гистидил тРНК-синтетазе (Jol). AT Jol выявляют у половины больных ДМ/ПМ, тогда как другие антисин- тетазные AT обнаруживают крайне редко (5 %). Продукция антисинтетаз-ных AT ассоциируется с развитием так называемого антисинтетазного синдрома, характеризующегося острым началом, лихорадкой, симметричным артритом, иитерстициальиым поражением легких, синдромом Рейно, поражением кистей рук по типу «руки механика».
Для ДМ опухолевого происхождения у мужчин характерно выявление простатспецифического антигена Аг, у женщин — СА-125 (антиген опухоли яичника). Кроме того, при иной локализации опухоли могут выявляться и иные опухолеспецифичные антигены.
Существенную помощь в диагностике поражения мышц оказывает электромиография, выявляющая нормальную электрическую активность мышц в состоянии их произвольного расслабления и низкоамплитудную при произвольных сокращениях.
Биопсия кожи и мышц обнаруживает картину тяжелого миозита с потерей поперечной исчерченности мышечных волокон, фрагментацией, зернистой и восковидной дегенерацией, очаги некроза, лимфоидно-плазмо-клеточную инфильтрацию, явления фиброза. Мышечную биопсию используют для подтверждения диагноза ДМ даже при наличии характерных клинических, лабораторных и инструментальных признаков болезни. Наиболее информативна биопсия мышцы, вовлеченной в патологический процесс, но без выраженной атрофии.
Прочие методы исследования (ЭКГ, рентгенологические и эндоскопические) необходимы для: 1) оценки состояния пораженных внутренних органов; 2) поисков опухоли при подозрении на ДМ опухолевого происхождения.
Диагностика. Для диагностики ДМ/ПМ следует использовать следующие диагностические критерии.
1. Поражение кожи:
• гелиотропная сыпь (пурпурно-красные высыпания на веках);
• признак Гортона (пурпурно-красная шелушащаяся, атрофическая эритема или пятна на разгибательной поверхности кистей над суставами);
• эритема на разгибательной поверхности конечностей над локтевыми и коленными суставами.
2. Проксимальная мышечная слабость (верхние и нижние конечности, туловище).
3. Повышение уровня КФК или альдолазы в сыворотке крови.
4. Боли в мышцах при пальпации или миалгии.
5. Миогенные изменения при ЭМГ (короткие полифазные потенциалы моторных единиц со спонтанными потенциалами фибрилляции).
6. Обнаружение антител Jol (антитела к гистидил тРНК-синтетазе).
7. Недеструктивный артрит или артралгии.
8. Признаки системного воспаления (температура тела более 37 °С, увеличение концентрации СРБ или увеличение СОЭ более 20 мм/ч).
9. Морфологические изменения: воспалительные инфильтраты в склет- ных мышцах с дегенерацией или некрозом мышечных волокон; активный фагоцитоз или признаки активной регенерации.
При наличии одного типа поражения кожи и четырех признаков (пункты 2—9) диагноз ДМ достоверен (чувствительность 94,1 %, специфичность 90,3 %). Наличие четырех признаков (пункты 2—9) соответствует диагнозу ПМ (чувствительность 98,9 %, специфичность 95,2 %).
Дифференциальная диагностика. Несмотря на высокую чувствительность и специфичность критериев, диагностика ДМ/ПМ представляет большие трудности, особенно в дебюте заболевания.
ДМ/ПМ следует дифференцировать от инфекционных и неврологических заболеваний, ССД, СКВ, РА. Основой такой дифференциации могут явиться:
• Упорство суставного синдрома при РА, обнаружение при рентгенологическом исследовании эрозий суставных поверхностей костей, отсутствие характерных для ДМ изменений кожи и мышц.
• В отличие от СКВ при ДМ висцеральная патология не столь резко выражена и встречается значительно реже, в клинической картине ДМ преобладает поражение мышц; лабораторные показатели (особенно иммунологические) изменены незначительно.
• В отличие от ССД кожные изменения при ДМ имеют совершенно иной характер, нет типичных изменений кистей; мышечный синдром является главным (в том числе резкая мышечная слабость). Тем не менее дифференциальная диагностика ССД и ДМ наиболее трудна, в сложных случаях необходимо использовать электрофизиологические и морфологические методы исследования.
• При остром течении ДМ необходимо исключить инфекционную патологию (септическое состояние, рожистое воспаление и др.), что возможно при динамическом наблюдении за больным.
• При доминировании адинамии, нарушении рефлексов возникает необходимость дифференциации с неврологической патологией, что осуществляется при совместном наблюдении за больным терапевта и невропатолога.
Формулировка развернутого клинического диагноза ДМ должна отражать: 1) период течения; 2) форму течения; 3) клинико-морфологическую характеристику поражения систем и органов с указанием основных синдромов и наличия (отсутствия) функциональной недостаточности органов (систем).
Лечение. Главной задачей является подавление активности иммунных реакций и воспалительного процесса на иммунной основе, а также нормализация функции отдельных, наиболее пораженных органов и систем.
Лучший эффект оказывают глюкокортикоидные препараты: при ДМ предпочтительнее назначать преднизолон [в среднем 1—2 мг/(кгсут)]. В течение первых недель суточную дозу следует делить на три приема, затем принимать всю дозу однократно утром. Поскольку состояние больного улучшается медленнее, чем при СКВ или ССД (в среднем через 1—3 мес), то при отсутствии положительной динамики следует увеличить дозу ГКС. После достижения эффекта (нормализация мышечной силы и КФК) дозу преднизолона очень медленно снижают до поддерживающей, каждый месяц на '/4 от суммарной.
Пульс-терапия редко эффективна, применяется при быстром прогрес- сировании дисфагии (риск аспирационной пневмонии) и развитии системных проявлений (миокардита, альвеолита).
Если лечение преднизолоном не дает эффекта или его невозможно использовать вследствие непереносимости и развития осложнений, то следует назначить цитостатические препараты. В настоящее время рекомендуется раннее назначение метотрексата, позволяющее быстрее перевести больных на поддерживающие дозы преднизолона. Метотрексат назначают внутрь, подкожно или внутривенно 7,5—25 мг/нед. Внутривенное введение метотрексата показано при недостаточной эффективности или плохой переносимости при приеме препарата внутрь. Следует помнить, что отсутствие эффекта от лечения преднизолоном указывает на возможность опухолевого Дерматомиозита, поэтому, прежде чем назначать цитостатические препараты, следует провести расширенный онкологический поиск для исключения злокачественной опухоли.
Больным с резистентными к преднизолону формами болезни назначают циклоспорин А внутрь по 2,5—5 мг/(кгсут).
Азатиоприн уступает метотрексату по эффективности, максимальный эффект развивается позже — через 6—9 мес; препарат назначают внутрь по 100-200 мг/сут.
Циклофосфамид является средством выбора при интерстициальном легочном фиброзе [по 2 мг/(кгсут)].
Аминохинолиновые препараты хингамин (делагил), гидроксихлорохин (плаквенил) применяют при:
1) хроническом течении болезни без признаков активности процесса (для контроля кожных проявлений болезни);
2) снижении дозы преднизолона или цитостатиков для уменьшения риска возможного обострения.
Прогноз. В настоящее время в связи с применением преднизолона и цитостатиков при острых и подострых формах прогноз значительно улучшился. В случае перехода ДМ в хроническое течение трудоспособность больного может восстанавливаться. Прогноз при вторичном (опухолевом) ДМ зависит от эффективности оперативного вмешательства: при успешно проведенной операции все признаки болезни могут исчезнуть. Факторами, ухудшающими прогноз болезни, являются пожилой возраст, поздний диагноз, неадекватная терапия в начале болезни, тяжелое течение миозита (лихорадка, дисфагия, поражение легких, сердца, ЖКТ), антисинтетазный синдром. Пятилетняя выживаемость при опухолевом ДМ составляет только 50 %.
Профилактика. Предупреждение обострений (вторичная профилактика) достигается проведением поддерживающей терапии, санации очагов инфекции, повышением сопротивляемости организма. Для родственников больного возможна первичная профилактика (исключение перегрузок, инсоляции, переохлаждений).
Контрольные вопросы и задачи
На вопросы 189—204 выберите один наиболее правильный ответ.
189. Системная красная волчанка обычно встречается у: А. Пожилых женщин. Б. Молодых людей. В. Женщин детородного возраста. Г. Пожилых людей. Д. Детей.
190. У молодых женщин нефрит наиболее часто может быть проявлением:
А Дерматомиозита. Б. Системной красной волчанки. В. Системной склеродермии. Г. Тромбоцитопенической пурпуры. Д. Узелкового периартериита.
191. Истинные LE-клетки являются: А. Нейтрофильными лейкоцитами, фагоцитировавшими ядра других клеток. Б. Нейтрофилами, фагоцитировавшими лимфоциты. В. Моноцитами, фагоцитировавшими ядра других клеток. Г. Моноцитами, формирующими «розетки» с эритроцитами. Д. Гематоксилиновыми тельцами.
192 Гемолитическая анемия с положительной реакцией Кумбса может наблюдаться при: А. Тромбоцитопенической пурпуре. Б. Системной склеродермии. В. Системной красной волчанке. Г. Узелковом периартериите. Д. Дерматомиозите.
193. В стационар поступила женщина 35 лет с жалобами на сухой кашель, одышку, боли в мелких суставах, субфебрильную температуру тела, похудение, вы падение волос. Больна в течение 2 лет. Вначале отмечались только суставные боли в виде повторных атак полиартрита мелких суставов кисти и лучезапястных суета bob; СОЭ 28 мм/ч. Затем появились боли в грудной клетке, сухой кашель, одышка. В последние месяцы нарастает похудение, выпадают волосы, на лице появились красные высыпания. При осмотре: деформация проксимальных, межфаланговых суставов, расширение сердца в обе стороны, глухие тоны сердца, систолический шум над верхушкой; АД 150/100 мм рт. ст. При рентгеноскопии легких — плевро- диафрагмальные спайки: утолщение междолевой плевры увеличение левого желу дочка. Анализ крови: НБ 10,6 г/л, эритроциты 3,210 /л, лейкоциты 4,3-10 /л (формула в пределах физиологической нормы); СОЭ 60 мм/ч. Анализ мочи: плотность 1,016, белок 1,65 % ,в осадке 8—10 эритроцитов в поле зрения, . цилиндры 4— 5 в поле зрения. Наиболее вероятный диагноз: А. Ревматоидный артрит. Б. Ревматизм. В. Системная красная волчанка. Г. Хронический гломерулонеф-рит. Д- Системная склеродермия.
194. Один из следующих признаков не встречается при системной склеродермии: А. Диффузный кальциноз. Б. Дисфагия. В. Артрит. Г. Гиперпигментация кожи и телеангиэктазии. Д. Патологические переломы костей.
195. При дерматомиозите встречаются перечисленные признаки, за исключением:
A. Миоглобинурии. Б. Повышения в сыворотке крови уровня креатинфосфоки-назы.
B. Креатинурии. Г. Наличия ревматоидного фактора. Д. Снижения содержания ол- глобулина.
196. Мужчины наиболее часто заболевают: А. Дерматомиозитом. Б. Системной красной волчанкой. В. Системной склеродермией. Г. Узелковым периартериитом. Д. Ревматоидным полиартритом.
197. У женщины 42 лет в течение 15 лет синдром Рейно. В последний год появились симптомы артрита мелких суставов кистей, затруднения при глотании твердой пищи. В крови: СОЭ 32 мм/ч, единичные волчаночные клетки. Каков предварительный диагноз? А. Опухоль пищевода. Б. Системная красная волчанка. В. Системная склеродермия. Г. Ревматоидный артрит. Д. Дерматомиозит.
198. Выберите из данных признаков классическую триаду СКВ: А. Миокардит, пневмонит, нефрит. Б. Артрит, дерматит, полисерозит. В. Полиневрит, тромбанги-ит, резкое похудение. Г. Дерматит, миозит, базальный пневмофиброз. Д. Артрит, амилоидоз почек, фиброзирующий альвеолит.
199. При СКВ наблюдаются следующие симптомы, за исключением одного:
A. Телеангиэктазии. Б. Эритема. В. Капилляриты. Г. Симптом «коротких» волос. Д. Алопеция.
200. При каком заболевании наиболее часто встречается синдром Рейно: А Системная красная волчанка. Б. Дерматомиозит. В. Хронический гепатит (ауто иммунный). Г. Системная склеродермия. Д. Узелковый периартериит.
201. Какой признак не входит в понятие «CREST-синдром»: А. Эзофагит. Б. Телеангиэктазии. В. Кальциноз. Г. Истинная склеродермическая почка. Д. Нарушение моторики пищевода.
202. Что из перечисленных препаратов не следует применять для улучшения микроциркуляции при системной склеродермии: А. Нифедипин. Б. Курантил.
B. Ксантинола никотинат. Г. Верапамил. Д. Пропранолол.
203. У девушки 25 лет после возвращения с летнего отдыха в горах появились эритематозные высыпания на лице, боли в мелких суставах кисти, субфебрильная температура, СОЭ 46 мм/ч, в моче — белок 1 г/сут, 5—8 эритроцитов в поле зре ния. Обнаружен антинуклеарный фактор. Какую тактику лечения следует выбрать в данном случае? А, Преднизолон по 15 мг/сут. Б. Преднизолон по 40 мг/сут. В. Аза тиоприн по 150 мг/сут. Г. Плазмаферез. Д. Индометацин по 150 мг/сут.
204. У больной 45 лет системной склеродермией в течение 3 мес наблюдалась тяжелая артериальная гипертония (240/130 мм рт. ст.), плохо поддающаяся гипо тензивной терапии клофелином, мочегонными средствами. При обследовании вы явлены выраженная ангиопатия сосудов глазного дна, протеинурия (2 г/сут), повы шение содержания креатинина крови. Какой препарат следует назначить для сни жения АД? А. Празозин. Б. Ингибитор АПФ. В. Пропранолол. Г. Метилдофа. Д. Гидралазин.
Глава VIII
| 556 556 569 574 581 585 |
Болезни суставов
Содержание
Болезни суставов................................................................
Ревматоидный артрит....................................................
Остеоартроз...................................................................
Подагра..........................................................................
Идиопатический анкилозируюгций спондилоартрит
(болезнь Бехтерева)
Контрольные вопросы и задачи
Болезни суставов
Поражения суставов различной природы встречаются достаточно часто в клинике внутренних болезней. Заболевания суставов могут быть самостоятельной нозологической формой (ревматоидный артрит, остеоартроз, подагра), проявлением патологии других систем (артрит при СКВ, ССД) или же быть реакцией на иной патологический процесс (реактивные артриты при какой-либо острой инфекции).
Все многообразие патологии суставов может быть сведено к двум формам
— артриты (воспалительные поражения суставов вне зависимости от непосредственной причины — инфекций, аутоиммунных процессов или выпадения микрокристаллов солей в синовиальной жидкости) и артрозы (дистрофически-дегенеративные поражения).
В данной главе будут рассмотрены наиболее частые заболевания суставов
— ревматоидный артрит, остеоартроз, подагра, идиопатический анкилозируюгций спондилоартрит (болезнь Бехтерева).
Ревматоидный артрит
Ревматоидный артрит (РА) — хроническое системное воспалительное заболевание соединительной ткани с преимущественным поражением суставов по типу эрозивно-деструктивного прогрессирующего полиартрита. Сущность заболевания состоит в поражении суставных тканей (синовиальная оболочка, суставной хрящ, капсула сустава) воспалительным процес
сом, развивающимся на иммунной основе и приводящим к эрозиям суставных поверхностей костей с последующим формированием выраженных деформаций и анкилозов. В основе нередко наблюдающихся внесуставных поражений лежит иммунокомплексный васкулит, вызывающий поражение внутренних органов и систем.
РА — одно из наиболее распространенных хронических воспалительных заболеваний суставов (частота в популяции составляет 1 %). Болеют чаще женщины (в 2,5 раза), чем мужчины, в пожилом возрасте это различие менее очевидно.
Этиология. Причины развития РА неизвестны. Придают значение вирусной инфекции (вирус Эпштейна—Барр), а также другим инфекционным факторам (стрептококки группы В, микоплазма). Молекулярные компоненты микробных клеток, продукты разрушения последних обладают тропизмом к суставным тканям, способны длительно персистировать в них и вызывать характерный иммунный ответ. Вирусы, встраиваясь в ДНК клеток хозяина, могут индуцировать синтез и секрецию неинфекционных белков, обладающих антигенной способностью, что является стимулом к развертыванию иммунных реакций. Предполагают, что вирус Эпштейна—Барр может длительно существовать в организме лиц с генетической предрасположенностью к такому персистированию, что ведет к нарушению супрессорной функции Т-клеток и нарушению продукции иммуноглобулинов В-лимфоцитами.
Генетическим факторам в настоящее время придается значение в происхождении данного заболевания; так, риск заболеть РА в 16 раз выше у кровных родственников. РА чаще встречается у носителей определенных антигенов класса II главного комплекса гистосовместимости, особенно HLA- DR1 и HLA-DR4. Так, носительство HLA DRW4 встречается у 52 % больных РА и лишь у 13 % в популяции.
Имеют значение гормональные факторы: у женщин в возрасте до 50 лет РА встречается в 2—3 раза чаще, нежели у мужчин. Прием контрацептивов и беременность снижают риск развития РА у женщин. Напротив, в период лактации (гиперпролактинемия) риск заболеть РА существенно повышается.
В целом вклад генетических факторов в развитие РА составляет 15 %, факторов внешней среды — 85 %.
Патогенез. На ранней стадии РА поражение суставов связано с «неспецифической» воспалительной реакцией, вызванной различными стимулами, которая в свою очередь (у генетически предрасположенных лиц) приводит к патологической реакции клеток синовиальной оболочки. В дальнейшем в результате вовлечения в процесс иммунных клеток (Т- и В-лимфо-Циты и пр.) в полости сустава происходит формирование «эктопического» лимфоидного органа, клетки которого начинают продуцировать аутоантите-ла к компонентам синовиальной оболочки. Аутоантитела (в первую очередь так называемый ревматоидный фактор, представляющий собой антитело к агрегированному IgM, а также антитела к глюкозо-6-фосфатдегидрогеназе и Др.) и иммунные комплексы, активируя систему комплемента, еще более усиливают воспалительную реакцию, вызывающую прогрессирующее повреждение суставных тканей. Формируется ведущий морфологический признак ревматоидного воспаления — очаг гиперплазии соединительной ткани, так называемого паннуса. Активированные Т-лимфоциты стимулируют синтез макрофагами «провоспалительных» медиаторов (цитокинов), среди которых центральное место занимает фактор некроза опухоли а (ФНО-а), а также интерлейкин-1 (ИЛ-1). В развитии деструкции хряща и субхондраль- ной кости при РА играют важную роль металлопротеиназы ( такие ферменты, как коллагеназа, желатиназа), образующиеся в зоне паннуса.
На поздних стадиях в патогенезе РА преобладают процессы, обусловленные соматической мутацией синовиальных фибробластов и дефектами апоптоза. Это объясняет трудности противовоспалительной терапии, которая эффективна в рамках небольшого временного отрезка, после чего клетки- мишени начинают терять способность отвечать на регулирующие «противовоспалительные» стимулы и приобретают устойчивость к фармакологическим воздействиям.
Главная особенность РА заключается в том, что паннус постепенно разрушает хрящ и эпифизы костей с образованием узур (эрозий). Исчезновение хряща ведет к развитию фиброзного, а затем и костного анкилоза сустава. Деформацию суставов обусловливает и изменение периартикуляр- ных тканей (капсула сустава, сухожилия и мышцы). Кроме поражений суставов, при РА практически всегда наблюдаются изменения соединительной ткани, различных органов и систем организма. Морфологической основой их поражения являются васкулиты и лимфоидная инфильтрация.
Классификация. В настоящее время в нашей стране принята рабочая классификация РА (Пленум Всесоюзного общества ревматологов, 1980), учитывающая клинико-анатомическую и клинико-иммунологическую характеристику процесса, характер течения, степень активности, рентгенологическую стадию артрита и функциональную активность больного. Клинико-анатомическая характеристика. I. Ревматоидный артрит: полиартрит, олигоартрит. II. Ревматоидный артрит с висцеритами; с' поражением ретикулоэн-дотелиальной системы, серозных оболочек, легких, сердца, сосудов, глаз, почек; амилоидоз органов, псевдосептический синдром, синдром Фелти.
III. Ревматоидный артрит в сочетании с остеоартрозом, ревматизмом, другими диффузными болезнями соединительной ткани.
Клинико-иммунологическая характеристика.
Серопозитивный.
Серонегативный.
Течение болезни.
Медленно прогрессирующее (классическое).
Быстро прогрессирующее.
Без заметного прогрессирования (доброкачественное, малопрогрессирующее).
Степень активности.
I. Минимальная. II.
Средняя. III. Высокая.
Ремиссия.
Рентгенологическая стадия. I.
Околосуставной остеопороз.
II. Остеопороз + сужение суставной щели (могут быть единичные узуры).
III. Остеопороз, сужение суставной щели, множественные узуры.
IV. То же + костный анкилоз.
Функциональная активность.
0. Сохранена.
1. Профессиональная способность ограничена.
II. Профессиональная трудоспособность утрачена.
III. Утрачена способность к самообслуживанию.
Клиническая картина. На I этапе диагностического поиска выясняют основные жалобы больного (как правило, связанные с поражением суставов), а также особенности начала заболевания. Выделяют несколько вариантов.
При постепенном начале заболевания (в течение нескольких месяцев) отмечают медленное нарастание болей и скованности в мелких периферических суставах (лучезапястных, проксимальных межфаланговых, пястно- фаланговых, голеностопных и плюснефаланговых) — примерно в половине случаев. Движения в суставах ограничены незначительно, температура тела остается нормальной.
Моноартрит коленных или плечевых суставов с последующим быстрым вовлечением в патологический процесс мелких суставов кистей и стоп.
Острый моноартрит крупных суставов, напоминающий септический артрит, который протекает с высокой температурой и сочетается с теноси- новитом, бурситом и подкожными (ревматоидными) узелками.
«Палиндромный ревматизм» — множественные рецидивирующие атаки острого симметричного полиартрита суставов кистей, реже коленных и локтевых суставов. Атаки длятся несколько дней и заканчиваются выздоровлением.
Рецидивирующие бурсит и теносиновит, особенно часто в области лучезапястных суставов.
Острый полиартрит с множественным поражением мелких и крупных суставов, с выраженными болями, диффузным отеком и ограничением подвижности у лиц пожилого возраста. Данный вариант описывают как ре- миттирующий серонегативный симметричный синовит с «подушкообразным» отеком.
Генерализованная полиартралгия, или симптомокомплекс, напоминающий «ревматическую полимиалгию» (обычно у лиц пожилого возраста).
По мере течения РА больные отмечают развитие деформаций пораженных суставов и ограничение в них подвижности, которая в выраженных случаях приводит к полной потере функции сустава.
На I этапе можно получить сведения о возможном поражении внутренних органов (появление жалоб соответственно вовлечению в патологический процесс различных органов), а также сведения о ранее проводимом лечении. Лечение препаратами золота, D-пеницилламином, цитостатиками указывает на развитую клиническую картину болезни, тогда как эффективность терапии нестероидными противовоспалительными препаратами и
аминохинолиновыми производными свидетельствует о небольшом сроке болезни, невысокой активности патологического процесса.
На II этапе диагностического поиска существенную информацию дает исследование пораженных суставов: в начале заболевания или в период обострения отмечаются клинические признаки артрита в виде сглаженности контуров сустава за счет воспалительного внутрисуставного отека и отека периартикулярных тканей.
Характерно симметричное поражение суставов. По мере развития болезни появляются деформации суставов, обусловленные пролиферативны-ми изменениями синовиальной оболочки и капсулы сустава, а также деструкцией суставного хряща и прилежащей костной ткани. Возникают подвывихи, усугубляющиеся развитием контрактур вследствие поражения сухожилий в местах их прикрепления к костям.
Некоторые из деформаций, наиболее типичные для РА, имеют самостоятельные значения: отклонение всей кисти в локтевую сторону — «плавник моржа»; сгибательная контрактура проксимального межфалангового сустава при одновременном переразгибании в дистальном межфаланговом суставе — деформация пальца типа «пуговичной петли»; укорочение фаланг, сопровождающееся сморщиванием кожи над ними, в сочетании с ульнарной девиацией кисти — деформация кисти типа «рука с лорнетом». Поражение других суставов не отличается от артритов иного происхождения. Изменения суставов кисти при РА являются «визитной карточкой» заболевания.
По мере прогрессирования заболевания развивается атрофия кожных покровов, которые выглядят блестящими и как бы прозрачными. Наиболее отчетливо изменения кожи выражены в области пальцев и голеней. В некоторых случаях возникает изъязвление кожи голеней, которое может быть связано с васкулитом, обусловливающим формирование локальных некрозов. Иногда при длительном течении РА отмечается эритема в области ладоней.
У 20—30 % больных встречаются так называемые ревматоидные узелки — безболезненные, достаточно плотные округлые образования диаметром от 2—3 мм до 2—3 см, локализующиеся обычно в местах, подвергающихся механическому давлению (разгибательная поверхность локтевой кости вблизи локтевого сустава, ахиллово сухожилие, седалищные бугры). Изредка узелки возникают в области мелких суставов кисти или стоп и в стенках синовиальной сумки, находящейся в области венечного отростка локтевой кости. Обычно узлы расположены подкожно, но могут формироваться и внутрикожно и в сухожилиях. Размер узлов с течением времени меняется, в период ремиссии они могут полностью исчезать. Они выявляются лишь у больных с серопозитивным РА.
Поражение суставов сопровождается развитием мышечной атрофии. Один из ранних симптомов РА при поражении суставов кисти — атрофия межкостных мышц. При поражении других суставов развивается атрофия мышц, являющихся «моторными» для данного сустава. Со временем мышечная атрофия распространяется не только на расположенные около пораженных суставов мышцы, но и на весь мышечный массив, что ведет к общему истощению. Отмечают также хруст в суставах при активных и пассивных движениях.
У больных РА можно обнаружить поражение сухожилий и синовиальных сумок. В синовиальной оболочке сухожильных влагалищ и синовиальных сумок также может развиваться воспаление, сопровождающееся воспалительным выпотом. Наиболее часто отмечается поражение влагалищ сухожилий сгибателей и разгибателей пальцев, характеризующееся болезненностью и припухлостью в области кисти. Пальпаторно выявляется крепитация при движениях. Сгибание пальцев может быть затруднено из-за тен- довагинита сухожилий сгибателей. В редких случаях формируются ревматоидные узелки в сухожилиях, что может послужить причиной их разрыва.
Аутоиммунный характер болезни с преимущественным поражением суставов и других соединительнотканных элементов обусловливает распространение патологического процесса на внутренние органы. Как следует из рабочей классификации, при РА могут поражаться практически все внутренние органы, однако частота и степень выраженности этих поражении различны. Как правило, поражение внутренних органов протекает субкли- нически, без выраженных симптомов.
Поражение сердца может проявляться миокардитом (обычно очаговым и поэтому труднодиагностируемым), а также эндокардитом. В редких случаях при РА формируются клапанные пороки (почти исключительно в виде недостаточности клапана аорты или митрального клапана). Степень поражения клапана обычно невелика, и порок проявляется «клапанными» (прямыми) симптомами, тогда как «косвенные» симптомы (указывающие на тяжесть расстройств гемодинамики и компенсаторную гипертрофию различных отделов сердца) отсутствуют либо выражены крайне незначительно.
Перикардит, как правило, является слипчивым и обнаруживается лишь при развитии застойных явлений в большом круге кровообращения, а также при рентгенологическом исследовании (на III этапе диагностического поиска). Выпотной перикардит наблюдается крайне редко и сочетается с плевритом.
Ревматоидное поражение легких выражается в виде диффузного фибро- зирующего альвеолита, узелкового поражения легочной ткани или легочного васкулита. В связи с этим данные физикального исследования очень скудные: признаки синдрома легочной недостаточности, эмфиземы легких, реже пневмосклероза с выслушиванием влажных звонких мелкопузырчатых хрипов в участках поражения.
При РА может развиться плеврит, обычно сухой, с бессимптомным течением. Следы перенесенного плеврита обнаруживают лишь при рентгенологическом исследовании (на III этапе). Исключительно редко наблюдается экссудативный плеврит с образованием небольшого количества выпота, быстро рассасывающегося.
Ревматоидное поражение почек диагностируется лишь на III этапе. Только при развитии амилоидоза почек и появлении нефротического синдрома могут отмечаться массивные отеки. В протеинурической стадии амилоидоза почек диагностические признаки можно выявить лишь при исследовании мочи.
Поражение нервной системы — полинейропатия — проявляется нарушениями чувствительности в зоне пораженных нервов. Реже возникают двигательные расстройства. Характерно поражение дистальных нервных стволов, чаще всего малоберцового нерва.
У 10—15 % больных бывают поражены слюнные и слезные железы, что диагностируют по сухости слизистой оболочки рта и конъюнктивы. Сочетание РА с поражением экзокринных желез носит название синдрома Шег- рена. В отдельных случаях выявляют увеличение печени и селезенки, иногда в сочетании с умеренным увеличением лимфатических узлов и лейкопенией. Такое сочетание носит название синдрома Фелти.
Поражение сосудов характерно для РА. Во время осмотра ногтей и дистальных фаланг можно выявить небольшие коричневатые очаги — следствие локальных микроинфарктов. Реже наблюдаются васкулиты более крупных сосудов. При РА может развиться синдром Рейно — результат артериита.
Поражение глаз встречается нечасто и обычно выражается в виде двустороннего склерита.
На III этапе диагностического поиска устанавливают степень активности воспалительного процесса, выраженность иммунологических сдвигов, уточняют степень поражения суставов и внутренних органов.
При лабораторном исследовании активность воспатительного процесса оценивают по наличию и выраженности острофазовых показателей (увеличение СОЭ, повышение уровня фибриногена, появление СРБ, повышение содержания а2-глобулинов). Для тяжелого течения РА, а также при поражении внутренних органов характерна гипохромная анемия, степень ее выраженности коррелирует со степенью активности патологического процесса.
Число лейкоцитов и иейтрофилов в периферической крови при РА обычно нормальное. Лейкоцитоз наблюдается при высокой лихорадке или лечении кортикостероидными препаратами, лейкопения — при синдроме Фелти — варианте течения РА.
Иммунные сдвиги при РА выражаются в появлении РФ в крови больных (в 70—90 % случаев). Как отмечаюсь, РФ синтезируется в плазматических клетках синовиальной оболочки, поэтому в начале болезни (в течение нескольких месяцев, реже лет), особенно при доброкачественном течении, РФ определяется только в синовиальной жидкости. В сыворотке крови РФ обнаруживают с помощью реакции Ваалера—Розе или латекс-теста. Величина титра РФ параллельна активности патологического процесса, быстроте прогрессирования и наличию внесу ставных проявлений болезни.
Титр РФ в реакции Ваалера—Розе 1:160 считается высоким. В низком титре (1:10 — 1:20) он может обнаруживаться в сыворотке здоровых лиц молодого возраста, а также при ряде заболеваний с иммунным механизмом развития СКВ, хроническом активном гепатите, циррозе печени. РФ появляется в различные сроки от начала болезни (обычно в течение 1—2 лет, иногда с самого ее начала). Прослеживается положительная корреляция титра РФ и его выявления на ранней стадии болезни с тяжестью артрита и развитием системных проявлений. В 10—20 % случаев РФ не выявляется ни в каком периоде болезни, это так называемые серонегативные формы болезни.
Другие проявления иммунных нарушений — LE-клетки, антиядерные антитела, антитела к гладким мышцам — обнаруживаются в существенно более низком титре, чем при СКВ.
При рентгенологическом исследовании выявляют изменения суставов. По выраженности этих изменений выделяют четыре стадии.
Стадия I — остеопороз без деструктивных рентгенологических изменений.
Стадия II — незначительное разрушение хряща, небольшое сужение суставной щели, единичные узуры костей.
Стадия III — значительное разрушение хряща и кости, выраженное сужение суставной щели, подвывихи, девиации костей.
Стадия IV — симптомы III стадии + анкилоз.
Эта стадийность отражает временное течение болезни: в ранней стадии изменения суставов могут не обнаруживаться или соответствуют I стадии, при длительно текущей болезни определяются III—IV стадии.
Для уточнения диагноза артрита производят диагностическую пункцию сустава с последующим исследованием синовиального выпота. При РА в синовиальной жидкости (в отличие от нормы) увеличено количество клеток (за счет иейтрофилов), содержание белка, выявляются рагоциты — нейтро-филы, фагоцитирующие РФ, и иммунные комплексы, содержащие РФ, а также сам РФ.
В ряде случаев проводят артроскопию в сочетании с биопсией синовиальной оболочки сустава с последующим морфологическим исследованием. Типичный признак — пролиферация клеток синовии с палисадообразным их расположением по отношению к наложениям фибрина. Другие изменения синовии в виде гиперплазии ворсин, лимфоидной инфильтрации, отложения фибрина, очаги некроза встречаются при артритах иного происхождения. Артроскопия на ранней стадии болезни позволяет четко дифференцировать РА от других воспалительных заболеваний суставов.
Электрокардиограмма, рентгенологическое исследование органов грудной клетки используются для выявления поражения сердца и легких при висцеральных формах РА.
На основании комплексной оценки клинических и лабораторных признаков выделяют три степени активности ревматоидного процесса: I степень — минимальная; II степень — средняя; III степень — высокая (табл. 23).
| Таблица 23. Клинико-лабораторные критерии активности ревматоидного артрита
|
На основании выраженности суставного синдрома и внесуставных поражений выделяют следующие клинические формы РА: 1) преимущественно суставная; 2) суставно-висцеральная; 3) сочетание РА с другими диффузными заболеваниями соединительной ткани или поражением суставов; 4) ювенильный РА.
Преимущественно суставная форма встречается у 80 % больных. У 66 % больных она протекает в виде хронического прогрессирующего полиартрита, у 14 % — в виде олиго- и моноартрита с подострым течением, поражением одного-двух крупных суставов (чаще коленных) и небольшой их деформацией.
Суставно-висцеральная форма встречается у 12—13 % больных, протекает с поражением внутренних органов и выраженными общими реакциями в виде лихорадки, снижения массы тела, с анемией, высокой активностью лабораторных показателей (острофазовых и иммунологических).
РА может сочетаться с другими заболеваниями соединительной ткани, в том числе с ревматизмом, а также развиваться на фоне уже имеющегося деформирующего остеоартроза.
Ювенильный РА (ЮРА) — форма РА у детей (в возрасте до 16 лет), отличающаяся от РА у взрослых. При ЮРА отмечается острое начало с высокой лихорадкой и внесуставными проявлениями (васкулит с поражением внутренних органов), значительными иммунными сдвигами. Поражаются преимущественно крупные суставы (моно-, олигоартрит) с частым вовлечением в патологический процесс суставов позвоночника. Часто отмечается поражение глаз (увеит), РФ обнаруживается редко. Прогноз и течение более благоприятны, чем РА у взрослых. Нередко отмечают его трансформацию в РА взрослых или болезнь Бехтерева.
В зависимости от темпа развития патологического процесса выделяют медленно прогрессирующий, быстро прогрессирующий и малопрогрессирующий (доброкачественный) РА.
На основании динамического исследования активности РА условно выделяют следующие варианты заболевания: «Легкий».
• Артралгии.
• Припухлость/болезненность 3—5 суставов.
• Внесуставные проявления отсутствуют.
• РФ отсутствует или выявляется в низких титрах.
• Показатели СОЭ и/или СРВ в пределах нормы или умеренно повышены.
• Отсутствие патологических изменений при рентгенологическом исследовании.
«Умеренно тяжелый».
• Артрит 6—20 суставов.
• Отсутствие внесуставных проявлений (в большинстве случаев).
• РФ выявляется в высоких титрах.
• Показатели СОЭ и/или СРВ стойко изменены.
• При рентгенологическом исследовании выявляются остеопения умеренное сужение межсуставных щелей, небольшие единичные эрозии.'
«Тяжелый».
• Артрит более 20 суставов.
• Быстрое развитие нарушений функции суставов.
• Стойкое значительное увеличение СОЭ и СРВ.
• Анемия, связанная с хроническим воспалением.
• Гипоальбуминемия.
• РФ выявляется в высоких титрах.
• При рентгенологическом исследовании отмечается быстрое появление новых эрозий.
• Экстраартикулярные проявления отсутствуют.
Осложнения. Поражение внутренних органов (легкие, сердце), разрывы сухожилий, синдромы Шегрена и Фелти считаются частью собственно РА. В качестве осложнений рассматривают амилоидоз почек и присоединение «септического» артрита.
Амилоидоз гистологически выявляется в 20—25 % случаев РА. Однако клинически он проявляет себя существенно реже и скорее связан с длительностью заболевания, чем с возрастом и полом. Наиболее характерный признак — протеинурия, которую можно выявить случайно. Иногда на наличие амилоидоза указывают высокая СОЭ и анемия при клинически неактивном РА. Могут наблюдаться также спленомегалия и синдром нарушенного всасывания. Диагноз ставят после морфологического исследования (биопсия слизистой оболочки десны или прямой кишки). Биопсия почек абсолютно диагностична.
Септический артрит встречается чаще всего у лиц, получавших корти- костероиды. При высокой температуре тела, увеличении сустава в объеме с признаками воспалительного процесса (отек, гиперемия, резкая болезненность) необходима немедленная аспирация экссудата с диагностической целью. Микроскопическое исследование экссудата обнаруживает нейтро- фильные лейкоциты в большом количестве. При развитии септического артрита все острофазовые показатели значительно изменяются.
Диагностика. При распознавании болезни учитывают следующие критерии: 1) утренняя скованность продолжительностью не менее 1 ч; 2) припухлость трех суставов и более; 3) артрит суставов кисти — припухлость лу- чезапястных, пястно-фаланговых или проксимальных межфаланговых суставов; критерии 1, 2, 3 должны сохраняться не менее 6 нед; 4) симметрич- 564 цость артрита; 5) ревматоидные узелки; 6) обнаружение РФ в сыворотке крови; 7) рентгенологические изменения типичны для РА.
В соответствии с этими критериями диагноз РА достоверен при выявлении не менее четырех.
Дифференциальная диагностика. РА следует дифференцировать от целого ряда заболеваний, сопровождающихся поражением суставов. Дифференциальная диагностика особенно сложна на ранней стадии болезни, когда отсутствует РФ, а также при суставно-висцеральных формах болезни.
РА следует дифференцировать от ревматического полиартрита, деформирующего остеоартроза, суставного синдрома при СКВ, склеродермии, болезни Бехтерева, псориатического артрита и болезни Рейтера.
При ревматизме артрит отличается «летучестью»; поражаются крупные суставы; назначение противоревматических препаратов (ацетилсалициловая кислота, бутадион, индометацин) быстро купирует суставные изменения. На первое место выступает поражение сердца: при первичной атаке порок еще не сформирован, однако признаки ревмокардита отчетливо выражены. В дебюте РА суставной синдром не поддается быстрому обратному развитию при лечении нестероидными противовоспалительными препаратами, сердце не поражено. При рецидивах ревматического полиартрита порок сердца обычно уже отчетливо сформирован, причем, если имеется стеноз устья аорты или стеноз митрального клапана, вероятность РА исключается. Наличие митральной или аортальной недостаточности не исключает РА, однако гемодинамические изменения при пороке, развившемся при РА, весьма незначительны в отличие от порока сердца ревматического происхождения. Наконец, суставные изменения при ревматизме полностью обратимы, чего не бывает при РА.
При остеоартрозе преимущественно поражаются дистальные межфа- ланговые суставы с образованием костных разрастаний около суставов (узелки Гебердена), а также голеностопные и коленные; в последующем возможно поражение тазобедренных суставов и суставов позвоночника. Заболевание развивается у лиц среднего и пожилого возраста, часто в сочетании с нарушением жирового обмена. Боли возникают при нагрузке и стихают в покое, нет утренней скованности. Острофазовые показатели отсутствуют. При рентгенологическом исследовании обнаруживают изменения, не свойственные РА (разрастание костной ткани — остеофиты, подхряще-вой остеосклероз, сужение суставной щели, кистевидные просветления в эпифизах).
Суставной синдром при СКВ, ССД не является основным. В отличие от РА при этих заболеваниях на первое место выступает поражение кожи (наиболее характерное для ССД), а также поражение внутренних органов, особенно при СКВ. При СКВ и ССД обычно выражен миозит, нередко наблюдают синдром Рейно (особенно часто при ССД), мышечно-висцераль-ный синдром (нарушение акта глотания при ССД), чего обычно не бывает при РА. Рентгенологические изменения суставов при СКВ и ССД незначительны и существенно отличны от изменений РА.
Наконец, при СКВ существенно выражены иммунологические изменения, не наблюдающиеся в такой мере при РА. Динамическое наблюдение за больными позволяет выявить преимущественное поражение суставов при РА, а висцериты и кожные поражения — при СКВ и ССД.
Болезнь Бехтерева — анкилозирующий спондилоартрит, характеризуется поражением мелких суставов позвоночника, распространяющимся «снизу— вверх» в определенной последовательности: сакроилеальные суставы, поясничный, грудной, шейный отделы позвоночника, что проявляется упорными болями в спине и ограничением подвижности позвоночника. Трудности в дифференциальной диагностике возникают при так называемой периферической форме болезни, когда преимущественно поражаются нижние конечности — коленные, голеностопные, тазобедренные суставы. Острые воспалительные проявления болезни, как правило, неяркие, болезнь начинается постепенно, исподволь. При дифференциации следует обратить внимание на поражение позвоночника, особенно илеосакрально-го отдела. Болезнь Бехтерева преимущественно выявляется у мужчин в молодом возрасте, заболевание генетически детерминировано (у 90—97 % определяется антиген гистосовместимости HLAB27, тогда как в популяции он встречается у 5—10 %).
Псориатический артрит возникает примерно у 5 % больных псориазом. Характерно поражение дистальных суставов кистей и стоп, но могут поражаться и другие суставы (включая позвоночник). Обострение кожного процесса обычно сопровождается обострением полиартрита. Трудность диагностики обусловлена тем, что поражение кожи может ограничиваться единичными бляшками, для выявления которых необходим тщательный осмотр волосистой части головы. Иногда артрит развивается раньше, чем поражение кожи. В крови РФ обычно отсутствует. Острофазовые показатели выражены нерезко.
Синдром (болезнь) Рейтера — острое заболевание, характеризующееся сочетанием полиартрита, уретрита, конъюнктивита; в более редких случаях отмечаются кишечные расстройства и своеобразный дерматит подошвенной стороны стопы. Болезнь развивается в ответ на урогенитальную инфекцию хламидиями, в более редких случаях — кишечную инфекцию сальмонеллами. Имеет значение наследственная предрасположенность к подобным реакциям организма. Трудность диагностики обусловлена тем, что у многих пациентов эпизод острого уретрита, конъюнктивита, кишечных расстройств бывает кратковременным или вообще отсутствует; суставной же синдром по течению напоминает РА стойкостью изменений, наличием достаточно выраженных местных, общих и лабораторных показателей воспаления, признаками «утренней скованности». При проведении дифференциального диагноза следует помнить, что болезнь Рейтера поражает суставы нижних конечностей — коленные, голеностопные (асимметрично, «снизу—вверх»), артрит часто сочетается с сакроилеитом, поражением ахиллова сухожилия, подошвенным фасциитом. Поражение мелких суставов кисти практически не наблюдается. РФ в крови не выявляется.
Формулировка развернутого клинического диагноза соответствует основным рубрикам, рабочей классификации РА и включает: 1) клинико-анато- мическую характеристику (полиартрит, олиго-, моноартрит, сочетание поражения суставов с висцеритами или другими заболеваниями); 2) клинико- иммунологическую характеристику (наличие или отсутствие РФ); 3) тяжесть болезни и характер течения (медленно или быстро прогрессирующий, малопрогрессирующий); 4) степень активности; 5) рентгенологическую характеристику (по стадиям); 6) функциональную способность больного (сохранена, утрачена, степень утраты).
Лечение. При РА назначают комплексную терапию, направленную на ликвидацию воспалительного процесса в суставах, коррекцию иммунных нарушений, восстановление нарушенной функции пораженных суставов, увеличение продолжительности жизни.
В настоящее время радикально пересмотрена тактика назначения лекарственных препаратов. Ранее лечение начинали с НПВП, однако если эффекта не было, то проводили так называемую базисную терапию.
Современные рекомендации лечения РА.
• Базисную терапию начинают сразу, как только устанавливают диагноз
РА.
• Лечение начинают с наиболее эффективного препарата.
• Базисная терапия продолжается неопределенно долго.
• При отсутствии эффекта следует сменить базисный препарат.
• При отсутствии эффекта от монотерапии необходимо проводить комбинированную базисную терапию.
Базисную терапию следует начинать как можно раньше, особенно у больных, у которых имеются факторы риска:
• Высокие титры РФ.
• Выраженное увеличение СОЭ.
• Поражение более 20 суставов.
• Внесуставные проявления (ревматические узелки, поражение внутренних органов).
Метотрексат в настоящее время рассматривается как препарат выбора («золотой стандарт») при «серопозитивном» активном РА.
Метотрексат вначале назначают в дозе 7,5 мг (пробная доза), затем ее постепенно увеличивают до 15—25 мг/нед. Во время лечения метотрексатом категорически запрещается употребление алкоголя (даже малых доз) и пищевых продуктов, содержащих кофеин. Метотрексат следует принимать в вечернее время 1 раз в неделю (дробный прием вызывает токсические реакции в виде стоматита, поражения ЖКТ, редко — миелосупрессии). Для уменьшения выраженности побочных эффектов метотрексата в день его приема отменяют НПВП (если больной их получает). Через 24 ч после приема метотрексата назначают фолиевую кислоту (не менее 1 мг/сут) вплоть до следующего приема. Эффект лечения оценивается спустя 4—8 нед. При повышении дозы метотрексата оценка токсичности производится спустя 6 дней. Парентеральное введение используется в случае отсутствия эффекта от перораль- ного приема или при развитии токсических реакций.
Другой базисный препарат — соли золота в виде внутримышечных инъекций: пробная доза 10 мг/нед, затем 25—50 мг/нед. Ожидаемый эффект наступает через 3—6 мес. Поддерживающая доза составляет 50 мг в 2—4 нед. Лечение солями золота потенциально показано всем больным с активным РА (как с ранним эрозивным артритом, так и в развернутой стадии заболевания) при отсутствии явных противопоказаний. Фактически терапия солями золота (кризотерапия) показана больным, имеющим противопоказания для назначения метотрексата (заболевания печени, легких, злоупотребление алкоголем).
Еще один базисный препарат — сульфасалазин по 0,5 г/сут в 2 приема после еды. Дозу постепенно увеличивают до 2—3 г/сут. Ожидаемый результат лечения — 1—2 мес. Сульфасалазин применяют при низкой активности РА. Его можно назначать больным, которым противопоказано лечение метотрексатом.
Циклофосфамид, D-пеницилламин, циклоспорин А в настоящее время применяют редко в первую очередь из-за побочных эффектов и отсутствия достоверных данных о влиянии на прогрессирование поражения суставов. Их применяют главным образом у больных РА, рефрактерных к метотрек-сату.
Аминохинолиновые препараты не назначают изолированно, их добавляют к сульфасалазину при низкой активности РА: гидроксихлорохин назначают внутрь по 400 мг/сут в 2 приема после еды (ожидаемый эффект — спустя 2—6 мес).
В последние годы стали применять моноклональные антитела к ФНО-ос (инфликсимаб, выпускаемый под названием «ремикейд»), являющийся препаратом выбора у пациентов, резистентных к терапии базисными препаратами; препарат вызывает быструю положительную динамику клинических проявлений и лабораторных показателей (СОЭ, СРБ), замедляет прогрессирование деструкции суставов (независимо от пола и возраста). Разовая доза составляет 3 мг/кг, препарат вводят повторно в той же дозе через 2 и 6 нед после первого введения и затем каждые 8 нед. Лечение ремикейдом следует проводить одновременно с применением метотрексата.
НПВП назначают практически всем больным с РА. Они оказывают обезболивающее и противовоспалительное действие, что особенно важно, так как лечебный эффект базисной терапии проявляется не сразу после ее назначения. Наиболее часто используют напроксен (0,75—1 г/сут), диклофенак-натрий-ретард (100—150 мг/сут), ибупрофен (1,2—1,6 г), ме- локсикам (7,5 мг 2 раза в сутки). Существует индивидуальная чувствительность к НПВП, и вследствие этого может отмечаться неадекватно высокое лечебное действие отдельных лекарственных препаратов.
ГКС (преднизолон) назначают внутрь при РА исключительно редко: в случаях яркого воспалительного процесса в суставах, высокой лихорадки, при висцеральных поражениях; лечение прекращают в тот период, когда проявляется эффект длительно действующих антиревматоидных препаратов — метотрексата, препаратов золота.
Из сказанного следует, что ГКС применяют лишь в комбинации с базисными препаратами. Если воспалительный процесс упорно держится в каком-либо суставе, то хороший эффект получают при внутрисуставном введении ГКС (депомедрол, метипред, дипроспан, кеналог).
Физиотерапевтические методы: фонофорез гидрокортизона, электрофорез гиалуронидазы, тепловые процедуры — способствуют уменьшению местного воспалительного процесса в суставах. Положительный эффект оказывают также аппликации димексида в сочетании с растворами НПВП на наиболее пораженные суставы при болях и признаках воспаления.
Кроме лекарственных, физиотерапевтических методов лечения, применяют так называемые нестандартные методы лечения, к которым относятся:
1) плазмаферез — удаление плазмы крови с целью снижения содержания циркулирующих иммунных комплексов;
2) лейкоцитоферез — удаление лейкоцитов (иммунных лимфоцитов);
3) облучение пораженных суставов лазерным лучом низкой мощности (наружное или внутрисуставное) с целью воздействия на синовиальную оболочку;
4) криотерапия (воздействие сверхнизких температур на суставы) для уменьшения выраженности воспалительного процесса в суставе;
5) хирургические методы лечения (ранняя синовэктомия, реконструктивные операции, замена пораженного сустава протезом).
Прогноз. Ожидаемая продолжительность жизни у больных РА ниже на 3 года у женщин и на 7 лет у мужчин. Однако, поскольку причины смерти у больных РА не отличаются от таковых в общей популяции, этот диагноз в большинстве случаев не фигурирует среди причин смерти. Смертность у больных РА выше, чем в общей популяции (основные причины — инфекции, поражение почек, респираторные заболевания, поражения ЖКТ). Болезнь в молодом возрасте, сохранение активности процесса более 1 года, высокий титр РФ и наличие ревматоидных узелков делают прогноз в отно шении восстановления функции сустава неблагоприятнымЛ сшеваний
ш Профилактика заключается в предупреждении °A/AAZpmcA- „ пяльнейшего прогрессирования поражения суставов. В отношении родм ведаиков больногоАвозмоАо проведение первичной лоДл"*" га?ь переохлаждений, тщательно лечить интеркуррентные инфекции).
Остеоартроз
Остеоартроз (OA) — гетерогенная группа заболеваний различной этиологии, но со сходными биологическими, морфологическими и клиническими проявлениями и исходом, в основе которых лежит поражение всех компонентов сустава (в первую очередь хряща, а также субхондральной кости, синовиальной оболочки, связок, капсулы и периартикулярных мышц).
Дегенерация суставного хряща является нормальным физиологическим процессом и после 60 лет отмечается в 100 % случаев. Этапы возрастной дегенерации хрящевой ткани:
1) уменьшение содержания хондроитинсульфата, что приводит к изменению гидродинамических свойств хряща и скорости диффузии питательных веществ;
2) замещение основного вещества хряща соединительной тканью вследствие гибели хондроцитов;
3) потеря эластичности и упругости хряща;
4) разволокнение хрящевой ткани, появление изъязвлений с обнажением подлежащей кости в зоне наибольшей нагрузки (обычно в середине суставной поверхности кости).
При OA происходит подобная, только более ранняя и быстрая дегенерация хряща, сопровождающаяся изменениями окружающих тканей. OA — самое частое заболевание суставов, которым страдает не менее 20 % населения земного шара. Заболевание обычно начинается в возрасте старше 40 лет. Рентгенологические признаки OA обнаруживают у 50 % людей в возрасте 55 лет и у 80 % — старше 75 лет. Поражение коленного сустава (гонартроз) чаще развивается у женщин, а тазобедренного сустава (коксар- троз) — у мужчин.
Этиология. Различают первичный и вторичный OA. Первичный OA — развитие преждевременного старения хряща суставов, ранее не поврежденных патологическим процессом. Вторичный OA — поражение хряща суставов, ранее подвергавшихся патологическим воздействиям.
При первичном OA имеют значение следующие факторы: 1) генетический (в семьях, где имеются больные OA, это заболевание встречается в 2 раза чаще, чем в контрольной группе), имеют значение дефекты гена коллагена II типа; 2) эндокринный (в климактерическом периоде OA развивается более быстрыми темпами); 3) постоянная микротравматизация сустава неадекватными физическими нагрузками (в частности, спортивными).
При вторичном OA отмечается снижение резистентности хряща к обычной (физиологической) нагрузке вследствие: 1) травм хряща; 2) врожденных нарушений статики; 3) слабости мышц и связок; 4) бывших ранее артритов; 5) нарушений конгруэнтности суставных поверхностей.
Патогенез. При OA все этапы возрастной дегенерации хряща протекают быстрее и в более молодом возрасте. В патогенезе клинических проявлений OA играют роль три фактора: 1) изменение суставных поверхностей кости; 2) фиброзио-склеротические изменения синовиальной оболочки; 3) реактивный синовит.
В основе патогенеза OA лежит нарушение нормального обмена хрящевой ткани в сторону преобладания катаболических процессов над анаболическими. Нарушение выработки медиаторов и ферментов при патологии хондропитов включает синтез провоспалительных цитокинов, особенно ИЛ-1, под действием которого хондроциты синтезируют протеиназы, вызывающие деградацию коллагена и протеогликана хряща. Синтезируются простагландины, принимающие участие в развитии воспаления, избыточно образуется оксид азота, оказывающий токсическое воздействие на хрящ.
Основное вещество хряща, покрывающего суставную поверхность хряща (кислые и нейтральные мукополисахариды), перерождается, местами исчезает, замещаясь плотной соединительной тканью. Хондроциты гибнут, хрящ становится тусклым, сухим, теряет эластичность, может растрескиваться и изъязвляться с обнажением подлежащей кости.
Однако этот процесс нетождествен эрозивному артриту при РА, при котором разрушение хряща осуществляется рыхлой соединительной тканью
— паннусом. Субхондрально развивается остеосклероз, на периферии суставных поверхностей возникают разрастания кости — остеофиты.
Фиброзно-склеротические изменения захватывают капсулу сустава и синовиальную оболочку. Возникают также фиброзные изменения связочного аппарата с их кальцинацией, что обусловливает подвывихи сустава.
Реактивный синовит (воспаление синовиальной оболочки) возникает вследствие раздражения внутрисуставным детритом — кусочками некроти- зированного хряща. Иногда отмечается гипертрофия ворсин синовиальной оболочки с хрящевой или костной метаплазией, отрыв таких измененных ворсин ведет к появлению суставных «мышей».
Клиническая картина. OA встречается преимущественно у женщин 40— 60 лет. Основным проявлением является суставной синдром. Выделяют следующие основные формы поражения суставов при OA:
• поражение тазобедренного сустава — коксартроз. Это наиболее тяжелая форма болезни, встречается в 40 % всех случаев OA;
• поражение коленного сустава — гонартроз, встречается в 33 % случаев. Первичная форма наблюдается преимущественно у женщин в климактерическом периоде, вторичная форма — результат травмы сустава, нарушения статики;
• поражение дистальных межфаланговых суставов с образованием узелков Гебердена (костные разрастания в области суставов). Встречается у Уз всех больных OA. Наблюдается преимущественно у женщин в климактерическом периоде;
• поражение суставов позвоночника — межпозвоночных дисков (спондилез или остеохондроз позвоночника) и синовиальных межпозвоночных суставов (спондилоартроз).
На I этапе диагностического поиска выявляется основная жалоба больного
— боли в пораженном суставе и некоторое ограничение подвижности в нем. Боли имеют ряд особенностей, они связаны с нагрузкой пораженного сустава, поэтому получили наименование «механических». Болезнь обычно начинается незаметно, и вначале больные отмечают лишь неясные, неинтенсивные боли в пораженных суставах (или одном суставе), появляются к концу дня и исчезают в покое. По мере развития патологических изменений в суставе боли становятся интенсивнее и длительнее, для их появления достаточно небольшой физической нагрузки. Отмечают так называемые стартовые боли, возникающие в начале ходьбы; постепенно больной «врабатывается» и боли стихают, но затем при длительной нагрузке появляются вновь и исчезают (уменьшаются) лишь при прекращении нагрузки. Боли в пораженных суставах (тазобедренном, позвоночнике) могут появляться при длительной фиксированной позе — работа сидя, длительное пребывание в вертикальном положении, для уменьшения болевых ощущений больной должен обязательно изменить позу. Причины болей не связаны с поражением собственно хряща (он лишен нервных окончаний), а определяются поражением костей, суставов (растяжение измененной капсулы сустава и связочного аппарата, сдав-ление нервных окончаний фиброзной тканью капсулы сустава), околосуставных тканей. Особое место занимают реактивные синовит, тендовагинит, обусловленные раздражением синовиальной оболочки детритом, а также неспецифическими факторами — переохлаждением, чрезмерной для больных физической нагрузкой. При развитии реактивного синовита больные отмечают отечность пораженного сустава, увеличение его в объеме, резкое усиление болей при движении. Иногда отмечается повышение температуры тела до субфебрильных цифр.
Движения в суставе в начале процесса из-за болей слегка ограничены, в дальнейшем по мере развития изменений капсулы сустава и связочного аппарата амплитуда движений может значительно ограничиваться (в особенности при коксартрозе). В ряде случаев развивается так называемая блокада сустава — внезапная резкая боль, почти полная невозможность движений в суставе, что обусловлено ущемлением суставной «мыши» между суставными поверхностями. Характерный симптом OA — крепитация (хруст, треск или скрип) в суставах при движении, возникающая вследствие нарушения конгруэнтности суставных поверхностей.
Своеобразны жалобы больных при поражении позвоночника. Отмечаются не только боли в пораженном отделе при длительной фиксированной позе, но и болевые ощущения в других местах (например, в грудной клетке, что иногда имитирует стенокардию, а также нижних конечностях, что сочетается со слабостью в мышцах бедер).
На II этапе диагностического поиска можно выявить изменения в пораженных суставах. Так, дистальные межфаланговые суставы кистей становятся менее подвижными, в них развиваются анкилозы, а также определяются узловатые образования — узелки Гебердена, представляющие костные разрастания. Такие же костные образования могут определяться и в проксимальных межфаланговых суставах — узелки Бушара. Постепенно искривляются и заостряются ногтевые фаланги пальцев кисти.
Могут развиться подвывихи в мелких суставах кисти, стопы, а также в голеностопном суставе (при OA в результате чрезмерных физических нагрузок и повторных травм).
В случае поражения межпозвоночных дисков и суставов позвоночника могут наблюдаться болезненность при поколачивании остистых отростков позвонков, а также симптомы вторичного корешкового синдрома вследствие сдавления остеофитами нервных корешков.
Если поражен тазобедренный сустав, то нарушается походка в связи с укорочением конечности вследствие сплющивания головки бедра. Фиброзно- склеротические изменения капсулы сустава нарушают отведение конечности. Постепенно развивается атрофия мышц бедра.
Можно обнаружить деформацию коленного сустава, развившуюся вследствие утолщения и сморщивания капсулы сустава, а также за счет остеофитов.
Пальпация выявляет также болезненность по ходу суставной щели в медиальной ее части, а также в местах прикрепления сухожилий к костям.
При развитии вторичного синовита появляется припухлость пораженного сустава, пальпация становится болезненной, объем движений уменьшается. Снижается чувствительность кончиков пальцев, возникают парестезии, чувство онемения.
Физикальное обследование больного позволяет утвердиться в предположении о наличии OA.
На III этапе диагностического поиска необходимо отвергнуть ряд заболеваний, протекающих со сходным суставным синдромом, а также уточнить характер и выраженность поражений суставов.
При исследовании периферической крови при OA не отмечается никаких патологических сдвигов. Лишь при наличии реактивного синовита можно отметить появление нерезко выраженных острофазовых показателей (увеличение СОЭ до 20—25 мм/ч, появление СРВ).
Точно так же при биохимическом исследовании крови не выявляют никаких сдвигов, характерных для OA; иммунологические показатели не изменены (РФ отсутствует, нет LE-клеток, не определяются антитела к гладкой мышечной ткани, к ДНК, антинуклеарный фактор).
Рентгенологическое исследование суставов выявляет изменения, прогрессивно нарастающие параллельно длительности болезни и тяжести клинической картины. Выделяют четыре стадии рентгенологических изменений.
Стадия I — нормальная суставная щель, нерезко выражены остеофиты.
Стадия II — выраженные остеофиты, незначительное сужение суставной щели.
Стадия III — множественные остеофиты, явное сужение суставной щели, умеренная деформация суставных поверхностей кости, субхондраль-ный остеосклероз.
Стадия IV — резко выраженные многочисленные остеофиты, резко выраженное сужение суставной щели, деформация суставных поверхностей, далеко зашедший остеосклероз.
При поражении позвоночника отмечаются следующие варианты поражения:
а) спондилез: по краям тел позвонков появляются так называемые шипы — остеофиты;
б) спондилоартроз — поражение суставов позвоночника (как известно, у каждого грудного позвонка имеется четыре межпозвоночных и два позво- ночно-реберных сустава);
в) остеохондроз — поражение межпозвоночных дисков, нередко с фор мированием так называемых грыж Шморля и пролабированием пульпар- ного ядра межпозвоночного диска в том или ином направлении.
Диагностика. OA диагностируют на основании выявления характерных клинических признаков (боли, темп развития болезни, характер поражения определенных суставов) и данных рентгенологического исследования. При постановке диагноза необходимо учитывать возраст больного, пол и факторы, которые могут быть причиной возникновения OA.
Институтом ревматологии (1993) предложены критерии OA:
Клинические критерии.
1. Боли в суставах, возникающие в конце дня и/или в первую половину ночи.
2. Боли в суставах, возникающие при физической нагрузке и уменьшающиеся в покое.
3. Деформация сустава за счет костных разрастаний (включая узелки Гебердена и Бушара).
Рентгенологические критерии.
1. Сужение суставной щели.
2. Остеосклероз.
3. Остеофитоз.
Критерии 1—2 — основные; критерии 3 — дополнительные. Для постановки диагноза OA наличие первых двух клинических и рентгенологических критериев обязательно.
Вместе с тем необходимо исключить ряд заболеваний, при которых поражение суставов напоминает клиническую картину OA. В первую очередь необходимо исключить РА у лиц пожилого возраста. Основой для такой дифференциации является следующее: поражение крупных суставов при РА появляется после длительного периода болезни, сам РА дебютирует поражением мелких суставов кисти и стопы (проксимальных межфаланговых, но отнюдь не дистальных, что типично для OA). Узелки Гебердена иногда принимают за ревматоидные узелки, однако последние локализуются в других местах (под кожей локтевых суставов). Исследование синовиальной жидкости при OA не выявляет характерных для РА признаков воспаления, а при биопсии синовиальной оболочки диагностируют фиброз, а также незначительную клеточную инфильтрацию.
Формулировка развернутого клинического диагноза учитывает: 1) локализацию поражения; 2) фазу заболевания (обострение, ремиссия); 3) наличие вторичных изменений в мышцах, нервных корешках и пр.
Лечение. Лечение OA продолжает оставаться сложной и нерешенной задачей.
Назначают комплексное лечение, которое преследует следующие цели: замедление прогрессирования патологического процесса, уменьшение выраженности боли — основной причины обращения больного к врачу; нормализацию обменных процессов в суставном хряще, улучшение функции пораженных суставов.
Поскольку увеличенная масса тела и снижение тонуса мышц — факторы риска развития и прогрессирования OA, нормализация массы тела и укрепление мышц являются важными направлениями в лечении OA.
• Ликвидация болевого синдрома обеспечивается назначением ненаркотических анальгетиков центрального действия (парацетамол), НПВП и так называемых хондропротекторов.
• При умеренных болях без признаков воспаления (синовит) следует периодически назначать ненаркотический анальгетик центрального действия (парацетамол в дозе до 4 г/сут). Его преимуществом перед НПВП считают меньшую вероятность развития побочных эффектов со стороны ЖКТ.
• У больных с выраженными постоянными болями, часто связанными не только с механическими факторами, но и с воспалением (синовит), препаратами выбора считаются НПВП. Наиболее предпочтительны ибу- профен (в дозе 1200—1400 мг/сут), кетопрофен (100 мг/сут), диклофенак (100 мг/сут). НПВП оказываются эффективными в меньших дозах, чем при лечении РА. Рационально, однако, начинать лечение с полной дозы, а при достижении обезболивающего эффекта дозу снижают до необходимой поддерживающей. При улучшении состояния больного НПВП отменяют, но при обострении их назначают повторно. Применение пироксикама и индометацина не рекомендуется в силу того, что они ослабляют действие других препаратов, которые может принимать пациент пожилого возраста (например, гипотензивные препараты). Кроме того, индометацин оказывает хондродеструктивное действие, и его прием может способствовать про- гессированию дегенерации хряща. У больных пожилого возраста, принимающих НПВП, следует иметь в виду возможность развития эрозивного гастрита, поэтому рекомендуются препараты, оказывающие селективную блокаду фермента циклооксигеназа-2 (ЦОГ-2) — мелоксикам (7,5 мг/сут), целекоксиб (целебрекс) в дозе 100—200 мг/сут.
Обезболивающий эффект оказывают аппликации димексида на пораженный сустав (особенно с добавлением раствора НПВП).
• Весьма эффективными препаратами считаются естественные компо ненты суставного хряща (хондропротекторы) — хондроитин сульфат натрия и глюкозамин.
Хондроитин сульфат назначают в дозе 1000—1500 мг/сут в 2—3 приема длительно (возможны повторные курсы), что позволяет снизить дозу НПВП. Сходной эффективностью и переносимостью обладает глюкозамин сульфат, который назначают в дозе 1500 мг/сут однократно в течение не менее 6 мес, повторными курсами.
При гонартрозе используют внутрисуставное введение производных гиалуроновой кислоты.
• Улучшение функции пораженных суставов достигается применени ем физиотерапевтических методов лечения: ЛФК, тепловые процедуры (парафиновые аппликации, озокерит), электропроцедуры (токи УВЧ или ультразвук на область пораженных суставов). Используют также электро форез лидазы и йодида калия, способствующий рассасыванию фиброзной ткани капсулы сустава и прикрепляющихся к суставу сухожилий.
При стихании обострения и уменьшении болей хороший эффект оказывает санаторно-курортное лечение (лечебные грязи, радиоактивные или сульфидные ванны).
• Хирургическое лечение (артроскопические операции для удаления хрящевого детрита) достаточно эффективно. Эндопротезирование тазобед ренного или коленного сустава проводят только при тяжелом инвалидизи- рующем поражении этих суставов.
Прогноз. OA (в особенности первичный) редко приводит к потере трудоспособности. Однако при локализации процесса в тазобедренном суставе вследствие быстро прогрессирующего ограничения движений больной становится инвалидом.
Профилактика. Первичная профилактика сводится к борьбе с внешними факторами, которые могут способствовать развитию дегенеративных изменений в суставном хряще (избегать постоянной микротравматизации суставов, длительной функциональной перегрузки; нормализация массы тела и пр.).
Подагра
Подагра (П) — заболевание, обусловленное нарушением обмена пуринов; характеризуется гиперурикемией, рецидивирующим острым, а в последующем и хроническим артритом, а также поражением почек.
Сущность заболевания состоит в нарушении обмена мочевой кислоты, в результате чего в суставах и околосуставной клетчатке откладываются кристаллы мононатриевых уратов, что приводит к развитию артрита. Кроме того, отмечают избыточное образование уратных камней в мочевыводя-щих путях, лоханках, а также развитие интерстициального нефрита.
Увеличение содержания в организме мочевой кислоты обусловливают три механизма: 1) метаболический — увеличение синтеза мочевой кислоты; 2) почечный — снижение экскреции мочевой кислоты почками; 3) смести щанныи — умеренное увеличение синтеза мочевой кислоты в сочетании со снижением ее экскреции почками.
Все эти механизмы нарушения обмена мочевой кислоты принимают участие в развитии подагры.
Частота подагрического артрита в популяции составляет на 1000 населения: 5—28 мужчин и 1—6 женщин. Пик заболеваемости приходится на возраст 40—50 лет у мужчин и старше 60 лет у женщин (до менопаузы женщины практически не болеют подагрой). Соотношение мужчин и жен- шин среди пациентов составляет 2—7:1. Подагра — одно из самых частых заболеваний суставов у лиц старше 40 лет.
Этиология. Различают первичную и вторичную подагру. Первичная, или идиопатическая, подагра — наследственная болезнь, детерминированная совместным действием нескольких патологических генов. В ее развитии, кроме наследственной предрасположенности, играет роль алиментарный фактор — повышенное употребление с пищей продуктов с избыточным содержанием пуринов, а также жиров, углеводов и алкоголя.
Вторичная подагра — результат гиперурикемии, возникающей при некоторых заболеваниях: гемобластозах, новообразованиях, болезнях почек, сердечной недостаточности, некоторых обменных и эндокринных заболеваниях, а также приема отдельных гиперурикемизируюших лекарственных препаратов (диуретики, салицилаты, цитостатические препараты, кортикостероиды).
Патогенез. При подагре наблюдается нарушение соотношения синтеза и выделения мочевой кислоты из организма.
Вследствие генетически обусловленного нарушения функции ферментов, участвующих в метаболизме пуринов (снижение или отсутствие глю-козо-6- фосфатдегидрогеназы, гипоксантинфосфорибозилтрансферазы и др.), повышается синтез мочевой кислоты и возникает постоянная гиперу-рикемия. Наряду с этим экскреция почками уратов снижается. В результате этих процессов в организме накапливаются ураты и происходит их отложение преимущественно в соединительной ткани суставов, почек, в других тканях. Под влиянием уратных кристаллов осуществляется стимуляция фагоцитами, синовиатьными клетками и другими компонентами сустава про- воспалительных медиаторов (ИЛ-1, ФНО-а, ИЛ-8, ИЛ-6, фосфолипаза А2. анафилотоксины и пр.). В ответ на эти процессы нейтрофилы поступают i полость сустава, где происходит фагоцитоз кристаллов; уратные кристалль повреждают лизосому нейтрофила с последующим выходом лизосомальны) ферментов и развитием воспаления. Основные звенья патогенеза подагрь представлены на схеме 25.
Клиническая картина. Развитие заболевания проявляется различным 1 синдромами.
• Поражение суставов в виде острого подагрического артрита (чащ всего моноартрита) и формирования хронического полиартрита. В основ острого артрита лежит острая преципитация кристаллических уратов в си новиальной жидкости с последующим их фагоцитозом нейтрофилами. Фа гоцитирующие лейкоциты затем разрушаются, и в полость сустава посту пает большое количество лизосомных ферментов, вызывающих воспали тельную реакцию синовиальной оболочки и периартикулярных ткане (артрит).
• Поражение почек в виде мочекаменной болезни и «подагрически почки» (интерстициальный нефрит, редко диффузный гломерулонефрит В основе «подагрической почки» лежит отложение уратов или мочевой кг
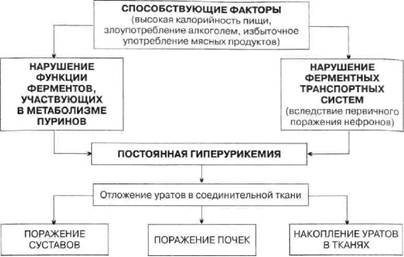
|
слоты в мозговом, реже в корковом, веществе почки. Эти отложения носят очаговый характер, располагаются в межуточной ткани. Вокруг них развивается воспалительная реакция. Клубочки поражаются редко (утолщение стенок капилляров, клеточная пролиферация, гиалиновые отложения и склероз клубочков).
• Поражение периферических тканей (отложение уратов, формирующих специфические для подагры подагрические узлы). Подагра может достаточно часто сочетаться с другими заболеваниями обмена веществ: сахарным диабетом, нарушением жирового обмена, атеросклерозом и гипертонической болезнью.
Подагра диагностируется у мужчин 30—50 лет (98 % всех больных); женщины заболевают лишь в климактерическом периоде.
На I этапе диагностического поиска можно получить информацию о начале заболевания, характерных признаках острого подагрического артрита и дальнейшем вовлечении суставов в патологический процесс, о наличии и выраженности почечного синдрома.
Подагра проявляется чаще всего в виде атаки острого подагрического артрита, часто развивающегося среди полного здоровья у мужчин старше 30 лет. Провоцирующими факторами приступа могут быть переохлаждение, легкая травма, длительная ходьба, злоупотребление алкоголем или обильной мясной жирной пищей, интеркуррентные инфекции. Приступ начинается внезапно, чаще ночью, проявляется резчайшими болями в плюснефаланговом суставе большого пальца стопы, реже в других суставах стопы (голеностопном, коленном, крайне редко — в лучезапястном, локтевом). Резчайшие боли отмечаются в покое, усиливающиеся при опускании конечности. Возможно повышение температуры тела до 38—39 "С «на высоте» болей. Сустав опухает, становится синевато-багровым. Приступ длится 3—10 дней, затем боли полностью исчезают, функция сустава восстанавливается, внешне сустав приобретает нормальную форму. С течением времени отмечается укорочение межприступных периодов и увеличение продолжительности суставных болей. В патологический процесс вовлекаются и другие суставы. С годами больные отмечают деформацию суставов, ограничение подвижности (поражаются преимущественно суставы нижних конечностей). При вовлечении в патологический процесс почек (развитие мочекаменной болезни) наблюдаются приступы почечной колики со всеми характерными признаками, отхождение камней.
На II этапе диагностического поиска во время приступа острого подагрического артрита выявляются характерные его признаки: припухлость сустава, резкая болезненность при пальпации, изменение цвета кожи над суставом. В межприступный период все патологические изменения исчезают.
Со временем нарастают стойкие изменения в суставах конечностей, возникают признаки хронического полиартрита (чаще поражаются суставы ног): дефигурация сустава, ограничение подвижности, деформация суставов за счет узелковых отложений, костных разрастаний, появляются подвывихи пальцев, контрактуры, грубый хруст в суставах (коленных и голеностопных). Больные утрачивают трудоспособность и с трудом могут передвигаться.
При длительности заболевания более 3—5 лет появляются тофу-сы — специфичные для подагры узелки, представляющие собой отложения уратов, окруженные соединительной тканью. Они локализуются преимущественно на ушных раковинах, локтях, реже на пальцах кистей и стоп. Тофусы иногда размягчаются, самопроизвольно вскрываются с образованием свищей, через которые выделяется беловатая масса (кристаллы моче-кислого натрия). Свищи инфицируются редко. При развитии «подагрической почки» появляется АГ. Подагра предрасполагает к развитию нарушений жирового обмена, атеросклероза, способствует прогрессированию гипертонической болезни, других заболеваний сердечно-сосудистой системы (ИБС). Все это следует помнить при обследовании больных, страдающих подагрой.
На III этапе диагностического поиска можно: 1) подтвердить характерное поражение суставов; 2) выявить поражение почек; 3) детализировать степень нарушений пуринового обмена.
При рентгенологическом исследовании пораженных суставов обнаруживают изменения, которые развиваются в случаях тяжелого течения, большой длительности болезни при дебюте артрита в молодом возрасте. Наиболее значительные изменения следующие:
1) круглые «штампованные» дефекты эпифизов костей, окруженные склеротической каймой;
2) кистевидные дефекты, разрушающие кортикальный слой кости;
3) утолщение и расширение тени мягких тканей в связи с отложением в них уратов.
Поражение почек («подагрическая почка») проявляется протеинурией, цилиндрурией, обычно нерезко выраженной. В случае развития мочекаменной болезни при умеренной протеинурии наблюдаются гематурия и большое количество кристаллов мочевой кислоты в осадке. После приступа почечной колики гематурия усиливается.
Почечная недостаточность при поражении почек развивается редко. Выражением ее служат повышение в крови содержания мочевины, креатинина, резкое снижение фильтрации, относительная плотность мочи ниже 1015.
Нарушение пуринового обмена проявляется гиперурикемией (0,24— 0,5 ммоль/л, или 4—8,5 мг/100 мл).
Во время приступа подагрического артрита отмечают появление острофазовых показателей (нейтрофильный лейкоцитоз, увеличение СОЭ, повышение содержания фибриногена, а2-глобулина, появление СРВ), исчезающих после купирования приступа.
Диагностика. Распознавание болезни основывается на выявлении характерных приступов суставных болей, подагрических тофусов, гиперури- кемии, выявлении кристаллов солей мочевой кислоты в синовиальной жидкости, характерных рентгенологических данных.
Наиболее распространены так называемые римские критерии диагноза подагры. Они включают: 1) гиперурикемию — содержание мочевой кислоты в крови более 0,42 ммоль/л (7 мг%) у мужчин и более 0,36 ммоль/л (6 мг%) у женщин; 2) наличие подагрических узелков (тофусов); 3) обнаружение кристаллов уратов в синовиальной жидкости или тканях; 4) наличие в анамнезе острого артрита, сопровождающегося сильной болью, начавшегося внезапно и стихнувшего за 1—2 дня. В соответствии с этими критериями диагноз подагры считается достоверным, если выявляются по крайней мере два любых признака.
Дифференциальная диагностика. Подагру дифференцируют от ряда заболеваний, проявляющихся как острым, так и хроническим поражением суставов. Основой для дифференциальной диагностики служат следующие особенности подагры и сходных по клинической картине заболеваний.
• Типичные для остеоартроза узелки Гебердена иногда расценивают как подагрические тофусы, однако при OA узелки обнаруживают в области дистальных межфаланговых суставов пальцев рук, где тофусы не локализуются. Узелки Гебердена в отличие от тофусов имеют плотную консистенцию. Кроме того, при OA прежде всего поражаются крупные суставы: тазобедренный, коленный, тогда как при подагре — плюснефаланговые (97 %) и голеностопные (50 %), коленные (36 %). В анамнезе при OA нет типичных приступов острого артрита.
• С тофусами путают и ревматоидные узелки, особенно если РА протекает с поражением плюснефаланговых суставов больших пальцев стоп. Необходимость дифференциальной диагностики с РА возникает также при длительном течении подагры, при вовлечении в патологический процесс многих суставов и их деформации. Различие вполне очевидно: при подагре болезнь обычно дебютирует атаками острого артрита типичной локализации (первый плюснефаланговый сустав или мелкий сустав стопы), отсутствует РФ, имеются типичные рентгенологические признаки. РА начинается с поражения суставов кисти, чаще у лиц молодого возраста; при длительном течении болезни развиваются мышечные атрофии, отсутствует гипер- урикемия, рентгенологические изменения другие. Ревматоидные узлы никогда не вскрываются, тогда как тофусы часто вскрываются с выделением беловатой крошковатой массы.
• Острый приступ подагрического артрита иногда расценивают как острый ревматический полиартрит, однако отличить подагру от ревматизма сравнительно нетрудно: ревматизм встречается преимущественно у детей и подростков (реже у взрослых), а подагра начинается в возрасте около 40 лет. Для ревматизма характерны поражение сердца и высокие титры противострептококковых антител.
• В ряде случаев возникает необходимость дифференцировать подагрический артрит от артроза первого плюснефалангового сустава. Деформирующий остеоартроз данной локализации встречается часто, сочетаясь с плоскостопием, нарушением жирового обмена, варикозным расширением вен нижних конечностей и проявляется болями при ходьбе, развитием остеофитов в области эпифиза плюсневой кости, постепенным искривлением большого пальца стопы. При повторной травматизации сустава (длительная ходьба, ношение узкой обуви) могут развиться реактивный синовит первого плюснефалангового сустава и воспаление периартикулярных тканей. В отличие от подагрического артрита признаки воспаления развиваются постепенно и выражены умеренно — незначительный отек и небольшая гиперемия. Боли нерезкие, не ухудшается общее самочувствие, острофазовые признаки воспаления отсутствуют, температура тела не повышается. На рентгенограмме выражены признаки остеоартроза.
Лечение. Назначают комплексное лечение, направленное на: 1) нормализацию пуринового обмена; 2) купирование острого приступа подагрического артрита; 3) восстановление функции пораженных суставов (лечение хронического полиартрита).
• Нормализация пуринового обмена осуществляется с помощью системы мероприятий: а) нормализация питания; б) ликвидация факторов, способствующих гиперурикемии; в) длительный прием лекарственных препаратов, способствующих снижению синтеза мочевой кислоты в организме и повышенному выделению ее почками. Тучным больным необходимо похудеть, так как ожирение закономерно сочетается с увеличением продукции уратов и одновременным снижением их выделения почками.
Запрещается употреблять алкоголь, который при частом приеме вызывает гиперурикемию. Полагают, что молочная кислота, являющаяся конечным продуктом метаболизма этилового спирта, замедляет выделение уратов почками.
Необходимо ограничить употребление продуктов, богатых пуринами (мясо, рыба, печень, почки, бобовые), принимать достаточное количество жидкости (более 1500 мл/сут), так как выделение мочи в меньшем количестве (менее 1 мл/мин — 1400 мл/сут) приводит к уменьшению выведения уратов.
Почти у 40 % больных подагрой отмечается АГ. Поэтому следует помнить, что применение тиазидовых мочегонных (для нормализации АД) у больных подагрой способствует повышению содержания в крови мочевой кислоты. Не следует назначать ацетилсалициловую кислоту, так как при этом нарастает содержание мочевой кислоты в крови и может быть спровоцирован приступ подагрического артрита.
В ряде случаев указанных мероприятий бывает достаточно для профилактики приступов артрита и снижения степени урикемии. Однако некоторым больным приходится назначать лекарственные препараты, нормализующие пуриновый обмен во избежание развития АГ и нарушения функции почек, а также мочекаменной болезни. Кроме того, нелеченая подагра способствует развитию атеросклероза.
При решении вопроса о выборе препарата для длительной антиподагрической терапии необходимо учитывать механизмы, обусловливающие повышение уровня мочевой кислоты в крови. При гиперпродукции пуринов следует назначать антагонисты синтеза пуринов, при уменьшении их выделения — урикозурические препараты. Больным с нормальным выделением пуринов рекомендуют препараты двойного механизма действия.
• Урикозурическим средством является сульфинпиразон (антуран). Увеличение выделения мочевой кислоты достигается за счет подавления ее реабсорбции в почечных канальцах. Начальная доза составляет 50 мг 3 раза в сутки. Дозу постепенно увеличивают (обычно до 200—400 мг/сут) до нормализации уровня уратов в сыворотке крови. При лечении антураном больному следует принимать много жидкости (2—3 л/сут) для уменьшения риска образования почечных камней. Побочные явления — тошнота, рвота, кожные аллергические реакции, лейкопения. Препарат противопоказан при язвенной болезни желудка и двенадцатиперстной кишки. Антуран нельзя назначать при гиперпродукции уратов, снижении клубочковой фильтрации, подагрической нефропатии и мочекаменной болезни.
• Среди средств, уменьшающих синтез пуринов, наилучшим является аллопуринол. Его назначают в стартовой дозе 100 мг/сут с постепенным увеличением дозы до 300 мг/день. Если клубочковая фильтрация снижена до 30—60 мл/мин, доза аллопуринола не должна превышать 100 мг/сут, а при клубочковой фильтрации 60—90 мл/мин — не более 200 мг/сут.
Лечение аллопуринолом показано при: выраженной гиперпродукции уратов (особенно у больных с содержанием мочевой кислоты более 0,6 ммоль/л); наличии подагрических узелков; подагре, сопровождающейся почечной недостаточностью; вторичной подагре с избыточным образованием мочевой кислоты (у больных лейкозами, множественной миело-мой, эритремией); больным, страдающим образованием уратных камней; при острой нефропатии, вызванной отложениями мочевой кислоты в результате лечения новообразований цитостатическими средствами.
При длительном лечении аллопуринолом возможны обратное развитие уратных отложений в тканях и улучшение функции почек.
Аллопуринол хорошо переносится, но у ряда больных могут возникать высыпания на коже и симптомы раздражения пищеварительного тракта.
Указанные препараты назначают лишь после полного купирования острого подагрического артрита, так как применение их на фоне затихающего подагрического воспаления суставов может вызвать серьезное обострение артрита. При первичной подагре аллопуринол следует принимать пожизненно, при вторичной — в зависимости от устранения конкретной провоцирующей ситуации. Перерывы в лечении ведут к рецидиву заболевания.
• Острый приступ подагрического артрита купируют назначением колхицина, который принимают по 0,5 мг каждый час до стихания прояв лений артрита (или до появления побочных эффектов — рвота, понос), но не более 6—8 мг/сут. Препарат принимают в течение суток, не более.
НПВП применяют обычно в больших дозах, чаще всего используют индометацин: первая разовая доза составляет 75 мг, после чего препарат назначают по 50 мг каждые 6 ч до купирования приступа. Эффективен диклофенак натрий (вольтарен): в первые сутки 200 мг, в последующие — по 150 мг. Другие НПВП менее эффективны.
Приступ подагрического артрита может начаться внезапно, без каких- либо предвестников, поэтому больной всегда должен иметь достаточное количество препарата, купирующего боли. Эффективность терапии тем выше, чем раньше начинают лечение.
• ГКС для купирования приступа обычно не используют; лишь при особенно нестерпимых болях возможно внутрисуставное введение (в крупные суставы 10—40 мг, в мелкие суставы 5—20 мг депомедрола, метипреда, дипроспана, кеналога).
• Восстановление функции пораженных суставов при хроническом течении подагрического артрита достигается с помощью лечебной физкультуры и санаторно-курортного лечения. На курорте больные принимают радиоактивные или сульфидные ванны, а также грязелечение (аппликации на пораженные суставы); в процессе бальнеотерапии возможно обострение артрита, в связи с чем в течение первых 8—10 дней рекомендуется принимать НПВП, купировавшие ранее острый приступ артрита (индометацин, ^ пРноз'лЙГение суставов обычно не ведет к утрате AJ™*A сти Однако при поражении почек прогноз становится неблагоприятным вследствие возможного развития почечной недостатотм°лтм;жтся прежде Профилактика. Первичная профилактика подАы включается ггриие всего в нормализации питания и отказе от употребления алкоголя, осооен но при наследственной предрасположенности к этой болезни.
Идиопатический анкилозирующий спондилоартрит
Болезнь Бехтерева (ББ) — хроническое, системное воспалительное заболевание осевого скелета, характеризующееся преимущественным поражением… ББ развивается главным образом у молодых мужчин, соотношение заболеваемости… Воспалительный процесс начинается с поражения крестцово-подвздошных сочленений, за которыми следует множественное…Ssm
тамила-С (сочетание 0,15 г изопротана и 0,1 г парацетамола) по 1 таблетке 3 р Очень важны для больных занятия ЛФК, препятствующие развитию ту- гоподвижности позвоночника и периферических суставов. лоМПДекс упражнений не должен быть слишком нагрузочным, его следует выполнять Кех раз в день. Весьма полезны занятия ЛФК в звательном бассейне. д Рентгенотерапия позвоночника (а при необходимости 14>«пй™-вздошных сочленений) применяется лишь в случаях полной неэффекгив ности других методов/Условием проведения рентгенотерапии является не-болыная общая доза облучения позвоночника. Важное место в терапии больных занимает ежегодное лечение радоновыми и сероводородными.ваннами грязевыми аппликациями на курортах или в специализированных
СТаЦПрон™оз! У большинства больных постепенно уменьшается функциональная подвижность опорно-двигательного аппарата, особенно через 10 лет от начл™олевания Однако при диспансерном наблюдении и длительном Систематическом лечении удается задержать прогрессировать болезни в 70 % случаев.
Контрольные вопросы и задачи
На вопросы 205—222 выберите один наиболее правильный ответ.
205.В патогенезе ревматоидного артрита участвуют следующие факторы: А. Образование ревматоидного фактора. Б. Образование иммунных комплексов. В. Развитие воспаления синовиальной оболочки на иммунной основе. Г. Генетическая предрасположенность. Д. Все варианты верны.
206.При ревматоидном полиартрите в клинической картине наиболее часто наблюдаются все признаки, кроме: А. Атрофии мышц. Б. Поражения проксимальных межфаланговых и лучезапястных суставов. В. Узелков Гебердена. Г. Ревматоидных узелков. Д. Утренней скованности в пораженных суставах.
207. Сочетание лейкопении с полиартритом и лимфаденопатией характерно для: А. Подагры. Б. Ревматоидного артрита. В. Ревматизма. Г. Системной склеродермии. Д. Деформирующего остеоартроза.
208. При ревматоидном полиартрите развивается поражение внутренних органов, кроме: А. Амилоидоза почек. Б. Фиброзирующего альвеолита. В. Митрального стеноза. Г. Полинейропатии. Д. Недостаточности клапана аорты.
209. В патогенезе деформирующего остеоартроза принимают участие все факторы, кроме: А. Компенсаторного разрастания кости (образование остеофитов). Б. Утолщения и обызвествления суставной капсулы. В. Эрозии суставных поверхностей кистей. Г. Реактивного синовита. Д. Образования суставных «мышей».
210. Больная 56 лет предъявляет жалобы на боль в коленных суставах, первом плюснефаланговом суставе стопы, дистальных межфаланговых суставах костей, временами опухание коленных суставов. Указанные явления, периодически усиливаясь, беспокоят много лет. Объективно: повышенного питания, коленные суставы увеличены за счет утолщения капсулы, в полости правого — небольшое количество выпота. При пальпации суставов во время движения — грубый хруст, активные и пассивные движения болезненны. Концевые фаланги пальцев кисти искривлены у основания, где пальпируются твердые узелки. Незначительная атрофия мышц бе-
| § |
ер. Сердце не увеличено, тоны приглушены, шумов нет, АД 160/100 мм рт. ст. 'рай печени пальпируется на 2 см ниже реберной дуги. Селезенка не увеличена. Анализ крови: НЬ 120 г/л, эритроциты 410' /л, лейкоциты 5,310 /л (формула без особенностей); СОЭ 23 мм/ч, СРБ +. При электрофорезе белков сыворотки — ос- глобулины 11 %. Латекст-тест отрицательный. Рентгенография суставов: суставная щель сужена, субхондральный остеосклероз — содержание мочевой кислоты 416,36 мкмоль/л (норма 400—630 мкмоль/л). Наиболее вероятный диагноз: А. Подагра. Б. Ревматоидный полиартрит. В. Деформирующий остеоартроз. Г. Системная красная волчанка, хроническое течение с артроиатическим синдромом. Д. Ревматизм.
211. В патогенезе подагры участвуют все факторы, кроме: А. Гиперурикемии. Б. Повышенного синтеза штатов в организме. В. Гиперхолестеринемии. Г. Снижения клиренса мочевины. Д. Избыточного употребления в пищу мяса.
212. Подагрические тофусы представляют: А. Разрастание соединительной ткани. Б. Разрастание костной ткани. В. Отложение солеи извести. Г. Воспалительную гранулему иммунного происхождения. Д. Отложение мочекислых солей.
213. Выберите одну наиболее важную комбинацию диагностических признаков ревматоидного артрита: А. Стойкие артралгии, осгеофитоз, «блок» сустава. Б. «Осевое» поражение суставов, преимущественное поражение суставов стоп и кистей, кистевидные просветления в эпифизах. В. Острый моноартрит, преимущественное поражение сустава большого пальца стопы, «штампованные» дефекты эпифизов. Г. Скованность в суставах, симметричное их поражение, формирование анкилоза. Д. Артралгии «летучего» характера, несимметричный артрит, полностью обратимый характер артрита.
214. Из приведенных заболеваний развитие «блокады» суставов, характеризующейся внезапной резкой болью и почти полной невозможностью движений в суставе на короткое время, характерно для: А. Подагры. Б. Болезни Бехтерева. В. Ревматоидного артрита. Г. Остеоартроза. Д. Острого ревматизма.
215. Больной 60 лет, диагностирован острый приступ подагры. Выберите наиболее оптимальный способ купирования приступа: А. Йндометацин. Б. Баралгин. В. Промедол. Г. Ацетилсалициловая кислота. Д. Преднизолон.
216. Больная 42 лет в течение 6 лет страдает ревматоидным артритом. Активность заболевания продолжается в последние 6 мес, на рентгенограммах — увеличение количества эрозии. Назначение преднизолона в дозе 10 мг/сут дополнительно к принимаемому вольтарену (150 мг/сут) принесло временное улучшение, но при снижении дозы преднизолона до 7,5 мг/сут состояние вновь ухудшилось. Ваши действия: А. Дальнейшее увеличение дозы преднизолона. Б. Увеличение дозы воль- тарена. В. Назначение кризинола. Г. Замена вольтарена на другой препарат из группы нестероидных противовоспалительных препаратов. Д. Внутрисуставное введение кеналога.
217. В синовиальной жидкости больных подагрой обнаруживается: А. Ревматоидный фактор. Б. Рыхлый муциновый сгусток. В. Кристаллы мочевой кислоты. Г. Антинуклеарные антитела. Д. Рыхлая соединительная ткань.
218. Паннус представляет: А. Костные разрастания. Б. Воспалительные гранулемы. В. Рыхлую соединительную ткань. Г. Отложения солей извести. Д. LE-клетки.
219. Поражение илеосакральных сочленений наиболее характерно для: А. Ревматизма. Б. Системной красной волчанки. В. Деформирующего артроза. Г. Болезни Бехтерева. Д. Ревматоидного артрита.
220. Наследственная предрасположенность, маркером которой является антиген гисгосовместимосги HLA-B2X характерна для: А. Ревматоидного артрита. Б. Подагры. В. Болезни Бехтерева. Г. Ревматизма. Д. Деформирующего остеоартроза.
221. Анкилозирующий спондилоартрит является проявлением: А. Ревматоидного артрита. Б. Подагры. В. Болезни Бехтерева. Г. Системной красной волчанки. Д. Дерматомиозита.
222. К препаратам, уменьшающим синтез мочевой кислоты, относится: А. Йндометацин. Б. Антуран. В. Диклофенак-натрий. Г. Аллопуринол. Д. Колхицин.
Заключение
Уважаемый читатель! Вы прочитали всю книгу. Мы надеемся, что приведенные в ней сведения помогли Вам выработать клиническое мышление, т.е. умение правильно собрать необходимую информацию и переработать ее в развернутый клинический диагноз. Общеизвестно, что достижения науки и техники последнего времени значительно улучшили распознавание внутренних болезней и углубили понимание многих вопросов их клиники и патологии. Однако, несмотря на большое число дополнительных методов исследования, врач по-прежнему испытывает значительные трудности в диагностике некоторых болезней. Это связано с рядом субъективных и объективных трудностей, знание которых во многом поможет преодолеть диагностические затруднения.
Ошибки в диагностике внутренних болезней имеют в своей основе множество причин, которые можно классифицировать.
Ошибки, имеющие объективную причину:
а) сложность, атипичность или тяжесть болезни, затрудняющие ее рас познавание;
б) несовершенство медицинской науки;
в) отсутствие необходимых условий для диагностики.
Ошибки, имеющие субъективную причину:
а) недостаточная подготовка врача; б) особенности личности и характера врача (своеобразие его мышления). Сложность, атипичность или тяжесть болезни могут выражаться в са мых различных вариантах.
Прежде всего следует помнить, что затруднения в постановке диагноза возникают, как правило, в финальной стадии заболевания и в его дебюте. Так, например, развитие недостаточности кровообращения III стадии в существенной степени «стирает» нозологические признаки заболевания, приведшего к развитию декомпенсации. У больного выявляют значительное увеличение сердца, шумы относительной недостаточности клапанов (митрального и трехстворчатого), нарушения ритма (чаще мерцательная аритмия), гепатомегалию с развитием фиброза, массивные отеки и жидкость в брюшной и плевральной полостях (или «сердечная» кахексия). На этом фоне очень трудно определить нозологическую принадлежность заболевания: клапанный порок, кардиомиопатия, диффузный миокардит тяжелого течения, постинфарктный кардиосклероз (часто с развитием аневризмы), амилоидоз сердца. Данные дополнительных методов исследования выявляют лишь значительную дилатацию сердца и признаки выраженного нарушения гемодинамики, а также изменения функции органов в условиях недостаточности кровообращения. Значительную помощь в подобной ситуации могут оказать результаты I этапа диагностического поиска. Однако нередки случаи, когда в анамнезе нет существенных данных, поэтому больной не может сообщить ничего ценного для распознавания заболевания. В этой ситуации вероятность диагностической ошибки велика.
Другая ситуация — наличие синдрома почечной недостаточности, когда признаки основного заболевания, приведшего к нарушению функции почек, в значительной мере стерты (хронический гломерулонефрит, пиелонефрит, амилоид оз почек). Точно так же при развитии тяжелого бронхообструктивного синдрома, дыхательной и в последующем сердечной недостаточности трудно определить, что лежит в основе тяжелой клинической картины: бронхиальная астма, хронический обструктивный бронхит, васкулит легочных сосудов, хронические специфические или неспецифические заболевания легких.
В дебюте заболевания также затруднена постановка диагноза. Так, многие диффузные заболевания соединительной ткани могут проявляться суставным синдромом и больного долгое время лечат от ревматоидного полиартрита (с большим или меньшим успехом). Чрезвычайные сложности представляет дебют болезни в виде лихорадки неясного генеза или изолированного увеличения СОЭ, появления анемии, немотивированного уменьшения массы тела. Круг дифференцируемых заболеваний чрезвычайно велик, и часто оказывается так, что правильное диагностическое заключение можно сделать лишь при динамическом наблюдении за больным, когда определяются характерные признаки того или иного заболевания.
К объективным сложностям диагностики следует также отнести случаи, когда в клинической картине болезни на первый план выступает поражение какого-либо одного органа или системы, а остальная патология как бы уходит на «второй» план, и вся ситуация расценивается иначе. Классический пример
— гломерулонефрит, которым дебютируют системная красная волчанка или инфекционный эндокардит. Такого больного расценивают как страдающего лишь гломерулонефритом (острым) и проводят соответствующее лечение. Между тем идет время, болезнь развивается, тогда как в одном случае необходимо как можно раньше назначить глюкокортикосте-роиды, а в другом
— массивную терапию антибиотиками.
Точно так же поражение сердечно-сосудистой системы, например сердца, при системной склеродермии может значительно преобладать в клинической картине, тогда как кожные проявления, синдром Рейно, нарушения глотания, суставной синдром практически могут быть не выражены. В подобной ситуации больной будет расцениваться как страдающий диффузным миокардитом и базисная терапия проводиться не будет. Еще один пример: при системной красной волчанке болезнь может дебютировать аутоиммунной гемолитической анемией или тромбоцитопенической пурпурой. Пройдет достаточно времени, прежде чем врач убедится, что эти проявления болезни
— не более как синдромы ее (время, необходимое для проведения глюкокортикостероидной терапии, будет упущено).
Объективные трудности диагностики связаны также с большей длительностью жизни населения и развитием атеросклероза, который сам по себе дает весьма пеструю симптоматику (в зависимости от преимущественной локализации пораженных сосудов). Типичная ситуация — развитие инфекционного эндокардита у стариков: имеющаяся аускультативная картина поражения сердца объясняется его атеросклеротическим поражением, а повышение температуры тела, потливость, изменения показателей крови — вялотекущей пневмонией без" четких рентгенологических изменений (или инфекцией мочевых путей, особенно у женщин). Проводимая антибиотико- терапия улучшает состояние больного: острофазовые гематологические показатели меняются, температура тела нормализуется, и диагностическая концепция как будто бы получает подтверждение. Однако инфекционный эндокардит не излечивается, напротив, болезнь прогрессирует, в процесс вовлекаются другие органы и системы, и, когда клиническая картина становится «классической», лечить больного (и вылечить) становится сложнее.
Из всего этого следует вывод: даже, казалось бы, в самой типичной ситуации надо помнить, что наблюдаюгцася клиническая картина болезни может иметь двоякий смысл — быть самостоятельной патологией или частью другого заболевания.
Несовершенство медицинской науки также обусловливает ошибки в диагностике. Так, при ряде заболеваний отсутствуют четкие «разграничительные линии». Общеизвестна сложность дифференцирования дилатационной кардиомиопатии и диффузного миокардита тяжелого течения, гипертонической формы хронического гломерулонефрита и гипертонической болезни с поражением почек. При проведении диагностики в таких случаях уже на I этапе диагностического поиска круг дифференцируемых заболеваний весьма велик, при любом числе предполагаемых болезней они «перекрывают» друг друга, т.е. имеют одни и те же сходные симптомы и синдромы. В таких случаях возникает вопрос: возможна ли точная диагностика в данный конкретный момент? (речь не идет о диагностике в процессе более или менее длительного наблюдения за больным, когда постепенно «разворачивается» вся клиническая картина). Принципиально, конечно, возможна при условии, если будет подвергнут исследованию сам «субстрат» болезни: ткань сердца, печени, почек, костного мозга, лимфатического узла. Однако это не всегда возможно выполнить вследствие чисто технических причин (в данном лечебном учреждении этим методом исследования не владеют), больной категорически отказывается от биопсии или пункции органа и, наконец, даже само патоморфологическое и цитологическое исследование далеко не во всех случаях иллюстрирует специфическую картину, характерную именно для конкретного заболевания. Например, при пункционной биопсии печени можно получить картину активного хронического гепатита, являющегося часто синдромом при ряде болезней, например СКВ, туберкулезе легких и другие; в то же время у больного может быть хронический активный гепатит как самостоятельная нозологическая единица. Все это приводит к тому, что в ряде случаев диагноз ставят с большей или меньшей долей вероятности: нет гистологического и цитологического подтверждения болезни; в клинической картине болезни нет основных ее признаков (например, при несомненном инфаркте миокарда у больных со злокачественными опухолями нет типичных изменений на ЭКГ или они неспецифичны). Точно так же значительные трудности возникают и при диагностике вторичного инфекционного эндокардита, развивающегося на фоне уже имеющегося ревматического порока сердца (ни клиническая картина, ни лабораторные данные не дают основания для точной диагностики).
Отсутствие необходимых условий для диагностики — ситуация, очень понятная для каждого врача (невозможность в лечебном учреждении проведения ряда лабораторно-инструментальных методов исследования, например фиброгастроскопии, сканирования с радиоактивными изотопами, эхографии, компьютерной томографии, некоторых нагрузочных тестов и пр.).
Ошибки, обусловленные пробелом в знаниях врача, наиболее многочисленны. Ситуация довольно проста: если врач не знает о существовании той или иной патологии, то он никогда о ней и не подумает. «Рецептом» для избежания диагностических ошибок может служить следующий совет: если клиническая картина болезни не «укладывается» в картину, знакомую врачу, надо думать о каком-то другом заболевании (или варианте течения болезни, известной врачу) и пытаться получить сведения о ней из литературы или обратившись к более опытному клиницисту. Будет большой ошибкой всякое отклонение от обычной картины болезни «объявлять» вариантом течения (или атипичным течением). В этом случае следует обязательно подумать о заболевании, синдромно сходном с наблюдаемой клинической картиной.
С некоторыми сложностями диагностики Вы познакомились на IV и V курсах. На VI курсе Вы будете знакомиться со сложностями диагностики во всей их полноте, и так будет продолжаться всю жизнь. В связи с этим выработка твердых навыков обследования больного и клинического мышления совершенно необходима для врача любой специальности.
Ошибки субъективного характера связаны с личностью врача, уровнем квалификации, своеобразием характера и особенностями мышления, умением обследовать больного, стремлением совершенствовать свои знания.
Диагностические ошибки во многом обусловлены дефектами сбора анамнеза. Причинами этого являются, с одной стороны, мнение, что лабо- раторно-инструментальные методы могут дать для диагноза значительно большую информацию, чем опрос больного, с другой стороны, неумение врача правильно интервьюировать больного. В большинстве случаев больной рассказывает врачу «где он был, что ему говорили, какие лекарства он принимал», но не рассказывает о симптоматике заболевания. В этой ситуации врач должен активно направлять рассказ больного (естественно, выслушивая, что он говорит) путем постановки вопросов, ответы на которые позволяют составить впечатление о заболевании, которым страдает больной. Искусству сбора анамнеза следует учиться всю жизнь. Известно, что диагностическая концепция, сложившаяся после хорошо собранного анамнеза, оказывается правильной в 70—80 % случаев.
Другая ошибка, зависящая непосредственно от врача, — неправильно проведенное физическое обследование больного. Так, для правильной диагностики клапанных пороков сердца необходимо проводить аускультацию с использованием специальных приемов (об этом достаточно много сказано в соответствующих разделах учебника). Известно, что позднее выявление ревматического порока у пожилых больных в 75—80 % случаев обусловлено дефектами аускультации при предыдущих осмотрах. Неумение правильно пропальпировать печень, селезенку затем окажет самое непосредственное влияние на формирование диагностической концепции. Врач не сможет определить основной признак бронхиальной обструкции — сухие свистящие хрипы и удлиненный выдох, если не будет проводить аускультацию при форсированном выдохе.
Опыт показывает, что наименьшее число ошибок обнаруживается при определении набора лабораторно-инструментальных методов исследования на III этапе диагностического поиска. В то же время замечено, что чем ниже квалификация врача, тем меньше он говорит с больным (недооценка I этапа диагностического поиска), меньше его обследует (осмотр, пальпация, аускультация и пр.), но чаще прибегает к назначению анализов, рентгенологических исследований, ЭКГ, ФКГ и пр.
Наконец, характер врача, его личностные особенности налагают существенный отпечаток на диагностические заключения. Диагностические ошибки могут зависеть от стремления врача отбирать факты, подтверждающие, а не противоречащие возникшему мнению. Симптомы, не укладывающиеся в сложившуюся диагностическую концепцию, попросту игнори-л руются. Между тем анализ симптомов, противоречащих первоначальной диагностической концепции, особенно важен, так как именно это направляет мысль врача на поиск других причин, обусловливающих появление симптомов, «противоречащих» первоначальному мнению.
Ошибки в суждении могут быть следствием недостаточности конструктивного мышления, установки на безошибочность своего диагноза, предвзятости мнения, самолюбия и тщеславия, нерешительности характера, стремления ставить особо «интересные» диагнозы, склонности к излишнему оптимизму или пессимизму.
| 179 - В 180 - В 181 -Д 182-Б 183 - В 184- А 185- Г 186- В 187 В 188- В Глава VIJ 189- Б 190 - Б 191 - А 192- В 193- В 194 — Д 195 -Д 196- Г 197- В 198 - Б 199- А 200- Г 201 - Г 202 - Д 203 -Б 204-Б Глава VIII -Д - 1! - Б - В - В —В - В — Д 213-Г 214 — Г 215 - Л 216 -Д 217- В 218- В 219- Г 220 - В 221 - В 222 - Г |
| Глава 1 1- Г 2- А В 4- В 5 — В 6- Г 7 — А 8 — Г 9- В 10- Г 11 - Б 12 — А И- В 14 - А 15 — Г 16— В 17 —Д 18- Б 19 — В 20 — В 21 — Д 22- Б 23- А 24- Г 25- Г 26- Г 27- А 28- Б 29- В 30- Г 31- д 32- Д 33- Г 34- А 35- А 36— 1 — Г 2- А 3- Г 4- В 5- Б 6- Г 7 — А В Б 10- В Глава II 37 - Б 38- Б 39- А |
Ответы на контрольные вопросы и задачи
| 40- А | 5 - В | 110-Д | 135 - Б | ||
| 41 - Б | 6- В | 111 -А | 136- В | ||
| 42- В | 7 — Б | 112- В | 137- Г | ||
| 43- Б | 8- В | 113- Б | 138 - Г | ||
| 44 1 | 79 - ! - В | 114- Б | |||
| 45 - А | 2-А | 115- Б | Глава V | ||
| 46-В | 3- Б | 116- В | 139- Д | ||
| 47- Б | 4- Г | 117 - А | 140-Г | ||
| 48 — Г | 5-А | 118- В | 141 - В | ||
| 49-Д | 6-Г | 119 — Г | 142- Б | ||
| 50- Г | 7- А | 120 - 1 - | А | 143-А | |
| 51 - Г | 80 - 1 - Б | 2- | А | 144- Б | |
| 52- Г | 2 — А | 3 - | Б | 145-Д | |
| 53- В | 3 — А | 4- | А | 146- Б | |
| 54-А | 4 — В | 5- | Б | 147-В | |
| 55-А | 5- В | 6- | Б | 148- Б | |
| 56 - Д | 6 - Б | 7 — | А | 149 - В | |
| 57 - Б | 7- В | 121 - 1 - | А | 150 -Д | |
| 58 — Б | 8- В | 2 — | Б | 151 - В | |
| 59- Д 60 - Б | Глава 111 | 3 — 4- 5 — | А Б д | 152- Г 153 - Г | |
| 61 -Д | 81 - В | Л k | 154- Б | ||
| 62 -Д | 82-Д | t) — 7- 122 — I — | Б А | 155 - Г | |
| 63 — Г | 83 — Д | 156 - В | |||
| 64 — В 65- В 66- В 67- Г | 84- А 85- Г 86- Д 87- Д | 2- 3- 4 - 5 — | А Б А Б | 157 - В 158 - Б 159 - В | |
| 68-А | 88- Б | 6 — | Б А | 160-А | |
| 69- Б | 89- В | 7 — | 161 - Б | ||
| 70- В | 90- В | 123 — 1 — | А | 162- В | |
| 71 - В | 91 - В | г— | Б | 163 — Г | |
| 72 - Г 73- Б | 92 - Д 93- Г | 3- 4- 5 - | А Б А | 164-А | |
| 74-Г | 94 - Б | 165 - Г | |||
| 75- Г | 95-Б | 6 — | Б | 166-Д | |
| 76- В | 96- В | 7 — | А | 167 - Б | |
| 77 - 1 - | Б | 97-В | 168 -Д | ||
| 2 — | А | 98-Г | Глава IV | 169- Б | |
| 3 - | Г | 99 - Б | 124- В | 170 - Б | |
| 4- | В | 100- Б | 125-Д | 171 - Б | |
| 5- | А | 101 -д | 126- Г | 172-А | |
| 6 — | Б | 102-А | 127- Г | 173-Д | |
| 7 — | А | 103- Б | 128 - Г | 174- В | |
| 8- | Г | 104- Г | 129 - Б | 175 - В | |
| 9- | В | 105-Д | 130- Г | 176- Г | |
| 78 - 1 - | В | 106-Д | 131 - В | ||
| 2- | Б | 107- Б | 132- В | Глава VI | |
| 3- | А | 108 - Д | 133 - Б | 177- Г | |
| 4- | А | 109 - Б | 134-В | 178 -Д |
[1] При этом варианте могут быть использованы существующие классификации легочно-сер- дечнои недостаточности.
Примечания. 1. Диагноз легочного сердца ставят после диагноза основного заболевания; при формулировке диагноза используют только первые две графы классификации. Графы 3 и 4 способствуют углубленному пониманию патофизиологической сущности процесса и выбору терапевтической тактики. 2. Степень недостаточности кровообращения оценивается по общепринятой классификации.
Различают острое, подострое и хроническое ЛС, что определяется темпом развития легочной гипертензии. При остром развитии ЛС легочная 94
[2] Наличие заболевания, при котором может развиться вторичнь амилоидоз (клинические или анамнестические признаки).
• Появление и прогрессирование протеинурии или возникнове нефротического синдрома.
• Заболевание, при котором может развиться амилоидоз, отсутству однако имеется протеинурия или нефротический синдром.
– Конец работы –
Используемые теги: Внутренние, болезни0.032
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Внутренние болезни
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов